Биологические мембраны: Журнал мембранной и клеточной биологии, 2019, T. 36, № 1, стр. 63-71
Пуринергическая регуляция транзиторного кальцийзависимого хлорного тока Ito2 в желудочковом миокарде крысы
Т. С. Филатова a, b, *, Д. В. Абрамочкин a, b, c
a Московский государственный университет им. М.В. Ломоносова, биологический факультет
119234 Москва, Ленинские горы, 1, стр. 12, Россия
b Российский национальный исследовательский медицинский университет им. Н.И. Пирогова
117997 Москва, ул. Островитянова, 1, Россия
c Институт физиологии Коми научного центра Уро РАН, лаборатория физиологии сердца
167982 республика Коми, Сыктывкар, Г, С, П-2, ул. Первомайская, 50, Россия
* E-mail: filatova@mail.bio.msu.ru
Поступила в редакцию 02.03.2018
После доработки 17.08.2018
Принята к публикации 08.08.2018
Аннотация
В настоящее время проводится активный поиск новых классов эндогенных регуляторных кардиотропных соединений, одним из которых считаются диаденозиновые полифосфаты (ДАП). Недавно было показано, что ДАП влияют на электрическую активность и сократимость сердца животных, в том числе крысы: в экспериментах ДАП вызывают снижение длительности потенциалов действия и уменьшают сократимость миокарда крысы. В желудочковом миокарде крысы нами выявлен транзиторный входящий хлорный кальцийзависимый ток (Ito2), а также показано, что ДАП влияют на этот ток. Ионные токи в изолированных желудочковых кардиомиоцитах крысы регистрировали методом фиксации потенциала пэтч-кламп в конфигурации whole-cell. Потенциалы действия в препаратах изолированного правого желудочка крысы регистрировали методом внутриклеточной регистрации биоэлектрической активности с использованием острых стеклянных микроэлектродов. При замене ионов Na+ на NMDG, а ионов K+ ‒ на ионы Cs+ и в присутствии блокаторов калиевых токов 4-аминопиридина (5 × 10‒3 M) и тетраэтиламмония (1.5 × 10‒2 M) в желудочковых кардиомиоцитах крысы регистрировали транзиторный выходящий ток, который подавлялся неселективным блокатором хлорных каналов и транспортеров 4,4'-диизотиоциано-2,2'-стильбендисульфоновой кислотой (DIDS, 10‒5 М), блокатором кальциевого тока L-типа нифедипином (10‒5 М) и селективным блокатором кальцийзависимых хлорных каналов 6-(1,1-диметилэтилэтил)-2-[(2-фуранилкарбонил)амино]-4,5,6,7-тетра-гидробензо[b]тиофен-3-карбоновой кислотой (CaCCinh-A01, 10‒5 М). В присутствии P1,P 4-ди(аденозин-5')тетрафосфата во внеклеточном растворе (Ap4A, 10‒4 М) амплитуда тока возрастала на 44 ± 11%. P1,P4-ди(аденозин-5')пентафосфат (Ap5A) и NAD+ не оказали существенного воздействия на амплитуду данного тока. В препаратах изолированного правого желудочка крысы DIDS (10‒5 М) и CaCCinh-A01 (10‒5 М) блокировали вызываемое Ap4A ускорение реполяризации. Таким образом, эффекты Ap4A на электрическую активность миокарда крысы опосредованы, по крайней мере отчасти, его влиянием на амплитуду реполяризующего хлорного тока Ito2.
ВВЕДЕНИЕ
Диаденозиновые полифосфаты (ДАП) – семейство пуринергических соединений, которое рассматривается в настоящее время в качестве новой группы эндогенных сигнальных молекул. Молекулы ДАП состоят из двух аденозиновых оснований, соединенных несколькими остатками фосфорной кислоты, число которых может составлять от двух до семи [1, 2]. ДАП синтезируются с помощью специфических ферментативных систем в самых различных тканях организма, в том числе в периферической и центральной нервной системе, где функционируют в качестве нейромедиаторов [3]. Наиболее важным источником ДАП в организме млекопитающих являются активированные тромбоциты, что указывает на сердечно-сосудистую систему как на непосредственную мишень ДАП [4]. Из пресинаптических нервных окончаний может выделяться также NAD+ – структурно сходное с ДАП соединение пуринового ряда, обладающее определенным кардиотропным действием [5, 6]. Согласно последним данным ДАП и NAD+ являются потенциальными комедиаторами катехоламинов, регулирующих сердечную функцию [7].
Влияние ДАП на сердечно-сосудистую систему зависит от вида животного, его возраста, органа или ткани и используемого соединения. Так, в зависимости от числа остатков фосфорной кислоты ДАП может вызывать вазодилатацию или же вазоконстрикцию резистивных артерий [8], а в миокарде крысы как ДАП, так и NAD на разных стадиях онтогенеза действуют через различные подтипы пуриновых рецепторов, что обуславливает различие их эффектов у животных разного возраста [9, 10].
Ранее нами было показано, что воздействие ДАП и NAD+ снижает длительность потенциалов действия (ПД) в предсердном и желудочковом миокарде крысы [6, 11]. Подобные изменения биоэлектрической активности обусловлены, как правило, модуляцией трансмембранных ионных токов. Тем не менее исследования с применением фиксации потенциала методом пэтч-кламп не выявили четко выраженного влияния ДАП и NAD+ ни на реполяризующие калиевые токи, ни на кальциевый ток L-типа в изолированных кардиомиоцитах крысы [12, 13]. В связи с этим нами была выдвинута гипотеза о том, что действие ДАП и NAD+ в миокарде крысы может быть опосредовано их влиянием на ионный ток другой природы, а именно, на хлорный реполяризующий ток.
В настоящее время известно несколько реполяризующих хлорных токов, некоторые из них могут быть обнаружены в кардиомиоцитах млекопитающих. В наибольшей степени на паттерн электрической активности сердца влияют хлорный ток, активируемый протеинкиназой А (ICl, PKA), хлорный ток, активируемый растяжением (ICl, SWELL), а также кальцийзависимый хлорный ток (ICl,Ca, обозначаемый также как Ito2) [14, 15]. В нормальных условиях в отсутствие адренергической стимуляции наибольший вклад в биоэлектрическую активность миокарда может вносить транзиторный кальцийзависимый ток Ito2 [16]. Кальцийзависимый хлорный ток, описанный ранее в изолированных клетках рабочего миокарда таких животных, как кролик [17] и мышь [18], определяется как транзиторный ток выходящего направления, характеризующийся резистентностью к тетраэтиламмонию и 4-аминопиридину – блокаторам калиевых токов, но чувствительный к блокатору кальциевого тока L-типа нифедипину [17]. Тем не менее, ранее в миокарде крысы Ito2 не обнаруживали.
В нашей работе в желудочковом миокарде крысы впервые описан транзиторный ток Ito2, а также изучено действие соединений пуринового ряда P1,P4-ди(аденозин-5')тетрафосфата (Ap4A), P1,P4-ди(аденозин-5')пентафосфата (Ap5A) и NAD+ на данный ток в изолированных желудочковых кардиомиоцитах крысы.
МАТЕРИАЛЫ И МЕТОДЫ
В работе использовали самцов белых беспородных крыс массой 200–250 г. Изолированные желудочковые кардиомиоциты получали по описанной ранее методике [19]. Перед экспериментом крыс наркотизировали внутрибрюшинной инъекцией раствора кетамина (80 мг/кг) и ксилазина (10 мг/кг). В дополнение к анестетикам животным вводили гепарин (1000 МЕ/кг) для предотвращения свертывания крови. Животных декапитировали, вскрывали грудную клетку и быстро вырезали сердце. Сердце помещали на аппарат Лангендорфа и ретроградно перфузировали раствором следующего состава (мМ): NaCl 116; KCl 4; NH2PO4 1.7; NaHCO3 25; MgCl2 0.5; таурин 20; Na-пируват 5; глюкоза 11; бычий сывороточный альбумин 1 мг/мл; pH 7.4 поддерживали аэрацией насыщенным карбогеном (95% O2, 5% CO2); перфузию проводили при температуре 37 ± ± 0.5°С. Далее сердце в течение 25–30 мин перфузировали раствором аналогичного состава с добавлением 0.5 мг/мл коллагеназы типа II (Worthington, США), 0.1 мг/мл протеазы типа XIV (Sigma, США) и 10‒5 М CaCl2. После завершения ферментативной обработки сердце снимали с аппарата Лангендорфа, отделяли и измельчали желудочки, затем механически выделяли их в раствор следующего состава (мМ): глутамат калия 50; KCl 30; KH2PO4 30; MgSO4 · 7H2O 3; таурин 20; EGTA 0.5; HEPES 20; глюкоза 10; pH 7.2 (KOH). Этот раствор использовали для хранения клеток в ходе эксперимента в течение 6–7 ч. При проведении экспериментов были соблюдены актуальные требования отечественного законодательства по надлежащему обращению с лабораторными животными.
Ионные токи регистрировали методом фиксации потенциала пэтч-кламп в конфигурации whole-cell с помощью усилителя EPC 800 (HEKA Elektronik, Германия). Кардиомиоциты помещали в экспериментальную камеру RC-26 (Warner Instruments, Великобритания) объемом 150 мкл и постоянно перфузировали модифицированным физиологическим раствором следующего состава (мМ): NMDG-Cl 126; CsCl 5.4; MgCl2 1; CaCl2 2; HEPES 10; глюкоза 10; pH 7.4 (CsOH) при комнатной температуре (24 ± 1°С), с добавлением блокаторов калиевых токов 4-аминопиридина (4-АР, 5 мМ) и тетраэтиламмония (ТЭА, 15 мМ) [20]. Пипетки изготавливали из боросиликатного стекла без филамента (Sutter Instrument, США) с помощью пуллера PIP 6 (HEKA Elektronik, Германия) и заполняли пипеточным раствором (мМ): аспартат цезия 110; CsCl 20; MgCl2 1; EGTA 0.1; Mg-ATP 5; Na-GTP 0.03; HEPES 10; pH 7.4 (CsOH). Сопротивление заполненных раствором пипеток составляло 2–3 МОм. Внеклеточная концентрация хлорид-ионов составляла, таким образом, 137.4 мМ, а внутриклеточная – 20 мМ, что примерно соответствует физиологическим значениям [21]. Перед началом регистрации ионных токов компенсировали емкость клетки, емкость пипетки, а также сопротивление контакта. Данные регистрировали и обрабатывали с помощью специального программного обеспечения WinWCP 4.8.6 (University of Strathclyde, Великобритания) и ClampFit 10.3 (Molecular Devices, США). Амплитуду транзиторного тока Ito2 определяли как пиковую амплитуду тока, полученного после вычитания тока, зарегистрированного в присутствии блокатора (DIDS, 10‒5 M; CaCCinh-A01, 10‒5 M). Величину тока нормировали по электрической емкости клетки и выражали в пА/пФ.
ПД регистрировали в препаратах изолированного правого желудочка крысы с помощью острых стеклянных микроэлектродов по описанной ранее методике [22]. Сердце сразу после извлечения промывали физиологическим раствором следующего состава (мМ): NaCl 130; KCl 5.6; NaH2PO4 0.6; MgCl2 1.1; CaCl2 1.8; NaHCO3 20; глюкоза 11; pH 7.4 поддерживали аэрацией насыщенным карбогеном. Выделяли препарат правого желудочка и закрепляли его на дне экспериментальной камеры эндокардиальной стороной вверх. Через камеру постоянно со скоростью 10 мл/мин протекал физиологический раствор (температура 37 ± ± 0.5°С). После адаптации препарата к экспериментальным условиям в течение 2 ч приступали непосредственно к регистрации трансмембранных потенциалов. Для регистрации использовали стеклянные микроэлектроды с сопротивлением 20–50 МОм, изготовленные из боросиликатного стекла (Sutter Instrument, США) с помощью пуллера P-30 (Sutter Instrument, США) и заполненные раствором KCl (3 М). Потенциалы регистрировали с помощью усилителя 1600 (A-M Systems, США) с использованием специального программного обеспечения PowerGraph Professional 3.0 (L-Card, Россия). При обработке зарегистрированных ПД определяли длительность ПД на уровнях реполяризации 50 и 90% (ДПД50 и ДПД90 соответственно).
В работе использовали следующие реактивы: аммониевую соль P1,P4-ди(аденозин-5')тетра-фосфата (Ap4A, Sigma, США); аммониевую соль P1,P 4-ди(аденозин-5')пентафосфата (Ap5A, Sigma, США); NAD+ (AppliChem, Германия); неселективный блокатор хлорных каналов и транспортеров 4,4'-диизотиоциано-2,2'-стильбендисульфоновую кислоту DIDS (Sigma, США); 4-аминопиридин (Santa Cruz Biotechnology, США); селективный блокатор кальцийзависимых хлорных каналов 6-(1,1-диметилэтилэтил)-2-[(2-фуранилкарбонил)амино]-4,5,6,7-тетрагидробензо[b]тиофен-3-карбоновую кислоту CaCCinh-A01 (Tocris Bioscience, Великобритания); неселективный блокатор хлорных каналов нифлюмовую кислоту (Sigma, США); хлорид тетраэтиламмония (MERCK, Германия).
Все результаты представлены как среднее ± ± стандартная ошибка среднего для n экспериментов. Статистический анализ проводили с использованием программного обеспечения GraphPad Prism 6.0 (GraphPad Software, США). Нормальность распределения выборок оценивали по критерию Пирсона. Статистическую значимость эффектов ДАП, NAD+ и блокаторов хлорных токов выявляли с использованием однофакторного дисперсионного анализа для связанных выборок (ANOVA) с последующим апостериорным тестом Бонферрони. Различия между сравниваемыми группами считали статистически значимыми при p ≤ 0.05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В желудочковых кардиомиоцитах крысы при потенциалах положительнее ‒40 мВ обнаруживается транзиторный выходящий ток Ito, имеющий большую амплитуду и определяющий быструю фазу реполяризации ПД. Однако при замене ионов Na+ на NMDG, а ионов K+ ‒ на Cs+ и в присутствии ТЭА (15 мМ) и 4-AP (5 мМ) транзиторный выходящий ток, индуцируемый деполяризацией клетки, исчезает не полностью. Поскольку в таких экспериментальных условиях незаблокированными остаются только кальциевые и хлорные токи, можно предположить наличие в желудочковом миокарде крысы транзиторного реполяризующего хлорного тока, обозначаемого как Ito2 (рис. 1а).
Рис. 1.
Транзиторный хлорный ток Ito2 в желудочковых кардиомиоцитах крысы. а – Оригинальные записи суммарного выходящего транзиторного тока в контроле и его 4-АР-резистентной компоненты, являющейся током Ito2. б – Оригинальные записи тока Ito2 в контроле и в присутствии неселективного блокатора хлорных каналов DIDS (10‒5 М). в – Оригинальные записи тока Ito2 в контроле и в присутствии блокатора кальциевого тока L-типа нифедипина (10‒5 М). г – Оригинальные записи тока Ito2 в контроле и в присутствии селективного блокатора кальцийзависимых хлорных каналов CaCCinh-A01 (10‒5 М). Соответствующие протоколы стимуляции приведены здесь же.
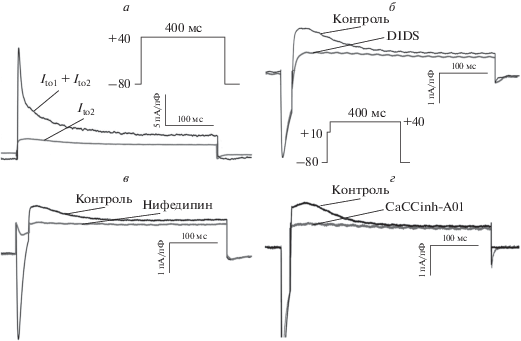
Согласно результатам более ранних исследований, хлорный ток Ito2 является кальцийзависимым: его амплитуда зависит от концентрации свободного Ca2+ в цитозоле. Исходя из этого, ток Ito2 индуцировали с использованием ступенчатого протокола изменения мембранного потенциала с первой деполяризующей ступенью до ‒10 мВ длительностью 20 мс для активации кальциевого тока L-типа ICaL. Это позволяло достигнуть относительно высокой концентрации Ca2+ в цитоплазме, а затем активировать ток Ito2 на второй ступени протокола [18]. Нами показано, что резистентная к 4-AP компонента тока Ito полностью подавляется неселективным блокатором хлорных каналов и транспортеров DIDS (10‒4 М), блокатором кальциевого тока L-типа нифедипином (10‒5 М) и селективным блокатором кальцийзависимых хлорных каналов CaCCinh-A01 (10‒5 М), что подтверждает хлорную природу данного тока, его кальцийзависимость и позволяет идентифицировать его как ток Ito2 (рис. 1б, 1в, 1г). Нифлюмовая кислота в концентрации 10‒5 М не блокировала регистрируемый ток.
На рис. 2 представлена вольт-амперная характеристика тока Ito2, зарегистрированного в изолированных желудочковых кардиомиоцитах крысы. Несмотря на значительно более низкую амплитуду данного тока в желудочковом миокарде крысы по сравнению с желудочковым миокардом мыши, форма вольт-амперной кривой полностью соответствует полученной ранее в опытах на изолированных желудочковых кардиомиоцитах мыши [18]. При потенциалах положительнее ‒40 мВ ток имел входящее направление; его амплитуда увеличивалась по мере деполяризации мембраны клетки. При потенциалах отрицательнее ‒50 мВ ток имел выходящее направление, но значительно меньшую амплитуду. Однако при таких значениях мембранного потенциала ток Ito2, по всей видимости, не вносит значительного вклада в формирование электрической активности сердца ввиду низкой цитоплазматической концентрации Ca2+.
Рис. 2.
Вольт-амперная характеристика транзиторного хлорного тока Ito2 в желудочковых кардиомиоцитах крысы. а – Оригинальные записи тока Ito2, полученные при различных поддерживаемых потенциалах. б – Кривая вольт-амперной зависимости тока Ito2. Амплитуду транзиторного тока Ito2 определяли как пиковую амплитуду тока, полученного после вычитания тока, зарегистрированного в присутствии блокатора (DIDS, 10‒5 M; CaCCinh-A01, 10‒5 M).

Для исследования влияния ДАП и NAD+ на хлорный ток Ito2 в изолированных желудочковых кардиомиоцитах крысы во внеклеточный раствор добавляли Ap4A, Ap5A и NAD+ в концентрации 10‒4 М, одновременно регистрируя ток при +40 мВ. Согласно опубликованным данным, при таком мембранном потенциале ток Ito2 имеет большую амплитуду, а ток ICaL практически отсутствует. Величину тока оценивали по амплитуде его пика после вычитания тока, зарегистрированного в присутствии блокатора. Значения амплитуды тока нормировали по емкости клетки. Аппликация Ap4A приводила к статистически значимому увеличению амплитуды тока на 44 ± 11% (p = 0.0065, n = 7). Действие Ap4A на Ito2 было обратимым. Ap5A (n = 6) и NAD+ (n = 6) не вызывали статистически значимых изменений тока Ito2 (рис. 3а, 3б). Таким образом, из всех использованных в данном исследовании агонистов пуринергических P2Y только Ap4A оказывал значительное влияние на Ito2.
Рис. 3.
Влияние ДАП и NAD+ на транзиторный хлорный ток Ito2 в желудочковых кардиомиоцитах крысы. а – Оригинальные записи тока Ito2 в контроле и в присутствии Ap4A (10‒4 М). б – Амплитуда тока Ito2 в контроле и в присутствии Ap4A (10‒4 М, n = 7), Ap4A (10‒4 М, n = 6) или NAD+ (10‒4 М, n = 6); ** – p < 0.01, **** – p < 0.0001, однофакторный дисперсионный анализ для связанных выборок (ANOVA). в – ПД в препарате изолированного правого желудочка крысы в контроле и в присутствии DIDS (10‒4 М, n = 6) или DIDS (10‒4 М) и Ap4A (10‒5 М, n = 6). г – ПД в препарате изолированного правого желудочка крысы в контроле и в присутствии CaCCinh-A01 (10‒5 М, n = 7) или CaCCinh-A01 (10‒5 М) и Ap4A (10‒5 М, n = 7).
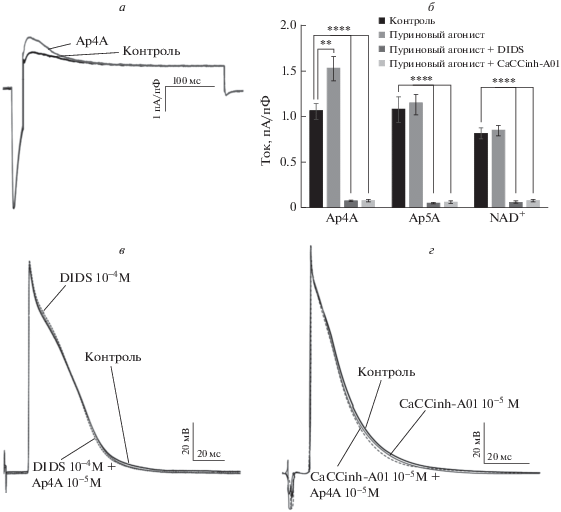
Для оценки вклада усиления Ap4A тока Ito2 в индуцируемое им изменение электрической активности миокарда проведена серия экспериментов с внутриклеточной регистрацией ПД в препарате миокарда с помощью острых стеклянных микроэлектродов (рис. 3в, 3г). В ходе эксперимента препарат изолированного правого желудочка крысы перфузировали физиологическим раствором с добавлением DIDS (10‒5 М) или CaCCinh-A01 (10‒5 М) в течение 5 мин для полной блокады кальцийзависимых хлорных каналов. После этого в присутствии блокатора в экспериментальную камеру подавали раствор Ap4A (10‒5 М). Проведенные ранее исследования показали, что перфузия ДАП в данной концентрации в течение 5 мин вызывает заметные обратимые изменения электрической активности изолированного препарата миокарда крысы [11]. В этой работе Ap4A не вызывал статистически значимых изменений длительности ПД в препарате изолированного правого желудочка крысы в присутствии DIDS (n = 6) или CaCCinh-А01 (n = 7) в растворе. Таким образом, можно утверждать, что эффекты Ap4A в желудочковом миокарде крысы опосредованы, по крайней мере отчасти, его влиянием на амплитуду хлорного тока Ito2.
Ранее мы показали, что ДАП и NAD+ способны не только снижать длительность ПД в изолированных препаратах миокарда крысы; они подавляют сократительную способность изолированного сердца, а также снижают кальциевые транзиенты в изолированных кардиомиоцитах крысы [6, 11, 23]. В желудочковых кардиомиоцитах крысы Ap4A не оказывал ярко выраженного ингибирующего влияния на кальциевый ток L-типа, амплитуда которого благодаря особенностям механизма электромеханического сопряжения в значительной степени определяет силу сокращения миокарда. Принимая во внимание обнаруженное нами усиление кальцийзависимого хлорного тока Ito2 в присутствии Ap4A, можно предположить, что поскольку данный ток вносит вклад в раннюю реполяризацию кардиомиоцитов в процессе генерации ПД, его усиление может приводить к снижению длительности ПД на уровнях реполяризации 25 и 50% и, соответственно к уменьшению длительности фазы плато и сократимости миокарда в результате снижения входа ионов Ca2+ [24].
Главными претендентами на роль каналов, переносящих кальцийзависимый хлорный ток, считаются аноктамины (Ano, известные также как каналы TMEM16A) и бестрофины, а также семейство белков CLCA [25, 26].
Маловероятно, что обнаруженный нами ток опосредуется белками семейства CLCA, поскольку данные каналы отличаются от классического кальцийзависимого хлорного тока по своим биофизическим свойствам (так, каналы CLCA способны активироваться при деполяризации без увеличения внутриклеточной концентрации Ca2+ и обладают линейной вольт-амперной характеристикой) и паттернам экспрессии [27].
Семейство Ano включает 10 различных белков, однако только Ano1 и Ano2 могут опосредовать кальцийзависимый хлорный ток в физиологических условиях, функция прочих членов не вполне ясна [28, 29]. Аnо1 экспрессируется в сердечной ткани мыши и переносит кальцийзависимый хлорный ток в изолированных желудочковых кардиомиоцитах мыши [20]. Данные об аналогичных исследованиях, проведенных на миокарде крысы, на сегодняшний день отсутствуют. Ano2 экспрессируется в обонятельном эпителии, однако нет данных о его экспрессии в миокарде млекопитающих [28]. Бестрофины экспрессируются в миокарде человека, собаки и мыши и формируют в клетках сердца функциональные ионные каналы [30–32]. Аno и бестрофины различаются чувствительностью к неселективным блокаторам хлорных токов. Tак, концентрация полумаксимального ингибирования (IC50) каналов Ano1 нифлюмовой кислотой составляет порядка 7.5 × 10‒6 М, тогда как у бестрофина 1 (Best1) она значительно выше – более 10‒4М. Напротив, бестрофины гораздо более эффективно ингибируются DIDS (IC50 около 4 × 10‒6 М) по сравнению с Ano (IC50 около 5.5 × 10‒4 М) [25]. Таким образом, на основании чувствительности исследуемого тока к DIDS и нифлюмовой кислоте можно предположить, что его молекулярным коррелятом являются скорее каналы семейства бестрофинов, нежели Ano.
Возможность того, что описываемый нами ток переносится не ионами Cl‒, а катионами Cs+ через кальцийзависимые неселективные катионные каналы семейства TRP, исключается в силу чувствительности тока к селективному блокатору CaCCinh-A01.
Что касается рецепторного механизма, опосредующего эффекты ДАП в миокарде млекопитающих, то показано, что в этом принимают участие пуриновые рецепторы типа P2Y, но не P1 и P2X [33]. Из пуриновых P2Y-рецепторов в сердце млекопитающих на наиболее высоком уровне экспрессируются рецепторы подтипов P2Y1, P2Y2, P2Y6, P2Y11, сопряженные с Gq-белками [34]. Известно, что сопряженные с Gq P2Y-рецепторы могут как запускать сигнальный каскад, связанный с протеинкиназой C, так и активировать сигнальный путь, зависимый от оксида азота (NO) [35, 36]. В исследовании, выполненном ранее нашей группой, показано, что применение блокаторов, действующих на компоненты NO-зависимого сигнального пути, не влияет на эффекты Ap4A и Ap5A в изолированном сердце крысы, тогда как блокатор протеинкиназы C и неселективный блокатор фосфодиэстераз предотвращали развитие данных эффектов [23]. Это позволяет сделать вывод о том, что эффекты ДАП в миокарде крысы опосредуются P2Y-рецепторами, сопряженными с Gq-белками, и сигнальным каскадом, включающим протеинкиназу C и некоторые фосфодиэстеразы.
Примечательно, что в экспериментах на клетках других органов млекопитающих (гладкомышечные клетки бронхов, клетки эпителия почечных канальцев) также показано, что активация пуринергических P2Y-рецепторов (в том числе и P2Y2, обнаруженных в миокарде крысы) приводит к увеличению кальцийзависимого хлорного тока, опосредованного каналами семейства Ano [37, 38]. Однако в этих случаях увеличение амплитуды хлорного тока происходит из-за повышения внутриклеточного уровня Ca2+, активирующего переносящие его каналы. В желудочковом миокарде крысы активация P2Y-рецепторов при аппликации ДАП сопровождалась отрицательным инотропным эффектом, уменьшением кальциевых транзиентов и, соответственно, снижением внутриклеточного уровня Ca2+ [23]. Таким образом, пуринергическая активация кальцийзависимого хлорного тока в кардиомиоцитах крысы опосредуется иным сигнальным механизмом.
Полученные результаты свидетельствуют о вкладе хлорного тока Ito2 в биоэлектрическую активность желудочкового миокарда крысы в норме, а также о возможности его модуляции агонистами пуринергических рецепторов. Это позволяет дополнить имеющуюся модель формирования и регуляции ПД в рабочем миокарде крысы. Тем не менее, для уточнения молекулярной природы и возможных путей регуляции обнаруженного нами тока Ito2 требуются дальнейшие исследования с использованием молекулярно-биологических методов.
Работа выполнена при финансовой поддержке Российского научного фонда (проект № 14-15-00268).
Список литературы
Baxi M.D., Vishwanatha J.K. 1995. Diadenosine polyphosphates: their biological and pharmacological significance. J. Pharmacol. Toxicol. Methods. 33 (3), 121–128.
Hoyle C.H., Hilderman R.H., Pintor J.J., Schlüter H., King B.F. 2001. Diadenosine polyphosphates as extracellular signal molecules. Drug Dev. Res. 52 (1–2), 260–273.
Mutafova-Yambolieva V.N., Durnin L. 2014. The purinergic neurotransmitter revisited: A single substance or multiple players? Pharmacol. Therapeut. 144 (2), 162–191.
Flores N.A., Stavrou B.M., Sheridan D.J. 1999. The effects of diadenosine polyphosphates on the cardiovascular system. Cardiovasc. Res. 42, 15–26.
Smyth L.M., Yamboliev I.A., Mutafova-Yambolieva V.N. 2009. N-type and P/Q-type calcium channels regulate differentially the release of noradrenaline, ATP and β-NAD in blood vessels. Neuropharmacology. 56 (2), 368–378.
Пустовит К.Б., Кузьмин В.С., Сухова Г.С. 2014. Влияние внеклеточного никотинамидадениндинуклеотида (NAD+) на сократительную и биоэлектрическую активность сердца крысы. Рос. физиол. журн. им. И.М. Сеченова. 100 (4), 445–457.
Pakhomov N.V., Pustovit K.B., Abramochkin D.V., Kuzmin V.S. 2017. The role of diadenosine pentaphosphate and nicotinamide adenine dinucleotide (NAD+) as potential nucleotide comediators in the adrenergic regulation of cardiac function. Neurochem. J. 11 (1), 63–71.
Steinmetz M., Schlatter E., Boudier H.A.J.S., Rahn K.H., De Mey J.G.R. 2000. Diadenosine polyphosphates cause contraction and relaxation in isolated rat resistance arteries. J. Pharmacol. Exp. Ther. 294 (3), 1175–1181.
Пустовит К.Б, Иванова А.Д., Кузьмин В.С. 2018. Внеклеточный НАД+ подавляет адренергические эффекты в предсердном миокарде крыс на раннем этапе постнатального онтогенеза. Бюлл. эксперим. биол. и мед. 165, 4–8.
Пустовит К.Б., Потехина, В.М., Пахомов, Н.В., Кузьмин, В.С. 2018. Влияние внеклеточного диаденозинтетрафосфата на биоэлектрическую активность предсердного и желудочкового миокарда крысы на ранних этапах постнатального онтогенеза. Вестник Московского университета. Сер. 16. Биология. 73 (1), 52–59.
Pustovit K.B., Kuzmin V.S., Abramochkin D.V. 2016. Diadenosine tetra- and pentaphosphates affect contractility and bioelectrical activity in the rat heart via P2 purinergic receptors. Naunyn Schmiedebergs Arch. Pharmacol. 389 (3), 303–313.
Абрамочкин Д.В., Пустовит К.Б., Филатова Т.С. 2015. Действие диаденозиновых полифосфатов на калиевые токи входящего выпрямления в кардиомиоцитах крысы. Вестник Московского университета. Сер. 16. Биология. 4, 3–7.
Кузьмин В.С., Пустовит К.Б. 2016. Эффекты и механизмы действия диаденозиновых полифосфатов и их производных в сердце млекопитающих. М.: Университетская книга, 116 с.
Кузьмин В.С., Розенштраух Л.В. 2010. Ионные механизмы действия антиаритмических препаратов III класса. Кардиология. 7, 49–61.
Бокерия О.Л., Ахобеков А.А. 2014. Ионные каналы и их роль в развитии нарушений ритма сердца. Анналы аритмологии. 11(3), 176–184.
Hiraoka M., Kawano S., Hirano Y., Furukawa T. 1998. Role of cardiac chloride currents in changes in action potential characteristics and arrhythmias. Cardiovasc. Res. 40, 23–33.
Zygmunt A.C., Gibbons W. 1992. Properties of the calcium-activated chloride current in heart. J. Gen. Physiol. 99 (3), 391–414.
Xu Y., Dong P.H., Zhang Z., Ahmed G.U., Chiamvimonvat N. 2002. Presence of a calcium-activated chloride current in mouse ventricular myocytes. Am. J. Physiol. Heart Circ. Physiol. 283, H302–H314.
Isenberg G., Klockner U. 1982. Calcium tolerant ventricular myocytes prepared by preincubation in a “KB medium”. Pflugers Arch. 395 (1), 6–18.
Ye Z., Wu M.M., Wang C.Y., Li Y.C., Gong Y.F., Zhang J., Wang Q.S., Song B.L., Yu K., Hartzell H.C., Duan D.D., Zhao D., Zhang Z.R. 2015. Characterization of cardiac anoctamin1 Ca2+-activated chloride channels and functional role in ischemia-induced arrhythmias. J. Cell. Physiol. 230 (2), 337–346.
Pogorelov A., Pogorelova V., Pogorelova M. 2010. Does an electroneutral K+/Cl− antiport occur in cardiomyocyte during acute ischemia? Biophysics. 55 (5), 771–774.
Абрамочкин Д.В., Бородинова А.А., Никольский Е.Е., Розенштраух Л.В. 2012. Модуляция оксидом азота интенсивности неквантовой секреции ацетилхолина в миокарде правого предсердия крысы. Биол. мембраны. 29 (5), 317–317.
Pakhomov N., Pustovit K., Potekhina V., Filatova T., Kuzmin V., Abramochkin D. 2018. Negative inotropic effects of diadenosine tetraphosphate are mediated by protein kinase C and phosphodiesterases stimulation in the rat heart. Eur. J. Pharmacol. 820, 97–105.
Oudit G.Y., Kassiri Z., Sah R., Ramirez R.J., Zobel C., Backx P.H. 2001. The molecular physiology of the cardiac transient outward potassium current (Ito) in normal and diseased myocardium. J. Mol. Cell Cardiol. 33 (5), 851–872.
Liu Y., Zhang H., Huang D., Qi J., Xu J., Gao H., Du X., Gamper N., Zhang H. 2015. Characterization of the effects of Cl‒ channel modulators on TMEM16A and bestrophin-1 Ca2+ activated Cl‒ channels. Pflügers Arch. 467 (7), 1417–1430.
Cho H., Oh U. 2013. Anoctamin 1 mediates thermal pain as a heat sensor. Curr. Neuropharmacol. 11 (6), 641–651.
Eggermont J. 2004. Calcium-activated chloride channels: (un)known, (un)loved? Proc. Am. Thorac. Soc. 1 (1), 22–27.
Tian Y., Schreiber R., Kunzelmann K. 2012. Anoctamins are a family of Ca2+-activated Cl‒ channels. J. Cell Sci. 125 (Pt 21), 4991–4998.
Pedemonte N., Galietta L.J. 2014. Structure and function of TMEM16 proteins (anoctamins). Physiol. Rev. 94 (2), 419–459.
Horvath B., Vaczi K., Hegyi B., Gonczi M., Dienes B., Kistamas K., Banyasz T., Magyar J., Baczko I., Varro A., Seprenyi G., Csernoch L., Nanasi P.P., Szentandrassy N. 2016. Sarcolemmal Ca2+-entry through L-type Ca2+ channels controls the profile of Ca2+-activated Cl‒ current in canine ventricular myocytes. J. Mol. Cell. Cardiol. 97, 125–139.
O’Driscoll K.E., Hatton W.J., Burkin H.R., Leblanc N., Britton F.C. 2008. Expression, localization, and functional properties of Bestrophin 3 channel isolated from mouse heart. Am. J. Physiol. Cell. Physiol. 295 (6), C1610–C1624.
O’Driscoll K.E., Leblanc N., Hatton W.J., Britton F.C. 2009. Functional properties of murine bestrophin 1 channel. Biochem. Biophys. Res. Commun. 384 (4), 476–481.
Pustovit K.B., Abramochkin D.V. 2016. Effects of nicotinamide adenine dinucleotide (NAD+) and diadenosine tetraphosphate (Ap4A) on electrical activity of working and pacemaker atrial myocardium in guinea pigs. Bull. Exp. Biol. Med. 160 (6), 733–736.
Erlinge D., Burnstock G. 2008. P2 receptors in cardiovascular regulation and disease. Purinergic Signal. 4 (1). 1–20.
Buvinic S., Briones R., Huidobro-Toro J.P. 2002. P2Y1 and P2Y2 receptors are coupled to the NO/cGMP pathway to vasodilate the rat arterial mesenteric bed. Br. J. Pharmacol. 136 (6), 847–856.
Erb L., Weisman G.A. 2012. Coupling of P2Y receptors to G proteins and other signaling pathways. Wiley Interdiscip. Rev. Membr. Transp. Signal. 1 (6), 789–803.
Mitchell C., Syed N.H., Gurney A.M., Kennedy C. 2012. A Ca2+-dependent chloride current and Ca2+ influx via Cav1.2 ion channels play major roles in P2Y receptor-mediated pulmonary vasoconstriction. Br. J. Pharmacol. 166 (4), 1503–1512.
Rajagopal M., Kathpalia P.P., Thomas S.V., Pao A.C. 2011. Activation of P2Y1 and P2Y2 receptors induces chloride secretion via calcium-activated chloride channels in kidney inner medullary collecting duct cells. Am. J. Physiol. Renal Physiol. 301 (3), F544–F553.
Дополнительные материалы отсутствуют.
Инструменты
Биологические мембраны: Журнал мембранной и клеточной биологии


