Биологические мембраны: Журнал мембранной и клеточной биологии, 2019, T. 36, № 1, стр. 72-76
Эктофосфодиэстераза циклических нуклеотидов плазмодия Physarum polycephalum
А. Р. Незвецкий a, Т. Г. Орлова a, О. В. Петрухин a, Н. Я. Орлов a, *
a Институт теоретической и экспериментальной биофизики РАН,
142290 Московская область, Пущино, Россия
* E-mail: norlov46@mail.ru
Поступила в редакцию 24.07.2018
После доработки 28.09.2018
Принята к публикации 20.08.2018
Аннотация
Показано, что по физико-химическим и ферментативным характеристикам обнаруженная ранее внеклеточная циклонуклеотидспецифичная фосфодиэстераза плазмодия миксомицета Physarum polycephalum сходна с циклонуклеотидспецифичной фосфодиэстеразой-1 дрожжей Saccharomyces cerevisiae. Предполагается, что фосфодиэстераза плазмодия P. polycephalum, как и фосфодиэстераза-1 S. cerevisiae, относится к малоизученному и эволюционно древнему семейству циклонуклеотидспецифичных фосфодиэстераз класса II.
ВВЕДЕНИЕ
Плазмодий миксомицета Physarum polycephalum является классическим объектом для изучения немышечных форм подвижности. Предполагалось, что существенную роль в регуляции процесса движения плазмодия играют секретируемый в окружающую среду медиатор сAMP и внеклеточная циклонуклеотидспецифичная фосфодиэстераза [EC 3.1.4.17] (PDE) [1, 2]. В согласии с этой точкой зрения нами показано, что плазмодий продуцирует внеклеточный сAMP в субмикромолярных концентрациях [3]. Кроме того, в среде инкубации плазмодия P. polycephalum обнаружена также фосфодиэстеразная активность, ассоциирующаяся с гидролизом циклических нуклеотидов [4]. В физиологических экспериментах показано [5], что ингибирование активности внеклеточной фосфодиэстеразы (Pp-PDE) дитиотреитолом (DTT) приводит к изменению характера подвижности плазмодия (подавление распластывания и пеpеxод в фазу мигpации). Это дополнительно указывало на важную роль этого фермента в контроле двигательного поведения плазмодия P. polycephalum [5].
По ряду свойств (например, термостабильности и чувствительности к ряду ингибиторов [4, 6]) этот фермент принципиально отличается от хорошо изученных ранее PDE млекопитающих, составляющих основу семейства ферментов класса I [7, 8]. Он также отличался от членов недавно обнаруженного семейства PDE класса III [9] и поэтому был предположительно отнесен нами к относительно небольшому и малоисследованному семейству PDE класса II, идентифицированному у низших эукариот [10]. Детальный анализ этого предположения до недавнего времени был затруднен, поскольку (1) данные о физико-химических и ферментативных свойствах членов семейства PDE класса II были ограничены и (2) характеристики внеклеточной Pp-PDE были получены на препарате, не свободном от ряда эндогенных примесей, взаимодействие с которыми, возможно, и определяет уникальные физико-химические и ферментативные свойства Pp-PDE.
Недавно выполнили рентгеноструктурный анализ одного из типичных членов семейства PDE класса II – PDE-1 дрожжей Saccharomyces cerevisiae (Sc-PDE), а также определили ряд физико-химических и ферментативных характеристик этого белка [11]. Это позволило провести более полное сравнение внеклеточной Pp-PDE P. polycephalum и PDE-1 S. cerevisiae. Кроме того, в отличие от предыдуших исследований [4, 6], выполненных нами на препарате, содержащем значительное количество продуцируемых плазмодием высокомолекулярных (30–70 кДа) полисахаридов [12], существенно затрудняющих очистку фермента, в настоящей работе мы использовали препарат фермента, в значительной степени свободный от полисахаридов. Это удалось достичь благодаря использованию экзогенной агаразы и удаления продуктов гидролиза полисахаридов ультрафильтрацией.
Результаты сравнительного анализа подтверждают точку зрения, согласно которой внеклеточная Рр-PDE является представителем семейства циклонуклеотидспецифичных PDE класса II. Ферменты этого класса значительно отличаются от внутриклеточных PDE класса I (PDE1–PDE11 [7]) и, согласно данным об их первичной структуре, представляют собой отдельную эволюционную ветвь [10, 11, 13, 14].
МАТЕРИАЛЫ И МЕТОДЫ
Культивирование плазмодия миксомицета P. polycephalum, приготовление материала для экстракции и получение экстрактов внеклеточной Рр-PDE выполняли как описано ранее [4].
Ионообменная хроматография. Ионообменную хроматографию препаратов Pp-PDE проводили на колонке (1.5 × 15 см) с DEAE-целлюлозой (Whatman, США), предварительно уравновешенной буфером А (20 мM HEPES-NaOH, pH 8.0, 1 мM MgCl2) при скорости элюции 20 мл/ч и температуре 20°С [4]. Препарат наносили на колонку в этом буфере, а затем этим буфером промывали колонку до получения минимальных значений поглощения элюата при 280 нм. Элюцию осуществляли с помощью линейного градиента концентрации NaCl (0–500 мМ). Общий объем растворов, используемых для формирования градиента, составлял 250–300 мл. Фракции объемом 2 мл собирали и измеряли в них активность PDE.
Очистка препаратов Pp-PDE от эндогенных высокомолекулярных полисахаридов. Фракции, полученные путем ионообменной хроматографии и обладающие активностью PDE, собирали (общий объем 40–50 мл) и инкубировали в течение 3–5 ч с 10 мкл агаразы Pseudomonas atlantica (Fermentas, США) c удельной активностью 0.5 ед./мкл. Инкубированный препарат концентрировали в концентраторах Ultracel-10k (Millipore, США), центрифугируя в течение 30 мин при 2000 g. Концентрат разбавляли буфером А и подвергали дополнительному концентрированию. Обработка препарата агаразой позволяла избежать снижения пропускной способности фильтра при проведении ультрафильтрации.
Определение кажущейся молекулярной массы PDE. Для определения кажущейся молекулярной массы PDE использовали метод гель-фильтрации. Гель-фильтрацию очищенных от примеси полисахаридов препаратов PDE проводили на предварительно калиброванной колонке (1.5 × 80 см) с Sephacryl S-200 HR, уравновешенной буфером А с добавлением 100 мM NaCl, как описано ранее [4]. Для калибровки колонки использовали гексамеры рекомбинантной альфа-изоформы нуклеозиддифосфаткиназы крысы (~110 кДa) [15], овальбумин (мол. масса мономеров и димеров 45 и 90 кДa соответственно), бычий сывороточный альбумин (мол. масса мономеров и димеров 67 и 134 кДa соответственно), бычий бета-лактальбумин (17.6 кДa), миоглобин кашалота (17 кДa), цитохром С лошади (11 кДa) и голубой декстран (2000 кДa).
Определение активности PDE. Активность PDE в большом количестве образцов определяли с использованием методов, детально описанных ранее [4, 6, 16]: 1) полуколичественного метода, основанного на разделении субстрата и продукта реакции методом тонкослойной хроматографии (ТСХ) [4, 6], и 2) рН-метрического метода [16], позволяющего регистрировать закисление среды, обусловленное высвобождением протонов в ходе реакции гидролиза циклических нуклеотидов (cAMP или cGMP). Для численного анализа активности PDE использовали уравнение Бриггса–Холдейна:
где V – скорость гидролиза при данной концентрации субстрата С, Vmax – максимальная скорость, Km – константа Михаэлиса. В координатах 1/С; 1/V уравнение (1) описывает прямую линию с наклоном Km/Vmax, которая отсекает отрезок 1/Vmax на оси ординат.Исследование термостабильности частично очищенных препаратов PDE. Температурную стабильность частично очищенных препаратов PDE определяли, как и препаратов PDE наружных сегментов фоторецепторов сетчатки быка и суслика [16] и рекомбинантных изоформ нуклеозиддифосфаткиназы крысы [17], измеряя ферментативную активность образцов после их инкубации в течение 15–30 мин при температуре в диапазоне 20–100°С. Образцы (20–50 мкл) находились в тонкостенных стеклянных капиллярах и содержали частично очищенный фермент в буфере А.
Дополнительные методы. Спектральные измерения выполняли на спектрофотометрах Specord UV-VIS (Carl Zeiss, Германия) и Cary 50 (Varian, США).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Молекулярная масса и субъединичный состав. Обработка препарата фермента, полученного в результате очистки с использованием ионообменной хроматографии агаразой, как описано в методической части работы, в течение 1–10 ч не влияла на его общую активность и значительно упрощала процедуру его концентрирования в 50–100 раз без изменения пропускной способности фильтров. Разбавление препарата буфером А и последующее повторное концентрирование, проводимое с целью удаления следов гидролизованных полисахаридов и понижения концентрации солей, также практически не влияло на общую активность препарата.
Анализ такого препарата методом гель-фильтрации на Sephacryl S-200 HR показал, что компонент, обладающий активностью PDE, элюируется как глобулярный белок с к.м.м. 85–90 кДа. Практически такую же величину мы получили ранее при анализе препарата фермента, содержащего эндогенные полисахариды P. polycephalum в виде примесей.
Недавно методом рентгеноструктурного анализа было впервые показано [11], что PDE-1 S. cerevisiae (Sc-PDE) является гомодимером двух субъединиц с молекулярной массой около 42 кДa (369 аминокислотных остатков). Отметим, что субъединицы PDE класса II патогенных грибов Сandida albicans (Ca-PDE) состоят из 426 остатков [13, 14] и имеют вычисленную молекулярную массу 48 кДа. Это означает, что при димерной структуре эти ферменты должны иметь молекулярную массу 84 и 96 кДa соответственно, что близко к полученному нами методом гель-фильтрации значению 85–90 кДа для Pp-PDE.
Кинетические характеристики. Ранее мы показали [4], что Pp-PDE гидролизует сAMP и сGMP с практически одинаковой максимальной скоростью и характеризуется аномально низким сродством к субстратам: значения Km составляли 0.9 и 7.7 мМ для сAMP и сGMP соответственно. Близкие результаты получены в настоящей работе. Значения Km составляли 1.2 и 6.5 мМ для сAMP и сGMP, соответственно, при практически равных значениях Vm (рис. 1).
Рис. 1.
Зависимости активности Pp-PDE от концентрации cAMP (1) и cGMP (2), линеаризованные в координатах Лайнуивера–Берка. Здесь С – концентрация субстрата. Прямые построены в соответствии с уравнением (1) при Km, равной 1.2 и 6.5 мМ и при Vmax, равной 0.32 и 0.35 для сAMP и сGMP соответственно.
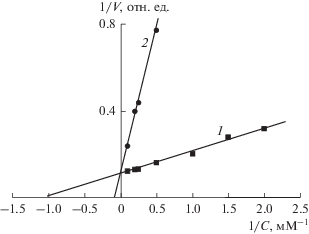
Сходными характеристиками обладает Sc-PDE-1: ее сродство к субстратам невысоко (значения Km составляют около 100 мкМ как для сAMP, так и для сGMP), причем данные субстраты гидролизуются с практически одинаковой скоростью [11]. Типичный представитель PDE класса II – фермент C. albicans также имеет низкое сродство к сAMP и сGMP (значения Km равны примерно 500 и 250 мкМ для сAMP и сGMP соответственно) [14].
Важно, что несмотря на значительные различия в значениях Km перечисленных ферментов, все они имеют заметно более низкое сродство к субстратам, чем PDE класса I. Подавляющее большинство ферментов этого класса характеризуется значениями Km в диапазоне 0.1–10 мкМ (см., например, табл. 1 в обзоре Бендера и Биво [7]).
Влияние ионов Mg2+ на ферментативную активность. Неожиданными оказались результаты, полученные нами при исследовании влияния ионов Mg2+ на активность внеклеточной Рр-PDE. Активность фермента была практически постоянной при понижении концентрации ионов Mg2+ от 10 до 0.5 мМ [4]. Более того, дальнейшее понижение концентрации ионов Mg2+ вплоть до величин < 1 мкМ введением 2 мM EDTA также не меняло его активность [6]. Аналогичные результаты получены нами в настоящей работе на препарате, свободном от полисахаридов: введение в реакционную среду 2 мМ EDTA не влияло на величину активности. Эти результаты согласуются с недавними данными Тиан и соавт. [11], согласно которым активность Sc-PDE-1 можно измерять в среде, не содержащей ионов Mg2+. Более того, каталитическая активность фермента остается постоянной даже после его длительного (12–24 ч) диализа против 1 мM EDTA.
Все это указывало на принципиальное различие регуляторных характеристик PDE класса II (том числе и внеклеточной Рр-PDE) и PDE класса I, необходимым условием функционированием которых, как хорошо известно [7], является присутствие ионов Mg2+ в миллимолярных концентрациях. Данные рентгеноструктурных исследований Sc-PDE указывают на то, что в активном центре PDE класса II роль каталитических ионов магния играют два плотно связанных иона цинка, не удаляемых в результате длительной процедуры диализа в присутствии EDTA [11].
Влияние дитиотреитола (DTT) и β-меркаптоэтанола на ферментативную активность. Нами показано [4], что добавление DТТ или β-меркаптоэтанола полностью (и необратимо) ингибирует активность фермента P. polycephalum. Аналогичный результат получен и в настоящей работе при использовании свободного от эндогенных полисахаридов препарата плазмодия P. polycephalum. Это согласуется с результатами Хойера и соавт. [14], в которой показано, что 10 мМ DTT значительно (~10 раз) ингибирует активность относящегося к PDE класса II фермента патогенных грибов C. albicans.
Влияние температуры и додецилсульфата натрия (SDS) на ферментативную активность Pp-PDE. Ранее мы показали, что Pp-PDE обладает аномально высокой температурной стабильностью. Нагревание раствора белка до 100°С в течение 30 мин и последующее его охлаждение не влияло на ферментативную активность (по-видимому, это означает, что либо нагревание не ведет к денатурации Pp-PDE, либо процесс денатурации полностью обратим). Кроме того, Pp-PDE сохранял активность в присутствии 1% SDS. В настоящее время нет данных о стабильности PDE класса II при высоких температурах и воздействии SDS. Однако необходимо отметить, что высокая стабильность к действию высоких температур и денатурирующих агентов (SDS) не характерна для PDE класса I [7, 8, 16].
Чувствительность к ингибиторам циклонуклеотидспецифичных PDE. PDE класса II характеризуются низким сродством к широко известным ингибиторам PDE класса I [9]. Мы показали, что внеклеточная Рр-PDE проявляет аномально низкую чувствительность к этому ряду ингибиторов фосфодиэстеразной активности [6]. Этот результат подтверждает, что изучаемая Pp-PDE принципиально отличается от PDE класса I.
ЗАКЛЮЧЕНИЕ
Таким образом, по большинству доступных для сравнения физико-химических и ферментативных характеристик термостабильная внеклеточная Pр-PDE принципиально отличается от ферментов класса I и напоминает ферменты класса II. Возможно, что вопрос о классификации фермента P. polycephalum будет прояснен в дальнейшем в результате его анализа методами масс-спектроскопии.
Список литературы
Murray A.W., Spiszman M., Atkinson D.E. 1971. Adenosine 3',5'-monophosphate phosphodiesterase in the growth medium of Physarum polycephalum. Science. 171 (970), 496–498.
Orlow S.J., Shapiro R.I., Franke J., Kessin R.H. 1981. The extracellular cyclic nucleotide phosphodiesterase of Dictyostelium discoideum. Purification and characterization. J. Biol. Chem. 256 (14), 7620–7627.
Матвеева Н.Б., Теплов В.А., Незвецкий А.P., Оpлова Т.Г., Бейлина C.И. 2012. Участие циклического 3′-5′-аденозинмонофосфата в регуляции двигательного поведения плазмодия Physarum polycephalum. Биофизика. 57 (5), 832–839.
Незвецкий А.Р., Орлова Т.Г., Бейлина С.И., Орлов Н.Я. 2006. Термостабильная экстраклеточная фосфодиэстераза циклических нуклеотидов плазмодия Physarum polycephalum. Биофизика. 51 (5), 810–816.
Матвеева Н.Б., Морозов М.А., Незвецкий А.Р., Орлова Т.Г., Теплов В.А., Бейлина С.И. 2010. Участие экстраклеточной цАМФ-специфичной фосфодиэстеразы в регуляции двигательной активности плазмодия Physarum polycephalum. Биофизика. 55(6), 1076–1082.
Незвецкий А.Р., Орлова Т.Г., Бейлина С.И., Орлов Н.Я. 2011. Влияние ингибиторов и ионов магния на активность термостабильной внеклеточной сАМР-специфичной фосфодиэстеразы плазмодия Physarum polycephalum. Биол. мембраны. 28 (6), 541–546.
Bender A.T., Beavo J. 2006. Cyclic nucleotide phosphodiesterases: Molecular regulation to clinical use. Pharmacol. Rev. 58 (3), 488–519.
Beavo J.A. 1995. Cyclic nucleotide phosphodiesterases: Functional implications of multiple isoforms. Physiol. Rev. 75 (4), 725–748.
Matange N. 2015. Revisiting bacterial cyclic nucleotide phosphodiesterases: cyclic AMP hydrolysis and beyond. FEMS Microbiol. Lett. 362 (22), 183–197.
Wentzinger L., Seebeck T. 2007. Protozoal phosphodiesterases. In: Cyclic nucleotide phosphodiesterases in health and disease. Eds Beavo J.A., Francis S.H., Houslay M.D. Boca Raton, FL: CRC Press, 277−300.
Tian Y., Cui W., Huang M., Robinson H., Yiqian W., Yousheng W., Hengming K. 2014. Dual specificity and novel structural folding of yeast phosphodiesterase-1 for hydrolysis of second messengers cyclic adenosine and guanosine 3′,5′-monophosphate. Biochemistry. 53, 4938–4935.
Farr D.R., Amster H., Horisberger M. 1972. Composition and partial structure of the extracellular polysaccharide of Physarum polycephalum. Carbohyd. Res. 24, 207–209.
Nikawa J., Sass P., Wigler M. 1987. Cloning and characterization of the low-affinity cyclic AMP phosphodiesterase gene of Saccharomyces cerevisiae. Mol. Cell. Biol. 7(10), 3629–3636.
Hoyer L.L., Cieslinski L.B., McLaughlin M.M., Torphy T.J., Shatzmanl A.R., Livil G.P. 1994. A Candida albicans cyclic nucleotide phosphodiesterase: Cloning and expression in Saccharomyces cerevisiae and biochemical characterization of the recombinant enzyme. Microbiology. 140, 1533−1542.
Ishijima Y., Shimada N., Fukuda M., Miyazaki H., Orlov N.Ya., Orlova T.G., Yamada T, Kimura N. 1999. Overexpression of nucleoside diphosphate kinases induced neurite outgrowth and their substitution to inactive forms leads to suppression of nerve growth factor- and dibutyryl cyclic AMP-induced effects of PC12D cells. FEBS Lett. 445, 155–159.
Orlov N.Ya., Kalinin E.V., Orlova T.G., Freidin A.A. 1988. Properties and content of cyclic nucleotide phosphodiesterase in photoreceptor outer segments of ground squirrel retina. Biochim. Biophys. Acta. 954 (3), 325–335.
Орлов Д.Н., Ишиджима Ю., Орлов Н.Я., Кимура Н. 2007. Исследование химерных и tag-форм альфа- и бета-нуклеозиддифосфаткиназ крысы. Связывание с родопсин-трансдуциновым комплексом и термостабильность. Биохимия. 72 (8), 1027–1036.
Дополнительные материалы отсутствуют.
Инструменты
Биологические мембраны: Журнал мембранной и клеточной биологии


