Биологические мембраны: Журнал мембранной и клеточной биологии, 2019, T. 36, № 3, стр. 155-175
Коагуляционная активность мембранных микрочастиц
О. А. Антонова a, В. В. Якушкин a, А. В. Мазуров a, *
a Национальный медицинский исследовательский центр кардиологии,
Министерство здравоохранения Российской Федерации
121552 Москва, ул. 3-я Черепковская, 15а, Россия
* E-mail: avmazurov@list.ru
Поступила в редакцию 12.12.2018
После доработки 10.01.2019
Принята к публикации 10.01.2019
Аннотация
В обзоре рассмотрены свойства и методы изучения мембранных микрочастиц (МЧ). МЧ представляют собой везикулярные фрагменты плазматической мембраны, отделяющиеся от поверхности клеток при их активации и/или повреждении. Ключевые события, приводящие к образованию МЧ – повышение концентрации внутриклеточного кальция и последующие перестройки мембранного цитоскелета и перераспределение мембранных фосфолипидов. Главная функция МЧ заключается в переносе биологически активных соединений (белки, липиды, нуклеиновые кислоты) от “родительской” клетки к другим клеткам организма. МЧ обладают также коагуляционной активностью, т.е. способностью ускорять свертывание крови. Прокоагулянтные свойства МЧ обусловлены присутствием на их поверхности отрицательно заряженных фосфолипидов (в первую очередь, фосфатидилсерина), служащих субстратом для сборки коагуляционных комплексов, и наличием в некоторых из них тканевого фактора – первичного инициатора коагуляционных реакций. В обзоре проведен сравнительный анализ методов подсчета и определения размера МЧ с указанием их преимуществ, ограничений и недостатков. Основное внимание уделено проточной цитометрии – наиболее распространенному методу изучения МЧ. Приведены данные о коагуляционной активности МЧ клеток крови (тромбоцитов, лейкоцитов и эритроцитов) и МЧ эндотелиальных клеток. Наибольшей способностью ускорять свертывание крови обладают содержащие тканевой фактор МЧ моноцитов и эндотелиальных клеток. Представлена информация о содержании в крови МЧ различного клеточного происхождения у здоровых лиц и у больных с тромботическими, воспалительными и некоторыми другими заболеваниями.
ВВЕДЕНИЕ
Клетки способны образовывать и высвобождать во внешнюю среду два типа небольших по размеру мембранных частиц (везикул) – микрочастицы (МЧ) (другие названия – микровезикулы, эктосомы) и экзосомы. МЧ представляют собой замкнутые везикулярные фрагменты плазматической мембраны размером от 100 до 1000 нм и продуцируются клеткой при ее активации и/или повреждении. Сначала вследствие “выпячивания” наружу участка плазматической мембраны происходит образование внешнего мембранного пузырька, а затем его отделение (“отшнуровка”) от поверхности. Таким образом формируется внеклеточная МЧ, содержащая на поверхности белки плазматической мембраны и небольшой объем цитоплазмы “родительской” клетки (рис. 1). Экзосомы существенно меньше, чем МЧ – от 40 до 100 нм, и секретируются из клетки при слиянии с плазматической мембраной мультивезикулярных телец, содержащих экзосомы. Эти тельца окружены мембраной и формируются в результате внутриклеточных трансформаций эндосом, которые исходно представляют собой интернализованные (отшнуровавшиеся внутрь клетки) фрагменты плазматической мембраны. В ходе внутриклеточных преобразований эндосом из их мембраны образуются (путем инвагинации внутрь эндосомы) более мелкие мембранные пузырьки (будущие секретируемые экзосомы), и происходит обмен молекулами с другими клеточными компонентами. После формирования мультивезикулярных телец (или поздних эндосом) часть из них сливается с лизосомами, а часть – с плазматической мембраной, секретируя во внеклеточную среду экзосомы (рис. 1). В качестве специфических антигенных маркеров экзосом чаще всего используют экспонированные на их поверхности внутриклеточные мембранные белки семейства тетраспанинов, в частности CD63. Иногда к отдельному типу внеклеточных МЧ относят также апоптотические тела – крупные (до нескольких микрометров) фрагменты клеток, образующиеся при их апоптотической гибели. Однако эти структуры скорее представляют собой клеточные обломки и принципиально отличаются от специально образующихся и секретируемых жизнеспособными клетками МЧ и экзосом [1, 2].
Рис. 1.
Микрочастицы (МЧ) и экзосомы. Микрочастицы образуются активированными/поврежденными клетками путем “выпячивания” участка плазматической мембраны и его последующего отделения от поверхности клетки. Экзосомы секретируются из клетки при слиянии с плазматической мембраной содержащих их мультивезикулярных телец (МВТ). МВТ формируются в результате внутриклеточных преобразований эндосом – фрагментов плазматической мембраны, отделившихся внутрь клетки. В ходе этих преобразований из мембраны эндосом образуются (путем инвагинации внутрь эндосомы) более мелкие мембранные пузырьки (будущие секретируемые экзосомы) и происходит обмен молекулами с другими клеточными структурами. После формирования МВТ часть из них сливается с плазматической мембраной, секретируя во внеклеточную среду экзосомы. Микрочастицы имеют размер 100–1000 нм, на их поверхности локализованы белки плазматической мембраны “родительской” клетки и значительное количество фосфатидилсерина. Экзосомы имеют размер 40–100 нм, на их поверхности локализованы белки внутриклеточных мембран (например, CD63) и существенно меньшее (по сравнению с МЧ) количество фосфатидилсерина. Внутри МЧ и экзосом содержатся переносимые ими цитозольные белки и нуклеиновые кислоты, в частности мРНК и микроРНК.
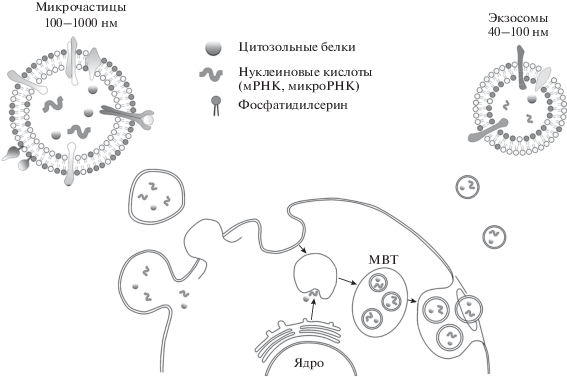
Основная функция внеклеточных МЧ – это перенос информации от родительской клетки к другим клеткам организма. Как МЧ, так и экзосомы содержат мембранные и цитозольные белки (молекулы клеточной адгезии, цитокины, факторы роста и др.) и биоактивные липиды родительских клеток. Кроме того, внутри этих частиц могут находиться и нуклеиновые кислоты (мРНК, не кодирующие РНК, в том числе микроРНК), которые защищены мембраной от действия нуклеаз. В последние годы опубликовано большое количество работ, в которых показано участие внеклеточных частиц и переносимых ими молекул в процессах ангиогенеза, воспаления, иммунного ответа и ряда других [1–7]. Однако, кроме способности осуществлять коммуникативные функции, МЧ обладают также коагуляционной активностью, т.е. способностью ускорять свертывание крови [3, 5, 6, 8]. Эта активность в значительно большей степени характерна для МЧ, чем для экзосом. МЧ содержат на своей поверхности большие (по сравнению с экзосомами) количества фосфатидилсерина (ФС), отрицательно заряженного фосфолипида, служащего субстратом для формирования коагуляционных комплексов [9–11]. Кроме того, некоторые МЧ могут, так же, как и образующие их клетки, экспрессировать тканевой фактор (ТФ), первичный инициатор реакций коагуляционного каскада [3, 5, 6, 8].
В настоящем обзоре мы рассмотрим различные характеристики МЧ и уделим особое внимание их коагуляционной активности. Будут представлены данные о свойствах МЧ, продуцируемых клетками крови (тромбоцитами, лейкоцитами и эритроцитами) и эндотелиальными клетками сосудистой стенки. Именно МЧ, продуцируемые этими клетками, циркулируют в кровотоке и могут непосредственно влиять на реакции свертывания крови при инициации процессов гемостаза (остановки кровотечений) и внутрисосудистого тромбообразования.
1. ИСТОРИЯ ОТКРЫТИЯ И ИЗУЧЕНИЯ МИКРОЧАСТИЦ
Участие осаждаемого при высокоскоростном центрифугировании материала в свертывании крови было продемонстрировано еще в 1946 г. Chargaff и West [12]. Эти авторы показали, что способность плазмы без тромбоцитов к свертыванию существенно снижается после центрифугирования при 31 000 g, а добавление ресуспендированного осадка приводит к ускорению свертывания. В 1967 г. британский исследователь Wolf [13] не только подтвердил, что высокоскоростное центрифугирование приводит к замедлению свертывания плазмы, но и обнаружил, используя электронную микроскопию, что осаждаемый материал состоит из частиц, отличных от целых тромбоцитов. Эти частицы содержали фосфолипиды и обладали коагуляционной активностью, характерной для фактора свертывания, который в то время определяли как тромбоцитарный фактор 3. Сейчас хорошо известно, что этим фактором являются отрицательно заряженные фосфолипиды тромбоцитов (в первую очередь ФС), необходимые для формирования коагуляционных комплексов. Также в этой работе было показано, что количество коагуляционно активного материала, осаждаемого при высокоскоростном центрифугировании, увеличивается в процессе хранения обогащенной тромбоцитами плазмы. Wolf назвал описанные и охарактеризованные им субклеточные частицы тромбоцитарной “пылью” (“platelet dust”). Впоследствии именно они и получили название МЧ, или микровезикул, а работа Wolf считается точкой отсчета в области изучения этих субклеточных элементов. В 1970 г. Webber и Johnson [14] обнаружили, что активация тромбоцитов тромбином приводит к резкому увеличению высвобождения МЧ и таким образом впервые продемонстрировали зависимый от активации характер их образования. В 1982 г. George и соавт. [15], анализируя МЧ из плазмы и сыворотки крови с помощью иммуноэлектрофореза, доказали наличие в них маркерного белка плазматической мембраны тромбоцитов, гликопротеина (ГП) IIb-IIIa. Эти авторы также отметили, что МЧ, осажденные из сыворотки, полученной при свертывании свободной от тромбоцитов плазмы, практически не реагировали с антителами против ГП IIb-IIIa. Таким образом, было установлено, что (1) МЧ содержат маркерные белки родительской клетки, и (2) не все МЧ крови имеют тромбоцитарное происхождение. В последующие десятилетия было выяснено, что присутствующие в кровотоке МЧ могут продуцироваться не только тромбоцитами, но и другими клетками крови (эритроцитами и лейкоцитами), эндотелиальными клетками сосудов и опухолевыми клетками. Резкое увеличение количества работ, посвященных изучению МЧ, произошло в 2000–2010 гг., что было, в частности, обусловлено развитием методов проточной цитометрии. Благодаря применению высокочувствительных проточных цитометров, способных анализировать мелкие субклеточные структуры, стало возможным не только оценивать количество МЧ в анализируемых образцах (например, в плазме крови) без использования методически сложных подходов (электронная микроскопия и др.), но и определять происхождение МЧ, окрашивая их антителами против маркерных антигенов родительских клеток [3, 5].
2. ОБРАЗОВАНИЕ МИКРОЧАСТИЦ
Образование клетками МЧ ассоциировано с их активацией и/или инициацией апоптоза. Покоящиеся клетки также могут продуцировать какое-то количество МЧ, однако отсутствие экзогенных индукторов не исключает частичную активацию и (или) апоптоз отдельных клеток в популяции, которые могут быть источником МЧ.
Повышение концентрации внутриклеточного кальция является ключевым событием, запускающим процесс образования МЧ. Одно из следствий повышения концентрации кальция – изменение работы ферментов, обеспечивающих асимметричность фосфолипидного состава внутреннего и внешнего слоя плазматической мембраны и, в частности, внутреннюю локализацию отрицательно заряженного ФС в покоящихся клетках. К этим ферментам относятся флиппаза, флоппаза и скрамблаза, участвующие в транспортировке фосфолипидов внутрь, наружу и в обоих направлениях соответственно. Кальций-зависимое ингибирование флиппазы на фоне активной работы флоппазы и скрамблазы приводит к появлению ФС в наружном слое плазматической мембраны. Подтверждение важной роли транслокации ФС в ремоделировании мембраны и последующем образовании мембранных пузырьков получено при изучении пациентов с редкой наследственной тромбоцитопатией, получившей название синдрома Скотта. У таких больных вследствие мутации белка TMEM16F, участвующего в реализации скрамблазной активности, отсутствует экспонирование ФС при активации тромбоцитов. Вследствие этого нарушаются не только прокоагулянтные функций тромбоцитов, но и процесса образования МЧ [3, 6, 16].
Повышение концентрации внутриклеточного кальция приводит также к разрушению мембранного цитоскелета, обеспечивающего относительную жесткость и прочность плазматической мембраны. Белки семейства каспаз и кальпаинов, протеазная активность которых повышается в присутствии кальция, разрушают такие компоненты цитоскелета, как филамин, талин, гельсолин и др. Ингибирование кальцийзависимых протеаз и деполимеризации актина подавляет образование МЧ. В ремоделировании мембранного цитоскелета участвуют также Rho-киназы, регулирующие фосфорилирование киназ легких цепей миозина, и некоторые другие внутриклеточные сигнальные белки. Сигнальные каскады, влияющие на мембранный цитоскелет, могут несколько различаться в разных типах клеток, однако в любом случае это приводит к его разрушению и снижению жесткости плазматической мембраны [6, 17, 18].
Механизмы удаления (клиренса) из кровотока МЧ, образующихся в организме, остаются не совсем ясными. Эксперименты на животных моделях по введению экзогенных МЧ показали, что они быстро (менее чем за 1 ч) выводятся из кровотока, в основном вследствие захвата макрофагами печени и селезенки. В то же время, по-видимому, существуют и пути специфического захвата МЧ различного происхождения клетками органов и тканей, с которыми МЧ могут взаимодействовать, используя поверхностные рецепторы родительских клеток [2, 6].
3. МЕТОДЫ АНАЛИЗА МИКРОЧАСТИЦ
Анализ МЧ проводят в различных биологических жидкостях, чаще всего в плазме крови (реже в сыворотке), а в экспериментальных условиях в клеточных супернатантах. Предварительно из анализируемых образцов осаждают клетки и крупный клеточный дебрис. Обычно с этой целью применяют двукратное центрифугирование при 1500–3000 g в течение 10–20 мин. Иногда второе центрифугирование проводят в течение короткого промежутка времени (<5 мин) при ~10 000 g. Научный комитет по стандартизации Международного общества по тромбозу и гемостазу (SSC ISTH, Scientific and Standardization Committee of the International Society on Thrombosis and Hemostasis) рекомендует для изучения МЧ центрифугировать кровь 2 раза по 15 мин при 2500 g [19]. Для осаждения МЧ из полученных супернатантов применяют центрифугирование при ~20 000 g. Повышение скорости центрифугирования может привести к осаждению уже более мелких МЧ, т.е. экзосом (для выделения экзосом супернатанты, полученные после осаждения МЧ, центрифугируют при скоростях более 60 000 g). Иногда для выделения МЧ применяют и более сложные методы – центрифугирование в градиенте плотности, гель-фильтрационную хроматографию и др. [20, 21].
3.1. Подсчет микрочастиц
3.1.1. Проточная цитометрия
Проточная цитометрия не самый точный метод подсчета МЧ (см. ниже), в первую очередь, вследствие ограничения размера анализируемых МЧ даже в современных высокочувствительных цитометрах. Однако в связи с доступностью приборов и необходимых реактивов именно этот подход чаще всего используют для определения количества МЧ как в клинических, так и в экспериментальных исследованиях. Еще одно важнейшее преимущество проточной цитометрии перед другими методами кроме доступности – возможность определения не только количества, но и клеточного происхождения МЧ. Подсчет разных видов МЧ проводят, используя флуоресцентные антитела против специфических маркеров родительских клеток.
При анализе любого материла в проточном цитометре требуется провести отсечение шумовых сигналов, источником которых могут быть очень мелкие объекты (пузырьки воздуха и пылевые частицы, молекулы крупных белков и липопротеинов, агрегаты белков и т.д.), которые сохраняются даже в предварительно фильтрованных растворах (фильтры 0.1–0.2 мкм), используемых для суспендирования внеклеточных частиц или клеток, и проведения исследований в цитометре. Как правило, порог устанавливается по показателям прямого или бокового светорассеяния в соответствии с базовыми настройками прибора. В современных цитометрах этот порог обычно соответствует уровню детекции калибровочных полистироловых частиц диаметром 100–150 нм. Однако в силу различных оптических свойств мембранных и полистироловых частиц (разный коэффициент преломления) этот порог соответствует размеру МЧ около 200 нм. Таким образом, при проведении анализа более мелкие МЧ не учитываются. Важное преимущество проточной цитометрии – возможность окрашивания МЧ с помощью флуоресцентных меток, что позволяет детектировать их по одному или нескольким флуоресцентным каналам. Чаще всего одна из меток представляет собой маркер ФС, аннексин V или лактадгерин, а вторая – антитела против маркерного антигена родительской клетки (рис. 2). Этот подход позволяет отделить анализируемые МЧ от фоновых объектов того же размера, а также определить их клеточное происхождение. Более того, при применении флуоресцентных меток существует возможность устанавливать пороговые значения для отделения шумовых сигналов по одному из показателей флуоресценции, например, по маркеру ФС (fluorescence triggering), что позволяет анализировать флуоресцирующие частицы небольшого размера, которые не учитываются, если порог установлен по показателям светорассеяния. В качестве маркерных белков при анализе происхождения МЧ целесообразно выбирать белки с наиболее высокой экспрессией на поверхности клетки. Для регистрации циркулирующих в крови МЧ наиболее часто используют антитела против следующих антигенов: CD41/61 (гликопротеин (ГП) IIb-IIIa) или CD42b (ГП Ib) для МЧ тромбоцитов, CD45 для МЧ всех типов лейкоцитов, CD14 для МЧ моноцитов, CD235a для МЧ эритроцитов и CD144 или CD31 для МЧ эндотелиальных клеток. В последнем случае, в связи с наличием небольшого количества CD31 на тромбоцитах, эти частицы должны быть негативными по отношению к тромбоцитарным маркерам. Наиболее корректным вариантом для оценки содержания конкретного вида МЧ является их положительная идентификация по двум маркерам – окраска ФС и окраска маркерного антигена (разные флуоресцентные метки). По размеру МЧ выделяют (“гейтируют”) с использованием калибровочных частиц. К МЧ относят все объекты размером менее 0.9–1.0 мкм (размер частиц для калибровки). После выделения (“гейтирования”) анализируемых МЧ (показатели светорассеяния, показатели флуоресценции) их подсчет можно проводить двумя способами. В цитометрах, позволяющих точно определить объем анализируемой суспензии, концентрацию МЧ определяют, зная количество подсчитанных МЧ и объем, в котором они подсчитаны. В цитометрах, не имеющих такой функции, в образцы добавляют частицы для счета с известной концентрацией и размером несколько больше МЧ (2–3 мкм), чтобы их подсчет не препятствовал подсчету самих МЧ, и затем перерассчитывают количество анализируемых МЧ, нормируя его на концентрацию частиц для счета. Независимо от применяемого метода, подсчет МЧ рекомендуется проводить в условиях низкой скорости анализа и при относительно невысокой концентрации МЧ, что способствует лучшему разделению МЧ в потоке и снижает возможность получения сигнала от нескольких МЧ одновременно. Для корректного подсчета МЧ необходим также анализ контрольных образцов: оценивают неспецифическое связывание аннексина V (в отсутствие кальция), проводят изотипический контроль на используемые антитела и растворы с красителями, но без МЧ [20–25].
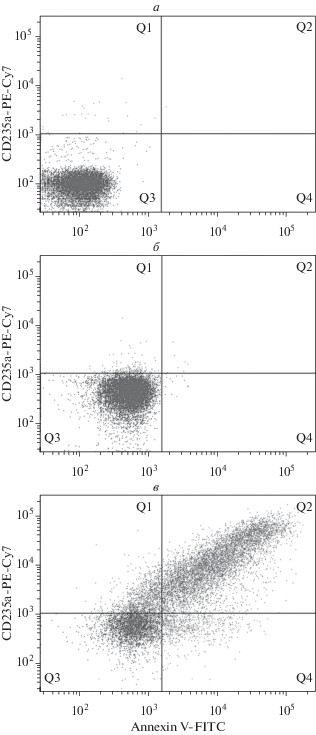
Рис. 2.
Выявление МЧ эритроцитов с помощью проточной цитофлуориметрии. Точки – события, регистрируемые проточным цитометром. Микрочастицы эритроцитов выделяли (осаждали при 20 000 g, 30 мин) из супернатанта эритроцитов, активированных ионофором А23187. а – Собственная флуоресценция МЧ без окрашивания аннексином V-FITC и антителами CD235a-PE-Cy7 (отрицательный контроль 1). Подавляющее большинство событий локализовано в квадрате Q3. б – Раствор без МЧ с аннексином V-FITC и антителами CD235a-PE-Cy7 (отрицательный контроль 2). Подавляющее большинство событий локализовано в квадрате Q3. в – Микрочастицы, окрашенные аннексином V-FITC и антителами CD235a-PE-Cy7. Микрочастицы эритроцитов, окрашенные двумя метками, локализованы в квадрате Q2. Проточный цитометр BD FACSCanto™ II (BD Biosciences, США). Собственные данные.
Несмотря на широкое распространение метода подсчета МЧ с помощью проточной цитометрии, вопросы стандартизации этого подхода остаются в значительной степени нерешенными. Применение разных цитометров, разных реактивов для окрашивания МЧ и разных контролей не позволяет сравнивать результаты, полученные в отдельных лабораториях. Даже при проведении организованных SSC ISTH стандартизованных исследований, в которых проводят подсчет МЧ тромбоцитов в одних и тех же образцах плазмы и с помощью стандартных реактивов, распространяемых центральной лабораторией, полученные разными участниками результаты значительно варьируют (некоторые показатели/параметры различались в 5–6 раз) [22, 25]. В стандартизированном исследовании, опубликованном в 2017 г. [25], количество тромбоцитарных МЧ в плазме, определяемое с помощью проточной цитометрии, составило в среднем около 8000 в 1 мкл (пул плазмы от 10 доноров) с межинструментальной вариабельностью 37%. Близкие количества МЧ тромбоцитов, около 10 000 в 1 мкл плазмы, зарегистрированы и в работе Arraud и соавт. [24], выполненной на современном цитометре и с использованием всех необходимых контролей. В то же время в других, также недавно опубликованных работах, абсолютные количества МЧ тромбоцитов были существенно меньше – от нескольких сотен до нескольких тысяч в 1 мкл плазмы [26–29]. По данным цитофлуориметрических сравнительных исследований именно МЧ тромбоцитарного происхождения являются основной фракцией МЧ плазмы крови: их количество (вне зависимости от регистрируемых абсолютных значений) существенно (не менее чем в несколько раз) превышает количество МЧ эритроцитов, лейкоцитов и эндотелиальных клеток [5, 6, 24, 26–29].
Таким образом, на сегодняшний день, несмотря на существенный прогресс в изучении МЧ с помощью проточной цитометрии, корректное сравнение результатов подсчета МЧ возможно лишь при выполнении анализов в одной лаборатории на одном и том же цитометре с одними и теми же реактивами.
3.1.2. Другие методы подсчета микрочастиц
Кроме проточной цитометрии, для подсчета МЧ можно использовать различные варианты электронной микроскопии, а также метод анализа траекторий наночастиц (Nanoparticle Tracking Analysis, NTA) и метод резистивного импульсного зондирования (Resistive Pulse Sensing, RPS). С помощью электронной микроскопии можно визуально просчитывать частицы практически любого размера, но этот метод слишком сложен, длителен и трудоемок для анализа большого количества образцов (например, при обследовании больных). Метод NTA основан на регистрации с помощью видеозаписи показателей броуновского движения отдельных частиц при освещении раствора лазерным лучом; последующая компьютерная обработка траекторий частиц позволяет оценить как их размер, так и концентрацию. Метод RPS фактически является усовершенствованным вариантом известного метода Коултера, с помощью которого проводят анализ частиц (измерение концентрации и размера) по изменению проводимости (“резистентности”) при их прохождении через отверстие, соединяющее два резервуара с проводящей ток жидкостью и расположенными в них электродами. В RPS-приборах используют мембраны с размером пор (через которые проходят частицы) менее 1 мкм, что позволяет анализировать очень мелкие объекты. Главное преимущество и электронной микроскопии, и методов NTA и RPS перед проточной цитометрией – возможность детекции МЧ размером менее 200 нм [21, 29–33]. В связи с этим при подсчете МЧ с помощью данных методов получают значения на порядки более высокие, чем в проточных цитометрах [32–36]. Тем не менее, методы NTA и RPS имеют и серьезные недостатки, и ограничения. В отличие от проточной цитометрии, при использовании метода NTA в стандартной модификации и метода RPS отсутствует возможность мечения МЧ маркерами родительских клеток. В связи с этим крайне сложно отделить анализируемые внеклеточные МЧ (как МЧ, так и экзосомы) от примесей того же размера и невозможно определить их клеточное происхождение. Эти же ограничения осложняют проведение исследований МЧ и экзосом с помощью NTA и RPS в биологических жидкостях, так как в них всегда присутствуют эндогенные не мембранные объекты, сопоставимые по размеру с фракциями мелких МЧ (крупные белки, агрегаты белков, липопротеины и т.д.). Таким образом, применение методов NTA и RPS требует предварительного выделения МЧ из биологических жидкостей и использования ультрачистых растворов. Наличие электронных микроскопов, NTA- и RPS-приборов лишь в специализированных лабораториях также ограничивает применение этих методов. За последние годы опубликованы работы, демонстрирующие возможность подсчета флуоресцентно меченных внеклеточных частиц с использованием специальных NTA-анализаторов, имеющих дополнительную функцию регистрации флуоресцентного сигнала [31, 36, 37]. При использовании электронной микроскопии также существует возможность мечения частиц антителами, конъюгированными с наночастицами золота (метод “immune-gold”) [32, 38]. Однако очевидно, что такие подходы, требующие применения дорогостоящей аппаратуры и присутствия в лаборатории высококвалифицированных специалистов, практически неприменимы для серийных и тем более клинических исследований.
3.2. Определение размера микрочастиц
Как сказано выше (см. ВВЕДЕНИЕ), размер МЧ варьирует от 100 до 1000 нм, а экзосом от 40 до 100 нм. Метод проточной цитометрии позволяет проводить лишь качественный и сравнительный анализ размеров различных МЧ (ограничения по размеру частиц, нелинейный характер изменений показателей прямого и бокового светорассеяния, трудности калибровки, межинструментальная вариабельность и другие причины). Наиболее корректные результаты при анализе размера мембранных внеклеточных частиц получают, используя электронную микроскопию, NTA- и RPS-методы (см. раздел “Подсчет микрочастиц”), а также метод динамического светорассеяния (Dynamic Light Scattering, DLS) или лазерной корреляционной спектроскопии. Метод DLS, с помощью которого размер частиц определяют по показателям их светорассеяния в процессе броуновского движения, более прост и доступен по сравнению с электронной микроскопией и NTA- и RPS-методами [21, 29–33].
С помощью метода DLS нами был проведен сравнительный анализ размеров МЧ, получаемых in vitro при активации различных клеток крови и эндотелиальных клеток (табл. 1) [39–41]. МЧ выделяли центрифугированием при 20 000 g в течение 30 мин, что обеспечивало отсутствие существенных примесей экзосом (более мелких частиц) в образцах. Результаты этих экспериментов показали, что размеры МЧ значительно варьируют в зависимости от их клеточного происхождения. Средний диаметр варьировал от ~600 нм для МЧ нейтрофилов и эндотелиальных клеток, ~500 нм для МЧ моноцитов, ~350–400 нм для МЧ тромбоцитов, до ~200 нм для МЧ эритроцитов. Средний диаметр МЧ, выделенных из плазмы крови, по нашим данным, составил ~350 нм, т.е. был наиболее близок к размеру МЧ тромбоцитов, составляющих, как указано выше, основную фракцию МЧ плазмы (см. раздел “Подсчет микрочастиц”). Эти результаты в основном соответствуют данным других работ, в которых размер МЧ этих клеток измеряли с помощью различных методических подходов. Размер МЧ эритроцитов в диапазоне ~200 нм был зарегистрирован также и другими авторами с помощью как DLS, так и микроскопических методов [42–44]. Средний диаметр основной фракции МЧ нейтрофилов при определении размера с помощью DLS и электронной микроскопии составил 500–600 нм [45], a при определении размера МЧ эндотелиальных клеток с помощью электронной микроскопии большая часть МЧ имела диаметр от 400 до 1000 нм [46]. Brisson и соавт. [38], используя электронную микроскопию и окрашивание МЧ с помощью антител, конъюгированных с наночастицами золота, показали, что размер МЧ, продуцируемых активированными тромбоцитами (CD41+/ФС+), варьируют в диапазоне от 100–200 до 500–600 нм с пиком в области 300–400 нм. Измеряя размер МЧ моноцитов и тромбоцитов с помощью электронной микроскопии и метода NTA, Aleman и соавт. [34] зарегистрировали несколько более мелкие размеры для обоих видов частиц (средний диаметр от 200 до 300 нм) по сравнению с нашими данными [39, 40] (МЧ тромбоцитов и моноцитов) и данными Brisson и соавт. [38] (МЧ тромбоцитов). Tripisciano и соавт. [10] методом NTA определили размер МЧ тромбоцитов даже менее 200 нм (средний диаметр ~170 нм), однако при анализе тех же МЧ с помощью электронной микроскопии были выявлены вариации в диапазоне от 100 до 500 нм. Причины значительных различий при определении размера МЧ в некоторых работах остаются неясными, однако при сопоставлении результатов необходимо учитывать применение авторами разных методических подходов. Sustar и соавт. [29, 47] измеряли размер МЧ плазмы крови с помощью электронной микроскопии и показали, что размер МЧ варьирует в диапазоне 300–400 нм, что близко к данным, полученным нами с помощью метода динамического светорассеяния [39].
Таблица 1.
Размеры микрочастиц (МЧ) различного происхождения, определенные методом динамического светорассеяния
| Источник МЧ | Средний диаметр МЧ, нм | Уровень значимости (р) отличия от группы | ||||
|---|---|---|---|---|---|---|
| НФ | МО | ТЦ | ЭР | ПК | ||
| Эндотелиальные клетки | 591 ± 21 (6) | 0.376 | 0.002 | <0.001 | <0.001 | <0.001 |
| Нейтрофилы (НФ) | 580 ± 10 (4) | – | 0.016 | <0.001 | <0.001 | <0.001 |
| Моноциты (МО) | 485 ± 61 (6) | – | – | 0.004 | <0.001 | <0.001 |
| Тромбоциты (ТЦ) | 382 ± 56 (10) | – | – | – | <0.001 | 0.186 |
| Эритроциты* (ЭР) | 213 ± 14 (9) | – | – | – | – | <0.001 |
| Плазма крови (ПК) | 346 ± 48 (7) | – | – | – | – | – |
Примечание. Микрочастицы получали (осаждение при 20 000 g, 30 мин) из надосадков активированных эндотелиальных клеток, нейтрофилов, моноцитов (везде активатор ЛПС), тромбоцитов (активатор TRAP), эритроцитов (активатор А23187) и из плазмы крови. Представлены средние значения ± стандартные отклонения, в скобках указано количество проанализированных препаратов. * Аналогичные результаты получены при анализе МЧ из просроченной эритроцитарной массы для переливания, 225 ± 26 нм (7). Собственные результаты [39–41].
Таким образом, анализ опубликованных и собственных данных указывает на то, что размер МЧ существенным образом варьирует в зависимости от их клеточного происхождения.
3.3. Определение коагуляционной активности микрочастиц
Коагуляционную активность МЧ в большинстве лабораторий оценивают с использованием стандартных коагуляционных тестов. Самый простой подход – определение времени свертывания плазмы после добавления кальция по изменению светопропускания/светорассеяния (тест рекальцификации) в присутствии изучаемых МЧ в сравнении с плазмой без МЧ, которые удаляют путем предварительного центрифугирования (рис. 3). В ходе таких экспериментов можно фиксировать не только время свертывания (лаг-фаза), но и скорость этой реакции. (см., например, [34, 40, 48–50]). Второй часто применяемый подход связан с использованием теста генерации тромбина. Добавление МЧ усиливает генерацию тромбина в плазме крови, что определяется по изменению всех изучаемых в этом тесте показателей: лаг-фаза, время достижения и высота пика, площадь под кривой (общее количество образовавшегося тромбина) (см., например, [10, 34, 49–52]). Еще один подход связан с использованием недавно разработанного в России теста “тромбодинамика”, позволяющего в реальном времени с помощью покадровой видеосъемки следить за “волной” свертывания плазмы, запускаемого иммобилизованным на пластиковой подложке ТФ [53]. Наличие коагуляционно активных эндогенных или добавление экзогенных МЧ приводит к образованию в объеме плазмы “спонтанных” сгустков и увеличению скорости свертывания [54]. Наличие ТФ в МЧ регистрируют иммунологически с использованием соответствующих антител. Активность ТФ оценивают по влиянию на коагуляционные показатели блокирующих анти-ТФ-антител и/или непосредственно измеряя ее по способности активировать фактор X. Еще одна возможность проверки способности МЧ инициировать свертывание по внешнему, ТФ-зависимому, пути – использование инактивированного фактора VII и дефицитной по этому фактору плазмы [10, 34, 40, 48, 51, 52, 54, 55]. Способность МЧ стимулировать свертывание по внутреннему пути изучают, используя ингибиторы факторов XI и XII, дефицитные по этим факторам плазмы и хромогенные тесты, специфически регистрирующие их активность [10, 34, 51, 52, 54].
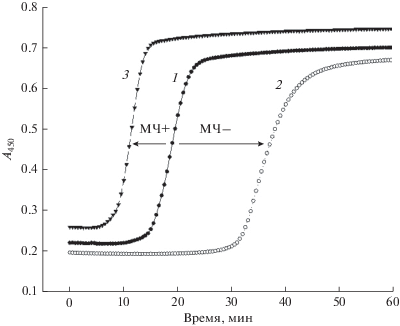
Рис. 3.
Микрочастицы и свертывание плазмы (тест рекальцификации). Кровь здорового донора собирали в 3.8% цитрат натрия и получали плазму после двукратного осаждения клеток при 2500 g, 15 мин. Свертывание плазмы инициировали добавлением 50 мкл раствора 25 мМ CaCl2 к 100 мкл плазмы, разведенной в 2 раза буфером Оурена–Коллера (Diagnostica Stago, Франция), содержащим 150 мкг/мл ингибитора трипсина из кукурузы (частичное подавление свертывания по контактному пути). Образование фибринового сгустка регистрировали в лунках микропланшета при 30°С, измеряя поглощение света (А450) каждые 30 с в планшетном спектрофотометре Thermo Scientific Multiskan Go (Thermo Fisher, Финляндия). Представлены кривые коагуляции контрольной плазмы (1), плазмы после осаждения МЧ (2) и плазмы после добавления предварительно осажденных из плазмы (20 000 g, 30 мин, 1 мл плазмы) и ресуспендированных МЧ (3). Видно, что удаление эндогенных МЧ замедляет, а добавление дополнительных экзогенных МЧ ускоряет свертывание плазмы. Собственные данные.
4. ЦИРКУЛИРУЮЩИЕ В КРОВОТОКЕ МИКРОЧАСТИЦЫ И ИХ КОАГУЛЯЦИОННАЯ АКТИВНОСТЬ
Очевидно, что такое свойство МЧ, как их коагуляционная активность, может проявиться лишь в том случае, если МЧ попадают в кровоток, где могут влиять на свертывание крови в процессе остановки кровотечения или внутрисосудистого тромбообразования. Главными источниками циркулирующих МЧ служат клетки крови (тромбоциты, лейкоциты, эритроциты), а также эндотелиальные клетки, выстилающие внутреннюю поверхность сосудов. Коагуляционная активность МЧ определяется наличием на их поверхности ФС (все МЧ вне зависимости от клеточного происхождения), формирующего отрицательно заряженный субстрат для сборки коагуляционных комплексов. С ФС связываются содержащие положительно заряженную γ-карбоксиглутаминовую кислоту факторы свертывания (факторы VII, IX, X и протромбин), а также антикоагулянтные белки S и С. Более выраженной коагуляционной активностью обладают МЧ, которые содержат не только ФС, но и активный ТФ – первичный инициатор реакций коагуляционного каскада. Такие МЧ продуцируются активированными моноцитами, активированными эндотелиальными клетками и клетками некоторых опухолей. Они обычно не циркулируют в крови здоровых доноров, но выявляются при патологических состояниях, ассоциированных с тромбозом или его повышенным риском [3, 5, 6, 8, 55, 56].
4.1. Микрочастицы тромбоцитов
Тромбоциты представляют собой безъядерные форменные элементы крови, образующиеся из мегакариоцитов костного мозга. Содержание тромбоцитов в крови в норме составляет (150–450) × 109/л.
Активация тромбоцитов различными индукторами приводит к стимуляции продукции МЧ, что впервые наблюдали еще в 1970 г. при добавлении к тромбоцитам тромбина [14]. Наибольшие количества МЧ образуются при активации тромбоцитов сильными агонистами (или их смесью), такими как тромбин, пептид-активирующий рецептор тромбина (TRAP, Thrombin Receptor Activating Peptide), коллаген или коллагеновые пептиды, и меньшие количества – при активации слабыми индукторами, такими как арахидоновая кислота и АDP. Обработка тромбоцитов ионофором A23187 вызывает наиболее высокий уровень продукции МЧ, так как этот искусственный агонист вызывает максимальное повышение внутриклеточного кальция (по сравнению со всеми физиологическими индукторами) – ключевого сигнала, запускающего процесс образования МЧ [10, 34, 38, 40, 48, 51, 57]. Образование МЧ регистрируется также при воздействии высоких напряжений сдвига (“shear stress”) [58, 59] и при хранении тромбоконцентратов [10, 60, 61].
Тромбоцитарные МЧ выявляют с помощью проточной цитометрии с использованием антител против специфических маркеров их поверхности, таких как CD41 (ГП IIb) и/или СD42b (ГП Ib) и маркеров ФС (аннексин V). Именно МЧ тромбоцитов представляют наиболее многочисленную фракцию циркулирующих МЧ – до 70–80% от общего числа МЧ плазмы крови [6, 24, 26–29, 32], а их абсолютное количество у здоровых доноров при измерении с помощью проточной цитометрии (в том числе по результатам стандартизованого исследования SSC ISTH 2017 г.) составляет около 10 000 в 1 мкл плазмы [24, 25]. Механизмы образования циркулирующих в крови МЧ тромбоцитов остаются не совсем ясными. Возможно, МЧ высвобождаются частично активированными в кровотоке тромбоцитами или образуются в процессе их “старения”. Однако в работах группы Italiano и соавт. [62, 63], выполненных на мышах, показано, что МЧ могут образовываться не только тромбоцитами, но и костно-мозговыми продуцентами тромбоцитов – мегакариоцитами, причем МЧ мегакариоцитов содержат на своей поверхности те же маркеры, что и МЧ тромбоцитов: CD41, CD42b и ФС. В отличие от МЧ, образующихся при активации тромбоцитов, мегакариоцитарные МЧ не содержат маркеры, специфичные для поверхности активированных тромбоцитов, такие как CD62P (P-селектин) и LAMP-1 (CD107а) (эти мембранные белки экспонируются на поверхности активированных тромбоцитов вследствие экзоцитоза содержащих их внутриклеточных гранул). Отсутствие активационных маркеров (CD62P) характерно и для большинства циркулирующих тромбоцитов, в связи с чем был сделан вывод о мегакариоцитарном происхождении значительной фракции CD41-положительных циркулирующих МЧ. Косвенно эту гипотезу подтверждают результаты ряда исследований, выполненных на пациентах и показавших, что количество МЧ-положительных по активационным маркерам тромбоцитов CD62P и/или СD63 (еще один маркер экзоцитоза гранул) коррелирует с наличием внутрисосудистого тромбоза (инфаркт миокарда, нестабильная стенокардия), т.е. с активацией тромбоцитов [64, 65].
Способность МЧ тромбоцитов ускорять свертывание плазмы продемонстрирована еще в первых работах по изучению МЧ (см. раздел 1 “История открытия и изучения микрочастиц”). В дальнейшем коагуляционную активность МЧ тромбоцитов изучали как с помощью теста свертывания плазмы (тест рекальцификации), так и более современными методами: тест генерации тромбина, измерение протромбиназной активности, измерение активности ТФ и др. Микрочастицы тромбоцитов стимулируют свертывание плазмы [34, 40, 48], проявляют протромбиназную активность и ускоряют образование тромбина [10, 34, 51]. С помощью иммуноэлектронной микроскопии показано, что МЧ тромбоцитов способны связывать фактор X и протромбин [9]. В то же время МЧ тромбоцитов, в отличие от МЧ моноцитов и эндотелиальных клеток, не содержат ТФ (активатор внешнего пути свертывания), поэтому соответствующие ингибиторы не влияют на коагуляционную активность МЧ тромбоцитов и в них не удается зарегистрировать наличие активного ТФ в хромогенном тесте [10, 34, 40, 48, 51]. Эти данные соответствуют тому, что ТФ не экспрессируется и в самих тромбоцитах [56, 66]. Однако МЧ тромбоцитов обладают способностью активировать фактор XII, т.е. контактный (внутренний) путь коагуляции [10, 51]. В отличие от целых тромбоцитов, продуцируемые ими МЧ не содержат фактора V (не проявляют коагуляционной активности в отсутствие экзогенного фактора) [34]. Коагуляционная активность МЧ тромбоцитов подавляется блокаторами ФС – аннексином V и лактадгерином [10, 40]. Сравнительные исследования, проведенные с помощью теста рекальцификации плазмы и теста генерации тромбина, показали, что МЧ тромбоцитов обладают меньшей коагуляционной активность по сравнению с МЧ моноцитов и эндотелиальных клеток, которые содержат активный ТФ [10, 34, 40, 51]. Таким образом, прокоагулянтные свойства МЧ тромбоцитов определяются (1) наличием на их поверхности ФС (субстрат для формирования коагуляционных комплексов) и (2) способностью активировать контактный путь свертывания (фактор XII). В работе Sinauridze и соавт. [67] показано, что тромбоцитарные МЧ обладают более высокой плотностью экспрессии ФС на поверхности по сравнению с активированными тромбоцитами, что позволяет предположить, что поверхность МЧ коагуляционно даже более активна, чем поверхность родительских клеток.
Повышение количества МЧ тромбоцитов зарегистрированы у больных с тромбоцитозом [68, 69], тромботическими обострениями сердечно-сосудистых заболеваний (острый коронарный синдром – инфаркт миокарда и нестабильная стенокардия) [64, 65, 70, 71], тяжелым атеросклерозом [72], хроническими воспалительными заболеваниями (системная красная волчанка, ревматоидный артрит) [73, 74] и другими патологиями, ассоциированными с риском тромбозов [3, 5, 6, 8, 56]. Очевидно, что в большинстве случаев увеличение МЧ тромбоцитов является следствием и маркером внутрисосудистой активации тромбоцитов. Повышение в кровотоке МЧ тромбоцитов может быть предиктором повторных тромботических событий у больных с острым коронарным синдромом [71] и развития рестеноза после чрескожных коронарных вмешательств (ангиопластическиx процедур) [75].
Тромбоцитарные МЧ, кроме реакций гемостаза и тромбоза, участвуют также в развитии воспаления, стимуляции ангиогенеза и заживления ран, метастазировании опухолей [6, 76–78].
4.2. Микрочастицы лейкоцитов
Общее количество лейкоцитов в крови здоровых лиц (4–9) × 109/л. Основные фракции лейкоцитов – моноциты, нейтрофилы, лимфоциты – способны образовывать МЧ. Общую фракцию МЧ лейкоцитов обычно идентифицируют с помощью панлейкоцитарного маркера CD45. В качестве специфического маркера МЧ моноцитов чаще всего используют CD14, МЧ нейтрофилов – CD66b, а МЧ лимфоцитов – CD3/CD4/CD8/CD20 (в зависимости от типа лимфоцитов) [5, 79]. В крови МЧ лейкоцитов определяются в меньших количествах по сравнению с МЧ более многочисленных форменных элементов крови – тромбоцитов и эритроцитов [26, 27, 74, 80–82]. С точки зрения участия в процессах гемостаза и тромбоза наиболее активными и наиболее хорошо изученными являются МЧ моноцитов.
4.2.1. Микрочастицы моноцитов
Количество моноцитов в крови в норме варьирует в диапазоне (0.2–0.7) × 109/л (3–7% от всех лейкоцитов). Для изучения образования МЧ in vitro обычно используют моноциты крови или моноцитарную линию клеток THP-1. Моноциты чаще всего активируют бактериальным липополисахаридом (ЛПС), но иногда используют и ионофор А23187 [10, 34, 40, 48, 51]. Bernimoulin и соавт. [83] обнаружили, что моноциты могут продуцировать МЧ при добавлении к ним химерной молекулы Р-селектин/IgG, моделируя таким образом возможное взаимодействие моноцитов и тромбоцитов, содержащих мембранный P-селектин. По данным Aleman и соавт. [34], моноциты, активированные ЛПС, продуцируют приблизительно 60 МЧ на 1 моноцит (подсчет МЧ с помощью NTA).
Во многих работах показано, что активированные моноциты и продуцируемые ими МЧ экспрессируют активный ТФ [10, 34, 40, 48, 51, 56, 66, 83]. Именно благодаря наличию ТФ, МЧ моноцитов обладают выраженной коагуляционной активностью, что показано в экспериментах с использованием теста генерации тромбина и теста рекальцификации. В тесте генерации тромбина МЧ моноцитов оказывались существенно более активны, чем МЧ тромбоцитов и эритроцитов [10, 34, 51]. В наших исследованиях мы обнаружили, что МЧ моноцитов ускоряют свертывание плазмы эффективнее МЧ тромбоцитов, нейтрофилов и даже МЧ эндотелиальных клеток, которые также содержат активный ТФ, хотя и в меньших количествах [40]. Ключевая роль ТФ в реализации прокоагулянтых свойств МЧ моноцитов подтверждена с помощью ингибиторного анализа [10, 34, 40, 48, 51]. Показано также, что МЧ моноцитов по сравнению с МЧ тромбоцитов стимулируют образование более плотного и более резистентного к фибринолизу фибринового сгустка [34].
В работах группы Furie [84–86] на модели тромбоза in situ с помощью интравитальной флуоресцентной видеомикроскопии показано, что МЧ моноцитов, содержащие ТФ, могут накапливаться в растущем тромбе, причем включение в тромб МЧ происходит на начальных стадиях тромбоза и быстрее, чем включение самих моноцитов. Способность МЧ накапливаться в зоне растущего тромба полностью зависела от взаимодействия лейкоцитарного лиганда P-селектина (P-selectin glycoprotein ligand 1, PSGL-1) и P-селектина, появляющегося на поверхности активированных тромбоцитов. На основании этих данных авторы предполагают, что МЧ моноцитов могут доставлять в растущий тромб появляющийся в крови (“blood-borne”) ТФ. ТФ, поступающий в кровь в больших количествах из субэндотелиальных структур при повреждении сосуда, может частично маскироваться тромбоцитами, накапливающимися в зоне повреждения. Однако ТФ, переносимый МЧ, в результате их связывания с адгезированными и агрегированными тромбоцитами может локализоваться не внутри тромба, а на его поверхности. Способность МЧ моноцитов переносить ТФ в тромбоциты путем слияния мембран также продемонстрирована в экспериментах in vitro [87, 88]. Кроме того, нам удалось выявить в крови больных с инфарктом миокарда небольшую фракцию тромбоцитов, положительных по лейкоцитарному антигену CD45, часть из которых оказалась положительной и по ТФ, что возможно обусловлено их взаимодействием в кровотоке с МЧ моноцитов [89]. Интересно, что моноциты – возможно, также с помощью МЧ – могут переносить ТФ и в нейтрофилы [90] (см. также ниже).
Повышение содержания в крови МЧ моноцитов выявлено у больных с сепсисом [91], серповидно-клеточной анемией [81], острым коронарным синдромом [92, 93], диабетом [82, 94] и воспалительными заболеваниями [74]. Временное повышение МЧ моноцитов наблюдали при моделировании эндотоксемии у здоровых лиц [95]. Важно отметить, что в ряде исследований зарегистрировано увеличение содержания МЧ моноцитов, содержащих ТФ [81, 91, 96], т.е. обладающих наиболее высокой коагуляционной активностью. Высокое содержание МЧ моноцитов у больных с острым коронарным синдромом может быть фактором риска последующего развития сердечной недостаточности [92] и даже смертельных исходов [96].
4.2.2. Микрочастицы нейтрофилов и лимфоцитов
Нейтрофилы (другие используемые названия – гранулоциты и полиморфноядерные лейкоциты (без учета базофилов и эозинофилов)) и лимфоциты присутствуют в крови в большем количестве, чем моноциты – (2–7) × 109/л и (1–5) × 109/л (50–70 и 25–40% от всех лейкоцитов) соответственно. И те, и другие клетки при активации способны продуцировать МЧ. В условиях in vitro для активации нейтрофилов, стимулирующей выброс МЧ, чаще всего используют ЛПС, хемоаттрактантный пептид N-формилметионин-лейцин-фенилаланин (N-formylmethionyl-leucyl-phenylalanine, fMCP) или форболмиристатацетат (активатор протеинкиназы С) [97], а для активации лимфоцитов – форболмиристатацетат и фитогемагглютинин (см., например, [98]). Количество МЧ нейтрофилов и лимфоцитов (как и моноцитов) крайне невелико по сравнению с МЧ тромбоцитов [93].
МЧ нейтрофилов и лимфоцитов содержат на поверхности ФС [45, 98], т.е. потенциально могут быть коагуляционно активны, однако в силу существенно меньшего количества в крови по сравнению с МЧ тромбоцитов и отсутствия на их поверхности активного ТФ (см. подробно ниже) (в отличие от МЧ моноцитов), их участие в свертывание крови скорее всего минимально. В связи с этим практически отсутствуют данные по изучению коагуляционной активности МЧ нейтрофилов и лимфоцитов. В нашей работе, используя тест рекальцификации, мы показали, что МЧ нейтрофилов обладают приблизительно такой же способностью ускорять свертывание плазмы, как и МЧ тромбоцитов, но существенно более низкой способностью по сравнению с ТФ-содержащими МЧ моноцитов и эндотелиальных клеток [40]. Вопрос о наличии ТФ в нейтрофилах является предметом дискуссий. В некоторых работах удалось зарегистрировать ТФ в нейтрофилах, активированных in vitro [99, 100], и даже в МЧ нейтрофилов в крови у больных васкулитом [101]. Однако в работе Egorina и соавт. [90] убедительно продемонстрирована не только неспособность нейтрофилов продуцировать ТФ при добавлении в кровь сильных активаторов лейкоцитов (ЛПС + форболмиристатацетат), но и возможность переноса ТФ с активированных моноцитов на нейтрофилы. Таким образом, в настоящее время большинство исследователей считают, что сами нейтрофилы не экспрессируют ТФ, но могут получать его путем переноса из других клеток, предположительно моноцитов [56, 66]. В соответствии c этой точкой зрения нам также не удалось обнаружить активный ТФ в МЧ нейтрофилов (отсутствие эффектов анти-ТФ-антител в тесте рекальцификации и отсутствие ТФ-зависимой активации фактора X в хромогенном тесте) [40, 48]. Интересно, что МЧ нейтрофилов могут взаимодействовать с тромбоцитами и активировать их в результате этого взаимодействия, т.е. оказывать на тромбоциты протромботическое действие [102]. Повышение количества МЧ нейтрофилов и лимфоцитов отмечено при инфаркте миокарда (тромботическая патология) [93], а повышение количества МЧ нейтрофилов – при выраженном атеросклеротическом стенозе сонных артерий (состояние с высоким риском тромбозов) [103]. Интересно, что в качестве прогностического фактора неблагоприятных исходов у больных с острым коронарным синдромом зарегистрированы не повышенные, а сниженные уровни МЧ нейтрофилов [104]. МЧ лимфоцитов как предикторы сердечно-сосудистых тромбозов выявлены у лиц с высоким риском развития ишемической болезни сердца [105]. Тем не менее, по-видимому, главная функция МЧ нейтрофилов и лимфоцитов – это их участие в реакциях воспаления и иммунитета (активация комплемента, провоспалительное воздействие на эндотелиальные клетки, взаимная активация разных типов лейкоцитов и др.), а не в реакциях тромбоза и гемостаза [6, 79, 97]. И именно эти свойства определяют их роль как маркеров и факторов риска атеросклероза и атеротромботических событий.
4.3. Микрочастицы эритроцитов
Эритроциты – это самые многочисленные форменные элементы крови. Их количество в норме составляет (4– 5) × 1012/л. Эритроциты образуют МЧ при хранении эритроконцентратов для трансфузии и, возможно, при старении в организме, а в экспериментах in vitro их продукцию чаще всего стимулируют ионофором А23187 [6, 106]. Как и другие МЧ, они содержат на своей поверхности ФС, т.е. взаимодействуют с аннексином V [6, 106], а для их специфического выявления практически всегда используют антитела против CD235a (гликофорина) (см., например, [24, 26–29, 32]). В крови количество МЧ эритроцитов в несколько раз меньше, чем количество МЧ тромбоцитов [24, 26–29, 32], но несколько больше, чем МЧ лейкоцитов [26, 27]. Различия в содержании МЧ эритроцитов и тромбоцитов отмечены не только с помощью проточной цитометрии, но и с помощью электронной микроскопии (антитела против маркеров эритроцитов и тромбоцитов, меченные наночастицами золота) [32].
Как и другие ФС-положительные МЧ, МЧ эритроцитов проявляют прокоагулянтные свойства, ускоряя свертывание плазмы [41, 107] и усиливая генерацию тромбина [51, 52]. Как и МЧ тромбоцитов, они не содержат ТФ [41, 51, 52], но способны активировать внешний путь свертывания (фактор XI- и XII-зависимый) [51, 52] и по своей коагуляционной активности существенно уступают ТФ-содержащим МЧ моноцитов [41, 51]. Как показано Fischer и соавт. [107], МЧ эритроцитов сами не содержат ТФ, однако могут стимулировать его синтез в моноцитах.
Количество МЧ эритроцитов ожидаемо и существенно увеличено при серповидно-клеточной анемии [81, 108]. Зарегистрировано увеличение МЧ эритроцитов у больных с инфарктом миокарда [109–111], что может быть обусловлено повреждением эритроцитов при включении в состав растущего тромба. Повышенный уровень МЧ эритроцитов у таких больных рассматривается как фактор риска повторных тромботических событий [109].
Поскольку МЧ эритроцитов не содержат ТФ и присутствуют в кровотоке в небольшом количестве (по крайней мере, по сравнению с МЧ тромбоцитов), их вклад в тромботические реакции, по-видимому, невелик, возможно, за исключением гиперкоагуляционного состояния при таком специфическом заболевании, как серповидно-клеточная анемия, ассоциированном в период кризисов с массированным разрушением патологически измененных эритроцитов и резким увеличением количества их МЧ [81, 108].
4.4. Микрочастицы эндотелиальных клеток
Эндотелиальные клетки монослоем выстилают всю внутреннюю поверхность сосудистого русла. Способность культивируемых эндотелиальных клеток (чаще всего изучают клетки из пупочной вены человека) продуцировать МЧ in vitro неоднократно наблюдали при их активации фактором некроза опухолей, интерлейкином 1, ЛПС, тромбином и другими активаторами [6, 56, 112]. Для выявления МЧ эндотелиального происхождения используют антитела против CD144 (VE-кадгерина), CD62E (E-селектина), CD31 (при использовании CD31 частицы должны быть негативными по отношению к тромбоцитарным маркерам, в связи с экспрессией этого антигена и в тромбоцитах, хотя и в гораздо меньшем количестве, чем в эндотелиальных клетках) [5, 6, 56, 112].
Микрочастицы эндотелиального происхождения, как и все другие МЧ, содержат на поверхности ФС [6, 56, 112]. Микрочастицы, продуцируемые in vitro активированными эндотелиальными клетками, способны экспрессировать ТФ, как и сами культивируемые клетки, [6, 40, 48, 56, 112–116]. Эндотелиальные МЧ, содержащие ТФ, обнаружены не только в экспериментах in vitro, но и в крови пациентов с серповидно-клеточной анемией [81]. Тем не менее, вопрос о способности эндотелия (и эндотелиальных МЧ) экспрессировать ТФ in vivo остается дискуссионным. Предполагается, что эндотелиальные клетки в сосудистом русле скорее не синтезируют ТФ de novo, но захватывают его в результате взаимодействия с МЧ моноцитов [56, 66], приблизительно так же, как и в случае нейтрофилов (см. выше). В соответствии с этой гипотезой Pawlinski и соавт. [117], блокируя синтез ТФ в эндотелии на модели эндотоксемии у мышей, не обнаружили снижения тромботических маркеров (в отличие от блокады синтеза ТФ в гемопоэтических клетках, т.е. моноцитах).
Коагуляционная активность эндотелиальных МЧ зарегистрирована при исследовании свертывания плазмы (тест рекальцификации) [40, 48, 114] и в тесте генерации тромбина [116]. Стимуляция различных коагуляционных реакций эндотелиальными МЧ зависела от ТФ [40, 48, 113–116], но не подавлялась существенно антителами против фактора XII [116]. По нашим данным, способность эндотелиальных МЧ ускорять свертывание плазмы существенно выше, чем у МЧ тромбоцитов и нейтрофилов, но несколько ниже, чем у МЧ моноцитов крови, что, возможно, обусловлено более низким уровнем экспрессии ТФ [40]. Abid Hussein и соавт. [116] показали, что полученные in vitro МЧ эндотелиальных клеток при введении крысам могут стимулировать ТФ-зависимое образование венозного тромба. Однако по данным Pawlinski и соавт. [117], блокада синтеза ТФ в эндотелиальных клетках мышей in vivo не влияла на маркеры тромбоза в модели эндотоксемии, что противоречит предположению об участии ТФ-содержащих эндотелиальных МЧ в реализации тромботических реакций в условиях in vivo.
Количество МЧ эндотелиальных клеток в циркуляции существенно ниже, чем МЧ тромбоцитов, и сравнимо с количеством МЧ лейкоцитов [26–29]. Количество эндотелиальных МЧ повышено при многих заболеваниях, ассоциированных с активацией или повреждением эндотелия и тромбозом: тромботическая тромбоцитопеническая пурпура [118], тромбоцитоз [68], серповидно-клеточная анемия [81], сепсис [119, 120], острый коронарный синдром (инфаркт миокарда и нестабильная стенокардия) [92, 93, 121, 122], тромбоэмболия [123] и ряд других [6, 56, 112]. Повышенные количества МЧ эндотелиального происхождения могут служить прогностическими маркерами развития тромботических патологий у лиц с высоким риском ишемической болезни сердца [124] и развития сердечной недостаточности у больных, перенесших инфаркт миокарда [92].
Таким образом, MЧ продуцируемые in vitro активированными эндотелиальными клетками, содержат ТФ и проявляют высокую коагуляционную активность, а повышение количества эндотелиальных МЧ наблюдается при многих тромботических патологиях. Однако роль этих МЧ в реализации тромботических событий остается непонятной, в частности, из-за неясности вопроса о способности эндотелия (и соответственно продуцируемых им МЧ) экспрессировать ТФ в условиях in vivo.
5. АНТИКОАГУЛЯНТНЫЕ И ФИБРИНОЛИТИЧЕСКИЕ СВОЙСТВА МИКРОЧАСТИЦ
Несмотря на то что МЧ обладают выраженными прокоагулянтными свойствами, на их поверхности могут быть локализованы и антикоагулянтные белки. Более того, некоторые МЧ способны проявлять фибринолитическую активность.
Ингибитор пути ТФ (Tissue Factor Pathway Inhibitor, TFPI) обнаружен в ТФ-содержащих МЧ эндотелиальных клеток [115] и моноцитов [125], а ингибирование TFPI повышало активность ТФ в этих МЧ. Микрочастицы, содержащие как ТФ, так и TFPI, обнаружены не только в экспериментах in vitro, но и у больных с инфарктом миокарда [126] и диабетом [127]. На основании этих данных предположили, что соотношение ТФ/TFPI и определяет ТФ-зависимую коагуляционную активность МЧ [8]. Интересно, что TFPI был обнаружен также и в неэкспрессирующих ТФ тромбоцитарных МЧ, образование которых запускалось мощной активацией тромбоцитов тромбином в сочетании с ионофором А23187 [128].
Продемонстрирована способность МЧ тромбоцитов и эритроцитов связывать белок S, а добавление к ним активированного белка C (антикоагулянт, кофактором которого является белок S) приводило к инактивации факторов V и VIII (субстраты белка C) [129, 130]. Perez-Casal и соавт. [131] показали, что эндотелиальные клетки могут образовывать МЧ, содержащие на своей поверхности рецептор белка С, причем активированный белок С в комплексе с рецептором на МЧ сохраняет свою антикоагулянтную активность. Однако такие МЧ образовывались лишь в результате инкубации клеток с активированным белком С, но не с фактором некроза опухолей.
Lacroix и соавт. [8, 132, 133] установили, что МЧ эндотелиальных клеток и МЧ всех типов лейкоцитов (моноцитов, нейтрофилов и лимфоцитов), но не МЧ тромбоцитов и эритроцитов могут стимулировать превращение плазминогена в плазмин (главный фибринолитический фермент крови). Эта активность выявлена как в МЧ, образующихся in vitro [132, 133], так и в МЧ, выделенных из плазмы пациентов с тромботической тромбоцитопенической пурпурой, атеросклерозом и системной красной волчанкой [133]. Превращение плазминогена в плазмин на поверхности МЧ лейкоцитов происходило с участием активатора плазминогена урокиназного типа, а на поверхности МЧ эндотелиальных клеток с участием тканевого активатора плазминогена [133]. Также некоторые МЧ (тромбоцитарные и эндотелиальные) могут содержать и ингибитор активатора плазаминогена типа 1 (Plasminogen Activator Inhibitor 1, PAI-1), один из ключевых регуляторов процесса образования плазмина [8, 133, 134].
Наличие антикоагулянтной и фибринолитической активности у некоторых МЧ не приводит к блокированию их более выраженной прокоагулянтной активности. Доказательством этого служит тот очевидный факт, что все МЧ при добавлении к плазме крови существенно ускоряют (но никак не замедляют) свертывающие реакции. Тем не менее, можно предположить, что уровень коагуляционной активности МЧ может регулироваться присутствущими в них антикоагулянтными и фибринолитическими факторами.
6. ЗАКЛЮЧЕНИЕ
Сравнение коагуляцонных свойств МЧ клеток крови и эндотелиальных клеток показывает, что все МЧ в той или иной степени могут ускорять коагуляционные реакции благодаря присутствию на их поверхности ФС. Наибольшей активностью обладают МЧ моноцитов и эндотелиальных клеток, так как они (как и продуцирующие их клетки) способны экспрессировать ТФ. Некоторые МЧ могут также содержать антикоагулянтные белки и проявлять фибринолитическую активность. Содержание МЧ различного происхождения повышается при тромботических и воспалительных патологиях и служит отражением активации и/или повреждения соответствующих родительских клеток.
Работа была выполнена при поддержке гранта РФФИ № 17-04-00347.
Список литературы
Raposo G., Stoorvogel W. 2013. Extracellular vesicles: Exosomes, microvesicles, and friends. J. Cell. Biol. 200, 373–383.
Yáñez-Mó M., Siljander P.R., Andreu Z., Zavec A.B., Borràs F.E., Buzas E.I., Buzas K., Casal E., Cappello F., Carvalho J., Colás E., Cordeiro-da Silva A., Fais S., Falcon-Perez J.M., Ghobrial I.M., Giebel B., Gimona M., Graner M., Gursel I., Gursel M., Heegaard N.H., Hendrix A., Kierulf P., Kokubun K., Kosanovic M., Kralj-Iglic V., Krämer-Albers EM., Laitinen S., Lässer C., Lener T., Ligeti E., Linē A., Lipps G., Llorente A., Lötvall J., Manček-Keber M., Marcilla A., Mittelbrunn M., Nazarenko I., Nolte-’t Hoen E.N., Nyman T.A., O’Driscoll L., Olivan M., Oliveira C., Pállinger É., Del Portillo H.A., Reventós J., Rigau M., Rohde E., Sammar M., Sánchez-Madrid F., Santarém N., Schallmoser K., Ostenfeld M.S., Stoorvogel W., Stukelj R., Van der Grein S.G., Vasconcelos M.H., Wauben M.H., De Wever O. 2015. Biological properties of extracellular vesicles and their physiological functions. J. Extracell. Vesicles. 4, 27 066. https://doi.org/10.3402/jev.v4.27066
Hargett L.A., Bauer N.N. 2013. On the origin of microparticles: From “platelet dust” to mediators of intercellular communication. Pulm. Circ. 3, 329–340.
Lawson C., Vicencio J.M., Yellon D.M., Davidson S.M. 2016. Microvesicles and exosomes: New players in metabolic and cardiovascular disease. J. Endocrinol. 228, R57–71.
Mooberry M.J., Key N.S. 2016. Microparticle analysis in disorders of hemostasis and thrombosis. Cytometry A. 89, 111–122.
Ridger V.C., Boulanger C.M., Angelillo-Scherrer A., Badimon L., Blanc-Brude O., Bochaton-Piallat M.L., Boilard E., Buzas E.I., Caporali A., Dignat-George F., Evans P.C., Lacroix R., Lutgens E., Ketelhuth D.F.J., Nieuwland R., Toti F., Tunon J., Weber C., Hoefer I.E. 2017. Microvesicles in vascular homeostasis and diseases. Position paper of the European Society of Cardiology (ESC) Working Group on Atherosclerosis and Vascular Biology. Thromb. Haemost. 117, 1296–1316.
Todorova D., Simoncini S., Lacroix R., Sabatier F., Dignat-George F. 2017. Extracellular vesicles in angiogenesis. Circ. Res. 120, 1658–1673.
Lacroix R., Dubois C., Leroyer A.S., Sabatier F. Dignat-George F. 2013. Revisited role of microparticles in arterial and venous thrombosis. J. Thromb. Haemost. 11 Suppl 1, 24–35.
Heijnen H., Schiel A., Fijnheer R., Geuze H., Sixma J. 1999. Activated platelets release two types of membrane vesicles: Microvesicles by surface shedding and exosomes derived from exocytosis of multivesicular bodies and alpha-granules. Blood. 94, 3791–3799.
Tripisciano C., Weiss R., Eichhorn T., Spittler A., Heuser T., Fischer M.B., Weber V. 2017. Different potential of extracellular vesicles to support thrombin generation: Contributions of phosphatidylserine, tissue factor, and cellular origin. Sci. Rep. 7 (1), 6522.
Skotland T., Hessvik N.P., Sandvig K., Llorente A. 2018. Exosomal lipid composition and the role of ether lipids and phosphoinositides in exosome biology. J. Lipid Res. pii: jlr.R084343. https://doi.org/10.1194/jlr.R084343
Chargaff E., West R. 1946. The biological significance of the thromboplastic protein of blood. J. Biol. Chem. 166, 189–197.
Wolf P. 1967. The nature and significance of platelet products in human plasma. Br. J. Haematol. 13, 269–288.
Webber A.J., Johnson S.A. 1970. Platelet participation in blood coagulation aspects of hemostasis. Am. J. Pathol. 60, 19–42.
George J.N., Thoi L.L., McManus L.M., Reimann T.A. 1982. Isolation of human platelet membrane microparticles from plasma and serum. Blood. 60, 834–840.
Lhermusier T., Chap H., Payrastre B. 2011. Platelet membrane phospholipid asymmetry: From the characterization of a scramblase activity to the identification of an essential protein mutated in Scott syndrome. J. Thromb. Haemost. 9, 1883–1891.
Fox J.E., Austin C.D., Reynolds C.C., Steffen P.K. 1991. Evidence that agonist-induced activation of calpain causes the shedding of procoagulant-containing microvesicles from the membrane of aggregating platelets. J. Biol. Chem. 266, 13289–13295.
Sapet C., Simoncini S., Loriod B., Sapet C., Simoncini S., Loriod B. 2006. Thrombin-induced endothelial microparticle generation: Identification of a novel pathway involving ROCK-II activation by caspase-2. Blood. 108, 1868–1876.
Lacroix R., Judicone C., Mooberry M., Boucekine M., Key N.S., Dignat-George F. 2013. The ISTH SSC Workshop. Standardization of pre-analytical variables in plasma microparticle determination: Results of the International Society on Thrombosis and Haemostasis SSC Collaborative workshop. J. Thromb Haemost. 11, 1190–1193.
Yuana Y., Bertina R., Osanto S. 2011. Pre-analytical and analytical issues in the analysis of blood microparticles. Thromb. Haemost. 105, 396–408.
Van der Pol E., Böing A.N., Gool E.L., Nieuwland R. 2015. Recent developments in the nomenclature, presence, isolation, detection and clinical impact of extracellular vesicles. J. Thromb. Haemost. 14, 48–56.
Lacroix R., Robert S., Poncelet P., Kasthuri R.S., Key N.S., Dignat-George F. 2010. On behalf of the ISTH SSC workshop. Standardization of platelet-derived microparticle enumeration by flow cytometry with calibrated beads: Results of the International Society on Thrombosis and Haemostasis SSC Collaborative workshop. J. Thromb. Haemost. 8, 2571–2574.
Shantsila E., Montoro-García S., Gallego P., Lip G.Y.H. 2014. Circulating microparticles: Challenges and perspectives of flow cytometric assessment. Thromb. Haemost. 111, 1009–1014.
Arraud N., Gounou C., Turpin D., Brisson A.R. 2016. Fluorescence triggering: A general strategy for enumerating and phenotyping extracellular vesicles by flow cytometry. Cytometry Part A. 89A, 184–195.
Cointe S., Judicone C., Robert S., Mooberry M.J., Poncelet P., Wauben M., Nieuwland R., Key N.S., Dignat-George F., Lacroix R. 2017. Standardization of microparticle enumeration across different flow cytometry platforms: Results of a multicenter collaborative workshop. J. Thromb. Haemost. 15, 187–193.
Nielsen M.H., Beck-Nielsen H., Andersen M.N., Handberg A. 2014. A flow cytometric method for characterization of circulating cell-derived microparticles in plasma. J. Extracell. Vesicles. 3, 20795 https://doi.org/10.3402/jev.v3.20795
Gustafson C.M., Shepherd A.J., Miller V.M., Jayachandran M. 2015. Age- and sex-specific differences in blood-borne microvesicles from apparently healthy humans. Biol. Sex Differ. 6, 10. https://doi.org/10.1186/s13293-015-0028-8
Alkhatatbeh M.J., Enjeti A.K., Baqar S., Ekinci E.I., Liu D., Thorne R.F., Lincz L.F. 2018. Strategies for enumeration of circulating microvesicles on a conventional flow cytometer: Counting beads and scatter parameters. J. Circ. Biomarkers. 7, 1–10.
Sustar V., Bedina-Zavec A., Stukelj R., Frank M., Ogorevc E., Jansa R., Mam K, Veranic P., Kralj-Iglic V. 2011. Post-prandial rise of microvesicles in peripheral blood of healthy human donors. Lipids Health Dis. 10, 47. doi https://doi.org/10.1186/1476-511X-10-47
Van der Pol E., Hoekstra A.G., Sturk A., Otto C., Van Leeuwen T.G., Nieuwland R. 2010. Optical and non-optical methods for detection and characterization of microparticles and exosomes. J. Thromb. Haemost. 8, 2596–2607.
Van der Pol E., Coumans F., Varga Z., Krumrey M., Nieuwland R. 2013. Innovation in detection of microparticles and exosomes. J. Thromb. Haemost. 11 (Suppl. 1), 36–45.
Arraud N., Linares R., Tan S., Gounou C., Pasquet J.M., Mornet S., Brisson A.R. 2014. Extracellular vesicles from blood plasma: Determination of their morphology, size, phenotype and concentration. J. Thromb. Haemost. 12, 614–627.
Van der Pol E., Coumans F., Grootemaat A.E., Gardiner C., Sargent I.L., Harrison P., Sturk A., Van Leeuwen T.G., Land R.N., Nieuwland R. 2014. Particle size distribution of exosomes and microvesicles determined by transmission electron microscopy, flow cytometry, nanoparticle tracking analysis, and resistive pulse sensing. J. Thromb. Haemost. 12, 1182–1192.
Aleman M.M., Gardiner C., Harrison P., Wolberg A.S. 2011. Differential contribution of monocyte- and platelet-derived microparticles towards thrombin generation and fibrin formation and stability. J. Thromb. Haemost. 9, 2251–2261.
Vogel R., Coumans F.A., Maltesen R.G., Böing A.N., Bonnington K.E., Broekman M.L., Broom M.F., Buzás E.I., Christiansen G., Hajji N., Kristensen S.R., Kuehn M.J., Lund S.M., Maas S.L., Nieuwland R., Osteikoetxea X., Schnoor R., Scicluna B.J., Shambrook M., de Vrij J., Mann S.I., Hill A.F., Pedersen S. 2016. A standardized method to determine the concentration of extracellular vesicles using tunable resistive pulse sensing. J. Extracell. Vesicles. 5, 31242. doi https://doi.org/10.3402/jev.v5.31242
Pasalic L., Williams R., Siupa A., Campbell H., Henderson M.J., Chen V.M.Y. 2016. Enumeration of extracellular vesicles by a new improved flow cytometric method is comparable to fluorescence mode nanoparticle tracking analysis. Nanomedicine. 12, 977–986.
Carnell-Morris P., Tannetta D., Siupa A., Hole P., Dragovic R. 2017. Analysis of extracellular vesicles using fluorescence nanoparticle tracking analysis. Methods Mol. Biol. 1660, 153–173.
Brisson A.R., Tan S., Linares R., Gounou C., Arraud N. 2017. Extracellular vesicles from activated platelets: A semiquantitative cryo-electron microscopy and immuno-gold labeling study. Platelets. 28, 263–271.
Алчинова И.Б., Хаспекова С.Г., Голубева Н.В., Шустова О.Н., Антонова О.А., Карганов М.Ю., Мазуров А.В. 2016. Сравнение размера мембранных микрочастиц различного клеточного происхождения методом динамического светорассеивания. Доклады Академии наук. 470 (2), 223–226.
Shustova O.N, Antonova O.A., Golubeva N.V, Khaspekova S.G., Yakushkin V.V., Aksuk S.A., Alchinova I.B., Karganov M.Y., Mazurov A.V. 2017. Differential procoagulant activity of microparticles derived from monocytes, granulocytes, platelets and endothelial cells: Impact of active tissue factor. Blood Coagul. Fibrinolys. 28, 373–382.
Антонова О., Шустова О., Голубева Н., Панских С., Мазуров А. 2018. Коагуляционные свойства мембранных микрочастиц эритроцитов. Сборник тезисов. Объединенный международный конгресс “Congress on Open Issues in Thrombosis and Hemostasis” совместно с 9-й Всероссийской конференцией по клинической гемостазиологии и гемореологии. Санкт-Петербург, с. 17–18.
Allan D., Thomas P., Limbrick A.R. 1980. The isolation and characterization of 60 nm vesicles (“nanovesicles”) produced during ionophore A23187-induced budding of human erythrocytes. Biochem. J. 188, 881–887.
Salzer U., Hinterdorfer P., Hunger U., Borken C., Prohaska R. 2002. Ca++-dependent vesicle release from erythrocytes involves stomatin-specific lipid rafts, synexin (annexin VII), and sorcin. Blood. 99, 2569–2577.
Nguyen D.B., Ly T.B.T, Wesseling M.C., Hittinger M., Torge A., Devitt A., Perrie Y., Bernhardt I. 2016. Characterization of microvesicles released from human red blood cells. Cell Physiol. Biochem. 38, 1085–1099.
Timar C.I., Lorincz A.M., Csepanyi-Komi R., Valyi-Nagy A., Nagy G., Buzas E.I., Iványi Z, Kittel A., Powell D.W., McLeish K.R, Ligeti E. 2013. Antibacterial effect of microvesicles released from human neutrophilic granulocytes. Blood. 121, 510–518.
Abdelhafeez A.H., Jeziorczak P.M., Schaid T.R., Hoefs S.L., Kaul S., Nanchal R., Jacobs E.R., Densmore J.C. 2014. Clinical CVVH model removes endothelium-derived microparticles from circulation. J. Extracell. Vesicles. 3, 23498. https://doi.org/10.3402/jev.v3.23498
Sustar V., Bedina-Zavec A., Stukelj R., Frank M., Bobojevic G., Jansa R., Ogorevc E., Kruljc P., Mam K., Simunic B., Mancek-Keber M., Jerala R., Rozman B., Veranic P., Hägerstrand H., Kralj-Iglic V. 2011. Nanoparticles isolated from blood: A reflection of vesiculability of blood cells during the isolation process. J. Nanomedicine. 6, 2737–2748.
Хаспекова С.Г., Антонова О.А., Шустова О.Н., Якушкин В.В., Голубева Н.В., Титаева Е.В., Добровольский А.Б., Мазуров А.В. 2016. Активность тканевого фактора в микрочастицах продуцируемых in vitro эндотелиальными клетками, моноцитами, гранулоцитами и тромбоцитами. Биохимия. 81, 206–214.
Stagnara J., Garnache Ottou F., Angelot F., Mourey G., Seilles E., Biichlé S., Saas P., Racadot E. 2012. Correlation between platelet-derived microparticle enumeration by flow cytometry and phospholipid-dependent procoagulant activity in microparticles: The centrifugation step matters! Thromb Haemost. 107, 1185–1187.
Marchetti M., Tartari C.J., Russo L., Panova-Noeva M., Leuzzi A., Rambaldi A., Finazzi G., Woodhams B., Falanga A. 2014. Phospholipid-dependent procoagulant activity is highly expressed by circulating microparticles in patients with essential thrombocythemia. Am. J. Hematol. 89, 68–73.
Van Der Meijden P.E., Van Schilfgaarde M., Van Oerle R., Renné T., ten Cate H., Spronk H.M. 2012. Platelet- and erythrocyte-derived microparticles trigger thrombin generation via factor XIIa. J. Thromb. Haemost. 10, 1355–1362.
Rubin O., Delobel J., Prudent M., Lion N., Kohl K., Tucker E.I., Tissot J.-D., Angelillo-Scherrer A. 2013. Red blood cell-derived microparticles isolated from blood units initiate and propagate thrombin generation. Transfusion. 53, 1744–1754.
Dashkevich N.M., Vuimo T.A., Ovsepyan R.A., Surov S.S., Soshitova N.P., Panteleev M.A., Ataullakhanov F.I., Negrier C. 2014. Effect of pre-analytical conditions on the thrombodynamics assay. Thromb Res. 133, 472–476.
Lipets E., Vlasova O., Urnova E., Margolin O., Soloveva A., Ostapushchenko O., Andersen J., Ataullakhanov F., Panteleev M. 2014. Circulating contact-pathway-activating microparticles together with factors IXa and XIa induce spontaneous clotting in plasma of hematology and cardiologic patients. PLoS One. 9 (1), e87692. https://doi.org/10.1371/journal.pone.0087692
Key N.S. 2010. Analysis of tissue factor positive microparticles. Thromb Res. 125, S42–S45.
Owens A.P. 3rd, Mackman N. Microparticles in hemostasis and thrombosis. 2011. Circ. Res. 108, 1284–1297.
Aatonen M.T., Ohman T., Nyman T.A., Laitinen S., Gronholm M., Siljander P.R.-M. 2014. Isolation and characterization of platelet-derived extracellular vesicles. J. Extracell. Vesicles. 3, 24 692 https://doi.org/10.3402/jev.v3.24692
Miyazaki Y., Nomura S., Miyake T., Kagawa H., Kitada C., Taniguchi H., Komiyama Y., Fujimura Y., Ikeda Y., Fukuhara S. 1996. High shear stress can initiate both platelet aggregation and shedding of procoagulant containing microparticles. Blood. 88, 3456–3464.
Chow T.W., Hellums J.D., Thiagarajan P. 2000. Thrombin receptor activating peptide (SFLLRN) potentiates shear-induced platelet microvesiculation. J. Lab. Clin. Med. 135, 66–72.
Bode A.P., Orton S.M., Frye M.J., Udis B.J. 1991. Vesiculation of platelets during in vitro aging. Blood. 77, 887–895.
Nollet K.E., Saito S., Ono T., Ngoma A., Ohto H. 2013. Microparticle formation in apheresis platelets is not affected by three leukoreduction filters. Transfusion. 53, 2293–2298.
Flaumenhaft R., Dilks J.R., Richardson J., Alden E., Patel-Hett S.R., Battinelli E., Klement G.L, Sola-Visner M., Italiano J.E. Jr. 2009. Megakaryocyte-derived microparticles: Direct visualization and distinction from platelet-derived microparticles. Blood. 113, 1112–1121.
Italiano J.E. Jr., Mairuhu A.T.A., Flaumenhaft R. 2010. Clinical relevance of microparticles from platelets and megakaryocytes. Curr. Opin. Hematol. 17, 578–584.
Van der Zee P.M., Biro E., Ko Y., de Winter R.J., Hack C.E., Sturk A., Nieuwland R. 2006. P-selectin- and CD63-exposing platelet microparticles reflect platelet activation in peripheral arterial disease and myocardial infarction. Clin. Chem. 52, 657–664.
Skeppholm M., Mobarrez F., Malmqvist K., Wallén H. 2012. Platelet-derived microparticles during and after acute coronary syndrome. Thromb. Haemost. 107, 1122–1129.
Osterud B., Bjorklid E. Tissue factor in blood cells and endothelial cells. 2012. Front. Biosci. (Elite Ed). 4, 289–299.
Sinauridze E.I., Kireev D.A., Popenko N.Y., Pichugin A.V., Panteleev M.A., Krymskaya O.V., Ataullakhanov F.I. 2007. Platelet microparticle membranes have 50- to 100-fold higher specific procoagulant activity than activated platelets. Thromb. Haemost. 97, 425–434.
Trappenburg M.C., van Schilfgaarde M., Marchetti M., Spronk H.M., ten Cate H., Leyte A., Terpstra W.E., Falanga A. 2009. Elevated procoagulant microparticles expressing endothelial and platelet markers in essential thrombocythemia. Haematologica. 94, 911–918.
Tan X., Shi J., Fu Y., Gao C., Yang X., Li J., Wang W., Hou J., Li H., Zhou J. 2013. Role of erythrocytes and platelets in the hypercoagulable status in polycythemia vera through phosphatidylserine exposure and microparticle generation. Thromb. Haemost. 109, 1025–1032.
Kafian S., Mobarrez F., Wallén H., Samad B. 2015. Association between platelet reactivity and circulating platelet-derived microvesicles in patients with acute coronary syndrome. Platelets. 26, 467–473.
Namba M., Tanaka A., Shimada K., Ozeki Y., Uehata S., Sakamoto T., Nishida Y., Nomura S., Yoshikawa J. 2007. Circulating platelet-derived microparticles are associated with atherothrombotic events: A marker for vulnerable blood. Arterioscler. Thromb. Vasc. Biol. 27, 255–256.
Tan K.T., Tayebjee M.H., Lynd C., Blann A.D., Lip G.Y. 2005. Platelet microparticles and soluble P selectin in peripheral artery disease: Relationship to extent of disease and platelet activation markers. Ann. Med. 37, 61–66.
Pereira J., Alfaro G., Goycoolea M., Quiroga T., Ocqueteau M., Massardo L., Pérez C., Sáez C., Panes O., Matus V., Mezzano D. 2006. Circulating platelet-derived microparticles in systemic lupus erythematosus. Association with increased thrombin generation and procoagulant state. Thromb. Haemost. 95, 94–99.
Sellam J., Proulle V., Jüngel A., Ittah M., Miceli Richard C., Gottenberg J.E., Toti F., Benessiano J., Gay S., Freyssinet J.M., Mariette X. 2009. Increased levels of circulating microparticles in primary Sjögren’s syndrome, systemic lupus erythematosus and rheumatoid arthritis and relation with disease activity. Arthritis Res. Ther. 11, R156. https://doi.org/10.1186/ar2833
Inoue T., Komoda H., Kotooka N., Morooka T., Fujimatsu D., Hikichi Y., Soma R., Uchida T., Node K. 2008. Increased circulating platelet-derived microparticles are associated with stent-induced vascular inflammation. Atherosclerosis. 196, 469–476
Vajen T., Mause S.F., Koenen R.R. 2015. Microvesicles from platelets: Novel drivers of vascular inflammation. Thromb. Haemost. 114, 228–236.
Varon D., Shai E. 2015. Platelets and their microparticles as key players in pathophysiological responses. J. Thromb. Haemost. 13 (Suppl. 1), S40–S46.
Кубатиев А.А., Боровая Т.Г., Жуховицкий В.Г., Андреевская С.Г., Шевлягина В.Г. 2017. Микрочастицы тромбоцитов: образование и свойства. Патогенез. 15 (2), 4–13.
Angelillo-Scherrer A. 2012. Leukocyte-derived microparticles in vascular homeostasis. Circ. Res. 110, 356–369.
Kanazawa S., Nomura S., Kuwana M., Muramatsu M., Yamaguchi K., Fukuhara S. 2003. Monocyte-derived microparticles may be a sign of vascular complication in patients with lung cancer. Lung Cancer. 39, 145–149.
Shet A.S., Aras O., Gupta K., Hass M.J., Rausch D.J., Saba N., Koopmeiners L., Key N.S., Hebbel R.P. 2003. Sickle blood contains tissue factor-positive microparticles derived from endothelial cells and monocytes. Blood. 102, 2678–2683.
Ogata N., Nomura S., Shouzu A., Imaizumi M., Arichi M., Matsumura M. 2006. Elevation of monocyte-derived microparticles in patients with diabetic retinopathy. Diabetes Res. Clin. Pract. 73, 241–248.
Bernimoulin M., Waters E.K., Foy M., Steele B.M., Sullivan M., Falet H., Walsh M.T., Barteneva N., Geng J.-G., Hartwig J.H., Maguire P.B., Wagner D.D. 2009. Differential stimulation of monocytic cells results in distinct populations of microparticles. J. Thromb. Haemost. 7, 1019–1028.
Falati S., Liu Q., Gross P., Merrill-Skoloff G., Chou J., Vandendries E., Celi A., Croce K., Furie B.C., Furi B. 2003. Accumulation of tissue factor into developing thrombi in vivo is dependent upon microparticle P-selectin glycoprotein ligand 1 and platelet P-selectin. J. Exp. Med. 197, 1585–1598.
Gross P.L., Furie B.C., Merrill-Skoloff G., Chou J., Furie B. 2005. Leukocyte-versus microparticle-mediated tissue factor transfer during arteriolar thrombus development. J. Leukoc. Biol. 78, 1318–1326.
Zwicker J.I., Trenor C.C. 3rd, Furie B.C., Furie B. 2011. Tissue factor–bearing microparticles and thrombus formation. Arterioscler. Thromb. Vasc. Biol. 31, 728–733
Rauch U., Bonderman D., Bohrmann B., Badimon J.J., Himber J., Riederer M.A., Nemerson Y. 2000. Transfer of tissue factor from leukocytes to platelets is mediated by CD15 and tissue factor. Blood. 96, 170–175
Del Conde I., Shrimpton C.N., Thiagarajan P., Lopez J.A. 2005. Tissue-factor–bearing microvesicles arise from lipid rafts and fuse with activated platelets to initiate coagulation. Blood. 106, 1604–1611.
Габбасов З.А., Сабурова О.С., Антонова О.А., Голубева Н.В., Хаспекова С.Г., Шустова О.Н., Зюряев И.Т., Руда М.Я., Мазуров А.В. 2016. Субпопуляция тромбоцитов, несущих специфический лейкоцитарный антиген и тканевой фактор. Доклады Академии наук. 471 (5), 599–603.
Egorina E.M., Sovershaev M.A., Olsen J.O., Østerud B. 2008. Granulocytes do not express but acquire monocyte-derived tissue factor in whole blood: Evidence for a direct transfer. Blood. 111, 1208–1216.
Nieuwland R., Berckmans R.J., McGregor S., Boing A.N., Romijn F.P., Westendorp R.G., Hack C.E., Sturk A. 2000. Cellular origin and procoagulant properties of microparticles in meningococcal sepsis. Blood. 95, 930–935.
Montoro-García S., Shantsila E., Tapp L.D., López-Cuenca A., Romero A.I., Hernández-Romero D., Orenes-Piñero E., Manzano-Fernández S., Valdés M., Marín F., Lip G.Y. 2013. Small-size circulating microparticles in acute coronary syndromes: Relevance to fibrinolytic status, reparative markers and outcomes. Atherosclerosis. 227, 313–322.
Suades R., Padró T., Crespo J., Ramaiola I., Martin-Yuste V., Sabaté M., Sans-Roselló J., Sionis A., Badimon L. 2016. Circulating microparticle signature in coronary and peripheral blood of ST elevation myocardial infarction patients in relation to pain-to-PCI elapsed time. Inter. J. Cardiol. 202, 378–387.
Omoto S., Nomura S., Shouzu A., Nishikawa M., Fukuhara S., Iwasaka T. 2002. Detection of monocyte-derived microparticles in patients with type II diabetes mellitus. Diabetologia. 45, 550–555.
Aras O., Shet A., Bach R.R., Hysjulien J.L., Slungaard A., Hebbel R.P., Escolar G., Jilma B., Key N.S. 2004. Induction of microparticle- and cell associated intravascular tissue factor in human endotoxemia. Blood. 103, 4545– 4553.
Chiva-Blanch G., Bratseth V., Ritschel V., Andersen G.Ø., Halvorsen S., Eritsland J., Arnesen H., Badimon L., Seljeflot I. 2017. Monocyte-derived circulating microparticles (CD14+, CD14+/CD11b+ and CD14+/CD142+) are related to long-term prognosis for cardiovascular mortality in STEMI patients. Int. J. Cardiol. 227, 876–881.
Johnson B.L. 3rd, Kuethe J.W., Caldwel C.C. 2014. Neutrophil derived microvesicles: Emerging role of a key mediator to the immune response. Endocr. Metab. Immune Disord. Drug Targets. 14, 210–217.
Scanu A., Molnarfi N., Brandt K.J., Gruaz L., Dayer J.-M., Burge D. 2008. Stimulated T cells generate microparticles, which mimic cellular contact activation of human monocytes: Differential regulation of pro- and anti-inflammatory cytokine production by high-density lipoproteins. J. Leukoc. Biol. 83, 921–927.
Maugeri N., Brambilla M., Camera M., Carbone A., Tremoli E., Donati M.B., de Gaetano G., Cerletti C. 2006. Human polymorphonuclear leukocytes produce and express functional tissue factor upon stimulation. J. Thromb. Haemost. 4, 1323–1330.
Ritis K., Doumas M., Mastellos D., Micheli A., Giaglis S., Magotti P., Rafail S., Kartalis G., Sideras P., Lambris J.D. 2006. A novel C5a receptor-tissue factor cross-talk in neutrophils links innate immunity to coagulation pathways. J. Immunol. 177, 4794–4802.
Kambas K., Chrysanthopoulou A., Vassilopoulos D., Apostolidou E., Skendros P., Girod A., Arelaki S., Froudarakis M., Nakopoulou L., Giatromanolaki A., Sidiropoulos P., Koffa M., Boumpas D.T., Ritis K., Mitroulis I. 2014. Tissue factor expression in neutrophil extracellular traps and neutrophil derived microparticles in antineutrophil cytoplasmic antibody associated vasculitis may promote thromboinflammation and the thrombophilic state associated with the disease. Ann. Rheum. Dis. 73, 1854–1863.
Pluskota E., Woody N.M., Szpak D., Ballantyne C.M., Soloviev D.A., Simon D.I., Plow E.F. 2008. Expression, activation, and function of integrin αMβ2 (Mac-1) on neutrophil-derived microparticles. Blood. 112, 2327–2335.
Sarlon-Bartoli G., Bennis Y., Lacroix R., Piercecchi-Marti M.D., Bartoli M.A., Arnaud L., Mancini J., Boudes A., Sarlon E., Thevenin B., Leroyer A.S., Squarcioni C., Magnan P.E., Dignat-George F., Sabatier F. 2013. Plasmatic level of leukocyte-derived microparticles is associated with unstable plaque in asymptomatic patients with high-grade carotid stenosis. J. Am. Coll. Cardiol. 62, 1436–1441.
Faille D., Frere C., Cuisset T., Quilici J., Moro P.J., Morange P.E., Bonnet J.L., Alessi M.C. 2011. CD11b+ leukocyte microparticles are associated with high-risk angiographic lesions and recurrent cardiovascular events in acute coronary syndromes. J. Thromb. Haemost. 9, 1870–1873.
Chiva-Blanch G., Suades R., Crespo J., Vilahur G., Arderiu G., Padró T., Corella D., Salas-Salvadó J., Arós F., Martínez-González M.A., Ros E., Fitó M., Estruch R., Badimon L. 2016. CD3+/CD45+ and SMA-α+ circulating microparticles are increased in individuals at high cardiovascular risk who will develop a major cardiovascular event. Int. J. Cardiol. 208, 147–149.
Said A.S., Rogers S.C., Doctor A. 2018. Physiologic impact of circulating RBC microparticles upon blood-vascular interactions. Front. Physiol. 8, 1120. doi https://doi.org/10.3389/fphys.2017.01120
Fischer D., Büssow J., Meybohm P., Weber C.F., Zacharowski K., Urbschat A., Müller M.M., Jennewein C. 2017. Microparticles from stored red blood cells enhance procoagulant and proinflammatory activity. Transfusion. 57, 2701–2711.
Van Beers E.J., Schaap M.C.L, Berckmans R.J., Nieuwland R., Sturk A., van Doormaal F.F., Meijers J.C.M., Biemond B.J. on behalf of the CURAMA study group. 2009. Circulating erythrocyte derived microparticles are associated with coagulation activation in sickle cell disease. Haematologica. 94, 1513–1519.
Giannopoulos G., Oudatzis G., Paterakis G., Synetos A., Tampaki E., Bouras G., Hahalis G., Alexopoulos D., Tousoulis D., Cleman M.W., Stefanadis C., Deftereos S. 2014. Red blood cell and platelet microparticles in myocardial infarction patients treated with primary angioplasty. Int. J. Cardiol. 176, 145–150.
Suades R., Padró T., Vilahur G., Martin-Yuste V., Sabaté M., Sans-Roselló J., Sionis A., Badimon L. 2015. Growing thrombi release increased levels of CD235a+ microparticles and decreased levels of activated platelet derived microparticles. Validation in ST-elevation myocardial infarction patient. J. Thromb. Haemost. 13, 1776–1786.
Giannopoulos G., Vrachatis D.A., Oudatzis G., Paterakis G., Angelidis C., Koutivas A., Sianos G., Cleman M.W., Filippatos G., Lekakis J., Deftereos S. 2017. Circulating erythrocyte microparticles and the biochemical extent of myocardial injury in ST elevation myocardial Infarction. Cardiology. 136, 15–20.
Curtis A.M., Edelberg J., Jonas R., Rogers W.T., Moore J.S., Syed W., Mohler E.R. 3rd. 2013. Endothelial microparticles: Sophisticated vesicles modulating vascular function. Vasc. Med. 18, 204–214.
Kagawa H., Komiyama Y., Nakamura S., Miyake T., Miyazaki Y., Hamamoto K., Masuda M., Takahashi H., Nomura S., Fukuhara S. 1998. Expression of functional tissue factor on small vesicles of lipopolysaccharide-stimulated human vascular endothelial cells. Thromb. Res. 91, 297–304.
Combes V., Simon A.-C., Grau G.-E., Arnoux D., Camoin L., Sabatier F., Mutin M., Sanmarco M., Sampol J., Dignat-George F. 1999. In vitro generation of endothelial microparticles and possible prothrombotic activity in patients with lupus anticoagulant. J. Clin. Invest. 104, 93–102.
Kushak R.I., Nestoridi E., Lambert J., Selig M.K., Ingelfinger J.R., Grabowski E.F. 2005. Detached endothelial cells and microparticles as sources of tissue factor activity. Thromb. Res. 116, 409–419.
Abid Hussein M.N., Böing A.N., Biró E., Hoek F.J., Vogel G.M., Meuleman D.G., Sturk A. 2008. Phospholipid composition of in vitro endothelial microparticles and their in vivo thrombogenic properties. Thromb Res. 121, 865–871.
Pawlinski R., Wang J.-G., Owens A.P. 3rd., Williams J., Antoniak S., Tencati M., Luther T., Rowley J.W., Low E.N., Weyrich A.S., Mackman N. 2010. Hematopoietic and nonhematopoietic cell tissue factor activates the coagulation cascade in endotoxemic mice. Blood. 116, 806–814.
Jimenez J.J., Jy W., Mauro L.M., Horstman L.L., Soderland C., Ahn Y.S. 2003. Endothelial microparticles released in thrombotic thrombocytopenic purpura express von Willebrand factor and markers of endothelial activation. Br. J. Haematol. 123, 896–902.
Soriano A.O., Jy W, Chirinos J.A., Valdivia M.A., Velasquez H.S., Jimenez J.J., Horstman L.L., Kett D.H., Schein R.M., Ahn Y.S. 2005. Levels of endothelial and platelet microparticles and their interactions with leukocytes negatively correlate with organ dysfunction and predict mortality in severe sepsis. Crit. Care Med. 33, 2540–2546.
Delabranche X., Boisramé-Helms J., Asfar P., Berger A., Mootien Y., Lavigne T., Grunebaum L., Lanza F., Gachet C., Freyssinet J.M., Toti F., Meziani F. 2013. Microparticles are new biomarkers of septic shock-induced disseminated intravascular coagulopathy. Intensive Care Med. 39, 1695–1703.
Bernal-Mizrachi L., Jy W., Jimenez J.J., Pastor J., Mauro L.M., Horstman L.L., de Marchena E., Ahn Y.S. 2003. High levels of circulating endothelial microparticles in patients with acute coronary syndromes. Am. Heart J. 145, 962–970.
Bernal-Mizrachi L., Jy W., Fierro C., Macdonough R., Velazques H.A., Purow J., Jimenez J.J., Horstman L.L., Ferreira A., de Marchena E., Ahn Y.S. 2004. Endothelial microparticles correlate with high-risk angiographic lesions in acute coronary syndromes. Int. J. Cardiol. 97, 439–446.
Chirinos J.A., Heresi G.A., Velasquez H., Jy W., Jimenez J.J., Ahn E., Horstman L.L., Soriano A.O., Zambrano J.P., Ahn Y.S. 2005. Elevation of endothelial microparticles, platelets, and leukocyte activation in patients with venous thromboembolism. J. Am. Coll. Cardiol. 45, 1467–1471.
Nozaki T., Sugiyama S., Koga H., Sugamura K., Ohba K., Matsuzawa Y., Sumida H., Matsui K, Jinnouchi H., Ogawa H. 2009. Significance of a multiple biomarkers strategy including endothelial dysfunction to improve risk stratification for cardiovascular events in patients at high risk for coronary heart disease. J. Am. Coll. Cardiol. 54, 601–608
Bajaj M.S., Ghosh M., Bajaj S.P. 2007. Fibronectin-adherent monocytes express tissue factor and tissue factor pathway inhibitor whereas endotoxin-stimulated monocytes primarily express tissue factor: Physiologic and pathologic implications. J. Thromb. Haemost. 5, 1493–1499.
Steppich B., Mattisek C., Sobczyk D., Kastrati A., Schömig A., Ott I. 2005. Tissue factor pathway inhibitor on circulating microparticles in acute myocardial infarction. Thromb. Haemost. 93, 35–39.
Tsimerman G., Roguin A., Bachar A., Melamed E., Brenner B., Aharon A. 2011 Involvement of microparticles in diabetic vascular complications. Thromb. Haemost. 106, 310–321.
Maroney S.A., Haberichter S.L., Friese P., Collins M.L., Ferrel J.P., Dale G.L., Mast A.E. 2007 Active tissue factor pathway inhibitor is expressed on the surface of coated platelets. Blood. 109, 1931–1937
Somajo S., Koshiar R.L., Norström E., Dahlbäck B. 2014. Protein S and factor V in regulation of coagulation on platelet microparticles by activated protein C. Thromb. Res. 134, 144–152.
Koshiar R.L., Somajo S., Norström E., Dahlbäck B. 2014. Erythrocyte-derived microparticles supporting activated protein C-mediated regulation of blood coagulation. PLoS One. 9 (8), e104200. https://doi.org/10.1371/ journal.pone.0104200
Perez-Casal M., Downey C., Fukudome K., Marx G., Toh C.H. 2005. Activated protein C induces the release of microparticle-associated endothelial protein C receptor. Blood. 105, 1515–1522.
Lacroix R., Sabatier F., Mialhe A., Basire A., Pannell R., Borghi H., Robert S., Lamy E., Plawinski L., Camoin-Jau L., Gurewich V., Angles-Cano E., Dignat-George F. 2007. Activation of plasminogen into plasmin at the surface of endothelial microparticles: A mechanism that modulates angiogenic properties of endothelial progenitor cells in vitro. Blood. 110, 2432–2439.
Lacroix R., Plawinski L., Robert S., Doeuvre L., Sabatier F., Martinez de Lizarrondo S., Mezzapesa A., Anfosso F., Leroyer A.S., Poullin P., Jourde N., Njock M.S., Boulanger C.M., Anglés-Cano E., Dignat-George F. 2012. Leukocyte- and endothelial-derived microparticles: A circulating source for fibrinolysis. Haematologica. 97, 1864–1872.
Gaetani E., Del Zompo F., Marcantoni M., Gatto I., Giarretta I., Porfidia A., Scaldaferri F., Laterza L., Lopetuso L., Gasbarrini A., Pola R 2018. Microparticles produced by activated platelets carry a potent and functionally active angiogenic signal in subjects with Crohn’s disease. Int. J. Mol. Sci. 19 (10). pii: E2921. https://doi.org/10.3390/ijms19102921
Дополнительные материалы отсутствуют.
Инструменты
Биологические мембраны: Журнал мембранной и клеточной биологии


