Биологические мембраны: Журнал мембранной и клеточной биологии, 2019, T. 36, № 3, стр. 192-206
Способы повышения активности глутаматдегидрогеназы в эритроцитах-биореакторах для удаления аммония
Д. В. Борсакова a, b, Е. С. Протасов a, b, c, С. В. Назаренко c, Ю. Г. Александрович a, b, А. А. Бутылин a, c, Ф. И. Атауллаханов a, b, c, d, Е. И. Синауридзе a, b, *
a Национальный медицинский исследовательский центр детской гематологии, онкологии и иммунологии
им. Дмитрия Рогачева, Министерство здравоохранения
117198 Москва, ул. Саморы Машела, 1, Россия
b Центр теоретических проблем физико-химической фармакологии РАН
119991 Москва, ул. Косыгина, 4, Россия
c Московский государственный университет им. М.В. Ломоносова, физический факультет
119991 Москва, Ленинские горы, 1, стр. 2, Россия
d Московский физико-технический институт (национальный исследовательский университет)
141700 Московская обл., г. Долгопрудный, Институтский пер., 9, Россия
* E-mail: sinaurid@list.ru
Поступила в редакцию 16.01.2019
После доработки 01.02.2019
Принята к публикации 05.02.2019
Аннотация
Повышение концентрации аммония в крови (гипераммониемия) токсично для центральной нервной системы, поэтому удаление его из кровотока является актуальной задачей. Одним из подходов для ее решения может быть использование эритроцитов-биореакторов (ЭБР) с загруженными внутрь ферментами, перерабатывающими аммоний. Ранее предпринимались попытки создать такие ЭБР путем загрузки в эритроциты глутаматдегидрогеназы (ГДГ) или глутаминсинтетазы, однако полученные ЭБР были недостаточно эффективны. Причины этого, с одной стороны, низкая проницаемость мембраны эритроцита для субстратов этих реакций (α-кетоглутарата и глутаминовой кислоты), а с другой – низкая активность включенного фермента (в биореакторах с ГДГ) из-за его высокой молекулярной массы и склонности к агрегации при концентрации в растворе выше 0.1 мг/мл. Ранее мы показали, что проблему низкой проницаемости мембраны эритроцита для α-кетоглутарата и глутаминовой кислоты можно устранить, если включить в эритроциты тандем из ГДГ и аланинаминотрансферазы, так как в таком ЭБР эти метаболиты расходуются и вновь производятся внутри эритроцита в циклическом процессе. Однако проблема низкой активности ГДГ, включенной в биореактор, сохраняется и в случае тандема ферментов, где ГДГ является основным перерабатывающим аммоний ферментом. Настоящая работа посвящена решению этой проблемы. Чтобы улучшить эффективность включения ГДГ в эритроциты и качество получаемых ЭБР (их эритроцитарные индексы и осмотическую резистентность), было проведено сравнение этих параметров для различных гипоосмотических методов загрузки ГДГ в клетки. Кроме того, проведено сравнение применяемой ранее ГДГ из печени быка и ГДГ из Proteus sp. Показано, что метод проточного диализа является самым эффективным и позволяет включить в 3 раза больше ГДГ, чем метод гипоосмотического диализа. При этом свойства эритроцитов после воздействия данного метода изменяются незначительно. Показано также, что ГДГ из Proteus sр. не подвергается агрегации при повышении ее концентрации, что позволяет примерно в 18 раз увеличить удельную активность фермента в эритроцитах, которая для Proteus sр. пропорциональна его исходной активности в суспензии при загрузке. Это делает данную ГДГ перспективной для создания эффективных ЭБР, удаляющих аммоний.
ВВЕДЕНИЕ
Исследования эритроцитов, в которые были включены различные ферменты, показали перспективность такой лекарственной формы для возможного применения в терапии различных патологических состояний. Эту лекарственную форму исследовали при болезни Гоше [1], диабете [2], остром лимфобластном лейкозе [3], гипераммониемии [4] и т.д. Настоящая работа посвящена поискам возможностей увеличения активности включенной в эритроциты глутаматдегидрогеназы. Это необходимо для создания наиболее эффективных эритроцитов-биореакторов (ЭБР), содержащих ферменты, утилизирующие аммоний, для удаления избытка аммония из крови пациента при состоянии гипераммониемии (ГА). Это состояние характеризуется повышенной концентрацией аммония в крови и может наблюдаться при различных заболеваниях печени (рак, цирроз, вирусные заболевания), при развитии патогенной флоры в кишечнике или при врожденной недостаточности ферментов цикла мочевины [5]. Аммоний токсичен для центральной нервной системы, поэтому его необходимо быстро удалять, однако существующие медикаментозные методы лечения ГА недостаточно эффективны [6–11]. Создание ЭБР, перерабатывающих аммоний, может оказаться перспективным путем решения этой задачи. Ранее в литературе уже были описаны эксперименты по включению в эритроциты ферментов, работающих с аммиаком: глутаминсинтетазы [12, 13] и глутаматдегидрогеназы (ГДГ) [4, 14, 15]. Полученные эритроциты-носители хотя и были способны удалять аммоний из крови, однако работали эффективно в течение только короткого промежутка времени (0.5–1 ч). Теоретический анализ показал, что причина этого кроется в низкой проницаемости мембраны эритроцитов для субстратов и продуктов этих реакций (α-кетоглутарата и глутамата) [11]. Было показано, что увеличить эффективность работы утилизирующих аммоний ЭБР можно, если включить в эритроциты систему из двух ферментов – ГДГ и аланинаминотрансферазы (ААТ). При этом снимаются ограничения для транспорта вышеупомянутых метаболитов, так как они расходуются и вновь синтезируются внутри эритроцита циклически. Полученные методом гипоосмотичесого диализа биореакторы удаляли аммоний in vitro со скоростью 1.5 ммоль/ч × лЭБР и in vivo со скоростью 0.24 ммоль/ч × л крови мыши (или 2 ммоль/ч × лЭБР). Теоретически максимальная скорость утилизации аммония этими ЭБР ограничивается притоком пирувата в клетку и может достигать 4.5–6 ммоль/ч × лЭБР [11].
Однако низкая эффективность работы ранее полученных ЭБР с ГДГ была связана не только с неоптимальным выбором ферментной системы, но также с низким уровнем активности ГДГ, которая была включена в эритроциты. Это определялось, с одной стороны, методом, который был использован для загрузки фермента в клетки, а с другой – свойствами самого фермента. Наиболее эффективными и щадящими методами включения ферментов в эритроциты в настоящее время считаются методы обратимого гипоосмотического воздействия, основанные на способности эритроцита обратимо образовывать поры в мембране под действием сниженной осмоляльности среды [16–18].
При помещении эритроцита в гипоосмотическую среду происходит постепенное увеличение объема клетки, так как вода из внешней среды начинает поступать внутрь, чтобы скомпенсировать разность осмотического давления внутри и снаружи мембраны, возникающую из-за того, что внутри клетки присутствует в высокой концентрации (~5 мМ) белок гемоглобин. Форма эритроцита постепенно становится сферической, а при дальнейшем увеличении объема клетки (более чем в 1.8–2 раза) в ее мембране начинают возникать поры. Размер этих пор, который был исследован экспериментально, сильно различался в разных работах и составлял от 8–10 нм [19–21], до 20–50 нм [22]. В литературе имеются данные о том, что разрывные дефекты мембраны могут существовать в условиях осмотического стресса в течение 3–5 мин при сохранении жизнеспособности клетки [23]. Необходимо отметить, что в реальных условиях при увеличении объема эритроцита в гипоосмотической среде размер пор может увеличиваться до тех пор, пока он не станет достаточным для того, чтобы через пору прошла молекула гемоглобина. Выход этого белка из клетки постепенно приводит к уравновешиванию осмотического давления по обе стороны клеточной мембраны, после чего поры в мембране закрываются. Молекула гемоглобина (64 кДа) имеет примерно глобулярную форму и эффективный диаметр 5 нм (50 Å) [24]. Таким образом, для того, чтобы он мог свободно выходить из эритроцита, вполне достаточно пор размером 8–10 нм [22]. По сравнению с гемоглобином молекула ГДГ имеет гораздо большую молекулярную массу (332 кДа) и несколько вытянутую форму. Это эллипсоид с длиной 13.3 нм и диаметром 4.3 нм [25]. Очевидно, что такая молекула хотя и будет способна проходить через поры диаметром до 10 нм, но не при всяком положении молекулы относительно мембраны. Это ограничивает эффективность инкапсуляции данного фермента.
В ранее опубликованных работах в эритроциты загружали ГДГ из печени быка, а для включения ее в клетки был использован метод обратимого гипоосмотического диализа в диализных мешках. В этих условиях удавалось включить в клетки только до 1.9–3.8% от всего присутствующего в системе фермента [4, 15]. Такая низкая доля включения препарата обусловлена, в первую очередь, его большой молекулярной массой (ГДГ – один из самых больших белков, который включали в эритроциты) [16, 26]. Кроме того, коммерческий препарата ГДГ из печени быка имеет малую удельную активность (примерно 40 МЕ/мг белка), а сам фермент способен обратимо агрегировать при уменьшении ионной силы раствора или увеличении концентрации ферментного белка в суспензии (в области от 0.1 до 4 мг/мл) [14, 27–29]. Известно, что при этом специфическая активность фермента не зависит от степени агрегации [28, 29], но увеличение размеров агрегатов молекул фермента препятствует их входу в эритроциты через поры, возникающие в мембране клетки в условиях гипоосмотического стресса [14]. В случае ААТ, которая имеет меньшую молекулярную массу (115–125 кДа) [30] и не агрегирует при увеличении концентрации фермента в системе, подобная проблема отсутствует. Таким образом, чтобы обеспечить возможность реального использования ЭБР для удаления аммония из крови пациентов, необходимо не только включить в клетки оптимальную ферментативную систему (ГДГ и ААТ), но также повысить активность включенной в эритроциты ГДГ. Чтобы решить эту задачу, в настоящей работе был проведен поиск по двум направлениям: 1) выбор наиболее эффективного варианта гипоосмотического метода для включения фермента; 2) попытка увеличить активность фермента внутри ЭБР за счет использования ГДГ из другого источника (Proteus sp.). Эта ГДГ имеет исходно более высокую удельную активность (примерно 400 МЕ/мг белка) и, предположительно, не склонна к агрегации [26, 31].
Для решения первой части задачи метод гипоосмотического диализа в мешках [4, 14, 15], с помощью которого были получены предыдущие биореакторы, мы сравнили с другими осмотическими методами: обратимым гипоосмотическим лизисом [32, 33] и проточным диализом [3, 34, 35]. Для всех методов была исследована эффективность включения ГДГ в эритроциты, а также степень воздействия метода на клетки.
При выборе препарата для замены ГДГ из печени быка было учтено, что перспективными ГДГ для биореакторов, удаляющих аммоний, являются либо NADPH-зависимые, либо работающие одновременно с NADH и NADPH (универсальные) глутаматдегидрогеназы [11]. Предпочтение должно быть отдано тем ферментам, которые имеют более низкие константы связывания с субстратами, более низкую молекулярную массу, большую удельную активность на 1 мг белка, а также не имеют склонности к агрегации. У многих глутаматдегидрогеназ из разных источников эти параметры лучше, чем у ГДГ из печени быка [36]. В основном это ферменты бактериального происхождения. Кроме того, имеются литературные данные о том, что бактериальные ГДГ не склонны к агрегации [26, 31], что также может оказаться очень важным их преимуществом. ГДГ из Proteus sp. появилась недавно как коммерчески доступный препарат. По данным производителя (Sigma-Aldrich,USА), этот фермент обладает чуть меньшей молекулярной массой (около 300 кДа), имеет более низкие величины констант Михаэлиса (КМ) по отношению к аммонию, α-кетоглутарату и NADPH (1.1, 0.34 и 0.014 мМ против 3.2, 0.7 и 0.025 мМ для ГДГ из Proteus sp. и печени быка, соответственно), а также почти в 10 раз более высокую удельную активность (>400 МЕ/мг белка), чем ГДГ из печени быка. Таким образом, задачей нашей работы было исследовать перспективность этого препарата для возможного повышения активности ГДГ, включенной в эритроциты.
МАТЕРИАЛЫ И МЕТОДЫ
Материалы. В работе были использованы L‑глутаматдегидрогеназа (1.4.1.2) из печени быка, тип I (в суспензии 2 М сульфата аммония) или тип II (в 50% растворе глицерина) и L-глутаматдегидрогеназа из Proteus sp. (водный раствор) фирмы Sigma-Аldrich (USA). Глюкоза, аденин, инозин, аланин, К2НРО4, КН2РО4, MgCl2, Na2HPO4, NaH2PO4, NADH, NADPH, физиологический раствор, содержащий 10 мМ фосфатного буфера (PBS), α-кетоглутарат, меркаптоэтанол и бычий сывороточный альбумин также были приобретены в фирме Sigma-Aldrich (USA). В работе были использованы диализные мешки на основе целлюлозных полупроницаемых мембран с уровнем отсечения примерно 12–15 кДа (Dialysis Tubing Cellulose Membrane D9777-100 FT Sigma-Aldrich, USA).
Выделение и отмывка эритроцитов. Кровь здоровых доноров забирали путем пункции локтевой вены в стандартные вакуумные пробирки фирмы Vacuette, содержащие 3.2% (0.109 М) цитрат натрия. Соотношение цитрат : кровь составляло 1 : 9. Эритроциты осаждали путем центрифугирования при 1000 g в течение 8 мин (rср 8 см). Плазму и лейкотромбослой удаляли, а осевшие эритроциты отмывали 3 раза в четырехкратном объеме раствора PBS с последующим центрифугированием в течение 8 мин при 1000 g (rср 8 см).
Обратимый гипоосмотический лизис. ГДГ из печени быка (тип I, 50 МЕ/мг, 11 мг/мл, в 2 M сульфате аммония, рН 7.0) отделяли от сульфата аммония путем центрифугирования при 13 000 g в течение 10 мин (rср 4 см). Исходный объем фермента восстанавливали, добавляя буфер для ресуспендирования (5 мМ K2HPO4/KH2PO4, рН 7.4). Полученный фермент добавляли к суспензии эритроцитов с гематокритом 83 ± 2% (к 100 мкл суспензии добавляли 10.5 мкл раствора фермента). Чтобы провести процедуру включения фермента при трех различных осмоляльностях, к 110.5 мкл суспензии эритроцитов с ГДГ добавляли по 400 мкл гипоосмотического раствора, содержащего 5 мМ калий-фосфатного буфера (рН 7.4), 1.5 мМ АТP, 2 мМ MgCl2 и 5 мМ глюкозы, который имел суммарную осмоляльность 18 мОсм/кг. Растворы с большей осмоляльностью (50 и 75 мОсм/кг) получали путем добавления в исходный гипотонический раствор NaCl в соответствующих концентрациях. Конечная осмоляльность суспензий с гипоосмотическими растворами составляла 75, 100 и 120 мОсм/кг. Смесь инкубировали при 4°С в течение 3 мин. После этого добавляли запечатывающий раствор (1 М NaCl, 50 мM калий-фосфатного буфера, 5 мM ATP, 50 мМ глюкозы, 50 мМ пирувата натрия, 2170 мОсм/кг, рН 7.4) в объеме 50 мкл, чтобы конечная осмоляльность суспензии составляла около 350 мОсм/кг, и инкубировали суспензию 30 мин при 37°С. Полученные эритроциты-носители отмывали в растворе PBS 3 раза путем центрифугирования при 1000 g в течение 8 мин (rср 8 см). Осмоляльность растворов измеряли на осмометре ОСКР-1 М фирмы КИВИ Осмометрия (Санкт-Петербург, Россия).
Гипоосмотический диализ в мешках. К 630 мкл дистиллированной воды добавляли 20 мкл исходного фермента L-глутаматдегидрогеназы из печени быка (тип II, концентрация 21 мг/мл, удельная активность 42 МЕ/мг) в буфере, содержащем 50% глицерина, 50 мМ фосфата калия (рН 7.2), 1 мМ EDTA, 2 мМ меркаптоэтанола. Полученную смесь добавляли к 1 мл суспензии отмытых эритроцитов с гематокритом 70%.
Суспензию помещали в диализный мешок из целлюлозной мембраны, размером 16 × 25 мм и диализовали 1 ч при 4°С против гипотонического раствора (2 мМ натрий-фосфатного буфера (рН 7.4), 0.5 мМ КСl, 27 мМ NaCl), который имел суммарную осмоляльность 65–75 мОсм/кг. Растворы с большей осмоляльностью получали путем добавления в исходный гипотонический раствор NaCl в соответствующих концентрациях. Соотношение объемов суспензия : раствор составляло 1 к 100. По завершении диализа суспензию извлекали из диализного мешка и добавляли к ней запечатывающий раствор с осмоляльностью 1020 мОсм/кг, содержащий 30 мM Na2HPO4, 30 мM инозина, 1.5 мМ аденина, 8.4 мM глюкозы, 1.5 мM пирувата натрия, 3 мM MgCl2, 55 мM NaCl и 458 мM KCl (pH 7.4) в количестве 1/3 от объема диализированной суспензии, чтобы итоговая осмоляльность суспензии составляла 350-400 мОсм/кг. После этого суспензию инкубировали 30 мин при 37°С. Затем полученные эритроциты-носители отмывали в растворе PBS 3 раза путем центрифугирования при 1000 g в течение 8 мин (rср 8 см).
Гипоосмотический диализ в малых диализаторах. Принцип метода проточного гипоосмотического диализа состоит в том, что суспензию отмытых эритроцитов пропускают по внутреннему контуру диализного патрона (внутри его волокон), в то время как гипоосмотический раствор прокачивают в противоположном направлении по его внешнему контуру. С целью экономии материалов и реактивов, для исследования эффективности включения ГДГ в эритроциты методом проточного гипоосмотического диализа были сконструированы малые по объему диализаторы.
Технология сборки диализатора малого объема. Схема малого диализатора приведена на рис. 1а. Для сборки малого диализатора из стандартного диализного патрона Fresenius HF 80S вырезали пучок полупроницаемых диализных волокон Fresenius Polysulfon длиной 16 см (толщина волокна 30–35 мкм, диаметр пор 5–8 нм, диаметр волокна примерно 200 мкм). Волокна взвешивали для получения массы пучка 0.237–0.240 г, что соответствует примерно 450–455 волокнам. Для фиксации волокон на них насаживали четыре отрезка трубки из термоусадочного материала диаметром 7 мм. Два отрезка длиной 15 мм ближе к центру диализатора (внутренние) и два отрезка длиной 25 мм по краям (внешние). Внутренние фрагменты насаженных трубок сдвигали до расстояния между ними 7 см (рабочая длина диализатора) и нагревали техническим феном (Hazan HS 60S) до 125°С. На концевые участки пучка волокон наносили двухкомпонентный полиуретановый клей “Силагерм 6080” (приготовленный по инструкции) так, чтобы заполнить все пространство между волокнами. На промазанные клеем участки сдвигали внешние насаженные трубки таким образом, чтобы они перекрывали внутренние трубки на 10 мм, и прогревали их для термоусадки. Высыхание клея происходило за 12–24 ч. Края внешних трубок отрезали вместе с излишками отвердевшего клея. На концы диализатора плотно насаживали трубки с внутренним диаметром 4.5 мм, заканчивающиеся люеровским разъемом с наружным конусом. Объем собранного диализатора составлял 0.85–1 мл.
Рис. 1.
Схема устройства диализатора малого объема (а) и проверки этого диализатора на герметичность (б).
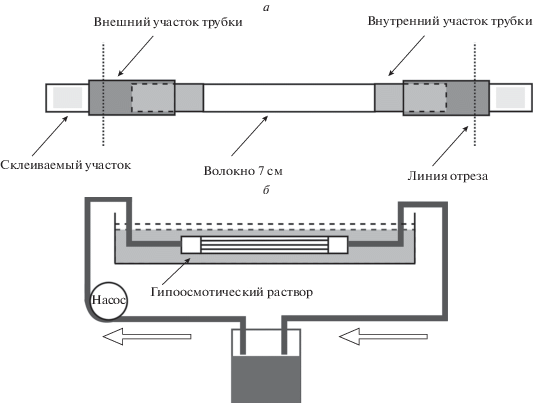
Проверка диализатора на герметичность. Для проверки готового диализатора на герметичность (рис. 1б) его помещали в кювету с раствором 0.9% NaCl и фиксировали таким образом, чтобы он находился в полностью погруженном состоянии. Диализатор соединен с трубками люер-коннекторами. Через конструкцию сначала прокачивали воздух, чтобы исключить наличие пузырей, выходящих у стыков диализатора с ПВХ-трубками контура. Затем в течение 2 мин через диализатор прокачивали со скоростью 1.5 мл/мин нагретый до температуры 50–70°С 0.05% раствор бетанина (красного пищевого красителя E-162 не окрашивающего волокна диализатора). Наблюдали за появлением красной окраски в объеме внешнего буфера, которая свидетельствовала об отсутствии герметичности собранного диализатора. Диализаторы с обнаруженными дефектами для работы не использовали. После пропускания красителя, в контур запускали физиологический раствор и прокачивали его на максимально доступной скорости насоса в течение 10 мин с целью полностью отмыть пропущенный через диализатор бетанин.
Проведение процедуры проточного диализа. ГДГ из печени быка (тип I, 50 МЕ/мг, 11 мг/мл, в 2 M сульфате аммония, рН 7.0) отделяли от сульфата аммония путем центрифугирования при 13 000 g в течение 10 мин (rср 4 см). Исходный объем фермента восстанавливали, добавляя буфер для ресуспендирования (5 мМ K2HPO4/KH2PO4, рН 7.4). Полученный фермент в объеме 60 мкл добавляли к 2 мл суспензии отмытых эритроцитов с гематокритом 70%.
ГДГ из Proteus sp. (NADP-зависимая, 413 МЕ/мг, 19 мг/мл, водный раствор) добавляли к 2 мл суспензии отмытых эритроцитов с гематокритом 70% либо в виде исходного неразведенного раствора (в объеме 3.8 мкл), либо в виде раствора, разведенного в PBS в 10 раз (в объеме 38 мкл). Чтобы исследовать зависимость эффективности включения фермента от его исходной концентрации в суспензии, в образцы добавляли различные объемы исходного фермента.
Полученные смеси пропускали через малый диализатор (волокна Fresenius Polysulfon диаметром 200 мкм и длиной 7 см), который был погружен в гипоосмотичекий раствор с мешалкой (5 мM КH2PO4/К2HPO4, 2 мM MgCl2, 5 мM глюкозы, рН 7.4) со скоростью 0.2 мл/мин. Соотношение объемов суспензия : раствор составляло 1 к 100. Полное время прохождения смеси через диализатор составляло около 10 мин. В полученный диализат добавляли запечатывающий раствор (1 М NaCl, 50 мМ КH2PO4/К2HPO4, 5 мМ ATР, 50 мМ глюкозы, 50 мМ пирувата натрия, pH 7.4, 2170 мОсм/кг) таким образом, чтобы конечная осмоляльность суспензии составляла 350–400 мОсм/кг. Расчет добавки проводили по формуле (1):
(1)
$\begin{gathered} {{V}_{{{\text{г и п е р }}{\text{.}}\,{\text{р а с т в о р а }}}}}({\text{м л }}) = \\ = {{V}_{{{\text{д и а л и з а т а }}}}}(350--{{S}_{{{\text{д и а л и з а т а }}}}})/\left( {2170--350} \right), \\ \end{gathered} $После этого суспензию инкубировали 30 мин при 37°С и полученные эритроциты-носители отмывали в растворе PBS 3 раза путем центрифугирования при 1000 g в течение 8 мин (rср 8 см).
Измерение активности глутаматдегидрогеназы. Для измерения активности фермента, включенного в эритроциты, полученные ЭБР были лизированы путем добавления лизирующего буфера (50 мМ КH2PO4/К2HPO4, 0.15 мМ EGTA, 0.2% сапонин, рН 7.4) в объемном соотношении клетки : лизирующий раствор 1 : 19.
Активность ГДГ в лизатах измеряли спектрофотометрически на микропланшетном фотометрическом ридере Anthos Zenyth 340rt (Biochrom, England) на длине волны λ = 340 нм.
Активность ГДГ из печени быка измеряли согласно работе McCarthy and Tipton [37] с некоторыми модификациями. К 320 мкл 50 мМ калий-фосфатного буфера (рН 7.4), содержащего 0.16 мМ NADH, добавляли 10 мкл пробы (лизата) и смесь инкубировали 10 мин при 30°С. После этого в каждую ячейку планшета добавляли 10 мкл 3.4 М раствора NH4Cl и запускали реакцию добавлением 0.8 М раствора α-кетоглутарата до конечной концентрации 5 мМ. Суммарный объем смеси в ячейке при измерении составлял 340 мкл.
Активность ГДГ из Proteus sp. измеряли согласно методике, предложенной производителем (Sigma-Аldrich, USA). Хотя оптимальным для данного фермента является рН 8.3, измерения проводили при рН 7.4, при котором этот фермент будет реально работать в эритроцитах. При этом к 330 мкл среды, содержащей 220 мМ NH4Cl, 7.6 мМ α-кетоглутарата, 0.25 мМ NADPH и 85 мМ Трис-HCl (pH 7.4), предварительно проинкубированной 5 мин при 30°С, добавляли 10 мкл пробы (лизата) и запускали измерение.
Расчет процента инкапсуляции глутаматдегидрогеназы и выхода клеток. Параметрами для оценки эффективности процедуры включения фермента в эритроциты в работе служили процент инкапсуляции (процент фермента, оказавшийся в эритроцитах после окончания процедуры) и выход клеток (процент клеток, выживших после процедуры). Эти показатели были рассчитаны по формулам (2), (3):
(2)
$\begin{gathered} {\text{В ы х о д к л е т о к }}\left( {{\text{в }}\% } \right) = \\ = {{V}_{{{\text{к о н е ч }}}}}H{{t}_{{{\text{к о н е ч }}}}} \times 100/({{V}_{{{\text{и с х }}}}}H{{t}_{{{\text{и с х }}}}}), \\ \end{gathered} $(3)
$\begin{gathered} {\text{И н к а п с у л я ц и я }}\left( {{\text{в }}\% } \right) = \\ = {{A}_{{{\text{к о н е ч }}}}}{{V}_{{{\text{к о н е ч }}}}} \times 100/({{A}_{{{\text{и с х }}}}}{{V}_{{{\text{и с х }}}}}), \\ \end{gathered} $Измерение осмотической резистентности клеток. Измерения проводили по методике Shcherbachenko [38]. В лунки 96-луночного планшета вносили по 300 мкл гипоосмотических растворов различной осмоляльности (от 0 (дистиллированная вода) до 297 мОсм/кг, рН 7.4). В каждую лунку добавляли по 6 мкл пробы (суспензии эритроцитов, разбавленной в PBS до гематокрита 5%) и инкубировали смеси 30 мин при комнатной температуре. Затем тоничность растворов возвращали к норме, добавляя в каждую лунку по 40 мкл гипертонического раствора, содержащего 96.2 мМ Na2HPO4, 15.6 мМ NaH2PO4, 1.54 М NaCl (рН 7.4). Измерение оптической плотности (поглощения) проб проводили на длине волны 620 нм на планшетном фотометрическом ридере Anthos Zenyth 340rt (Biochrom, England). Процент нелизировавших клеток определяли как отношение (в %) оптической плотности, измеренной в конкретной пробе, к оптической плотности той же пробы при нулевом лизисе (в растворе с физиологической осмоляльностью). Величину осмотической резистентности характеризовали значением осмоляльности раствора, при которой 50% исходных клеток было лизировано (Н50), а также шириной распределения клеток по осмотической резистентности (W), т.е. величиной разности осмоляльностей растворов, при которых наблюдали лизис 10 и 90% клеток.
Измерение эритроцитарных индексов. Эритроцитарные индексы исходных эритроцитов, а также полученных разными методами эритроцитов-носителей были измерены с помощью автоматического гематологического анализатора Micros OT (АВХ-France, France).
Статистическая обработка данных. Распределения всех измеренных параметров согласно тесту Д’Агостино–Пирсона были нормальными (MedCalc Statistical Software bvba, version 14.12, Belgium). Все экспериментальные результаты были проанализированы с использованием теста one-way ANOVA и представлены как средние величины ± стандартные ошибки среднего (SEM). Различия между группами считали достоверными при р < 0.05.
Статистическая обработка данных и построение графиков были выполнены в программе OriginPro 8.1 (OriginLab Corporation, USA).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Сравнение эффективности включения ГДГ в эритроциты с помощью различных гипоосмотических методов
Выход процедуры включения в эритроциты (инкапсуляция в %) ГДГ из печени быка, полученный тремя различными методами при различных осмоляльностях гипоосмотической среды, представлен на рис. 2а. С ростом осмоляльности гипоосмотического буфера в методе лизиса наблюдался небольшой рост инкапсуляции, который становился достоверно различимым между осмоляльностями 75 и 120 мОсм/кг. На инкапсуляцию методом диализа осмоляльность гипоосмотического буфера существенно не влияла. В методе проточного диализа оптимум процента инкапсуляции наблюдали при осмоляльности буфера 100 мОсм/кг.
Рис. 2.
Зависимость эффективности инкапсуляции ГДГ из печени быка (а) и выхода эритроцитов (б) от осмоляльности гипоосмотического буфера при включении фермента в эритроциты тремя различными гипоосмотическими методами (лизис, диализ в мешке, проточный диализ). Число экспериментов n = 10 и n = 7 для всех осмоляльностей в случае лизиса или диализа соответственно. Для проточного диализа n = 8 (при 75 мОсм/кг), n = 9 (при 100 мОсм/кг) и n = 5 (при 120 мОсм/кг). Представлены средние значения ± стандартная ошибка среднего. * – Процент инкапсуляции достоверно отличается от значения, полученного для метода лизиса при 120 мОсм/кг и для проточного диализа при 75 и 100 мОсм/кг (ANOVA, р < 0.05). ** –Значение инкапсуляции достоверно отличается от всех остальных, кроме полученного для проточного диализа при 75 мОсм/кг (ANOVA, р < 0.05). *** – Выход клеток достоверно отличается от выходов клеток, полученных другими методами при тех же осмоляльностях, и от полученного методом диализа при 120 мОсм/кг (ANOVA, р < 0.05). **** –Выход клеток достоверно отличается от выходов клеток, полученных методом диализа при любых осмоляльностях буфера, методом лизиса при осмоляльностях 75 и 100 мОсм/кг и методом проточного диализа при 75 мОсм/кг (ANOVA, р < 0.05).
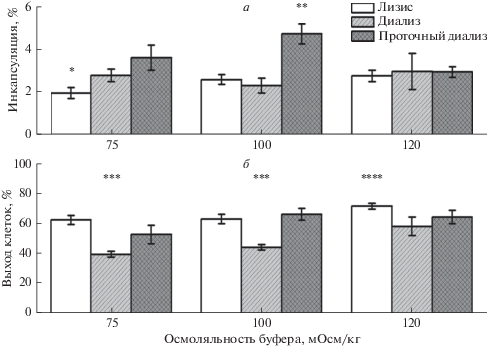
При 120 мОсм/кг эффективности включения ГДГ различными методами достоверно не различались, в то время как при 75 и 100 мОсм/кг инкапсуляция методом проточного диализа была достоверно выше, чем другими методами. При этом, хотя доля инкапсуляции ГДГ возросла незначительно (возможно, из-за размера фермента и его способности к агрегации), эффективность инкапсуляции методом проточного диализа была почти в 2 раза выше, чем при использовании других методов.
Выход клеток (рис. 2б) возрастал с ростом осмоляльности гипоосмотического буфера. При 120 мОсм/кг он достоверно отличался от выхода при других осмоляльностях (примерно на 10% в методе лизиса и на 20% в методе диализа). В проточном диализе изменение осмоляльности гипоосмотического буфера не вызывало существенных изменений в выходе клеток. Метод диализа имел самые низкие выходы эритроцитов, которые достоверно отличались в среднем на 20% от выхода клеток в методе лизиса при всех осмоляльностях буфера и от метода проточного диализа при осмоляльности буфера 100 мОсм/кг. Методы лизиса и проточного диализа по выходу клеток достоверно не различались.
Таким образом, наибольший процент инкапсуляции ГДГ из печени быка, равный 4.7 ± 0.47% (среднее ± SEM, n = 9), был достигнут в методе проточного диализа при осмоляльности 100 мОсм/кг. При этом выход клеток при этой осмоляльности также был максимальным и составлял 66.1 ± 4% (среднее ± SEM, n = 9).
Характеристики эритроцитов-носителей, полученных разными методами
Эритроциты-носители, полученные различными методами, могут различаться не только эффективностью включения фермента, но и свойствами клеток после процедуры. В качестве параметров, характеризующих эти свойства, были выбраны стандартные эритроцитарные индексы (средний объем эритроцитов (MCV, в фл), среднее содержание гемоглобина в клетке (МСН, в пг) и средняя концентрация гемоглобина в эритроците (МСНС, г/л)), а также осмотическая резистентность исходных эритроцитов и полученных ЭБР. Все эти параметры могут влиять на длительность циркуляции ЭБР в кровотоке.
Величины стандартных эритроцитарных индексов при проведении процедуры включения ферментов в эритроцит с помощью гипоосмотического стресса изменяются, так как после образования в мембране эритроцита пор часть внутриклеточного содержимого может выходить во внешнюю среду. Чем жестче воздействие на клетки, тем более сильным будет изменение эритроцитарных индексов, поэтому их измерение принято проводить при получении эритроцитов-носителей для характеристики силы воздействия на клетки использованного метода включения фермента [14]. Наши измерения этих индексов после включения ГДГ в эритроциты любым гипоосмотическим методом показали, что средний объем клетки всегда снижался, уменьшалось также количество гемоглобина в клетке и его концентрация (рис. 3).
Рис. 3.
Зависимость среднего объема эритроцитов (MCV, фл) (а), среднего содержания гемоглобина (MCH, пг) (б) и средней концентрации гемоглобина в эритроците (MCHC, г/л) (в) от осмоляльности гипоосмотического буфера при включении ГДГ из печени быка в клетки методами лизиса, диализа в мешках или проточного диализа. Заштрихованные области соответствуют диапазонам соответствующих значений для исходных эритроцитов до начала процедуры. Размеры боксов соответствуют области значений, включающей от 25 до 75 процентилей всех измеренных величин. Средние значения отмечены квадратами, медианы – горизонтальными линиями, а разбросы между минимальными и максимальными значениями – вертикальными линиями.
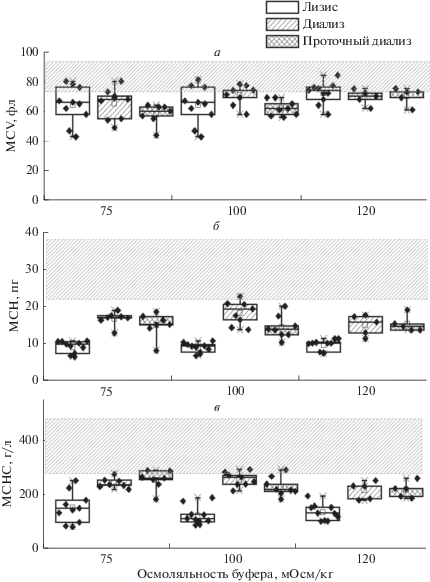
При осмоляльности гипоосмотического буфера 75 мОсм/кг средний объем эритроцита после лизиса и диализа становился ниже объема исходного эритроцита в среднем на 25%. При этом часть обработанных эритроцитов имела объем близкий к исходному. Для метода проточного диализа объем обработанных клеток уменьшался на 30%. При увеличении осмоляльности буфера разница исходного и конечного объемов сокращалась до 15% (рис. 3а).
Содержание гемоглобина в эритроцитах (МСН) снижалось больше всего после процедуры обратимого лизиса (примерно на 66–70%) (рис. 3б). Так как объем эритроцитов в среднем менялся примерно одинаково и незначительно для всех методов, концентрация гемоглобина в эритроцитах (МСНС) также снижалась больше всего после процедуры обратимого лизиса (примерно на 60–70%).
После диализа и проточного диализа клетки теряли примерно от 30 до 50% своего гемоглобина. И, в отличие от лизиса, в результате диализа и проточного диализа содержание гемоглобина внутри эритроцитов снижалось пропорционально уменьшению объема эритроцитов. Это приводило к тому, что концентрация гемоглобина в эритроцитах при проточном диализе изменялась слабо (не более чем на 15–30%) (рис. 3в). При этом осмоляльность в исходном растворе на выход гемоглобина не влияла (во всех методах).
Необходимо отметить, что сам по себе наблюдаемый уровень снижения объема эритроцитов-носителей или содержания в них гемоглобина не являются предпосылками для сокращения жизни этих клеток в организме. Хотя их способность переносить кислород явно снижена, это не нарушает критически способность всех эритроцитов организма переносить кислород. Количество переливаемых пациенту ЭБР не будет превышать 10% от общего числа его эритроцитов, поэтому, даже если снижение в них гемоглобина составляет 30–50%, это не нарушит кислород-переносящей функции в целом, поскольку в организме присутствует явный избыток гемоглобина, который эту функцию стабилизирует. Существенное снижение уровня доставки кислорода требует переливания эритроцитов. Такое снижение наступает при уровне гемоглобина, который зависит от пола и возраста пациента, а также условий, в которых он находится. Для мужчин переливание может потребоваться при снижении гемоглобина ниже 70 г/л, а для женщин – ниже 60 г/л [39]. Очевидно, что такое снижение не может быть достигнуто, если в 10% клеток гемоглобин будет снижен даже на 50%. Общее снижение его уровня при этом будет составлять только 5%, что абсолютно несущественно. С другой стороны, основной задачей ЭБР, содержащих ферменты, утилизирующие аммоний (кроме убирания из крови аммония), является поддержание собственной жизнедеятельности. Источником энергии, которая для этого необходима, является гликолиз. Концентрации гликолитических ферментов в ходе раскрытия мембран клеток также снижаются. Поскольку размеры большинства этих ферментов примерно соответствуют размеру молекул гемоглобина, можно предположить, что снижение концентраций этих ферментов внутри клетки, также не будут превышать 30–50%. Такое снижение этих концентраций не может приводить к критическому снижению эффективности гликолиза в эритроците, так как все эти ферменты присутствуют в клетке в большом избытке [40].
После лизиса объем эритроцитов меняется незначительно, но содержание гемоглобина в них, наоборот, снижается сильнее, чем в ЭБР, полученных другими методами. Это может говорить о том, что такие эритроциты, хотя и потеряли большую часть своего осмотического материала (гемоглобина), но их объем не снизился пропорционально доле потерянного гемоглобина, так как, возможно, в ходе процедуры включения ГДГ эритроциты-носители набухли. Это и могло привести к относительному более высокому снижению в них концентрации гемоглобина.
Такая ситуация может быть связана с неспособностью клеток регулировать свой объем после жестких условий лизиса. Если это так, то отношение площади поверхности к объему у этих эритроцитов должно быть уменьшено, что должно прямо отразиться на их осмотической резистентности. Деформируемость таких эритроцитов и их способность проходить через узкие капилляры должна быть снижена.
Кривые осмотической резистентности исходных эритроцитов и ЭБР, полученных разными методами, представлены на рис. 4.
Рис. 4.
Кривые осмотической резистентности исходных эритроцитов и эритроцитов-носителей ГДГ из печени быка, полученных тремя различными методами. Представлены средние значения ± стандартная ошибка среднего; n – количество экспериментов.
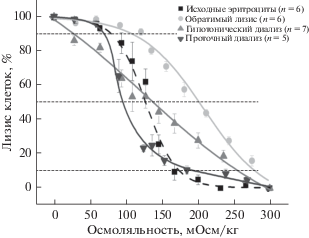
Как и было предположено выше, у эритроцитов, полученных методом лизиса, осмотическая резистентность оказалась самой низкой (рис. 4). Кривая их осмотической резистентности сильно сдвинута вправо относительно аналогичной кривой для нативных клеток. Это подтверждает и параметр Н50, который численно характеризует осмоляльность буфера, при которой лизирует 50% клеток (табл. 1). Параметр Н50 у этих ЭБР также самый высокий. Половина этих клеток разрушается при осмоляльности около 200 мОсм/кг, когда нативные эритроциты еще практически не лизированы (рис. 4). Эритроциты-носители, полученные методом диализа, по параметру Н50 близки к исходным клеткам, но они очень разнородны. Об этом говорит то, что кривая их осмотической резистентности стала гораздо более пологой (рис. 4), а ширина распределения ЭБР по осмотической резистентности (W) после диализа была максимальна среди всех исследованных методов (табл. 1). Эритроциты-носители, полученные методом проточного диализа, по параметру Н50 были даже более осмотически устойчивы, чем исходные клетки (половина клеток была лизирована при снижении осмоляльности буфера на две трети от физиологической (рис. 4)). Эти эритроциты имели также минимальную величину W среди всех полученных ЭБР (табл. 1).
Таблица 1.
Параметры осмотической резистентности эритроцитов-носителей ГДГ из печени быка, полученных разными методами
| Параметр | Исходные эритроциты | Лизис | Диализ | Проточный диализ |
|---|---|---|---|---|
| H50 | 128 ± 13 (n = 7) |
198.2 ± 4.0 (n = 6) |
133 ± 14 (n = 7) |
100.6 ± 6.0 (n = 5) |
| W | 35.0 ± 2.7 (n = 7) |
171.3 ± 7.6 (n = 6) |
183.5 ± 5.9 (n = 7) |
102 ± 11 (n = 5) |
Примечание. H50 – осмоляльность буфера, при которой лизирует половина эритроцитов; W – ширина распределения эритроцитов по осмотической резистентности, равная разности осмоляльностей буферов, при которых лизирует 10 и 90% эритроцитов. Представлены средние значения ± стандартная ошибка среднего. В скобках представлено количество экспериментов (n).
Таким образом, результаты измерения осмотической резистентности дают косвенное представление о деформируемости полученных ЭБР и позволяют предполагать, что эритроциты, полученные методом проточного диализа, могут быть наиболее деформируемы, в то время как биореакторы, полученные методом лизиса, будут деформироваться хуже и будут быстро выводиться из кровотока селезенкой.
Сравнение глутаматдегидрогеназ из печени быка и Proteus sp.
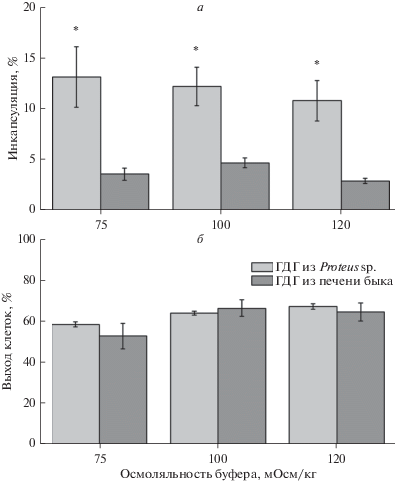
С целью увеличения удельной активности ГДГ, которой можно достигнуть в эритроцитах-биореакторах, было проведено сравнение эффективности включения в клетки, обычно используемой ГДГ из печени быка и бактериальной ГДГ из Proteus sp. Полученные результаты представлены на рис. 5. Процент инкапсуляции ГДГ из Proteus sp. был в 2.6–3.7 раза выше процента инкапсуляции для бычьего фермента при любой осмоляльности гипоосмотического буфера в диапазоне 75–120 мОсм/кг (рис. 5а), в то время как выход клеток в том же диапазоне осмоляльностей достоверно не различался (рис. 5б).
Рис. 5.
Включение в эритроциты ГДГ из печени быка или из Proteus sp. методом проточного диализа. Зависимость процента инкапсуляции (а) и выхода клеток (б) от осмоляльности буфера в исходной суспензии при включении фермента. Для ГДГ из Proteus sp. число экспериментов (n) равно 7, 5 и 6 при осмоляльностях буфера 75, 100 и 120 мОсм/кг соответственно, для ГДГ из печени быка при тех же осмоляльностях n равно 8, 9 и 5 соответственно. Представлены средние значения ± стандартная ошибка среднего. * – Достоверное отличие между ферментами при одинаковой осмоляльности буфера (ANOVA, p < 0.05).
При исследовании того, как удельная активность ГДГ внутри ЭБР зависит от концентрации этого фермента в суспензии в ходе процедуры включения (рис. 6а), а также того, как процент инкапсуляции фермента зависит от его концентрации в исходной суспензии (рис. 6б), было показано, что две ГДГ вели себя по-разному. Для ГДГ из печени быка было характерно снижение процента инкапсуляции с ростом концентрации фермента в исходной суспензии. По-видимому, оно связано с агрегацией ферментного белка в области концентраций выше 0.1 мг/мл (рис. 6б). Для ГДГ из Proteus sp. процент инкапсуляции с ростом концентрации белка не снижался, а оставался практически неизменным (несмотря на большой экспериментальный разброс результатов) (рис. 6б). Это приводило к тому, что для ГДГ из печени быка в диапазоне концентраций от 0.1 до 0.4 мг/мл суспензии рост удельной активности фермента в ЭБР практически не наблюдался. При дальнейшем увеличении концентрации фермента происходил очень незначительный рост его удельной активности в эритроцитах-носителях при сохранении процента инкапсуляции (рис. 6). Такое поведение бычьей ГДГ полностью согласуется с результатами работы [14].
Рис. 6.
Зависимость активности фермента, измеренной при рН 7.4, в эритроцитах-биореакторах, содержащих ГДГ (АЭБР) (а), и процента инкапсуляции фермента (б) от концентрации ГДГ в исходной суспензии при включении в эритроциты для ГДГ из печени быка (n = 16) или из Proteus sp. (n = 12). Ферменты были включены методом проточного диализа при осмоляльности 100 мОсм/кг.
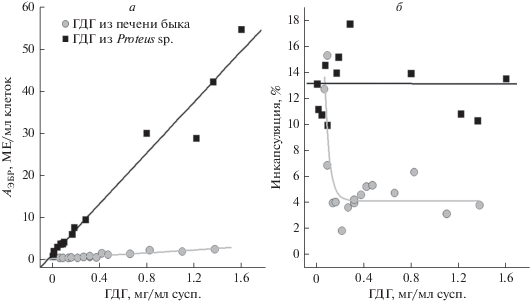
Процент инкапсуляции в эритроциты ГДГ из Proteus sp. не изменялся при увеличении концентрации фермента в исходной суспензии клеток, а удельная активность фермента в эритроцитах-носителях увеличивалась прямо пропорционально увеличению этой концентрации (рис. 6). Это подтверждает предположение о том, что для этого фермента не характерна агрегация при повышении его концентрации, либо она очень слабо выражена. Несмотря на то, что для данной ГДГ максимальная активность наблюдается при рН 8.3 [41], активность фермента в ЭБР при физиологическом рН 7.4 все равно значительно превышала активность бычьего фермента при тех же концентрациях (рис. 6а). Максимальная полученная активность ГДГ из Proteus sp. в эритроцитах при концентрации фермента в исходной суспензии 1.4 мг/мл суспензии составила 54.5 МЕ/мл эритроцитов-носителей.
ЗАКЛЮЧЕНИЕ
Степень инкапсуляции фермента является самым важным параметром при выборе фермента-кандидата и наиболее эффективного метода его включения для создания эритроцитов-биореакторов. Этот параметр тесно связан с выходом эритроцитов, так как чем меньше выживших клеток останется после процедуры, тем меньше фермента останется суммарно в этих клетках.
Результаты нашего исследования показали, что максимальная инкапсуляция ГДГ из печени быка наблюдалась при ее включении в эритроциты методом проточного диализа при осмоляльности гипоосмотического буфера 100 мОсм/кг. При этом процесс сопровождался также высоким выходом эритроцитов.
ЭБР, полученные методом проточного диализа, имели хорошую осмотическую резистентность. По параметру Н50 они были даже более устойчивы, чем исходные эритроциты. Это дает основание полагать, что такие эритроциты будут хорошо деформируемыми и способными проходить сквозь капиллярные сосуды организма, в том числе и селезенки, и будут способны дольше циркулировать в кровотоке. Все это вместе взятое позволило нам выбрать метод обратимого проточного диализа как наиболее оптимальный для включения ГДГ в эритроциты. Кроме того, переход от такого лабораторного рутинного метода, как гипоосмотический диализ в мешках, к методу проточного диализа с использованием стандартных диализаторов позволит в дальнейшем стандартизовать и ускорить получение таких эритроцитов-биореакторов для их применения в клинике.
При сравнении ГДГ из печени быка и Proteus sp. было показано, что использование бактериальной ГДГ может существенно (примерно в 2.6–3.7 раза) повысить процент инкапсуляции фермента, а также увеличить удельную активность фермента, включенную в эритроциты (примерно в 18 раз при концентрации ГДГ в исходной суспензии 1.4 мг/мл суспензии). Это обусловлено более высокой удельной активностью коммерческого препарата ГДГ из Proteus sp. по сравнению с ГДГ из печени быка (~400 и 40 МЕ/мг белка соответственно), а также тем, что этот фермент не проявлял склонности к агрегации при увеличении его концентрации. Это согласуется с литературными данными о бактериальных ГДГ [18, 35] и впервые показано экспериментально в данной работе. Удельная активность ГДГ из Proteus sp. в эритроцитах может быть сильно увеличена, так как она прямо пропорциональна концентрации фермента в исходной суспензии клеток (при сохранении постоянного процента инкапсуляции). Это дает основание полагать, что, включая ГДГ из Proteus sp., можно создавать эритроциты-биореакторы с различными терапевтическими дозами ГДГ для применения в клинике. Таким образом, ГДГ из Proteus sp. является перспективным ферментом, а метод проточного диализа – наиболее подходящим осмотическим методом, с клиническим потенциалом реализации для создания ЭБР на основе тандема ГДГ и ААТ для удаления аммония из кровотока.
Работа поддержана грантом по программе фундаментальных исследований Президиума РАН “Фундаментальные основы технологии физиологических адаптаций”.
Авторы работы декларируют отсутствие конфликта интересов.
Список литературы
Bax B.E., Bain M.D., Ward C.P., Fensom A.H., Chalmers R.A. 1997. The entrapment of mannose-terminated glucocerebrosidase (alglucerase) in human carrier erythrocytes. In: Erythrocytes as Drug Carriers in Medicine. Eds Sprandel U., Way J.L. New York, London: Plenum Press USA, p. 59–62.
Rossi L., Bianchi M., Magnani M. 2018. Increased glucose metabolism by enzyme-loaded erythrocytes in vitro and in vivo normalization of hyperglycemia in diabetic mice. Biotechnol. Appl. Biochem. 15, 207–216.
Kravtzoff R., Desbois I., Lamagnere J.P., Muh J.P., Valat C., Chassaigne M., Colombat P., Ropars C. 1996. Improved pharmacodynamics of L-asparaginase-loaded in human red blood cells. Eur. J. Clin. Pharmacol. 49, 465–470.
Sanz S., Lizano C., Luque J., Pinilla M. 1999. In vitro and in vivo study of glutamate dehydrogenase encapsulated into mouse erythrocytes by a hypotonic dialysis procedure. Life Sci. 65, 2781–2789.
Auron A., Brophy P.D. 2012. Hyperammonemia in review: Pathophysiology, diagnosis, and treatment. Pediatr. Nephrol. 27, 207–222.
Husson M.C., Schiff M., Fouilhoux A., Cano A., Dobbelaere D., Brassier A., Mention K., Arnoux J.B., Feillet F., Chabrol B., Guffon N., Elie C., de Lonlay P. 2016. Efficacy and safety of i.v. sodium benzoate in urea cycle disorders: A multicentre retrospective study. Orphanet J. Rare Dis. 11, 127. https://doi.org/10.1186/ s13023-016-0513-0
Sushma S., Dasarathy S., Tandon R.K., Jain S., Gupta S., Bhist M.S. 1992. Sodium benzoate in the treatment of acute hepatic encephalopathy: A double-blind randomized trial. Hepatology. 16, 138–144.
Honda S., Yamamoto K., Sekizuka M., Oshima Y., Nagai K., Hashimoto G., Kaneko H., Tomomasa T., Konno Y., Horiuchi R. 2002. Successful treatment of severe hyperammonemia using sodium phenylacetate powder prepared in hospital pharmacy. Biol. Pharm. Bull. 25, 1244–1246.
Sharma B.C., Sharma P., Lunia M.K., Srivastava S., Goyal R., Sarin S.K. 2013. A randomized, double-blind, controlled trial comparing rifaximin plus lactulose with lactulose alone in treatment of overt hepatic encephalopathy. Am. J. Gastroenterol. 108, 1458–1463.
Kircheis G., Nilius R., Held C., Berndt H., Buchner M., Görtelmeyer R., Hendricks R., Krüger B., Kuklinski B., Meister H., Otto H.J., Rink C., Rösch W., Stauch S. 1997. Therapeutic efficacy of L-ornithine-L-aspartate infusions in patients with cirrhosis and hepatic encephalopathy: Results of a placebo-controlled, double-blind study. Hepatology. 25, 1351–1360.
Protasov E.S., Borsakova D.V., Alexandrovich Y.G., Korotkov A.V., Kosenko E.A., Butylin A.A., Ataullakhanov F.I., Sinauridze E.I. 2019. Erythrocytes as bioreactors to decrease excess ammonium concentration in blood. Sci. Reports. 9 (1) 1455. https://doi.org/10.1038/s41598-018-37828-5
Venediktova N.I., Kosenko E.A., Kaminsky Y.G. 2008. Studies on ammocytes: Development, metabolic characteristics, and detoxication of ammonium. Bull. Exp. Biol. Med. 146, 730–732.
Kosenko E.A., Venediktova N.I., Kudryavtsev A.A., Ataullakhanov F.I., Kaminsky Y.G., Felipo V., Montoliu C. 2008. Encapsulation of glutamine synthetase in mouse erythrocytes: A new procedure for ammonia detoxification. Biochem. Cell Biol. 86, 469–476.
Sanz S., Pinilla M., Garin M., Tipton K.F., Luque J. 1995. The influence of enzyme concentration on the encapsulation of glutamate dehydrogenase and alcohol dehydrogenase in red blood cells. Biotechnol. Appl. Biochem. 22, 223–231.
Sanz S., Lizano C., Garin M.I., Luque J., Pinilla M. 1997. Biochemical properties of alcohol dehydrogenase and glutamate dehydrogenase encapsulated into human erythrocytes by a hypotonic-dialysis procedure. In: Erythrocytes as Drug Cariers in Medicine. Eds Sprandel U., Way J.L. New York: Springer Science + Business Media, p. 101–108.
Millan C.G., Marinero M.L.S., Castaneda A.Z., Lanao J.M. 2004. Drug, enzyme and peptide delivery using erythrocytes as carriers. J. Control. Release. 95, 27–49.
Gupta A., Mishra A.K., Bansal1 P., Kumar S., Gupta V., Singh R., Kalyan G.S. 2010. Cell based drug delivery system through resealed erythrocyte – a review. Int. J. Pharm. Sci. Drug Res. 2, 23–30.
Pierigè F., Serafini S., Rossi L., Magnani M. 2008. Cell-based drug delivery. Adv. Drug Deliv. Rev. 60 (2), 286–295.
Linderkamp O., Meiselman H.J. 1982. Geometric, osmotic, and membrane mechanical properties of density-separated human red cells. Blood. 59, 1121–1127.
Ponder E. 1951. Diffractometric measurements of the tonicity volume relations of human red cells in hypotonic systems. J. Gen. Physiol. 34, 567–571.
Evans J., Gratzer W., Mohandas N., Parker K., Sleep J. 2008. Fluctuations of the red blood cell membrane: Relation to mechanical properties and lack of ATP dependence. Biophys. J. 94, 4134–4144.
Seeman P. 1967. Transient holes in the erythrocyte membrane during hypotonic hemolysis and stable holes in the membrane after lysis by saponin and lysolecithin. J. Cell Biol. 32, 55–70.
Saari J.T., Beck J.S. 1975. Hypotonic hemolysis of human red blood cells: A two-phase process. J. Membr. Biol. 23, 212–226.
Erickson H.P. 2009. Size and shape of protein molecules at the nanometer level determined by sedimentation, gel filtration, and electron microscopy. Biol. Proced Online. 11, 32–51. https://doi.org/10.1007/s12575-009-9008-x
Colman R.F. 1990. Dehydrogenases-structure and catalytic mechanisms: Glutamate dehydrogenase (bovine liver). In: A study of enzymes. Ed. S.A. Kuby S.A. Vol. II, Mechanism of enzyme action. Chapter 7. Boston, Roca Raton, Ann Arbor: CRC Press, p. 173–192.
Moon K., Smith E.L. 1973. Sequence of bovine liver glutamate dehydrogenase. VIII. Peptides produced by specific chemical cleavages; the complete sequence of the protein. J. Biol. Chem. 248, 3082–3088.
Hudson R.C., Daniel R.M. 1993. L-glutamate dehydrogenases: Distribution, properties and mechanism. Comp. Biochem. Physiol. B. 106, 767–792.
Goldin B.R., Frieden C. 1971. L-glutamate dehydrogenases. Curr. Top. Cell. Regul. 4, 77–117.
Sund H., Markau K., Koberstein R. 1975. Glutamate dehydrogenase. In: Subunits in biological systems. Part C (Biological macromolecules. V. 7). Eds Timasheff S.H., Fasman G.D. New York, Basel: Marcel Dekker, p. 225–287.
Saier M.H., Jenkins W.T. 1967. Alanine aminotransferase. I. Purification and properties. J. Biol. Chem. 242, 91–100.
Eisenberg H., Tomkins G.M. 1968. Molecular weight of the subunits, oligomeric and associated forms of bovine liver glutamate dehydrogenase. J. Mol. Biol. 31, 37–49.
Sinauridze E.I., Vitvitsky V.M., Pichugin A.V., Zhabotinsky A.M., Ataullakhanov F.I. 1992. A new chemotherapeutic agent: L-asparaginase entrapped in red blood cells. Adv. Exp. Med. Biol. 326, 203–206.
Ihler G.M., Glew R.H., Schnure F.W. 1973. Enzyme loading of erythrocytes. Proc. Natl. Acad. Sci. U.S.A. 70, 2663–2666.
Godfrin Y., Horand F., Franco R., Dufour E., Kosenko E., Bax B.E., Banz A., Skorokhod O.A., Lanao J.M., Vitvitsky V., Sinauridze E., Bourgeaux V., Gunter K.C. 2012. Meeting highlights: International seminar on the red blood cells as vehicles for drugs. Expert Opin. Biol. Ther. 12, 127–133.
Yew N.S., Dufour E., Przybylska M., Putelat J., Crawley C., Foster M., Gentry S., Reczek D., Kloss A., Meyzaud A., Horand F., Cheng S.H., Godfrin Y. 2013. Erythrocytes encapsulated with phenylalanine hydroxylase exhibit improved pharmacokinetics and lowered plasma phenylalanine levels in normal mice. Mol. Genet. Metab. 109, 339–344.
Santero E., Hervas A.B., Canosa I., Govantes F. 2012. Glutamate dehydrogenases: Enzymology, physiological role and biotechnological relevance. In: Dehydrogenases (chapter 12). Ed. Canuto R.A. InTechOpen, p. 289–318. https://doi.org/10.5772/4776710.5772/47767
McCarthy A.D., Tipton K.F. 1985. Ox glutamate dehydrogenase. Comparison of the kinetic properties of native and proteolysed preparations. Biochem. J. 230, 95–99.
Shcherbachenko I.M., Lisovskaya I.L., Tikhonov V.P. 2007. Oxidation-induced calcium-dependent dehydration of normal human red blood cells. Free Radic. Res. 41, 536–545.
Klein H.G., Anstee D.J. 2005. Transfusion of blood, blood components and plasma alternatives in oligaemia. In Mollison’s Dlood Transfusion in Clinical Medicine. 11 ed. Chapter 2. Massachusetts: Blackwell Publishing, Inc., USA, p. 19–47.
Martinov M.V., Plotnikov A.G., Vitvitsky V.M., Ataullakhanov F.I. 2000. Deficiencies of glycolytic enzymes as a possible cause of hemolytic anemia. Biochim. Biophys. Acta. 1474, 75-87.
Shimizu H., Kuratsu T., Hirata F. 1979. Purification and some properties of glutamate dehydrogenase from Proteus inconstans. J. Ferment. Technol. 57, 428–433.
Дополнительные материалы отсутствуют.
Инструменты
Биологические мембраны: Журнал мембранной и клеточной биологии


