Биологические мембраны: Журнал мембранной и клеточной биологии, 2019, T. 36, № 3, стр. 207-217
Вклад нестационарности внутриклеточной концентрации ионов калия в кинетику потенциал-зависимых калиевых токов
В. А. Семенов a, *, Д. В. Амахин a, Н. П. Веселкин a
a Институт эволюционной физиологии и биохимии им. И.М. Сеченова РАН
194223 Санкт-Петербург, пр. Тореза, 44, Россия
* E-mail: semenov.vlad.anat@mail.ru
Поступила в редакцию 13.09.2018
После доработки 05.02.2019
Принята к публикации 07.02.2019
Аннотация
Потенциал-зависимые калиевые каналы (Kv-каналы) и опосредуемый ими потенциал-зависимый калиевый ток вносят существенный вклад в формирование потенциала действия и регуляцию возбудимости нейрона. На сегодняшний день было проведено большое количество исследований этих ионных каналов методом пэтч-кламп в конфигурации “целая клетка”. Предполагается, что в ходе реализации метода внутриклеточные концентрации ионов остаются примерно постоянными благодаря относительно быстрому обмену содержимого между цитоплазмой и пэтч-пипеткой. Однако это предположение может быть неверным в случае большого потока ионов через мембрану. В данном исследовании было продемонстрировано, что большие по величине выходящие токи ионов калия способны приводить к снижению их внутриклеточной концентрации даже в условиях эксперимента методом пэтч-кламп в конфигурации “целая клетка”. Данный феномен может ускорять спад потенциал-зависимых калиевых токов в ходе пэтч-кламп-регистрации, что может привести к завышенным оценкам скорости инактивации потенциал-зависимых калиевых каналов.
ВВЕДЕНИЕ
Потенциал-зависимый калиевый ток – это ток через Kv-каналы, которые представлены во всех эукариотических и прокариотических организмах [1]. Kv-каналы регулируют мембранный потенциал и возбудимость как нейронов, так и других типов клеток [2, 3], что позволяет им контролировать многие процессы, такие как высвобождение нейротрансмиттеров, мышечную сократимость и др. [4, 5].
Kv-каналы выполняют свою функцию благодаря наличию у них потенциал-чувствительного домена, который при деполяризации мембраны меняет конформацию канала, приводя к его открытию. При длительной деполяризации мембраны наступает инактивация Kv-каналов, которая также обусловлена их конформационными изменениями [6]. Нарушения в работе Kv-каналов играют существенную роль в патогенезе ряда наследственных и приобретенных заболеваний. Кроме того, воздействия на Kv-каналы лежат в основе побочных эффектов многих медицинских препаратов [7].
Одним из популярных методов исследования Kv-каналов является метод пэтч-кламп в конфигурации “целая клетка”. Данный метод позволяет оценить важные свойства Kv-каналов, включая их активацию, инактивацию и проводимость (см., например, [8–15]).
Однако для корректной интерпретации экспериментальных результатов необходимо учитывать некоторые особенности данного метода. Ранее как экспериментально [16], так и при помощи математической модели [17, 18] было продемонстрировано, что при исследовании методом пэтч-кламп в конфигурации “целая клетка”, кончик пэтч-пипетки является значительным барьером для обмена содержимым между пипеткой и цитоплазмой клетки. Считалось, что это больше применимо к клеточным компонентам и большим молекулам, чем к малым ионам, однако в исследованиях на ГАМКА-рецепторах было обнаружено, что кончик пэтч-пипетки существенно замедляет диффузию даже малых ионов, таких как ионы хлора [19–21]. Несмотря на это, подобных данных для других ионов, включая ионы калия, на сегодняшний день не опубликовано.
Если допустить ограниченность обмена ионов калия между клеткой и пэтч-пипеткой, то теоретически при протекании длительного потенциал-зависимого калиевого тока через мембрану клетки может происходить изменение внутриклеточной концентрации ионов калия ([K+]i). Это должно повлечь за собой сдвиг потенциала реверсии для этих ионов (VK) и изменение проводимости мембраны. Таким образом, в случае выходящего калиевого тока скорость его спада будет увеличиваться по причинам, не зависящим от инактивации Kv-каналов. Так как инактивация Kv-каналов в значительном количестве работ оценивается по спаду амплитуды тока [9, 11, 22–26], данный феномен может привести к завышенным оценкам ее скорости.
Целью данного исследования было продемонстрировать возможность сдвига [K+]i в ходе активации большой потенциал-зависимой калиевой проводимости, а также оценить, насколько эффективно пэтч-пипетка способна поддерживать постоянство [K+]i вследствие обмена ионов калия между пипеточным раствором и цитоплазмой клетки в ходе эксперимента пэтч-кламп.
МАТЕРИАЛЫ И МЕТОДЫ
Получение срезов коры головного мозга крысы
Исследование проводилось на изолированных пирамидных нейронах префронтальной коры головного мозга крыс линии Вистар (возраст – 21 день). Все экспериментальные процедуры проводились в соответствии с директивой Совета Европы Directive 86/609/EEC и регламентом использования лабораторных животных в ИЭФБ РАН, принятым и утвержденным комиссией по биоэтике. Если не указано иначе, все реактивы, использованные в работе, были произведены компанией Sigma-Aldrich, США.
Крыс убивали декапитацией. Головной мозг быстро извлекался и помещался в искусственную спинномозговую жидкость (ИСЖ) аэрируемую газовой смесью 95% О2 + 5% СО2. ИСЖ использовалась на всех стадиях приготовления срезов и имела следующий состав (в мМ): NaCl 126, KCl 2.5, NaH2PO4 1.25, MgSO4 1, CaCl2 2, NaHCO3 24 и декстроза 13.
С помощью вибратома Microm HM650V (Thermo Fisher Scientific, США) изготавливались срезы префронтальной коры головного мозга крысы толщиной 300 мкм. Далее срезы оставлялись при комнатной температуре в емкости с аэрируемой ИСЖ на 1.5 ч для адаптации.
Изоляция нейронов префронтальной коры головного мозга
После адаптационного периода срезы переносили в раствор, который содержал (в мМ): NaCl 145, HEPES 10, глюкоза 10, KCl 5, CaCl2 2, MgCl2 1.6, тетродотоксин 0.0005 (Alomone Labs, Израиль); рН 7.4; раствор аэрировался чистым кислородом. Срезы подвергались обработке протеазой из Streptomyces griseus, типа XIV (Sigma–Aldrich, P5147, 1 мг/мл в течение 20 мин при 35°C) или трипсином (Sigma–Aldrich, T8003, 1 мг/мл, 25–30 мин при 35°С). После этого срезы переносили в чашку для культивирования диаметром 35 мм при комнатной температуре (20–21°С). Медиальную префронтальную кору вырезали из среза с помощью игл под стереоскопическим микроскопом. Изоляция нейронов из полученных срезов производилась путем пипетирования срезов несколькими пипетками Пастера (от наибольшего диаметра к наименьшему). Изолированные нейроны переносили в камеру, смонтированную на инвертированном микроскопе, и оставляли на 10 мин перед началом эксперимента. Камера перфузировалась раствором, который содержал (в мМ): NMDG-Cl 145, HEPES 10, глюкоза 10, KCl 5, CaCl2 2, MgCl2 1.6, CdCl2 2 (Sigma–Aldrich, США), тетродотоксин 0.0005 (Alomone Labs, Израиль); рН 7.4 (доводился с помощью раствора HCl), раствор аэрировался чистым кислородом. Хлорид кадмия и тетродотоксин были добавлены в целях блокады потенциал-зависимых кальциевых и натриевых каналов нейронов.
Регистрация методом пэтч-кламп
Регистрация потенциал-зависимых калиевых токов проводилась методом пэтч-кламп в конфигурации “целая клетка” в режиме фиксации напряжения. Для этого использовались: пэтч-кламп усилитель модель 2400 (AM-Systems, США), аналого-цифровой преобразователь NI USB-6211 (National Instruments, США) и программное обеспечение WinWCP 5 (SIPBS, Великобритания).
Пэтч-пипетки были изготовлены при помощи пуллера Sutter P-1000 (Sutter Instrument, США) из трубочек боросиликатного стекла с наружным диаметром 1.5 мм и внутренним диаметром 0.86 мм. Пипетки заполнялись раствором следующего состава (в мМ): KF 140, KCl 5, HEPES 5; EGTA 10; Na-ATP 4; GTP 0.1 и имели сопротивление 3–3.5 МОм. Согласно методике, описанной ранее [27], был измерен потенциал на границе раздела пипеточного и внешнего раствора (liquid junction potential, LJP), который составил –7 мВ, что было учтено в ходе обработки данных.
Использование фторида калия в качестве основного компонента пипеточного раствора обусловлено задачей снизить концентрацию ионов хлора внутри клетки и нивелировать входящий потенциал-зависимый ток этих ионов при отрицательных мембранных потенциалах. Кроме того, в ряде исследований было показано, что ионы фтора могут подавлять потенциал-зависимый кальциевый ток [28–30]. Известно, что внутриклеточные ионы фтора действуют на кальциевую проводимость, ускоряя инактивацию потенциал-зависимого кальциевого тока, а также подавляя его персистирующий компонент, который не инактивируется при мембранном потенциале от –40 до –10 мВ [29].
После формирования конфигурации “целая клетка” емкость мембраны нейронов (Cm) составляла 11.3 ± 0.4 пФ (n = 7), последовательное сопротивление (Rs) до компенсации составляло 13 ± 2 МОм (n = 7). Для установления ионного равновесия между содержимым пипетки и клетки перед началом экспериментального протокола выдерживался временной интервал не менее 60 с. Большую часть времени регистрации мембранный потенциал фиксировался на значении –87 мВ. В ходе записи компенсировалась емкость мембраны и последовательное сопротивление (70–80%). Данные фильтровались на 10 кГц и записывались с той же частотой дискретизации.
Построение вольт-амперных характеристик калиевых токов
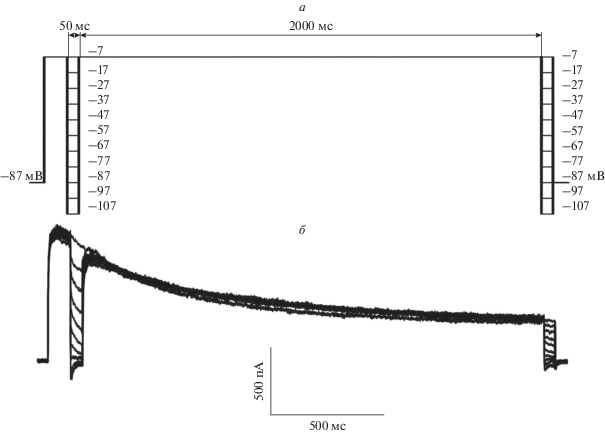
Экспериментальный протокол изменения мембранного потенциала (с учетом LJP) изображен на рис. 1а. Для открытия потенциал-зависимых калиевых каналов подавалась ступенька командного потенциала до –7 мВ. Согласно литературным данным, при данном потенциале активируются как Kv-каналы, опосредующие IA-ток, так и Kv-каналы, опосредующие IK-ток [12, 31]. Вольт-амперные характеристики (ВАХ) потенциал-зависимых калиевых токов были получены при помощи двух ступенчатых изменений командного потенциала длительностью 50 мс, подающихся с интервалом в 2 с. Данные кратковременные ступеньки не вызывали существенной деактивации Kv-каналов. Всего регистрировалось 11 пробегов с шагом ступенчатых изменений потенциала, равным 10 мВ (от –107 до –7 мВ). Значения силы тока, которые использовались для построения ВАХ, считывались через 10 мс от начала подачи кратковременной ступеньки. Из полученных ВАХ вычитались ВАХ тока утечки, которая определялась из ответа на ступенчатое изменение командного потенциала с –80 до –95 мВ и считалась линейной. Таким образом, от каждой клетки, включенной в анализ, строились две ВАХ: первая – спустя 100 мс от подачи деполяризующей ступеньки командного потенциала, вторая – спустя 2 с от первой.
Обработка экспериментальных данных
Обработка данных осуществлялась в программе Sigmaplot 12.5 (Systat Software Inc, США).
Для определения проводимости и значений потенциала реверсии калиевого тока полученные ВАХ аппроксимировались уравнением:
где I – сила тока, G – проводимость, Vcom – командный потенциал, VK – потенциал реверсии для ионов калия.Для теоретического определения [K+]i использовалось преобразованное уравнение Нернста:
(2)
${{[{{{\text{K}}}^{ + }}]}_{{\text{i}}}} = \frac{{{{{[{{{\text{K}}}^{ + }}]}}_{{\text{o}}}}}}{{{{e}^{{\frac{{F{{V}_{{\text{K}}}}}}{{RT}}}}}}},$Для теоретического определения величины предельного изменения внутриклеточной концентрации ионов калия (∆[K+]i), при потенциал-зависимом калиевом токе и отсутствии быстрого обмена содержимым между клеткой и пэтч-пипеткой использовалось следующее уравнение:
где ∆Q – количество заряда, которое вышло из клетки в течение потенциал-зависимого калиевого тока (определялось как площадь под графиком зависимости калиевого тока от времени за 2 с между подачей ступенек командного потенциала); vequ – эквивалентный объем клетки.Моделирование поведения внутриклеточной концентрации ионов калия в ходе пэтч-кламп-регистрации высокоамплитудного ионного тока
Моделирование проводилось в среде Wolfram Mathematica 10 (Wolfram Research, США). За основу была взята модель поведения внутриклеточных ионных концентраций в ходе пэтч-кламп экспериментов, предложенная в работах [20, 21]. Файл с расчетами доступен по ссылке: https://yadi.sk/d/07KR1Ldd2wM_rA. Для упрощения расчетов рассматривалось поведение внутриклеточных концентраций для трех ионов: катиона, проходящего через мембрану (условный ион калия) и двух не проходящих через мембрану анионов (условные ионы фтора и хлора). Мобильности условных ионов калия, фтора и хлора в водном растворе считались равными. Поведение каждого из этих ионов описывалось дифференциальным уравнением, согласно которому скорость изменения внутриклеточной концентрации иона определяется: 1) потоком этого иона из клетки в наружную среду (не равен нулю только для катиона); 2) потоком этого иона из клетки в пипетку вследствие электрического поля (вычисляется с учетом числа переноса для данного иона); 3) потоком этого иона вследствие диффузии (пропорционален разнице концентраций этого иона между внутриклеточной средой и пипеточным раствором). Итоговая система дифференциальных уравнений имела следующий вид:
(4)
$\begin{gathered} \frac{{d{{C}_{1}}(t)}}{{dt}} = \frac{{I(t)}}{{{{z}_{1}}FV}} \times \\ \times \,\,\left( { - 1 + \frac{{\left| {{{z}_{1}}} \right|{{C}_{1}}(t)}}{{\left| {{{z}_{1}}} \right|{{C}_{1}}(t) + \left| {{{z}_{2}}} \right|{{C}_{2}}(t) + \left| {{{z}_{3}}} \right|{{C}_{3}}(t)}}} \right) + \\ + \,\,\frac{{{{C}_{{1\_{\text{pipette}}}}} - {{C}_{1}}(t)}}{{{{\tau }_{{{\text{diff}}}}}}}, \\ \end{gathered} $(5)
$\begin{gathered} \frac{{d{{C}_{2}}(t)}}{{dt}} = \frac{{I(t)}}{{{{z}_{2}}FV}}\left( {\frac{{\left| {{{z}_{2}}} \right|{{C}_{2}}(t)}}{{\left| {{{z}_{1}}} \right|{{C}_{1}}(t) + \left| {{{z}_{2}}} \right|{{C}_{2}}(t) + \left| {{{z}_{3}}} \right|{{C}_{3}}(t)}}} \right) + \\ + \,\,\frac{{{{C}_{{2\_{\text{pipette}}}}} - {{C}_{2}}(t)}}{{{{\tau }_{{{\text{diff}}}}}}}, \\ \end{gathered} $(6)
$\begin{gathered} \frac{{d{{C}_{3}}(t)}}{{dt}} = \frac{{I(t)}}{{{{z}_{3}}FV}}\left( {\frac{{\left| {{{z}_{3}}} \right|{{C}_{3}}(t)}}{{\left| {{{z}_{1}}} \right|{{C}_{1}}(t) + \left| {{{z}_{2}}} \right|{{C}_{2}}(t) + \left| {{{z}_{3}}} \right|{{C}_{3}}(t)}}} \right) + \\ + \,\,\frac{{{{C}_{{3\_{\text{pipette}}}}} - {{C}_{3}}(t)}}{{{{\tau }_{{{\text{diff}}}}}}}, \\ \end{gathered} $В ходе расчетов использовалось два типа уравнений для ионного тока I(t) через мембрану (и через сечение пипетки) от мембранного потенциала: (I) уравнение, подразумевающее линейную зависимость силы тока через мембрану от мембранного потенциала; (II) уравнение, подразумевающее зависимость силы тока от мембранного потенциала, подчиняющейся уравнению потока Гольдмана–Ходжкина–Катца (ГХК) [32, 33]. В случае использования линейной зависимости уравнение имело вид:
(7)
$I(t) = g(t)\left( {{{V}_{{{\text{hold}}}}} - \frac{{RT}}{{{{z}_{1}}F}}\ln \left[ {\frac{{{{C}_{{1\_{\text{out}}}}}}}{{{{C}_{1}}(t)}}} \right]} \right),$В случае использования зависимости ГХК уравнение для трансмембранного тока имело вид:
(9)
$\begin{gathered} I(t) = \\ = \frac{{{{{\left( {{{z}_{1}}F} \right)}}^{2}}}}{{RT}}PS(t)U\frac{{{{C}_{1}}(t) - {{C}_{{1\_{\text{out}}}}}\exp \left( {\frac{{ - {{z}_{1}}F}}{{RT}}{{V}_{{{\text{hold}}}}}} \right)}}{{\exp \left( {\frac{{{{z}_{1}}F{{V}_{{{\text{hold}}}}}}}{{RT}}} \right) - 1}}, \\ \end{gathered} $Множитель перед экспонентой был подобран из условия одинаковой начальной амплитуды ионного тока при 0 мВ для случаев линейной и нелинейной ВАХ. Предполагалось, что непосредственно перед активацией калиевой проводимости внутриклеточные концентрации ионов были равны их внутрипипеточным концентрациям, так что начальные условия для системы дифференциальных уравнений были:
Статистический анализ
Статистический анализ был выполнен с использованием Sigmaplot 12.5 (Systat Software Inc, США). Нормальность распределения выборочных данных оценивалась по критерию Шапиро–Уилка. Для данных, которые имели нормальное распределение, был применен метод параметрической статистики парный t-критерий Стьюдента. Для данных, которые имели ненормальное распределение, был использован непараметрический статистический тест Уилкоксона. Все значения приведены как среднее арифметическое ± стандартная ошибка среднего.
РЕЗУЛЬТАТЫ
Характеристики потенциал-зависимых калиевых токов
Потенциал-зависимые калиевые токи были записаны в условиях пэтч-кламп-эксперимента в конфигурации “целая клетка” на изолированных нейронах префронтальной коры головного мозга крысы. Все нейроны (n = 7), включенные в анализ, имели характерную пирамидальную форму (рис. 2). Изменения мембранного потенциала с –87 до –7 мВ во всех клетках (n = 7) вызывали калиевые токи, которые спадали со временем (схема экспериментального протокола приведена на рис. 1а, характерный пример регистрируемых токов приведен на рис. 1б).
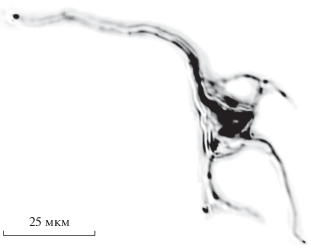
Рис. 2.
Микрофотография изолированного нейрона префронтальной коры головного мозга крысы. Характерный пример.
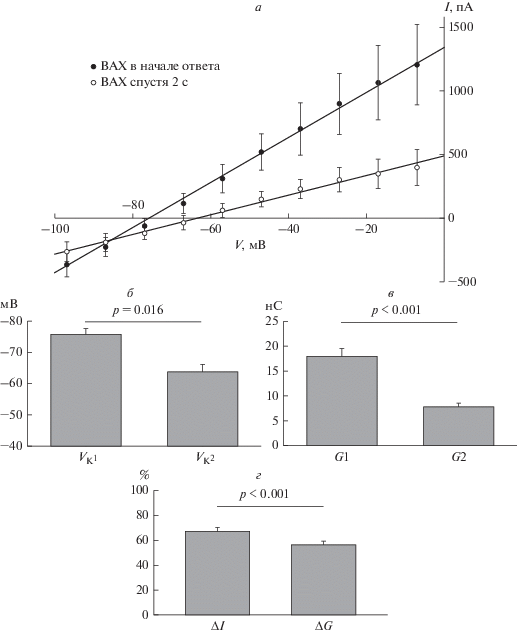
Усредненные ВАХ калиевых токов были построены по описанной выше методике в разные моменты времени от их активации (рис. 3а). Как видно из рис. 3а, за 2 с, в течение которых Kv-каналы были открыты, изменились не только проводимость мембраны, но и потенциал реверсии калиевых токов. Проводимость потенциал-зависимых калиевых каналов снизилась на 57% с 17.9 ± 1.6 нС до 7.8 ± 0.8 нС (p < 0.001, парный t‑критерий Стьюдента, рис. 3б). VK сдвинулся в сторону положительных значений на 12 мВ, от –76 ± ± 2 мВ до –64 ± 1 мВ (p = 0.016, тест Уилкоксона, рис. 3в). При этом относительное падение амплитуды калиевого тока за 2 с при мембранном потенциале –7 мВ достоверно превосходит относительное падение проводимости мембраны для ионов калия: амплитуда тока снизилась на 67.3 ± 2.9%, тогда как проводимость мембраны упала только на 56.5 ± 3.1% (p < 0.001, парный t-критерий Стьюдента, рис. 3г). Таким образом, непосредственно измеряемый ионный ток спадал быстрее, чем проводимость мембраны.
Рис. 3.
Изменения параметров ВАХ потенциал-зависимых калиевых токов со временем. а – ВАХ потенциал-зависимых калиевых токов в начале ответа (черные точки) и спустя 2 с (белые точки). б – Потенциалы реверсии для калиевых токов в начале ответа (VK1) и спустя 2 с (VK2). в – Проводимость Kv-каналов в начале ответа (G1) и спустя 2 с (G2). г – Относительная величина спада (в %) амплитуды тока (∆I) и проводимости мембраны (∆G) за 2 с потенциал-зависимого калиевого тока. На рисунке обозначены статистические достоверности отличий по парному t-критерию Стьюдента или критерию Уилкоксона потенциалов реверсии (б, p = 0.016), значений проводимости (в, p < 0.001), величины спада (%) амплитуды тока и проводимости мембраны (г, p < 0.001).
Изменения внутриклеточной концентрации ионов калия
Внутриклеточная концентрация ионов калия в начале потенциал-зависимого калиевого тока и спустя 2 с вычислялась при помощи уравнения (3). Как показали расчеты, в начале тока [K+]i составляла ~105 мМ, а через 2 с ~73 мМ; таким образом, изменение составило ~32 мМ.
Для того чтобы оценить, насколько сильно контролируется [K+]i за счет быстрого обмена содержимым между пипеткой и клеткой, был произведен теоретический расчет предельного значения ∆[K+]i при условии, что выходящие ионы калия не замещаются в результате его входа из пэтч-пипетки. Количество заряда (∆Q), которое вышло из клетки в результате потенциал-зависимого калиевого тока за 2 с между регистрацией двух ВАХ, было вычислено как площадь под графиком силы тока от времени (рис. 1б) за время между ступеньками командного потенциала. Как показали расчеты, за 2 с из клетки вышло 1515 ± 138 нКл (n = 7). В анализ были включены клетки схожих размеров и формы, характерный пример приведен на рис. 2. В качестве приближенного объема клетки был взят объем конуса с диаметром основания и высотой, равными 15 мкм (884 мкм3), что примерно соответствует характерным размерам включенных в анализ нейронов (см. рис 2). На основании того, что объем цитозоля vequ по ряду оценок [20, 34] составляет приблизительно 50% от общего объема клетки, при помощи уравнения (3) было высчитано предельное теоретическое значение ∆[K+]i, которое составило 35.6 мМ. Данное значение лишь незначительно выше оцененного с помощью уравнения Нернста. Это указывает на низкую эффективность пэтч-пипетки в поддержании [K+]i в ходе эксперимента.
Моделирование поведения внутриклеточной концентрации ионов калия при высокоамплитудных токах для случая линейной зависимости ионного тока от мембранного потенциала
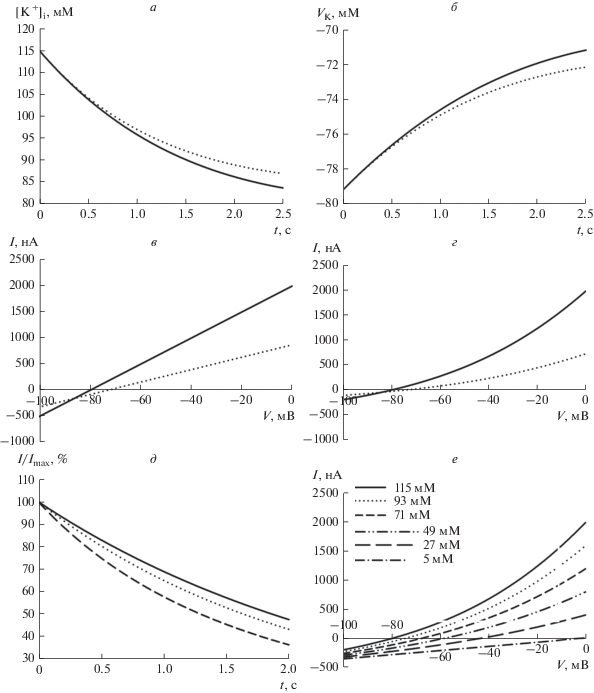
С помощью теоретического моделирования поведения [K+]i удалось качественно воспроизвести результаты, полученные в ходе эксперимента. Для этого система дифференциальных уравнений (4), (5), (6), в которой для трансмембранного тока использовалась линейная зависимость от мембранного потенциала (уравнение (7)), с набором начальных условий (уравнения (11), (12), (13)) численно решалась в среде Wolfram Mathematica 10. Ключевым параметром модели является временная константа диффузионного обмена между клеткой и пипеткой (τdiff). Модель хорошо воспроизводит все полученные результаты в случае, если ее значение составляет несколько секунд. На рис. 4 приведены результаты моделирования при условии τdiff = 6 с. При данной временной константе в моделируемой клетке происходит изменение [K+]i вследствие потока данных ионов через мембрану (рис. 4а), что порождает изменение потенциала реверсии для калиевого тока (рис. 4б). В результате ВАХ калиевого тока сдвигаются вправо по ходу ответа (рис. 4в, ВАХ построены с помощью подстановки вычисленных значений C1(t) и g(t), соответствующих моментам времени t = 0 с и t = 2 с, в уравнение (7)). Из-за того, что по ходу ответа снижается не только количество открытых ионных каналов, но и движущая сила для ионов калия, амплитуда калиевого тока спадает быстрее, чем проводимость мембраны для этих ионов (рис. 4д). Таким образом, если использовать кинетику спада тока для оценки скорости инактивации калиевых каналов, то последняя может быть переоценена.
Рис. 4.
Моделирование потенциал-зависимого калиевого тока в условиях непостоянства внутриклеточных ионных концентраций. а – Изменение внутриклеточной концентрации ионов калия со временем ([K+]i) по ходу ответа Kv-каналов на ступеньку командного потенциала и б – изменение равновесного потенциала для ионов калия (VK) со временем. Сплошными линиями обозначены изменения [K+]i и VK при линейных ВАХ, пунктирными – при ВАХ по уравнению ГХК. в и г – ВАХ смоделированных потенциал-зависимых калиевых токов в начале ответа (сплошные линии) и спустя 2 с (пунктирные линии). Случаи линейных ВАХ (в) и ВАХ, подчиняющихся уравнению ГХК (г). д – Сопоставление спадов амплитуды калиевого тока за время активации Kv-каналов. Референсный спад ионного тока (сплошная линия) наблюдался бы в случае отсутствия изменений внутриклеточных ионных концентраций), происходит по тому же экспоненциальному закону, что и спад проводимости или проницаемости мембраны для ионов калия. Спад тока с ВАХ по уравнению ГХК (штриховая линия) и линейными ВАХ (пунктирная линия), при наличии падения концентрации внутриклеточных ионов калия во время ответа, происходит быстрее, чем референсный спад. е – Совокупность ВАХ, подчиняющаяся уравнению ГХК построена для одинакового значения проницаемости мембраны для ионов калия, равного начальному значению из модели, но для разных [K+]i (на рисунке для каждой ВАХ указана [K+]i).
Моделирование поведения внутриклеточной концентрации ионов калия при высокоамплитудных токах для случая нелинейной зависимости ионного тока от мембранного потенциала
Использованная нами линейная зависимость силы тока от мембранного потенциала (уравнение (7)) хотя и широко используется для моделирования трансмембранного тока, в то же время недостаточно хорошо подходит для описания протекания токов ионов калия в случае неравенства их концентраций по разные стороны мембраны [35]. Данное уравнение предполагает, что способность мембраны проводить ионы калия определяется только величиной их трансмембранного градиента, при этом она не учитывает изменения проводимости мембраны вследствие снижения внутриклеточной концентрации ионов калия. Ранее было показано, что для корректного описания процесса электродиффузии ионов калия в канале необходимо использовать более биофизически обоснованные модели [35, 36]. Хотя модели, учитывающие центры связывания иона в канале, в целом позволяют предсказать более точно согласующиеся с экспериментом ВАХ трансмембранного тока [36, 37], зачастую уравнение ГХК (уравнение (9)), являющееся следствием приближения постоянного электрического поля в мембране, дает удовлетворительное сходство с экспериментальными данными [36, 38–41].
Для корректного учета влияния внутриклеточной концентрации ионов на проводимость мембраны производилось решение системы дифференциальных уравнений (4), (5), (6), в которой для трансмембранного тока использовалось уравнение ГХК (уравнение (9)). Аналогично рассмотренному выше случаю линейной ВАХ, рассчитанная внутриклеточная концентрация ионов калия снижалась по ходу ответа (рис. 4а), что приводило к увеличению потенциала реверсии для калиевого тока (рис. 4б). Таким образом, ВАХ калиевого тока спустя 2 с от начала ответа была смещена влево относительно начальной и имела меньший наклон (рис. 4г). Но при этом наклон ВАХ снижался не только за счет деактивации каналов и снижения движущей силы для ионов калия, но и за счет снижения внутриклеточной концентрации этих ионов как такового (рис. 4е), что в совокупности приводит к еще большему ускорению спада ионного тока и еще большему его расхождению с временным течением процесса спада проницаемости мембраны для ионов калия (рис. 4д). Для того чтобы нагляднее проиллюстрировать этот процесс, на рис. 4е приведена совокупность ВАХ, подчиняющихся уравнению ГХК, построенных при одинаковом значении проницаемости мембраны для ионов калия, но отличающихся значениями внутриклеточной концентрации этого иона. В этом случае, несмотря на одинаковую способность мембраны пропускать ионы калия, наклон ВАХ все равно снижается с уменьшением внутриклеточной концентрации иона.
ОБСУЖДЕНИЕ
В настоящем исследование было продемонстрировано, что в условиях регистрации высокоамплитудных калиевых токов методом пэтч-кламп в конфигурации “целая клетка” нельзя считать, что пэтч-пипетка эффективно поддерживает постоянство внутриклеточной концентрации этого иона. При регистрации потенциал-зависимого выходящего калиевого тока за 2 с происходило увеличение потенциала реверсии для ионов калия на 12 мВ, что свидетельствует о снижении их внутриклеточной концентрации на ~32 мМ. Чтобы оценить вклад пэтч-пипетки в поддержание [K+]i, было рассчитано теоретическое значение ∆[K+]i в случае, если бы в ходе измерений полностью отсутствовал обмен ионов калия между клеткой и пэтч-пипеткой. Как показали расчеты, в этом случае [K+]i должна была бы измениться на 35.6 мМ, что лишь незначительно превышает наблюдаемый в ходе эксперимента прирост концентрации. Таким образом, можно заключить, что при высокоамплитудном калиевом токе вклад пэтч-пипетки в поддержание [K+]i является крайне незначительным, из-за чего [K+]i не успевает релаксировать к своему равновесному значению в ходе 2-секундной записи.
В работе было показано, что в условиях пэтч-кламп-эксперимента спад амплитуды калиевого тока происходил быстрее спада проводимости мембраны для ионов калия, что указывает на то, что инактивация калиевых каналов – не единственный процесс, опосредующий спад ионного тока. Экспериментальные результаты были воспроизведены при помощи математической модели потенциал-зависимого калиевого тока, протекающего в условиях ограниченного обмена содержимым между пэтч-пипеткой и клеткой. При этом моделирование было произведено для двух случаев: случай линейных ВАХ потенциал-зависимого калиевого тока и случай ВАХ, согласующихся с уравнением ГХК. Моделирование показало, что наблюдаемое расхождение спада ионного тока и спада проводимости мембраны для ионов калия обусловлено двумя факторами: во-первых, изменения [K+]i приводят к сдвигу потенциала реверсии и, следовательно, к снижению движущей силы для ионов калия, что напрямую влияет на величину амплитуды тока; во-вторых, снижение [K+]i само по себе приводит к снижению проводимости мембраны независимо от деактивации калиевых каналов. Последний фактор возможно учесть только при использовании уравнения ГХК для описания ВАХ калиевого тока.
Таким образом, кинетика спада амплитуды тока в условиях пэтч-кламп-эксперимента некорректно отражает свойства Kv-каналов, а непостоянство [K+]i в ходе регистрации может привести к завышенным оценкам скорости инактивации потенциал-зависимых калиевых каналов, которая в большом числе экспериментальных работ оценивается именно по спаду амплитуды тока [9, 11, 22–26]. Возможно, что результаты исследований, в которых изменения [K+]i не были учтены, могут потребовать уточнения.
Ранее было описано и смоделировано аналогичное по своей природе изменение внутриклеточной концентрации ионов хлора в ходе пэтч-кламп-регистрации высокоамплитудных ГАМК-опосредованных токов. Показано, что непостоянство внутриклеточной концентрации ионов хлора приводит к значительному искажению оценок скорости десенситизации ГАМКА-рецепторов [20, 21]. Таким образом, есть основания предполагать, что подобное изменение внутриклеточных ионных концентраций при регистрации высокоамплитудных токов в режиме фиксации напряжения является универсальной закономерностью, которую необходимо учитывать при интерпретации результатов экспериментов.
Работа выполнена в рамках государственного задания Минобрнауки России (тема “Нейрофизиологические механизмы регуляции функций и их эволюция”, рег. ЦИТиС № АААА-А18-118012290372-0).
Список литературы
Gutman G.A., Chandy K.G., Grissmer S., Lazdunski M., McKinnon D., Pardo L.A., Robertson G.A., Rudy B., Sanguinetti M.C., Stühmer W., Wang X. 2005. International Union of Pharmacology. LIII. Nomenclature and molecular relationships of voltage-gated potassium channels. Pharmacological Reviews. 57, 473–508.
Hille B. 2001. Ion channels of excitable membranes. Sunderland, Mass: Sinauer, 814 p.
Lai H.C., Jan L.Y. 2006. The distribution and targeting of neuronal voltage-gated ion channels. Nature Reviews. Neuroscience. 7, 548–562.
Manganas L.N., Akhtar S., Antonucci D.E., Campomanes C.R., Dolly J.O., Trimmer J.S. 2001. Episodic ataxia type-1 mutations in the Kv1.1 potassium channel display distinct folding and intracellular trafficking properties. J. Biol. Chem. 276, 49427–49434.
Delisle B.P., Anson B.D., Rajamani S., January C.T. 2004. Biology of cardiac arrhythmias: ion channel protein trafficking. Circulation Research. 94, 1418–1428.
Yellen G. 2002. The voltage-gated potassium channels and their relatives. Nature. 419, 35–42.
Camerino D.C., Tricarico D., Desaphy J.-F. 2007. Ion channel pharmacology. Neurotherapeutics. J. Amer. Soc. for Experimental NeuroTherapeutics. 4, 184–198.
Zhou B.Y., Ma W., Huang X.Y. 1998. Specific antibodies to the external vestibule of voltage-gated potassium channels block current. J. Gen. Physiol. 111, 555–563.
Yu S.P., Kerchner G.A. 1998. Endogenous voltage-gated potassium channels in human embryonic kidney (HEK293) cells. J. Neuroscience Research. 52, 612–617.
Wilson S.M., Pappone P.A. 1999. P2 receptor modulation of voltage-gated potassium currents in Brown adipocytes. J. Gen. Physiol. 113, 125–138.
Xu C., Lu Y., Tang G., Wang R. 1999. Expression of voltage-dependent K+ channel genes in mesenteric artery smooth muscle cells. Amer. J. Physiology Gastrointestinal and Liver Physiology. 277, G1055–G1063.
Bekkers J.M. 2000. Distribution and activation of voltage-gated potassium channels in cell-attached and outside-out patches from large layer 5 cortical pyramidal neurons of the rat. J. Physiology. 525, 611–620.
Misonou H., Thompson S.M., Cai X. 2008. Dynamic regulation of the Kv2.1 Voltage-gated potassium channel during brain ischemia through neuroglial interaction. J. Neuroscience. 28, 8529–8538.
Ding S., Zhou F.-M. 2011. Profiling voltage-gated potassium channel mRNA expression in nigral neurons using single-cell RT-PCR techniques. J. Visualized Experiments. 55, 2–5.
Wu B.-M., Wang X.-H., Zhao B., Bian E.-B., Yan H., Cheng H., Lv X.-W., Xiong Z.-G., Li J. 2013. Electrophysiology properties of voltage-gated potassium channels in rat peritoneal macrophages. Int. J. Clinical and Experimental Medicine. 6, 166–173.
Pusch M., Neher E. 1988. Rates of diffusional exchange between small cells and a measuring patch pipette. Pflügers Archiv: Europ. J. Physiol. 411. 204–211.
Oliva C., Cohen I.S., Mathias R.T. 1988. Calculation of time constants for intracellular diffusion in whole cell patch clamp configuration. Biophys. J. 54, 791–799.
Mathias R.T., Cohen I.S., Oliva C. 1990. Limitations of the whole cell patch clamp technique in the control of intracellular concentrations. Biophys. J. 58, 759–770.
Le Foll F., Soriani O., Vaudry H., Cazin L. 2000. Contribution of changes in the chloride driving force to the fading of I(GABA) in frog melanotrophs. Amer. J. Physiol. Endocrinology and Metabolism. 278, E430–E443.
Karlsson U., Druzin M., Johansson S. 2011. Cl(-) concentration changes and desensitization of GABA(A) and glycine receptors. J. Gen. Physiology. 138, 609–626.
Yelhekar T.D., Druzin M., Karlsson U., Blomqvist E., Johansson S. 2016. How to properly measure a current-voltage relation?—interpolation vs. ramp methods applied to studies of GABAA receptors. Frontiers in Cellular Neuroscience. 10, 10.
Cahalan M.D., Chandy K.G., DeCoursey T.E., Gupta S. 1985. A voltage-gated potassium channel in human T lymphocytes. J. Physiol. 358, 197–237.
Maruyama Y. 1987. A patch-clamp study of mammalian platelets and their voltage-gated potassium current. J. Physiol. 391, 467–485.
Deutsch C., Lee S.C. 1989. Modulation of K+ currents in human lymphocytes by pH. J. Physiol. 413, 399–413.
Choquet D., Korn H. 1992. Mechanism of 4-aminopyridine action on voltage-gated potassium channels in lymphocytes. J. Gen. physiology. 99, 217–240.
Cameron M.A., Abed A. Al, Buskila Y., Dokos S., Lovell N.H., Morley J.W. 2017. Differential effect of brief electrical stimulation on voltage-gated potassium channels. J. Neurophysiology. 117, 2014–2024.
Neher E. 1992. Correction for liquid junction potentials in patch clamp experiments. Methods in Enzymology. 207, 123–131.
Bertollini L., Biella G., Wanke E., Avanzini G., de Curtis M. 1994.Fluoride reversibly blocks HVA calcium current in mammalian thalamic neurones. Neuroreport. 5, 553–556.
Kay A.R., Miles R., Wong R.K. 1986. Intracellular fluoride alters the kinetic properties of calcium currents facilitating the investigation of synaptic events in hippocampal neurons. J. Neurosci. 6, 2915–2920.
Kostyuk P.G., Krishtal O.A., Shakhovalov Y.A. 1977. Separation of sodium and calcium currents in the somatic membrane of mollusc neurones. J. Physiol. (Lond.). 270, 545–568.
Kang J., Huguenard J.R., Prince D.A. 2000. Voltage-gated potassium channels activated during action potentials in layer V neocortical pyramidal neurons. J. Neurophysiology. 83, 70–80.
Goldman D.E. 1943. Potential, impedance, and rectification in membranes. J. Gen. Physiol. 27, 37–60.
Hodgkin A.L., Katz B. 1949. The effect of sodium ions on the electrical activity of the giant axon of the squid. J. Physiol. 108, 37–77.
Alberts B. 2008. Molecular biology of the cell. 5th ed. New York: Garland Science, 1268 p.
Clay J.R. 2009. Determining k channel activation curves from K channel currents often requires the goldman-hodgkin-katz equation. Front Cell Neurosci. 3, 20.
Clay J.R. 1991. A paradox concerning ion permeation of the delayed rectifier potassium ion channel in squid giant axons. J. Physiol. (Lond.). 444, 499–511.
Bormann J., Hamill O.P., Sakmann B. 1987. Mechanism of anion permeation through channels gated by glycine and gamma-aminobutyric acid in mouse cultured spinal neurones. J. Physiol. 385, 243–86.
Frankenhaeuser B. 1962. Delayed currents in myelinated nerve fibres of Xenopus laevis investigated with voltage clamp technique. J. Physiology. 160, 40–45.
Binstock L., Goldman L. 1971. Rectification in instantaneous potassium current-voltage relations in Myxicola giant axons. J. Physiol. (Lond.). 217, 517–531.
Siegelbaum S.A., Camardo J.S., Kandel E.R. 1982. Serotonin and cyclic AMP close single K+ channels in Aplysia sensory neurones. Nature. 299, 413–417.
Taglialatela M., Stefani E. 1993. Gating currents of the cloned delayed-rectifier K+ channel DRK1. Proc. Natl. Acad. Sci. U.S.A. 90, 4758–4762.
Дополнительные материалы отсутствуют.
Инструменты
Биологические мембраны: Журнал мембранной и клеточной биологии