Биологические мембраны: Журнал мембранной и клеточной биологии, 2019, T. 36, № 4, стр. 271-280
Модуляция холестерин-зависимой активности макрофагов IC-21 пептидом, содержащим два CRAC-мотива из белка М1 вируса гриппа
А. Я. Дунина-Барковская a, *, Х. С. Вишнякова b, Л. А. Баратова a, В. А. Радюхин a, **
a НИИ физико-химической биологии им. А.Н. Белозерского,
Московский государственный университет им. М.В. Ломоносова,
119991 Москва, Ленинские Горы, 1, стр. 40, Россия
b Институт молекулярной биологии им. В.А. Энгельгардта РАН,
119991 Москва, ул. Вавилова, 32, Россия
* E-mail: dunina@belozersky.msu.ru
** E-mail: varvic@belozersky.msu.ru
Поступила в редакцию 20.03.2019
После доработки 27.03.2019
Принята к публикации 28.03.2019
Аннотация
Холестерин является регулятором активности многих мембранных белков. У ряда белков идентифицированы холестерин-распознающие мотивы (cholesterol-recognizing amino acid consensus, CRAC). Такие мотивы имеются в белке М1 вируса гриппа. С целью изучения функциональной роли и механизмов действия пептидов, содержащих CRAC-мотивы, был синтезирован пептид RTKLWEMLVELGNMDKAVKLWRKLKR-NH2 (пептид Р4) на основе комбинации двух пептидов, соответствующих амфипатическим CRAC-содержащим α-спиралям 3 и 6 белка М1. Показано, что пептид Р4 меняет холестерин-зависимое взаимодействие культивируемых макрофагов IC-21 с 2-мкм латексными частицами, имитирующими бактерии. Эффект пептида Р4 был дозозависимым, имел двухфазный характер и был более выраженным, чем описанные ранее эффекты составляющих его пептидов. При концентрациях от 0.5 до 10 мкМ пептид Р4 значительно увеличивал число частиц, связанных клетками; при дозах 10–20 мкМ адгезивная активность клеток снижалась; при концентрациях 20–50 мкМ пептид Р4 угнетал адгезию клеток к субстрату и оказывал токсическое действие. При удалении мембранного холестерина с помощью метил-β-циклодекстрина угнетающие эффекты пептида Р4 развивались при существенно более низких концентрациях. Стимулирующий эффект пептида Р4, наблюдаемый при низких концентрациях, может быть обусловлен тем, что CRAC-содержащий пептид Р4 способствует образованию обогащенных холестерином мембранных доменов. Угнетающее действие при высоких концентрациях пептида Р4 может объясняться нарушением работы холестерин-зависимых мембранных рецепторов вследствие вызванной пептидом дезорганизации взаимодействий этих рецепторов с холестерином. Новый пептид Р4 может быть полезен для исследований холестерин-зависимых процессов в клетке, а также может служить основой для разработки антивирусных и иммуномодулирующих препаратов.
ВВЕДЕНИЕ
Холестерин является интегральным компонентом мембраны животной клетки, необходимым для ее нормального функционирования. Активность многих мембранных белков – рецепторов, ионных каналов, ферментов, транспортеров – модулируется холестерином [1–7]. Холестерин-зависимыми являются важнейшие клеточные процессы – адгезия, локомоция, эндоцитоз, фагоцитоз и др. [8–12]. Более того, многие патогенные бактерии и вирусы используют холестерин и холестерин-зависимые процессы при инфицировании клетки [13–18]. Распределение холестерина в клеточных компартментах очень неоднородно и строго контролируется. Нарушения распределения, транспорта и метаболизма холестерина могут приводить к патологическим состояниям, наиболее известное из которых – развитие атеросклеротических повреждений, ведущих к тяжелым последствиям [19, 20]. Поэтому понимание механизмов взаимодействий белков с холестерином и путей регуляции холестерин-зависимых клеточных процессов является важнейшей задачей фундаментальной и прикладной биологии.
Предполагается, что один из возможных механизмов взаимодействия холестерина с белками основан на существовании у белков холестерин-распознающей аминокислотной консенсусной последовательности (CRAC, Cholesterol-Recognition/Interaction Amino acid Consensus). Этот термин был предложен в работе Li & Papadopoulos, 1998 [21]. Авторы показали, что у бензодиазепинового рецептора периферического типа (PBR, позже переименованного в белок-транслокатор, TSPO [22]), осуществляющего транспорт холестерина в митохондриях, есть необходимый для связывания холестерина участок с аминокислотной последовательностью ATVLNYYVWRDNS. Авторы изучили аминокислотные последовательности других белков, имеющих отношение к транспорту и метаболизму холестерина, и обнаружили мотивы, похожие на холестерин-связывающую последовательность из PBR. Для этих мотивов, названных CRAC, предложена общая формула L/V-(X)(1-5)-Y-(X)(1-5)-R/K. В дальнейшем появились варианты этой формулы (cholesterol consensus motif (CCM), sterol sensing motif (SSM) и др. [23–25]), но общая идея сохранилась: для успешного взаимодействия трансмембранного домена белка с холестерином нужна определенная последовательность аминокислот с неполярными (изолейцин Ile, валин Val, лейцин Leu), ароматическими (тирозин Y, триптофан W) и положительно заряженными (аргинин R или лизин K) боковыми цепочками [23–25].
Гипотеза о существовании и функциональном значении холестерин-связывающих доменов у мембранных белков простимулировала серию экспериментальных исследований, в ходе которых создавались CRAC-содержащие пептиды и оценивалось их действие на холестерин-зависимые процессы в искусственных [26–28] и клеточных [29–32] системах. В работах Epand и соавт. на липидных бислоях [26–28] было показано, что CRAC-пептиды вызывают формирование богатых холестерином доменов. В 2001 г. Papadopoulos с соавторами продемонстрировал [29], что CRAC-пептид угнетает транспорт холестерина бензодиазепиновым рецептором периферического типа. В нашей работе [33] CRAC-мотив был выявлен у рецепторов фагоцитоза FcγR, а эксперименты с использованием синтетического CRAC-содержащего пептида VLNYYVW показали возможность модуляции этим пептидом фагоцитозной активности макрофагов IC-21 [30, 31]. В дальнейшем на этой же клеточной системе было проверено действие синтетических CRAC-содержащих пептидов не клеточного, а вирусного происхождения, а именно – пептидов, соответствующих 3-й, 6-й и 13-й амфипатическим α-спиралям белка М1 вируса гриппа [34]. Эти CRAC-содержащие α-спирали белка М1 могут иметь функциональное значение при формировании обогащенной холестерином вирусной оболочки из мембраны клетки-хозяина [35, 36]. Мы обнаружили [34], что эти пептиды по-разному модулируют холестерин-зависимую активность макрофагов IC-21. Однако взаимосвязь между структурой CRAC-содержащих пептидов и их эффектами пока остается непонятной.
В данной работе с целью дальнейшего исследования функциональной роли и молекулярных механизмов действия CRAC-содержащих пептидов на холестерин-зависимые процессы был синтезирован пептид на основе комбинации двух пептидов, использованных в работе [34], – LEVLMEWLKTR и NNMDKAVKLYRKLK. Эти пептиды представляют собой две отдельные амфипатические α-спирали с экспонированными CRAC-доменами, связанными гибкой петлей и, вероятно, вовлеченными во взаимодействие с рафтовой мембраной вирионов вируса гриппа [35, 36]. В данной работе мы показали, что новый пептид RTKLWEMLVELGNMDKAVKLWRKLKR-NH2 (далее – пептид Р4), содержащий два CRAC-мотива, оказывает более сильное действие на активность макрофагов по сравнению с эффектами составляющих его пептидов. Влияние метил-β-циклодекстрина (mβCD), экстрагирующего холестерин из мембраны, на дозозависимость эффекта пептида Р4 свидетельствует о том, что эффект этого пептида зависит от содержания холестерина в мембране.
МАТЕРИАЛЫ И МЕТОДЫ
Пептид. Пептид Р4 (RTKLWEMLVELGNMD-КAVKLWRKLKR-NH2 ; 26 а.к., мол. масса ~3200 Да) синтезирован в ООО Синейро (Syneuro Co. Ltd., Россия). Пептид Р4 содержит в своем составе два α-спиральных CRAC-содержащих пептида: LEVLMEWLKTR (α-спираль 3 белка М1 вируса гриппа, “пептид 1” из работы [34]) и NNMDKAVKLWRKLK (α-спираль 6 белка М1 вируса гриппа, модифицированный “пептид 2” из работы [34], с заменой тирозина на триптофан). Пептид LEVLMEWLKTR использован в обратной последовательности, что соответствует ориентации α-спиралей 3 и 6 в третичной структуре белка М1 [35, 36]. В пептиде Р4 α-спиральные участки двух составляющих пептидов соединены гибкой петлей, образованной межспиральными неструктурированными участками.
Перед экспериментом пептид Р4 растворяли в диметилсульфоксиде (DMSO, MP Biomedicals, Франция) до концентрации 0.2–5 мМ (в этом виде при хранении в холодильнике (4°С) пептид сохранял активность по меньшей мере 2 недели). В эксперименте к клеткам добавляли необходимое количество раствора пептида в DMSO для получения конечной концентрации 0.5–50 мкМ; конечная концентрация DMSO не превышала 1%.
Культура клеток. Эксперименты проводили на клетках линии IC-21 перитонеальных макрофагов мыши (ATCC no. TIB-186™). Клетки культивировали в модифицированной по Дульбекко среде Игла (DMEM, PanEco, Россия) с 10% эмбриональной телячьей сыворотки (FBS, Biolot, Россия), 2 мМ L-глутамина (PanEco, Россия) и 40 ед/мл гентамицина (PanEco, Россия) в атмосфере 5% CO2 при 37°C. Клетки пересевали дважды в неделю с помощью раствора Версена (PanEco, Россия). За 2 дня до эксперимента клетки высевали на 6-луночные планшеты (Costar) с плотностью ~105 клеток на лунку.
Протокол эксперимента и определение фагоцитозного индекса. Действие пептидов на фагоцитозную активность определяли по числу ассоциированных с клетками флуоресцентно меченных 2-мкм латексных микросфер, как описано ранее [30, 31, 34] с небольшими модификациями. Клетки в 6-луночных планшетах предварительно инкубировали при 37°C в атмосфере CO2 в течение 1 ч в среде DMEM без сыворотки (2 мл на лунку), чтобы минимизировать угнетающее влияние сыворотки на фагоцитозную активность [37]. Затем к клеткам добавляли альбумин (1 мг/мл), исследуемый пептид или DMSO в соответствующей концентрации (контроль), а также флуоресцентно меченные частицы (Fluoresbrite Carboxy YG 2.0 Micron Microspheres, Polysciences, Inc., PA, США) в количестве ~8 × 106 частиц на лунку, и инкубировали при 37°C в атмосфере CO2 в течение 1 ч. После инкубации клетки трижды промывали солевым раствором на фосфатном буфере (PBS) для удаления свободных и слабо связанных с клетками частиц и фиксировали 2.5% раствором глутарового альдегида (Ted Pella, США) в PBS.
Опыты с использованием mβCD (Sigma, США) проводили следующим образом. На этапе инкубации клеток в среде DMEM без сыворотки (см. выше) в эту среду добавляли mβCD в требуемой концентрации. Затем, согласно одному протоколу, к клеткам добавляли альбумин, пептид и частицы, проводили инкубацию, промывку и фиксацию клеток стандартным способом. По другому протоколу после 1-ч инкубации клеток в присутствии mβCD среду с mβCD удаляли, к клеткам добавляли свежую среду без сыворотки и без mβCD, вносили альбумин, пептид и частицы, как описано выше. Этот протокол минимизировал контакт пептида с mβCD.
Фиксированные клетки исследовали с помощью флуоресцентного микроскопа Zeiss Axiovert 200M (Carl Zeiss, Германия), оборудованного цифровой видеокамерой ORCAII-ERG2 (Hamamatsu, Япония) и соответствующим программным пакетом (Axiovision 4.5, Carl Zeiss Imaging). В каждой лунке фотографировали 10–15 случайно выбранных полей зрения в режиме фазового контраста, а также в режиме флуоресценции частиц и глутарового альдегида (возбуждение/ эмиссия при 490/520 и 520/590 нм соответственно). Число частиц, связанных с клетками, подсчитывали с помощью специально адаптированного приложения к программе ImageJ [31, 37]. Среднее число частиц на одну клетку для данной лунки (“фагоцитозный индекс”) считали параметром, характеризующим активность клеток. Для оценки фагоцитозного индекса использовали по ~200 клеток в каждой лунке. Этот экспериментальный параметр включает не только поглощенные частицы, но и частицы, плотно связанные с поверхностью клеток; однако этот показатель достаточно точно отражает фагоцитозную активность клеток в условиях эксперимента (инкубации длительностью 1 ч), поскольку связывание частицы с поверхностью фагоцита является необходимым условием фагоцитоза [38, 39].
Ранее мы показали, что фагоцитозный индекс клеток IC-21 зависит от плотности культуры [31]; поэтому в экспериментах мы использовали только культуры с низкой плотностью (10–50 клеток в поле зрения, что соответствует примерно 2–10% от плотного монослоя) и сравнивали между собой показатели, только если плотности культуры различались не более чем на 25%. Данные представлены как среднее ± SE (стандартная ошибка), число независимых экспериментов (4–8) указано в подписях к рисункам. Статистическую значимость различий между группами оценивали с помощью анализа ANOVA one-way. Графическую и статистическую обработку данных проводили с помощью встроенных программ OriginPro 7.5 (OriginLab Corporation, США).
РЕЗУЛЬТАТЫ
Концентрационная зависимость эффекта пептида Р4. Рис. 1 иллюстрирует изменение активности макрофагов IC-21, инкубированных в присутствии пептида Р4. В диапазоне концентраций пептида Р4 от 0.5 до 10 мкМ наблюдалось значительное (в некоторых опытах в 2–3 раза) увеличение числа частиц на клетку по сравнению с контролем. Концентрация пептида Р4, при которой достигалась максимальная стимуляция, варьировала от опыта к опыту и находилась в диапазоне 0.5–10 мкМ. При концентрациях 10–20 мкМ стимулирующий эффект пептида сменялся угнетением: фагоцитозный индекс уменьшался до контрольного уровня или ниже. Кроме того, при ~20 мкМ пептида наблюдалось ослабление адгезии клеток к субстрату: они легко удалялись при промывке и фиксации, а оставшиеся клетки имели характерную шарообразную форму (рис. 2в). При концентрации пептида 50 мкМ, помимо значительного снижения адгезии клеток к субстрату и уменьшения числа частиц на клетку, появлялись признаки токсического действия пептида Р4: на микрофотографиях (рис. 2г) видны поврежденные клетки (контрастированные ядра, фрагменты клеток). Концентрационная зависимость эффекта пептида Р4, построенная на основании восьми независимых экспериментов, представлена на рис. 1б. Морфологические изменения клеток в присутствии пептида Р4 иллюстрирует рис. 2.
Рис. 1.
Концентрационная зависимость влияния пептида Р4 на активность макрофагов. а – Репрезентативный эксперимент; по оси ординат – среднее число связанных с клеткой частиц ± стандартная ошибка (SE); среднее получено на основании измерений на ~200 клетках; б – концентрационная зависимость эффекта пептида Р4, построенная на основании восьми опытов; по оси ординат – активность клеток в % от контрольного значения. Контролем служили клетки, инкубированные без пептида, в присутствии соответствующей концентрации DMSO и 1 мг/мл альбумина.
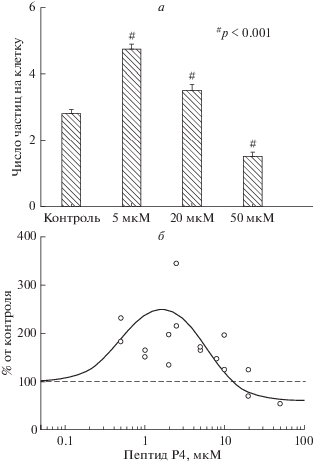
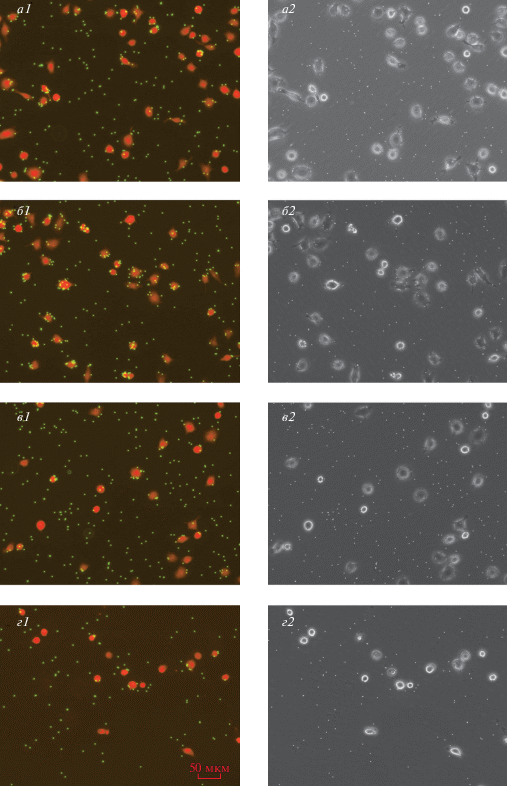
Рис. 2.
Микрофотографии, иллюстрирующие дозозависимое влияние пептида Р4 на активность макрофагов IC-21. а1, а2 – Контроль; б1, б2 – 5 мкМ пептида Р4; в1, в2 – 20 мкМ пептида Р4; г1, г2 – 50 мкМ пептида Р4. Фото слева (а1, б1, в1, г1) – флуоресценция (красный и зеленый каналы), справа (а2, б2, в2, г2) – фазовый контраст. Масштабная полоска – 50 мкм.
Влияние метил-β-циклодекстрина (mβCD). Для того чтобы выявить холестерин-зависимую компоненту взаимодействий частиц с клетками, а также выяснить, влияет ли удаление холестерина на эффекты пептида Р4, мы использовали mβCD – циклический олигосахарид, экстрагирующий холестерин из клеточной мембраны и широко применяемый в экспериментальной практике для модуляции содержания холестерина в мембране (см. обзоры [40–42]). Молекула mβCD имеет гидрофобную полость, в которую включается молекула холестерина. Такое устройство молекулы mβCD позволяет быстро и обратимо экстрагировать мембранный холестерин [40–42]. Ранее [31, 34, 37] мы показали, что mβCD в диапазоне концентраций 5–15 мМ угнетает активность макрофагов. Рис. 3 иллюстрирует концентрационную зависимость влияния mβCD на активность макрофагов в отсутствие и в присутствии пептида Р4 (один из шести подобных опытов). В этом эксперименте использован пептид Р4 в концентрации 5 мкМ и mβCD в двух концентрациях – 2 и 5 мМ. В присутствии 2 мМ mβCD активность клеток практически не отличается от контрольного уровня (соответственно 1.60 ± 0.07 и 1.76 ± 0.06 частиц на клетку (контроль), р > 0.05), а в присутствии 5 мМ mβCD фагоцитозный индекс снижается до 1.01 ± 0.05, что составляет 57% от контроля (p < 0.001). Пептид Р4 при концентрации 5 мкМ повышает фагоцитозный индекс до 2.91 ± ± 0.09 частиц на клетку (165% от контроля, p < 0.001). Этот эффект 5 мкМ пептида дозозависимо угнетается mβCD: в присутствии 2 мМ mβCD фагоцитозный индекс снижается до 1.84 ± 0.07, а в присутствии 5 мМ mβCD стимулирующий эффект 5 мкМ пептида полностью подавлен, и фагоцитозный индекс составляет 0.84 ± 0.04 частиц на клетку, что достоверно ниже контрольного значения (p < 0.001), а также ниже фагоцитозного индекса в присутствии 5 мМ mβCD без пептида (p < 0.05).
Рис. 3.
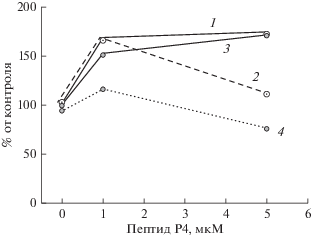
Дозозависимое влияние метил-β-циклодекстрина на активность макрофагов IC-21 и на эффект 5 мкМ пептида Р4 (данные одного опыта из шести аналогичных; каждая точка получена на основании измерений на ~200 клетках). а – Диаграмма, иллюстрирующая изменение активности макрофагов в присутствии пептида Р4 и mβCD. б, в – Данные опыта, представленного на диаграмме (а), в координатах активность vs. концентрация пептида Р4 (б) и в координатах активность vs. концентрация mβCD (в). Обозначения на (б): 1 – без mβCD; 2 – 2 мМ mβCD; 3 – 5 мМ mβCD. Обозначения на (в): 1 – без пептида; 2 – в присутствии 5 мкМ пептида.
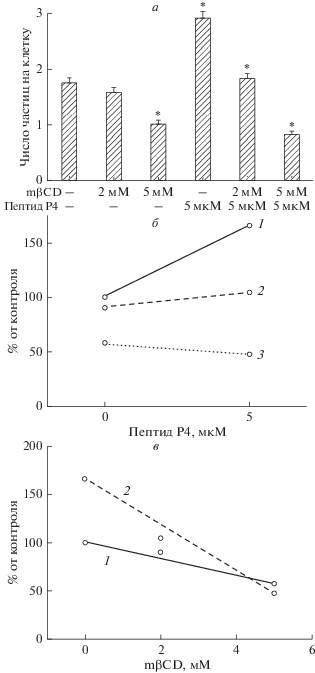
Рис. 4 иллюстрирует другой эксперимент, в котором оценивали влияние mβCD (5 мМ) на эффекты, производимые пептидом Р4 в концентрациях 2 и 10 мкМ. В присутствии 5 мМ mβCD кривая доза–эффект для пептида Р4 идет ниже, чем без mβCD (рис. 4а). Кроме того, при более высокой концентрации пептида Р4 (10 мкМ) угнетающий эффект mβCD выражен существенно сильнее, чем при более низкой концентрации пептида Р4 (2 мкМ) (рис. 4б). Такой результат означает, что угнетающее действие циклодекстрина на эффект пептида нельзя объяснить тем, что циклодекстрин связывает пептид и поэтому предотвращает его стимулирующий эффект. Незначительный вклад возможного связывания пептида P4 c циклодекстрином подтверждается экспериментом, в котором после 1 ч инкубации клеток в присутствии mβCD среду с циклодекстрином удаляли, чтобы исключить контакт пептида с mβCD (рис. 5). Как показывает рис. 5, после удаления холестерина 5- или 10-мМ циклодекстрином активность клеток в присутствии 5 мкМ пептида Р4 существенно ниже, чем в присутствии 1 мкМ пептида Р4.
Рис. 4.
Метил-β-циклодекстрин угнетает эффект пептида Р4. а – Концентрационные зависимости эффекта пептида Р4 в отсутствие mβCD (1) и в присутствии 5 мМ mβCD (2), данные одного опыта (n = 5). б – Угнетающий эффект 5 мМ mβCD сильнее при более высокой концентрации пептида Р4. Обозначения на (б): 1 – в отсутствие пептида; 2 – в присутствии 2 мкМ пептида; 3 – в присутствии 10 мкМ пептида.
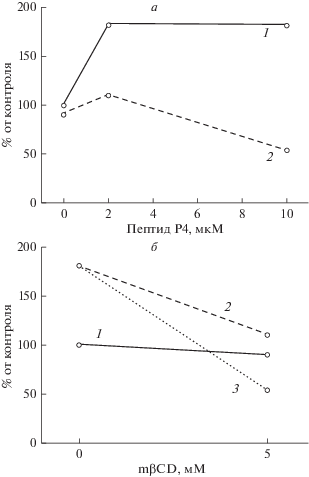
Рис. 5.
Метил-β-циклодекстрин угнетает эффект пептида Р4, другой протокол опыта. После предварительной инкубации клеток в присутствии mβCD в концентрации 5 мМ (белые символы) или 10 мМ (серые символы) среду с mβCD удаляли для исключения контакта mβCD с пептидом. Кривые 1 и 3 – концентрационные зависимости эффекта пептида Р4 без mβCD; 2 и 4 – после инкубации клеток в присутствии 5 и 10 мМ mβCD соответственно. Угнетающий эффект mβCD при данной концентрации сильнее в присутствии 5 мкМ пептида, чем в присутствии 1 мкМ пептида (n = 4).
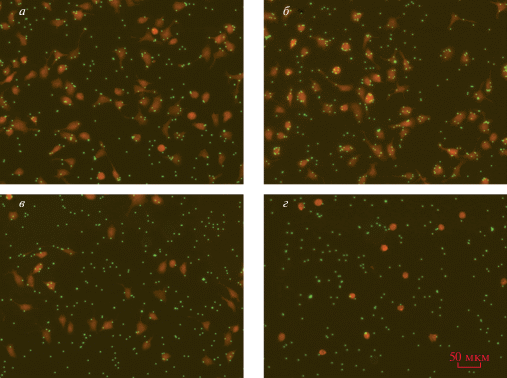
При комбинированной аппликации пептида Р4 и mβCD мы обнаружили, что в присутствии mβCD токсический эффект пептида Р4 развивается при гораздо более низких концентрациях пептида, чем без mβCD. Это иллюстрирует рис. 6. При концентрации 5 мкМ пептид Р4 значительно увеличивает фагоцитозный индекс по сравнению с контролем (рис. 6а, 6б); 10 мМ mβCD снижает число частиц на клетку без влияния на адгезию и без токсического эффекта (рис. 6в). После инкубации клеток в присутствии 5 мкМ пептида P4 и 10 мМ mβCD (рис. 6г) наблюдается токсический эффект, подобный тому, что наблюдался в отсутствие mβCD при действии 50 мкМ пептида Р4, т.е. в 10 раз более высокой его концентрации (см. рис. 2г).
Рис. 6.
Влияние метил-β-циклодекстрина на дозозависимость эффекта пептида Р4. а – Контроль; б – 5 мкМ пептида Р4; в – 10 мМ mβCD; г – 5 мкМ пептида Р4 + 10 мМ mβCD. Приведены микрофотографии в режиме флуоресценции (красный и зеленый каналы). При сочетании пептида Р4 и mβCD в нетоксичных концентрациях развивается токсический эффект. Масштабная полоска – 50 мкм.
ОБСУЖДЕНИЕ
В данной работе нами сконструирован новый пептид Р4, RTKLWEMLVELGNMDKAVKLWRKLKR-NH2, на основе пептидов LEVLME- WLKTR и NNMDKAVKLYRKLK, соответствующих CRAC-содержащим α-спиралям 3 и 6 из белка М1 вируса гриппа [35, 36]. Оказалось, что пептид Р4 влияет на холестерин-зависимую активность культивируемых макрофагов IC-21. Эффект пептида Р4 был сильнее, чем эффекты составляющих его пептидов, и развивался при более низких концентрациях. Так, пептид Р4 вызывал увеличение активности клеток в 2–3 раза от контрольного уровня при концентрациях 0.5–2 мкМ, в то время как максимальное изменение активности, вызываемое пептидами LEVLMEWLKTR и NNMDKAVKLYRKLK, достигалось при концентрациях 2–5 и 20–30 мкМ и составляло 15 и 60% от контроля соответственно [34]. Концентрационная зависимость эффекта пептида Р4 носила выраженный колоколообразный характер: при концентрациях от 0.5 до ~10 мкМ фагоцитозный индекс был значительно выше контрольного значения; при концентрациях 10–20 мкМ индекс снижался, а также наблюдалось ухудшение адгезии клеток к субстрату; при концентрации 50 мкМ появлялся токсический эффект. При экстракции холестерина из мембраны с помощью mβCD [40–42] стимулирующее действие пептида Р4 дозозависимо подавлялось, а угнетающее и токсическое действие развивалось при более низких концентрациях пептида Р4. Это свидетельствует о том, что наблюдаемые эффекты пептида Р4 зависят от содержания холестерина в мембране.
Мы предполагаем, что сложное модулирующее влияние пептида Р4 на холестерин-зависимую активность макрофагов может быть обусловлено как его действием на формирование богатых холестерином доменов в мембране – рафтов [25–28, 43], так и нарушением взаимодействий холестерин-зависимых белков с холестерином [29]. Это предположение объясняет концентрационную зависимость эффекта пептида Р4 и дозозависимое влияние mβCD на эффекты пептида Р4. Действительно, при низких концентрациях Р4 (до 10–20 мкМ) этот пептид может стимулировать образование рафтов за счет доступного мембранного холестерина и способствовать агрегации холестерин-зависимых рецепторов; это выражается в увеличении числа связанных клетками частиц (рис. 1, рис. 2а, 2б). При повышении концентрации (от 20 до 50 мкМ) пептид Р4 может препятствовать работе холестерин-зависимых и ассоциированных с рафтами рецепторов, нарушая взаимодействия этих рецепторов с холестерином (например, конкурируя за холестерин). Это отражается как на количестве связанных частиц, так и на качестве адгезии клеток: снижается фагоцитозный индекс и адгезия клеток (рис. 1, рис. 2а, 2в). Появление токсического действия пептида Р4 при концентрации 50 мкМ можно объяснить образованием в мембране олигомеров пептида, которые могут обладать канальной активностью. Формирование неселективных пор в мембранах описано для амфипатических антимикробных пептидов [43–45]. Холестерин-секвестрирующий агент mβCD удаляет холестерин из мембраны и сдвигает соотношение пептид/холестерин в сторону пептида, и поэтому в присутствии mβCD дозозависимость эффекта пептида Р4 смещается в сторону меньших его концентраций: антиадгезионные и токсические эффекты пептида Р4 наблюдаются при концентрациях ниже 10 мкМ.
В целом, наши данные свидетельствуют о том, что синтетический пептид RTKLWEMLVELGNMDKAVKLWRKLKR-NH2 активен в отношении холестерин-зависимых процессов в макрофагах IC-21, и эффекты пептида Р4 зависят от содержания холестерина в мембране. Более высокая активность нового пептида Р4 по сравнению с активностью составляющих его α-спиралей белка М1 вируса гриппа может быть связана с тем, что входящие в состав пептида Р4 CRAC-содержащие α-спирали ориентированы так же, как и в третичной структуре белка М1, что позволяет им более эффективно взаимодействовать с клеточной мембраной [36]. Таким образом, полученные результаты можно интерпретировать в рамках гипотезы о холестерин-распознающей аминокислотной консенсусной последовательности [21, 23–26, 28, 29]. Однако для объяснения механизмов взаимодействий белков с холестерином в клеточных системах требуются дальнейшие исследования. Нам представляется перспективным использование CRAC-содержащих пептидов в этих исследованиях, результаты которых могут стать основой для дизайна новых пептидных модуляторов холестерин-зависимых клеточных процессов.
Работа проведена при частичной поддержке грантов РФФИ № 16-04-00563 и №18-04-01363.
Список литературы
Mukherjee S., Zha X., Tabas I., Maxfield F.R. 1998. Cholesterol distribution in living cells: Fluorescence imaging using dehydroergosterol as a fluorescent cholesterol analog. Biophys. J. 75, 1915–1925.
Levitan I., Fang Y., Rosenhouse-Dantsker A., Romanenko V. 2010. Cholesterol and ion channels. Subcell. Biochem. 51, 509–549. https://doi.org/10.1007/978-90-481-8622-8_19
Bukiya A.N., Durdagi S., Noskov S., Rosenhouse-Dantsker A. 2017. Cholesterol up-regulates neuronal G protein-gated inwardly rectifying potassium (GIRK) channel activity in the hippocampus. J. Biol. Chem. 292 (15), 6135–6147. https://doi.org/10.1074/jbc.M116.753350
Poveda J.A., Giudici A.M., Renart M.L., Molina M.L., Montoya E., Fernández-Carvajal A., Fernández-Bal-lester G., Encinar J.A., González-Ros J.M. 2014. Lipid modulation of ion channels through specific binding sites. Biochim. Biophys. Acta. 1838 (6), 1560–1567. https://doi.org/10.1016/j.bbamem.2013.10.023
Coddou C., Yan Z., Obsil T., Huidobro-Toro J.P., Stojilkovic S.S. 2011. Activation and regulation of purinergic P2X receptor channels. Pharmacol. Rev. 63 (3), 641–683. https://doi.org/10.1124/pr.110.003129
Murrell-Lagnado R.D. 2017. Regulation of P2X purinergic receptor signaling by cholesterol. Curr. Top. Membr. 80, 211–232. https://doi.org/10.1016/bs.ctm.2017.05.004
Kwiatkowska K., Frey J., Sobota A. 2003. Phosphorylation of FcγRIIA is required for the receptor-induced actin rearrangement and capping: The role of membrane rafts. J. Cell Sci. 116, 989–998.
Oh H., Mohler E.R. III, Tian A., Baumgart T., Diamond S.L. 2009. Membrane cholesterol is a biomechanical regulator of neutrophil adhesion. Arterioscler. Thromb. Vasc. Biol. 29, 1290–1297.
Sitrin R.G., Sassanella T.M., Landers J.J., Petty H.R. 2010. Migrating human neutrophils exhibit dynamic spatiotemporal variation in membrane lipid organization. Am. J. Respir. Cell Mol. Biol. 43, 498–506.
Stuart A.E., Davidson A.E. 1963. The effect of intravenous cholesterol oleate on the phagocytic function of the reticulo-endothelial system. Br. J. Exp. Pathol. 44, 24‒30.
Conner S.D., Schmid S.L. 2003. Regulated portals of entry into the cell. Nature. 422 (6927), 37–44.
Lajoie P., Nabi I.R. 2007. Regulation of raft-dependent endocytosis. J. Cell Mol. Med. 11 (4), 644–653.
Viswanathan G., Jafurulla M., Kumar G.A., Raghunand T.R., Chattopadhyay A. 2015. Dissecting the membrane cholesterol requirement for mycobacterial entry into host cells. Chem. Phys. Lipids. 189, 19–27.
Carter G.C., Bernstone L., Sangani D., Bee J.W., Harder T., James, W. 2009. HIV entry in macrophages is dependent on intact lipid rafts. Virology. 386, 192–202.
Dou X., Li Y., Han J., Zarlenga D.S., Zhu W., Ren X., Dong N., Li. X., Li G. 2018. Cholesterol of lipid rafts is a key determinant for entry and post-entry control of porcine rotavirus infection. BMC Vet. Res. 14 (1), 45. https://doi.org/10.1186/s12917-018-1366-7
Lafont F., van der Goot F.G. 2005. Bacterial invasion via lipid rafts. Cell. Microbiol. 7 (5), 613–620. https://doi.org/10.1111/j.1462-5822.2005.00515.x
Gatfield J., Pieters J. 2000. Essential role for cholesterol in entry of mycobacteria into macrophages. Science. 288, 1647–1650.
Ouellet H., Johnston J.B., Ortiz de Montellano P.R. 2011. Cholesterol catabolism as a therapeutic target in Mycobacterium tuberculosis. Trends Microbiol. 19 (11), 530–539.
Tabas I. 2002. Consequences of cellular cholesterol accumulation: Basic concepts and physiological implications. J. Clin. Invest. 110 (7), 905–911. https://doi.org/10.1172/JCI16452
Sorci-Thomas M.G., Thomas M.J. 2016. Microdomains, inflammation and atherosclerosis. Circ Res. 118 (4), 679–691. https://doi.org/10.1161/CIRCRESAHA.115.306246
Li H., Papadopoulos V. 1998. Peripheral-type benzodiazepine receptor function in cholesterol transport. Identification of a putative cholesterol recognition/interaction amino acid sequence and consensus pattern. Endocrinology. 139, 4991–4997.
Papadopoulos V., Baraldi M., Guilarte T.R., Knudsen T.B., Lacapere J.J., Lindemann P.L., Norenberg M.D., Nutt D., Weizman A., Zhang M.R., Gavish M. 2006. Translocator protein (18kDa): New nomenclature for the peripheral-type benzodiazepine receptor based on its structure and molecular function. Trends Pharmacol. Sci. 27, 402–409.
Song Y., Kenworthy A.K., Sanders Ch.R. 2014. Cholesterol as a co-solvent and a ligand for membrane proteins. Protein Science. 23, 1–22.
Miller C.M., Brown A.C., Mittal J. 2014. Disorder in cholesterol-binding functionality of CRAC peptides: A molecular dynamics study. J. Phys. Chem. B. 118, 13169–13174.
Epand R.F., Thomas A., Brasseur R., Vishwanathan S.A., Hunter E., Epand R.M. 2006. Juxtamembrane protein segments that contribute to recruitment of cholesterol into domains. Biochemistry. 45, 6105–6114.
Epand R.M., Sayer B.G., Epand R.F. 2003. Peptide-induced formation of cholesterol-rich domains. Biochemistry. 42, 14677–14689.
Epand R.M., Sayer B.G., Epand R.F. 2005. Caveolin scaffolding region and cholesterol-rich domains in membranes. J. Mol. Biol. 345, 339–350.
Epand R.M. 2008. Proteins and cholesterol-rich domains. Biochim. Biophys. Acta. 1778, 1576–1582.
Li H., Yao Z., Degenhardt B., Teper G., Papadopoulos V. 2001. Cholesterol binding at the cholesterol recognition/interaction amino acid consensus (CRAC) of the peripheral-type benzodiazepine receptor and inhibition of steroidogenesis by an HIV TAT-CRAC peptide. Proc. Natl. Acad. Sci. USA. 98 (3), 1267–1272.
Дунина-Барковская А.Я., Вишнякова Х.С., Чешев Д.А., Чеканов Н.Н., Бужурина И.М. 2007. Действие диметилсульфоксида и холестерин-связывающих пептидов на фагоцитозную активность макрофагов IC-21. Биол. мембраны. 24, 451–456.
Вишнякова Х.С., Киреев И.И., Дунина-Барковская А.Я. 2011. Влияние плотности культуры на параметры фагоцитоза у макрофагов линии IC-21. Биол. мембраны. 28, 387–396.
Dunina-Barkovskaya A. 2012. Cholesterol-binding peptides and phagocytosis. in Protein Interactions. Eds Cai J., and Wang R.E. Croatia: IntechOpen, pp. 275–290. https://doi.org/10.5772/38255
Чешев Д.А., Чеканов Н.Н., Дунина-Барковская А.Я. 2006. Холестерин-связывающие участки в трансмембранных доменах интегральных мембранных белков, участвующих в фагоцитозе и способных к агрегации в липидных рафтах. Биол. мембраны. 23 (1), 69–73.
Дунина-Барковская А.Я., Вишнякова Х.С., Головко А.О., Арутюнян А.М., Баратова Л.А., Батищев О.В., Радюхин В.А. 2018. Амфипатические CRAC-содержащие пептиды-фрагменты белка М1 вируса гриппа модулируют холестерин-зависимую активность макрофагов IC-21. Биохимия. 83 (8), 1235–1246. (Англ. Версия: Biochemistry (Moscow), 83 (8): 982–991)
Tsfasman T., Kost V., Markushin S., Lotte V., Koptiaeva I., Bogacheva E., Baratova L., Radyukhin V. 2015. Amphipathic alpha-helices and putative cholesterol binding domains of the influenza virus matrix M1 protein are crucial for virion structure organization. Vir. Res. 210, 114–118.
Radyukhin V.A., Dadinova L.A., Orlov I.A., Baratova L.A. 2018. Amphipathic secondary structure elements and putative cholesterol recognizing amino acid consensus (CRAC) motifs as governing factors of highly specific matrix protein interactions with raft-type membranes in enveloped viruses. J. Biomol. Str. Dynam. 36, 1351–1359.
Головкина М.С., Скачков И.В., Метелев М.В., Кузеванов А.В., Вишнякова Х.С., Киреев И.И., Дунина-Барковская А.Я. 2009. Угнетающее действие сыворотки на фагоцитозную активность макрофагов IC-21. Биол. мембраны. 26, 379–386.
Ueda M.J., Ito T., Ohnishi S., Okada T.S. 1981. Phagocytosis by macrophages. I. Kinetics of adhesion between particles and phagocytes. J. Cell Sci. 51, 173–188.
Дунина-Барковская А.Я. 2004. Фагоцитоз – три в одном: эндоцитоз, экзоцитоз, адгезия. Биол. мембраны. 21, 243–270.
Zidovetzki R., Levitan I. 2007. Use of cyclodextrins to manipulate plasma membrane cholesterol content: Evidence, misconceptions and control strategies. Biochim. Biophys. Acta. 1768, 1311–1324.
Kurkov S.V., Loftsson Th. 2013. Cyclodextrins. Int. J. Pharmaceutics. 453, 167–180.
Leclercq L. 2016. Interactions between cyclodextrins and cellular components: Towards greener medical applications? Beilstein J. Org. Chem. 12, 2644–2662.
Hanson J.M., Gettel D.L., Tabaei S.R., Jackman J., Kim M.C., Sasaki D.Y., J Groves.T., Liedberg B., Cho N.-J., Parikh A.N. 2016. Cholesterol-enriched domain formation induced by viral-encoded, membrane-active amphipathic peptide. Biophys. J. 110, 176–187.
Cheng G., Montero A., Gastaminza P., Whitten-Bauer Ch., Wieland S.F., Isogawa M., Fredericksen B., Selvarajah S., Gallay Ph.A., Ghadiri M.R., Chisari F.V. 2008. A virocidal amphipathic α-helical peptide that inhibits hepatitis C virus infection in vitro. Proc. Natl. Acad. Sci. USA. 105 (8), 3088–3093.
Papo N., Oren Z., Pag U., Sahl H.-G., Shai Y. 2002. The consequence of sequence alteration of an amphipathic α-helical antimicrobial peptide and its diastereomers. J. Biol. Chem. 277 (37), 33 913–33 921.
Дополнительные материалы отсутствуют.
Инструменты
Биологические мембраны: Журнал мембранной и клеточной биологии


