Биологические мембраны: Журнал мембранной и клеточной биологии, 2019, T. 36, № 4, стр. 301-304
Изменение содержания стеринов тонопласта при осмотическом стрессе
И. С. Нестёркина a, В. В. Гурина a, Н. В. Озолина a, *, В. Н. Нурминский a
a Сибирский институт физиологии и биохимии растений СО РАН,
664033 Иркутск, ул. Лермонтова, 132, Россия
* E-mail: ozol@sifibr.irk.ru
Поступила в редакцию 13.02.2019
После доработки 18.03.2019
Принята к публикации 27.03.2019
Аннотация
Изучено содержание стеринов в вакуолярной мембране, выделенной из корнеплодов свеклы, подвергнутых гипо- и гиперосмотическому стрессу. Показано, что общее содержание стеринов снижалось при гипоосмотическом стрессе (89% от контроля) и не изменялось при гиперосмотическом стрессе. При обоих видах осмотического стресса в вакуолярной мембране увеличивалось содержание стигмастерина и кампестерина, тогда как содержание преобладающего стерина – β-ситостерина – снижалось. При обоих вариантах стрессового воздействия существенно увеличивалось соотношение стигмастерин/β-ситостерин. Полученные результаты говорят об изменениях в составе стеринов вакуолярной мембраны корнеплодов столовой свеклы при осмотическом стрессе и позволяют предположить, что стерины тонопласта принимают участие в защитных механизмах растительной клетки.
ВВЕДЕНИЕ
Резкое изменение условий окружающей среды вызывает развитие стресса у растений. Такие воздействия, как засуха, засоление почвы, низкие температуры, повышенный уровень радиации, загрязнение почвы солями тяжелых металлов, чрезмерное освещение и высокая температура, существенно влияют на жизнедеятельность растений и создают осмотический стресс [1]. Стресс, в зависимости от того, чем он вызван – недостатком воды или его избытком, подразделяют на гипер- и гипоосмотический соответственно. При стрессе происходят перестройки метаболизма, в том числе, на уровне клеточных мембран и мембранных липидов. Одна из основных групп мембранных липидов, обеспечивающая целостность мембраны – стерины [2]. Также известно, что стерины составляют основу рафтов – динамичных мембранных наноструктур, которые играют важную роль в механизмах передачи сигналов в клетке и в регуляции различных белков, включая аквапорины, участвующие в транспорте воды через мембраны [3]. При осмотическом стрессе содержание несвязанной воды в клетке меняется. Поступление и удержание воды внутри клетки во многом зависит от вакуолярной мембраны [4]. Тонопласт, как и другие клеточные мембраны, участвует в защите клетки от стрессовых воздействий, но до настоящего времени его роль в этом процессе недостаточно изучена. Изменение состава стеринов вакуолярной мембраны при осмотическом стрессе может быть одним из адаптационных механизмов растительной клетки. Нами изучено изменение в содержании стеринов тонопласта при гипо- и гиперосмотическом стрессовом воздействии.
МАТЕРИАЛЫ И МЕТОДЫ
Объектом исследования служили корнеплоды столовой свеклы (Beta vulgaris L.) сорт Модана. В экспериментах были использованы корнеплоды в период покоя, хранящиеся в течение нескольких месяцев при температуре 4–5°C. Корнеплоды подвергали гипо- и гиперосмотическому стрессу. Для создания гиперосмотического стресса корнеплоды в течение 3 суток выдерживали (подсушивали) на открытом воздухе при комнатной температуре, что приводило к снижению массы корнеплодов и увеличению осмоляльности клеточного сока. Для создания гипоосмотического стресса корнеплоды выдерживали в течение 1 суток в дистиллированной воде при комнатной температуре, из-за чего происходило насыщение клеток водой, и уменьшалась осмоляльность клеточного сока. Осмоляльность оценивали на осмометре ОМКА 1Ц-01 (Россия). В контрольном варианте использовали корнеплоды, не подвергнутые воздействию стресса.
Стрессовое воздействие на корнеплоды оценивали с использованием кондуктометрического метода [5]. Содержание диеновых конъюгатов определяли по методу [6]. Влияние осмотического стресса на барьерные свойства мембран (стабильность мембран) изучали с использованием цейтраферной видеосъемки [7]. Вакуолярные мембраны получали согласно [8]. Чистоту использованных в экспериментах изолированных мембран оценивали по наличию ферментов-маркеров [9]. Из вакуолярных мембран, выделенных из контрольных и подвергнутых разным видам стрессового воздействия корнеплодов, экстрагировали суммарные липиды по методу [10]. Стерины анализировали с помощью одномерной ТСХ с использованием системы растворителей для нейтральных липидов: гексан–диэтиловый эфир–уксусная кислота (80 : 20 : 1). Стерины, элюированные с пластинок хлороформом и этилацетатом, подвергали силилированию гексаметилдисилазаном и N,O-бис(тиметилсилил)ацетамидом. Образовавшиеся триметилсилильные производные стеринов анализировали с помощью хромато-масс-спектрометра GC–MS 7000/7890A TripleQuad, Agilent Technologies (США). Идентификацию стеринов проводили, сравнивая времена их удержания со стандартами, а также использовали библиотеки масс-спектров NIST08 и WILEY7. Количественный анализ проведен с использованием калибровочной кривой по холестерину, кампестерину, стигмастерину и β-ситостерину с помощью внутреннего стандарта, которым служил эргостерин.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
На первом этапе исследования были подобраны условия эффективного стрессового воздействия. При осмотическом стрессе происходили существенные изменения массы корнеплода столовой свеклы и осмотической концентрации клеточного сока. Так, при гиперосмотическом стрессе масса корнеплода снижалась на 20%, осмотическая концентрация клеточного сока увеличивалась на 13%, а при гипоосмотическом стрессе, наоборот, масса увеличивалась на 20%, а осмотическая концентрация снижалась на 12%. В 2 раза увеличивалось количество диеновых конъюгатов и при гипоосмотическом (209% от контроля), и при гиперосмотическом стрессе (185% от контроля). О нарушении проницаемости мембран судили по выходу электролитов из тканей корнеплодов, подвергнутых осмотическому стрессу, который увеличился почти в 1.5 раза по сравнению с контролем. При гипоосмотическом стрессе выход электролитов составил 161% от контроля, а при гиперосмотическом – 153%. Стабильность вакуолярных мембран по-разному снижалась при разных видах осмотического стресса. Более интенсивное разрушение вакуолей происходило при гипоосмотическом стрессе. Период полураспада составил 22% от контроля, тогда как при гиперосмотическом стрессе он составил 72% от контроля.
Содержание общих стеринов и отдельных видов стеринов в вакуолярной мембране при гипо- и гиперосмотическом стрессе представлено на рис. 1. Общее количество стеринов снижалось при гипоосмотическом стрессе и не изменялось при гиперосмотическом. Ранее неоднократно наблюдали снижение содержания стеринов в плазмалемме при холодовом стрессе [11, 12]. Среди мембранных липидов именно стерины наиболее существенно влияют на такие свойства мембраны, как текучесть и проницаемость [13]. Кроме того, стерины могут воздействовать на упаковку мембранных бислоев, взаимодействуя с другими мембранными липидами. Так, стерины могут взаимодействовать с насыщенными алкильными цепями фосфолипидов и сфинголипидов, ограничивая их подвижность [14]. Обнаруженное в наших экспериментах снижение содержания стеринов при гипоосмотическом стрессе может обеспечивать уменьшение микровязкости и повышение проницаемости тонопласта. Кроме этого очевидного адаптационного механизма, нужно учитывать, что стерины являются основой рафтовых структур, присутствующих в тонопласте. Рафты, например, участвуют в регуляции аквапоринов – белков, осуществляющих водную проницаемость мембран [15].
Рис. 1.
Суммарное содержание стеринов и их отдельных видов в тонопласте, выделенном из корнеплодов столовой свеклы в контроле, при гипо- и гиперосмотическом стрессе (мкг/г сухого веса (M ± SD, n = 5)). Содержание стеринов определяли методом газовой хроматографии/масс-спектрометрии.
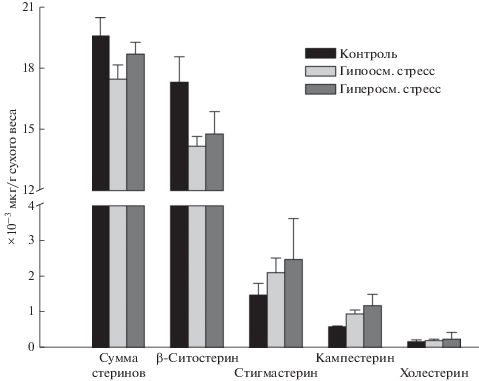
Уменьшение содержания общих стеринов в вакуолярной мембране при гипоосмотическом стрессе связано со снижением содержания преобладающего среди стеринов β-ситостерина. Содержание всех остальных стеринов увеличивалось. Особенно интересно значительное увеличение содержания таких стеринов, как кампестерин и стигмастерин, которые, как отмечено другими исследователями, являются “антистрессовыми” [16, 17]. Содержание общих стеринов достоверно не изменилось при гиперосмотическом стрессе, несмотря на существенные изменения в соотношении разных видов стеринов (табл. 1). Так, содержание β-ситостерина уменьшалось даже более заметно, чем при гипоосмотическом стрессе (с 88 до 79% от всех стеринов) и, соответственно, увеличилось содержание “антистрессовых” стеринов кампестерина и стигмастерина.
Таблица 1.
Относительное содержание разных видов стеринов от суммы стеринов тонопласта в контроле и при разных видах осмотического стресса
| Вариант опыта | Стерины | ||||
|---|---|---|---|---|---|
| β-ситостерин | стигмастерин | кампестерин | холестерин | стигмастерин/ β-ситостерин | |
| % от суммы стеринов | |||||
| Контроль | 88.43 | 7.59 | 3.05 | 0.93 | 0.09 |
| Гипоосмотический стресс | 81.21 | 12.11 | 5.47 | 1.21 | 0.15 |
| Гиперосмотический стресс | 79.02 | 13.32 | 6.35 | 1.31 | 0.17 |
Во всех вариантах опыта наблюдали также увеличение соотношения стигмастерин/β-ситостерин, вызывающее, по мнению ряда исследователей, активацию защитных механизмов растительной клетки [18, 19]. Увеличение содержания стигмастерина и снижение содержания β-ситостерина связано, вероятно, с тем, что β-ситостерин является предшественником стигмастерина. Оба этих стерина относятся к 24-этилстеринам, тогда как кампестерин это 24-метилстерин. Его молекула имеет меньшую свободу вращения С-17 углеводородной цепи благодаря более короткому размеру цепи, что позволяет плотнее упаковывать липидный бислой, и это приводит к снижению проницаемости мембраны для заряженных ионов [20]. Следует отметить, что стигмастерин способствует образованию рафтов [13], и эта его особенность тоже может быть связана с защитными механизмами.
Закономерности изменения в содержании стеринов тонопласта при разных видах осмотического стресса имеют черты сходства и отличия. Главное отличие состоит в содержании общих стеринов, которое уменьшается только при гипоосмотическом стрессе. С другой стороны, при обоих стрессах существенно уменьшается содержание β-ситостерина и значительно увеличивается содержание кампестерина и стигмастерина, а также увеличивается соотношение стигмастерин/β-ситостерин.
Таким образом, полученные данные показывают, что осмотический стресс приводит к изменению содержания стеринов тонопласта, и позволяют предположить, что стерины вакуолярной мембраны принимают участие в защите растительной клетки от стресса.
Работа выполнена с частичным использованием средств гранта РФФИ № 19-04-00013 на оборудовании ЦКП “Биоаналитика” Сибирского института физиологии и биохимии растений СО РАН (г. Иркутск).
Список литературы
Фомин Л.В. 2013. Регуляция водного режима растений. Вестник Алтайского государственного аграрного университета. 8, 63–69.
Kumar M.S., Mawlog I., Ali K., Tyagi A. 2018. Regulation of phytosterol biosynthetic pathway during drought stress in rice. Plant Physiol. Biochem. 129, 11–20.
Martinez-Ballesta Mdel C., Carvajal M. 2016. Mutual interactions between aquaporins and membrane components. Front. Plant Sci. 7, 1322.
Обручева Н.В., Синькевич И.А. 2010. Аквапорины и рост клеток. Физиол. растений. 57 (2), 163–176.
Грищенкова Н.Н., Лукаткин А.С. 2005. Определение устойчивости растительных тканей к абиотическим стрессам с использованием кондуктометрического метода. Поволжский экологический журн. 1, 3–11.
Владимиров Ю.А. 1972. Перекисное окисление липидов в биологических мембранах. М.: Наука, 252 с.
Нурминский В.Н., Озолина Н.В., Нестеркина И.С., Колесникова Е.В., Корзун А.М, Тихонов Н.В., Тарков М.С., Чернышов М.Ю., Саляев Р.К. 2011. Стабильность вакуолярных мембран растений при осмотическом стрессе и воздействии редокс-агентов. Биол. мембраны. 28, 224–229.
Саляев Р.К., Кузеванов В.Я., Хаптагаев С.Б., Копытчук В.Н. 1981. Выделение и очистка вакуолей и вакуолярных мембран из клеток растений. Физиол. растений. 28, 1295–1305.
Ozolina N.V., Nesterkina I.S., Kolesnikova E.V., Salyaev R.K., Nurminsky V.N., Rakevich A.L., Martynovich E.F., Chernyshov M.Yu. 2013. Tonoplast of Beta vulgaris L. contains detergent-resistant membrane microdomains. Planta. 237, 859–871.
Bligh E.G., Dyer W.J. 1959. A rapid method of total lipid extraction and purification. Can. J. Biochem. Physiol. 37, 911–917.
Uemura M., Joseph R.A., Steponkus P.L. 1995. Cold acclimation of Arabidopsis thaliana. Plant Physiol. 109, 15–30.
Takahashu D., Imai H., Kawamura Y. Uemura M. 2016. Lipid profiles of detergent resistant fractions of the plasma membrane in oat and rye in association with cold acclimation and freezing tolerance. Cryobiology. 72, 123–134.
Mongrand S., Morel J., Laroche J., Claverol S., Carde J.P., Hartmann M.A., Bonneu M., Simon-Plas F., Lessire R., Bessoule J.J. 2004. Lipid rafts in higher plant cells. J. Biol. Chem. 279, 36277–36286.
Schuler I., Milon A., Nakatani Y., Ourisson G., Albrecht A.M., Benveniste P., Hartman M.A. 1991. Differential effects of plant sterols on water permeability and on acyl chain ordering of soybean phosphatidylcholine bilayers. Proc. Natl. Acad. Sci. USA. 88, 6926–6930.
Koffman J.S., Arnspang E.C., Marlar S., Nejsum L.N. 2015. Opposing effects of cAMP and T259 phosphorylation on plasma membrane diffusion of the water channel aquaporin-5 in madin-darby canine kidney cells. PLoS ONE 10, e0133324. https://doi.org/10.1371/journal.pone.0133324
Kumar M.S., Ali K., Dahuia A., Tyagi A. 2015. Role of phytosterols in drought stress tolerance in rice. Plant Physiol. Biochem. 96, 83–89.
Валитова Ю.Н., Сулкарнаева А., Минибаева Ф.В. 2016. Растительные стерины: многообразие, биосинтез, физиологические функции. Биохимия. 18, 1050–1068.
Han P.P., Zhou J., Yuan Y.J. 2009. Analysis of phospholipids, sterols, and fatty acids in Taxus Chinensis var. mairei cells in response to shear stress. Biotechnol. Appl. Biochem. 54, 105–112.
Griebel T., Zeier J. 2010. A role for beta-sitosterol to stigmasterol conversion in plant-pathogen interactions. Plant J. 63, 253–268.
Edwards P.A., Green C. 1972. Incorporation of plant sterols into membranes and its retation to sterol absorption. FEBS Lett. 20, 97–99.
Дополнительные материалы отсутствуют.
Инструменты
Биологические мембраны: Журнал мембранной и клеточной биологии


