Биологические мембраны: Журнал мембранной и клеточной биологии, 2019, T. 36, № 5, стр. 373-380
Уабаин в низких концентрациях изменяет транскрипцию, не влияя на внутриклеточное содержание натрия и калия в нейронах мозга крысы
Л. В. Смольянинова a, b, *, А. А. Шиян a, Т. С. Клементьева c, А. А. Московцев c, А. А. Кубатиев c, С. Н. Орлов a, b, **
a Московский государственный университет им. М.В. Ломоносова, биологический факультет
119992 Москва, ул. Ленинские горы, 1, стр.12, Россия
b Национальный исследовательский Томский государственный университет
634050 Томск, просп. Ленина, 36, Россия
c Научно-исследовательский институт общей патологии и патофизиологии
125315 Москва, ул. Балтийская, 8,
Россия
* E-mail: smolyaninovalarisa1@gmail.com
** E-mail: sergeinorlov@yandex.ru
Поступила в редакцию 12.02.2019
После доработки 12.02.2019
Принята к публикации 15.02.2019
Аннотация
Ингибирование универсальной α1-изоформы Na+,K+-ATP-азы сопровождается резкими изменениями транскриптома клеток ряда тканей, опосредованными диссипацией градиента одновалентных катионов. В данном исследовании мы использовали резкое отличие сродства α1- и α3-Na+,K+-ATP-азы к уабаину для изучения участия α3-изоформы в регуляции внутриклеточной концентрации Na+ и K+ и экспрессии генов в первичной культуре гранулярных клеток мозжечка крыс. Добавление 100 нМ уабаина снижает активность Na+,K+-ATP-азы на 20%, что обусловлено ингибированием α3-изоформы фермента. В этой концентрации уабаин изменяет транскрипцию 17 генов с максимальным уровнем активации и ингибирования в ~2 и 1.5 раза соответственно. Полномасштабное ингибирование α1- и α3-Na+,K+-ATP-азы 1 мМ уабаином сопровождалось 50-кратным увеличением соотношения [Na+]i/[K+]i и изменением содержания мРНК 673 генов с максимальным уровнем активации и ингибирования в 20 и 3 раза соответственно. В отличие от 1 мМ уабаина, добавление 100 нМ уабаина не влияло на фосфорилирование Са2+-чувствительного регулятора транскрипции CREB. Таким образом, изменение экспрессии генов в нейронах при ингибировании α3-Na+,K+-ATP-азы низкими дозами уабаина не связано с увеличением [Na+]i/[K+]i, и активацией ${\text{Ca}}_{{\text{i}}}^{{2 + }}$-чувствительного механизма регуляции транскрипции.
ВВЕДЕНИЕ
Na+,K+-ATP-аза – трансмембранный белок состоящий из ~110 кДа α-субъединицы, ~35 кДа β-субъединицы и 8 кДа γ-субъединицы. Гидролиз АТР приводит к фосфорилированию Asp369 α-субъединицы, что обеспечивает электрогенный транспорт ионов (3Na+vs. 2K+) со скоростью 60–80 циклов в секунду. В дополнение к универсальной α1-изоформе нейроны обогащены α3-Na+,K+-ATP-азой, в то время как астроциты, кардиомиоциты и клетки скелетной мускулатуры содержат α2-изоформу этого фермента. Четыре изоформы β-субъединиц сильно гликозилированы и необходимы для ферментативной активности α-субъединицы и ее встраивания в плазматическую мембрану клеток. Функциональная значимость семи γ-субъединиц, содержащих мотив Pro-Phe-X-Tyr-Asp (FXYD), остается плохо изученной [1, 2].
Кардиотонические стероиды (КТС) известны как селективные ингибиторы Na+,K+-ATP-азы, обнаруженные как в растениях (карденолиды), так и у некоторых представителей животного царства (буфадиенолиды). Механизм ингибирования Na+,K+-ATP-азы кардиотоническими стероидами лучше всего изучен на примере водорастворимого карденолида уабаина, выделенного из Strophanthus gratus. Как и предполагалось, уабаин воздействует на большое количество клеточных функций, связанных с поддержанием трансмембранного градиента Na+ и K+, таких как электрический мембранный потенциал (Em), клеточный объем, трансэпителиальное движение солей и осмотически связанной воды, обмен Na+/H+ и Na+(K+)/Ca2+, симпорт Na+ с неорганическим фосфатом, глюкозой, аминокислотами, нуклеотидами и т.д. За последние 20 лет показано, что вместе с ранее перечисленными каноническими [Na+]i-, [K+]i-, Em-опосредуемыми клеточными ответами, кардиотонические стероиды могут воздействовать на экспрессию генов, мембранный транспорт, клеточную адгезию, пролиферацию и гибель клеток. Роль вклада ${\text{Na}}_{{\text{i}}}^{ + },{\text{K}}_{{\text{i}}}^{ + }$-зависимой и независимой сигнализации и этих неканонических клеточных ответах, запускаемых кардиотоническими стероидами, широко обсуждается [3–7].
В отличие от большинства других клеток пирамидные и зубчатые нейроны в коре головного мозга и в гиппокампе [8, 9], как и культивируемые гранулярные клетки [10, 11] обогащены α3-изоформой Na+,K+-ATP-азы. Munzer и соавт. показали, что при высокой внутриклеточной концентрации K+ и насыщающей концентрации внеклеточного K+ полумаксимальная активация уабаин-чувствительного входа 86Rb α1-, α2- и α3-изоформами Na+,K+-ATP-азы наблюдалась при концентрации цитоплазматического Na+$\left( {{\text{Na}}_{{\text{i}}}^{{\text{ + }}}} \right)$ ~18, 20 и 64 мМ соответственно [12]. Более низкая аффинность α3-изоформы к Na+i подтверждена в исследовании кинетики выхода Na+ из α1-α3-трансфицированных клеток HeLa, заполненных Na+-чувствительной флуоресцентной краской SBFI [13]. Исходя из этих данных предположили, что α1-Na+,K+-ATP-аза играет важную роль в поддержании низкого отношения [Na+]i/[K+]i в базальных условиях, в то время как α3-изоформы участвуют в нормализации прироста [Na+]i, вызванного длительным возбуждением нейронов [13–15].
Несколько исследовательских команд [16–18] показали, что у грызунов сродство α3-Na+,K+-ATP-азы к КТС на 3 порядка выше, чем у α1-изоформы. Так, используя трансфицированные фибробласты NIH3T3, O’Brien и соавт. показали, что стандартная аффинность α3-, α2- и α1-изоформ крысы к уабаину, посчитанная по связыванию [3H]-уабаина, составляет ~2, 115 и 48 000 нМ соответственно [16]. В клетках BALB/c 3T3, трансфицированных α3- и α1-Na+,K+ATP-азами крысы, полумаксимальное ингибирование входа 86Rb наблюдалась при концентрациях уабаина 8 × 10–8 и 4.5 × 10–5 M соответственно [17]. Эти резкие различия подтверждены сравнительным анализом дозозависимого действия уабаина на активность Na+,K+-ATP-азы в мозге крыс [18] и культивируемых нейронах из мозжечка крысы [19].
Ранее было установлено, что ингибирование α1-Na+,K+-ATP-азы сопровождается резкими изменениями транскриптома клеток ряда тканей, опосредованными диссипацией градиента одновалентных катионов и последующей активацией как Са2+-опосредованных, так и Са2+-независимых сигнальных систем [20]. В данном исследовании мы использовали резкое отличие сродства к уабаину α1- и α3-Na+,K+-ATP-азы для изучения участия α3-изоформы в регуляции внутриклеточной концентрации Na+ и K+ и экспрессии генов в первичной культуре гранулярных клеток мозжечка крыс.
МАТЕРИАЛЫ И МЕТОДЫ
Первичное культивирование гранулярных клеток мозжечка. Для приготовления первичной культуры гранулярных клеток мозжечка использовали 5–7-дневных крыс линии Wistar Kyoto. Животных содержали в стандартных условиях в виварии при естественном световом режиме и свободном доступе к воде и еде. Для получения первичной культуры клеток мозжечка проводили декапитацию животных, далее в стерильных условиях извлекали мозжечок, как описано ранее [21]. Диссоциацию клеток мозжечка производили с помощью 0.25% раствора трипсин-EDТА (ПанЭко, Россия) в течение 15 мин при 37°C. После инкубации клетки на 2–3 мин помещали в 2–3 мл 10% бычьей сыворотки для остановки реакции (ПанЭко, Россия). Клетки культивировали в нейробазальной среде (Gibco, США) содержащей 2% Supplement B-27 (Gibco, США), 0.5 мM GlutaMax (Gibco, США), 100 ед./мл пенициллина/стрептомицина (ПанЭко, Россия) и 20 мM KCl и с плотностью 1.2 × 105 клеток/см2 в шестилуночных плашках, обработанных поли-L-орнитином (Sigma, CША). Клетки культивировали при 37°C, 90% влажности, 5% CO2 в течение 7 дней. Цитозин β-D-арабинофуранозид (Sigma, CША) добавляли до конечной концентрации 10 мкМ после 24 ч нахождения клеток в культуральных плашках для ингибирования пролиферации астроцитов.
Количественный анализ содержания Na+ и K+ с помощью масс-спектрометрии с индуктивно связанной плазмой (ICP-MS). Клетки культивировали в 6‑луночных плашках с плотностью 1.2 × 105 клеток/см2. Через 3 ч после инкубации с уабаином, клетки дважды промывали холодным раствором 0.1 M MgCl2 и лизировали в 200 мкл трихлоруксусной кислоты (ТХУ). Лизаты переносили в микропробирки (0.5 мл) и инкубировали в течение 12 ч при 4°C. После инкубации образцы разбавляли до 500 мкл дважды деионизированной водой и проводили измерение на Varian 820-MS (США). Концентрации выбранных элементов (мг/л) измеряли методом внешней калибровки. Данные анализировали с помощью ICP-MS Expert, version 2.1 b-107 (США). Содержание Na+ и K+ выражали как миллионную долю (м.д.) на образец.
Измерение активности Na+,K+-ATP-азы. Клетки после инкубации с уабаином разрушали методом замораживания–оттаивания. Далее определение активности Na+,K+-ATP-азы проводили по накоплению неорганического фосфата, используя метод Ратбуна и Бетлах, основанный на применении хлористого олова в качестве восстановителя. Реакцию проводили в среде инкубации объемом 1 мл, содержащей 130 мМ NaCl, 20 мМ KCl, 30 мМ имидазола, 3 мМ MgCl2, 3 мМ ATP. Количество фермента и время инкубации подбирали экспериментально. Поскольку препараты белков содержали некоторое количество других ATP-аз, таких как Мg-ATP-аза, Ca2+-активируемая ATP-аза, H+-ATP-аза и ряд других, проводили две серии измерений: измеряли общую активность и уабаин-независимую активность в присутствии 1 мМ уабаина; активность Na+,K+-ATP-азы рассчитывали как разность этих активностей. Реакцию начинали добавлением ATP в пробу. Для остановки реакции использовали 3 M ацетатный буфер, содержащий 3.7% формальдегида с pH 4.3. Затем в пробы добавляли 0.1 мл 2% раствора молибдата аммония и 0.1 мл раствора хлорида олова, который готовили непосредственно перед определением (15 мг SnCl2, 4–5 капель концентрированной уксусной кислоты, 5 мл воды). В контрольную пробу после смешивания с ацетатным буфером добавляли белок. Окраска развивалась в течение 15 мин при комнатной температуре. Оптическую плотность раствора регистрировали на приборе Ultrospec 1100 (660 нм).
Выделение суммарной РНК. Суммарную РНК выделяли с помощью набора PureLink® RNA Mini Kit (Ambion, США) по протоколу производителя. Образцы суммарной РНК для предотвращения заражения геномной ДНК обрабатывали ДНКазой I (Thermo Fisher Scientific, США) в соответствии с протоколом производителя.
Анализ транскриптома методом микрочипов. Для анализа транскриптома методом микрочипов использовали образцы c показателем целостности РНК больше 7.0 (RIN). Качество РНК оценивали с помощью 2100 Bioanalyzer (Agilent Technologies, США). Для анализа транскриптомов контрольных и экспериментальных образцов использовали микрочипы GeneChip® Rat Gene 2.0 ST Array (Affymetrix, США). Суммарное количество транскриптов, определяемое данными микрочипами, составляет 28 407 (по базе RefSeq). Для пробоподготовки с помощью набора GeneChip® WT PLUS Reagent kits (Affymetrix, США) использовали 500 нг РНК. Данный набор проводит реакцию обратной транскрипции с использованием праймеров, связывающих нерибосомную РНК, с получением амплифицированной и биотинилированной ДНК. Далее кДНК (5.5 мг) фрагментировали и метили с помощью набора Affymetrix GeneChipH WT Terminal Labeling Kit (Affymetrix, США), и подвергали гибридизации кДНК (3.5 мг) на микрочипах, используя GeneChip® Hybridization, Wash and Stain Kit (Affymetrix, США). Совместную обработку CEL-файлов и оценку уровня экспрессии генов осуществляли в Affymetrix Expression Console (build 1.4.1.46) стандартным для используемых микрочипов методом RMA-Sketch. Статистический анализ проводили в Affymetrix Transcriptome Analysis Console 3.0. При сравнении групп применяли парный вариант анализа Repeated Measure (paired).
Вестерн-блотинг. Клетки после инкубации с уабаином промывали дважды холодным сбалансированным раствором Хенкса и лизировали в буфере RIPA (Sigma, США), содержащем коктейль ингибиторов протеаз и фосфатаз (Sigma, США). Общую концентрацию белка измеряли, используя набор DC Protein Assay Kit (Bio-Rad, США). Для разделения белков с помощью 15% SDS-PAGE использовали 15 мкг белка, а затем осуществляли электроперенос на PVDF-мембрану методом полусухого переноса. После электропереноса белков PVDF-мембраны блокировали и инкубировали с первичными антителами в течение ночи и с соответствующими вторичными антителами, конъюгированными с пероксидазой хрена (HRP). В работе использовали первичные антитела: фосфо-CREB (Ser133) (87G3) mAb (Cell Signaling, США); β-актин (D6A8) mAb (Cell Signaling Technology, США) и вторичные антитела IgG-HRP (Cell Signaling Technology, США). Визуализацию белков осуществляли с помощью наборов SuperSignal West Pico Chemiluminescent Substrate или SuperSignal West Femto Chemiluminescent Substrate (Thermo Fisher Scientific, США) в соответствии с протоколом производителя. Хемилюминесценцию измеряли, используя систему ChemiDoc XRS+ (Bio-Rad, США). Данные хемилюминесценции анализировали с помощью программного обеспечения Image Lab 3.0 (Bio-Rad, США). В каждом эксперименте контрольные значения были приняты за 100%. β-актин использовали как маркер равномерного нанесения белка.
Статистика. Данные анализировали с помощью программы GraphPad Prism4 с применением однофакторного дисперсионного анализа (ANOVA) и критерия Даннета. Различия считали статистически значимыми при p < 0.05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
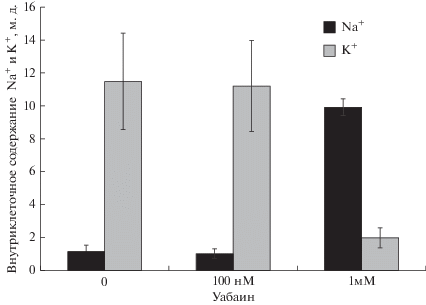
Сложный характер зависимости активности АТР-азы гранулярных клеток мозжечка от концентрации уабаина (рис. 1) согласуется с данными других исследований [22, 23], и указывает на наличие двух ферментов с высоким и низким сродством к этому ингибитору: высокоаффинной (Ki ~ 10–7 М) нейрон-специфической α3-Na+,K+-ATP-азы и низкоаффинной (Ki ~ 10–4 М) универсальной α1-Na+,K+-ATP-азы соответственно. Рис. 2 показывает, что инкубация α1- и α3-Na+,K+-ATP-азы гранулярных клеток мозжечка в течение 3 ч в присутствии 1 мМ уабаина приводит к увеличению ${\text{Na}}_{{\text{i}}}^{ + }$ в 8 раз и снижению в 6 раз содержания внутриклеточного калия $\left( {{\text{K}}_{{\text{i}}}^{ + }} \right).$ Мы не наблюдали значительного изменения этих параметров при селективном ингибировании КТС-чувствительной α3-Na+,K+-ATP-азы в присутствии 100 нМ уабаина (рис. 2). Эти результаты предполагают, что в базальных условиях ингибирование α3-Na+,K+-ATP-азы не влияет на внутриклеточную концентрацию Na+ и K+. Эти выводы согласуются с данными, полученными с помощью Na+-чувствительного флуоресцентного зонда SBFI. В этой работе установлено незначительное влияние 10–6 М уабаина на содержание натрия в культивируемых клетках гиппокампа крысы и нейронах стриатума в отличие от 7-кратного увеличения [Na+]i при воздействии 10–3 М уабаина [15].
Рис. 1.
Изменение активности Na+,K+-ATP-азы при действии разных концентраций уабаина. Представлены среднеарифметические значения и значения стандартной ошибки, полученные в трех независимых экспериментах. Исходное значение активности принято за 1.
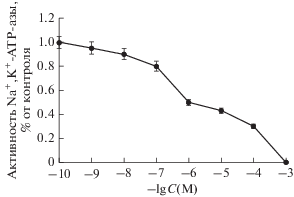
Рис. 2.
Действие уабаина на внутриклеточное содержание Na+ и K+ в первичной культуре нейронов мозжечка крыc. Клетки инкубировали в присутствии и в отсутствие 100 нМ и 1 мМ уабаина в течение 3 ч. Внутриклеточное содержание ионов выражено в м.д. Представлены среднеарифметические значения и значения стандартной ошибки, полученные в трех независимых экспериментах.
Из представленных в табл. 1 данных видно, что ингибирование α3-Na+,K+-ATP-азы в присутствии 100 нМ уабаина в течение 3 ч сопровождалось изменением содержания мРНК 17 генов с максимальным уровнем активации и ингибирования в 1.87 и 1.54 раза соответственно. Ингибирование Na+,K+-ATP-азной активности 1 мМ уабаином вызывало (в отличие от низких доз) резкие изменения транскриптома, что выражалось в увеличении до 20 раз содержания транскриптов 295 генов и уменьшении до 3 раз содержания 378 генов (табл. 1).
Таблица 1.
Количество генов, экспрессия которых изменилась после инкубации в течение 3 ч в присутствии 100 нМ и 1 мМ уабаина
| Гены | Уабаин, 100 нМ | Уабаин, 1 мМ |
|---|---|---|
| Экспрессия повысилась | ||
| Количество транскриптов | 10 | 295 |
| Максимальная активация, разы | 1.87 | 18.82 |
| Экспрессия понизилась | ||
| Количество транскриптов | 7 | 378 |
| Максимальное подавление, разы | 1.54 | 2.91 |
Функциональная классификация генов, при экспрессии которых получаемые белки зачастую многофункциональны, всегда в той или иной степени искусственна. Учитывая это, мы ограничили наш анализ только основными функциональными категориями. Из табл. 2 и 3 видно, что список генов, чья экспрессия изменялась при добавлении 100 нМ уабаина, обогащен генами обонятельных рецепторов. Обонятельные рецепторы кодируются большим семейством генов, число которых в геноме крысы составляет почти 1200 [24]. Функции обонятельных рецепторов, как рецепторов, связанных с G-белками, хорошо изучена на примере эпителиальных клеток. В этих высокоспециализированных клетках связывание пахучих стимулов обонятельными рецепторами приводит к активации аденилатциклазы, увеличению внутриклеточной сАМР и активации сАМР-зависимых Ca2+-каналов [25, 26]. Недавно экспрессию обонятельных рецепторов выявили в клетках скелетной мускулатуры и других тканей, не чувствительных к запахам [27]. В скелетных мышцах мышей и крыс эктопические обонятельные рецепторы участвуют в миогенезе [28]. Нами показано что в культивируемых миотубулах C2C12 как уабаин, так и электростимуляция воздействуют на экспрессию обонятельных рецепторов через Ca2+-опосредованную передачу сигнала [29]. Функциональная значимость изменений экспрессии эктопических обонятельных рецепторов в нейронах, запускаемых уабаином в низких дозах через ${\text{Na}}_{{\text{i}}}^{{\text{ + }}}/{\text{K}}_{{\text{i}}}^{ + }$-независимые сигнальные пути, остается не изученной.
Таблица 2.
Гены, экспрессия которых увеличилась в присутствии 100 нМ уабаина более чем в 1.4 раза (p < 0.05)
| Символ и название белковых продуктов генов | Функциональная категория* | Уровень активации/p-значение |
|---|---|---|
| Olr551, olfactory receptor 551 | OLFR | 1.87/0.018489 |
| SPC24, NDC80 kinetochore complex component | PSHD | 1.55/0.04222 |
| Olr1334, olfactory receptor 1334 | OLFR | 1.50/0.037193 |
| RGD1310495, similar to KIAA1919 protein | MTR | 1.47/0.044616 |
| Olr397, olfactory receptor 397 | OLFR | 1.47/0.014367 |
| LOC102548248, calphotin-like | UN | 1.47/0.032125 |
| Csdc2, cold shock domain containing C2, RNA binding | TR | 1.45/0.033715 |
| Olr1394, olfactory receptor 1394 | OLFR | 1.44/0.032407 |
| LOC102556805, rho GTPase-activating protein 20-like | S | 1.43/0.023919 |
| Drgx, dorsal root ganglia homeobox | TR | 1.41/0.044668 |
* Здесь и в табл. 3. Функциональные категории: MTR – мембранные транспортеры; O – другое; OLFR – обонятельные рецепторы; PSHD – синтез, сворачивание и деградация белков; S – сигналинг; TR – регуляция транскрипции; UN – не охарактеризованы.
Таблица 3.
Гены, экспрессия которых уменьшилась в присутствии 100 нМ уабаина в более чем 1.4 раза (p < 0.05)
| Символ и название белковых продуктов генов | Функциональная категория | Уровень подавления/p-значение |
|---|---|---|
| Olr1875, olfactory receptor 1875 | OLFR | –1.4/0.039398 |
| Cdkl5, cyclin-dependent kinase-like 5 | S | –1.41/0.008764 |
| Olr687, olfactory receptor 687 | OLFR | –1.42/0.015524 |
| Olr639, olfactory receptor 639 | OLFR | –1.44/0.03603 |
| Olr1065, olfactory receptor 1065 | OLFR | –1.44/0.033742 |
| RGD1566085, similar to pyridoxal kinase | O | –1.47/0.044618 |
| Olr1246, olfactory receptor 1246 | OLFR | –1.54/0.015191 |
| Slc6a12, solute carrier family 6 neurotransmitter transporter | MTR | –1.56/0.015467 |
Резкие изменения транскриптома в гранулярных клетках мозжечка в ответ на воздействие 1 мМ уабаина охарактеризованы нами ранее [30]. Эти изменения, по-видимому, опосредованы увеличением соотношения [Na+]i/[K+]i как следствие полномасштабного ингибирования Na+,K+-ATP-азы (рис. 1, 2). Этот вывод подтверждается сравнительным анализом дозовой и временной зависимостей действия уабаина и другого кардиотонического стероида маринобуфагенина на внутриклеточное содержание Na+ и K+ и экспрессию генов в эндотелиальных клетках человека, обогащенных универсальной α1-изоформой Na+,K+-ATP-азы [31].
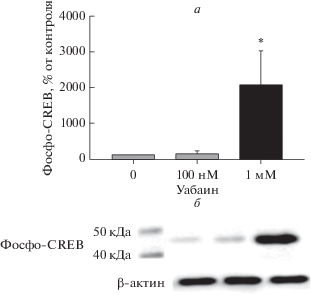
Изменения транскрипции небольшого числа генов, отмеченные при воздействии 100 нМ уабаина, предполагают участие α3-изоформы Na+,K+-ATP-азы как первоначального звена сигнального каскада. Важно отметить, что в этой концентрации, уабаин не оказывал достоверного влияния на внутриклеточное содержание одновалентных катионов (рис. 2). В большинстве типов клеток увеличение соотношения [Na+]i/[K+]i приводит к увеличению [Ca2+]i через активацию Na+/Ca2+-обменника и/или потенциал-зависимых Ca2+-каналов, что, в свою очередь, приводит к фосфорилированию регулятора транскрипции CREB Са2+-кальмодулинзависимой киназой [20, 32–34]. В самом деле, инкубация гранулярных клетках мозжечка в течение 3 ч в присутствии 1 мМ уабаина сопровождалась 20-кратным увеличением фосфорилирования CREB (рис. 3). Однако нам не удалось обнаружить статистически значимого увеличения фосфорилирования этого белка в ответ на добавление 100 нМ уабаина. Таким образом, изменение экспрессии генов в нейронах головного мозга под действием уабаина в низких дозах, при которых ингибируется α3-Na+,K+-ATP-аза, вызвано активацией [Na+]i/[K+]i-независимого сигнального каскада, не связанного с известным Са2+-зависимым механизмом регуляции транскрипции.
Рис. 3.
а – Влияние уабаина на активацию CREB в клетках первичной культуры нейронов мозжечка крыс. К культуре клеток добавляли уабаин в концентрации 100 нМ или 1 мМ и инкубировали в течение 3 ч. Исходный уровень фосфорилирования CREB в клетках принят за 100%, данные представлены как среднеарифметические значения и значения стандартной ошибки, полученные в четырех независимых экспериментах. б – Вестерн-блот фосфо-CREB (Ser133) и β-актина в образцах после 3 ч инкубации нейронов с уабаином.
Работа выполнена при финансовой поддержке РНФ (16-15-10026) и РФФИ (18-04-00063).
Список литературы
Scheiner-Bobis G. 2003. The sodium pump. Its molecular properties and mechanics of ion transport. Eur. J. Biochem. 269, 2424–2433.
Blanco G. 2015. Subunit heterogeneity as a mechanism for tissue-specific ion regulation. Sem. Nephrology. 25, 292–303.
Xie Z., Askari A. 2002. Na+/K+-ATPase as a signal transducer. Eur. J. Biochem. 269, 2434–2439.
Aperia A. 2007. New roles for an old Na,K-ATPase emerges as an interesting drug target. J. Intern. Med. 261, 44–52.
Liu J., Xie Z. 2010. The sodium pump and cardiotonic steroids-induced signal transduction protein kinases and calcium-signaling microdomain in regulation of transporter traficking. Biochim. Biophys. Acta. 1802, 1237–1245.
Riganti C., Campia I., Kopecka J., Gazzano E., Doublier S., Aldieri E., Bosia A., Ghigo D. 2011. Pleiotropic effects of cardioactive glycosides. Curr. Med. Chem. 18, 872–885.
Orlov S.N., Klimanova E.A., Tverskoi A.M., Vladychenskaya E.A., Smolyaninova L.V., Lopina O.D. 2017. ${\text{Na}}_{{\text{i}}}^{{\text{ + }}},{\text{K}}_{{\text{i}}}^{{\text{ + }}}$-dependent and -independent signaling triggered by cardiotonic steroids, facts and artifacts. Molecules. 22, E635.
Hieber V., Siegel G.J., Fink D.J., Beaty M.V., Mata M. 1991. Differential distribution of (Na,K)-ATPase alpha isoforms in the central nervous system. Cell. Mol. Neurobiol. 11, 253–262.
McGrail K.M., Phillips J.M., Sweadner K.J. 1991. Immunofluorescent localization of three Na,K-ATPase isozymes in rat central nervous system, both neurons and glia can express more than one Na,K-ATPase. J. Neurosci. 11, 381–391.
Peng L., Martin-Vasallo P., Sweadner K.J. 1997. Isoforms of Na,K-ATPase alpha and beta subunits in the rat cerebellum and granule cell cultures. J. Neurosci. 17, 3488–3502.
Akkuratov E.E., Lopacheva O.M., Kruusmagi M., Lopachev A.V., Shah Z.A., Boldyrev A.A., Liu L. 2015. Functional interaction between Na/K-ATPase and NMDA receptor in cerebellar neurons. Mol. Neurobiol. 52, 1726–1734.
Munzer J.S., Daly S.E., Jewell-Motz E.A., Lingrel J.B., Blostien R. 1994. Tissue- and isoform-specific behavior of the Na,K-ATPase. J. Biol. Chem. 269, 16 668–16 676.
Zahler R., Zhang Z.-T., Manor M., Boron W.F. 1997. Sodium kinetics of Na,K-ATPase α isoforms in intact transfected HeLa cells. J. Gen. Physiol. 110, 201–213.
Dobretsov M., Stimers J.R. 2005. Neuronal function of alpha3 isoform of the Na/K-ATPase. Front. Biosci. 10, 2372–2396.
Azarias G., Kruusmag M., Connor S., Akkuratov E.E., Liu X.L., Lyons D., Brismar H., Broberger C., Aperia A.A. 2013. Specific and essential role for Na,K-ATPase α3 in neurons co-expressing α1 and α3. J. Biol. Chem. 288, 2734–2743.
O’Brien W.J., Lingrel J.B., Wallick E.T. 1994. Ouabain binding kinetics of the rat alpha two and alpha three isoforms of the sodium-potassium adenosine triphosphate. Arch. Biochem. Biophys. 310, 32–39.
Hara Y., Nikamoto A., Kojima T., Matsumoto A., Nakao M. 1980. Expression of sodium pump activities in BALB/c 3T3 cells transfected withcDNA encoding alpha 3-subunits of rat brain Na+,K+-ATPase. FEBS Lett. 26, 27–30.
Berrebi-Betrand I., Maixent J.M., Christe G., Lelievre L.G. 1990. Two active Na+/K+-ATPases of high affinity for ouaban in adult rat brain membranes. Biochim. Biophys. Acta. 1021, 148–156.
Atterwill C.K., Cunningham V.J., Balazs R. 1984. Characterization of Na+,K+-ATPase in cultured and separated neuronal and glial cells from rat cerebellum. J. Neurochem. 43, 8–18.
Orlov S.N., Hamet P. 2015. Salt and gene expression: Evidence for Na+i,K+i-mediated signaling pathways. Pflugers Arch. – Eur. J. Physiol. 467, 475–487.
Lopachev A.V., Lopacheva O.M., Osipova E.A., Vladychenskaya E.A., Smolyaninova L.V., Fedorova T.N., Koroleva O.V., Akkuratov E.E. 2016. Ouabain-induced changes in MAP kinase phosphorylation in primary culture of rat cerebellar cells. Cell. Biochem. Funct. 34, 367–377.
Marks M.J., Seeds N.W. 1978. A heterogeneous ouabain – ATPase interaction in mouse brain. Life Sci. 23, 2735–2744.
Berrebi-Bertrand I., Maixent J.M., Christe G., Lelièvre L.G. 1990. Two active Na+/K+-ATPases of high affinity for ouabain in adult rat brain membranes. Biochim. Biophys. Acta. 1021, 148–156.
Touhara K., Niimura Y., Ihara S. 2016. Chemosensory Transduction. Elsevier Inc., p. 49–66.
Lowe G., Nakamura T., Gold G.H. 1989. Adenylate cyclase mediates olfactory transduction for a wide variety of odorants. Proc. Natl. Acad. Sci. USA. 86, 5641–5645.
Nakamura T., Gold G.H. 1987. A cyclic nucleotide-gated conductance in olfactory recepptor glia. Nature. 325, 442–444.
Kang N., Koo J. 2012. Olfactory receptors in non-chemosensory tissues. BMB Rep. 45, 612–622.
Griffin C.A., Kafadar K.A., Pavlath G.K. 2009. MOR23 promotes muscle regeneration and regulates cell adhesion and migration. Developmental Cell. 17, 649–661.
Sidorenko S.V., Klimanova E.A., Milovanova K., Lopina O.D., Kapilevich L.V., Chibalin A.V., Orlov S.N. 2018. Transciptomic changes in C2C12 myotubes triggered by electrical stimulation, role of ${\text{Ca}}_{{\text{i}}}^{{2 + }}$-mediated and ${\text{Ca}}_{{\text{i}}}^{{2 + }}$-independent signaling and elevated [Na+]i/[K+]i ratio. Cell Calcium. 76, 72–86.
Klimanova E.A., Sidorenko S.V., Smolyaninova L.V., Kapilevich L.V., Gusakova S.V., Lopina O.D., Orlov S.N. 2019. Ubiquitous and cell type-specific transcriptomic changes triggered by dissipation of monovalent cation gradients in rodent cells: Physiological and pathophysiological implications. Curr. Topics Membranes. 83. Accepted for print.
Klimanova E.A., Tverskoi A.M., Koltsova S.V., Sidorenko S.V., Lopina O.D., Tremblay J., Hamet P., Kapilevich L.V., Orlov S.N. 2017. Time- and dose-dependent actions of cardiotonic steroids on transcriptome and intracellular content of Na+ and K+, a comparative analysis. Sci. Rep. 7, 45403.
Santana L.F. 2008. NFAT-dependent excitation-transcription coupling in heart., Circ. Res. 103, 681–683.
Gundersen K. 2011. Excitation-transcription coupling in skeletal muscle, the molecular pathways of exercise. Biol. Rev. 86, 564–600.
Ma H., Groth R.D., Wheeler D.G., Barrett C.F., Tsien R.W. 2011. Excitation-transcription coupling in sympathetic neurons and the molecular mechanism of its initiation. Neurosci. Res. 70, 2–8.
Дополнительные материалы отсутствуют.
Инструменты
Биологические мембраны: Журнал мембранной и клеточной биологии


