Биологические мембраны: Журнал мембранной и клеточной биологии, 2019, T. 36, № 5, стр. 332-341
Додецилтрифенилфосфоний как индуктор калий-зависимой проницаемости митохондрий печени крыс
К. Н. Белослудцев a, b, *, К. С. Теньков b, А. А. Ведерников b, Н. В. Белослудцева a, М. В. Дубинин b
a Институт теоретической и экспериментальной биофизики РАН
142290 Пущино, Институтская 3, Россия
b Марийский государственный университет
424001 Йошкар-Ола, пл. Ленина, 1, Россия
* E-mail: bekonik@gmail.com
Поступила в редакцию 15.04.2019
После доработки 25.05.2019
Принята к публикации 25.05.2019
Аннотация
Додецилтрифенилфосфоний (С12ТРР) – мембраносвязанный проникающий катион с делокализованным зарядом, широко используемый для создания и доставки антиоксидантов, спиновых ловушек и различных зондов в митохондрии. Исследована способность С12ТРР в микромолярных концентрациях индуцировать увеличение проницаемости внутренней мембраны митохондрий печени крыс. Показано, что С12ТРР дозозависимо (10–30 мкМ) вызывает набухание митохондрий в инкубационной среде, осмолярность которой поддерживается KCl. В то же время, в изотонической сахарозной среде С12ТРР вызывал сокращение объема митохондрий печени крыс. Установлено, что набухание митохондрий, вызванное С12ТРР, не ингибируется циклоспорином А, но подавляется ингибиторами ATP-чувствительного калиевого канала – глибенкламидом и ATP. Показано также, что С12ТРР-индуцированное набухание митохондрий ингибируется свободными жирными кислотами. В свою очередь, С12ТРР предотвращал циклоспорин А-нечувствительное набухание митохондрий, индуцированное пальмитиновой кислотой и Са2+. Обсуждается возможный механизм С12ТРР-индуцированной проницаемости митохондриальной мембраны.
ВВЕДЕНИЕ
Липофильные катионы, заряд которых делокализован по большой органической молекуле, впервые были синтезированы и описаны в конце 60-х гг. XX века [1, 2]. В силу своей низкой гидратации эти ионы легко проникают через мембраны и в соответствии с законом Нернста накапливаются в клетке преимущественно в энергизованных митохондриях. Липофильные катионы достаточно широко используются в современной биологии и медицине. Их применяют для определения мембранного потенциала митохондрий и доставки различных соединений (в том числе, противораковых) внутрь этих органелл [3]. В настоящее время на основе липофильных катионов конструируют митохондриально-направленные антиоксиданты, которые предотвращают накопление активных форм кислорода в условиях ишемии/реперфузии органов и тканей [4–7].
Среди митохондриально-направленных катионов наиболее популярными являются конъюгаты трифенилфосфония, в частности, додецилтрифенилфосфоний (С12ТРР) (рис. 1). Взаимодействие С12ТРР и его производных c митохондриальными и искусственными мембранами интенсивно изучают во многих лабораториях мира. На сегодняшний день выявлено несколько механизмов действия производных С12ТРР. Во-первых, С12ТРР и его производные (в том числе SkQ и MitoQ) являются разобщителями дыхания. Считается, что разобщающее действие проникающих митохондриально-направленных катионов опосредуется их способностью переносить анионы жирных кислот через митохондриальную мембрану [8, 9]. Так, предположили, что это свойство С12ТРР препятствовало развитию ожирения мышей [10]. Во-вторых, наличие в структуре молекулы пластохинона или убихинона (SkQ и MitoQ) придает антиоксидантные свойства данным молекулам. Показано, что такие митохондриально-направленные антиоксиданты предотвращали накопление активных форм кислорода, клеточную гибель и, как следствие, дегенеративные процессы при многих патологиях [11, 12]. Помимо этого, наличие пластохинона и убихинона способствует переносу электронов через фосфолипидные мембраны [13].
Отличительной особенностью митохондриально-направленных антиоксидантов, сконструированных на основе С12ТРР, является их способность накапливаться во внутренней митохондриальной мембране в высоких концентрациях [11]. Как и в случае любых других антиоксидантов, избыточное накопление С12ТРР может привести к прооксидантному эффекту, коллапсу мембранного потенциала, образованию митохондриальной поры и развитию митохондриальной дисфункции [14, 15]. Действительно, обнаружено, что высокие концентрации С12TPP (20–40 мкМ) способны индуцировать набухание митохондрий дрожжей Yarrowia lipolytica. Поскольку в митохондриях дрожжей не происходит образования MPT поры (Mitochondrial Permeability Transition pore), предположили, что такое действие С12ТРР опосредуется его детергентным эффектом [16]. Известно, что ряд соединений, в том числе и такой детергент, как тритон X-100, способны в низких концентрациях работать в качестве переносчиков ионов, а в высоких концентрациях оказывать лизирующее действие на мембраны [17, 18]. В настоящей работе исследована способность С12ТРР увеличивать проницаемость внутренней мембраны митохондрий печени крыс, изучен возможный механизм такого действия. Показано: 1) С12ТРР в концентрациях 10–30 мкМ индуцирует набухание митохондрий печени крыс в среде, осмолярность которой поддерживается KCl, но не сахарозой. Это набухание нечувствительно к селективному ингибитору MPT-поры – циклоспорину А; 2) Глибенкламид и ATP, ингибиторы митохондриального ATP-чувствительного калиевого канала, подавляют митохондриальное набухание, индуцированное С12ТРР; 3) Жирные кислоты ингибируют С12ТРР-индуцированное набухание митохондрий печени крысы. В свою очередь, С12ТРР предотвращает набухание, вызванное открытием циклоспорин А-нечувствительной пальмитат/Са2+-зависимой поры в митохондриях.
МАТЕРИАЛЫ И МЕТОДЫ
Митохондрии из печени крыс линии Вистар (220–250 г) выделяли общепринятым методом дифференциального центрифугирования в соответствии с описанной ранее методикой [19]. Среда выделения содержала 210 мМ маннитол, 70 мМ сахарозу, 1 мМ EDTA, 10 мМ HEPES-KOH (pH 7.4). Полученная суспензия митохондрий содержала приблизительно 80 мг митохондриального белка на 1 мл. Концентрацию белка в полученной митохондриальной суспензии определяли по методу Лоури [20]. Значение дыхательного контроля полученных митохондрий, окисляющих сукцинат, было в диапазоне 3–4.
Набухание митохондрий регистрировали по изменению оптической плотности суспензии митохондрий (А) при длине волны 540 нм при постоянном перемешивании и термостатировании при 25°C на спектрометрической оптоволоконной оптической системе Ocean Optics USB 2000 (Ocean Optics, Inc, США). Среда инкубации содержала 5 мМ янтарную кислоту, 0.2 мМ EGTA, 1 мкМ ротенон, 10 мМ HEPES-Tрис (pH 7.4). Осмолярность среды инкубации поддерживалась 130 мМ KCl или 250 мМ сахарозой. Концентрация митохондриального белка в кювете составляла ∼0.4 мг/мл. Скорость набухания митохондрий (Vmax = ΔА540/мин на 1 мг белка) рассчитывали как изменение оптической плотности суспензии в течение первых 30 с с момента начала высокоамплитудного набухания.
Выход ионов К+ из митохондрий печени крыс в безкалиевой среде регистрировали с помощью K+-селективного электрода (НикоАналит, Россия) и многоканальной электрометрической системы Record 4 [21]. Среда инкубации содержала 180 мМ сахарозу, 70 мМ маннитол, 1 мкг/мл олигомицин, 10 мМ Tрис-HCl (pH 7.4). Концентрация митохондриального белка в кювете составляла 1–1.5 мг/мл.
SkQ1 был любезно предоставлен д.б.н. Ю.Н. Антоненко (НИИ ФХБ им. А.Н. Белозерского). С12ТРР, тетрафенилфосфоний и все остальные реактивы, используемые в работе, приобретены в Sigma-Aldrich (США).
РЕЗУЛЬТАТЫ
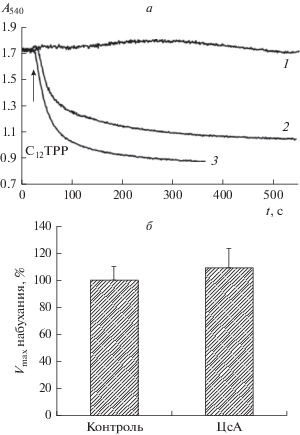
C12ТРР вызывает K+-зависимое набухание митохондрий печени крыс. Нами изучена способность катиона С12ТРР индуцировать пермеабилизацию митохондрий печени крыс. Как видно на рис. 2а, С12ТРР в концентрации 10–30 мкМ вызывает дозозависимое набухание органелл в среде инкубации, содержащей 130 мМ KCl в качестве осмотического агента. Такое митохондриальное набухание было нечувствительно к 1 мкМ циклоспорину А – специфическому ингибитору MPT-поры (рис. 2б).
Рис. 2.
С12ТРР индуцирует набухание митохондрий печени крыс в среде с KCl. а – Кинетика изменения оптической плотности суспензии митохондрий печени крыс, инкубируемых в присутствии 10 (1), 20 (2) и 30 мкМ С12ТРР (3). б – Влияние 1 мкМ циклоспорина А на набухание митохондрий печени крыс, индуцированное 20 мкМ С12ТРР. Состав среды инкубации: 130 мМ KCl, 5 мМ янтарная кислота, 1 мкМ ротенон, 0.2 мМ EGTA, 10 мМ HEPES-Tрис (pH 7.4). Приведены средние ± ошибки средней (n = 3–6).
Ранее было показано, что С12ТРР индуцировал также набухание митохондрий дрожжей Y. lipolytica [16]. Было предположено, что этот эффект обусловлен его детергентным действием. Подобное действие предполагает, что С12ТРР будет индуцировать деструкцию митохондрий в средах разного состава. В связи с этим мы проверили, способен ли С12ТРР индуцировать митохондриальное набухание в среде, осмолярность которой поддерживалась 250 мМ сахарозой.
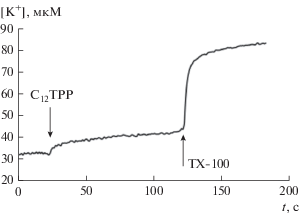
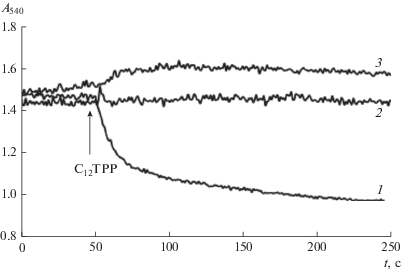
Из рис. 3а видно, что 20 мкМ С12ТРР не вызывал набухания митохондрий в среде, осмолярность которой поддерживалась сахарозой. Более того, С12ТРР вызывал в этой среде увеличение оптической плотности суспензии, что свидетельствует о сокращении объема митохондрий. Как известно, сокращение объема митохондрий может быть связано с выходом из органелл осмотически активного K+. Действительно, можно видеть, что 20 мкМ С12ТРР индуцирует выброс К+ из митохондрий печени крыс (рис. 4).
Рис. 3.
Кинетика изменений оптической плотности суспензии митохондрий печени крыс, индуцированных С12ТРР (а), SkQ1 (б) и тетрафенилфосфония (в), в средах, осмолярность которых поддерживалась 130 мМ KCl (1) или 250 мМ сахарозой (2). Добавки: 20 мкМ С12ТРР (а), 20 мкМ SkQ1 (б), 100 мкМ тетрафенилфосфоний (ТРР) (в). Состав среды инкубации: 5 мМ янтарная кислота, 0.2 мМ EGTA, 1 мкМ ротенон, 10 мМ HEPES -Tрис (pH 7.4) 130 мМ KCl (1) и 250 мМ сахароза (2).
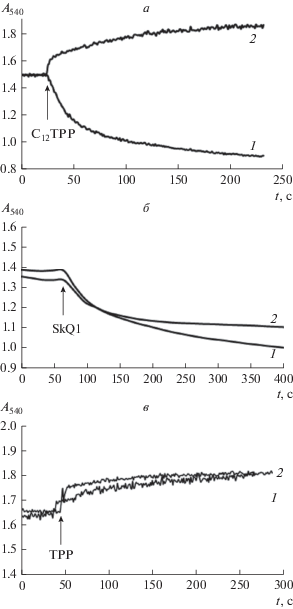
Рис. 4.
Выход ионов К+ из митохондрий печени крыс, индуцированный С12ТРР. Добавки: 20 мкМ C12TPP и 0.1% тритон X-100. Среда инкубации содержала 180 мМ сахарозу, 70 мМ маннитол, 1 мкг/мл олигомицин, 10 мМ Tрис-HCl (pH 7.4).
В отличие от С12ТРР тетрафенилфосфоний и SkQ1 индуцировали несколько иные эффекты изменения объема митохондрий печени крыс. Так SkQ1 вызывал набухание как в калиевой, так и в сахарозной среде (рис. 3б). В то же время тетрафенилфосфоний даже в концентрации 100 мкМ был не способен индуцировать набухание митохондрий печени крыс. В обеих средах он индуцировал увеличение оптической плотности суспензии митохондрий, т.е. сокращение их объема (рис. 3в). Таким образом, лишь действие С12ТРР на митохондрии печени крыс изменяется в зависимости от состава инкубационной среды.
С12ТРР в концентрации 20 мкМ не способен индуцировать набухание митохондрий в среде с низким содержанием (10 мМ) хлорида калия, осмолярность которой поддерживалась 230 мМ сахарозой (рис. 5а). В этом случае наблюдалось увеличение оптической плотности суспензии митохондрий, как и в отсутствие хлорида калия. Подобные результаты получены и на средах, содержащих 10 мМ KNO3, K2SO4. В то же время присутствие в сахарозной среде инкубации 10 мМ KH2PO4 приводило сначала к сокращению, а затем к набуханию митохондрий печени крыс. Мерсалил (10 мкМ), ингибитор фосфатного переносчика, препятствовал набуханию митохондрий в присутствии 10 мМ KH2PO4 (рис. 5б).
Рис. 5.
а – Изменение оптической плотности суспензии митохондрий печени крыс, индуцированное 20 мкМ С12ТРР, в среде инкубации, осмолярность которой поддерживалась 250 мМ сахарозой (1), в присутствии 10 мМ KCl (2), 10 мМ KNO3 (3), 5 мМ K2SO4 (4) и 10 мМ KH2PO4 (5). Среда инкубации содержала 230 мМ сахарозу, 5 мМ янтарную кислоту, 0.2 мМ EGTA, 1 мкМ ротенон, 10 мМ HEPES -Tрис (pH 7.4). б – Набухание митохондрий печени крыс, индуцированное 20 мкМ С12ТРР, в среде инкубации, осмолярность которой поддерживалась 250 мМ сахарозой и 10 мМ KH2PO4 в отсутствие (1) и в присутствии (2) ингибитора фосфатного переносчика мерсалила (10 мкМ).
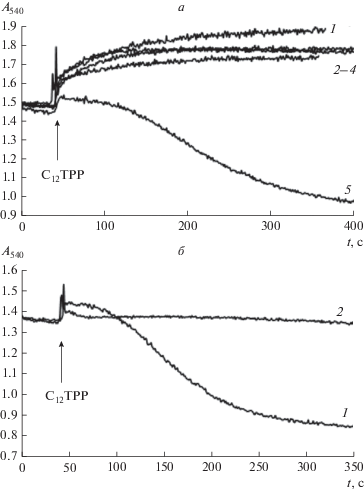
Глибенкламид и ATP подавляют набухание митохондрий печени крыс, индуцированное С12ТРР. Считается, что транспорт К+ в митохондрии происходит вследствие активации во внутренней мембране органелл калиевых каналов. Одной из основных К+-транспортирующих систем митохондрий является митохондриальный ATP-чувствительный К+-канал (митоКATP), который подавляется ATP и глибенкламидом [22, 23]. В связи с этим в следующей части работы мы оценили влияние этих ингибиторов митоКATP на набухание митохондрий, индуцированное С12ТРР. Как видно из рис. 6, С12ТРР-индуцированное набухание митохондрий можно ингибировать микромолярными концентрациями глибенкламида. (рис. 6а, б). Подобным действием обладал и другой ингибитор митоКATP – ATP в концентрации 1 мМ (рис. 6в).
Рис. 6.
Влияние глибенкламида и ATP на набухание митохондрий печени крыс, индуцированное 20 мкМ С12ТРР. а – Кинетика изменения светорассеяния суспензии митохондрий печени крыс, индуцированное 20 мкМ С12ТРР в отсутствие (1) и в присутствии 10 мкМ глибенкламида (2). б – Зависимость скорости набухания митохондрий печени крыс, индуцированного 20 мкМ С12ТРР, от концентрации глибенкламида. в – Влияние 1 мМ ATP на скорость набухания митохондрий печени крыс, индуцированного 20 мкМ С12ТРР. Состав среды инкубации как на рис. 2. Приведены средние ± ошибки средней (n = 3–6).
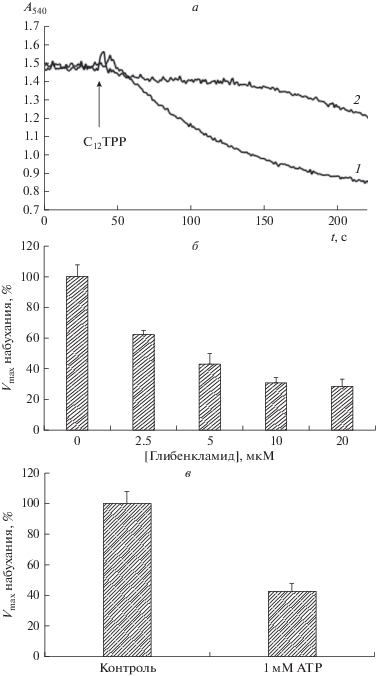
Жирные кислоты ингибируют индуцированное С12ТРР набухание митохондрий, С12ТРР подавляет открытие пальмитат/Са2+-индуцированной поры. Ранее было показано, что С12ТРР и его конъюгаты способны в субмикромолярных и микромолярных концентрациях индуцировать процесс разобщения дыхания. Считается, что это действие проникающих мембраносвязанных катионов опосредуется их взаимодействием с жирными кислотами, что облегчает диффузию анионов жирных кислот через мембрану митохондрий [9, 14]. В пользу достаточно прочного взаимодействия жирных кислот с С12ТРР говорит и тот факт, что они подавляли индуцируемый проникающими катионами выброс флуоресцентных зондов из липосом [9]. В связи с этим в следующей части работы нами исследовано влияние жирных кислот на набухание митохондрий, индуцированное C12TPP. Как видно из рис. 7, преинкубация митохондрий с 15 мкМ пальмитиновой или олеиновой жирными кислотами приводила к ингибированию набухания митохондрий, индуцированного 20 мкМ C12ТРР, в среде, осмолярность которой поддерживалась 130 мМ KCl.
Рис. 7.
Влияние пальмитиновой (2) и олеиновой (3) кислот на набухание митохондрий печени крыс, индуцированное 20 мкМ С12ТРР (1). Состав среды инкубации как на рис. 2. Добавки: 15 мкМ пальмитиновой кислоты (2), 15 мкМ олеиновой кислоты (3).
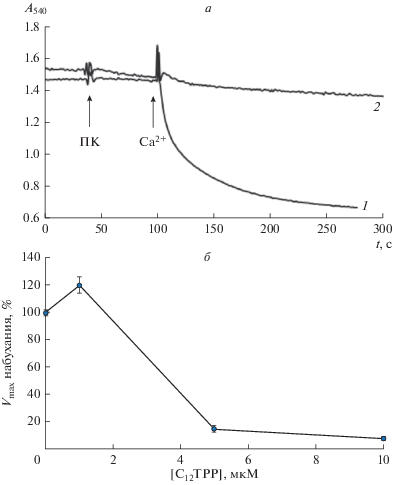
С другой стороны можно предположить, что сам С12ТРР может снижать активность процессов, которые протекают с участием жирных кислот. Таким процессом может быть образование в митохондриях липидной циклоспорин А-нечувствительной поры, индуцированной пальмитиновой кислотой и Са2+ [19, 24]. Как показано на рис. 8а и 8б, преинкубация митохондрий печени с 5–10 мкМ С12ТРР (концентрации, которые не вызывают изменения объема митохондрий) приводила к достаточно мощному ингибированию скорости циклоспорин А-нечувствительного набухания митохондрий, индуцированного 15 мкМ пальмитиновой кислотой и 30 мкМ Са2+.
Рис. 8.
Влияние С12ТРР на открытие митохондриальной пальмитат/Ca2+-зависимой циклоспорин А-нечувствительной липидной поры. а – Кинетика набухания митохондрий печени крыс, индуцированная 15 мкМ пальмитиновой кислотой (ПК) и 30 мкМ Са2+ в отсутствие (1) и в присутствии 5 мкМ С12ТРР (2). б – Зависимость скорости набухания митохондрий печени крыс, индуцированного 15 мкМ пальмитиновой кислоты и 30 мкМ Са2+, от концентрации С12ТРР. Среда инкубации содержала 210 мМ маннитол, 70 мМ сахарозу, 5 мМ янтарную кислоту, 1 мкМ ротенон, 10 мкМ EGTA, 10 мМ HEPES-KOH (pH 7.4). Приведены средние ± ошибки средней (n = 3–5).
ОБСУЖДЕНИЕ
С12ТРР – липофильный проникающий катион с делокализованным зарядом, широко используемый для создания и доставки антиоксидантов, спиновых ловушек и различных зондов в митохондрии [12, 25–29]. Согласно современным представлениям, существует несколько механизмов воздействия С12ТРР и его конъюгатов на функционирование митохондрий. К подобным механизмам можно отнести прежде всего антиоксидантное и разобщающее действие [12]. Действительно, соединения, синтезированные на основе С12ТРР, способны в наномолярных концентрациях проявлять терапевтическое действие при заболеваниях, связанных с ишемией/реперфузией тканей, когда наблюдается избыточное образование активных форм кислорода [5–7]. В настоящей работе продемонстрирован еще один механизм воздействия С12ТРР на митохондрии – активация транспорта К+ через внутреннюю митохондриальную мембрану.
В настоящей работе показано, что С12ТРР способен индуцировать набухание митохондрий печени крыс в среде, осмолярность которой поддерживалась хлоридом калия (рис. 2). При этом трудно представить, что сам катион С12ТРР способен транспортировать осмотически активный катион калия. Поскольку в работе использованы достаточно высокие концентрации С12ТРР (10–30 мкМ), то можно предположить, что он оказывает детергентное действие на митохондрии. О подобном влиянии С12ТРР на митохондрии говорилось ранее в контексте дрожжевых митохондрий [16]. Однако С12ТРР-индуцированное набухание отсутствовало в среде, осмолярность которой поддерживалась сахарозой (рис. 3). Более того, в сахарозной среде наблюдалось сокращение объема митохондрий. Исходя из этого становится понятным, что эффект С12ТРР на митохондрии печени крыс не связан с детергентным действием этого соединения. Кроме того, действие С12ТРР, по-видимому, не связано и с образованием митохондриальных пор (как чувствительной, так и нечувствительной к циклоспорину А) [24, 30]. Полученные данные позволяют говорить о том, что действие С12ТРР опосредовано активацией систем транспорта ионов К+ через внутреннюю мембрану митохондрий. Стоит отметить, что в случае С12ТРР-индуцированного набухания митохондрий дрожжей Y. lipolytica была использована среда, содержащая хлорид калия [16].
Полученные нами данные позволяют выявить несколько параметров индуцированного С12ТРР транспорта К+ через митохондриальную мембрану. 1) С12ТРР может индуцировать транспорт К+ как в митохондрии (когда концентрация К+ снаружи высокая), так и из органелл (когда снаружи митохондрий К+ либо отсутствует, либо его концентрация низка). 2) Транспорт К+ в митохондрии облегчается, когда параллельно происходит транспорт аниона (например, фосфата, у которого есть свой специализированный переносчик) через внутреннюю митохондриальную мембрану.
Считается, что в нормальных условиях вход ионов К+ в митохондрии опосредуется К+-каналами: митохондриальный ATP-чувствительный К+-канал, Са2+-активируемые К+ -каналы (BKCa, IKCa, SKCa), потенциал-зависимые каналы (Kv1.3) и TASK-3 канал [22]. Выброс ионов К+ из митохондрий может быть опосредован K+/H+-обменником Letm1 [31]. Работа этих систем регулирует концентрацию К+ через внутреннюю митохондриальную мембрану и, как следствие этого, объем митохондрий. В основе механизма действия С12ТРР, как показано в настоящей работе, может лежать активация митохондриального ATP-чувствительного К+-канала. Несмотря на то, что структура этого канала до сих пор не определена, считается, что это белок с молекулярной массой 55–57 кДа, способный в зависимости от мембранного потенциала транспортировать К+ как в митохондрии, так и из митохондрий [23]. Общепризнано, что активация этого канала приводит к мягкому разобщению и снижению продукции активных форм кислорода при ишемии и последующей реперфузии тканей [22, 32, 33]. Как показано на рис. 6, ингибиторы митоКATP – глибенкламид и ATP – предотвращали и задерживали развитие набухания митохондрий, индуцированное С12ТРР. Таким образом, можно предположить, что С12ТРР может быть новым активатором канала митоКATP. Стоит отметить, что тетрафенилфосфоний и SkQ1 оказывают на проницаемость митохондриальной мембраны влияние, отличное от эффектов С12ТРР (рис. 3). Тетрафенилфосфоний стимулировал сокращение объема митохондрий в обеих средах, которое можно объяснить выбросом К+ из митохондрий. В то же время SkQ1 индуцировал набухание органелл в обеих средах, что может говорить как о неспецифической пермеабилизации липидной мембраны, так и о детергентном действии. Таким образом, именно молекулярная форма С12ТРР, а не видоизмененных молекул способна стимулировать транспорт К+ в митохондриях печени крыс.
Считается, что разобщающее действие низких концентраций С12ТРР в митохондриях опосредуется переносом анионов жирных кислот с матриксной стороны внутренней мембраны митохондрий на цитоплазматическую. По-видимому, в основе этого лежит электростатическое взаимодействие аниона жирной кислоты с катионом С12ТРР [9, 14]. Можно предположить, что такие электростатические взаимодействия могут модулировать в мембранах как эффекты жирных кислот, так и С12ТРР. Действительно, как показано ранее, жирные кислоты препятствовали переносу флуоресцентного зонда из липосом, опосредованному С12ТРР и SkQ1 [9]. В настоящей работе показано, что пальмитиновая и олеиновая жирные кислоты способны подавлять набухание митохондрий, индуцированное С12ТРР (рис. 7). Таким образом, взаимодействие С12ТРР с жирными кислотами приводит к снижению свободного катиона в мембране митохондрий и неспособности активировать калиевый транспорт.
В свою очередь, С12ТРР, помимо участия в разобщающем действии жирных кислот, способен также влиять на другие мембранные процессы, в которых участвуют жирные кислоты. Один из таких патологических процессов – открытие во внутренней мембране митохондрий циклоспорин А-нечувствительной липидной поры, индуцированной пальмитиновой кислотой и Са2+ [24]. Как показано на рис. 8, С12ТРР в концентрациях, в которых еще сам не индуцирует изменения объема органелл, подавлял пальмитат/Ca2+-зависимое набухание митохондрий печени крыс. В данном случае взаимодействие жирной кислоты с С12ТРР препятствует образованию комплексов пальмитиновая кислота/Са2+ в митохондриальной мембране и тем самым формированию липидной поры. Подобное действие на образование в мембране липидной поры можно наблюдать в присутствии БСА или хелаторов Са2+ – EGTA и адениновых нуклеотидов [24].
Таким образом, полученные в работе данные позволяют говорить о том, что наряду с известным разобщающим действием С12ТРР обладает способностью стимулировать транспорт ионов К+ в митохондриях, опосредованный, вероятно, активацией митохондриального ATP-чувствительного К+-канала, и является ингибитором митохондриальной циклоспорин А-нечувствительной липидной поры, индуцированной пальмитиновой кислотой и Са2+. Вероятно, такое действие С12ТРР может способствовать выживанию клеток в различных патологических условиях.
Работа выполнена при финансовой поддержке РФФИ (18-315-20011-мол_а_вед), РНФ (№16-15-00157 (рис. 6)) и гранта президента РФ для поддержки молодых ученых (МК-61.2019.4).
Список литературы
Skulachev V.P., Sharaf A.A., Liberman E.A. 1967. Proton conductors in the respiratory chain and artificial membranes. Nature. 216 (5116), 718–719.
Liberman E.A., Topaly V.P., Tsofina L.M., Jasaitis A.A., Skulachev V.P. 1969. Mechanism of coupling of oxidative phosphorylation and the membrane potential of mitochondria. Nature. 222 (5198), 1076–1078.
Kamo N, Muratsugu M, Hongoh R, Kobatake Y. 1979. Membrane potential of mitochondria measured with an electrode sensitive to tetraphenyl phosphonium and relationship between proton electrochemical potential and phosphorylation potential in steady state. J. Membr. Biol. 49 (2), 105–121.
Chen Z.P., Li M., Zhang L.J., He J.Y., Wu L., Xiao Y.Y., Duan J.A., Cai T., Li W.D. 2016. Mitochondria-targeted drug delivery system for cancer treatment. J. Drug Target. 24 (6), 492–502.
Isaev N.K., Stelmashook E.V., Genrikhs E.E., Korshunova G.A., Sumbatyan N.V., Kapkaeva M.R., Skulachev V.P. 2016. Neuroprotective properties of mitochondria-targeted antioxidants of the SkQ-type. Rev. Neurosci. 27 (8), 849–855.
Khailova L.S., Silachev D.N., Rokitskaya T.I., Avetisyan A.V., Lyamsaev K.G., Severina I.I., Il’yasova T.M., Gulyaev M.V., Dedukhova V.I., Trendeleva T.A., Plotnikov E.Y., Zvyagilskaya R.A., Chernyak B.V., Zorov D.B., Antonenko Y.N., Skulachev V.P. 2014. A short-chain alkyl derivative of Rhodamine 19 acts as a mild uncoupler of mitochondria and a neuroprotector. Biochim. Biophys. Acta. 1837 (10), 1739–1747.
Plotnikov E.Y., Silachev D.N., Jankauskas S.S., Rokitskaya T.I., Chupyrkina A.A., Pevzner I.B., Zorova L.D., Isaev N.K., Antonenko Y.N., Skulachev V.P., Zorov D.B. 2012. Mild uncoupling of respiration and phosphorylation as a mechanism providing nephro- and neuroprotective effects of penetrating cations of the SkQ family. Biochemistry (Mosc). 77 (9), 1029–1037.
Rokitskaya T.I., Sumbatyan N.V., Tashlitsky V.N., Korshunova G.A., Antonenko Y.N., Skulachev V.P. 2010. Mitochondria-targeted penetrating cations as carriers of hydrophobic anions through lipid membranes. Biochim. Biophys. Acta. 1798 (9), 1698–1706.
Severin F.F., Severina I.I., Antonenko Y.N., Rokitskaya T.I., Cherepanov D.A., Mokhova E.N., Vysso-kikh M.Y., Pustovidko A.V., Markova O.V., Yaguzhinsky L.S., Korshunova G.A., Sumbatyan N.V., Skulachev M.V., Skulachev V.P. 2010. Penetrating cation/ fatty acid anion pair as a mitochondria-targeted protonophore. Proc. Natl. Acad. Sci. USA. 107 (2), 663–668.
Kalinovich A.V., Mattsson C.L., Youssef M.R., Petrovic N., Ost M., Skulachev V.P., Shabalina I.G. 2016. Mitochondria-targeted dodecyltriphenylphosphonium (C12TPP) combats high-fat-diet-induced obesity in mice. Int. J. Obes. 40 (12), 1864–1874
Armstrong J.A., Cash N.J., Morton J.C., Tepikin A.V., Sutton R., Criddle D.N. 2019. Mitochondrial Targeting of Antioxidants Alters Pancreatic Acinar Cell Bioenergetics and Determines Cell Fate. Int. J. Mol. Sci. 20 (7), E1700.
Feniouk B.A., Skulachev V.P. 2017. Cellular and Molecular Mechanisms of Action of Mitochondria-Targeted Antioxidants. Curr. Aging Sci. 10 (1), 41–48.
Rokitskaya T.I., Murphy M.P., Skulachev V.P., Antonenko Y.N. 2016. Ubiquinol and plastoquinol triphenylphosphonium conjugates can carry electrons through phospholipid membranes. Bioelectrochemistry. 111, 23–30.
Хайлова Л.С., Назаров П.А., Сумбатян Н.В., Коршунова Г.А., Рокицкая Т.И., Дедухова В.И., Антоненко Ю.Н., Скулачев В.П. 2015. Разобщающее и токсическое действие алкил-трифенилфосфониевых катионов на митохондрии и бактерии Bacillus subtilis в зависимости от длины алкильного фрагмента. Биохимия. 80, 1851–1860.
Белослудцев К.Н., Белослудцева Н.В., Теньков К.С., Шарапов В.А., Косарева Е.А., Дубинин М.В. 2017. Влияние деквалиниума на дыхание и проницаемость внутренней мембраны митохондрий печени крысы. Биол. мембраны. 34 (6), 101–108.
Trendeleva T.A., Rogov A.G., Cherepanov D.A., Sukhanova E.I., Il’yasova T.M., Severina I.I., Zvyagilskaya R.A. 2012. Interaction of tetraphenylphosphonium and dodecyltriphenylphosphonium with lipid membranes and mitochondria. Biochemistry (Mosc). 77 (9), 1021–1028.
Koley D., Bard A.J. 2010. Triton X-100 concentration effects on membrane permeability of a single HeLa cell by scanning electrochemical microscopy (SECM). Proc. Natl. Acad. Sci. USA. 107 (39), 16783–16787.
Rokitskaya T.I., Kolodkin N.I., Kotova E.A., Antonenko Y.N. 2011. Indolicidin action on membrane permeability: Carrier mechanism versus pore formation. Biochim. Biophys. Acta. 1808 (1), 91–97.
Belosludtsev K.N., Belosludtseva N.V., Agafonov A.V., Astashev M.E., Kazakov A.S., Saris N.-E.L., Mironova G.D. 2014. Ca2+-dependent permeabilization of mitochondria and liposomes by palmitic and oleic acids: A comparative study. Biochim. Biophys. Acta. 1838 (10), 2600–2606.
Lowry O.H., Rosebrough N.J., Farr A.L., Randall R.J., 1951. Protein measurement with the Folin phenol reagent. J. Biol. Chem. 193 (1), 265–275.
Belosludtsev K.N., Belosludtseva N.V., Talanov E.Y, Tenkov K.S., Starinets V.S., Agafonov A.V., Pavlik L.L., Dubinin M.V. 2019. Effect of bedaquiline on the functions of rat liver mitochondria. Biochim. Biophys. Acta. 1861 (1), 288–297.
Augustynek B., Kunz W.S., Szewczyk A. 2017. Guide to the Pharmacology of Mitochondrial Potassium Channels. Handb. Exp. Pharmacol. 240, 103–127.
Mironova G.D., Kachaeva E.V., Kopylov A.T. 2007. Mitochondrial ATP-dependent potassium channel. 1. The structure of the channel, the mechanisms of its functioning and regulation. Vestn. Ross. Akad. Med. Nauk. (2) 34–43.
Белослудцев К.Н., Миронова Г.Д. 2012. Митохондриальная липидная пальмитат/Са2+-индуцированная пора и ее возможная роль в деградации нервных клеток. Патологическая физиология и экспериментальная терапия. (3), 20–32.
Smith R.A., Porteous C.M., Coulter C.V., Murphy M.P. 1999. Selective targeting of an antioxidant to mitochondria. Eur. J. Biochem. 263 (3), 709–716.
Xu Y., Kalyanaraman B. 2007. Synthesis and ESR studies of a novel cyclic nitrone spin trap attached to a phosphonium group-a suitable trap for mitochondria-generated ROS? Free Radic. Res. 41 (1), 1–7.
Quin C., Trnka J., Hay A., Murphy M.P., Hartley R.C. 2009. Synthesis of a mitochondria-targeted spin trap using a novel Parham-type cyclization. Tetrahedron. 65 (39), 8154–8160.
Robinson K.M., Janes M.S., Pehar M., Monette J.S., Ross M.F., Hagen T.M., Murphy M.P., Beckman J.S. 2006. Selective fluorescent imaging of superoxide in vivo using ethidium-based probes. Proc. Natl. Acad. Sci. USA. 103 (41), 15038–15043.
Cocheme H.M., Quin C., McQuaker S.J., Cabreiro F., Logan A., Prime T.A., Abakumova I., Patel J.V., Fearnley I.M., James A.M., Porteous C.M., Smith R.A., Saeed S., Carre J.E., Singer M., Gems D., Hartley R.C., Partridge L., Murphy M.P. 2011. Measurement of H2O2 within living Drosophila during aging using a ratiometric mass spectrometry probe targeted to the mitochondrial matrix. Cell Metab. 13 (3), 340–350.
Halestrap A.P., Richardson A.P. 2015. The mitochondrial permeability transition: A current perspective on its identity and role in ischaemia/reperfusion injury. J. Mol. Cell Cardiol. 78, 129–141.
Li Y., Tran Q., Shrestha R., Piao L., Park S., Park J., Park J. 2019. LETM1 is required for mitochondrial homeostasis and cellular viability. Mol. Med. Rep. 19 (5), 3367–3375.
Costa A.D., Garlid K.D. 2009. MitoKATP activity in healthy and ischemic hearts. J. Bioenerg. Biomembr. 41 (2), 123–126.
Mironova G.D., Shigaeva M.I., Gritsenko E.N., Murzaeva S.V., Gorbacheva O.S., Germanova E.L., Lukyanova L.D. 2010. Functioning of the mitochondrial ATP-dependent potassium channel in rats varying in their resistance to hypoxia. Involvement of the channel in the process of animal’s adaptation to hypoxia. J. Bioenerg. Biomembr. 42 (6), 473–481.
Дополнительные материалы отсутствуют.
Инструменты
Биологические мембраны: Журнал мембранной и клеточной биологии