Биологические мембраны: Журнал мембранной и клеточной биологии, 2020, T. 37, № 1, стр. 34-44
Изучение роли серотонина в мышечной функции у планарий
Н. Д. Крещенко *
Институт биофизики клетки Российской академии наук – обособленное подразделение
Федерального государственного бюджетного учреждения науки “Федеральный исследовательский центр
«Пущинский научный центр биологических исследований Российской академии наук”
142290 Московская обл., Пущино, Россия
* E-mail: nkreshch@rambler.ru
Поступила в редакцию 16.04.2019
После доработки 15.05.2019
Принята к публикации 16.05.2019
Аннотация
В настоящей работе с помощью иммуноцитохимического и гистохимического методов и конфокальной лазерной сканирующей микроскопии продемонстрировано близкое расположение периферических серотонинергических нервных элементов и мускулатуры тела у планарий Polycelis tenuis, Schmidtea mediterranea и Girardia tigrina. Такая локализация серотонинергических нейронов и их волокон свидетельствует о важной роли серотонина в регуляции мышечной функции у планарий. В ходе изучения механизмов мышечного сокращения у планарий было обнаружено, что деполяризация, вызванная высокой концентрацией ионов калия (15–100 мМ), а также серотонин (10–4–10–9 М), индуцировали сокращения изолированных мышечных волокон планарий Procerodes littoralis. Дигидропиридиновые блокаторы кальциевых каналов – никардипин, нитрендипин и нифедипин – подавляли калий- и серотонин-индуцированные мышечные сокращения, что указывает на зависимость сокращения от внеклеточного кальция. Тапсигаргин и циклопиазоновая кислота существенно уменьшали число клеток, сокращающихся в ответ на введение ионов калия, но не оказывали влияния на индукцию мышечного сокращения серотонином. Таким образом, сокращение, вызванное серотонином, не зависело от внутриклеточного кальция. Результаты свидетельствуют о наличии разнообразных рецепторов и ионных каналов, опосредующих мышечное сокращение у планарий.
ВВЕДЕНИЕ
У свободноживущих плоских червей турбеллярий (или планарий) мускулатура поддерживает форму тела, а также принимает участие в различных видах двигательной активности: перемещении, плавании, поиске добычи и ее захвате, осуществлении репродуктивного поведения. Планарии также используют мускулатуру для поглощения пищи с помощью мускулистой глотки. Планарии, обладая выдающейся регенерационной способностью, используются при изучении процессов регенерации и бесполого размножения, являются важным объектом в биологии стволовых клеток [1, 2]. В дополнение к этому, планарии являются удобной моделью для изучения механизмов мышечного сокращения, а также поиска новых антипаразитарных препаратов [3].
Серотонин (или гидрокситриптамин, 5-HT) относится к биогенным аминам и является широко распространенным в животном мире низкомолекулярным азотистым соединением [4]. Он обнаружен у животных из разных таксономических групп – млекопитающих, ракообразных, насекомых, моллюсков, червей [5–7]. Cеротонин как нейротрансмиттер регулирует у позвоночных животных чувство голода, температуру тела, болевую чувствительность, а также модулирует настроение, возбуждение, сексуальное поведение, выделение гормонов, играет роль в иммунном ответе [8–10]. Среди многочисленных свойств серотонина выделяется его возбуждающее действие на мускулатуру тела. Известно, что у млекопитающих серотонин вызывает сокращение гладкой мускулатуры кишечника, матки, бронхов, сосудов, регулирует сократительную функцию скелетной мускулатуры [9–13]. Он также регулирует сокращение мускулатуры кишечника у насекомых [14]. Однако у большинства беспозвоночных животных наличие серотонина и его функциональная роль изучены недостаточно.
Среди Platyhelminthes наиболее исследованными являются паразитические виды, относящиеся к классам трематод, цестод и моногеней, поскольку они имеют экономическое и медицинское значение. Многие виды трематод и цестод, являясь паразитами человека и сельскохозяйственных животных, причиняют серьезный вред здоровью людей и существенный экономический ущерб хозяйственной деятельности (животноводству, птицеводству, рыбному хозяйству). Серотонин был обнаружен в нервной системе паразитических червей Schistosoma mansoni, Hymenolepis diminuta, Moniezia expansa, Mesocestoides vogae, Aspidogaster conchicola, Opisthiogliphe ranae и других видов [15, 16]. Свободноживущие представители плоских червей – планарии – в этом отношении наименее изучены.
В настоящей работе изучали пространственное расположение серотонинергических нервных клеток и миофиламентов планарий в рамках исследования гипотезы о регуляторной роли серотонина в функционировании их мускулатуры. Проведены иммуногистохимические и физиологические исследования, позволяющие пролить свет на роль серотонина в мышечном сокращении у планарий. Выявлено тесное пространственное взаимодействие серотонинергических нейронов и их отростков с мускулатурой тела планарий Polycelis tenuis, Schmidtea mediterranea и Girardia tigrina. Показано, что серотонин, так же как избыток ионов калия (К+), индуцирует сокращение мускулатуры планарий Procerodes littoralis.
Проведенные исследования представляют теоретический и практический интерес: они раскрывают некоторые регуляторные механизмы возбуждения и сокращения мускулатуры у планарий. Полученные сведения могут быть использованы при разработке новых антипаразитарных препаратов, мишенью действия которых является мускулатура паразитических червей.
МАТЕРИАЛЫ И МЕТОДЫ
Для определения серотонина в нервной системе планарий использовали виды: Polycelis tenuis, Schmidtea mediterranea и Girardia tigrina. Исследования проводили в ИБК РАН (г. Пущино, Россия). Физиологические исследования проведены на планариях Procerodes littoralis в Королевском университете г. Белфаст, Великобритания. Для гистохимического выявления мускулатуры и иммуноцитохимического определения серотонинергических нервных компонентов готовили замороженные срезы (P. tenuis, S. mediterranea) и тотальные препараты (G. tigrina) планарий длиной 9–10 мм. Образцы фиксировали 4% параформальдегидом (MP Biomedicals, США) в 0.1 М фосфатном буфере (PBS, pH 7.4; Helicon, Pоccия) в течение 4 ч при комнатной температуре, последующие процедуры проводили при 4°С. Для приготовления тотальных препаратов образцы промывали PBST, содержащем PBS с добавлением 0.3% Тритона X-100 (Sigma), 0.1% азида натрия и 0.1% бычьего сывороточного альбумина (Amresco, CША). Затем образцы помещали на 48 ч в раствор первичных поликлональных (whole serum) кроличьих неконъюгированных антител к серотонину (Immunostar, США, кат. № 20 080, концентрация 1 : 500; или Sigma, США, кат. № 5545, концентрация 1 : 1000), промывали в PBS и инкубировали в среде, содержащей вторичные FITC-конъюгированные свиные анти-кроличьи антитела (Daco, Дания, кат. № F-025, разведение 1 : 40, 48 ч) или вторичные козьи анти-кроличьи конъюгированные с Alexa Fluor488 антитела (Molecular Probes, США, кат. № A1108, разведение 1 : 100, 48 ч). Для приготовления замороженных срезов фиксированный материал помещали в 10% раствор сахарозы (Helicon, Россия) на 3–5 сут, после чего на криотоме Shandon Cryomatrix (Termoelectron Corporation, США) пpи температуре –18…–20°C готовили замороженные срезы с помощью заливочной среды Tissue Tek (Tissue Tek, США). Срезы собирали на обpаботанные поли-L-лизином пpедметные cтекла (Polysine, Menzel-Glaser, Геpмания), высушивали на воздухе 1 ч и xpанили пpи –20°C. Перед окраской препараты промывали в PBST (3 раза по 5 мин в горизонтальном положении) и окрашивали во влажной камере при 4°C антителами к серотонину (Immunostar, США, 1 : 1000 или Sigma, 1 : 1000) в течение 48 ч. После промывки в PBS (3 × 5 мин) препараты помещали во вторичные иммуноглобулины (Daco, Дания, 1 : 50) на 24 ч и снова промывали в PBS (3 × 5 мин). Для идентификации мускулатуры тела препараты докрашивали TRITC-(тетраметилродамин изотиоцианат)-меченым фаллоидином (Sigma, 1 : 200) в течение 6–12 ч. Окончательно препараты промывали PBS, заключали в 75% раствор глицерина (Helicon, Pоccия) и накрывали покровным стеклом.
Отрицательный контроль включал: (1) инкубацию образцов в растворе без первичных антител и (2) использование неиммунной сыворотки вместо иммунной.
Микpоcкопия. Готовые окpашенные cpезы изучали c помощью флуоpеcцентного микpоcкопа Leica DM6000 B (Leica Mycrosystems, Геpмания), оcнащенного цифровой фотокамерой DC300F (Leica Mycrosystems, Геpмания) в Центре коллективного пользования ПНЦБИ РАН (Пущино). Для анализа использовали фильтры пpоxодящего cвета (ВF), а также возбуждающего света с длиной волны в 450–490 нм (I3) для флуоpоxpома FITC (fluorescein isothiocyanate) и Alexa488, и c длиной волны 515–560 нм (N2.1) для локализации флуоpоxpома TRITC (tetramethylrhodamine isothiocyanate).
Тотальные пpепаpаты планаpий анализиpовали c помощью конфокального лазеpного cканиpующего микpоcкопа Leica TCS SP5 (Leica Mycrosystems, Геpмания). Микpофотогpафии c конфокального лазеpного cканиpующего микpоcкопа пpедcтавлены в виде cуммаpной пpоекции от 12–32 поcледовательныx оптичеcкиx cpезов, полученныx пpи cканиpовании чеpез толщину тканей в 30–60 мкм и cуммиpованныx (пpи необxодимоcти получения cуммаpного изобpажения) c макcимальной интенcивноcтью флуоpеcценции пpи помощи пpогpаммы анализа изобpажений, пpилагаемой к конфокальному микpоcкопу. Микpофотогpафии, полученные с помощью флyоpеcцентного и конфокального микpоcкопов, cоxpаняли в виде файлов в фоpмате TIFF. Размеры изображений варьировали в зависимости от микроскопа и увеличения (например, от 1024 × 1024 до 4096 × 4096 пикселей). Для анализа иcпользовали по 5–7 пpепаpатов каждого вида планарий.
Физиология. Для изучения мышечного сокращения были использованы изолированные мышечные волокна планарий. Метод выделения индивидуальных мышечных волокон у паразитических червей успешно применялся ранее [17]. Мышечные волокна получали с помощью энзиматического расщепления. Из 25 особей (P. littoralis) с помощью тонкого скальпеля готовили гомогенат тканей, который помещали в инкубационную среду (ИС), содержащую 13.6 мМ CaCl2, 13.4 мМ KCl, 458 мМ NaCl, 9.8 мМ MgCl2 · 6H2O, 13.6 мМ Na2SO4, 10 мМ Hepes, 10 мМ D-глюкозы; и 1% раствора антибиотка/антимикотика (GibcoBRL, Великобритания), в который добавляли: 0.11 мг/мл коллагеназы (type 1A, из Clostridium hystoliticum, Sigma), 0.15 мг/мл протеазы (type XIV, из Streptomyces griseus, Sigma), и 0.15 мг/мл дитиотреитола (dithiothreitol, Sigma) и оставляли на 12 ч при 4°C.
Полученную смесь тканевых фрагментов и среды перемешивали на магнитной мешалке 10 мин и бережно пропускали через тонкий кончик пипетки. Cуспензию помещали в 15 мл пробирки (Falcon) и центрифугировали при 28 g в течение 5 мин (при 4°C). Супернатант сливали, а осадок ресуспендировали в инкубационной среде, не содержащей ферментов, в течение 15 мин (4°C). После этого суспензию мышечных клеток распределяли в 50-мм чашки Петри (Falcon) по 3 мл в каждую, и оставляли при 4°C на 30–90 мин для исследования.
Микроперфузионная система, соединенная с инвертированным микроскопом Nikon Eclipse TE200 (Япония) использовалась для визуального наблюдения мышечного сокращения. Под микроскопом с помощью инжектора и тонкой стеклянной микропипетки (диаметр кончика 5 мкм) исследуемое вещество вводили в непосредственной близости к мембране мышечной клетки. Ответы на введение вещества исследовали в свежеприготовленной культуре мышечных клеток планарий. Сокращение мышечного волокна наблюдали на экране монитора, соединенного с микроскопом. Данные представлены в виде процента мышечных волокон, сокращающихся в течение 30 с после введения тестируемого вещества. Во всех экспериментах использовали только неподвижные – спонтанно не сокращающиеся мышечные клетки. Перед использованием тестируемого вещества проводили аппликацию инкубационной среды без добавок (негативный контроль); после аппликации тестируемых веществ на клетки подавалась среда с высоким (20 мМ) содержанием ионов калия (K+) (положительный контроль).
В одной серии опытов использовали сто случайно выбранных мышечных клеток, взятых из четырех чашек Петри. Опыты повторяли по крайней мере 3 раза. Изучали действие серотонина (Sigma) и среды с высоким содержанием ионов калия (K+, 15–90 мМ) в сочетании с избранными антагонистами ионных каналов. Для исследования роли внеклеточного кальция в мышечном сокращении использовали блокаторы кальциевых каналов – никардипин, нитрендипин, нифедипин (дигидропиридины), а также метоксиверапамил и дилтиазем (все вещества в концентрациях 10 и 100 мкМ). Для изучения участия внутриклеточного кальция в серотонин-индуцируемом мышечном сокращении использовали ингибиторы Ca2+-ATP-азы саркоплазматического ретикулума – циклопиазоновую кислоту и тапсигаргин.
Во всех случаях антагонисты добавляли в чашки Петри за 10 мин до начала опыта (тестирования). Для статистической обработки результатов использовали t-тест Стьюдента. Результаты физиологических исследований были ранее частично опубликованы в виде тезисов докладов [18].
РЕЗУЛЬТАТЫ
Гистохимическое и иммуноцитохимическое исследование
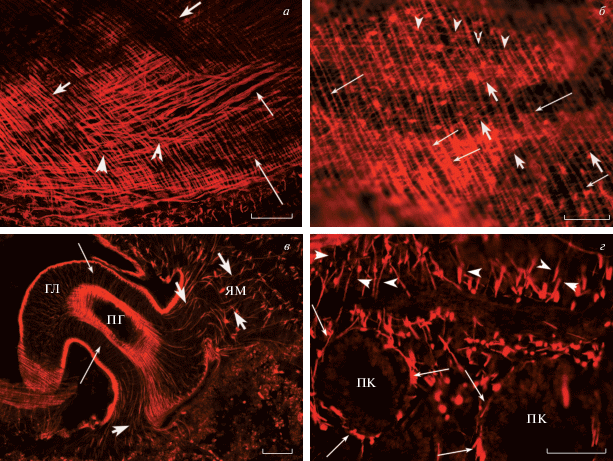
Мускулатура. У планарий S. mediterranea, P. tenuis и G. tigrina окраска фаллоидином была обнаружена в мускулатуре стенки тела (рис. 1а, 1б), а также в специализированных органах (кишечник, глотка, рис. 1в, 1г) и репродуктивной системе планарий P. tenuis, размножающихся половым способом. Стенка тела планарий состоит из наружных кольцевых (рис. 1а, короткие толстые стрелки) и внутренних продольных мышечных волокон (рис. 1а, длинные тонкие стрелки), составляющих компактно упакованные слои мышц. Между ними расположены немногочисленные и неплотно расположенные диагональные мышечные волокна (рис. 1а и 1б, острия стрелок). Поперечные мышечные тяжи, состоящие из нескольких волокон, соединяют спинную и брюшную стенки тела. Дорзо-вентральные мышечные волокна расположены более или менее равномерно и пронизывают все тело планарии (рис. 1г, острия стрелок). Мускулатура глотки (рис. 1в, длинные стрелки), имеющая форму трубки, расположенной в центральной части туловища, представлена кольцевыми и продольными мышечным слоями. Обнаружены мышцы, расположенные у основания глотки и прикрепляющие глотку к мускулатуре тела планарии – якорные мышцы глотки (рис. 1в, короткие стрелки). Окраска фаллоидином выявлена в тонких мышечных филаментах, окаймляющих ветви слепого кишечника планарий. Мускулатура кишечника содержит, по крайней мере, кольцевые (рис. 1г, длинные стрелки), а также продольные мышечные волокна (не показано).
Рис. 1.
Гистохимическая окраска мускулатуры тела планарий Girardia tigrina (а), Schmidtea mediterranea (б) и Polycelis tenuis (в, г): кольцевые (короткие толстые стрелки, продольные (длинные тонкие стрелки) и диагональные (острия стрелок) мышечные волокна стенки тела планарий (а, б); мускулатура глотки (гл, длинные стрелки; пг – полость глотки) и якорные мышцы (ям) глотки (в, короткие стрелки); мускулатура кишечника (г) – кольцевые волокна (длинные стрелки, пк – полость кишечника), и вверху мышечные волокна, соединяющие брюшную и спинную стороны тела планарии (острия стрелок). а – Конфокальная лазерная сканирующая микроскопия. б–г – Флуоресцентная микроскопия. Масштаб: a – 50 мкм, б – 40 мкм, в, г – 100 мкм.
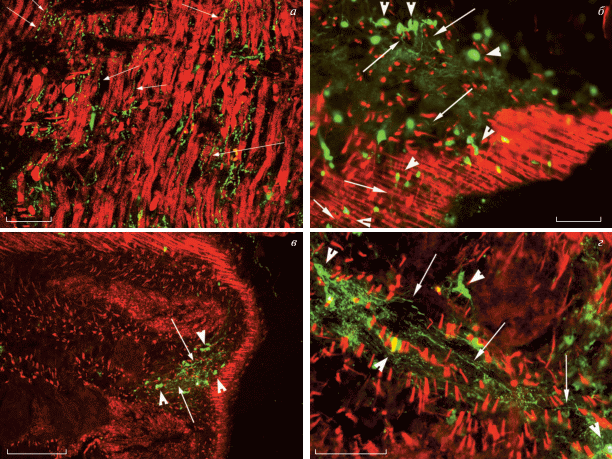
Серотонин. У планарий S. mediterranea и P. tenuis положительная окраска на серотонин обнаружена в нейронах и волокнах центральной нервной системы: головном ганглии, нервных стволах, отходящих от головного ганглия, и простирающихся вдоль боковых сторон тела, а также в поперечных комиссурах, соединяющих нервные стволы. Серотонинергические нервные компоненты описаны также в центральной нервной системе планарий G. tigrina [19]. В настоящем исследовании продемонстрировано обилие серотонинергических нервных элементов – нейронов (рис. 2а, 2в, 2г, острия стрелок) и их волокон (рис. 2а, 2б, 2г, тонкие стрелки) в периферических отделах нервной системы у трех исследованных видов планарий: S. mediterranea, P. tenuis и G. tigrina. Характерной особенностью локализации серотонинергических нервных элементов в периферических отделах нервной системы планарий оказалось их расположение вблизи мышечных волокон (рис. 2а, 2б). Такое расположение серотониновых нейронов и их волокон может свидетельствовать об участии биогенного амина серотонина в регуляции мышечной функции у планарий.
Рис. 2.
Иммуноцитохимическая окраска к серотонину (зеленым) и гистохимическая окраска мускулатуры (красным) у планарий Girardia tigrina (а), Schmidtea mediterranea (б) и Polycelis tenuis (в, г). Серотонинергические нервные волокна (тонкие стрелки) и тела нейронов (острия стрелок) в непосредственной близости к мышечным волокнам. а – Конфокальная лазерная сканирующая микроскопия. б–г – Флуоресцентная микроскопия. Масштаб: a – 40 мкм; б – 50 мкм; в – 200 мкм; г – 100 мкм.
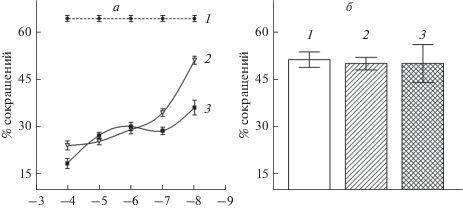
Физиологические исследования. Чтобы проверить предположение об участии серотонина в регуляции мышечной функции, были проведены физиологические исследования влияния серотонина на изолированные мышечные волокна, выделенные у планарий P. littoralis. Обнаружено, что ионы калия в высокой концентрации, а также серотонин вызывали сокращение мышечных волокон планарий (рис. 3а, 3б). Избыток ионов калия в среде (K+), начиная с концентрации 15 мМ, вызывал сокращение мышечных клеток (около 20%), в концентрации 40 мМ K+ индуцировал сокращение около 80% мышечных волокон, при концентрациях ионов калия в диапазоне 40–80 мМ кривая сокращений выходила на плато (рис. 3а). Никардипин в концентрациях 10 и 100 мкМ, а также нитрендипин и нифедипин в концентрации 100 мкМ уменьшали число клеток, сокращающихся в ответ на высокую концентрацию ионов калия (табл. 1). Данные подтверждают наличие ионных кальциевых каналов на мембране мышечной клетки планарий.
Рис. 3.
Физиология мышечного сокращения у планарий Procerodes littoralis. а – Зависимость интенсивности мышечного сокращения от концентрации ионов калия (в мМ, ось абсцисс); процент сокращений мышечных волокон (ось ординат), в каждой точке графика число повторов N равно от 4 до 20 для разных точек графика, число клеток в серии n = 100. б – Кривая зависимости мышечного сокращения (ось ординат) от десятичного логарифма концентрации серотонина (5-HT) (ось абсцисс); число повторных опытов N равно от 6 до 16 для разных точек графика, число клеток в одной серии n = 100. Разбросы (везде) – стандартное отклонение.
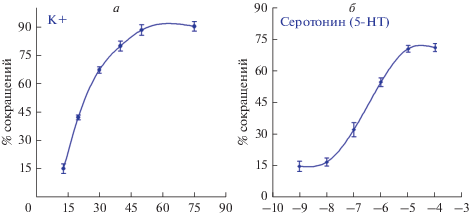
Таблица 1.
Процент сокращений изолированных мышечных волокон планарий P. littoralis в ответ на введение раствора с высоким содержанием ионов калия (30 мМ K+) после предварительной инкубации клеток с блокаторами кальциевых каналов
| Блокатор | Концентрация блокатора, М | Процент сокращений мышечных волокон ± SE | Число опытов N |
|---|---|---|---|
| Контроль (30 мМ K+) | – | 64.4 ± 2.44 | 9 |
| Никардипин | 10–5 | 8.0 ± 2.52* | 4 |
| 10–4 | 3.0 ± 1.0* | 8 | |
| Нитрендипин | 10–5 | 60.0 ± 3.69 | 4 |
| 10–4 | 4.0 ± 1.03* | 6 | |
| Нифедипин | 10–5 | 64.0 ± 2.58 | 4 |
| 10–4 | 32.2 ± 2.01* | 9 | |
| Дилтиазем | 10–5 | 69.0 ± 2.32 | 4 |
| 10–4 | 58.3 ± 2.91 (ns) | 8 | |
| Метоксиверапамил | 10–5 | 67.0 ± 2.52 | 4 |
| 10–4 | 61.0 ± 3.02 | 4 |
Серотонин вызывал сокращение мышечных волокон планарий P. littoralis в дозозависимой манере (рис. 3б) в концентрациях от 10–4 до 10–9 М, при его введении вблизи мембраны клетки. Дигидропиридиновые блокаторы кальциевых (Ca2+) каналов L-типа существенно (p < 0.001) уменьшали число мышечных клеток, сокращающихся в ответ на введение серотонина (рис. 4); порядок ингибирующей активности был следующим: никардипин > нитрендипин > нифедипин. Дилтиазем, бензотиазепиновый блокатор Ca2+ каналов, в концентрациях 10 мкМ и 100 мкМ не оказывал существенного влияния на индуцированное серотонином мышечное сокращение. Метоксиверапамил (10 и 100 мкМ), фенилалкиламиновый блокатор Ca2+ каналов, не подавлял серотонин-индуцированные сокращения мышечных клеток планарий (рис. 4). Тапсигаргин и циклопиазоновая кислота (10–4–10–8 М) значительно уменьшали число мышечных волокон, сокращающихся в ответ на высокую концентрацию калия (30 мМ, рис. 5а), но не оказывали существенного влияния (в концентрации 10–5 и 10–7 М) на серотонин-индуцированное мышечное сокращение (рис. 5б).
Рис. 4.
Процент сокращений изолированных мышечных волокон (ось ординат) в ответ на введение серотонина (5-HT) (10–5 М, N = 15, число клеток в одной серии везде n = 100) при предварительном, в течение 10 мин, инкубировании клеток с дигидропиридиновыми блокаторами: никардипином 10 мкМ (N = 4) и 100 мкМ (N = 4); нитрендипином 10 мкМ (N = 4) и 100 мкМ (N = 4) и нифедипином 10 мкМ (N = 9) и 100 мкМ (N = 4); а также с метоксиверапамилом 10 мкМ (N = 4) и 100 мкМ (N = 3) и дилтиаземом 10 мкМ (N = 6) и 100 мкМ (N = 4). Разбросы – стандартная ошибка среднего (SE). *** – отличие от контроля (5-HT, 10–5 М), достоверно при (p < 0.001).
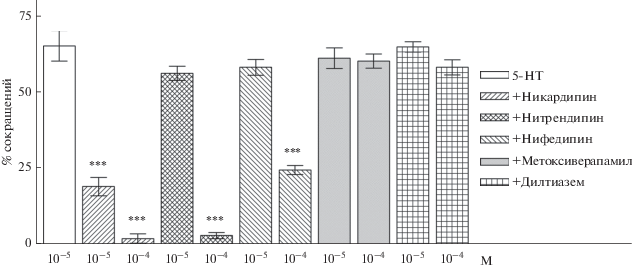
Рис. 5.
а – Воздействие тапсигаргина и циклопиазоновой кислоты на сокращение изолированных мышечных волокон планарий, вызванное избытком ионов К+ (30 мМ). По оси ординат – процент сократившихся мышечных волокон в ответ на введение ионов калия, по оси абсцисс – десятичный логарифм концентрации тапсигаргина и циклопиазоновой кислоты, добавленных в культуру мышечных клеток за 10 мин до начала эксперимента. 1 – Контроль, среднее значение (N = 18) процента мышечных сокращений в ответ на введение раствора с высоким содержанием ионов калия (30 мМ), внизу – эмпирические кривые, описывающие ответы мышечных волокон после их предварительной инкубации с циклопиазоновой кислотой (2) и тапсигаргином (3), построенные с помощью Fit spline анализа статистической программы GraphPad Prizm 3.02 Software Inc. Число повторных опытов в каждой точке двух нижних кривых – от 3 до 7. Разбросы – стандартная ошибка среднего (SE). б – Число сокращений изолированных мышечных клеток планарий, индуцированных 10–5 М серотонином (1) после предварительного культивирования с 10–5 М тапсигаргином (2) и 10–5 М циклопиазоновой кислотой (3). Разбросы – стандартное отклонение.
ОБСУЖДЕНИЕ
Разработка гистохимической методики идентификации актиновых филаментов с помощью токсина из бледной поганки Amanita phalloides – фаллоидина, способного необратимо связываться с фибриллярным актином мышечной клетки, привела к существенному прогрессу в исследовании цитоскелета мышечного волокна. Конъюгация фаллоидина с флуорохромом (например, TRITC или FITC) позволила исследовать окрашенные ткани с помощью флуоресцентного или конфокального сканирующего микроскопов [20, 21]. Наличие актина у планарий было продемонстрировано итальянскими исследователями в 1992 году [22]. Однако, несмотря на некоторый прогресс в области изучения мускулатуры у представителей плоских червей, и, в частности, планарий, сведения о ее строении и тем более о ее функционировании, ограничены для большинства известных видов. Так, анатомия мышечной системы была детально изучена только у нескольких видов планарий – Dugesia japonica [23], G. tigrina, P. tenuis [21, 24], S. mediterranea [25]. Морфология муcкулатуpы у планарий G. tigrina,S. mediterranea и P. tenuis, используемых в настоящей работе, имеет общие черты. Так, мышечная cтенка тела у этих животных выcоко упоpядочена и pегуляpно оpганизована: под наpужными кольцевыми мышечными волокнами pаcполагаются внутpенние пpодольные волокна, вмеcте они cоcтавляют компактно упакованные cлои мышц. Немногочисленные и редко расположенные диагональные мышечные волокна локализуются между продольными и кольцевыми слоями миофибрилл. У G. tigrina расположение миофиламентов в стенке тела менее плотное по сравнению с S. mediterranea. Наиболее компактно мышечные волокна упакованы у планарий P. tenuis, однако pаcположение cлоев у G. tigrina не отличаетcя от такового у P. tenuis. Доpзо-вентpальные мышечные волокна более или менее pавномеpно пpонизывают вcе тело планарии. Настоящая работа показала консервативность общего плана строения мускулатуры тела у изучаемых видов планарий.
С помощью иммуноцитохимического метода и специфических антител в нервной системе планарий P. littoralis были выявлены два нейропептида – NPF и GNFFRFамид. Пространственное расположение пептидергических структур позволило описать базовую морфологию центральной нервной системы у данного вида планарий [26, 27]. В доступной литературе сведений о наличии серотонина в нервной системе P. littoralis не имеется. Серотонинергические клетки и волокна обнаружены в нервной системе некоторых других близкородственных видов, например, Crenobia alpina, Microstomum lineare, Castrella truncate, S. mediterranea, Dendrocoelum lacteum, Planaria torva (для ссылок см. [19]). У G. tigrina серотониновые нейроны были описаны в глотке [28] и центральной нервной системе [19, 29].
В исследованиях, посвященных выявлению серотонина у планарий, взаимодействие серотонинергических нервных волокон и мышечных филаментов либо вообще не изучалось, либо окраска мускулатуры в ходе идентификации серотонинергических нервных элементов не проводилась. Так, о тесном соседстве мышечных и серотониновых нервных волокон у планарий S. mediterranea есть упоминание в работе Цебрия [30]. В работе [31] авторы наблюдали проникновение тонких серотонин-иммунопозитивных нервных волокон в глубь мускулатуры тела у планарий B. kewense. В настоящем исследовании, проведенном с помощью высокоспецифического окрашивания тканей антителами к серотонину и гистохимического окрашивания мышечных филаментов флуоресцентно меченным фаллоидином, было продемонстрировано тесное взаиморасположение серотонинергических нервных элементов (клеток и волокон) и мускулатуры тела у трех видов планарий – P. tenuis, G. tigrina и S. mediterranea. Полученные данные могут указывать на важную роль нейромедиатора серотонина в регуляции функциональной активности мускулатуры планарий.
Роль серотонина в организме планарий мало изучена. Имеются единичные работы, в которых выяснялось участие серотонина в регуляции мышечной или локомоторной активности. В этих работах показано, что серотонин стимулирует биение ресничек, покрывающих поверхность тела планарий, и способствует их передвижению в воде [32], а также вызывает специфические движения (“сворачивания”, “скручивания”) при добавлении в воду [33]. В литературе же, касающейся паразитических видов Platyhelminthes, ранее обсуждалась роль серотонина как в индукции двигательной активности целых червей [34], так и в отношении мышечных препаратов или изолированных мышечных волокон [35, 36]. Однако в силу объективных трудностей работы с паразитическими видами, когда требуется большое количество животных для постановки физиологических экспериментов, исследования носили нерегулярный характер, и точные механизмы действия серотонина на мускулатуру не были определены.
Исследования, проводимые на планариях, близких родственников паразитических червей, которые введены в лабораторную культуру и доступны в больших количествах для проведения экспериментов, могут пролить свет на механизмы мышечного сокращения у плоских червей. Методика получения жизнеспособных изолированных мышечных волокон у планарий разработана в Королевском Университете Белфаста (Queen’s University of Belfast, Великобритания). Эта процедура позволила исследовать прямое действие тестируемых веществ на отдельную мышечную клетку без влияния окружающих ее тканей и нервных импульсов. Pабота Mоннипени c соавторами [37] была первой, в которой продемонстрировано индуцирующее влияние серотонина на сокращение отдельной мышечной клетки планарий. Представленные здесь данные – это продолжение начатых исследований по изучению мышечного сокращения и идентификации серотониновых рецепторов у планарий. Полученные результаты подтвердили, что высокая концентрация ионов калия и серотонин вызывают сокращение мышечных волокон у P. littoralis. Исследования показали, что как серотонин-индуцированное, так и вызванное деполяризацией мышечное сокращение зависит от внеклеточного кальция, поскольку блокируется дигидропиридиновыми блокаторами кальциевых каналов (никардипином, нитрендипином и нифедипином). Тапсигаргин и циклопиазоновая кислота, специфические ингибиторы Са2+-АТР-азы мембраны эндоплазматического ретикулума, вызывающие пассивный выход Са2+ из внутриклеточных депо в цитозоль, значительно уменьшали число мышечных сокращений в ответ на высокую концентрацию ионов калия (деполяризацию), но не влияли на серотонин-индуцированное сокращение. Таким образом, сокращение, вызванное серотонином, не зависело от запасов внутриклеточного кальция. Результаты настоящего исследования свидетельствуют о том, что у планарий присутствуют кальциевые ионные каналы (на момент проведения опытов еще не выявленные), обладающие некоторыми свойствами кальциевых каналов позвоночных животных. Отсутствие ингибирующего действия кальциевых блокаторов дилтиазема и метоксиверапамила на сокращение мышечных клеток планарий может указывать на то, что кальциевые каналы планарий отличаются от кальциевых каналов позвоночных. Возбуждающее влияние серотонина на мускулатуру планарий, зависящее от внеклеточного кальция, но не зависящее от внутриклеточных резервов кальция, указывает на существование специфических серотониновых рецепторов, механизм действия которых требует дальнейшего изучения.
Помимо физиологических исследований, проведенные отдельные фармакологические и молекулярно-биологические исследования также свидетельствуют о наличии серотониновых рецепторов у свободноживущих и паразитических плоских червей [38–43]. Высказаны предположения о том, что циклический AMP является посредником в осуществлении серотонином физиологического действия у планарий [38], однако сами рецепторы на молекулярном уровне в то время еще не были идентифицированы. Позднее у планарий D. japonica были выявлены четыре G-белок сопряженных рецептора, получивших название 5HTLpla1–4, нуклеотидные последовательности которых были полностью установлены. Эти последовательности имели существенную гомологию с 5HT1A серотониновым рецептором человека и Drosophila5HTdrol рецептором дрозофилы [39]. Еще один рецептор планарий DjSER-7 продемонстрировал высокое сродство к серотонину при его встраивании в ооциты шпорцевой лягушки [40]. Недавно в геномных базах данных паразитических трематод S. mansoni и свободноживущих планарий S. mediterranea было выявлено большое количество гептаспиральных рецепторов, сопряженных с G-белками, из которых 24 у S. mansoni и 66 у S. mediterranea рассматриваются как возможные аминергические рецепторы [41, 42]. Показано снижение двигательной активности взрослых шистосом (S. mansoni) при уменьшении экспрессии одного из рецепторов серотонина (5HTR7) в результате РНК интерференции [43]. Таким образом, проведенные нами иммуноцитохимические и физиологические исследования, наши предыдущие результаты [37] и имеющиеся литературные сведения [39, 43] позволяют предположить, что серотониновые рецепторы планарий локализуются на мембране мышечных клеток и опосредуют миостимулирующее действие серотонина. Изучение механизмов действия серотонина и типа рецепторов, через который этот биогенный амин осуществляет свое влияние у плоских червей, планарий, продолжается. Исследования, проводимые на этих относительно простых организмах, позволяют получить фундаментальную информацию о природе мышечного возбуждения и сокращения и его регуляторных механизмах у животных, находящихся у истоков эволюционного развития всех Bilateria.
Автор выражает благодарность проф. А.Г. Молу (A.G. Maule) и проф. Д.В. Халтону (D.W. Halton) Королевского Университета г. Белфаста (Queen’s University of Belfast, Nothern Ireland, UK) за предоставленную возможность работать в лаборатории, а также А. Моусли (Dr. A. Mousley) за помощь в освоении методики культивирования мышечных клеток планарий и ценные рекомендации. Работа в части физиологии мышечного сокращения была поддержана стипендией Королевского Общества Великобритании (Royal Society Fellowship Programme, Великобритания). Иммуноцитохимические исследования по идентификации серотонина в нервной системе планарий поддержаны грантом РФФИ № 18-04-00349а.
Список литературы
Baguna J. 1981. Planarian neoblasts. Nature. 290, 14–15.
Grohme M.A., Schloissnig S., Rozanski A., Pippel M., Young G.R., Winkler S., Brandl H., Henry I., Dahl A., Powell S., Hiller M., Myers E., Rink J.Ch. 2018. The genome of Schmidtea mediterranea and the evolution of core cellular mechanisms. Nature. 554, 56–61. https://doi.org/10.1038/nature25473
Nogi T., Zhang D., Chan J.D., Marchant J.S. 2009. A novel biological activity of praziquantel requiring voltage-operated ca channel Beta subunits: Subversion of flatworm regenerative polarity. PLoS Negl. Trop. Dis. 3 (6), e464.
Page I. H. 1976. The discovery of serotonin. Perspect. Biol. Med. 20 (1), 1–8.
Хожай Л.И., Пучков В.Ф., Отеллин В.А. 1995. Влияние недостатка серотонина на эмбриональное развитие млекопитающих. Онтогенез. 26 (5), 350–355.
Vleugels R., Verlinden H., Vanden Broeck J. 2015. Serotonin, serotonin receptors and their actions in insects. Neurotransmitter. 2, e314. https://doi.org/10.14800/nt.314
Ivashkin E.G., Khabarova M.Yu., Melnikova V.I., Kharchenko O.A., Voronezhskaya E.E. 2017. Local serotonin-immunoreactive plexus in the female reproductive system of hermaphroditic gastropod mollusc Lymnaea stagnalis. Invertebrate Zoology. 14 (2), 134–139.
Baganz N.L., Blakely R.D. 2013. A dialogue between the immune system and brain, spoken in the language of serotonin. ACS Chem. Neurosci. 4 (1), 48–63.
Plieger T., Melchers M., Vetterlein A., Görtz J., Kuhn S., Ruppel M., Reuter M. 2017. The serotonin transporter polymorphism (5-HTTLPR) and coping strategies influence successful emotion regulation in an acute stress situation: Physiological evidence. Int. J. Psychophysiol. 114, 31–37.
Okaty B.W., Commons K.G., Dymecki S.M. 2019. Embracing diversity in the 5-HT neuronal system. Nat. Rev. Neurosci.https://doi.org/10.1038/s41583-019-0151-3
Gershon M.D. 2004. Review article: Serotonin receptors and transporters – roles in normal and abnormal gastrointestinal motility. Aliment. Pharmacol. Ther. 20 (7), 3–14.
Sung D.J., Noh H.J., Kim J.G., Park S.W., Kim B., Cho H., Bae Y.M. 2013. Serotonin contracts the rat mesenteric artery by inhibiting 4-aminopyridine-sensitive Kv channels via the 5-HT2A receptor and Src tyrosine kinase. Exp. Mol. Med. 45, e67. https://doi.org/10.1038/emm.2013.116
Zavaritskaya O, Lubomirov L.T., Altay S., Schubert R. 2017. Src tyrosine kinases contribute to serotonin-mediated contraction by regulating calcium-dependent pathways in rat skeletal muscle arteries. Pflugers Arch. 469 (5–6), 767–777. https://doi.org/10.1007/s00424-017-1949-3
French A.S., Simcock K.L., Rolke D., Gartside S.E., Blenau W., Wright G.A. 2014. The role of serotonin in feeding and gut contractions in the honeybee. J. Insect. Physiol. 61, 8–15. https://doi.org/10.1016/j.jinsphys.2013.12.005
Hrchkova G., Halton D.W., Maule A.G., Show Ch., Johnston C.F. 1994. 5-Hydroxytryptamine (serotonin)-immunoreactivity in the nervous system of Mesocestoides corty tetrathyridia (Cestoda: Cyclophyllidea). J. Parasitol. 80 (1), 144–148.
Теренина Н.Б., Густавссон М.К.С. 2014. Функциональная морфология нервной системы паразитических плоских червей (трематоды, цестоды). М.: КМК Товарищество научных изданий. 296 с.
Blair K.L., Day T.A., Lewis M.C., Bennett J.L., Pax R.A. 1991. Studies on muscle cells isolated from Schistosoma mansoni: a Ca2+-dependent K+ channel. Parasitol. 102, 251–258.
Totten M., Kreshchenko N., Day T., Marks N., Halton D.W., Maule A.G. 2002. Signal transtduction mechanisms mediating muscle contraction in platyhelminth. In: Proceedings of the 10th International Congress of Parasitology. Vancouver, Canada. p. 117.
Крещенко Н.Д. 2016. Иммуноцитохимическая идентификация серотонинергических нейронов у планарий Girardia tigrina. Биол. мембраны. 33 (5), 353–362.
Wulf E., Deboben A., Bautz F.A., Faulstich H., Wieland T. 1979. Fluorescent phallotoxin, a tool for the visualization of cellular actin. Proc. Natl. Acad. Sci. USA. 76, 4498–4502.
Крещенко Н.Д. 2017. Некоторые детали морфологического строения мускулатуры планарий, идентифицированные с помощью флуоресцентной и конфокальной лазерной сканирующей микроскопии. Биофизика. 62 (2), 347–354.
Pascolini R., Panara F., Di Rosa I., Fagotti A., Lorvik S. 1992. Characterization and fine structural localization of actin- and fibronectin-like proteins in planaria (Dugesia lugubris s.1). Cell. Tiss. Res. 267, 499–506.
Orii H., Ito H., Watanabe K. 2002. Anatomy of the planarian Dugesia japonica. I. The muscular system revealed by antisera against myosin heavy chain. Zoological Science. 19, 1123–1131.
Bueno D., Baguñà J., Romero R. 1997. Cell-, tissue-, and position-specific monoclonal antibodies against the planarian Dugesia (Girardia) tigrina. Histochem. Cell. Biol. 107, 139–149.
Cebrià F. 2016. Planarian body-wall muscle: regeneration and function beyond a simple skeletal support. Front. Cell Develop. Biol. 4, 8. https://doi.org/10.3389/fcell.2016.00008
Reuter M., Gustafsson M.K.S., Sahlgren C., Halton D.W., Maule A.G. Shaw Ch. 1995a. The nervous system of Tricladida. I. Neuroanatomy of Procerodes littoralis (Maricola, Procerodidae): An immunocytochemical study. Invert. Neurosci. 1, 11–122.
Mäntylä K., Reuter M., Halton D.W., Maule A.G., Brennan G.P., Shaw C., Gustafsson M.K.S. 1998b. The nervous system of Procerodes littoralis (Maricola, Tricladida). An ultrastructural and immunoelectron microscopical study. Acta Zoologica. 79, 1–8.
Kreshchenko N.D., Reuter M., Sheiman I.M., Halton D.W, Johnston R.N., Shaw Ch., Gustafsson M.K.S. 1999. Relationship between musculature and nervous system in the regenerating pharynx in Dugesia tigrina (Plathelminthes). Invert. Reprod. Dev. 35 (2), 109–125.
Reuter M., Gustafsson M.K., Sheiman I.M., Terenina N., Halton D.W., Maule A.G., Shaw C. 1995b. The nervous system of Tricladida. II. Neuroanatomy of Dugesia tigrina (Paludicola, Dugesiidae): An immunocytochemical study. Invert. Neurosci. 1, 133–143.
Cebrià F. 2008. Organization of the nervous system in the model planarian Schmidtea mediterranea: An immunocytochemical study. Neurosci. Res. 61, 375–384.
Fernandes M.C., Alvares E.P., Gama P., Silveira M., 2003. Serotonin in the nervous system of the head region of the land planarian Bipalium kewense. Tissue Cell. 35, 479–486.
Sakharov D.A., Golubev A.I., Malyutina L.V., Kabotyanski E.A., Nezlin L.P. 1988. Serotoninergic control of ciliary locomotion in a turbellarian flatworm. In: Neurobiology of invertebrates: Transmitters, modulators and receptors. Budapest: Akadémiai Kiadó. p. 479–491.
Farrell M.S., Gilmore K., Raffa R.B., Walker E.A. 2008. Behavioral characterization of serotonergic activation in the flatworm Planaria. Behav. Pharmacol. 19 (3), 177–182.
Hrchkova G., Velebny S., Halton D.W., Maule A.G. 2002. Mesocestoides corti (syn.M. vogae): Modulation of larval motility by neuropeptides, serotonin and acetylcholine. Parasitol.124, 409–421.
Graham M.K., McGeown J.G., Fairweather I. 1999. Ionic mechanisms underlying spontaneous muscle contractions in the liver fluke, Fasciola hepatica. Amer. J. Physiology. 277, R374–R383.
Blair K.L., Bennet J.L., Pax R.A. 1993. Serotonin and acetylcholine: further analysis of praziquantel-induced contraction of magnesium-paralysed Schistosoma mansoni. Parasitol. 107, 387–395.
Monneypenny C.G., Kreshchenko N., Day T.A., Moffett C., Halton D.W., Maule A.G. 2001. Physiological effects of platyhelminth FMRFamide-related peptides and classical transmitters on dispersed muscle fibres of the turbellarian, Procerodes littoralis. Parasitol. 115, 281–288.
Creti P., Capasso A., Grasso M., Parisi E. 1992. Identification of a 5-HT receptor positively coupled to planarian adenilate cyclase. Cell. Biol. Inter. Rep. 16 (5), 427–432.
Saitoh O., Yuruzume E., Nakata H. 1996. Identification of planarian serotonin receptor by ligand binding and PCR studies. Neuroreport. 8, 173–178.
Nishimura K., Unemura K., Tsushima J., Yamamuchi Y., Otomo J., Taniguchi T., Kaneko S., Agata K., Kitamura Y. 2009. Identification of a novel planarian G-protein-coupled receptor that responds to serotonin in Xenopus laevis oocytes. Biol. Pharm. Bull. 32(10), 1672–1677.
Zamanian M., Kimber M.J., McVeigh P., Carlson S.A., Maule A.G., Day T.A. 2011. The repertoire of G protein-coupled receptors in the human parasite Schistosoma mansoni and the model organism Schmidtea mediterranea. BMC Genomics. 12, 596. http://www.biomedcentral.com/1471-2164/12/596
Zamanian M., Agbedanu P.N., Wheeler N.J., McVeigh P., Kimber M.J., Day T.A. 2012. Novel RNAi-mediated approach to G protein-coupled receptor deorphanization: Proof of principle and characterization of a planarian 5-HT receptor. PLoS One. 7 (7), e40787.
Patocka N., Sharma N., Rashid M., Ribeiro P. 2014. Serotonin signaling in Schistosoma mansoni: A serotonin–activated G protein-coupled receptor controls parasite movement. PLOS Pathogens. 10 (1), e1003878.
Дополнительные материалы отсутствуют.
Инструменты
Биологические мембраны: Журнал мембранной и клеточной биологии


