Биологические мембраны: Журнал мембранной и клеточной биологии, 2020, T. 37, № 2, стр. 156-160
Изоформы PI3-киназы в пуринергических мезенхимных стромальных клетках
П. Д. Котова a, *, М. Ф. Быстрова a
a Институт биофизики клетки РАН, ФИЦ ПНЦБИ РАН
142290 Московская обл., Пущино, Россия
* E-mail: polinakotova88@gmail.com
Поступила в редакцию 28.03.2019
После доработки 28.04.2019
Принята к публикации 30.04.2019
Аннотация
Методами транскриптомного анализа в популяции мезенхимных стромальных клеток (МСК) жировой ткани человека выявлены транскрипты генов, кодирующих α, β и δ изоформы PI3-киназы класса I; изоформа PI3Kγ в МСК не экспрессируется. Участие различных изоформ PI3-киназы в пуринергической трансдукции в МСК анализировали, используя флуоресцентную микроскопию и Са2+-индикатор Fluo-4. Показано, что Са2+-ответы МСК на ATP подавляются в присутствии ингибиторов PI3Kα и PI3Kβ (GSK 1 059 615 и AZD 6482 соответственно). Полученные данные свидетельствуют о том, что в большинстве (69%) пуринергических МСК для полноценной генерации Са2+-ответов на АТР требуется активная PI3Kα. При этом в небольшой (15%) субпопуляции этих клеток изоформа PI3Kβ также вовлечена в пуринергическую трансдукцию.
ВВЕДЕНИЕ
Семейство PI3-киназ представляет собой группу киназ, способных фосфолилировать некоторые белковые, но преимущественно липидные субстраты, а именно фосфатидилинозитолы (phosphatidylinositols, PtdIns). У млекопитающих идентифицировано 8 изоформ PI3-киназ, и на основе их функциональных и структурных свойств выделено 3 класса [1]. PI3-киназы класса I (PI3KI) катализируют фосфорилирование сигнального липида фосфатидилинозитол-4,5-бисфосфата (phosphatidylinositol 4,5-bisphosphate, PtdIns(4,5)P2), продуцируя PtdIns(3,4,5)P3, также известный как PIP3. PI3-киназы класса II генерируют PtdIns(3,4)P2 и PtdIns3P из PtdIns. PI3-киназы класса III синтезирует PtdIns3P из PtdIns. Связываясь с PH-доменами различных эффекторных белков, PIP3 модулирует их локализацию и активность, регулируя широкий ряд биологических процессов, включая клеточный цикл, миграцию клеток и ряд других. Таким образом, PI3KI действуют как классический посредник передачи сигнала от рецепторов плазматической мембраны внутрь клетки, они вовлечены в передачу сигналов от тирозинкиназных рецепторов, G-белок-связанных рецепторов и малых GTPаз. Представители II и III классов PI3-киназ в основном регулируют мембранный транспорт и лишь косвенно влияют на сигнальные процессы [2].
У млекопитающих подсемейство PI3KI представлено четырьмя членами: PI3Kα, PI3Kβ, PI3Kγ и PI3Kδ в соответствии с их каталитическими субъединицами p110α, β, γ, и δ [1]. Уровни экспрессии изоформ PI3KI варьируют в различных тканях, p110α и p110β присутствуют в клетках многих тканей, тогда как p110γ и p110δ на высоком уровне экспрессируются в лейкоцитах, а в других тканях присутствуют в меньших количествах. Функции изоформ PI3KI также различны, например, ключевую роль в инсулиновой сигнализации играет PI3Kα [3], но не PI3Kβ [4], в ангиогенезе – PI3Kα, сперматогенезе – PI3Kβ [5], в иммунных процессах – PI3Kγ и PI3Kδ [6].
Мезенхимные стромальные клетки (МСК) представляют собой гетерогенную популяцию, которая содержит стволовые клетки, способные дифференцироваться и давать начало костной, хрящевой и жировой тканям. МСК присутствуют практически во всех тканях взрослого организма, однако наиболее доступными для их выделения источниками являются костный мозг и жировая ткань. МСК обладают высоким потенциалом для использования в регенеративной и клеточной медицине, и изучение их рецепторных и сигнальных систем является важной задачей на пути к более глубокому пониманию физиологии этих клеток. Роль различных изоформ PI3-киназ в физиологии МСК на сегодняшний день в целом не очерчена, и в литературе имеются лишь разрозненные сведения об их вкладе в функционирование МСК. Так, например, показано, что уровень экспрессии белков PI3K/Akt каскада повышается в процессе адипогенной дифференцировки, а ингибиторы PI3-киназ понижают ее эффективность, что свидетельствует о важной роли PI3-киназного пути для адипогенеза [7, 8]. При этом PI3K/Akt-путь также вовлечен и в остеогенную дифференцировку МСК [9].
Ранее нами было показано, что в МСК, выделенных из жировой ткани человека, присутствует субпопуляция клеток, в которых аппликации экстраклеточного ATP вызывают мобилизацию внутриклеточного Са2+. Ответы на ATP генерируются по принципу “все или ничего”, и механизм их генерации включает две стадии. На первой – активированный ATP P2Y-рецептор посредством G-белка стимулирует фосфолипазу С, которая гидролизует фосфолипид PIP2 и продуцирует два вторичных медиатора – IP3 и DAG. В свою очередь, PI3 стимулирует IP3-рецепторы, функционирующие в Са2+-депо, что приводит к выбросу депонированного Са2+, зависящему от концентрации агониста. Вторая стадия наблюдается, только если внешний стимул достигает некоторой пороговой величины, при которой первоначальный локальный внутриклеточный Са2+-сигнал достигает определенного уровня, достаточного, чтобы инициировать Са2+-индуцированный выброс депонированного Са2+ (Са2+-induced Са2+ release, CICR), развивающийся за счет стимуляции ионами Са2+ IP3-рецепторов [10]. Механизм CICR продуцирует глобальный Са2+-ответ, не зависящий от концентрации агониста [11].
Одним из существенных вопросов, возникающих при изучении этой системы, является вопрос о том, какие внутриклеточные регуляторные системы определяют порог возникновения CICR как ключевого механизма усиления в каскаде трансдукции агонистов в МСК. Как было показано нами ранее, Са2+-ответы пуринергических МСК на нуклеотиды модулируются и подавляются в присутствии LY294002, являющегося ингибитором PI3-киназы (phosphoinositide 3‑kinase) [12]. Хотя это свидетельствовало о том, что PI3-киназа контролирует пуринергическую трансдукцию в МСК, механизмы этого явления остались невыясненными. Описанные ниже эксперименты представляют собой попытку очертить роль различных изоформ PI3-киназы в этом процессе.
МАТЕРИАЛЫ И МЕТОДЫ
Выделение клеток. В данной работе исследовали МСК из жировой ткани человека, выделение и поддержание первичной культуры которых подробно описано ранее [13]. Выделенные МСК культивировали в 12-луночном планшете в среде Advance Stem (HyClone) с 10% Advance Stem Supplement (HyClone). При достижении 80% монослоя клетки пассировали. Клетки обрабатывали раствором Версена (Sigma) и HyQTase Cell Detachment Solution (HyClone), а затем рассаживали. В экспериментах использовали МСК 2–4 пассажей.
Микрофотометрия. Клетки прикрепляли с помощью адгезивного материала Cell Tak на дно фотометрической камеры и инкубировали при комнатной температуре (23–25°С) в присутствии проникающего через мембрану препарата Fluo-4AM (4 мкМ) и детергента Pluronic (0.02%) (оба Molecular Probes, США) в течение 20 мин, что обеспечивало загрузку клеток Са2+-зондом Fluo-4. Затем клетки отмывали внеклеточным раствором, в котором их выдерживали 40 мин при 4°С. Внеклеточный раствор содержал (мМ): NaCl – 110, KCl – 5.5, CaCl2 – 2, MgCl2 – 0.8, HEPES – 10, глюкозу – 10. Фотометрические эксперименты проводили с использованием инвертированного флуоресцентного микроскопа Axiovert 135 (Zeiss, Германия), оборудованного объективом Plan NeoFluar 20x/0.75 и цифровой ECCD камерой LucaR (Andor Technology, США). Флуоресценцию клеток, нагруженных Fluo-4, возбуждали при длине волны 480 ± 5 нм, а эмиссию регистрировали в области 535 ± 20 нм. Изменение концентрации цитозольного Са2+ в индивидуальных клетках оценивали по относительному изменению интенсивности флуоресценции целой клетки (ΔF/F0), где ΔF = F0 – F, F и F0 – текущая интенсивность эмиссии Fluo-4 и его эмиссия в начале регистрации соответственно. Количественный фотометрический анализ изображений осуществлялся с использованием программы Imaging Workbench 6 (INDEC, США). Использованные в экспериментах соли, HEPES, глюкозу и ATP приобретали у Sigma–Aldrich (США); специфические ингибиторы PI3Kα – GSK 1 059 615, PI3Kβ – AZD 6482, PI3Kγ – AS 605 240 были получены от Tocris (Великобритания), PI3Kδ – IC 87 114 – Calbiochem (США).
Молекулярная биология. ОТ-ПЦР. Тотальная РНК выделялась из суспензии МСК, содержащей до 106 клеток, с использованием набора GenElute Mammalian Total RNA Miniprep Kit (Sigma). Удаление остатков геномной ДНК из образцов РНК и реакция обратной транскрипции проводились с использованием набора SuperScript IV VILO Master Mix with ezDNAse enzyme в присутствии случайных, гексамерных праймеров по протоколу производителя (Invitrogene). Для ПЦР использовалась готовая смесь ScreenMix-HS (Евроген) и следующие ген-специфические праймеры, комплементарные всем возможным транскрипт-вариантам генов, кодирующих каталитические субъединицы PI3KI, включая p110α (5'-GACAAGAACAAAGGAGAAATATATG-3', 5'-AACACATCTCCTGAAACCTC-3'), P110β (5'-GTCAAAAAAACTGGCCAGCTC-3', 5'-TTCCCTAATGCAAGAGAGTCC-3'), P110δ (5'-ATCT-TTAAGAACGGGGATGAC-3', 5'-AAAATCAATGTGGAACAGCTG-3'), P110γ (5'-AATCCCCTA-CTGAAGAAAAGTTTC-3', 5'-TAAGCCTTAACA-CAGATGTCC-3'). Ожидаемый размер продуктов был 306, 316, 407 и 309 п.н. соответственно.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В данной работе проводились эксперименты с применением транскриптомного анализа и микрофотометрии, чтобы выявить изоформы PI3KI, функционирующие в МСК. С этой целью в препаратах РНК, выделенной из суспензии МСК, осуществляли поиск транскриптов генов, кодирующих каталитические субъединицы PI3KI, включая PI3Kα, PI3Kβ, PI3Kδ и PI3Kγ. Для этого использовали метод ОТ-ПЦР и ген-специфичные праймеры, которые были сконстрированы на основе имеющихся в базе данных последовательностей человеческих генов PI3KI и были комплементарны всем возможным транскрипт-вариантам этих генов. Оказалось, что все три образца РНК, полученные независимо из трех препаратов МСК, содержали транскрипты генов PI3Kα, PI3Kβ, PI3Kδ, в то время как транскрипты гена PI3Kγ не были обнаружены (рис. 1а).
Рис. 1.
Функциональная экспрессия изоформ PI3-киназы в МСК. а – Транскрипты генов PI3Kα, PI3Kβ и PI3Kδ, идентифицированные в препаратах МСК (n = 3). Ампликоны ожидаемого размера 306, 316 и 407 п.н. соответствуют PI3Kα, PI3Kβ и PI3Kδ. Транскрипты гена PI3Kγ (309 п.н.) не детектировались. В качестве маркеров молекулярных весов (M) использовался GeneRuler 100 bp DNA Ladder (Fermentas). Агарозный гель (1.3%) окрашивался бромидом этидия. б, в – Репрезентативные регистрации Са2+-ответов клетки на 2 мкМ АТР в контроле и в присутствии ингибиторов PI3Kα GSK 1059615 (20 мкМ) и PI3Kβ AZD 6482 (20 мкМ) (б, n = 52; в, n = 11). Моменты аппликации АТР и ингибиторов обозначены горизонтальными отрезками выше экспериментальной кривой. г – Репрезентативный (n = 27) ответ клетки на 2 мкМ АТР в контроле и в присутствии ингибитора PI3Kγ AS 605 240 в концентрациях 20–100 мкМ. д – Репрезентативный (n = 33) ответ клетки на 2 мкМ АТР в контроле и присутствии ингибитора PI3Kδ IC87114 в концентрациях 20–100 мкМ. Во всех случаях изменение внутриклеточного Са2+ характеризовали относительной флуоресценцией Fluo-4 ΔF/F0, где ΔF=F – F0, F – текущая интенсивность флуоресценции, F0 – средняя интенсивность флуоресценции в начальный момент регистрации.
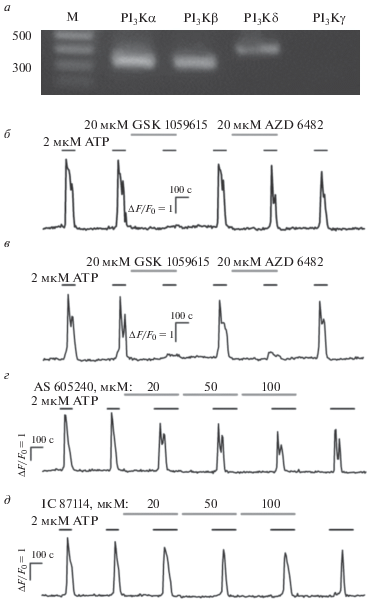
В дополнение к транскриптомному анализу проводили функциональные тесты. МСК нагружали Са2+-зондом Fluo-4, и их чувствительность к АТР оценивали по Са2+-сигналам, инициируемым этим нуклеотидом в цитоплазме клеток. В общей сложности в нами было проанализировано 398 МСК, из которых 124 (31%) были идентифицированы как пуринергические, поскольку в этих клетках регистрировалось повышение концентрации внутриклеточного Са2+ в ответ на аппликацию ATP (1–5 мкМ) (рис. 1б–1д). Как оказалось, ингибитор PI3Kα (GSK 1 059 615) блокировал ответы МСК на АТР в 52 (69%) из 75 протестированных в данном типе эксперимента пуринергических МСК (рис. 1б), при этом в 11 клетках (15%) ингибитор PI3Kβ (AZD 6482) также подавлял ответы на АТР (рис. 1в). В то же время ингибитор PI3Kγ (AS 605 240) не влиял на способность МСК генерировать Са2+-ответы на ATP в широком диапазоне концентраций (20–100 мкМ) (n = 27) (рис. 1г). Этот факт вполне согласуется с данными экспрессионного анализа об отсутствии транскриптов PI3Kγ в препаратах РНК, выделенных из популяции МСК (n = 3) (рис. 1а). Хотя транскрипты гена PI3Kδ детектировались (рис. 1а), роль этой изоформы PI3K в генерации ответов на АТР выявлена не была – в присутствии ингибитора PI3Kδ (IC 87114, 20–100 мкМ) (n = 33) МСК генерировали полноценные Са2+-ответы на АТР (рис. 1д). Вероятно, PI3Kδ проявляет свою регуляторную активность в других внутриклеточных процессах, не связанных с генерацией агонист-индуцированных Са2+-ответов.
Таким образом, полученные данные свидетельствуют о том, что в большинстве пуринергических МСК для полноценной генерации Са2+-ответов на АТР требуется активная PI3Kα. При этом в небольшой субпопуляции этих клеток PI3Kβ-изоформа также вовлечена в пуринергическую трансдукцию.
Хотя приведенные данные не позволяют в деталях определить роль выявленных изоформ PI3K класса I, интересным является тот факт, что PI3Kα, PI3Kβ, PI3Kδ принадлежат к подклассу А, представители которого, как правило, сопряжены с тирозинкиназными рецепторами. Изоформа PI3Kγ, которая не была обнаружена нами в МСК, является единственным представителем PI3K класса IВ, который преимущественно активируется βγ-субъединицей GPCR-рецепторов [1]. Эти факты указывают на потенциальную возможность того, что сигнальные процессы, инициируемые в МСК агонистами GPCR-рецепторов, могут модулироваться при участии тирозинкиназных рецепторов.
Работа поддержана Российским научным фондом (грант 17-75-10 127).
Список литературы
Jean S., Kiger A.A. 2014. Classes of phosphoinositide 3-kinases at a glance. J. Cell Sci. 127, 923–928.
Bilanges B., Posor Y., Vanhaesebroeck B. 2019. PI3K isoforms in cell signalling and vesicle trafficking. Nat. Rev. Mol. Cell Biol. 20 (9), 515–534.
Knight Z.A., Gonzalez B., Feldman M.E., Zunder E.R., Goldenberg D.D., Williams O., Loewith R., Stokoe D., Balla A., Toth B., Balla T., Weiss W.A., Williams R.L., Shokat K.M. 2006. A pharmacological map of the PI3-K family defines a role for p110α in insulin signaling. Cell. 125 (4), 733–747.
Nylander S., Kull B., Bjorkman J.A., Ulvinge J.C., Oakes N., Emanuelsson B.M., Andersson M., Skarby T., Inghardt T., Fjellstrom O., Gustafsson D. 2012. Human target validation of phosphoinositide 3-kinase (PI3K)β: Effects on platelets and insulin sensitivity, using AZD6482 a novel PI3Kβ inhibitor. J. Thromb. Haemost. 10 (10), 2127–2136.
Guillermet-Guibert J., Smith L.B., Halet G., Whitehead M.A., Pearce W., Rebourcet D., Leon K., Crepieux P., Nock G., Stromstedt M., Enerback M., Chelala C., Graupera M., Carroll J., Cosulich S., Saunders P.T., Huhtaniemi I., Vanhaesebroeck B. 2015. Novel role for p110β PI3-kinase in male fertility through regulation of androgen receptor activity in Sertoli cells. PLOS Genet. 11 (7), e1005304.
So L., Fruman D.A. 2012. PI3K signalling in B- and T-lymphocytes: New developments and therapeutic advances. Biochem. J. 442 (3), 465–481.
Yu W., Chen Z., Zhang J., Zhang L., Ke H., Huang L., Peng Y., Zhang X., Li S., Lahn B.T., Xiang A.P. 2008. Critical role of phosphoinositide 3-kinase cascade in adipogenesis of human mesenchymal stem cells. Mol. Cell. Biochem. 310 (1–2), 11–18.
Cervelli V., Scioli M.G., Gentile P., Doldo E., Bonanno E., Spagnoli L.G., Orlandi A. 2012. Platelet-rich plasma greatly potentiates insulin-induced adipogenic dfferentiation of human adipose-derived stem cells through a serine/threonine kinase Akt-dependent mechanism and promotes clinical fat graft maintenance. Stem Cells Transl. Med. 1 (3), 206–220.
Wu R., Ruan J., Sun Y., Liu M., Sha Z., Fan C., Wu Q. 2018. Long non-coding RNA HIF1A-AS2 facilitates adipose-derived stem cells (ASCs) osteogenic differentiation through miR-665/IL6 axis via PI3K/Akt signaling pathway. Stem Cell Res. Ther. 9 (1), 348.
Prole D.L., Taylor C.W. 2019. Structure and function of IP3 receptors. Cold Spring Harb. Perspect. Biol. 11 (4), a035063.
Kotova P.D., Bystrova M.F., Rogachevskaja O.A., Khokhlov A.A., Sysoeva V.Yu., Tkachuk V.A., Kolesnikov S.S. 2018. Coupling of P2Y receptors to Ca2+ mobilization in mesenchymal stromal cells from the human adipose tissue. Cell Calcium. 71, 1–14.
Котова П.Д. 2017. Модуляция Cа2+-ответов на ATP PI3-киназой в мезенхимных cтромальных клетках. Биол. мембраны. 34 (1), 70–73.
Котова П.Д., Фадеева Ю.И., Рогачевская О.А., Сысоева В.Ю., Ткачук В.А., Колесников С.С. 2015. Пуринергическая сигнализация в мезенхимных стромальных клетках. Биол. мембраны. 32(4), 265–273.
Дополнительные материалы отсутствуют.
Инструменты
Биологические мембраны: Журнал мембранной и клеточной биологии


