Биологические мембраны: Журнал мембранной и клеточной биологии, 2020, T. 37, № 3, стр. 197-207
Антиоксидантное действие природных полифенолов на митохондрии печени крыс с токсическим гепатитом
Д. И. Дергачева a, О. И. Кляйн b, А. А. Мариничев a, b, Н. Н. Гесслер a, В. В. Теплова c, Е. П. Исакова a, Ю. И. Дерябина a, *
a Институт биохимии им. А.Н. Баха, Федеральный исследовательский центр
“Фундаментальные основы биотехнологии” РАН
119071 Москва, Россия
b Московский химико-технологический университет
им. Д.И. Менделеева
125047 Москва, Россия
c Институт теоретической и экспериментальной биофизики PАН
142290 Московская обл., Пущино, Россия
* E-mail: yul_der@mail.ru
Поступила в редакцию 23.04.2019
После доработки 17.09.2019
Принята к публикации 23.09.2019
Аннотация
Исследовано влияние природных полифенолов (ресвератрола (РСВ), дигидромирицетина (ДГМ), пиносильвина (ПС), эпигаллокатехина (ЭГК), мирицетина и дигидрокверцетина (ДГК)) на скорость генерации перекиси водорода митохондриями печени крыс при развитии токсического повреждения печени, индуцированного гепатотропным ядом тиоацетамидом. Показано, что все исследованные полифенолы в концентрации 10 мкМ оказывали антиоксидантное действие при развитии окислительного стресса в митохондриях печени крыс с токсическим гепатитом, снижая скорость роста флуоресцентного сигнала зонда Amplex Red с эффективностью: РСВ > мирицетин > ДГК > ДГМ > ПС > ЭГК. Все протестированные полифенолы оказывали незначительное влияние на уровень продукции свободных радикалов в митохондриях печени контрольных животных. Исследование антиоксидантной активности полифенолов показало, что в условиях неспецифической Са2+-зависимой пермеабилизации митохондриальной мембраны в присутствии ионов Са2+ и неорганического фосфата в митохондриях контрольных животных полифенолы вызывали выраженное уменьшение скорости генерации перекиси: 2-кратное в случае ДГМ, ПС и ЭГК, 3-кратное в случае РСВ, 3.7-кратное и 5-кратное для ДГК и мирицетина соответственно. В митохондриях, изолированных из печени животных с индуцированной патологией, исследованные полифенолы также вызывали существенное снижение скорости генерации АФК. Наиболее эффективное действие оказывали ДГК, ПС и ДГМ, снижающие скорость продукции АФК в среднем в 5.3, 2.8 и 2.4 раза соответственно. Представленные данные демонстрируют, что в условиях клеточной патологии природные полифенолы оказывают мощное антиоксидантное действие, в то время как в физиологических условиях эти соединения могут оказывать либо нейтральный, либо даже мягкий прооксидантный эффект. Полученные данные могут быть применены для разработки новых потенциальных фармакологических препаратов природного происхождения для предотвращения развития и лечения распространенных заболеваний, в основе которых лежат митохондриальные патологии.
ВВЕДЕНИЕ
Полифенолы составляют большую группу биоактивных фитохимических веществ, которые включают множество подклассов, таких как флавоноиды, стильбены, фенольные кислоты и лигнаны [1]. Полифенолы растительного происхождения являются одним из наиболее активно используемых в молекулярной медицине типов антиоксидантов [2]. Они обладают умеренной гидрофобностью, позволяющей им при определенных условиях проникать через клеточные мембраны и другие барьеры. Некоторые полифенолы несут заряженные группы, позволяющие им менять степень гидрофобности в зависимости от значения pH. Полифенолы активно взаимодействуют с липидами различных клеточных мембран, в том числе, плазматической и митохондриальной, изменяя их латеральную текучесть и проницаемость [3]. Особое внимание исследователей к этим классам соединений обусловлено уникальными антиоксидантными, противовоспалительными, антимикробными, гепато- и кардиопротекторными, антиканцерогенными и антидиабетическими свойствами, которые проявляют отдельные их представители. Являясь природными соединениями с одной или несколькими гидроксильными группами, присоединенными к бензольному кольцу, эти вещества обладают способностью захватывать свободные радикалы и таким образом реализовывать свои антиоксидантные свойства [4] (рис. 1). Наиболее заметное влияние полифенолы оказывают на клетки, обладающие увеличенной способностью к генерации активных форм кислорода (АФК): нейтрофилы, клетки макрофагального ряда миелоцитоидного типа и клетки, подвергшиеся малигнизации [3]. Наряду с антиоксидантной активностью некоторые полифенолы способны специфически взаимодействовать с рецепторами на поверхности клеток, различными внутриклеточными ферментами (в том числе, из состава дыхательных комплексов митохондрий) и мембранными ионными каналами (транспортерами) [3].
Растительные полифенолы оказывают влияние и на функции митохондрий. Было обнаружено, что проантоцианидины экстракта из виноградной косточки могут смягчать дисфункцию митохондрий, индуцированную пероксидом водорода, за счет поддержания мембранного потенциала, работы цепи переноса электронов и подавления продукции кислородных радикалов митохондриями [5]. Вальдекантос и соавт. [6] описали уменьшение продукции АФК митохондриями печени крыс на фоне увеличения активности митохондриальной Mn-супероксиддисмутазы и уменьшения активности глутатионпероксидазы под действием наиболее изученного природного полифенола ресвератрола (РСВ). Другие авторы [7] сообщили об уменьшении продукции перекиси водорода и снижении скорости дыхания митохондрий в состоянии 4 под действием РСВ, однако точный механизм этого явления не был объяснен. Было обнаружено, что изофлавоноид гесперидин также оказывал положительное действие на активность комплексов I–IV дыхательной цепи митохондрий Т-клеток мышей [8]. Однако помимо позитивного воздействия на функции митохондрий, был отмечен и противоположный эффект полифенолов на эти органеллы, связанный с общим нарушением биоэнергетики и запусканием апоптических реакций [9]. В частности, Зини и соавт. [10] обнаружили, что РСВ способен ингибировать поглощение кислорода в изолированных митохондриях мозга, связанное с ингибированием участка между комплексами I и III. В работе [11] авторы констатировали блокирование РСВ ATP-азной активности в митохондриях мозга и печени, предположив, что это связано с взаимодействием соединения с субъединицей F1 ферментного комплекса. Морейра и соавт. [12] доложили как о прооксидантном, так и об антиоксидантном действии РСВ на изолированные митохондрии мозга и печени у крыс обоих полов. В то же время было показано, что некоторые прооксидантные эффекты полифенола могут запускать стимуляцию антиоксидантной защиты клеток через сигнальные пути, включающие ядерные факторы (erythroid-derived 2)-like 2 (ARE/Nrf2) и фосфатидилинозитол-4,5-бисфосфат-3-киназу/Akt (PI3K/Akt) [12].
Перечисленные разнонаправленные функции полифенолов приводят к тому, что их поведение в организме оказывается во многом непредсказуемым: оно зависит не только от структуры полифенола, но и от дозы, пути введения, состояния иммунной и других систем организма. Многочисленные исследования фармакокинетики полифенолов привели лишь к пониманию чрезвычайной сложности этой проблемы, но не к выработке концепции применения этих соединений. Точный механизм, посредством которого природные полифенолы моделируют функции и динамику митохондрий, остается неизвестным.
В представленной работе мы использовали модель хронической интоксикации экспериментальных животных гепатотоксикантом тиоацетамидом (ТАА), обусловливающим тяжелые изменения в тканях печени и возникновение гипераммониемии [13]. Выбор этой экспериментальной модели был обусловлен доказанной для эффекта ТАА на животных моделях патологической картиной, включающей в себя ингибирование сукцинатдегидрогеназной активности, коллапсирование мембранного потенциала, набухание митохондрий и возрастание уровня АФК [13]. Хроническое администрирование ТАА провоцирует индуцированную гипераммониемией обширную митохондриальную дисфункцию и клеточный энергетический дефицит. Поскольку природные полифенолы являются эффективными антиоксидантами, мы сочли крайне интересным исследовать их эффекты на модели с выраженным развитием окислительного стресса.
Целью данной работы являлось исследование влияния природных полифенолов: РСВ, дигидромирицетина (ДГМ), пиносильвина (ПС), эпигаллокатехина (ЭГК), мирицетина и дигидрокверцетина (ДГК) – на уровень окислительного стресса, индуцированного в митохондриях печени крыс при развитии экспериментальной печеночной патологии.
МАТЕРИАЛЫ И МЕТОДЫ
Эксперименты проводили на самцах белых крыс линии Wistar в соответствии с международными требованиями для медико-биологических экспериментов на животных, одобренными комиссией по биомедицинской этике ИНБИ ФИЦ Биотехнологии РАН. Крысы весом 120–140 г были разделены на 2 группы, по 8–10 животных в каждой группе: 1 – контрольные животные, которые содержались на обычном пищевом рационе вивария; 2 – животные с индуцированным токсическим гепатитом (группа печеночной патологии, ПП).
Для индукции токсического повреждения печени и развития печеночной патологии животным ежедневно алиментарным путем вводили водный 0.05% раствор гепатотоксиканта ТАА, который показал высокую эффективность при разработке модели ПП [14, 15]. Введение ТАА животным начинали с концентрации 0.015% ТАА, повышая в течение трех дней до рабочей концентрации (0.05% ТАА). Через 10 дней животных выводили из эксперимента и немедленно после вскрытия проводили отбор крови для биохимических исследований и образцов печени крыс контрольной и ПП групп. Развитие токсического гепатита оценивали по динамике веса животных, изменению биохимических параметров крови (билирубина, общего белка и глюкозы) и гистологическим изменениям печени. Образцы сыворотки крови исследовали на биохимическом анализаторе на содержание белка, глюкозы, прямого билирубина и активности аспартатаминотрансферазы (АСТ) и аланинаминотрансферазы (АЛТ). Биохимический анализ крови экспериментальных животных выполняли на базе независимой ветеринарной лаборатории “ШансБио”. Лаборатория является участником Международной системы внешнего контроля качества лабораторных исследований EQAS (Bio-Rad, США) (код участника 9471) и Федеральной системы внешнего контроля качества лабораторных исследований МЗ РФ ФСВОК (код участника 10 705).
Из печени крыс контрольной и ПП групп выделяли митохондрии методом дифференциального центрифугирования [16]. Осадок митохондрий ресуспендировали в среде промывания митохондрий (60 мг в мл) и хранили на льду до использования в эксперименте. Определение белка в препаратах митохондрий проводили по методу Брэдфорд с Кумасси G-250 [17].
Для оценки уровня АФК при помощи флуоресцентного красителя Amplex Red (AR) (стоковый 10 мМ раствор в ДМСО) митохондрии добавляли в среду для исследования дыхательной активности, содержащую 210 мМ маннит; 70 мМ сахарозу; 10 мМ HEPES-Na, pH 7.4; 0.2 мМ KH2PO4; 5 мМ сукцинат; 1 мкМ ротенон, 0.5 мг/мл митохондриального белка. Затем разносили митохондриальную суспензию по лункам 96-луночного иммунологического планшета для флуоресцентных исследований. Туда же вносили экспериментальные образцы полифенолов в конечной концентрации 10 мкМ (стоковый 1 мМ раствор в ДМСО), после чего добавляли Amplex Red (Hydrogen Peroxide/Peroxidase Assay Kit, Sigma) в конечной концентрации 25 мкМ. Реакцию запускали внесением в реакционную среду пероксидазы хрена (RZ = 0.6 = 150–170 ед/мг), применяя стоковый раствор с концентрацией 1 мг / 5 мл. Измерение флуоресценции в длине волны λ 590 ± 25 нм при возбуждении λ 530 ± 35 нм проводили на фотометре-флуориметре Synergy 2 Multi-Mode Microplate Reader BeoTek (США). Измерения проводили в течение 15 мин с последующим анализом данных в программе Microsoft Excel. Динамика скорости продукции перекиси носила нелинейный характер в течение первых 10 мин детекции за счет развития максимального уровня флуоресценции, достигая плато к 15 мин, поэтому уровень флуоресценции AR в относительных единицах был оценен через 15 мин инкубации митохондрий в контроле или инкубированных с полифенолами. Этот показатель был соотнесен с уровнем флуоресценции AR, регистрируемым после добавления свежеприготовленного раствора перекиси водорода (100 нмоль/мл). Это было сделано для разных групп животных (контрольной и с индуцированной ПП) и разных условий эксперимента (инкубации в нормальных физиологических условиях и в условиях индукции Са2+-зависимой неспецифической поры – в присутствии 100 мкМ Са2+ и 2 мМ Pi). На основании полученных данных, с учетом времени измерения (15 мин) и количеством белка в пробе (0.5 мг/мл), были проведены вычисления скоростей образования перекиси водорода.
Данные представляли в виде среднего значения ± стандартное отклонение. Достоверность в разнице полученных данных определяли по методике непарного t-теста. Значение p ≤ 0.05 считалось достоверным.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Для демонстрации развития ПП была оценена динамика физиолого-биохимических показателей крови экспериментальных животных при введении гепатотоксиканта ТАА через 10 сут после начала эксперимента. Были определены следующие параметры: билирубин прямой, АСТ, АЛТ, общий белок и глюкоза. Данные, представленные в табл. 1, продемонстрировали, что при интоксикации ТАА уровень билирубина увеличивался более чем в 12 раз в ходе развития ПП, что ярко свидетельствовало о развитии патологии печени. Наряду с этим, уровни общего белка и глюкозы в крови животных исследуемых групп практически не отличались (табл. 1). Уровень активности фермента АЛТ достоверно уменьшался на 30% по отношению к контрольной группе, в то время как активность АСТ возрастала примерно на 14% (табл. 1). Общеизвестно, что АЛТ содержится во многих органах человека и животных: почках, сердечной мышце, печени и скелетной мускулатуре. Основная функция этого фермента, катализирующего обратимый перенос аминогруппы аланина на α-кетоглутарат, заключается в обмене аминокислот. В результате переноса аминогруппы образуются глутаминовая и пировиноградная кислоты. Таким образом, посредством АЛТ реализуется получение энергии для работы головного мозга и центральной нервной системы. В тесном взаимодействии с АЛТ работает фермент АСТ, который также синтезируется внутриклеточно. Уровень АСТ резко повышается на поздних стадиях заболевания печени, таких как цирроз, что и наблюдалось в наших исследованиях (табл. 1). Соотношение АСТ к АЛТ характеризует коэффициент де Ритиса [18]. Расчет этого показателя в наших исследованиях показал, что в контрольной группе он составлял 3.01, а в группе, получающей гепатотоксикант – 5.0 (табл. 1), что свидетельствовало о нарушении функции печени. Таким образом, через 10 дней введения гепатотоксиканта ТАА испытуемым животным наблюдались выраженные симптомы патологии печени.
Таблица 1.
Биохимические показатели крови контрольных животных и животных с индуцированной печеночной патологией (группа ПП)
| Группа животных | Билирубин прямой, мкмоль/л | АСТ | АЛТ | Общий белок, г/л | Глюкоза, ммоль/л |
|---|---|---|---|---|---|
| ед/л | |||||
| Контроль | 0.4 ± 0.1 | 238 ± 2.1 | 79.0 ± 4.2 | 68.0 ± 10.9 | 6.75 ± 0.54 |
| Группа ПП | 4.9 ± 0.4 | 276 ± 3.2 | 55.5 ± 9.3 | 65.5 ± 4.4 | 6.51 ± 0.38 |
Для оценки антиоксидантной активности исследуемых полифенолов с помощью флуоресцентного зонда AR было проведено исследование их действия на скорость генерации пероксида водорода митохондриями печени крыс контрольных животных и животных с индуцированной ПП. На рис. 2а представлены оригинальные кривые флуоресценции AR в митохондриях печени с индуцированной патологией, как без добавок полифенолов, так и с добавками ДГМ (10 мкМ) и РСВ (10 мкМ). Выбор концентраций был обусловлен литературными данными, полученными на аналогичных экспериментальных объектах. Как видно, в контрольном варианте (без добавки полифенолов) уровень флуоресценции составлял 400–450 усл. ед., причем этот параметр планомерно возрастал в ходе проведения измерений (15 мин) (рис. 2а, кривая 1). Внесение ДГМ и РСВ снижало уровень флуоресценции более чем в 2 и 4 раза, соответственно (рис. 2а, кривые 2, 3). Кроме того, в случае РСВ происходила стабилизация сигнала на одинаково низком уровне в ходе всего времени проведения эксперимента (рис. 2а, кривая 3). На рис. 2б представлены данные по влиянию всех исследованных полифенолов на скорость генерации перекиси водорода in vitro митохондриями печени крыс контрольной группы (серые столбики) и митохондриями печени крыс с ПП (белые столбики).
Рис. 2.
Влияние полифенолов на скорость генерации АФК (перекиси водорода) in vitro митохондриями печени крыс контрольных животных и животных с индуцированной патологией печени. На панели а представлены оригинальные кривые флуоресценции AR в митохондриях печени с индуцированной патологией, как без добавок полифенолов (1), так и с добавками ДГМ (2) и РСВ (3); на панели б представлены данные по влиянию полифенолов на продукцию перекиси водорода в митохондриях печени крыс контрольной группы (серые столбики) и данные по влиянию полифенолов на продукцию перекиси водорода в митохондриях печени крыс, с индуцированной гепатотоксичностью (белые столбики). Столбики, подписанные “контроль”, обозначают контроль для каждой группы животных без действия полифенолов. Данные по действию полифенолов сравниваются с “контролем” внутри каждой группы. Все полифенолы вносили в концентрации 10 мкМ. Приведены данные 3–5 независимых экспериментов. На панели б: * – статистически значимые различия между генерацией Н2О2 митохондриями печени крыс группы ПП без добавления полифенолов (контроль) и данными по действию полифенолов на генерацию Н2О2 митохондриями печени этой группы. ∆ – статистически значимые различия между генерацией Н2О2 митохондриями печени крыс контрольной группы без добавления полифенолов (контроль) и данными по действию полифенолов на генерацию Н2О2 митохондриями печени этой группы.
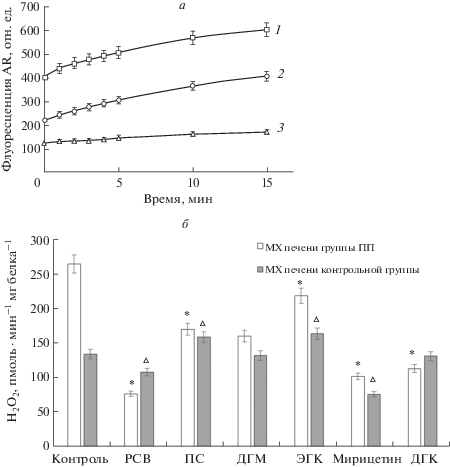
Митохондрии печени животных, получавших гепатотоксикант в течение 10 дней, характеризовались более чем 2-кратным увеличением скорости генерации АФК, по сравнению с митохондриями печени животных контрольной группы. Внесение полифенолов РСВ, ДГМ, ПС, ЭГК, мирицетина и ДГК в концентрации 10 мкМ в митохондриальную суспензию, полученную из печени животных группы ПП, приводило к уменьшению продукции АФК в 3.4, 1.6 и 1.7 раз для РСВ, ПС и ДГМ, соответственно. ЭГК, мирицетин и ДГК уменьшали этот параметр в 1.2, 2.5 и 2.3 раза, соответственно (рис. 2б). Таким образом, эффективность действия полифенолов может быть представлена следующим рядом: РСВ > мирицетин > ДГК > ДГМ > ПС > ЭГК. В то же время все протестированные полифенолы не оказывали существенного влияния на уровень продукции свободных радикалов в митохондриях печени контрольных животных, за исключением вариантов с РСВ и мирицетином, где наблюдалось незначительное уменьшение флуоресцентного сигнала. Это наблюдение можно объяснить специфическим антиоксидантным действием этих полифенолов на уровень митохондриальных АФК (рис. 2б).
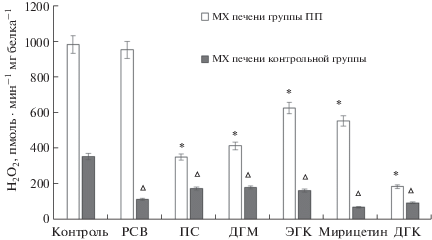
Увеличение концентрации свободного Са2+ в матриксном пространстве митохондрий млекопитающих в присутствии целого ряда веществ-индукторов приводит к возникновению неспецифической проницаемости внутренней мембраны, обусловленной открытием Са2+-зависимой белковой поры (mitochondrial permeability transition pore, PTP) [19]. В патологических условиях (окислительный стресс, истощение внутримитохондриального пула адениновых нуклеотидов и др.) эта неспецифическая циклоспорин А-зависимая пора открывается и вызывает широкое освобождение накопленного Са2+, падение митохондриального мембранного потенциала (Δψ) и высокоамплитудное набухание митохондрий [20, 21]. Открытие РТP может рассматриваться как один из путей эффективного вывода катиона в условиях высоких нагрузок цитоплазматического Са2+ [21, 22]. Имеются убедительные доказательства участия PTP митохондрий в запуске ключевых реакций апоптоза [23]. В настоящей работе было исследовано влияние полифенолов на скорость генерации АФК в условиях неспецифической Са2+-зависимой пермеабилизации мембраны в присутствии Са2+ и неорганического фосфата (Pi), который является мощным стимулятором поры. На рис. 3 представлены данные по влиянию всех исследованных полифенолов на скорость генерации перекиси водорода in vitro митохондриями печени крыс контрольной группы (серые столбики) и митохондриями печени крыс с ПП (белые столбики). В условиях Са2+-зависимого развития неспецифических нарушений митохондриальной мембранной проницаемости в присутствии индукторов поры в митохондриях контрольной группы скорость генерации АФК увеличивалась в среднем в 2.7 раза, в то время как органеллы, изолированные из печени группы ПП, демонстрировали возрастание скорости образования перекиси в среднем в 3.8 раз (рис. 3). Кроме того, скорость образования АФК в митохондриях группы ПП в среднем в 2.8 раз превосходила этот параметр у контрольных органелл (рис. 3). Интересно отметить, что в митохондриях контрольных животных полифенолы вызывали более выраженное уменьшение скорости генерации перекиси: 2-кратное в случае ДГМ, ПС и ЭГК, 3-кратное в случае РСВ, 3.7-кратное и 5-кратное для ДГК и мирицетина, соответственно (рис. 3). В митохондриях, изолированных из печени животных с индуцированной патологией, исследованные полифенолы также вызывали существенное снижение скорости генерации АФК. Наиболее эффективное действие оказывали ДГК, ПС и ДГМ, снижающие скорость продукции АФК в среднем в 5.3, 2.8 и 2.4 раза соответственно. Исключение составил РСВ, который практически не влиял (или влиял очень слабо) на скорость генерации АФК (рис. 3).
Рис. 3.
Влияние полифенолов на скорость генерации АФК (перекиси водорода) in vitro митохондриями печени крыс контрольных животных и животных с индуцированной патологией печени в условиях индукции неспецифической мембранной проницаемости. Представлены данные по влиянию полифенолов на продукцию перекиси водорода в митохондриях печени крыс контрольной группы (серые столбики) и данные по влиянию полифенолов на продукцию перекиси водорода в митохондриях печени крыс, с индуцированной гепатотоксичностью (белые столбики). Столбики, подписанные “контроль”, обозначают контроль для каждой группы животных без действия полифенолов. Данные по действию полифенолов сравниваются с “контролем” внутри каждой группы. Представлены скорости образования гидроперекиси митохондриями печени из обеих групп животных, в контроле и после инкубации с полифенолами. Среда инкубации митохондрий, дополнена 100 мкМ Са2+ и 2 мМ Pi. Все полифенолы вносили в концентрации 10 мкМ. Приведены данные 3–5 независимых экспериментов. * – статистически значимые различия между генерацией Н2О2 митохондриями печени крыс группы ПП без добавления полифенолов (контроль) и данными по действию полифенолов на генерацию Н2О2 митохондриями печени этой группы. ∆ – статистически значимые различия между генерацией Н2О2 митохондриями печени крыс контрольной группы без добавления полифенолов (контроль) и данными по действию полифенолов на генерацию Н2О2 митохондриями печени этой группы.
Митохондриальная дисфункция является ключевым событием патогенетического звена широкого круга заболеваний, включая метаболический синдром, различные печеночные патологии, сердечно-сосудистые и неврологические расстройства. Дисбаланс между образованием АФК и их нейтрализацией приводит к гиперпродукции АФК с соответствующим снижением синтеза ATP и нарушением всех других функций митохондрий. Высокая концентрация Ca2+ создает условия для дополнительной генерации АФК. Поиск агентов, предотвращающих избыточную продукцию АФК митохондриями и способствующих снижению митохондриальной патологии, остается чрезвычайно востребованным направлением исследований. К настоящему времени установлено, что ряд полифенолов оказывают положительное действие на функции митохондрий [3]. Так, обладающий свойствами антиоксиданта РСВ стимулирует экспрессию гена sirt1 и улучшает окисление жирных кислот в митохондриях в условиях дефицита карнитинпальмитоилтрансферазы 2 [24]. Положительное влияние на функции митохондрий как в системе in vitro, так и в опытах in vivo наряду с РСВ оказывает также природный полифенол мирицетрин [8, 25]. Проявляемые эффекты зависят от типа клеточной линии или ткани, продолжительности экспозиции с полифенолами и их концентрации, а также пола и возраста животных [3]. Так, РСВ с одной стороны, способен регулировать активность F0F1-ATPаза/ATP-синтазы, снижая скорость поглощения кислорода митохондриями сердца, мозга и печени [26], а с другой – уменьшать степень перекисного окисления липидов [27] и генерацию супероксидного радикала, а также стимулировать Mn-зависимую супероксиддисмутазу – главный фермент антиоксидантной защиты митохондрий [6]. Дженг и Рамирез [11] констатировали блокирование РСВ ATP-азной активности в митохондриях мозга и печени, предположив, что это связано с взаимодействием соединения с субъединицей F1 ферментного комплекса. Однако точный механизм действия полифенола на митохондриальный синтез ATP и электронный транспорт до сих пор не изучен.
В настоящее время анализ данных о влиянии РСВ на окислительное фосфорилирование митохондрий приводит к парадоксальным заключениям: 1) РСВ подавляет активность системы окислительного фосфорилирования, что приводит к утечке электронов из цепи переноса, однако стимулирует продукцию супероксидного радикала; 2) уменьшение активности комплекса III посредством РСВ также снижает уровень кислородных радикалов, в том числе супероксидного анион-радикала. Следует отметить, что на фоне высказанных предположений измерения генерации АФК в исследованных экспериментальных моделях не проводились. На основании полученных нами данных по влиянию полифенола на скорость генерации перекиси водорода митохондриями печени крыс можно предположить, что при индуцированной патологии печени РСВ может подавлять активность системы окислительного фосфорилирования и тем самым уменьшать уровень АФК, в то время как в контрольных вариантах полифенол такого эффекта не оказывает (рис. 2б). Существует также альтернативное объяснение этих результатов. В работе [6, 28] было описано уменьшение продукции АФК митохондриями печени крыс на фоне увеличения активности митохондриальной Mn-супероксиддисмутазы и уменьшения активности глутатионпероксидазы, что подтвердило прямое действие РСВ на эти ферменты. Антиоксидантный эффект РСВ на митохондрии сердца описан также в работе [27]. При исследовании действия РСВ на функции сердца было показано, что полифенол прямо взаимодействует с АФК и является “гасителем” радикалов [29]. Вероятно, в наших исследованиях может иметь место схожий механизм. Раскрытие механизма избирательного антиоксидантного действия РСВ на модели токсического гепатита является предметом будущих исследований.
Мы обнаружили, что дигидрофлавонол ДГМ был также способен эффективно подавлять образование перекиси во всех исследованных нами моделях (рис. 2б, рис. 3). В последние годы появилось большое количество работ, посвященных различным аспектам действия ДГМ: регуляции экспрессии генов [30], ренопротекции при химиотерапии цисплатином [31], улучшении поведенческих реакций у животных с нейропатологией, индуцированной 3-нитропропионатом [32], противовоспалительных эффектах [33], нейропротекции на животной модели болезни Паркинсона [34]. ДГМ, подобно РСВ, может оказывать множественное влияние на митохондриальные функции: проявляет антиоксидантное действие при индуцированном окислительном стрессе в эндотелиальных клетках человека HUVECs [35], запускает селективный митохондриально-зависимый апоптоз в клетках рака легких человека NSCLC при лояльности к нормальным клеткам [36]. Возможно, как и в случае с РСВ, в антиоксидантных эффектах ДГМ имеет место его комплексное воздействие на митохондрии.
ПС (3,5-дигидрокси-транс-стильбен) является еще менее изученным представителем класса биологически активных стильбенов. В последние годы в ряде публикаций было показано, что ПС оказывает противовоспалительное и антиканцерогенное действие [37–41]. Антиоксидантная активность ПС в широком диапазоне концентраций (от 0.1 до 200 мкM) была показана на эпителиальных клетках человека RPE [42]. Авторы подтвердили, что ПС оказывает положительное действие на выживаемость клеток при окислительном стрессе, хотя и не оказывает непосредственного влияния на экспрессию гена Nrf2 (Nuclear factor (erythroid-derived 2)-like 2), выполняющего роль транскрипционного фактора антиоксидантных генов. Однако, данные относительно биологических эффектов ПС хотя и многочисленны, но противоречивы, и не дают представления о механизме действия этого полифенола на молекулярном и клеточном уровне. Данные о влиянии ПС на митохондриальные функции отсутствуют, однако, основываясь на схожести механизмов реализации биологических ответов природных полифенолов в живых системах, а также на структурном сходстве этого полифенола с РСВ (рис. 1), можно предположить, что этот стильбен также может оказывать мощное антиоксидантное действие на митохондрии, особенно ярко выраженное в условиях патологии (рис. 2б, рис. 3).
Интересно отметить, что природный флавоноид мирицетин, проявляющий широкую биологическую активность как противовоспалительный и антираковый агент, кардиоваскулярный протектор и эффективный антимикотик [43], также показал высокую антиоксидантную активность на митохондриях печени крыс, причем его эффекты были сопоставимы с действием РСВ (рис. 2б). Наряду с этим оказался неожиданным слабовыраженный по сравнению с этими полифенолами эффект хорошо известного своим митохондриально-направленным действием ЭГК [44]. Так, в последних работах было доложено, что этот “полифенол зеленого чая” воздействует на митохондриальный биогенез и биоэнергетику, индуцируя апоптоз в раковых клетках и оказывая антиоксидантное действие в физиологических условиях. Однако, учитывая, что эффекты этого агента строго специфичны в зависимости от концентраций и применяемых клеточных линий [44], можно предположить, что оптимизация модели исследования его действия на митохондриях печени позволит более полно раскрыть потенциал этого митохондриально-направленного соединения.
В целом, стоит подчеркнуть, что все без исключения исследованные нами полифенолы, хотя и в разной степени, оказывали антиоксидантное действие на митохондриях печени животных с токсическим гепатитом, причем как в модели физиологических условий, так и в условиях индукции Са2+-зависимой PTP. Можно предположить, что в проведенных нами исследованиях имеет место так называемый “комплексный механизм” положительного воздействия полифенолов на печеночную патологию, предложенный в работе [45] и включающий в себя помимо предотвращения окислительного стресса и продукции свободных радикалов индукцию ряда белков, ответственных за биогенез митохондрий (супероксиддисмутазы, каталазы, гем-оксигеназы).
Данные, представленные в настоящей работе, позволяют внести некоторую ясность в противоречивые эффекты полифенолов на митохондриальные функции и демонстрируют, что в условиях клеточной патологии природные полифенолы оказывают мощное антиоксидантное действие, в то время как в физиологических условиях эти соединения могут оказывать либо нейтральный, либо даже мягкий прооксидантный эффект. Полученные данные могут быть использованы для разработки новых терапевтических стратегий и фармакологических препаратов направленного действия для предотвращения развития и лечения распространенных заболеваний, в основе которых лежит нарушение функционирования митохондрий.
Работа выполнена при поддержке Министерства образования и науки РФ (соглашение № 14.616.21.0083, уникальный идентификатор проекта RFMEFI61617X0083).
Список литературы
Fraga C.G., Croft K.D., Kennedy D.O., Tomás-Barberán F.A. 2019. The effects of polyphenols and other bioactives on human health. Food Funct. 10 (2), 514–528.
Tanase C., Coșarcă S., Muntean D.L. 2019. A Critical review of phenolic compounds extracted from the bark of woody vascular plants and their potential biological activity. Molecules. 24 (6), 1182. https://doi.org/10.3390/molecules24061182
Теплова В.В., Исакова Е.П., Кляйн О.И., Дергачева Д.И., Гесслер Н.Н., Дерябина Ю.И. 2018. Природные полифенолы: биологическая активность, фармакологический потенциал, пути метаболической инженерии. Прикл. биохим. и микробиол. 54 (3), 215–235.
Kim D.H., Kim M.J., Kim D.W., Kim G.Y., Kim J.K., Gebru Y.A., Choi H.S., Kim Y.-H., Kim M.K. 2019. Changes of phytochemical components (urushiols, polyphenols, gallotannins) and antioxidant capacity during Fomitella fraxinea – mediated fermentation of Toxicodendron vernicifluum bark. Molecules. 24 (4), 683. https://doi.org/10.3390/molecules24040683
Zhang Z., Zheng L., Zhao Z., Shi J., Wang X., Huang J. 2014. Grape seed proanthocyanidins inhibit H2O2-induced osteoblastic MC3T3-E1 cell apoptosis via ameliorating H2O2-induced mitochondrial dysfunction. J. Toxicol. Sci. 39, 803–813.
Valdecantos M.P., Pérez-Matute P., Quintero P., Martinez J.A. 2010. Vitamin C, resveratrol and lipoic acid actions on isolated rat liver mitochondria: all antioxidants but different. Redox Rep. 15, 207–216.
Murphy M. 2009. How mitochondria produce reactive oxygen species. Biochem. J. 417 (1), 1–13.
Wang B., Sun J., Ma Y., Wu G., Tian Y., Shi Y., Le G. 2014. Resveratrol preserves mitochondrial function, stimulates mitochondrial biogenesis, and attenuates oxidative stress in regulatory T cells of mice fed a high-fat diet. J. Food Sci. 79, H1823–H1831.
de Oliveira M.R., Nabavi S.F., Manayi A., Daglia M., Hajheydari Z., Nabavi S.M. 2016. Resveratrol and the mitochondria: From triggering the intrinsic apoptotic pathway to inducing mitochondrial biogenesis, a mechanistic view. Biochim. Biophys. Acta. 1860 (4), 727–745.
Zini R., Morin C., Bertelli A., Bertelli A.A., Tillement J.P. 1998. Effects of resveratrol on the rat brain respiratory chain. Drugs Exp. Clin. Res. 25 (2–3), 87–97.
Zheng J., Ramirez V. 2000. Inhibition of mitochondrial proton F0F1-ATPase/ATP synthase by polyphenolic phytochemicals. Br. J. Pharmacol. 130 (5), 1115–1123.
Moreira A.C., Silva A.M., Santos M.S., Sardгo V.A. 2013. Resveratrol affects differently rat liver and brainmitochondrial bioenergetics and oxidative stress in vitro: Investigation of the role of gender. Food Chem. Toxicol. 53, 18–26.
Jamshidzadeh A., Heidari R., Abasvali M., Zarei M., Ommati M.M., Abdoli N., Khodaei F., Yeganeh Y., Jafari F., Zarei A., Latifpour Z., Mardani E., Azarpira N., Asadi B., Najibi A. 2017. Taurine treatment preserves brain and liver mitochondrial function in a rat model of fulminant hepatic failure and hyperammonemia. Biomed. Pharmacother. 86, 514–520.
Koblihová E., Mrázová I., Vernerová Z., Ryska M. 2014. Acute liver failure induced by thioacetamide: Selection of optimal dosage in Wistar and Lewis rats. Physiol. Res. 63, 491–503.
Ingawale D.K., Mandlik S.K., Naik S.R. 2014. Models of hepatotoxicity and the underlying cellular, biochemical and immunological mechanism(s): A critical discussion. Environ. Toxicol. Pharmacol. 37 (1), 118–33.
Федотчева Н.И., Теплова В.В., Белобородова Н.В. 2010. Участие фенольных кислот микробного происхождения в дисфункции митохондрий при сепсисе. Биол. мембраны. 27 (1), 60–66.
Bradford M.M. 1976. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Anal. Biochem. 72, 248–254.
Тамаркина А.Д., Дементьева Е.С., Крылова Н.И. 1985. Энзимодиагностика механической желтухи. Вопр. Биомед. химии. 31 (5), 101–104.
Giorgio V., Guo L., Bassot C., Petronilli V., Bernardi P. 2018. Calcium and regulation of the mitochondrial permeability transition. Cell Calcium. 70, 56–63.
Baines C.P. 2009. The molecular composition of the mitochondrial permeability transition pore. J. Mol. Cell Cardiol. 46 (6), 850–857.
Boyman L., Coleman A.K., Zhao G., Wescott A.P., Joca H.C., Greiser B.M., Karbowski M., Ward C.W., Lederer W.J. 2019. Dynamics of the mitochondrial permeability transition pore: Transient and permanent opening events. Arch. Biochem. Biophys. 2019. 666, 31–39.
Halestrap A.P., McStay G.P., Clarke S.J. 2002. The permeability transition pore complex: another view. Biochimie. 84 (2–3), 153–166.
Orrenius S., Gogvadze V., Zhivotovsky B. 2015. Calcium and mitochondria in the regulation of cell death. Biochem. Biophys. Res. Commun. 460 (1), 72–81.
Бельских Э.С., Звягина В.И., Урясьев О.М. 2016. Современные представления о патогенезе и подходах к коррекции митохондриальной дисфункции. Наука молодых – Eruditio Juvenium. 1, 104–112.
Cai Z., Zeng W., Tao K., Lu F., Gao G., Yang Q. 2015. Myricitrin alleviates MPP+-induced mitochondrial dysfunction in a DJ-1-dependent manner in SN4741 cells. Biochem. Biophys. Res. Commun. 458 (2), 227–233.
Madrigal-Perez L.A., Ramos-Gomez M. 2016. Resveratrol inhibition of cellular respiration: New paradigm for an old mechanism. Int. J. Mol. Sci. 17 (3), 368. https://doi.org/10.3390/ijms17030368
Gutiérrez-Pérez A., Cortés-Rojo C., Noriega-Cisneros R., Calderón-Cortés E., Manzo-Avalos S., Clemente-Guerrero M., Godínez-Hernández D., Boldogh I., Saavedra-Molina A. 2011. Protective effects of resveratrol on calcium-induced oxidative stress in rat heart mitochondria. J. Bioenerg. Biomembr. 43 (2), 101–107.
Shin S.M., Cho I.J., Kim S.G. 2009. Resveratrol protects mitochondria against oxidative stress through AMP-activated protein kinase-mediated glycogen synthase kinase-3beta inhibition downstream of poly(ADP-ribose)polymerase-LKB1 pathway. Mol. Pharmacol. 76 (4), 884–895.
Hung L.M., Su M.J., Chu W.K., Chiao C.W., Chan W.F., Chen J.K. 2002. The protective effect of resveratrols on ischaemia-reperfusion injuries of rat hearts is correlated with antioxidant efficacy. Br. J. Pharmacol. 135 (7), 1627–1633.
Tang N., Ma J., Wang K.S., Mi C., Lv Y., Piao L.X., Xu G.H., Li X., Lee J.J., Jin X. 2016. Dihydromyricetin suppresses TNF-α-induced NF-кB activation and target gene expression. Mol. Cell Biochem. 422 (1–2), 11–20.
Wu F., Li Y., Song H., Zhang Y., Zhang Y., Jiang M., Wang F., Mu Q., Zhang W., Li L., Tang D. 2016. Preventive effect of dihydromyricetin against cisplatin-induced nephrotoxicity in vitro and in vivo. Evid. Based Complement. Alternat. Med. 7937385. https://doi.org/10.1155/2016/7937385
Mu S., Li Y., Liu B., Wang W., Chen S., Wu J., OuYang L., Zhu Y., Li K., Zhan M., Liu Z., Jia Y., Ma Y., Lei W. 2016. Dihydromyricetin ameliorates 3NP-induced behavioral deficits and striatal injury in rats. J. Mol. Neurosci. 60 (2), 267–275.
Wang R., Pi J., Su X., Liu J., Zeng X., Wong I., Huang L., Zhou H., Cai J., Li T., Liu L. 2016. Dihydromyricetin suppresses inflammatory responses in vitro and in vivo through inhibition of IKKβ activity in macrophages. Scanning. 38 (6), 901–912.
Ren Z.X., Zhao Y.F., Cao T., Zhen X.C. 2016. Dihydromyricetin protects neurons in an MPTP-induced model of Parkinson’s disease by suppressing glycogen synthase kinase-3 beta activity. Acta Pharmacol. Sin. 37 (10), 1315–1324.
Hou X., Tong Q., Wang W., Xiong W., Shi C., Fang J. 2015. Dihydromyricetin protects endothelial cells from hydrogen peroxide-induced oxidative stress damage by regulating mitochondrial pathways. Life Sci. 130, 38–46.
Kao S.J., Lee W.J., Chang J.H., Chow J.M., Chung C.L., Hung W.Y., Chien M.H. 2016. Suppression of reactive oxygen species-mediated ERK and JNK activation sensitizes dihydromyricetin-induced mitochondrial apoptosis in human non-small cell lung cancer. Environ. Toxicol. 32 (4), 1426–1438.
Lee S.K., Lee H.J., Min H.Y., Park E.J., Lee K.M., Ahn Y.H., Cho Y.J., Pyee J.H. 2005. Antibacterial and antifungal activity of pinosylvin, a constituent of pine. Fitoterapia. 76 (2), 258–260.
Park E.J., Park H.J., Chung H.J., Shin Y., Min H.Y., Hong J.Y., Kang Y.J., Ahn Y.H., Pyee J.H., Lee S.K. 2012. Antimetastatic activity of pinosylvin, a natural stilbenoid, is associated with the suppression of matrix metalloproteinases. J. Nutr. Biochem. 23 (8), 946–952.
Park E.J., Chung H.J., Park H.J., Kim G.D., Ahn Y.H., Lee S.K. 2013. Suppression of Src/ERK and GSK-3/β-catenin signaling by pinosylvin inhibits the growth of human colorectal cancer cells. Food Chem. Toxicol. 55, 424–433.
Yang M.H., Kim J., Khan I.A., Walker L.A., Khan S.I. 2014. Nonsteroidal anti-inflammatory drug activated gene-1 (NAG-1) modulators from natural products as anti-cancer agents. Life Sci. 100 (2), 75–84.
Laavola M., Nieminen R., Leppдnen T., Eckerman C., Holmbom B., Moilanen E. 2015. Pinosylvin and monomethylpinosylvin, constituents of an extract from the knot of Pinus sylvestris, reduce inflammatory gene expression and inflammatory responses in vivo. J. Agric. Food Chem. 63 (13), 3445–3453.
Koskela A., Reinisalo M., Hyttinen J.M., Kaarniranta K., Karjalainen R.O. 2014. Pinosylvin-mediated protection against oxidative stress in human retinal pigment epithelial cells. Mol. Vis. 20, 760–769.
Devi K.P., Rajavel T., Habtemariam S., Nabavi S.F., Nabavi S.M. 2015. Molecular mechanisms underlying anticancer effects of myricetin. Life Sci. 142, 19–25.
Shi W., Li L., Ding Y., Yang K., Chen Z., Fan X., Jiang S., Guan Y., Liu Z., Xu D., Wu L. 2018. The critical role of epigallocatechin gallate in regulating mitochondrial metabolism. Future Med. Chem. 10(7), 795–809.
Mohib M., Afnan K., Paran T.Z., Khan S., Sarker J., Hasan N., Hasan I., Sagor A.T. Beneficial role of citrus fruit polyphenols against hepatic dysfunctions: A review. 2018. J. Diet Suppl. 15(2), 223–250.
Дополнительные материалы отсутствуют.
Инструменты
Биологические мембраны: Журнал мембранной и клеточной биологии