Биологические мембраны: Журнал мембранной и клеточной биологии, 2020, T. 37, № 3, стр. 235-240
Морфометрический анализ внутренней ультраструктуры митохондрий мышечной ткани волосатика Gordionus alpestris (Nematomorpha)
Ч. М. Эльдаров a, В. Б. Вайс a, И. М. Вангели a, О. А. Аверина a, Б. Д. Ефейкин b, Л. Е. Бакеева a, *
a НИИ физико-химической биологии им. А.Н. Белозерского,
Московский государственный университет
им. М.В. Ломоносова
119234 Москва, Россия
b Институт проблем экологии и эволюции
им. А.Н. Северцова РАН
119071 Москва, Россия
* E-mail: bakeeva@belozersky.msu.ru
Поступила в редакцию 02.04.2019
После доработки 25.07.2019
Принята к публикации 27.07.2019
Аннотация
В работе было проведено морфометрическое исследование внутренней ультраструктуры митохондрий мышечной ткани волосатика Gordionus alpestris (Nematomorpha). В качестве основного измеряемого морфометрического параметра был взят общепринятый стереологический параметр – площадь поверхности внутренней мембраны митохондрий на единицу объема митохондрии или поверхностная плотность внутренней мембраны. Был проведен сравнительный анализ значений данного параметра у волосатика с аналогичными данными для митохондрий скелетной и сердечной мышцы. Было установлено, что значение поверхностной плотности внутренней мембраны митохондрий волосатика паразитической формы составляет 41.70 мкм2/мкм3, а свободноживущей формы – 39.42 мкм2/мкм3, что соответствует значениям этого параметра для кардиомиоцитов мыши (С57BL/6 × CBA) в возрасте трех месяцев, кардиомиоцитов крыс Wistar в возрасте трех месяцев и достоверно выше, чем у митохондрий скелетной мышцы мыши того же возраста (33.53 мкм2/мкм3). Обсуждается функциональное значение мощно развитой системы митохондриальных мембран протяженных митохондрий волосатика как структуры в качестве структуры, необходимой для обеспечения эффективной работы сократительного аппарата мышечной ткани волосатика.
ВВЕДЕНИЕ
Проведенное нами ранее исследование ультраструктуры хондриома мышечной ткани волосатика (Gordionus alpestris) показало, что митохондриальный аппарат лентообразных мышечных волокон, достигающих в длину до 800 мкм, – это мощно развитая митохондриальная система, образованная протяженными митохондриями, расположенными в центральном цитоплазматическом пространстве мышечного волокна и полностью его заполняющими [1]. Однако согласно литературным данным, хондриом мышечной ткани волосатика представлен мелкими, одиночными, редко расположенными митохондриями [2, 3]. Нами было высказано предположение, что система протяженных гигантских митохондрий, обнаруженная в мышечной ткани волосатика, является не просто морфологической особенностью ультраструктуры данной ткани, но функционально обусловленным типом организации митохондриального аппарата, который выполняет определяющую роль для энергообеспечения активно работающей мышечной ткани.
Известно, что функциональные особенности митохондрий в большой степени определяются не только морфологическими состояниями, но и параметрами внешней и внутренней мембраны митохондрий. Такая оценка состояния хондриома возможна с использованием методов морфометрии и стереологии, позволяющих устанавливать корреляцию митохондриальных структурных параметров с энергетическим режимом митохондрий и ткани в целом [4–9]. Энергетический режим митохондрий хорошо иллюстрирует такой общепринятый стереологический параметр, как площадь поверхности внутренней мембраны митохондрий на единицу объема митохондрии или поверхностная плотность внутренней мембраны [10, 11].
Этот параметр был взят нами в качестве основного измеряемого морфометрического параметра для анализа ультраструктуры митохондрий мышечной такни волосатика. Для обоснования предположения об особенностях структуры митохондрий мышечной ткани волосатика, связанных с уровнем энергозатрат и функциональных нагрузок, мы провели сравнительный анализ данных поверхностной плотности внутренней мембраны митохондрий волосатика с аналогичными данными для митохондрий скелетной и сердечной мышцы мыши.
МАТЕРИАЛЫ И МЕТОДЫ
Особи Gordionus alpestris (Villot, 1885) были собраны в Республике Адыгея, пос. Никель (44°10′40.1″ N, 40°09′28.2″ E), хозяин – двупарноногая многоножка Pachyiulus krivolutskyi. Волосатики паразитируют в полости тела различных членистоногих (в основном насекомых). Достигнув определенных размеров, они выходят из хозяев и живут свободно в воде, при этом свободноживущая форма не способна к питанию и умирает вскоре после копуляции. [12]. Исследованы 1 самка, 1 самец паразитарной формы, которых добывали путем вскрытия многоножек, и 2 самки, 2 самца свободноживущей формы. Мышечную ткань забирали на одном и том же уровне центральной части тела особей.
В нашем исследовании были также использованы лабораторные мыши-самцы, F1 (C57Bl/6 × × CBA).
Животных содержали в стандартных условиях вивария, в индивидуально вентилируемых клетках (система IVC, TECNIPLAST S.p.A., Италия) по 5 особей, в условиях свободного доступа к корму (Ssniff Spezialdiäten GmbH, Германия) и воде; в условиях свободных от патогенов; при световом режиме 12/12, в помещениях с кратностью воздухообмена не менее 15 об/ч, с температурой воздуха 20–24°С, влажностью 30–70%; в качестве подстила использовали деревянную щепу Lignocel (JRS, Германия); все материалы, поступающие к животным, были стерилизованы.
Все манипуляции на лабораторных мышах осуществлялись по протоколу, одобренному локальной комиссией по биоэтике ИЦ ВЭК OOO “НИИ Митоинженерии МГУ”, заключение комиссии номер 67 от 28.04.2015 года.
Для исследования ультраструктуры митохондриального аппарата скелетной мышцы забирали ткань широких мышц бедра: латеральной, медиальной и промежуточной (musculus vastus lateralis, medius, intermedius).
Для исследования ультраструктуры митохондриального аппарата кардиомиоцитов забирали ткань левого желудочка сердца.
Материал фиксировали 3% раствором глутарового альдегида в фосфатном буфере (рН 7.4) в течение 2 ч при 4°С, затем дофиксировали 1% раствором четырехокиси осмия в буфере в течение 1.5 ч и обезвоживали в растворах спиртов с возрастающей концентрацией спирта (70% спирт был насыщен уранилацетатом). Материал заливали в эпоксидную смолу Эпон-812. Серийные ультратонкие срезы делали на ультрамикротоме Leica ULTRACUT (Германия), окрашивали свинцом по Рейнольдсу. Полученные препараты просматривали и фотографировали в электронном микроскопе JEOL JEM-1400 (Япония) c цифровой камерой Emsis QUEMESA. Для морфометрического исследования на каждом отобранном электронно-микроскопическом снимке вручную выделялись отдельные митохондрии, затем внутри каждой митохондрии выделялась внутренняя мембрана. Ширина линии при выделении мембран выбиралась исходя из масштаба снимка, среднюю ширину внутренней мембраны митохондрии на снимке считали равной 75 Å. Учитывая известную толщину среза в 700 Å, с помощью пакета анализа данных в Adobe Photoshop были вычислены различные морфометрические параметры, такие как площадь внутренней мембраны митохондрий в объеме среза, общая длина внутренней мембраны митохондрий и объем митохондрии в срезе. С помощью полученных данных была рассчитана площадь поверхности внутренней мембраны (мкм2) на единицу объема митохондрии (мкм3). Для статистической обработки морфометрических данных использовался пакет STATISTICA 8. Для проверки нормальности данных использовался тест Колмогорова-Смирнова, попарные сравнения делались между формами волосатика, а также между мышцей волосатика и скелетной/сердечной мышцей мыши с поправкой Бонферрони на множественные сравнения и уровнем значимости p < 0.05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Мышечная ткань волосатика (тип flattened circomyarian) представлена слоем уплощенных лентообразных мышечных волокон. В центре мышечного волокна располагается узкая цитоплазматическая область, окруженная сплошным периферическим слоем сократительного материала, который образует подобие футляра вокруг центральной цитоплазматической области. На рис. 1а показан участок мышечного волокна на поперечном сечении. Можно видеть узкую центральную цитоплазматическую область, равномерно заполненную мелкими митохондриями округлой или удлиненной формы. В предыдущем исследовании [1] мы показали, что это поперечные сечения собранных в продольные тяжи протяженных гигантских митохондрий, достигающих в длину более 4 мкм. На рис. 1б при большем увеличении можно видеть, что митохондрии имеют хорошо выраженный матрикс, хаотично расположенные кристы. Различий в структуре митохондриального аппарата самцов и самок выявлено не было. Такая ультраструктурная картина оказалась подходящей для морфометрической оценки поверхностной плотности внутренней мембраны митохондрий мышечных волокон волосатика: отчетливо видны кристы митохондрий и для измерений одновременно доступны сечения 8–10 митохондрий.
Рис. 1.
Ультраструктура митохондрий мышечной ткани волосатика. а – на поперечном сечении мышечного волокна можно видеть мелкие одиночные митохондрии, расположенные в центральной цитоплазматической области. б – особенности ультраструктуры митохондрий при большем увеличении.

В предыдущем исследовании было показано, что ультраструктура митохондрий была идентична у свободноживущих и у паразитарных форм волосатика. В этой работе мы провели измерения на участках поперечного сечения центральной цитоплазматической области мышечных волокон по 20 электронно-микроскопическим фотографиям в обеих группах животных.
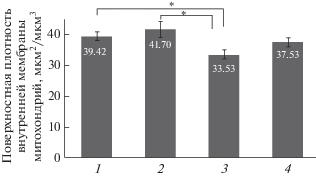
На рис. 2 представлены результаты измерения площади поверхности внутренней мембраны в единице объема митохондрии мышечной ткани волосатика. Этот показатель составил 39.42 мкм2/мкм3 для митохондрий паразитарной формы и 41.7 мкм2/мкм3 для свободноживущей формы. Значение стандартной ошибки среднего не превышает 1.5 мкм2/мкм3, статистически достоверных отличий не выявлено, что свидетельствует о том, что митохондрии обеих форм волосатика имеют схожий уровень активности.
Рис. 2.
Поверхностная плотность внутренней мембраны митохондрий в мышечной ткани различных животных: 1 – мышечная ткань паразитической формы волосатика; 2 – мышечная ткань свободноживущей ткани волосатика; 3 – скелетная мышца мыши; 4 – сердечная мышца мыши.
Отсутствие разницы в строении митохондрий у свободноживущих и паразитарных форм волосатика (как в предыдущем исследовании, так и в этой работе) можно объяснить тем, что невозможно установить точную фазу жизненного цикла отловленных животных.
Интерес представляет сравнение полученных морфометрических данных о параметрах внутренней митохондриальной мембраны мышечной ткани волосатика с результатами морфометрического анализа митохондрий скелетной и сердечной мышц млекопитающих, характеризующихся энергоемкими и одновременно синхронными процессами сокращения мышечных клеток.
Хорошо известно, что наряду с существенными различиями в функционировании этих мышечных тканей (в скелетной мышце сокращение и расслабление происходит не постоянно, в мышечной ткани сердца – непрерывно) и значительными различиями в структурной организации хондриома сердечной и скелетной мышц, ультраструктурная организация хондриома этих мышечных тканей подчинена выполнению одной и той же основной функции – обеспечению эффективной деятельности сократительного аппарата, которое происходит за счет систем мембран гигантских митохондрий, объединенных в единую систему митохондриального ретикулума.
Как известно, в скелетной мышце основная масса митохондриального материала – митохондриальный ретикулум, образованный разветвленными гигантскими митохондриями – располагается в виде слоев в изотропных зонах, в плоскости перпендикулярной длинной оси мышечного волокна [13, 14]. Поэтому на продольном срезе мышечного волокна мы видим поперечные сечения гигантских митохондрий в виде мелких одиночных митохондрий, расположенных в изотропной зоне попарно по обе стороны от Z-линии (рис. 3).
Рис. 3.
Участок продольного среза мышечного волокна скелетной мышцы мыши. В изотропной зоне можно видеть поперечные сечения митохондриального ретикулума в виде мелких митохондрий, расположенных попарно по обе стороны Z-линии.

Морфометрическую оценку поверхностной плотности внутренней мембраны митохондрий скелетной мышцы мыши мы проводили на 20 электронно-микроскопических фотографиях участков продольного среза мышцы, содержащего не менее 15 поперечных сечений митохондриального ретикулума. На рис. 2 можно видеть, что значение поверхностной плотности внутренней мембраны митохондрий скелетной мышцы составило 33.53 мкм2/мкм3, что достоверно ниже показателей как для паразитической, так и для свободноживущей формы волосатика.
В кардиомиоцитах митохондриальный материал представлен в виде слоев, образованных митохондриями, объединенными в единую систему митохондриального ретикулума, которые окружают пучки миофибрилл [15, 16]. Такое расположение митохондрий представлено на рис. 4. Анализ поверхностной плотности митохондрий кардиомиоцитов мы проводили также по 20 электронно-микроскопическим фотографиям участков продольных срезов кардиомиоцитов мыши, содержащих не менее 10 сечений митохондрий.
Рис. 4.
Участок продольного среза кардиомиоцита мыши. Можно видеть ряды митохондрий, расположенных вдоль миофибрилл.

Значение поверхностной плотности внутренней мембраны митохондрий кардиомиоцитов мыши составило 37.53 мкм2/мкм3 (рис. 3). Аналогичные значения были получены нами ранее для митохондрий кардиомиоцитов трехмесячных крыс Wistar, которое составило 41.30 мкм2/мкм3 [8].
Таким образом, не только морфологические ультраструктурные исследования, но и морфометрический анализ параметров внутренней митохондриальной мембраны показал, что в мышечной ткани волосатика присутствует хорошо развитая митохондриальная мембранная система Косоисчерченная мышечная ткань волосатика (тип flattened circomyarian), имеет черты сходства как с гладкомышечной тканью – митохондрии располагаются в особой зоне – центральном цитоплазматическом пространстве, а не среди миофибрилл, так и с поперечнополосатой – на основании ультраструктуры и особенностей функционирования сократительного аппарата.
Если представить структуру митохондриального аппарата огромных лентообразных мышечных волокон волосатика (согласно литературным данным) [2, 3] в виде мелких, одиночных не связанных друг с другом митохондрий, расположенных в центральном цитоплазматическом пространстве, то очевидно, что при максимальной сократительной работе мелкие, одиночные митохондрии с небольшим количеством крист не смогут обеспечить координированную работу по осуществлению нужной скорости выработки энергии для энергообеспечения протяженных мышечных волокон, достигающих в длину до 800 мкм.
Как показали морфометрические измерения, значения поверхностной плотности внутренней мембраны митохондрий волосатика соответствуют значениям этого параметра для кардиомиоцитов мыши (C57Bl/6 × CBA) в возрасте 3 мес., кардиомиоцитов крыс Wistar в возрасте 3 мес. и достоверно выше, чем у митохондрий скелетной мышцы мыши (C57Bl/6 × CBA) того же возраста.
Согласно существующим представлениям [2, 3], основную часть туловищной мускулатуры волосатика составляют косоисчерченные мышцы. В косоисчерченных мышечных клетках присутствуют так называемые “косые” саркомеры, т.к. ограничивающие их Z-диски расположены косо по отношению к длинной оси клетки. В отличие от поперечнополосатых мышц в косоисчерченных мышечных клетках Z диски – это система расположенных в ряд уплотненных фибриллярных участков, разделенных свободными промежутками, где отсутствует жесткая структурная связь толстых миозиновых протофибрилл в центре саркомера. Поэтому при сокращении происходит не только движение актиновых протофибрилл к центрам саркомеров, но и смещение миозиновых протофибрилл относительно друг друга, приводящее к изменению угла наклона саркомера, вследствие чего меняется расположение Z-дисков – они располагаются так же, как и в саркомерах поперечнополосатой мышечной ткани – перпендикулярно длинной оси клетки. Эти структурные особенности косоисчерченных мышечных клеток позволяют генерировать более мощное (по сравнению с поперечнополосатой мышечной тканью) напряжение, необходимое для осуществления разнообразных по направлению сокращений, позволяющих обеспечивать червеобразные движения тела волосатика [17]. Как известно, мышечные сокращения являются зависящими от энергии процессами. Поэтому можно предположить, что обнаруженное нами статистически достоверное увеличение площади поверхности внутренней митохондриальной мембраны в мышечных клетках волосатика по сравнению с митохондриями скелетной мышцы мыши необходимо для обеспечения соответствующего уровня дыхательной активности митохондрий, лежащей в основе особенностей механохимических процессов сокращения мышечных клеток волосатика.
Таким образом, результаты наших исследований организации хондриома мышечной ткани волосатика, на основе ультраструктурного и морфометрического анализов, характеризуют функциональное значение выявленной нами развитой системы митохондриальных мембран протяженных митохондрий, в качестве структуры, необходимой для эффективной работы сократительного аппарата мышечной ткани волосатика.
Авторы выражают глубокую благодарность В.В. Алёшину за помощь при подготовке публикации результатов исследований.
Исследование выполнено за счет гранта Российского фонда фундаментальных исследований (проект № 18-34-00413).
Список литературы
Вайс В.Б., Вангели И.М., Эльдаров Ч.М., Ефейкин Б.Д., Бакеева Л.Е. 2019. Митохондрии с характерной для энергоемких процессов клетки структурной организацией в косо-исчерченной мышечной ткани Gordionus alpestris (Nematomorpha, Gordioidea). Биохимия. 84 (1), 56–61.
Lanzavecchia G., Valvassory R., Magda de Eguileor, Lanzavecchia P. 1979. Three-dimensional reconstruction of the contractile system of the Nematomorpha muscle fiber. J. Ultrastruct. Res. 66, 201–223.
Restelli M. A., de Villalobos L.C., Fernanda Z. 2002. Ultrastructural description of the musculature, the intraepidermal nervous system, and their interrelation in Pseudochordodes bedriagae (Nevatomorpha). Cell Tissue Res. 308, 299–306.
Weibel E.R. 1979. Stereological methods. Practical methods for biological morphometry. Academic Press, London. 1.
Gundersen H.J., Bendtsen T.F., Korbo L., Marcussen N., Møller A., Nielsen K., Nyengaard J.R., Pakkenberg B., Sørensen F.B., Vesterby A. 1989. Some new, simple and efficient stereological methods and their use in pathological research and diagnosis. APMIS. 96 (5), 379–394.
Mandarim-de-Lacerda C.A. 2003. Stereological tools in biomedical research. An. Acad. Bras. Cienc. 75 (4), 469–486.
Шиндерите В.С., Ясайтис А.А. 1984. Влияние ингибиторов энергетического обмена на морфометрические параметры в пространственную структуру митохондрий L-клеток. Цитология. 26, 666–671.
Эльдаров Ч.М., Вайс В.Б., Вангели И.М., Колосова Н.Г., Бакеева Л.Е. 2015. Морфометрическое исследование ультраструктуры митохондрий кардиомиоцитов при старении. Биохимия. 80 (5), 604–609.
Непомнящих Л.М., Лушникова Е.М., Молодых Н.А., Клинникова М.Г., Молодых О.П. 2011. Ультраструктура и стереология кардиомиоцитов при развитии регенераторно-пластической недостаточности миокарда в онтогенезе. Бюлл. экспер. биол. и мед. 151 (1), 100–106.
Mccallister B.D., Brown A.L. 1965. A quantitative morphological study of the mitochondria in experimental cardiac hypertrophy. Lab. Invest. 14, 692–700.
Cieciura L., Rydzynski K., Klitonczyk W. 1979. Stereologic studies on mitochondrial configuration in different organs of the rat. Cell Tissue Res. 196, 347–360.
Догель В.А. 1975. Зоология беспозвоночных. М: “Высшая школа”. 559 с.
Бакеева Л.Е., Скулачев В.П., Ченцов Ю.С. 1977. Митохондриальный ретикулум: строение и возможные функции внутриклеточных структур нового типа в мышечной ткани. Вестник Московского университета, серия Биология. 3, 23–38.
Bakeeva L.E., Chentsov Yu.S, Skulachev V.P. 1978. Mitochondrial Framework (reticulum mitochondriale) in rat diaphragm muscle. Biochim. Biophys. Acta. 501, 349–369.
Бакеева Л.Е., Ченцов Ю.С., Скулачев В.П. 1982. Межмитохондриальные контакты кардиомиоцитов. Цитология. 24 (2), 161–166.
Bakeeva L.E., Chentsov Yu.S., Skulachev V.P. 1983. Intermitochondrial contacts in myocardiocytes. J. Mol. Cell. Cardiol. 15, 413–420.
Заварзин А.А. 1985. Основы сравнительной гистологии. Л: Изд-во Ленингр. ун-та, с. 321.
Дополнительные материалы отсутствуют.
Инструменты
Биологические мембраны: Журнал мембранной и клеточной биологии


