Биологические мембраны: Журнал мембранной и клеточной биологии, 2020, T. 37, № 5, стр. 396-400
Влияние рафтов тонопласта на импорт ДНК в митохондрии клубней картофеля (Solanum tuberosum)
Е. С. Клименко a, И. С. Нестеркина a, Н. В. Озолина a, *, В. В. Гурина a, М. В. Кулинченко a, Ю. М. Константинов a, **
a Сибирский институт физиологии и биохимии растений СО РАН
664033 Иркутск, Россия
* E-mail: ozol@sifibr.irk.ru
** E-mail: yukon48@mail.ru
Поступила в редакцию 26.12.2019
После доработки 10.04.2020
Принята к публикации 15.04.2020
Аннотация
Изучено влияние тонопласта и изолированных из него рафтов на импорт ДНК в митохондрии картофеля (Solanum tuberosum). Показано, что добавление рафтов тонопласта в 8 раз увеличивало активность импорта ДНК в митохондрии по сравнению с фракцией вакуолярных мембран, из которых они были выделены.
ВВЕДЕНИЕ
Многочисленные экспериментальные данные в настоящее время указывают на то, что нормальное функционирование митохондрий эукариот, включая высшие растения, в значительной степени зависит от физических контактов этих органелл с другими клеточными органеллами, в особенности с мембранами эндоплазматического ретикулума (ЭР), пероксисомами и вакуолями [1–6]. Участки контактов разных типов органелл, получившие название “мембранных контактных сайтов” (МКС), в последние годы интенсивно изучаются [7]. Так, в исследованиях на клетках человека установлен факт значительного содержания в составе МКС стеринов, что позволяет отнести их к так называемым “рафтовым структурам” или “рафтам” [2]. Рафтами принято называть небольшие (10–200 нм), высоко динамичные, обогащенные стеринами и сфинголипидами мембранные домены, принимающие участие, в зависимости от типа контактирующих органелл, в регуляции функций мембранных каналов, импорте липидов, доставке белков из аппарата Гольджи в плазматическую мембрану, внутриклеточной передаче Ca2+-сигналов, эндоцитозе и некоторых других процессах [8]. Если в отношении липидного состава рафтов мембран разного происхождения значительных различий не обнаружено, то белковый состав рафтов, определяющий их функциональную роль, зависит от типа органелл, из мембран которых рафты были выделены [9].
Общепризнано, что одним из важных условий нормального функционирования митохондрий растений является наличие у них мембранных систем транспорта макромолекул (белков, тРНК и ДНК) [10, 11]. Предполагается, что природная способность митохондрий растений к импорту ДНК [11, 12] может иметь прямое отношение к горизонтальному переносу генов в эти органеллы, происходящему со значительно более высокой частотой, чем в ядерный и хлоропластный геномы. Однако в целом, в отличие от импорта белков и тРНК, детальных сведений о биологической роли и мембранном механизме импорта ДНК в митохондрии растений пока не существует.
Ранее нами было обнаружено стимулирующее влияние мембран ЭР на импорт ДНК в изолированные митохондрии растений [13]. Целью данной работы было изучить влияние вакуолярной мембраны и выделенных из нее рафтов на активность импорта ДНК в митохондрии картофеля (Solanum tuberosum).
МАТЕРИАЛЫ И МЕТОДЫ
Выделение митохондрий из клубней картофеля (Solanum tuberosum) осуществляли, как описано в работе [14]. Содержание белка определяли по методу Бредфорда [15]. В качестве субстрата импорта в митохондрии использовали фрагмент ДНК размером 717 п.н., включающий в себя последовательность гена GFP. Для получения митопластов наружную мембрану митохондрий разрушали с помощью осмотического шока: осадок митохондрий ресуспендировали в 1 мл 5 мМ фосфата калия, pH 7.5, инкубировали на льду 5 мин, затем осаждали и промывали в буфере, содержащем 0.3 М сахарозу.
Импорт ДНК в митохондрии проводили согласно описанному ранее протоколу [16]. Инкубацию митохондрий (200 мкг белка в одной пробе) с ДНК проводили в стандартных условиях (25°С при постоянном мягком покачивании) в течение 40 мин в 20 мкл буфера импорта (0.4 М сахарозы, 40 мМ фосфата калия, рН 7.0). Для инкубации с митохондриями рафты и фракцию вакуолярных мембран добавляли в количестве 5 мкг. После инкубации митохондрии дважды отмывали от избытка ДНК в среде инкубации, затем ресуспендировали в исходном объеме буфера импорта и добавляли ДНКазу I (1 ед. акт./проба) (Thermo Scientific) и хлорид магния до конечной концентрации 10 мМ. ДНКазную обработку проводили в течение 20 мин при 25°С, отмывали от ДНКазы центрифугированием и проводили экстракцию нуклеиновых кислот. Для выделения тотальной ДНК из митохондрий использовали метод термообработки изолированных митохондрий, как описано в [16]. Анализ активности импорта ДНК в митохондрии проводили с использованием метода мультиплексной количественной ПЦР в реальном времени (ПЦР-РВ) и программного обеспечения CFX 96 (BioRad). Активность импорта, определяемая как количество чужеродной ДНК, поглощенной митохондриями за фиксированный период времени, оценивали в условных единицах, полученных нормированием в каждом образце показателей уровней амплификации гена GFP (GenBank: U73901.1) и митохондриального гена СOX2 (GenBank: DQ185064.1) (табл. 1).
Таблица 1.
Нуклеотидные последовательности праймеров и флуоресцентных зондов
| Олигонуклеотид | Нуклеотидная последовательность | |
|---|---|---|
| COX2 | Rev | 5'-AGCCTGCAATGTCCGATAAC-3' |
| For | 5’-ACCATTCCGAAGGTTACTG-3' | |
| Проба | FAM~5'‑TGGTATACAACTTTGGACCTAACAGCCGGC‑3'~FQ | |
| GFP(2) | Rev | 5'-CGGGGCATGGCACTCTTGA-3' |
| For | 5'-CTGTTCCTTGGCCACACT-3’ | |
| Проба | Cy5~5'‑TGTTCAATGCTTTTCAAGATACCCAGA‑3'~BHQ2 | |
Вакуолярные мембраны получали из находящихся на стадии покоя корнеплодов столовой свеклы (Веta vulgaris L.) методом [17]. Чистоту мембранных фракций оценивали при помощи таких специфических ингибиторов H+-АТP-аз F-, P- и V-типа, как азид натрия, ванадат натрия и бафиломицин. Рафты выделяли по методу [18]. Материал, полученный после высокоскоростного центрифугирования, делили на зоны. В экспериментах использовали везикулы вакуолярной мембраны и зону, которая, как нами ранее установлено [18], содержала рафты.
Используемые фракции перед экспериментами промывали буферным раствором, содержащим 300 мM сахарозу, 10 мM фосфат калия, 1 мM EDTA, 5 мM глицин (pH 7.5) и осаждали центрифугированием при 100 000 g.
Статистическую обработку результатов проводили с применением программы SigmaPlot 12.5. Полученные данные представлены в виде среднего арифметического ± стандартное отклонение. Для доказательства наличия значимых различий между средними проводили анализ с использованием t-критерия Стьюдента. Различия между экспериментальными данными считали статистически значимыми при p < 0.05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
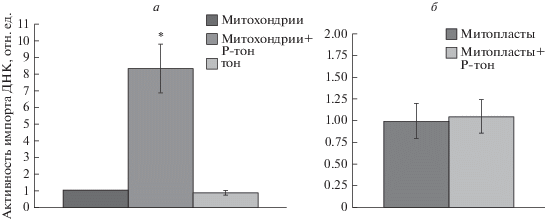
Нами установлено, что добавление рафтовых структур тонопласта в систему митохондриального импорта ДНК приводило к существенному (в 8 раз) увеличению активности импорта ДНК в эти органеллы по сравнению с эффектом вакуолярной мембраны, из которой они были выделены (рис. 1). Мы полагаем, что при добавлении рафтов к митохондриальной суспензии создаются условия в некоторой степени аналогичные условиям in vivo, при которых формируются МКС между митохондриями и вакуолями. Одним из вероятных последствий, происходящих при этих структурных изменениях наружной и внутренней митохондриальных мембран, может быть активация работы мембранных каналов, обеспечивающих перенос молекул ДНК в эти органеллы. Ранее экспериментально продемонстрировано существование МКС между митохондриями и вакуолями [6]. Из полученных в данной работе результатов следует, что ключевую роль в формировании контактных сайтов между митохондриями и тонопластом играют, по-видимому, компоненты наружной мембраны митохондрий, поскольку присутствие рафтов в среде инкубации оказывало активирующий эффект только на импорт ДНК в митохондрии, но не в митопласты (митохондрии, лишенные наружной мембраны) (рис. 1).
Рис. 1.
Влияние рафтов тонопласта и вакуолярной мембраны на активность импорта ДНК в митохондрии (а) и митопласты (б). Условные обозначения: митохондрии – контроль; митохондрии + Р-тон – митохондрии + рафты тонопласта; тон – митохондрии + тонопласт; митопласты + Р-тон – митопласты + рафты тонопласта. *p < 0.05, M± SD, n = 3.
Важно отметить, что существует определенное сходство в механизмах импорта стеринов и ДНК в митохондрии, состоящее в участии в этих процессах таких переносчиков, как порин (VDAC) наружной митохондриальной мембраны и адениннуклетидтранслоказа (ANT) внутренней митохондриальной мембраны [12, 19, 20]. В случае импорта стеринов установлено, что в состав транспортного комплекса помимо VDAC и ANT входит периферический бензодиазепиновый рецептор (PBR), именуемый в последнее время транслокаторным белком TSPO [20, 21]. Ранее уже высказывалась гипотеза о важной роли PBR/TSPO в импорте ДНК в митохондрии животных [22]. В связи с этим нельзя исключать, что такие компоненты рафтов, как стерины могут выступать в качестве активатора субстратного типа при работе транспортосомного комплекса PBR/TSPO-VDAC-ANТ в данном случае в отношении импорта ДНК в митохондрии.
Ранее показано, что предшественник β-субъединицы ATP-синтазы принимает участие в переносе ДНК через наружную мембрану митохондрий [11]. В составе многочисленных белков рафтов тонопласта содержится также и β-субъединица ATP-синтазы [23]. Таким образом, данный белок мог также служить одним из факторов, вызывающих эффект активации импорта ДНК в митохондрии.
Примечательно, что добавление к митохондриям собственно вакуолярной мембраны не оказывало какого-либо влияния на импорт ДНК (рис. 1а). Это можно объяснить тем, что тонопласт и его рафты мы вносили в систему митохондриального импорта ДНК in organello в равных по содержанию белка количествах. Однако очевидно, что в рафтах тонопласта липиды и белки, оказывающие влияние на мембранный механизм импорта ДНК, содержатся в существенно бóльшем количестве, чем в тонопласте.
Таким образом, в настоящей работе впервые установлено, что в системе in organello добавление рафтов тонопласта вызывает значительное возрастание активности импорта ДНК в митохондрии Solanum tuberosum. Обнаруженный эффект, по-видимому, связан с активирующим влиянием структурных компонентов рафтов на работу транспортных систем митохондрий, которые задействованы в импорте ДНК. Важно подчеркнуть, что в случае добавления рафтов к митохондриям, лишенным наружной мембраны, активации импорта ДНК в органеллы не наблюдалось (рис. 1б), что указывает на необходимость наружной мембраны для проявления обнаруженного эффекта. Выяснение молекулярной природы активации митохондриального импорта ДНК в присутствии рафтов требует проведения дополнительных исследований.
Работа выполнена с частичным использованием средств грантов МК-6666.2020.11, РФФИ № 18-04-00603 и 19-04-00013 на оборудовании ЦКП “Биоаналитика” Сибирского института физиологии и биохимии растений СО РАН (г. Иркутск).
Список литературы
Stacchiotti A., Favero G., Lavezza A., Garcia-Gomez R., Monsalve M., Rezzani R. 2018. Perspective: Mitochondria-ER contacts in metabolic cellular stress assessed by microscopy. Cells. 8, 1–9.
Fujimotoat M., Hayashi T., Su T.P. 2012. The role of cholesterol in the association of endoplasmic reticulum membranes with mitochondria. Biochem. Biophys. Res. Commun. 417, 635–639.
Janikiewicz J., Szymanski J., Malinska D., Patalas-Krawczyk P., Michalska B., Duszynski J., Giorfi C., Bonora M., Dobrzyn A., Wieckowski M.R. 2018. Mitochondria-associated membranes in aging and senescence: Structure, function, and dynamics. Cell Death Disease. 9, 1–12.
Camões F., Bonekamp N.A., Delille H.K., Schrader M. 2009. Organelle dynamics and dysfunction: A closer link between peroxisomes and mitochondria. J. Inherit. Metab. Dis. 32, 163–180.
Shai N., Schuldiner M., Zalckvar E. 2016. No peroxisome is an island–Peroxisome contact sites. Biochim. Biophys. Acta. 1863, 1061–1069.
Honscher C., Mari M., Auffarth K., Bohnert M., Griffith J., Geerts W., van de Laan M., Cabrera M., Reggiori F., Ungermann C. 2014. Cellular metabolism regulates contact sites between vacuoles and mitochondria. Dev. Cell. 30 (1), 86–94.
Ilacqua N., Sanchez-Alvarez M., Bachmann M., Costiniti V., Del Pozo M.A., Giacomello M. 2017. Protein localization at mitochondria-ER contact sites in basal and stress conditions. Front. Cell Develop. Biol. 5, 1–14
Pike L.J. 2006. Rafts defined: A report on the Keystone Symposium on lipid rafts and cell function. J. Lipid Res. 47 (7), 1597–1598.
Simons K., Sampaio J.L. 2011. Membrane organization and lipid rafts. Cold Spring Harb Perspect. Biol. 3 (10), 1–17.
Верещагина Н.А., Константинов Ю.М., Каменский П.А., Мазунин И.О. 2018. Импорт белков и нуклеиновых кислот в митохондрии. Биохимия. 83 (6), 816–838.
Weber-Lotfi F., Koulintchenko M.V., Ibrahim N., Hammann P., Mileshina D.V., Konstantinov Yu.M., Dietrich A. 2015. Nucleic acid import into mitochondria: New insights into the translocation pathways. Biochim. Biophys. Acta. 1853, 3165–3181.
Koulintchenko M., Konstantinov Y., Dietrich A. 2003. Plant mitochondria actively import DNA via the permeability transition pore complex. EMBO J. 22 (6), 1245–1254.
Клименко Е.С., Шмаков В.Н., Болотова Т.А., Суббота И.Ю., Тарасенко В.И., Кулинченко М.В., Константинов Ю.М. 2018. Изучение роли взаимодействия мембран митохондрий и эндоплазматического ретикулума в импорте ДНК. Материалы докладов II Всероссийской научной конференции “Механизмы регуляции функций органелл эукариотической клетки”. Иркутск. 49–51.
Neuburger M. 1982. Purification of plant mitochondria by isopycnic centrifugation in density gradients of Percoll. Arch. Biochem. Biophys. 217 (1), 312–323.
Bradford M.M. 1976. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Anal. Biochem. 72 (1–2), 248–254.
Клименко Е.С., Милейко В.А., Морозкин Е.С., Лактионов П.П., Константинов Ю.М. 2011. Характеристика импорта и экспорта ДНК в митохондриях картофеля (Solanum tuberosum) с использованием метода количественной ПЦР. Биол. мембраны. 28 (3), 199–205.
Саляев Р.К., Кузеванов В.Я., Хаптагаев С.Б., Копытчук В.Н. 1981. Выделение и очистка вакуолей и вакуолярных мембран из клеток растений. Физиология растений. 28 (6), 1295–1306.
Ozolina N.V., Nesterkina I.S., Kolesnikova E.V., Salyaev R.K., Nurminsky V.N., Rakevich A.L., Martynovich E.F., Chernyshov M.Y. 2013. Tonoplast of Beta vulgaris L. contains detergent-resistant membrane microdomains. Planta. 237 (3), 859–871.
Константинов Ю.М., Дитриш А., Вебер-Лотфи Ф., Ибрагим Н., Клименко Е.С., Тарасенко В.И., Болотова Т.А., Кулинченко М.В. 2016. Импорт ДНК в митохондрии. Биохимия. 81, 1307–1321.
Flis V.V., Daum G. 2013. Lipid transport between the endoplasmic reticulum and mitochondria. In: The endoplasmic reticulum. A subject collection from Cold Spring Harbor Perspectives in Biology. Eds. Ferro-Novick S., Rapoport T.A., Schekman R. Cold Spring Harbor, New York, USA: Cold Spring Harbor Laboratory Press, p. 109–130.
McEnery M.W., Snowman A.M., Trifiletti R.R., Snyder S.H. 1992. Isolation of the mitochondrial benzo-diazepine receptor: Association with the voltage-dependent anion channel and adenine nucleotide carrier. Proc. Natl. Acad. Sci. USA, 89, 3170–3174.
Zorov D.B. 1996. Mitochondrial transport of nucleic acids. Involvement of the benzodiazepine receptor. Biochemistry (Moscow). 61, 939–946.
Yoshida K., Ohnishi M., Fukao Y., Okazaki Y., Fujiwara M., Song C., Nakanishi Y., Saito K., Shimmen T., Suzaki T., Hayashi F., Fukaki H., Maeshima M., Mimura T. 2013. Studies on vacuolar membrane microdomains isolated from Arabidopsis suspension-cultured cells: Local distribution of vacuolar membrane proteins. Plant Cell Physiol. 54 (10), 1571–1584.
Дополнительные материалы отсутствуют.
Инструменты
Биологические мембраны: Журнал мембранной и клеточной биологии


