Биологические мембраны: Журнал мембранной и клеточной биологии, 2021, T. 38, № 1, стр. 71-80
Применение SPR-биосенсора для анализа белок-белковых взаимодействий в водной среде и бислойной липидной мембране на примере P450scc (CYP11A1)
П. В. Ершов a, Л. А. Калужский a, Е. О. Яблоков a, *, О. В. Гнеденко a, А. А. Ковалевский b, А. М. Тумилович b, А. А. Гилеп b, Н. В. Струшкевич c, А. С. Иванов a
a Научно-исследовательский институт биомедицинской химии им. В.Н. Ореховича
119121 Москва, Россия
b Институт биоорганической химии Национальной академии наук Беларуси
220141 Минск, Республика Беларусь
c Сколковский институт науки и технологий
121205 Москва, Россия
* E-mail: evgeyablokov1988@mail.ru
Поступила в редакцию 14.07.2020
После доработки 20.08.2020
Принята к публикации 25.08.2020
Аннотация
Белок-белковые взаимодействия (ББВ) лежат в основе функционирования множества метаболических и сигнальных путей. Особый интерес представляют ББВ с участием мембранных белков, образующих стабильные или временные комплексы для передачи сигнала в клетку, транспорта ионов и молекул, переноса электронов в различных электрон-транспортных цепях. Метод SPR позволяет оценить термодинамику, кинетические (kon и koff) и равновесные (Kd) константы ББВ, а также определить модулирующие действия низкомолекулярных соединений. Цель данной работы состояла в адаптации протоколов SPR-анализа для исследования ББВ с участием митохондриального цитохрома Р450 CYP11A1, митохондриального цитохрома b5 (СYB5B) и адренодоксина (Adx). Было показано, что взаимодействия Adx – CYP11A1 и CYB5B–CYP11A1 зависят от способа иммобилизации белков и микроокружения. Ранее нами было показано, что в водном микроокружении при сходном значении koff (1.5 ± 0.2) × 10–3 c–1, значения kon комплексов Adx−CYP11A1 и CYB5B–CYP11A1 различались на порядок ((6.5 ± 0.5) × 104 и (0.30 ± 0.03) × 104 М–1 с–1 соответственно), что согласуется с высоким сродством CYP11A1 к физиологическому редокс-партнеру Adx. В липидном микроокружении скорость распада комплекса CYP11A1–Adx значительно выше, чем в водном, koff составляет (9.1 ± 0.3) × 10–3 c–1. Для сравнения параметры комплекса CYP11A1−CYB5B определить не удалось вследствие неспецифического связывания мембранных белков, используемых в качестве аналитов, с фосфолипидным бислоем на L1-чипе. Мы впервые доказали применимость SPR-метода для детекции и количественной оценки комплексообразования митохондриальных цитохромов Р450 с их редокс-партнерами как в водном, так и липидном микроокружении. Экспериментальные протоколы SPR-анализа, которые были разработаны и проверены в этой и предыдущих работах, представляют собой неотъемлемую часть современных подходов для изучения ферментов семейства цитохромов Р450 (CYP-omics), а также могут быть применимы для исследования мембранных белков.
ВВЕДЕНИЕ
Оптико-биосенсорный анализ, основанный на эффекте поверхностного плазмонного резонанса (SPR), позволяет регистрировать любые белок-белковые и белок-лигандные взаимодействия в режиме реального времени без использования вспомогательных детектирующих молекул, при этом один из партнеров по взаимодействию иммобилизуется на оптическом чипе (лиганд), а другой подается в измерительную ячейку с потоком рабочего буфера (аналит). Разные комбинации химических групп на поверхности оптического чипа позволяют иммобилизовать белковые молекулы ковалентно или нековалентно, ориентированным или случайным образом. Важным фактором выбора способа иммобилизации по-прежнему остаются физико-химические характеристики взаимодействующих биомолекул: наличие аффинной метки на N- или С-конце белка, мембранного “якоря”, профиль распределения сульфгидрильных и аминогрупп по поверхности белковой глобулы.
Цитохромы P450 (CYP) представляют собой класс гемсодержащих монооксигеназ, осуществляющих биохимические превращения огромного множества ксенобиотиков, лекарств, эндогенных метаболитов, а также участвующих в биосинтезе стероидных гормонов. Ферментативная активность P450 осуществляется с участием электронов, которые передаются от NADPH на железо гема с участием белков редокс-партнеров. В зависимости от клеточной локализации P450, разные редокс-белки осуществляют перенос электронов: NADPH-зависимая цитохром-Р450–оксидоредуктаза (CPR) – в эндоплазматическом ретикулуме и короткая редокс-цепь, состоящая из адренодоксинредуктазы (AdR) и адренодоксина (Adх) – в митохондриях.
У митохондриальных цитохромов Р450 имеется несколько участков связывания с мембраной, а редокс-партнер взаимодействует с дистальной стороной молекулы, удаленной от сайта связывания с мембраной. Эта особенность и чувствительность гемового кофактора к химическим воздействиям накладывают ограничения при проведении SPR-анализа белок-белковых взаимодействий с участием цитохромов Р450. Ранее мы показали, что CYP11A1 в водном микроокружении образует высокоаффинные комплексы с Adx [1, 2] и с митохондриальным цитохромом b5 (CYB5B) [3], а также способен к комплексообразованию с другими цитохромами Р450 [4]. Взаимодействия характеризовались высокой аффинностью, со значениями Kd в субмикромолярном диапазоне.
В настоящей работе представлены методические подходы оптико-биосенсорного анализа для оценки межмолекулярных взаимодействий с участием цитохромов Р450. В качестве объекта исследования был использован митохондриальный цитохром Р450 11А1 (P450scc, CYP11A1), катализирующий отщепление боковой цепи стероидных субстратов (холестерина, 7-дегидрохолестерола, эргостерола, люмистерола), а также гидроксилирование витаминов D3 и D2 [5, 6]. С помощью SPR-биосенсора были исследованы параметры взаимодействия Adx и CYP11A1, иммобилизованного в фосфолипидной бислойной мембране.
Для демонстрации возможного применения SPR-анализа для детекции белок-белковых взаимодействий (ББВ) с участием мембранных белков, находящихся в липидном микроокружении, нами был выбран митохондриальный цитохром Р450 CYP11A1, так как его взаимодействия с белками-партнерами в водном микроокружении уже были подробно изучены [1]. Детекцию можно проводить как в водной среде, так и в липидном микроокружении, в зависимости от типа оптического чипа. Следует отметить, что параметры взаимодействия CYP11A1 с белками-партнерами в водном и липидном микроокружении различаются. Перспективным представляется изучение взаимодействия митохондриальных CYP с Adx в липидном микроокружении различного состава, поскольку доступ гидрофобных субстратов в активный центр происходит из мембраны. Однако оценку влияния липофильных молекул на взаимодействие, определение термодинамических параметров белок-белковых комплексов, а также исследования мембранотропных аналитов предпочтительнее проводить в водном микроокружении.
МАТЕРИАЛЫ И МЕТОДЫ
Оборудование, расходные материалы и белковые препараты. В работе был использован 4-канальный SPR-биосенсор Biacore T-200 (GE Healthcare, США), оптические чипы CM5 серии S (с полимерной поверхностью, покрытой карбоксилированным декстраном) и чипы L1 серии S (GE Healthcare) с липофильными группами на поверхности. В качестве рабочих буферов был использован HBS-N (10 мМ HEPES (pH 7.4), 150 мМ NaCl) и HBS-EP+ (10 мМ HEPES (pH 7.4), 150 мМ NaCl, 1 мМ EDTA, 0.05% Tween-20). 10 мМ ацетат натрия (рН 5.0), водный раствор 0.1 М NHS (N-гидрокси-сукцинимид) и 0.4 М EDC (1-этил-3-(3-диметил-аминопропил)карбодиимид гидрохлорид) и стоковые растворы HBS-N и HBS-EP+ получали от GE Healthcare.
Высокоочищенные (>95% по данным SDS-PAGE) препараты рекомбинантных белков (CYP11A1, CYB5В, Adx) были получены как описано ранее [1, 7]. Бычий сывороточный альбумин (БСА) был получен от фирмы Sigma Aldrich (США).
Протокол ковалентной неориентированной иммобилизации на оптическом чипе СМ5. Данный протокол был использован для иммобилизации Adx, CYB5B, БСА, а также CYP11А1 на оптическом чипе. После уравновешивания поверхности чипа СМ5 рабочим буфером HBS-ЕР+ в течение 30 мин и скорости потока 10 мкл/мин выполняли промывку раствором 50 мМ NaOH в течение 30 с и скорости потока 30 мкл/мин. Иммобилизацию белков в разных каналах биосенсора осуществляли ковалентно путем формирования амидных связей между аминогруппами белка и карбоксильными группами на поверхности оптического чипа СМ5. Для этого карбоксильные группы чипа активировали пропусканием через канал биосенсора смеси равных объемов 0.2 М EDC/0.05 М NHS в течение 7 мин при скорости потока 5 мкл/мин. Далее осуществляли введение раствора белка (25 мкг/мл) в 10 мМ ацетатном буфере (рН 5.0) в течение 10 мин со скоростью 5 мкл/мин. Целевой уровень иммобилизации белков был в диапазоне 4000–5000 рез. ед. (резонансных единиц, от англ. resonance units, RU) или в среднем 4.5 нг белка на 1 мм2 поверхности чипа.
Протокол “прямой” и “инвертированной” регистрации ББВ на CM5-чипе. Протокол “прямой” регистрации был использован для детекции комплексообразования иммобилизованного на чипе белка CYP11А1 (лиганд); редокс-партнеры вводили в измерительную ячейку биосенсора в виде раствора (аналит). При “инвертированной” регистрации ББВ в качестве лиганда использовали редокс-партнеры, а в качестве аналита – CYP11A1.
Регистрация взаимодействия аналита в разных концентрациях с иммобилизованными на чипе лигандами осуществлялась путем их пропускания через контрольный (без белка) и затем через рабочий каналы оптического биосенсора в течение 5 мин при скорости потока 10 мкл/мин. По окончании инжекции аналита, в течение 10 мин регистрировали диссоциацию белкового комплекса, после чего связавшийся аналит удаляли путем двукратной инжекции раствора 2 М NaCl и 0.4% CHAPS в течение 30 с при скорости потока 30 мкл/мин. Результирующие сенсограммы (запись сигнала биосенсора во времени) представляли собой разницу между рабочим и контрольным каналом. Для определения значений кинетических констант комплексообразования (kon, koff) измерения выполняли при 25°С. Значения Kd, которые представляют собой отношение величин koff/kon, рассчитывали с помощью программы BIAevaluation software (GE Healthcare). Для вычисления термодинамических параметров (ΔG, ΔH, –TΔS), измеряли значения кинетических констант комплексообразования цитохромов Р450 с редокс-партнерами в интервале температур от 10 до 40°С с шагом 5°С, как описано ранее [1, 3].
Протокол получения липосом на основе 1,2-диолеоил-глицеро-3-фосфатидилхолина (DOPC) и 1,2-диолеоил-глицеро-3-фосфоглицерина (DOPG). В текущей работе критическим моментом является захват липосом гидрофобными углеводородными цепями (“гидрофобными якорями”) на поверхности оптического чипа с последующим их превращением в планарный липидный бислой. Для этих процессов важно, чтобы бислойная мембрана липосом была жидкой. Именно поэтому для создания экспериментальной модели бислойной мембраны были использованы препараты липидов на основе олеиновой мононенасыщенной жирной кислоты. Образцы фосфолипидов DOPC и DOPG растворяли в хлороформе до концентрации 10 и 2 мг/мл соответственно. Далее готовили смесь в молярном соотношении DOPС (80%) и DOPG (20%). После многократного пипетирования смесь переносили в круглодонную колбу и высушивали на вакуумном роторном испарителе Rotacool (Heidolph, Германия) до образования на дне колбы тонкой пленки фосфолипидов, которую диспергировали при помощи стеклянных шариков в HBS-N-буфере до конечной концентрации 2 мг/мл. Затем суспензию переносили в пробирку и дополнительно диспергировали на льду в течение 2 мин на ультразвуковом гомогенизаторе Sonoplus hd 3110 (Bandelin, Германия), мощность излучателя составляла 20% от максимальной. Полученную суспензию однослойных липосом стандартизовали по размеру путем многократной экструзии через поликарбонатный фильтр с диаметром пор 100 нм с использованием набора LipoFast-Basic (Avestin, Канада).
Протокол контроля качества суспензии липосом методом динамического светорассеяния (DLC). Полученные суспензии липосом анализировали с использованием дзета-сайзера (Malvern, Англия) при следующих условиях: температура 25°С, частота измерений 333.6 тыс/с, длительность измерения 60 с, количество повторов 18. Исходную суспензию липосом разводили калий-фосфатным буфером (pH 7.4) до конечной концентрации 100 мкг/мл. Измерения проводили в специализированной кварцевой кювете zmv 1002 (Malvern). Пик максимальной интенсивности светорассеяния соответствовал диаметру частиц 100 нм. Контроль качества суспензии липосом выполняли по графику корреляционной функции; удовлетворительным результатом измерений считался коэффициент корреляции выше 0.75. В качестве стандарта использовали 5% раствор сахарозы в воде с основным и второстепенным пиками интенсивности светорассеяния частиц с диаметром 1 и 200 нм соответственно [8].
Протокол создания липидной бислойной мембраны на поверхности чипа L1 и нековалентная иммобилизация CYP11A1 в липидной бислойной мембране. После уравновешивания поверхности чипа L1 рабочим буфером HBS-N в течение 30 мин и скорости потока 10 мкл/мин через рабочий и контрольный каналы биосенсора пропускали растворы 50 мМ NaOH и 2 М NaCl в течение 30 с со скоростью потока 30 мкл/мин. Через рабочий канал биосенсора последовательно пропускали: (1) суспензию липосом, содержащую 2 мг/мл смеси DOPC : DOPG = 80 : 20%, в течение 18 мин при скорости потока 5 мкл/мин и (2) 10 мМ NaOH в течение 30 с при скорости 30 мкл/мин. Затем для контроля гомогенности сформированного плоского липидного бислоя на поверхности оптического чипа вводили раствор бычьего сывороточного альбумина (БСА) (0.2 мг/мл в HBS-N‑буфере) в течение 5 мин при скорости потока 10 мкл/мин. Далее образец, содержащий 5 мкМ CYP11A1 в HBS-N-буфере, пропускали через рабочий канал биосенсора в течение 5 мин при скорости потока 10 мкл/мин. Для контроля уровня иммобилизации белка-лиганда пропускали растворы 10 мМ HEPES (pH 7.4), содержащие возрастающие концентрации NaCl (от 0 до 2 М). Отсутствие падения сигнала биосенсора после пропускания растворов NaCl и систематического снижения дрейфа базовой линии указывали на достаточно прочное связывание молекул CYP11A1 с бислойной липидной мембраной.
Протокол регистрации ББВ в бислойной липидной мембране на поверхности L1-чипа. Образцы, содержащие Adx в концентрациях 0.5–3 мкМ в HBS-N-буфере, последовательно пропускали через контрольный (без белка-лиганда) и рабочий (с иммобилизованным в бислойной липидной мембране CYP11A1) каналы биосенсора. Продолжительность введения образцов Adx составляла 5 мин при скорости потока 10 мкл/мин. Сенсограммы взаимодействия CYP11A1−Adx представляли собой разницу сигналов рабочего канала (с CYP11A1) и контрольного (без белка). После окончания введения раствора аналита и регистрации диссоциации комплексов CYP−Adx, липиды и белки удаляли с поверхности L1 чипа трехкратной промывкой раствором, содержащим 2 М NaCl и 0.5% CHAPS, в течение 30 с при скорости потока 30 мкл/мин, и однократной промывкой 50 мМ NaOH (30 с, 30 мкл/мин).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Дизайн схемы биосенсорных экспериментов выбирается в зависимости от задач по определению параметров комплексообразования цитохромов Р450 с редокс-партнерами. Можно отметить три наиболее часто встречающиеся задачи.
1) Определение кинетических констант и равновесной константы диссоциации белкового комплекса при стандартных условиях (температура 25°С). В данном случае предпочтительно фосфолипидное микроокружение, созданное на поверхности оптического чипа L1, с учетом структурных особенностей рекомбинантных белков. Пример данного применения будет описан ниже.
2) Определение термодинамических параметров комплексообразования в широком температурном диапазоне 10–40°С на чипах СМ-типа с покрытием из карбоксилированного декстрана без создания липидного микроокружения. В данном варианте исключается систематическая ошибка эффекта температурного фактора на физико-химические и реологические свойства фосфолипидов, и как следствие, влияние на ББВ. Такой подход использовался в работах [1, 3], где были охарактеризованы ББВ с участием CYP11A1 и его редокс-партнеров (CYB5A, CYB5B, CPR, Adx). Недостатком неориентированной иммобилизации белков на оптических чипах типа СМ является снижение чувствительности детекции молекулярных взаимодействий [9]. В данной работе мы исследовали влияние температурного фактора на кинетические параметры комплексообразования CYP11A1 с редокс-партнерами (табл. 1). Интересно отметить, что для комплексов CYP11A1−Adx и CYP11A1−CYB5B наблюдались разнонаправленные изменения кинетических параметров взаимодействия под влиянием температурного фактора. Значения Kd комплекса CYP11A1−Adx монотонно возрастают с повышением температуры, тогда как для комплекса CYP11A1−CYB5B наблюдалась обратная зависимость.
Таблица 1.
Влияние температурного фактора на кинетические параметры комплексообразования CYP11A1−Adx и CYP11A1−CYB5B в водном микроокружении
| T, °C | kon, М–1 с–1 | koff, с–1 | Kd, нМ | kon, М–1 с–1 | koff, с–1 | Kd, нМ |
|---|---|---|---|---|---|---|
| CYP11A1−Adx | CYP11A1/CYB5B | |||||
| 10 | (1.5 ± 0.2) × 105 | (1.1 ± 0.1) × 10–3 | 8 | н/о | н/о | н/о |
| 15 | (1.2 ± 0.2) × 105 | (1.4 ± 0.1) × 10–3 | 12 | н/о | н/о | н/о |
| 20 | (8.3 ± 0.7) × 104 | (1.5 ± 0.1) × 10–3 | 18 | (4.4 ± 0.3) × 103 | (2.8 ± 0.2) × 10–3 | 638 |
| 25 | (6.5 ± 0.3) × 104 | (1.6 ± 0.1) × 10–3 | 23 | (3.1 ± 0.2) × 103 | (1.5 ± 0.1) × 10–3 | 500 |
| 30 | (7.3 ± 0.3) × 104 | (2.2 ± 0.2) × 10–3 | 30 | (6.1 ± 0.3) × 103 | (1.0 ± 0.1) × 10–3 | 163 |
| 35 | (6.9 ± 0.3) × 104 | (2.7 ± 0.2) × 10–3 | 39 | (1.1 ± 0.1) × 104 | (8.0 ± 0.5) × 10–4 | 69 |
| 40 | (7.3 ± 0.3) × 104 | (3.6 ± 0.2) × 10–3 | 49 | (2.3 ± 0.1) × 104 | (6.8 ± 0.3) × 10–4 | 30 |
3) Оценка влияния низкомолекулярных соединений на кинетические и термодинамические параметры взаимодействия цитохромов Р450 с редокс-партнерами.
Малые молекулы (низкомолекулярные соединения, пептиды, фрагменты антител) способны влиять на кинетику белок-белковых взаимодействий, а следовательно, изменять аффинность комплекса. Среди низкомолекулярных соединений, с молекулярной массой ≤1 кДа, интерес представляют субстраты, продукты и ингибиторы цитохромов Р450. Их модулирующее действие на образование комплексов цитохромов Р450 с редокс-партнерами можно оценить методом SPR, учитывая следующие факторы:
а) растворимость в водных растворах и органических растворителях (спирты, диметилсульфоксид (ДМСО), диметилформамид (ДМФ));
б) стабильность белкового комплекса в присутствии органических растворителей;
в) выбор нескольких тестовых концентраций соединения (диапазон молярного соотношения белок-аналит/соединение). Максимальная концентрация соединения должна быть равной или превышать значение константы Михаэлиса (при наличии данных), но в то же время не вызывать преципитацию соединения в анализируемом образце;
г) способность соединений связываться с иммобилизованным на чипе белком- лигандом и его белком-партнером (аналитом);
д) оптимальная ионная сила и состав рабочего буфера: наличие детергентов, восстанавливающих агентов (дитиотреитол), а также хелатирующих агентов (например, EDTA);
е) время инкубации белка-аналита с соединением.
Ранее нами было показано [10], что в присутствии стероидных субстратов скорость образования комплекса стероидогенного микросомального цитохрома Р450 17А1 (CYP17A1) с цитохромом b5 (CYB5A) увеличивается, чего не наблюдалось в случае CPR и Adx. В данных экспериментах CYB5A был ковалентно иммобилизован за аминогруппы на СМ5-чипе, а раствор CYP17A1 вводили в качестве аналита в отсутствии (контроль) или в присутствии стероидных субстратов. В данной системе добавление фосфолипидного окружения неизбежно приводило бы к артефактам измерений из-за совокупного вклада факторов, таких как сродство стероидных субстратов к бислойной липидной мембране, влияние липидного состава бислоя на связывание субстрата с цитохромом Р450, а также подвижность мембранотропных субстратов в бислое [11, 12].
Для определения кинетических констант и равновесной константы диссоциации белкового комплекса с помощью SPR-биосенсора нами были разработаны методы оценки комплексообразования CYP11A1−Adx и CYP11A1−CYB5B в системе водного и фосфолипидного микроокружения. Схема иммобилизации препаратов рекомбинантных белков на оптическом чипе СМ5 и на чипе L1 приведена на рис. 1. Четырехканальный биосенcор Biacore позволяет регистрировать максимум три целевых взаимодействия, так как один канал используется в качестве контроля (коррекция на неспецифическую сорбцию веществ на поверхности чипа). В качестве контрольного белка для оценки специфичности связывания изучаемых белков, а также для “закрытия” возможных оставшихся гидрофобных участков на L1-чипе, не занятых липидным бислоем, использовали БСА. Сигналы связывания БСА с подложкой чипа составляли не более 5% от уровня равновесных сигналов после формирования липидного бислоя, что свидетельствует о достаточно однородном распределении последнего на чипе L1. Также было отмечено отсутствие взаимодействия Adx, CYB5B и CYP11A1 c иммобилизованным БСА на чипе СМ5. Сравнительный анализ кинетических и равновесных параметров комплексообразования с участием CYP11A1 приведен в табл. 2. Так, взаимодействие между ковалентно иммобилизованным CYP11A1 на чипе СМ5 и Adx (аналит) не регистрировалось даже при высоких концентрациях Adx. Использование инвертированной пары лиганд-аналит позволило зарегистрировать высокоаффинное комплексообразование CYP11A1−Adx с Kd порядка 10–9–10–8 М [1], что согласуется с ранее опубликованными данными других авторов [13]. В первом случае имеет место либо нарушение пространственной структуры контактной области белка-лиганда, либо химическая модификация аминокислотных остатков СYP11A1, принимающих участие во взаимодействии с Adx. Следует отметить, что дизайн схемы иммобилизации целевых и контрольных белков обусловлен структурными особенностями различных изоформ цитохромов Р450 и их редокс-партнеров. Слабокислая среда (рН 5.0) буфера для иммобилизации практически не влияет на спектральные свойства CYP8A1, который был иммобилизован на чипе без потери гемового кофактора [4] в виде мономерной формы, что следовало из отсутствия ступенчатого падения сигнала биосенсора при пропускании растворов ионных детергентов. Демонстрация возможности комплексообразования CYP11A1 с иммобилизованным за аминогруппы цитохромом b5 (CYB5B) показана на рис. 2, при этом CYB5B, так же как и CYP8A1, не переходил в апоформу при воздействии pH.
Рис. 1.
Схема иммобилизации белков в разных каналах биосенсора на чипах СМ5 и L1. На чипе СМ5 канал 1 был использован в качестве контрольного канала (без иммобилизации белка) для коррекции неспецифического связывания CYP11A1 с поверхностью чипа. В каналах 2, 3, 4 были ковалентно иммобилизованы бычий сывороточный альбумин (BSA) (дополнительный контроль), Adx и CYB5B соответственно. На чипе L1 каналы 1 и 3 были контрольными (липидный бислой, без белка), канал 2 – контроль связывания с BSA, канал 4 – иммобилизованный в липидном бислое CYP11A1.
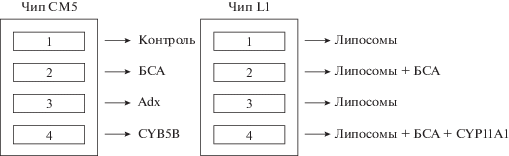
Таблица 2.
Сравнительный анализ параметров комплексообразования CYP11A1 с его редокс-партнерами в зависимости от вариантов SPR-анализа
| Белковые партнеры по взаимодействию | Кинетические параметры | Равновесные параметры | ||
|---|---|---|---|---|
| лиганд | аналит | kon, М–1 с–1 | koff, с–1 | Kd, нM |
| Водное микроокружение (ковалентная иммобилизация лиганда за аминогруппы на оптическом чипе СМ5 с поверхностью, покрытой карбоксилированным декстраном) | ||||
| Прямое взаимодействие | ||||
| СYP11A1 | Adx | Нет | Нет | Нет |
| СYP11A1 | СYB5B | Нет | Нет | Нет |
| Инвертированное взаимодействие | ||||
| Adx | СYP11A1 | (6.5 ± 0.5) × 104 | (1.5 ± 0.2) × 10–3 | 23 [1] |
| CYB5B | СYP11A1 | (0.30 ± 0.03) × 104 | (1.5 ± 0.2) × 10–3 | 500 [3] |
| Фосфолипидное микроокружение (нековалентная иммобилизация лиганда в липидном бислое на оптическом чипе L1) | ||||
| Прямое взаимодействие | ||||
| СYP11A1 | Adx | (1.6 ± 0.1) × 104 | (9.1 ± 0.3) × 10–3 | 570 |
| СYP11A1 | СYB5B | Ограничение детекции* | ||
| Инвертированное взаимодействие | ||||
| Adx | СYP11A1 | Невозможность иммобилизации лиганда** | ||
| CYB5B | СYP11A1 | Ограничение детекции* | ||
Примечание. Кинетические параметры представляют собой средние значения ± стандартное отклонение (SD) (n = 3). * Ограничение детекции ББВ из-за вклада неспецифического связывания СYB5B и СYP11A1, используемых в качестве аналитов, с фосфолипидным бислоем на чипе L1. ** Невозможность иммобилизации Adx в фосфолипидном бислое на чипе L1.
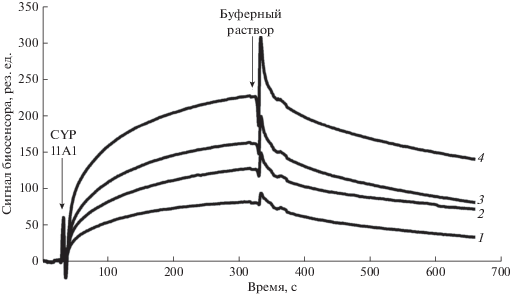
Рис. 2.
SPR-анализ взаимодействия цитохрома b5 (СYB5B), ковалентно иммобилизованного за аминогруппы на оптическом чипе СМ5, и CYP11A1. В качестве аналита использовали растворы CYP11A1 в следующих концентрациях, нМ: 250 (1), 500 (2), 1000 (3) и 2000 (4). Все измерения выполнялись при 25°С. Результирующий сигнал биосенсора представлял собой разницу между рабочим (с иммобилизованным СYB5B) и контрольным (без белка) каналами биосенсора; сигналы биосенсора представлены в резонансных единицах, 1 рез. ед. соответствует связыванию 1 пг белка на 1 мм2 поверхности чипа.
С другой стороны, Adx – водорастворимый белок, в отличие от других редокс-партнеров, таких как CYB5B (CYB5A) или CPR. Это дает возможность использовать Adx в качестве аналита для регистрации взаимодействия с CYP11A1, находящимся в фосфолипидном микроокружении, так как не наблюдается неспецифического связывания Adx c липидным бислоем, (рис. 3). Напротив, регистрация взаимодействия между СYP11A1, иммобилизованным на чипе L1 в фосфолипидном микроокружении, и его альтернативным редокс-партнером CYB5B (аналит) имела некоторые ограничения – CYB5B связывался с липидной бислойной мембраной на чипе как в контрольном канале биосенсора, так и в канале с иммобилизованным в бислой CYP11A1. Исключить фоновое связывание CYB5B с липидным бислоем можно путем использования водорастворимой транкированной по мембранному домену формы белка (с удаленным мембранным якорем), однако такие ББВ не будут отражать реальной картины.
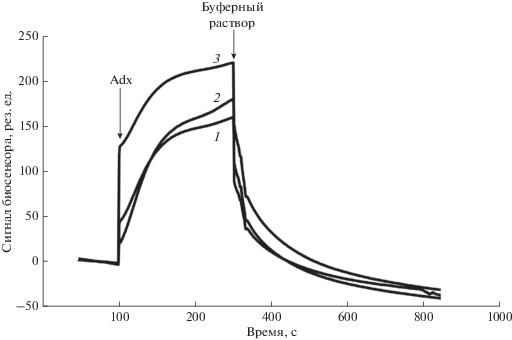
Рис. 3.
SPR-анализ взаимодействия CYP11A1, иммобилизованного в фосфолипидном микроокружении на чипе L1, и адренодоксина (Adx). В качестве аналита использовали растворы Adx в следующих концентрациях, мкМ: 0.5 (1), 1 (2) и 3 (3). Все измерения выполнялись при 25°С. Результирующий сигнал биосенсора представлял собой разницу между рабочим (с иммобилизованным CYP11A1) и контрольным (с липидным бислоем, но без белка) каналами биосенсора; сигналы биосенсора представлены в резонансных единицах, 1 рез. ед. соответствует связыванию 1 пг белка на 1 мм2 поверхности чипа.
С учетом вышеизложенного SPR-анализ термодинамических параметров и влияние низкомолекулярных соединений стероидной природы (субстраты, продукты, ингибиторы) на белок-белковые взаимодействия Adx–CYP11A1 и CYB5B–CYP11A1 предпочтительно проводить в водном микроокружения, т.е. в таких условиях, когда редокс-партнер ковалентно иммобилизован на чипе СМ-типа, а цитохром Р450 используется в качестве аналита (в растворе).
Таким образом, с помощью оптико-биосенсорного анализа было обнаружено, что взаимодействие CYP11A1 с Adx зависит от способа иммобилизации белков (при иммобилизации на чип CYP11А1 взаимодействия с Adx не было) и микроокружения (водная среда или липидный бислой). С помощью разработанного метода было зарегистрировано взаимодействие CYB5B с CYP11A1. Несмотря на различную локализацию данных белков в клетке (CYB5B расположен на внешней мембране митохондрии, CYP11A1 – на внутренней), результат представляет интерес с точки зрения потенциальной регуляции активности стероидогенного цитохрома CYP11A1 на уровне ББВ. На основании полученных данных можно сделать вывод, что при работе на оптическом SPR-биосенсоре с цитохромами Р450 предпочтительна ковалентная иммобилизация редокс-партнера (Adx, CYB5) на чипе СМ-типа. Такой способ иммобилизации подходит для первичной оценки параметров ББВ (кинетические и равновесные константы, термодинамические параметры взаимодействия), а также для оценки влияния низкомолекулярных соединений на взаимодействие CYP с редокс-партнерами. Для анализа ББВ мембранных белков в липидном микроокружении в качестве аналита предпочтительнее использовать белок-партнер, не имеющий тропности к мембране. Параметры ББВ с участием CYP, установленные в липидном и в водном микроокружении, могут отличаться, предположительно, в зависимости от способа иммобилизации белка-лиганда на оптическом чипе. Так, неодинаковая плотность доступных сайтов для связывания белка-партнера вследствие экранирования декстрановой поверхностью или липидным бислоем функциональных химических групп контактной поверхности, а также ограничение конформационных степеней свободы фиксированной белковой молекулы могут вносить вклад в наблюдаемую разницу значений кинетических констант.
Применение SPR-биосенсора было расширено для детекции разных комбинаций белок-белковых взаимодействий с участием мембранных гем-содержащих ферментов цитохромов Р450 и их редокс-партнеров в водном и фосфолипидном микроокружении. Разработанные нами экспериментальные протоколы могут использоваться для дифференциальной оценки кинетики, аффинности и термодинамики комплексообразования, а также для оценки эффекта субстратов и/или продуктов на параметры комплексообразования. SPR-анализ ББВ представляет собой ценный инструмент в арсенале современных подходов в исследовании данного класса ферментов (CYP-omics).
Настоящая статья не содержит каких-либо исследований с участием людей или с использованием животных в качестве объектов.
Авторы заявляют об отсутствии конфликта интересов.
Исследование взаимодействия CYP11A1−Adx в бислойной липидной мембране было выполнено при поддержке Российского фонда фундаментальных исследований (грант № 19-04-00485). Оптимизация SPR-протоколов для работы с мембранными белками P450-зависимых систем была выполнена в рамках Программы фундаментальных научных исследований государственных академий наук на 2013–2020 годы. Работа проводилась с использованием оборудования Центра коллективного пользования “Протеом человека” при ИБМХ, поддержанного субсидией Минобрнауки (№ 075-15-2019-1502 от 5 сентября 2019 года).
Список литературы
Yablokov E.O., Sushko T.A., Ershov P.V., Florin-skaya A.V., Gnedenko O.V., Shkel T.V., Grabovec I.P., Strushkevich N.V., Kaluzhskiy L.A., Usanov S.A., Gilep A.A., Ivanov A.S. 2019. A large-scale comparative analysis of affinity, thermodynamics and functional characteristics of interactions of twelve cytochrome P450 isoforms and their redox partners. Biochimie. 162, 156–166.
Strushkevich N., MacKenzie F., Cherkesova T., Grabovec I., Usanov S., Park H.-W. 2011. Structural basis for pregnenolone biosynthesis by the mitochondrial monooxygenase system. Proc. Natl. Acad. Sci. USA. 108 (25), 10139–10143.
Yablokov E., Florinskaya A., Medvedev A., Sergeev G., Strushkevich N., Luschik A., Shkel T., Haidukevich I., Gilep A., Usanov S., Ivanov A. 2017. Thermodynamics of interactions between mammalian cytochromes P450 and b5. Arch. Biochem. Biophys. 619, 10–15.
Гнеденко О.В., Яблоков Е.О., Ершов П.В., Свирид А.В., Шкель Т.В., Гайдукевич И.В., Струшкевич Н.В., Гилеп А.А., Усанов С.А., Иванов А.С. 2019. Взаимодействие простациклинсинтазы с цитохромами P450. Биомед. химия. 65 (1), 63–66.
Guryev O., Carvalho R.A., Usanov S., Gilep A., Estabrook R.W. 2003. A pathway for the metabolism of vitamin D3: Unique hydroxylated metabolites formed during catalysis with cytochrome P450scc (CYP11A1). Proc. Natl. Acad. Sci. USA. 100 (25), 14754–14759.
Slominski A.T., Li W., Kim T.-K., Semak I., Wang J., Zjawiony J.K., Tuckey R.C. 2015. Novel activities of CYP11A1 and their potential physiological significance. J. Steroid Biochem. Mol. Biol. 151, 25–37.
Сергеев Г.В., Гилеп А.А., Усанов С.А. 2014. Роль структурных доменов цитохрома b5 во взаимодействии с цитохромами. Биохимия. 79 (5), 520–531.
Kaszuba M., McKnight D., Connah M.T., McNeil-Watson F.K., Nobbmann U. 2008. Measuring sub nanometre sizes using dynamic light scattering. J. Nanopart. Res. 10 (5), 823–829.
Калужский Л.А., Ершов П.В., Курпединов К.С., Сонина Д.С., Яблоков Е.О., Шкель Т.В., Гайдукевич И.В., Сергеев Г.В., Усанов С.А., Иванов А.С. 2019. SPR анализ белок-белковых взаимодействий с участием цитохромов Р450 и цитохрома b5, встроенных в бислойную липидную мембрану. Биомед. химия. 65 (5), 374–379.
Ershov P.V., Yablokov E.O., Florinskaya A.V., Mezentsev Y.V., Kaluzhskiy L.A., Tumilovich A.M., Gilep A.A., Usanov S.A., Ivanov A.S. 2019. SPR-based study of affinity of cytochrome P450s / redox partners interactions modulated by steroidal substrates. J. Steroid Biochem. Mol. Biol. 187, 124–129.
Šrejber M., Navrátilová V., Paloncýová M., Bazgier V., Berka K., Anzenbacher P., Otyepka M. 2018. Membrane-attached mammalian cytochromes P450: An overview of the membrane’s effects on structure, drug binding, and interactions with redox partners. J. Inorgan. Biochem. 183, 117–136.
Yamada A., Shimizu N., Hikima T., Takata M., Kobayashi T., Takahashi H. 2016. Effect of Cholesterol on the Interaction of Cytochrome P450 Substrate Drug Chlorzoxazone with the Phosphatidylcholine Bilayer. Biochemistry. 55 (28), 3888–3898.
Neunzig J., Bernhardt R. 2014. Dehydroepiandrosterone sulfate (DHEAS) stimulates the first step in the biosynthesis of steroid hormones. PLOS ONE. 9 (2), e89727.
Дополнительные материалы отсутствуют.
Инструменты
Биологические мембраны: Журнал мембранной и клеточной биологии


