Биологические мембраны: Журнал мембранной и клеточной биологии, 2021, T. 38, № 1, стр. 20-43
Математическое моделирование фотосинтеза и анализ продуктивности растений
Е. М. Сухова a, В. А. Воденеев a, В. С. Сухов a, *
a Нижегородский государственный университет им. Н.И. Лобачевского
603950 Нижний Новгород, Россия
* E-mail: vssuh@mail.ru
Поступила в редакцию 20.08.2020
После доработки 13.09.2020
Принята к публикации 21.09.2020
Аннотация
Фотосинтез лежит в основе продукционного процесса растений, что делает крайне актуальным разработку методов его оценки и прогнозирования при различных условиях окружающей среды. Сложность фотосинтетических процессов и наличие многочисленных обратных связей делает значимым развитие комплексных подходов к его анализу, включая математическое моделирование. В обзоре проведен анализ математических моделей фотосинтетических процессов различного уровня (от процессов в тилакоидных мембранах – до уровня целого растения и экосистемы) и оценка потенциальных путей их применения для исследования продуктивности растений. При этом, прежде всего, были отмечены модели, описывающие функционирование фотосинтетических реакционных центров (включая первичное разделение зарядов, флуоресценцию, тепловую диссипацию и т.д.), которые широко используются для интерпретации экспериментальных данных при анализе фотосинтетических процессов у растений. Следующая группа моделей фокусируется на описании переноса электронов фотосинтетической электрон-транспортной цепью или ее участками (в частности, фотосистемой II). Такие модели могут быть использованы как для анализа экспериментальных данных, так и для прогнозирования повреждения фотосинтетического аппарата в условиях быстрых изменений условий среды (например, колебаний интенсивности освещения). Модели, учитывающие темновую стадию фотосинтеза, опираются на представление о лимитирующих для фиксации CO2 стадиях либо на детализированные описания реакций цикла Кальвина. Модели этой группы уже могут быть непосредственно использованы для описания продукционного процесса. Более комплексные модели, помимо описания фотосинтеза, могут также учитывать распределение освещения и потоки CO2 в листе и взаимодействие фотосинтеза с другими физиологическими процессами; это позволяет использовать такие модели для прогнозирования продуктивности растений в различных условиях или при модификациях фотосинтетического аппарата. В обзоре также анализируются “надорганизменные” фотосинтетические модели, которые опираются на достаточно простые описания фотосинтетических процессов и могут быть использованы для анализа продуктивности на уровне растительного покрова, естественных или искусственных экосистем. В целом, многочисленные математические модели фотосинтеза различного уровня направлены на решение широкого спектра исследовательских и практических задач. В частности, они могут быть потенциально использованы для оценки нарушений продуктивности сельскохозяйственных растений в нестабильных условиях выращивания или для ее оптимизации в стабильных условиях защищенного грунта. Перспективным направлением развития фотосинтетического моделирования является интеграция отдельных моделей различного уровня в единую среду моделирования фотосинтеза.
1. ВВЕДЕНИЕ
Фотосинтез, который лежит в основе продуктивности, является одним из ключевых процессов в жизни растений. Его исследования имеют как фундаментальное, так и прикладное значение; в частности, понимание механизмов функционирования фотосинтеза и его адаптации к действию стрессоров может стать основой для разработки методов повышения урожая сельскохозяйственных растений и снижения его потерь в неблагоприятных условиях [1–3].
В то же время фотосинтез является комплексным процессом, который включает в себя фотофизические, фотохимические и биохимические реакции, протекающие на уровне тилакоидных мембран, стромы и люмена хлоропластов; характерные времена таких реакций варьируют от пикосекунд – до секунд и более [4, 5] (рис. 1). При этом реакции с различными характерными временами могут оказывать взаимное влияние друг на друга [4–7]. Например, фотохимические реакции в электрон-транспортной цепи (ЭТЦ) тилакоидных мембран и цикл Кальвина могут оказывать взаимное влияние друг на друга через соотношение ATP/ADP и NADPH/NADP+ в строме хлоропластов [8, 9]: замедление одной группы процессов приводит к снижению скорости другой и наоборот. Взаимодействие фотосинтетических процессов еще в большей степени усложняется вследствие многочисленных регуляторных механизмов [10–12], которые могут модифицировать их протекание. В частности, растения имеют разнообразные механизмы защиты фотосинтетического аппарата, включая процессы на уровне ЭТЦ (энергозависимое нефотохимическое тушение флуоресценции, “state transition” [13–16] и фотоингибирование [17, 18], активация циклического потока вокруг фотосистемы I (ФСI) [19–21], изменение активности ферредоксин-NADP+–редуктазы [22, 23] и другое), активности ферментов цикла Кальвина [24–26], активности Н+-ATP-синтазы [27–30], поступления CO2 в строму хлоропластов [31–33], оттока сахаров в русло дальнего транспорта [34, 35] и т.д.
Рис. 1.
Общая схема уровней описания фотосинтеза и продукционного процесса, начиная от процессов в электрон-транспортной цепи (ЭТЦ) хлоропластов до листа, целого растения и экосистем. NPQ – нефотохимическое тушение флуоресценции хлорофилла, FNR – ферредоксин-NADP+–редуктаза.
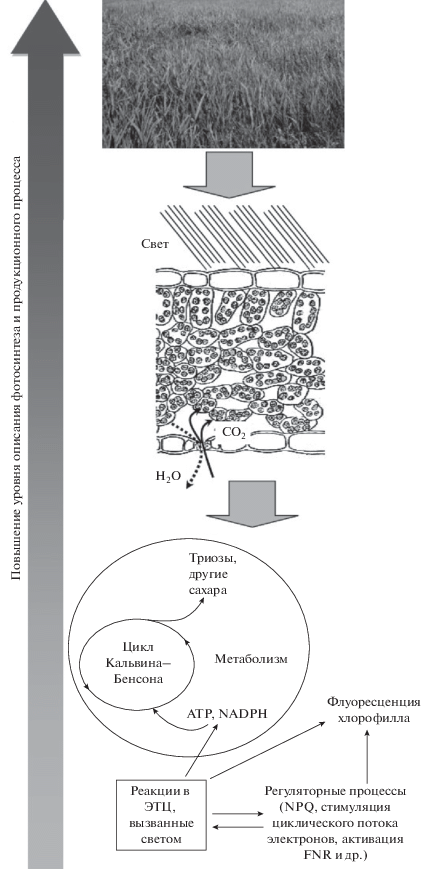
Комплексный характер фотосинтетических процессов затрудняет их экспериментальное исследование и, в частности, создает ограничения для прогнозирования фотосинтеза в различных условиях или для интерпретации экспериментальных данных, получаемых с использованием достаточно сложных систем [11, 12, 36] (например, листа растения). Одним из путей решения подобных проблем является использование метода математического моделирования, которое позволяет теоретически изучить различные аспекты процессов фотосинтеза и продуктивности растений. В настоящее время разработано значительное число фотосинтетических моделей [5, 7, 33, 37, 38], которые могут базироваться на разных принципах описания (от простых аппроксимаций [39, 40] – до детализированных описаний [41–43]), фокусироваться на различных фотосинтетических реакциях [37, 38], описывать или не описывать взаимодействие с другими процессами [31–33, 42, 44], иметь точечный [45–47] или пространственный характер [31, 33, 48, 49] и т.д.
Применение математического моделирования может иметь значение как для фундаментальных исследований в области физиологии фотосинтеза [31–33, 37, 38, 46, 47], так и для прикладных разработок в области культивирования сельскохозяйственных растений [44, 45, 50, 51]. В частности, можно отметить несколько потенциальных областей прикладного применения математических моделей фотосинтеза.
– Долгосрочный прогноз продуктивности растений при конкретных условиях выращивания, что может быть использовано для теоретической оценки урожая. Практическую реализуемость такой задачи демонстрирует, например, линейка математических моделей продукционного процесса, разработанных “школой de Wit” [50]; отдельные модели из этой группы (например, WOFOST) показали возможность достаточно эффективного использования для прогнозирования урожая сельскохозяйственных культур. Такие модели зачастую опираются на упрощенное описание фотосинтетических процессов и учитывают другие процессы, влияющие на продуктивность растений (дыхание, водный обмен, азотный обмен, процесс роста и другие) [50, 51].
– Прогнозирование ответов фотосинтеза на стрессовые воздействия, что, в частности, может быть потенциально использовано для оценки повреждения фотосинтетического аппарата при действии определенных стрессоров. Решение этой задачи базируется, прежде всего, на описании в моделях регуляторных процессов на уровне тилакоидных мембран, хлоропластов и растений в целом, которые участвуют в формировании быстрых ответов растения на действие стрессоров (например, нефотохимического тушения флуоресценции (NPQ) [38–40, 43, 52–56]). Модели этой группы могут быть использованы для предварительной оценки возможных рисков для продукционного процесса при заданных режимах действия неблагоприятных факторов (например, колебания температуры и освещенности).
– Выявление потенциальных “мишеней” для улучшения фотосинтетических процессов и повышения их устойчивости к действию стрессоров (например, методами генной инженерии или действием химических препаратов). Такие работы опираются на достаточно детализированные модели фотосинтеза; например, модель Farguhar-von Coermer-Berry [37, 45] и описание потоков углекислого газа используются при прогнозировании влияния на фотосинтез повышения проводимости мезофилла для СО2 [31–33].
– Интерпретация непосредственно измеряемых в ходе исследований и/или дистанционного мониторинга показателей фотосинтеза. К таким показателям, прежде всего, относится измерение флуоресценции хлорофилла, например PAM-флуориметрия, или измерение флуоресценции, которая индуцирована солнечным освещением [36, 57, 58].
Таким образом, математическое моделирование является важным теоретическим инструментом для исследований фотосинтеза и, в сочетании с описанием других физиологических процессов, может быть, потенциально, использовано в качестве основы для прогнозирования продукционного процесса растений; возможность этого подтверждает применение некоторых групп моделей [50] для агроэкологического зонирования или для оценки сценариев воздействия на продукционные процесс изменений условий окружающей среды. Представленный обзор посвящен анализу современных фотосинтетических моделей различного уровня, включая оценку перспектив их использования для анализа продуктивности растений.
2. КРАТКОЕ ОПИСАНИЕ ФОТОСИНТЕТИЧЕСКИХ ПРОЦЕССОВ У ВЫСШИХ РАСТЕНИЙ
Фотосинтез, т.е. процесс фиксации СО2 и синтеза углеводов с использованием световой энергии, является ключевым процессов в жизни растений [4]. Фотосинтетические реакции локализованы в хлоропластах и могут быть разделены на световую и темновую стадию (рис. 2).
Рис. 2.
Упрощенная схема фотосинтетических процессов у высшего растения (на примере С3 фотосинтеза). Ru5P – рибулозо-5-фосфат, RuBP - рибулозо-1,5-бисфосфат, 3-PGA - 3-фосфоглицерат, 1,3-PGA – бисфосфоглицерат, triose-P – триозофосфаты, ФСI и ФСII – фотосистемы I и II, LHCI и LHCII – светособирующие комплексы фотосистемы I и II, Cyt b6/f – комплекс цитохромов b6/f, H+-ATP-synth – H+-ATP-синтаза тилакоидной мембраны, OEC – кислородвыделяющий комплекс, Tyr – тирозин (первичный донор фотосистемы II), P680 – реакционный центр фотосистемы II, Pheo – феофитин (первичный акцептор фотосистемы I), QA и QB – хиноны А и В, pQ и pQH2 – пластохинон и пластохинон из пула пластохинонов, FQR – ферредоксин-хинон–редуктаза, Cyt f и Cyt b6 – цитохромы f и b6, Q – хинон в составе комплекса цитохромов b6/f, PC – пластоцианин, Fd – ферредоксин, P700 – реакционный центр фотосистемы I, A0 – хлорофилл (первичный акцептор фотосистемы I), A1 – филлохинон, FX и FA/FB – железосерные кластеры, FNR – ферредоксин-NADP+–редуктаза. При подготовке схемы использованы работы [4, 7, 10, 25, 37].
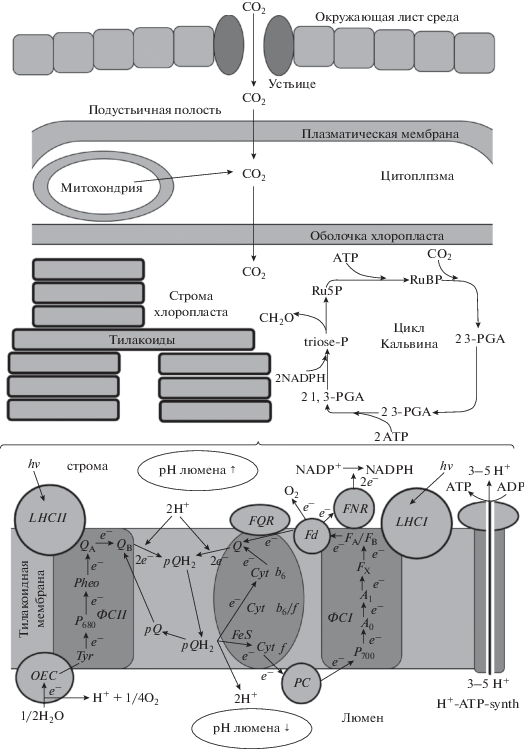
Реакции световой стадии фотосинтеза протекают в специализированных мембранных структурах – тилакоидах [4, 7], которые входят в состав хлоропластов и представляют собой замкнутые мембранные пузырьки, либо объединенные в граны, либо расположенные отдельно друг от друга. При этом протекание световой стадии фотосинтеза требует участия как локализованных в тилакоидных мембранных мультиферментных комплексов (фотосистемы I и II, комплекс цитохромов b6/f, светособирающие комплексы и кислородвыделяющий комплекс), так и ряда подвижных переносчиков (пул пластохинонов, пластоцианин, ферредоксин). Следует отметить, что пространственная организация фотосинтетических мембран в виде тилакоидов позволяет значительно увеличить общую площадь таких мембран на единицу объема (т.е. ускорить протекание локализованных в пределах мембраны реакций световой стадии фотосинтеза).
Процессы световой стадии фотосинтеза подробно описаны в ряде обзорных работ [4, 7, 10]. Начальным этапом таких реакций является поглощение кванта света светособирающим комплексом и миграция энергии возбуждения к реакционному центру (РЦ) фотосистемы I или фотосистемы II, которые представляют собой молекулы хлорофилла; в дальнейшем энергия возбужденного состояния используется для разделения зарядов в РЦ. В случае фотосистемы II происходит переход электрона от РЦ P680 (хлорофилл) к первичному акцептору электронов – феофитину, с феофитина электрон переносится на хинон QA, а с хинона QA – на хинон QВ; возникающий при этом положительный заряд P680 компенсируется электроном с первичного донора электронов (тирозин), восстановление тирозина происходит за счет поступления электронов с молекул воды, которые последовательно окисляются кислородвыделяющим комплексом с образованием молекулярного кислорода и протонов. После получения двух электронов QA протонируется двумя протонами из стромы хлоропластов, превращаясь в пластохинол, и уходит в пул пластохинолов; после чего с фотосистемой II связывается окисленный пластохинон из пула. Пластохинол диффундирует к комплексу цитохромов b6/f и окисляется; протоны уходят в люмен тилакоида. При этом один из электронов переносится на пластоцианин, а другой восстанавливает хинон в составе цитохромного комплекса; при восстановлении хинона двумя электронами он также поглощает два H+ из стромы и уходит в пул пластохинонов, формируя дополнительный цикл переноса протонов. Восстановленный пластоцианин выступает в качестве донора электронов для фотосистемы I и восстанавливает ее РЦ P700, который предварительно окисляется, отдавая электроны в цепь в ходе разделения зарядов после получения энергии кванта света. Электроны с P700 проходят через ряд компонент фотосистемы I и восстанавливают ферредоксин. Окисление ферредоксина может происходить различными путями [7, 10, 21]: с восстановлением NADPH из NADP+ (нециклический поток электронов), с восстановлением пластохинона, которое, вероятно, происходит в составе комплекса цитохромов b6/f (циклический поток электронов вокруг фотосистемы I), а также с восстановлением кислорода и образованием его активных форм (псевдоциклический поток электронов). Важно отметить, что при протекании реакций световой стадии фотосинтеза наиболее длительные характерные времена имеют процессы, связанные с транспортом подвижных переносчиков; в частности, одним из таких “медленных” процессов является окисление пластохинола при взаимодействии с комплексом цитохромов b6/f, которое может рассматриваться как “узкое место” при транспорте электронов в тилакоидной мембране хлоропластов.
Фотосинтетический поток электронов в тилакоидных мембранах хлоропластов сопровождается не только образованием NADPH, но и переносом протонов через мембрану, что приводит формированию значительного транстилакоидного электрохимического градиента протонов [4, 7]. Его энергия используется для синтеза АТP при участии H+-ATP-синтазы тилакоидной мембраны, которая синтезирует одну молекулу АТP при переносе от 3 [10] до 4–5 [4] протонов через мембрану. Важно отметить, что формирование такого градиента зависит от целостности тилакоидных мембран и нарушение замкнутости тилакоидов может снижать и даже полностью подавлять формирование электрохимического градиента протонов, а значит – нарушать фотосинтетические процессы.
Образующиеся в ходе функционирования световой стадии фотосинтеза в строме хлоропластов NADPH и АТP используются в качестве основного источника энергии для протекания реакций темновой стадии фотосинтеза (цикл Кальвина) (рис. 2), в ходе которой с участием фермента РУБИСКО осуществляется фиксация углекислого газа [4, 25]; поступление CO2 из внешней среды осуществляется через устьица и тесно связано с процессом транспирации листа; вклад в транспорт СО2 может также вносить проводимость плазматической мембраны и оболочек хлоропласта для углекислого газа. Среди основных интермедиатов цикла Кальвина можно отметить рибулозо-5-фосфат, рибулозо-1,5-бисфосфат, 3-фосфоглицерат, бисфосфоглицерат и др. [37]; основным продуктом этого цикла являются углеводы [4], которые затем могут транспортироваться в другие части растения [35]. При этом РУБИСКО может также функционировать как оксигеназа и тем самым участвовать в поддержании фотодыхания [37, 45]. Следует также отметить, что помимо C3 фотосинтеза, который преимущественно базируется на цикле Кальвина, у растений могут существовать и другие формы темновой стадии фотосинтеза (C4 и CAM типы фотосинтеза) [4]. Функционирование таких путей требует дополнительного транспорта фотосинтетических метаболитов между хлоропластом и вакуолью (CAM) или между клетками мезофилла и обкладки проводящих пучков (C4), что позволяет оптимизировать процесс фиксации CO2. В случае темновой стадии фотосинтеза, в качестве “узкого места” процесса может, прежде всего, рассматриваться непосредственно фиксация углекислого газа РУБИСКО [37, 45]; однако лимитирующим процессом может также быть поступление углекислого газа в строму хлоропластов.
3. МАТЕМАТИЧЕСКИЕ МОДЕЛИ, ОПИСЫВАЮЩИЕ ФОТОСИНТЕТИЧЕСКИЕ ПРОЦЕССЫ НА УРОВНЕ РЕАКЦИОННЫХ ЦЕНТРОВ
При математическом моделировании фотосинтетических процессов на уровне РЦ может быть реализовано два подхода. Первый из них фокусируется на детализированном описании поглощения света, миграции энергии возбуждения и разделения зарядов [59, 60]; для этого, в частности, может быть использовано описание индуктивно-резонансного механизма переноса энергии (переноса энергии вследствие резонанса Фёрстера), которое основано на диполь-дипольном взаимодействии при переносе возбуждения между двумя хромофорами. Такой подход преимущественно направлен на выявление фундаментальных механизмов поглощения света фотосинтетическим аппаратом; перспективы его использования для решения проблем, связанных с продуктивностью растений, достаточно ограничены.
Другой подход опирается на описание конкурирующих путей утилизации энергии возбужденного состояния РЦ фотосистемы II (ФСII) ([11, 57, 58, 61–67]. При этом такая энергия может быть потрачена на флуоресценцию, нерегулируемую тепловую диссипацию, а также на разделение зарядов, которое является необходимым шагом для дальнейшего протекания реакций световой стадии фотосинтеза [4, 7]. Кроме того, в случае предварительного освещения растения у него может развиваться контролируемая диссипация энергии возбужденных состояний в РЦ ФСII (нефотохимическое тушение флуоресценции) [10, 16]. В настоящее время такую диссипацию связывают с тремя основными механизмами: (i) энергозависимое тушение флуоресценции, которое обусловлено закислением люмена в условиях освещения с высокой интенсивностью; такое закисление приводит к протонированию белков светособирающего комплекса и способствует превращению виолоксантина в зеаксантин, что, в свою очередь, повышает потери поглощаемой энергии света; (ii) “State transition”, т.е. перемещение светособирающего комплекса от фотосистемы II к фотосистеме I в условиях стрессовой интенсивности освещения; (iii) фотоповреждение фотосинтетического аппарата в условиях избыточной интенсивности освещения или других стрессовых факторов.
В некоторых моделях этой группы используется детализированное описание переходных процессов между состояниями РЦ ФСII [67]; однако важным преимуществом большинства моделей является применение относительно простых уравнений [62, 63], использующих величины констант скорости конкурирующих процессов для расчета вероятности их протекания. В качестве примера применения такого подхода можно привести стандартное уравнение для расчета квантового выхода фотохимических реакций ФСII (γPSII):
(1)
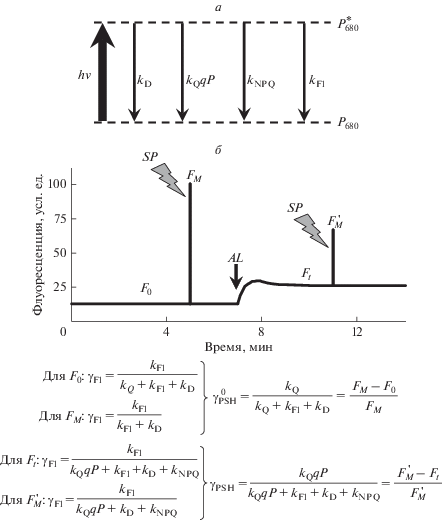
${{\gamma }_{{{\text{PSII}}}}} = \frac{{{{k}_{{\text{Q}}}}qP}}{{{{k}_{{\text{Q}}}}qP + {{k}_{{{\text{Fl}}}}} + {{k}_{{\text{D}}}} + {{k}_{{{\text{NPQ}}}}}}},$Важной особенностью фотосинтетических моделей, опирающихся на описание конкуренции различных путей утилизации энергии возбуждения в РЦ, является их широкое использование для интерпретации результатов измерения флуоресценции хлорофилла (рис. 3а). Следует отметить, что методы, базирующиеся на измерении флуоресценции и последующем анализе результатов с использованием фотосинтетических моделей, являются быстрыми, неинвазивными и информативными подходами к оценке фотосинтетических процессов у растений [11, 57, 58, 62]. Рисунок 3б показывает динамику изменений флуоресценции листа при применении метода РАМ-флуориметрии, который опирается на использование периодических импульсов света высокой интенсивности (насыщающие вспышки). При этом для каждого из приведенных параметров (F0 – интенсивность флуоресценции у адаптированного к темноте растения, FM – максимальный уровень флуоресценции, измеряемый при первой насыщающей вспышке после адаптации к темноте, Ft – текущий уровень флуоресценции при освещении растения актиничным светом, $F_{M}^{{\text{'}}}$ – максимальный уровень флуоресценции у адаптированных к свету растений при насыщающей вспышке) показаны уравнения для расчета квантового выхода флуоресценции (уравнения слева). Комбинация таких уравнений позволяет рассчитать характеристики фотосистемы II (в частности, потенциальный и эффективный квантовый выход фотохимических реакций фотосистемы II) как функцию измеряемых показателей (F0, FM, Ft и $F_{M}^{{\text{'}}}$) (уравнения справа). Аналогичный подход можно использовать для оценки методом РАМ-флуориметрии других показателей ФСII (NPQ, qP и другие) [57, 58].
Рис. 3.
Схема конкурентной модели утилизации энергии возбужденного состояния (а) и пример применения такой модели к оценке показателей фотосинтеза при использовании РАМ-флуориметрии (б). P680 и ${\text{P}}_{{680}}^{*}$ – основное и возбужденное состояние РЦ ФСI. kQ, kFl, kD и kNPQ – константы скорости разделения зарядов, флуоресценции, тепловой диссипации и NPQ, соответственно, qP – это доля РЦ ФСII в “открытом состоянии” (т.е. доля РЦ у которых отсутствует электрон на хиноне QA), γFl – квантовый выход флуоресценции для каждого из вариантов измерения, $\gamma _{{{\text{PSII}}}}^{0}$ и γPSII – потенциальный и эффективный квантовый выход фотохимических реакций у ФСII, SP – насыщающие вспышки, AL – актиничный свет (стрелка обозначает момент его включения), F0 – интенсивность флуоресценции у адаптированного к темноте растения, FM – максимальный уровень флуоресценции (первая насыщающая вспышка), Ft – текущий уровень флуоресценции при освещении растения актиничным светом, $F_{M}^{{\text{'}}}$ – максимальный уровень флуоресценции (насыщающая вспышка) у адаптированных к свету растений.
Близкий подход может быть также развит для описания квантовых выходов конкурирующих процессов в реакционном центре ФСI [68, 69]. К таким процессам будет относиться (i) использование энергии поглощенного света для разделения зарядов и транспорта электронов по ЭТЦ, (ii) потеря энергии поглощенного света из-за окисленного состояния P700 (${\text{P}}_{{700}}^{ + }$) и (iii) потеря энергии поглощенного света из-за восстановленного состояния акцепторной части PSI. При этом в качестве анализируемого показателя ФСI используется поглощение света на длине волны 830, так как окисление РЦ ФСI P700 приводит к изменению абсорбции света в этой спектральной полосе.
При анализе временны́х диапазонов, равных минутам, десяткам минут, часам и более, достаточно часто принимается допущение о том, что потоки электронов через фотосистемы I и II имеют стационарный характер [19, 20, 57, 70, 71], т.е. равны на различных участках ЭТЦ. В этом случае можно принять, что поток электронов через ФСII приблизительно равен нециклическому потоку электронов (LEF), а поток электронов через ФСI приблизительно равен сумме циклического потока электронов вокруг фотосистемы I (CEF) и нециклического потока (т.е. CEF + LEF) [19, 20, 57, 70]. Принимая эти допущения, для описания LEF и CEF могут быть использованы уравнения (2) и (3) соответственно:
(3)
${\text{CEF}} = {\text{PAR}}\beta \left[ {\left( {1 - {\text{dII}}} \right){{\gamma }_{{{\text{PSI}}}}} - {\text{dII}}{{\gamma }_{{{\text{PSII}}}}}} \right],$В целом, математические модели, описывающие фотосинтетические процессы на уровне реакционных центров, используются, прежде всего, для анализа результатов измерений флуоресценции ФСII и поглощения света фотосистемой I, полученных с применением РАМ-метода [11, 19, 20, 57, 58, 62, 70]. Такая область применения делает развитие этой группы математических моделей очень значимой для решения прикладных задач в рамках дистанционного мониторинга продуктивности и стрессовых изменений у растений на основании измерений их флуоресценции [57].
4. МАТЕМАТИЧЕСКИЕ МОДЕЛИ, ФОКУСИРУЮЩИЕСЯ НА ОПИСАНИИ ПОТОКА ЭЛЕКТРОНОВ В ЭТЦ ИЛИ ЕЕ КОМПОНЕНТАХ
Следующая группа математических моделей [7, 46, 54, 72–91] фокусируется на описании функционирования ЭТЦ хлоропластов (или крупных участков электрон-транспортной цепи, таких как ФСI и ФСII) и сопутствующих регуляторных процессов. В общем случае такие модели опираются на Z-схему, которая описывает перенос электрона по цепи переносчиков с учетом значений их окислительно-восстановительного потенциала [7, 46, 54, 72]. Модели этой группы могут также описывать регуляцию световой стадии фотосинтеза, формирование электрохимического градиента и функционирование Н+-ATP-синтазы, транспорт ионов через тилакоидную мембрану, синтез ATP и NADPH и др. [7, 72–77].
При разработке математических моделей этой группы, для построения систем дифференциальных уравнений часто используется комбинация двух подходов (см., например, работы [42, 46, 79, 85–88]).
(i) При описании процессов переноса электронов в рамках мультиферментных комплексов (например, ФСI, ФСII или комплекс цитохромов b6/f) в качестве переменных используют вероятности различных состояний комплекса в целом (или концентрации этих состояний). Такой подход является более корректным для описания переноса электронов между компонентами ЭТЦ, взаимное расположение которых зафиксировано, нежели закон действующих масс, который был показан для химических реакций, протекающих в растворах. Применение такого описания позволяет моделировать процессы переноса электронов в пределах фотосинтетического мультиферментного комплекса как мономолекулярные реакции, т.е. переходить к системам линейных дифференциальных уравнений первого порядка. Расчет констант скорости таких реакций опирается на стандартное описание транспорта электрона через энергетический барьер между компонентами ЭТЦ [42]; аналогичным образом могут рассчитывать константы скорости для рассеяния избыточной энергии в виде флуоресценции и тепла [42, 46, 72, 81, 88]. В то же время использование при моделировании вероятностей различных состояний фотосинтетического мультиферментного комплекса значительно увеличивает число переменных при моделировании; так, в работе [86] для описания только ФСII было использовано около 30 переменных.
(ii) При описании взаимодействия мультиферментных комплексов с подвижными переносчиками (компоненты пула пластохинонов, пластоцианин и ферредоксин) используется классический закон действующих масс, в соответствии с которым скорость реакции пропорциональна произведению концентраций реагентов. В этом случае для подвижных переносчиков в качестве переменных используют их концентрации.
Вследствие значительного числа используемых переменных подробное описание ЭТЦ имеет достаточно сложный характер, поэтому при разработке математических моделей широко используются упрощения. В частности, можно отметить:
(i) использование стационарных решений для быстрых процессов, т.е. для процессов, характерные времена которых значительно меньше, нежели временны́е интервалы, анализируемые с использованием разрабатываемой модели. Так, в некоторых работах [42, 43, 78] стационарные решения были использованы при описании распределения состояний в мультиферментных фотосинтетических комплексах, в то же время для более медленных процессов взаимодействия с подвижными переносчиками (пластохиноны, пластоцианин, ферредоксин) стационарные решения не использовались.
(ii) Обобщенное описание переменных, позволяющее представить фотосинтетические процессы максимально упрощенно [6, 56, 79, 80]. Примером такого подхода может служить модель [56], в которой вся совокупность состояний ФСII была описана с помощью двух переменных, соответствующих “открытому” и “закрытому” РЦ. При этом в условиях колебаний интенсивности освещения между экспериментальными и имитированными моделью фотосинтетическими показателями наблюдалось хорошее соответствие. Среди других примеров использования упрощенных описаний при моделировании процессов световой стадии фотосинтеза можно отметить работу [79], в которой ФСII была описана тремя переменными, или работу [49], в которой учитывалась только исходное и окисленное состояние ФСII.
(iii) Использование регрессионных функций, которые описывают определенные фотосинтетические процессы, однако не учитывают возможные механизмы протекания процессов. В качестве примеров такого подхода можно отметить применение экспоненциального описания для моделирования динамики изменения во времени электрического [81] или электрохимического [82] градиента на тилакоидной мембране. Несмотря на то, что такое описание не отражает конкретные механизмы изменения градиента, оно может быть использовано для упрощения модели.
Отдельной проблемой при моделировании фотохимических процессов фотосинтеза является описание их регуляции при изменении окружающих условий и, в частности, при действии неблагоприятных факторов. При этом важную роль играет NPQ, которое является важным ключевым механизмом фотосинтетического аппарата, позволяющим регулировать поглощение световой энергии реакционным центрами ФСII. Как уже отмечалось, NPQ включает в себя, прежде всего, энергозависимую компоненту тушения (индуцируется закислением люмена хлоропластов), state-transition (обусловлено изменениями фосфорилирования светособирающего комплекса и его перемещением между фотосистемами) и фотоингибирование. Механизм формирования энергозависимого компонента NPQ, обусловленного взаимодействием PsbS белков и ксантофиллов со светособирающими комплексами, детально моделируется в ряде работ [38, 43, 52, 54, 55]; при этом описывается взаимодействие протонированных/непротонированных PsbS с ксантофиллами.
Другой подход к моделированию развития NPQ опирается на описание связи тушения с уровнем восстановления ЭТЦ. Высокая активность ЭТЦ сопровождается как закислением люмена, так и увеличением доли пластохинолов в пуле (для интактных и не подверженных действию разобщителей тилакоидных мембран); такая особенность позволяет описать развитие энергозависимого компонента NPQ как функцию заполнения пула пластохинонов, что и было реализовано в ряде моделей [41, 43, 78, 89]. Аналогичный подход также был использован для описания state-transition: заполнение пула пластохинонов определяло активность киназы светособирающего комплекса и его фосфорилирование [43, 78].
Среди других регуляторных процессов, описанных в современных фотосинтетических моделях, можно отметить активацию ферредоксин-NADP+–редуктазы в условиях освещения [43, 72, 87], отток электронов от пластохинолов посредством терминальной оксидазы PTOX [43, 54] и светоиндуцированную активацию циклического потока [43, 82, 90]. Также активность ЭТЦ в моделях может зависеть от количества быстрых и медленных PQ на один реакционный центр [46] и кинетических свойств пластохинонов [88, 91]. Еще одна группа моделей [42, 81, 86, 87] учитывает также динамику электрического и химического градиентов протонов на тилакоидной мембране, описанную на основе трансмембранного транспорта электронов и ионов.
В качестве отдельной группы можно выделить модели, которые изучают пространственное движение компонент ЭТЦ. Эти модели описывают броуновское движение исследуемых молекул, их электростатические взаимодействия и перенос электронов между такими молекулами [92–97]. В частности, такая модель позволяет прогнозировать влияние ионной силы раствора на константу скорости реакции переноса электронов [93, 96, 97]. Альтернативная модель пространственного движения молекул ЭТЦ и протонов может базироваться на уравнении диффузии и описании геометрии тилакоидов [49].
В целом, модели, описывающие световую стадию фотосинтеза растений, не содержат в явном виде описания фиксации углекислого газа. Однако они могут быть использованы для прогнозирования ответов фотосинтетического аппарата на действие ряда неблагоприятных факторов (в частности, быстрых колебаний интенсивности освещения [56, 83] или гербицидов [46]). Таким образом, модели этой группы позволяют прогнозировать уровень стрессовых изменений фотосинтетического аппарата, которые потенциально могут стать причиной снижения продуктивности. Кроме того, значительная часть моделей световой стадии фотосинтеза может описывать флуоресцентные процессы, включая процесс индукции флуоресценции в условиях освещения [46, 47, 82, 85, 86, 88]. Учитывая существенную роль анализа флуоресценции хлорофилла в исследовании растений [12, 57, 98], это открывает перспективы для использования данной группы моделей при решении прикладных задач в рамках мониторинга состояния растений.
5. МАТЕМАТИЧЕСКИЕ МОДЕЛИ, ФОКУСИРУЮЩИЕСЯ НА ОПИСАНИИ ФОТОСИНТЕТИЧЕСКОЙ АССИМИЛЯЦИИ CO2
Фотосинтетическая ассимиляция CO2, связанная с функционированием цикла Кальвина, лежит в основе продуктивности растений. Вследствие этого возникает потребность в разработке математических моделей, фокусирующихся на описании ассимиляции углекислого газа. Известно, что цикл Кальвина нуждается в ATP и NADPH, синтезируемых в результате работы ЭТЦ, а для поддержания функционирования ЭТЦ необходимо потребление таких соединений [4, 37, 42]. Это означает, что модели, фокусирующиеся на описании фотосинтетической ассимиляции CO2, должны также включать в себя описание функционирования ЭТЦ в тилакоидных мембранах (возможно, в минимальном варианте) и его взаимодействия с реакциями цикла Кальвина.
Многообразие промежуточных продуктов цикла Кальвина, необходимость притока CO2 и фотосинтетической продукции ATP и NADPH для его функционирования, существование различных путей оттока углеводов из цикла (например, триоз и фруктозы-6-фосфата), а также наличие механизмов, регулирующих активность ферментов темновой стадии фотосинтеза, делает актуальным вопрос об оптимальной детализации описания при разработке математической модели фиксации углекислого газа [99].
В литературе представлены модели, описывающие фотосинтетическую ассимиляцию CO2 с различной степенью детализации. В частности, такие модели могут базироваться на описании активности РУБИСКО [45] или на более подробном описании ферментов цикла Кальвина и оттока его продуктов [100, 101], при этом модели могут быть дополнены описанием процесса синтеза сахарозы [75, 102], фотодыхания [103], потоков углекислого газа в строму хлоропластов [31, 32, 104, 105] и др. При разработке этой группы моделей для описания фотосинтетической ассимиляции CO2 может использоваться кинетика Михаэлиса–Ментен, классические уравнения химической кинетики, а также специализированные функции на основе аналитических решений и аппроксимаций (подробнее см. обзор [99]). Сравнительный анализ Arnold и Nikoloski [99] показал, что наиболее надежными для прогнозирования ассимиляции являются относительно простые модели (например, [45, 101]). Вероятно, это связано с тем, что увеличение детализации моделей ведет за собой рост неопределенности, связанный с их параметризацией, а также со сложностью описания связей между компонентами модели и регуляторными процессами.
Ярким примером относительно простой модели, которая широко используется для анализа фотосинтетической ассимиляции CO2 растениями, является модель Farquhar-von Caemmerer-Berry (FvCB) [37, 45, 106]. Модель базируется на допущении, что стационарная скорость ассимиляции углекислого газа определяется наиболее медленным из трех лимитирующих темновую стадию фотосинтеза процессов: фиксация СО2 при функционировании РУБИСКО, поток электронов в ЭТЦ тилакоидных мембран и отток триоз из стромы хлоропластов. При этом расчет потенциальной скорости функционирования РУБИСКО базируется на представлении о ее конкурентном взаимодействии с СО2 в ходе цикла Кальвина и с О2 в процессе фотодыхания [37, 45, 106]. Скорость такого взаимодействия описывается с использованием формализма Михаэлиса–Ментен, что позволяет получить соотношение активности оксигенации и карбоксилирования в условиях функционирования РУБИСКО в качестве лимитирующей стадии фотосинтеза. Потенциальная скорость фотосинтетического потока электронов через ЭТЦ в классическом варианте модели FvCB описывается как эмпирическая функция интенсивности освещения [45, 106], однако могут использоваться и модифицированные варианты описания [87]. Потенциальная скорость оттока триоз может быть описана как постоянная величина [106], при некоторых модификациях модели FvCB этот процесс не учитывается [107]. Уровень дыхания, не связанный с фотосинтетическими процессами (“темновое дыхание”), в модели FvCB описывается как постоянная величина; фотодыхание описывается на основе соотношения уровней карбоксилирования и оксигенирования при функционировании РУБИСКО [103]. Важно отметить, что в настоящее время существуют многочисленные модификации модели FvCB. В частности, существуют вариант модели с описанием альтернативных потоков электронов (циклического и псевдоциклического), на ее основе разработаны модели С4 и С2 фотосинтеза и т.д. [37, 107].
Значительным преимуществом модели FvCB является ее простота, позволяющая анализировать процессы, которые являются ключевыми для фотосинтетической ассимиляции CO2. В то же время существенным ограничением этой модели является недостаточно детальное описание взаимодействия процессов ассимиляции CO2 с реакциями в ЭТЦ [106]. В частности, классическая версия модели FvCB не позволяет описать обратное влияние изменений процесса фиксации CO2 на активность ЭТЦ. В целом, модель FvCB является эффективным инструментом для прогнозирования ассимиляции CO2 в различных условиях, а также для анализа и интерпретации данных. В частности, она позволяет анализировать состояние растений при действии стрессоров [37, 107, 108].
Другая группа моделей фотосинтетической ассимиляции CO2 делает акцент на подробное описание процессов в ЭТЦ, биохимических реакций фотосинтеза для С3 и С4 растений, взаимодействия процессов темновой и световой стадии (в частности, через концентрации ATP и NADPH), а также на моделирование регуляторных механизмов (например, активации фотосинтетических процессов тиоредоксином) [41, 42, 75, 87, 109–111]. Преимуществом моделей такого типа является возможность анализа нестационарных изменений в ходе переходных процессов [41], что позволяет анализировать фотосинтетические процессы (включая их регуляцию) и, опосредованно, продуктивность в условиях быстрых изменений условий среды. Кроме того, благодаря детализированному описанию исследуемых процессов их можно использовать как теоретический инструмент для выявления потенциальных “мишеней” для интенсификации фотосинтеза, в частности, путем метаболической инженерии и создания трансгенных растений [99, 112, 113]. В то же время сложный характер моделей этой группы затрудняет их параметризацию и повышает вероятность неустойчивого характера найденных решений при анализе моделей. Таким образом, при разработке комплексных моделей необходимо соблюдение баланса между подробным описанием процессов и надежностью параметризации и анализа модели.
6. МАТЕМАТИЧЕСКИЕ МОДЕЛИ ФОТОСИНТЕЗА, УЧИТЫВАЮЩИЕ СВЕТОВЫЕ ПОТОКИ И ТРАНСПОРТ CO2 НА УРОВНЕ КЛЕТОК, ТКАНЕЙ И ЛИСТА В ЦЕЛОМ
В предыдущих разделах были рассмотрены преимущественно “точечные” модели или модели с описанием пространственного фактора в очень ограниченном масштабе (участки тилакоидной мембраны, хлоропласты и т.д.). Однако протекание фотосинтетических процессов может характеризоваться существенной неоднородностью в большем пространственном масштабе. Она может быть связана с пространственной неоднородностью в структуре клеток и листа, разным содержанием пигментов, особенностями расположения хлоропластов, а также с различной доступностью CO2 (вследствие различного расстояния до устьиц) или света [114–116].
Одним из направлений моделирования фотосинтеза, учитывающим пространственный фактор, является описание профилей распределения света по толщине листа. Такие профили моделируются на основании описания поглощения, рассеяния и пропускания света различными слоями листа в зависимости от условий освещения (освещение с абаксиальной и/или адаксиальной стороны, разная интенсивность света и др.) и используются при моделировании профиля фотосинтетических процессов [114, 116, 117]. Модели этой группы позволяют оценить эффективность [116] и валовую скорость [114] фотосинтеза в различных слоях листа, а также оценить световые ограничения для функционирования ЭТЦ [117].
Другим направлением моделирования является описание механизмов перемещения СО2 внутри листа, которое значительно влияет на эффективность ассимиляции [105]. Важно отметить, что структура листа очень неоднородна и включает множество переходов между воздушной, водной и липидной средой [115], при этом большое количество мембран, значительная толщина клеточных стенок и плотное примыкание клеток друг к другу значительно усложняет прохождение CO2 к хлоропластам. Транспорт CO2 часто описывается на основе последовательных эквивалентных электрических цепей, проводимость мезофилла определяется как функция проводимостей клеточной стенки и мембран [31, 32], цитоплазмы и компартментов клетки [115], а также устьиц [44, 87]. Структурные особенности клеток и компартментов, отдельных слоев по глубине листа, а также воздушные полости внутри мезофилла являются дополнительными факторами, влияющими на транспорт CO2 [33, 104]. Такие модели могут также учитывать взаимопревращения СО2 и ${\text{HCO}}_{3}^{ - }$ и их перенос между цитоплазмой, хлоропластами [31–33, 116], вакуолью [118] и митохондриями [31]. Важно отметить, что большинство моделей этой группы описывает большое число клеток, каждая из которых включает упрощенное описание ассимиляции и дыхания [31, 104, 114, 116–118].
Анализ моделей этой группы показал ряд важных результатов. В частности, выявлено, что для фотосинтетических процессов существенную роль играет соотношение площади хлоропластов и мембраны клетки, а также пространственное расположение и угол поворота хлоропластов [31, 33]. Другим лимитирующим фотосинтез фактором является проводимость для CO2 у разных фаз (водной и липидной) и компартментов [32], а также потери СО2 в ходе транспорта [31]. Еще одним фактором, положительно влияющим на транспорт СО2 и фотосинтез, может выступать активность карбоангидразы [31, 33, 118], так как транспорт СО2 и ${\text{HCO}}_{3}^{ - }$ в листе может различаться [115]. Эти различия могут также лежать в основе влияния на фотосинтетические процессы разной активности протонной помпы плазматической мембраны (и связанных с этим различных значений внутри- и внеклеточного pH) [119]. Такие результаты показывают значимость для фотосинтеза отдельных компонент проводимости мезофилла для СО2 и выявляют ключевые компоненты, в частности они позволяют теоретически оценить роль транспорта СО2 через системы активного транспорта или аквапорины [31, 32, 115, 120]. Анализ моделей может быть использован при разработке механизмов улучшения фотосинтеза и продуктивности растений (например, путем создания генетически модифицированных растений, проводимость мезофилла которых для СО2 будет улучшена) [115, 120].
В целом, фотосинтетические модели, которые учитывают такие критичные для фотосинтеза факторы, как распределение интенсивности освещения и концентрации CO2 в пространстве листа, обладают значительным потенциалом для прогнозирования ассимиляции CO2 и продуктивности при различных режимах освещения, модификации концентрации углекислого газа или действии стрессоров. В частности, такие модели могут стать инструментом для теоретического поиска оптимальных условий для выращивания сельскохозяйственных растений и интенсификации их продуктивности.
7. МАТЕМАТИЧЕСКИЕ МОДЕЛИ ФОТОСИНТЕЗА, УЧИТЫВАЮЩИЕ ЕГО ВЗАИМОДЕЙСТВИЕ С ДРУГИМИ ФИЗИОЛОГИЧЕСКИМИ ПРОЦЕССАМИ
Следующим важным шагом в направлении более комплексного моделирования фотосинтеза является разработка математических моделей, учитывающих взаимодействие фотосинтеза с другими физиологическими процессами.
Учитывая, что фотосинтез является ключевым процессом в метаболизме растительной клетки, в настоящее время активно разрабатываются модели фотосинтеза, основанные на классической химической кинетике, которые описывают последующее использование фотосинтетических продуктов в синтезе широкого спектра соединений. В частности, модели описывают синтез аминокислот (например, серин и глицин) или моно- и полисахаридов (включая малат, сахарозу, крахмал и др.) [41, 42, 44, 87, 103]. Кроме того, при моделировании может описываться дальнейшее использование фотосинтетических ATP и NADPH в качестве источника энергии для других биохимических реакций [41, 42, 103]. Существуют также модели, описывающие восстановление нитритов как конкурентный процесс для синтеза крахмала, который приводит к потреблению 3-фосфоглицерата, электронов с ферредоксина и ATP [41, 87]. Модели этой группы позволяют теоретически оценить роль фотосинтеза в поддержания соотношения C/N в растительных тканях (в частности, анализировать связь снижения доступности азота для растений с уменьшением активности фотосинтеза, а также прогнозировать влияние оттока фотосинтетических продуктов на активность фотосинтеза) и продукционный процесс [41, 42, 87, 103].
Другим важным направлением “расширения” фотосинтетических моделей является описание процесса дыхания, которое наряду с фотосинтезом является одним из основных источников энергии, а при стрессовых условиях может менять свою активность [121]. В наиболее простом варианте скорость темнового дыхания может быть описана как постоянная величина [45], при этом могут также учитываться поправки на объем митохондрий и хлоропластов [31]. Существуют и более сложные модели, учитывающие большее число компонент [122, 123]. В частности, Buckley и Adams [124] разработали стационарную модель, включающую описание процессов фотосинтеза, дыхания и фотодыхания; при этом предполагается, что продукты метаболизма определяют скорость этих процессов. Разработанная модель позволяет оценить вклад дыхания в энергетический баланс и потребление продуктов фотосинтеза, а также выявить возможные механизмы снижения активности дыхания при освещении. В моделях фотосинтеза может также учитываться процесс фотодыхания. В простых вариантах модели [106] оно может быть описано на основе уравнения для соотношения скоростей фотосинтеза и фотодыхания. В работе Laisk с соавторами [41] реализовано детализированное описание фотодыхание, учитывающее баланс вещества и энергии. Еще более детализированной является модель Zhu с соавторами [42, 103], в которой дополнительно описывается транспорт участвующих в фотодыхании соединений через мембраны. Такие транспортные процессы являются важной составляющей регуляции фотосинтеза, поскольку обеспечивают отток триоз из хлоропластов; описание этих процессов может значительно повысить эффективность описания фотосинтеза в стрессовых условиях.
Еще одной важной задачей моделирования фотосинтеза является описание взаимодействия устьиц и фотосинтеза. При этом важно отметить, что устьица участвуют в контроле фотосинтетических процессов (обеспечивая необходимый для фотосинтеза приток воды и СО2); с другой стороны, протекание фотосинтетических процессов является необходимым условием для работы устьиц [125]. Модель Kim и Lieth [126] объединяет классические модели ассимиляции [45] и описание проводимости устьиц и мезофилла [127]. Показано, что такая модель хорошо описывает зависимость активности РУБИСКО и ЭТЦ хлоропластов от температуры, а также возрастные изменения ассимиляции листьев. Другая модель [128] опирается на гидромеханическое описание влияния давления на проводимость устьиц. При этом предполагается, что осмотический градиент через мембраны устьичных клеток определяется концентрацией в них ATP и тургорным давлением соседних эпидермальных клеток; концентрация ATP выступает в качестве связующего звена между состоянием устьиц и фотосинтетическими процессами (описанными на основании классической модели ассимиляции CO2 [45]). Существуют модификации гидромеханической модели, описывающие С4 растения и учитывающие возможность ограниченного полива растений [129]. Подобные модели могут быть использованы для анализа роли фотосинтеза в потреблении воды растением, для оценки ассимиляции и продуктивности в условиях лимитирования фотосинтеза водным режимом, содержанием СО2, состоянием устьичного аппарата или активностью ферментов цикла Кальвина [125]. Детализированное описание взаимодействия устьиц и фотосинтеза было реализовано в модели OnGuard [44, 130]. Такая модель описывает изменения открытости устьиц как функцию их объема, который зависит от функционирования систем ионного транспорта плазмалеммы и вакуоли и от активности синтеза осмотически активных сахарозы и малата в ходе фотосинтеза (а также от их взаимопревращения); кроме того, в модели учитываются буферные свойства малата для протонов. В ряде работ модель OnGuard была использована для анализа роли транспортных систем (в частности, К+-каналов) [131, 132] и H+ и Са2+-сигналинга [132, 133] в регуляции устьиц. В целом, модель OnGuard может быть дополнена детализированным описанием фотосинтеза и продукционного процесса, что открывает широкие возможности для симуляции этих процессов в различных условиях [125].
Существуют и другие направления моделирования фотосинтеза. В частности, значительный интерес представляют математические модели, описывающие взаимодействие фотосинтетических процессов с процессами сигналинга [119, 134]. При этом из экспериментов известно, на фотосинтез могут оказывать влияние сигнальные процессы, происходящие в других компартментах клетки (например, сдвиги рН [27, 28], изменения концентрации Ca2+ [135] или распространение метаболитов [136] в цитоплазме). Такие результаты делают актуальным моделирование регуляторного влияния на фотосинтез процессов, протекающих в отдаленных от хлоропластов компартментах. В настоящее время существуют лишь ограниченное число моделей такой группы, которые могут опираться на простые регрессионные уравнения [134], на описание распространения регуляторного соединения в потоке цитоплазмы [136], а также на более детализированные модели влияния активности Н+-ATP-азы и Са2+-каналов плазмалеммы на потребление CO2 клеткой [119]. В целом, подобные модели могут стать основой для прогнозирования фотосинтеза и продуктивности в условиях активации различных сигнальных систем; однако, их это направления моделирования фотосинтеза требует дальнейшего развития.
Отдельно можно выделить модели, которые связывают фотосинтетические процессы с приростом биомассы растений, т.е. с их продуктивностью [50, 137–140]. При этом описание фотосинтеза в таких моделях может значительно варьировать (от модификаций FvCB [137, 139] до максимально упрощенных эмпирических уравнений [140]). Помимо фотосинтеза, модели этой группы могут учитывать транспирацию, дыхание, азотный обмен, транспорт ассимилятов и другие процессы [50, 137, 139, 140]. Моделирование роста и увеличения биомассы базируется на описании распределения синтезированных углеводов между органами растения (корень и стебель) [137] или элементарными структурными элементами растительного организма [140], также учитывается накопление органических соединений и их расход в ходе дыхания. Модели этой группы могут быть непосредственно использованы для оценки продукционного процесса при различных условиях среды. Кроме того, такие модели хорошо интегрируются в более сложные описания, учитывающие “надорганизменный” уровень.
8. МАТЕМАТИЧЕСКИЕ МОДЕЛИ ФОТОСИНТЕЗА, УЧИТЫВАЮЩИЕ “НАДОРГАНИЗМЕННЫЙ” УРОВЕНЬ
Рассмотренные выше модели преимущественно направлены на анализ различных аспектов фотосинтеза на уровне отдельного растения. Однако в естественных условиях фотосинтез и продукционный процесс растений могут зависеть от взаимодействия растений друг с другом, другими живыми организмами и с биотопом [51], т.е. актуальной является задача по разработке математических моделей фотосинтеза “надорганизменного” уровня.
Среди таких моделей важную роль играют математические модели, описывающие фотосинтез в растительном покрове [141–149], при этом основное внимание обычно уделяется распространению света. Такое описание может варьировать от усредненных моделей (покров как “большой” лист, серия расположенных последовательно листьев или сочетание освещенных и затененных листьев) [146, 149] до использования виртуальных моделей растений с реалистичной геометрией и описанием конкретных траекторий распространения лучей света [144, 145, 150]. В некоторых моделях может учитываться неоднородность в покрове других значимых для фотосинтеза параметров (например, температуры [146]). Для моделирования фотосинтетических процессов листа широко используется классическая модель FvCB [141, 142, 149, 150]. Однако могут быть также использованы как простые эмпирические описания [141], так и детализированные кинетические модели фотосинтетических процессов [147]. Помимо описания фотосинтеза модели этой группы могут описывать и другие процессы (например, азотный метаболизм, регуляцию активности устьиц, транспорт ассимилятов и др.) [144, 148, 149]. В целом, анализ моделей, описывающих фотосинтез в растительном покрове, позволяет выявить принципиально новые механизмы регуляции фотосинтетических процессов [142, 147, 148], которые могут оказывать существенное влияние на продукционный процесс и устойчивость растений в естественных условиях. В частности, можно отметить выявление возможности стимуляции ассимиляции CO2 при снижении концентрации хлорофилла [147], обнаружение связи такого влияния с распределением азота [148], оценку влияния флуктуаций интенсивности освещения на ассимиляцию растительного покрова [151] и т.д.
Следующая группа “надорганизменных” моделей фокусируется на описании естественных и искусственных экосистем [51, 137, 152–155], масштаб моделируемой экосистемы может существенно варьировать (вплоть до планетарных моделей). Такие модели в значительной степени опираются на описанные в предыдущем разделе модели продукционного процесса [50, 137–140, 144], кроме того, они могут учитывать эффекты, связанные с распространением света в растительном покрове. Особенностью таких моделей является описание взаимодействия растений с другими живыми организмами (например, почвенными микроорганизмами) и/или с компонентами биотопа [51]. В отдельных случаях модели этой группы могут иметь узкоспециализированный характер (например, моделирование функционирования фитокомплекса для выращивания конкретного сорта растений [154]). Важно отметить, что в связи с высокой прикладной значимостью этой категории моделей (сельское хозяйство, экология) для их реализации к настоящему времени создано значительное количество программных инструментов (см., например, обзор [51]), которые могут быть применены для прогнозирования продуктивности определенных видов растений в условиях конкретных биотопов. В то же время широкое использование упрощенных описаний в этой группе моделей может создавать определенные ограничения для их применения и снижать эффективность прогнозирования [156].
9. ЗАКЛЮЧЕНИЕ
Анализ современной литературы, посвященной математическому моделированию фотосинтеза, показывает, что существует значительное число моделей фотосинтетических процессов различного уровня (от описания молекулярных взаимодействий в тилакоидных мембранах – до моделей на уровне целого растения и экосистемы), которые опираются на различную степень детализации описания исследуемых процессов (ряд особенностей описания приведен табл. 1). Различные типы моделей могут быть использованы для прогнозирования продуктивности растений, для оценки нарушений фотосинтетических процессов при действии стрессоров, для выявления потенциальных путей улучшения фотосинтеза и для интерпретации данных мониторинга состояния растений. В то же время обзор показывает, что множество разработанных моделей направлено на решение частных проблем при исследовании фотосинтеза; напротив, модели высокого уровня (модели фотосинтеза и продукционного процесса на уровне целого растения, растительного покрова или экосистемы) опираются на достаточно упрощенные описания. Такая ситуация делает крайне актуальным развитие путей совместного использования существующих моделей, их адаптации к решению широкого круга задач. Опираясь на литературные данные, мы можем предложить несколько возможных путей такого развития (рис. 3).
Таблица 1.
Некоторые особенности моделирования фотосинтетических процессов различного уровня в условиях описания в разной степени детализированности
| Моделируемый процесс | Упрощенное описание | Описание с промежуточной детализацией | Детализированное описание |
|---|---|---|---|
| Поступление света в фотосинтетический аппарат | Интенсивность света описывается как постоянная величина, без учета распределения света в толще листа или в растительном покрове [72, 78, 79, 81, 91] | Описывается распределение интенсивности освещения в толще листа [117] или растительном покрове [146, 149] на основании упрощенной модели прохождения света в рассеивающей среде, которая приблизительно соответствует таким структурам | Описывается распределение интенсивности освещения в толще листа [33, 88, 104, 114] или растительном покрове [144, 145, 150] на основании виртуальных моделей, детально имитирующих геометрию этих структур |
| Поглощение энергии света в РЦ | Поглощение света РЦ описывается как величина, пропорциональная его интенсивности [56] | Для описания поглощения света РЦ используется стационарное описание путей миграции и утилизации энергии возбуждения [62–64] | Для описания поглощения света РЦ используется нестационарное описание динамики миграции и утилизации энергии возбуждения [61, 67] |
| Поток электронов в фотосинтетической ЭТЦ в тилакоидных мембранах | Поток электронов описывается с использованием стационарных функций, аппроксимирующих его зависимость от интенсивности освещения [45, 106, 108] | Поток электронов описывается с использованием упрощенных систем дифференциальных уравнений, которые учитывает лишь отдельные ключевые процессы в ЭТЦ [56, 79] | Поток электронов описывается с использованием детализированных систем дифференциальных уравнений, описывающих перенос электронов между компонентами ЭТЦ [43, 46, 72, 81, 86, 91]. При этом может учитываться распределение процессов в пространстве [49, 92–97] |
| Регуляция процессов в ЭТЦ | Регуляторные процессы описываются с использованием функций, аппроксимирующих зависимости активности ЭТЦ от факторов среды (в частности, интенсивности света [39]) или их динамики [40] | Регуляторные процессы упрощенно описываются как функция фотосинтетических процессов (в частности, доли “закрытых” РЦ [56], количества восстановленных пластохинонов [84] или pH [53]) без детального описания их механизмов | Описываются молекулярные механизмы регуляторных процессов (переходы в ксантофилловом цикле [38, 43, 52, 54, 55], изменения активности ферредоксин-NADP+–редуктазы на свету [43, 72, 87], активацию циклического потока электронов [43, 82, 90] и др.) |
| Поддержание CO2 в строме хлоропластов, необходимое для функционирования цикла Кальвина | Концентрация CO2 описывается как заданная константа [110] | Поток CO2 в строму описывается на основании минимальной эквивалентной схемы из проводимостей для CO2 (в частности, часто учитывается проводимость устьиц [127, 129]) | Поток CO2 описывается на основании детализированной эквивалентной схемы и/или диффузионных уравнений [31–33]. Также учитываются регуляторные процессы (например, детально описываются устьица) [44, 130] и переходы между нейтральной и заряженной формами углекислого газа [31–33, 116, 119] |
| Фотосинтетическая ассимиляция CO2 в ходе темновой стадии фотосинтеза | Описывается на основе эмпирических уравнений [138] или стационарного уравнения для лимитирующего скорость фотосинтеза процесса [45, 106, 108] | Описывается на основании упрощенной системы дифференциальных уравнений, которая учитывает ключевые компоненты цикла Кальвина [110] | Описывается на основе детализированной системы дифференциальных уравнений, которая учитывает компоненты цикла Кальвина и связанные процессы [99–103, 111] |
| Связанное с фотосинтезом накопление биомассы | Описывается как суммарное накопление ассимилированного CO2; возможно, с учетом потоков ассимилятов [144] | Описывается, как функция фотосинтетической ассимиляции CO2, дыхания и оттока ассимилятов [50, 149] | При описании учитывается синтез углеводов, их потребление и распределение между частями растений [137, 140], а также часто описывается азотный обмен [137] |
Во-первых, это создание базы фотосинтетических моделей различного уровня, которая объединит существующие модели и обеспечит автоматический поиск подходящих описаний на основании критериев, заданных пользователем. Потенциально, такая база может быть также использована для выявления оптимальных моделей на основании предоставленных пользователем экспериментальных данных, так как эффективность различных моделей при решении разных задач может существенно варьировать [99].
Во-вторых, это разработка программной среды для совместного использования групп моделей, фокусирующихся на описании различных фотосинтетических процессов. Следует отметить, что существующие модели могут значительно отличаться друг от друга (вследствие описания различных процессов, использования разных упрощений и т.д.); как следствие, каждая из моделей может опираться на свой набор параметров и переменных и иметь собственную область корректного применения. Программная среда для их объединения должна включать в себя алгоритм поиска оптимальной линейки моделей для решения конкретной задачи пользователя и алгоритм, обеспечивающий взаимодействие и обмен информацией между такими моделями. Несмотря на высокую сложность такого пути, он представляется наиболее перспективным, и в настоящее время предпринимаются попытки для его реализации [83, 156]. Можно ожидать, что такая среда может быть использована для прогнозирования процессов фотосинтеза и продуктивности в различных условиях (или при различных модификациях фотосинтетического аппарата).
Рис. 4.
Потенциально перспективные направления развития математического моделирования фотосинтетических процессов у растений и их ограничения.
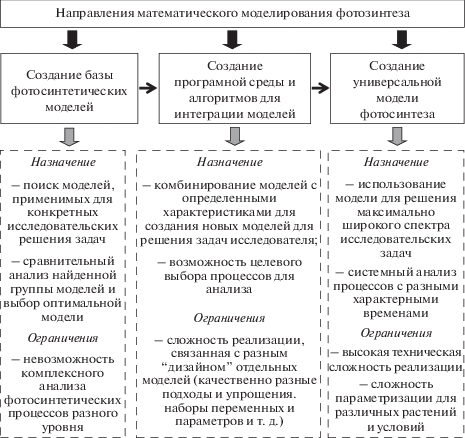
В-третьих, это разработка максимально полной модели фотосинтеза, описывающей процессы различного уровня, которая будет объединять существующие знания о фотосинтезе и его регуляции, а также суммировать опыт моделирования отдельных фотосинтетических процессов. Можно ожидать, что такая модель позволит выявить ряд новых свойств фотосинтетического аппарата, однако ее реализация связана с рядом принципиальных проблем. (i) Такая модель всегда будет ограничиваться неполнотой наших знаний о фотосинтезе, его регуляции и связях с другими процессами. Более того, появление новых знаний в этой области может потребовать существенной модификации модели. (ii) Параметризация такой комплексной модели будет представлять собой очень сложную задачу, при этом для нового объекта (вида или сорта растений) может потребоваться новая параметризация. Кроме того, наличие большого числа параметров может увеличить вероятность ошибок параметризации. (iii) Анализ такой модели потребует значительных вычислительных ресурсов (при этом часть вычислений будет не нужна для решения текущих задач), что также может ограничивать ее применимость. В целом, несмотря на кажущуюся привлекательность, такой подход имеет существенные ограничения.
Таким образом, математическое моделирование является эффективным инструментом для анализа фотосинтетических процессов, однако в настоящее время назрела острая необходимость интеграции многочисленных разработанных моделей, которая будет направлена на решение конкретных исследовательских и прикладных задач.
Исследование выполнено при финансовой поддержке РФФИ в рамках научного проекта № 19-14-50 410.
Funding: The reported study was funded by RFBR, project number 19-14-50 410.
Список литературы
Murchie E.H., Pinto M., Horton P. 2009. Agriculture and the new challenges for photosynthesis research. New Phytol. 181, 532–552.
Foyer C.H., Ruban A.V., Nixon P.J. 2017. Photosynthesis solutions to enhance productivity. Philos. Trans. R. Soc. Lond. B Biol. Sci. 372, 20160374.
Simkin A.J., López-Calcagno P.E., Raines C.A. 2019. Feeding the world: Improving photosynthetic efficiency for sustainable crop production. J. Exp. Bot. 70, 1119–1140.
Johnson M.P. 2016. Photosynthesis. Essays Biochem. 60, 255–273.
Photosynthesis in silico. Advances in Photosynthesis and Respiration. 2009. Eds Laisk A., Nedbal L., Govindjee. Dordrecht: Springer. 504 p.
Nedbal L., Červený J., Schmidt H. 2009. Scaling and integration of kinetic models of photosynthesis: Towards comprehensive e-photosynthesis. In: Photosynthesis in silico. Advances in Photosynthesis and Respiration. Eds. Laisk A., Nedbal L., Govindjee. Dordrecht: Springer, p. 17–29.
Tikhonov A.N., Vershubskii A.V. 2014. Computer modeling of electron and proton transport in chloroplasts. Biosystems. 121, 1–21.
Pavlovič A., Slováková L., Pandolfi C., Mancuso S. 2011. On the mechanism underlying photosynthetic limitation upon trigger hair irritation in the carnivorous plant Venus flytrap (Dionaea muscipula Ellis). J. Exp. Bot. 62, 1991–2000.
Sukhov V., Orlova L., Mysyagin S., Sinitsina J., Vodeneev V. 2012. Analysis of the photosynthetic response induced by variation potential in geranium. Planta. 235, 703–712.
Бухов Н.Г. 2004. Динамическая световая регуляция фотосинтеза. Физиология растений. 51, 825–837.
Kramer D.M., Johnson G., Kiirats O., Edwards G.E. 2004. New fluorescence parameters for the determination of QA redox state and excitation energy fluxes. Photosynth. Res. 79, 209–218.
Kalaji H.M., Schansker G., Brestic M., Bussotti F., Calatayud A., Ferroni L., Goltsev V., Guidi L., Jajoo A., Li P., Losciale P., Mishra V.K., Misra A.N., Nebauer S.G., Pancaldi S., Penella C., Pollastrini M., Suresh K., Tambussi E., Yanniccari M., Zivcak M., Cetner M.D., Samborska I.A., Stirbet A., Olsovska K., Kunderlikova K., Shelonzek H., Rusinowski S., Baba W. 2017. Frequently asked questions about chlorophyll fluorescence, the sequel. Photosynth. Res. 132, 13–66.
Demmig-Adams B. 1990. Carotenoids and photoprotection in plants: A role for the xanthophylls zeaxanthin. Biochim. Biophys. Acta. 1020, 1–24.
Li X.P., Gilmore A.M., Caffarri S., Bassi R., Golan T., Kramer D., Niyogi K.K. 2004. Regulation of photosynthetic light harvesting involves intrathylakoid lumen pH sensing by the PsbS protein. J. Biol. Chem. 279, 22866–22874.
Jahns P., Latowski D., Strzalka K. 2009. Mechanism and regulation of the violaxanthin cycle: The role of antenna proteins and membrane lipids. Biochim. Biophys. Acta. 1787, 3–14.
Ruban A.V. 2016. Nonphotochemical chlorophyll fluorescence quenching: Mechanism and effectiveness in protecting plants from photodamage. Plant Physiol. 170, 1903–1916.
Murata N., Takahashi S., Nishiyama Y., Allakhverdiev S.I. 2007. Photoinhibition of photosystem II under environmental stress. Biochim. Biophys. Acta. 1767, 414–421.
Murata N., Allakhverdiev S.I., Nishiyama Y. 2012. The mechanism of photoinhibition in vivo: Re-evaluation of the roles of catalase, α-tocopherol, non-photochemical quenching, and electron transport. Biochim. Biophys. Acta. 1817, 1127–1133.
Miyake C., Shinzaki Y., Miyata M., Tomizawa K. 2004. Enhancement of cyclic electron flow around PSI at high light and its contribution to the induction of non-photochemical quenching of Chl fluorescence in intact leaves of tobacco plants. Plant Cell Physiol. 45, 1426–1433.
Miyake C., Miyata M., Shinzaki Y., Tomizawa K. 2005. CO2 response of cyclic electron flow around PSI (CEF-PSI) in tobacco leaves—relative electron fluxes through PSI and PSII determine the magnitude of non-photochemical quenching (NPQ) of Chl fluorescence. Plant Cell Physiol. 46, 629–637.
Joliot P., Johnson G.N. 2011. Regulation of cyclic and linear electron flow in higher plants. Proc. Natl. Acad. Sci. USA. 108, 13317–13322.
Alte F., Stengel A., Benz J.P., Petersen E., Soll J., Groll M., Bölter B. 2010. Ferredoxin:NADPH oxidoreductase is recruited to thylakoids by binding to a polyproline type II helix in a pH-dependent manner. Proc. Natl. Acad. Sci. USA. 107, 19260–19265.
Benz J.P., Lintala M., Soll J., Mulo P., Bölter B. 2010. A new concept for ferredoxin-NADP(H) oxidoreductase binding to plant thylakoids. Trends Plant Sci. 15, 608–613.
Matsumoto M., Ogawa K. 2008. New insight into the Calvin cycle regulation – glutathionylation of fructose bisphosphate aldolase in response to illumination. In: Photosynthesis. Energy from the Sun. Eds Allen J.F., Gantt E., Golbeck J.H., Osmond B. Dordrecht: Springer, p. 871–874.
Michelet L., Zaffagnini M., Morisse S., Sparla F., Pérez-Pérez M.E., Francia F., Danon A., Marchand C.H., Fermani S., Trost P., Lemaire S.D. 2013. Redox regulation of the Calvin–Benson cycle: Something old, something new. Front Plant Sci. 4, 470.
Jensen E., Clément R., Maberly S.C., Gontero B. 2017. Regulation of the Calvin–Benson–Bassham cycle in the enigmatic diatoms: Biochemical and evolutionary variations on an original theme. Philos. Trans. R. Soc. Lond. B Biol. Sci. 372, 20160401.
Sukhov V., Surova L., Morozova E., Sherstneva O., Vodeneev V. 2016. Changes in H+-ATP synthase activity, proton electrochemical gradient, and pH in pea chloroplast can be connected with variation potential. Front. Plant Sci. 7, 1092.
Sukhov V. 2016. Electrical signals as mechanism of photosynthesis regulation in plants. Photosynth. Res. 130, 373–387.
Armbruster U., Galvis V.C., Kunz H.-H., Strand D.D. 2017. The regulation of the chloroplast proton motive force plays a key role for photosynthesis in fluctuating light. Curr. Opin. Plant Biol. 37, 56–62.
Kohzuma K., Froehlich J.E., Davis G.A., Temple J.A., Minhas D., Dhingra A., Cruz J.A., Kramer D.M. 2017. The role of light–dark regulation of the chloroplast ATP synthase. Front. Plant Sci. 8, Article 1248.
Tholen D., Zhu X.-G. 2011. The mechanistic basis of internal conductance: A theoretical analysis of mesophyll cell photosynthesis and CO2 diffusion. Plant Physiol. 156, 90–105.
Tomás M., Flexas J., Copolovici L., Galmés J., Hallik L., Medrano H., Ribas-Carbó M., Tosens T., Vislap V., Niinemets Ü. 2013. Importance of leaf anatomy in determining mesophyll diffusion conductance to CO2 across species: Quantitative limitations and scaling up by models. J Exp Bot. 64, 2269–2281.
Ho Q.T., Berghuijs H.N., Watté R., Verboven P., Herremans E., Yin X., Retta M.A., Aernouts B., Saeys W., Helfen L., Farquhar G.D., Struik P.C., Nicolaï B.M. 2016. Three-dimensional microscale modelling of CO2 transport and light propagation in tomato leaves enlightens photosynthesis. Plant Cell Environ. 39, 50–61.
Чиков В.И. 2008. Эволюция представлений о связи фотосинтеза с продуктивностью растений. Физиология растений. 55, 140–154.
Nikinmaa E., Hölttä T., Hari P., Kolari P., Mäkelä A., Sevanto S., Vesala T. 2013. Assimilate transport in phloem sets conditions for leaf gas exchange. Plant Cell Environ. 36, 655–669.
chreiber U. 2004. Pulse-amplitude-modulation (PAM) fluorometry and saturation pulse method: an overview. In: Chlorophyll a fluorescence: a signature of photosynthesis. Advances in photosynthesis and respiration. Eds Papageorgiou G.C., Govindjee. Dordrecht: Springer, p. 279–319
von Caemmerer S. Steady-state models of photosynthesis. 2013. Plant Cell Environ. 36, 1617–1630.
Bennett D.I.G., Amarnath K., Park S., Steen C.J., Morris J.M., Fleming G.R. 2019. Models and mechanisms of the rapidly reversible regulation of photosynthetic light harvesting. Open Biol. 9, 190043.
Serôdio J., Lavaud J. 2011. A model for describing the light response of the nonphotochemical quenching of chlorophyll fluorescence. Photosynth. Res. 108, 61–76.
Holzwarth A.R., Lenk D., Jahns P. 2013. On the analysis of non-photochemical chlorophyll fluorescence quenching curves I. Theoretical considerations. Biochim. Biophys. Acta. 1827, 786–792.
Laisk A., Eichelmann H., Oja V. 2009. Leaf C3 Photosynthesis in silico: Integrated Carbon/Nitrogen Metabolism. In: Photosynthesis in silico. Advances in Photosynthesis and Respiration. Eds Laisk A., Nedbal L., Govindjee. Dordrecht: Springer, p. 295–322.
Zhu X.-G., Wang Y., Ort D.R., Long S.P. 2013. E-photosynthesis: a comprehensive dynamic mechanistic model of C3 photosynthesis: From light capture to sucrose synthesis. Plant Cell Environ. 36, 1711–1727.
Matuszyńska A., Saadat N.P., Ebenhöh O. 2019. Balancing energy supply during photosynthesis – a theoretical perspective. Physiol Plant. 166, 392–402.
Hills A., Chen Z.-H., Amtmann A., Blatt M.R., Lew V.L. 2012. OnGuard, a computational platform for quantitative kinetic modeling of guard cell physiology. Plant Physiol. 159, 1026–1042.
Farquhar G.D., von Caemmerer S., Berry J.A. 1980. A biochemical model of photosynthetic CO2 assimilation in leaves of C 3 species. Planta. 149, 78–90.
Lazár D. 2003. Chlorophyll a fluorescence rise induced by high light illumination of dark-adapted plant tissue studied by means of a model of photosystem II and considering photosystem II heterogeneity. J. Theor. Biol. 220, 469–503.
Lazár D., Jablonský J. 2009. On the approaches applied in formulation of a kinetic model of photosystem II: Different approaches lead to different simulations of the chlorophyll a fluorescence transients. J. Theor. Biol. 257, 260–269.
Rubin A., Riznichenko G. 2009. Modeling of the primary processes in a photosynthetic membrane. In: Photosynthesis in silico. Advances in Photosynthesis and Respiration. Eds Laisk A., Nedbal L., Govindjee. Dordrecht: Springer, p. 151–176.
Vershubskii A.V., Kuvykin I.V., Priklonskii V.I., Tikhonov A.N. 2011. Functional and topological aspects of pH-dependent regulation of electron and proton transport in chloroplasts in silico. Biosystems.103, 164–179.
Bouman B.A.M., van Keulen H., van Laar H.H., Rabbinge R. 1996. The ‘School of de Wit’ crop growth simulation models: A pedigree and historical overview. Agric. Syst. 52, 171–198.
Brilli L., Bechini L., Bindi M., Carozzi M., Cavalli D., Conant R., Dorich C.D., Doro L., Ehrhardt F., Farina R., Ferrise R., Fitton N., Francaviglia R., Grace P., Iocola I., Klumpp K., Léonard J., Martin R., Massad R.S., Recous S., Seddaiu G., Sharp J., Smith P., Smith W.N., Soussana J.F., Bellocchi G. 2017. Review and analysis of strengths and weaknesses of agro-ecosystem models for simulating C and N fluxes. Sci. Tot. Environ. 598, 445–470.
Zaks J., Amarnath K., Kramer D.M., Niyogi K.K., Fleming G.R. 2012. A kinetic model of rapidly reversible nonphotochemical quenching. Proc. Natl. Acad. Sci. USA. 109, 15757–15762.
Sato R., Ohta H., Masuda S. 2014. Prediction of respective contribution of linear electron flow and PGR5-dependent cyclic electron flow to non-photochemical quenching induction. Plant Physiol. Biochem. 81, 190–196.
Matuszyńska A., Heidari S., Jahns P., Ebenhöh O. 2016. A mathematical model of nonphotochemical quenching to study short-term light memory in plants. Biochim. Biophys. Acta. 1857, 1860–1869.
Leuenberger M., Morris J.M., Chan A.M., Leonelli L., Niyogi K.K., Fleming G.R. 2017. Dissecting and modeling zeaxanthin- and lutein-dependent nonphotochemical quenching in Arabidopsis thaliana. Proc. Natl. Acad. Sci. USA. 114, E7009–E7017.
Sukhova E., Khlopkov A., Vodeneev V., Sukhov V. 2020. Simulation of a nonphotochemical quenching in plant leaf under different light intensities. Biochim. Biophys. Acta Bioenerg. 1861, Article 148138.
Porcar-Castell A., Tyystjärvi E., Atherton J., van der Tol C., Flexas J., Pfündel E.E., Moreno J., Frankenberg C., Berry J.A. 2014. Linking chlorophyll a fluorescence to photosynthesis for remote sensing applications: mechanisms and challenges. J. Exp. Bot. 65, 4065–4095.
Oxborough K., Baker N.R. 1997. Resolving chlorophyll a fluorescence images of photosynthetic efficiency into photochemical and non-photochemical components – calculation of qP and Fv`/Fm`; without measuring Fo`. Photosynth. Res. 54, 135–142.
van Grondelle R., Novoderezhkin V.I., Dekker J.P. 2009. Modeling light harvesting and primary charge separation in photosystem I and photosystem II. In: Photosynthesis in silico. Advances in Photosynthesis and Respiration. Eds Laisk A., Nedbal L., Govindjee. Dordrecht: Springer, p. 33–53.
Freiberg A., Trinkunas G. 2009. Unraveling the hidden nature of antenna excitations. In: Photosynthesis in silico. Advances in Photosynthesis and Respiration. Eds Laisk A., Nedbal L., Govindjee. Dordrecht: Springer, p. 55–82.
Yakovlev A.G., Shuvalov V.A. 2014. Modeling of reversible charge separation in reaction centers of photosynthesis: an incoherent approach. J. Theor. Biol. 343, 92–101.
Kitajima M., Butler W.L. 1975. Quenching of chlorophyll fluorescence and primary photochemistry in chloroplasts by dibromothymoquinone. Biochim. Biophys. Acta Bioenerg. 376, 105–115.
Butler W.L. 1978. Energy distribution in the photochemical apparatus of photosynthesis. Ann. Rev. Plant Physiol. 29, 345–378.
Булычев А.А., Ниязова М.М. 1989. Модель потенциалзависимых изменений флуоресценции хлорофилла фотосистемы II. Биофизика. 34, 63–67.
Bernhardt K., Trissl H.-W. 1999. Theories for kinetics and yields of fluorescence and photochemistry: How, if at all, can different models of antenna organization be distinguished experimentally? Biochim. Biophys. Acta Bioenerg. 1409, 125–142.
Bulychev A.A., Vredenberg W.J. 2001. Modulation of photosystem II chlorophyll fluorescence by electrogenic events generated by photosystem I. Bioelectrochem. 54, 157–168.
Vredenberg W.J. 2000. A three-state model for energy trapping and chlorophyll fluorescence in photosystem II incorporating radical pair recombination. Biophys. J. 79, 26–38.
Klughammer C., Schreiber U. 1994. An improved method, using saturating light pulses, for the determination of photosystem I quantum yield via P700+-absorbance changes at 830 nm. Planta. 192, 261–268.
Klughammer C., Schreiber U. 2008. Saturation Pulse method for assessment of energy conversion in PS I. PAM Applic. Not. 1, 11–14.
Zivcak M., Brestic M., Balatova Z., Drevenakova P., Olsovska K., Kalaji H.M., Yang X., Allakhverdiev S.I. 2013. Photosynthetic electron transport and specific photoprotective responses in wheat leaves under drought stress. Photosynth. Res. 117, 529–546.
Genty B., Briantais J.-M., Baker N.R. 1989. The relationship between the quantum yield of photosynthetic electron transport and quenching of chlorophyll fluorescence. Biochim. Biophys. Acta Gen. Subj. 990, 87–92.
Belyaeva N.E., Bulychev A.A., Riznichenko G.Y., Rubin A.B. 2019. Analyzing both the fast and the slow phases of chlorophyll a fluorescence and P700 absorbance changes in dark-adapted and preilluminated pea leaves using a thylakoid membrane model. Photosynth. Res. 140, 1–19.
Antal T.K., Kovalenko I.B., Rubin A.B., Tyystjärvi E. 2013. Photosynthesis-related quantities for education and modeling. Photosynth. Res. 117, 1–30.
Штирбет А., Ризниченко Г.Ю., Рубин А.Б., Говинджи. 2014. Моделирование кинетики флуоресценции хлорофилла а: связь с фотосинтезом. Биохимия. 79, 379–412.
Laisk A., Eichelmann H., Oja V. 2006. C3 photosynthesis in silico. Photosynth Res. 90, 45–66.
Vershubskii A.V., Tikhonov A.N. 2013. Electron transport and transmembrane proton transfer in photosynthetic systems of oxygenic type in silico. Biophysics. 58, 60–71.
Вершубский А.В., Приклонский В.И., Тихонов А.Н. 2007. Математическая модель электронного и протонного транспорта в фотосинтетических системах оксигенного типа. Рос. хим. ж. LI, 59–69.
Ebenhöh O., Fucile G., Finazzi G., Rochaix J.-D., Goldschmidt-Clermont M. 2014. Short-term acclimation of the photosynthetic electron transfer chain to changing light: A mathematical model. Philos. Trans. R. Soc. Lond. B Biol. Sci. 369, 20130223.
Ebenhöh O., Houwaart T., Lokstein H., Schlede S., Tirok K. 2011. A minimal mathematical model of nonphotochemical quenching of chlorophyll fluorescence. Biosystems. 103, 196–204.
Gorbunov M.Y., Kuzminov F.I., Fadeev V.V., Kim J.D., Falkowski P.G. 2011. A kinetic model of non-photochemical quenching in cyanobacteria. Biochim. Biophys. Acta. 1807, 1591–1599.
Belyaeva N.E., Bulychev A.A., Riznichenko G.Y., Rubin A.B. 2016. Thylakoid membrane model of the Chl a fluorescence transient and P700 induction kinetics in plant leaves. Photosynth. Res. 130, 491–515.
Vredenberg W. 2011. Kinetic analyses and mathematical modeling of primary photochemical and photoelectrochemical processes in plant photosystems. Biosystems. 103, 138–151.
Nedbal L., Cervený J., Rascher U., Schmidt H. 2007. E-photosynthesis: a comprehensive modeling approach to understand chlorophyll fluorescence transients and other complex dynamic features of photosynthesis in fluctuating light. Photosynth Res. 93, 223–234.
Porcar-Castell A., Bäck J., Juurola E., Hari P. 2006. Dynamics of the energy flow through photosystem II under changing light conditions: A model approach. Func. Plant Biol. 33, 229–239.
Riznichenko G., Lebedeva G., Demin O., Rubin A. 1999. Kinetic mechanisms of biological regulation in photosynthetic organisms. J. Biol. Phys. 25, 177–192.
Лебедева Г.В., Беляева Н.Е., Дёмин О.В., Ризниченко Г.Ю., Рубин А.Б. 2002. Кинетическая модель первичных процессов фотосинтеза в хлоропластах. Описание быстрой фазы индукции флуоресценции хлорофилла при различной интенсивности света. Биофизика. 47, 1044–1058.
Morales A., Yin X., Harbinson J., Driever S.M., Molenaar J., Kramer D.M., Struik P.C. 2018. In silico analysis of the regulation of the photosynthetic electron transport chain in C3 plants. Plant Physiol. 176, 1247–1261.
Xin C.-P., Yang J., Zhu X.-G. 2013. A model of chlorophyll a fluorescence induction kinetics with explicit description of structural constraints of individual photosystem II units. Photosynth. Res. 117, 339–354.
Laisk A., Oja V., Rasulov B., Eichelmann H., Sumberg A. 1997. Quantum yields and rate constants of photochemical and nonphotochemical excitation quenching (experiment and model). Plant Physiol. 115, 803–815.
Vredenberg W.J., Bulychev A.A. 2010. Photoelectrochemical control of the balance between cyclic- and linear electron transport in photosystem I. Algorithm for P700+ induction kinetics. Biochim. Biophys. Acta. 1797, 1521–1532.
Zhu X.-G., Govindjee, Baker N.R., deSturler E., Ort D.O., Long S.P. 2005. Chlorophyll a fluorescence induction kinetics in leaves predicted from a model describing each discrete step of excitation energy and electron transfer associated with photosystem II. Planta. 223, 114–133.
Ullmann G.M., Knapp E.-W., Kostic N.M. 1997. Computational simulation and analysis of dynamic association between plastocyanin and cytochrome f. Consequences for the electron-transfer reaction. J. Am. Chem. Soc. 119, 42–52.
Pearson D.C., Gross E.L. 1998. Brownian dynamics study of the interaction between plastocyanin and cytochrome f. Biophys. J. 75, 2698–2711.
De Rienzo F., Gabdoulline R.R., Menziani M.C., De Benedetti P.G., Wade R.C. 2001. Electrostatic analysis and Brownian dynamics simulation of the association of plastocyanin and cytochrome f. Biophys. J. 81, 3090–3104.
Ризниченко Г.Ю., Беляева Н.Е., Коваленко И.Б., Рубин А.Б. 2009. Математическое и компьютерное моделирование первичных процессов фотосинтеза. Биофизика. 54, 16–33.
Kovalenko I.B., Diakonova A.N., Abaturova A.M., Riznichenko G.Y., Rubin A.B. 2010. Direct computer simulation of ferredoxin and FNR complex formation in solution. Phys. Biol. 7, 026001.
Kovalenko I.B., Abaturova A.M., Diakonova A.N., Knyazeva O.S., Ustinin D.M., Khruschev S.S., Riznichenko G.Yu., Rubin A.B. 2011. Computer simulation of protein-protein association in photosynthesis. Math. Model. Nat. Phenom. 6, 39–54.
Гольцев В.Н., Каладжи Х.М., Паунов М., Баба В., Хорачек Т., Мойски Я., Коцел Х., Аллахвердиев С.И. 2016. Использование переменной флуоресценции хлорофилла для оценки физиологического состояния фотосинтетического аппарата растений. Физиология растений. 63, 881–907.
Arnold A., Nikoloski Z. 2011. A quantitative comparison of Calvin–Benson cycle models. Trends Plant Sci. 16, 676–683.
Pettersson G., Ryde-Pettersson U. 1988. A mathematical model of the Calvin photosynthesis cycle. Eur. J. Biochem. 175, 661–683.
Poolman M., Fell D.A., Thomas S. 2000. Modelling photosynthesis and its control. J. Exp. Bot. 51, 319–328.
Laisk A., Eichelmann H., Oja V., Eatherall A., Walker D.A. 1989. A mathematical model of carbon metabolism in photosynthesis: Difficulties in explaining oscillations by fructose 2,6-bisphosphate regulation. Proc. R. Soc. Lond. B: Biol. Sci. 237, 389–415.
Zhu, X-G., de Sturler E., Long S.P. 2007. Optimizing the distribution of resources between enzymes of carbon metabolism can dramatically increase photosynthetic rate: a numerical simulation using an evolutionary algorithm. Plant Physiol. 145, 513–526.
Aalto T., Juurola E. 2002. A three-dimensional model of CO2 transport in airspaces and mesophyll cells of a silver birch leaf. Plant Cell Environ. 25, 1399–1409.
Berghuijs H.N., Yin X., Ho Q.T., Driever S.M., Retta M.A., Nicolaï B.M., Struik P.C. 2016. Mesophyll conductance and reaction-diffusion models for CO2 transport in C3 leaves; needs, opportunities and challenges. Plant Sci. 252, 62–75.
von Caemmerer S., Farquhar G., Berry J. 2009. Biochemical model of C3 photosynthesis. In: Photosynthesis in silico. Advances in Photosynthesis and Respiration. Eds Laisk A., Nedbal L., Govindjee. Dordrecht: Springer, p. 209–230.
Yin X., Harbinson J., Struik P.C. 2009. A model of the generalized stoichiometry of electron transport limited C3 photosynthesis: development and applications. In: Photosynthesis in silico. Advances in Photosynthesis and Respiration. Eds Laisk A., Nedbal L., Govindjee. Dordrecht: Springer, p. 247–273.
Bernacchi C.J., Rosenthal D.M., Pimentel C., Long S.P., Farquhar G.D. 2009. Modeling the temperature dependence of C3 photosynthesis. In: Photosynthesis in silico. Advances in Photosynthesis and Respiration. Eds Laisk A., Nedbal L., Govindjee. Dordrecht: Springer, p.231–246.
Laisk A., Edwards G.E. 2000. A mathematical model of C4 photosynthesis: The mechanism of concentrating CO2 in NADP-malic enzyme type species. Photosynth. Res. 66, 199–224.
Badretdinov D.Z., Baranova E.A., Kukushkin A.K. 2004. Study of temperature influence on electron transport in higher plants via delayed luminescence method: Experiment, theory. Bioelectrochemistry. 63, 67–71.
Laisk A., Edwards G. 2009. Leaf C4 Photosynthesis in silico: The CO2 concentrating mechanism. In: Photosynthesis in silico. Advances in Photosynthesis and Respiration. Eds Laisk A., Nedbal L., Govindjee. Dordrecht: Springer, p. 323–348.
Poolman M., Aßmus H., Fell D.A. 2004. Application of metabolic modelling to plant metabolism. J. Exp. Bot. 55, 1177–1186.
Baghalian K., Hajirezaei M.R., Schreiber F. 2014. Plant metabolic modeling: Achieving new insight into metabolism and metabolic engineering. Plant Cell. 26, 3847–3866.
Ustin S. L., Jacquemoud S., Govaerts Y. 2001. Simulation of photon transport in a three-dimensional leaf: implications for photosynthesis. Plant Cell Environ. 24, 1095–1103.
Evans J.R., Kaldenhoff R., Genty B., Terashima I. 2009. Resistances along the CO2 diffusion pathway inside leaves. J. Exp. Bot. 60, 2235–2248.
Xiao Y., Tholen D., Zhu X.-G. 2016. The influence of leaf anatomy on the internal light environment and photosynthetic electron transport rate: exploration with a new leaf ray tracing model. J. Exp. Bot. 67, 6021–6035.
Buckley T.N., Farquhar G.D. 2004. A new analytical model for whole-leaf potential electron transport rate. Plant Cell Environ. 27, 1487–1502.
Ho Q.T., Verboven P., Yin X., Struik P.C., Nicolaï B.M. 2012. A microscale model for combined CO2 diffusion and photosynthesis in leaves. PLoS One. 7, e48376.
Сухова Е.М., Сухов В.С. 2018. Зависимость поступления СО2 в растительную клетку от активности Н+-ATP-азы плазматической мембраны. Теоретический анализ. Биол. мембраны. 35, 52–65.
Flexas J., Niinemets Ü., Gallé A., Barbour M.M., Centritto M., Diaz-Espejo A., Douthe C., Galmés J., Ribas-Carbo M., Rodriguez P.L., Rosselló F., Soolanayakanahally R., Tomas M., Wright I.J., Farquhar G.D., Medrano H. 2013. Diffusional conductances to CO2 as a target for increasing photosynthesis and photosynthetic water-use efficiency. Photosynth. Res. 117, 45–59.
Jacoby R.P., Taylor N.L., Millar A.H. 2011. The role of mitochondrial respiration in salinity tolerance. Trends Plant Sci. 16, 614–623.
Cannell M.G.R., Thornley J.H.M. 2000. Modelling the components of plant respiration: Some guiding principles. Ann. Bot. 85, 45–54.
Thornley J.H.M., Cannell M.G.R. 2000. Modelling the components of plant respiration: Representation and realism. Ann. Bot. 85, 55–67.
Buckley T.N., Adams M.A. 2011. An analytical model of non-photorespiratory CO2 release in the light and dark in leaves of C3 species based on stoichiometric flux balance. Plant Cell Environ. 34, 89–112.
Buckley T.N. 2017. Modeling stomatal conductance. Plant Physiol. 174, 572–582.
Kim S.-H., Lieth J.H. 2003. A coupled model of photosynthesis, stomatal conductance and transpiration for a rose leaf (Rosa hybrida L.). Ann. Bot. 91, 771–781.
Ball J.T., Woodrow I.E., Berry J.A. 1987. A model predicting stomatal conductance and its contribution to the control of photosynthesis under different environmental conditions. In: Progress in Photosynthesis Research. Eds Biggins J. Dordrecht: Springer, p. 221–224.
Buckley T.N., Mott K.A., Farquhar G.D. 2003. A hydromechanical and biochemical model of stomatal conductance. Plant Cell Environ. 26, 1767–1785.
Bellasio C., Quirk J., Buckley T.N., Beerling D.J. 2017. A dynamic hydro-mechanical and biochemical model of stomatal conductance for C4 photosynthesis. Plant Physiol. 175, 104–119.
Chen Z.-H., Hills A., Bätz U., Amtmann A., Lew V.L., Blatt M.R. 2012. Systems dynamic modeling of the stomatal guard cell predicts emergent behaviors in transport, signaling, and volume control. Plant Physiol. 159, 1235–1251.
Wang Y., Papanatsiou M., Eisenach C., Karnik R., Williams M., Hills A., Lew V.L., Blatt M.R. 2012. Systems dynamic modeling of a guard cell Cl– channel mutant uncovers an emergent homeostatic network regulating stomatal transpiration. Plant Physiol. 160, 1956–1967.
Wang Y., Hills A., Blatt M.R. 2014. Systems analysis of guard cell membrane transport for enhanced stomatal dynamics and water use efficiency. Plant Physiol. 164, 1593–1599.
Minguet-Parramona C., Wang Y., Hills A., Vialet-Chabrand S., Griffiths H., Rogers S., Lawson T., Lew V.L., Blatt M.R. 2016. An optimal frequency in Ca2+ oscillations for stomatal closure is an emergent property of ion transport in guard cells. Plant Physiol. 170, 33–42.
Шерстнева О.Н., Воденеев В.А., Сурова Л.М., Новикова Е.М., Сухов В.С. 2016. Использование математической модели вариабельного потенциала для анализа его влияния на фотосинтез высших растений. Биол. мембраны. 33, 293–302.
Krupenina N.A., Bulychev A.A. 2007. Action potential in a plant cell lowers the light requirement for non-photochemical energy-dependent quenching of chlorophyll fluorescence. Biochim. Biophys. Acta. 1767, 781–788.
Komarova A.V., Sukhov V.S., Bulychev A.A. 2018. Cyclosis-mediated long distance communications of chloroplasts in giant cells of Characeae. Funct. Plant Biol. 45, 236–246.
Yin X., van Laar H.H. 2005. Crop systems dynamics: An ecophysiological simulation model for genotype-by-environment interactions. Wageningen: Wageningen Academic Publishers, 155 p.
Wu A., Song Y., van Oosterom E.J., Hammer G.L. 2016. Connecting biochemical photosynthesis models with crop models to support crop improvement. Front. Plant Sci. 7, 1518.
Yin X., Struik P.C. 2017. Can increased leaf photosynthesis be converted into higher crop mass production? A simulation study for rice using the crop model GECROS. J. Exp. Bot. 68, 2345–2360.
Gu S., Zhang L., Yan Z., van der Werf W., Evers J.B. 2018. Quantifying within-plant spatial heterogeneity in carbohydrate availability in cotton using a local-pool model. Ann. Bot. 121, 1005–1017.
Niinemets Ü., Anten N.P.R. 2009. Packing the photosynthetic machinery: From leaf to canopy. In: Photosynthesis in silico Advances in Photosynthesis and Respiration. Eds Laisk A., Nedbal L., Govindjee. Dordrecht: Springer, p. 363–399.
Zhu X.G., Long S.P. 2009. Can increase in Rubisco specificity increase carbon gain by whole canopy? A modeling analysis. In: Photosynthesis in silico. Advances in Photosynthesis and Respiration. Eds Laisk A., Nedbal L., Govindjee. Dordrecht: Springer, p. 401–416.
Küppers M., Pfiz M. 2009. Role of photosynthetic induction for daily and annual carbon gains of leaves and plant canopies. In: Photosynthesis in silico. Advances in Photosynthesis and Respiration. Eds Laisk A., Nedbal L., Govindjee. Dordrecht: Springer, p. 417–440.
Evers J.B., Vos J., Yin X., Romero P., van der Putten P.E., Struik P.C. 2010. Simulation of wheat growth and development based on organ-level photosynthesis and assimilate allocation. J. Exp. Bot. 61, 2203–2216.
Chen T.-W., Henke M., de Visser P.H.B., Buck-Sorlin G., Wiechers D., Kahlen K., Stützel H. 2014. What is the most prominent factor limiting photosynthesis in different layers of a greenhouse cucumber canopy? Ann. Bot. 114, 677–688.
Hikosaka K., Kumagai T., Ito A. 2016. Modeling canopy photosynthesis. In: Canopy photosynthesis: from basics to applications. Advances in photosynthesis and respiration (including bioenergy and related processes). Eds Hikosaka K., Niinemets Ü., Anten N. Dordrecht: Springer, p. 239–268.
Song Q., Wang Y., Qu M., Ort D.R., Zhu X.-G. 2017. The impact of modifying photosystem antenna size on canopy photosynthetic efficiency-Development of a new canopy photosynthesis model scaling from metabolism to canopy level processes. Plant Cell Environ. 40, 2946–2957.
Walker B.J., Drewry D.T., Slattery R.A., VanLoocke A., Cho Y.B., Ort D.R. 2018. Chlorophyll can be reduced in crop canopies with little penalty to photosynthesis. Plant Physiol. 176, 1215–1232.
Wu A., Doherty A., Farquhar G.D., Hammer G.L. 2018. Simulating daily field crop canopy photosynthesis: an integrated software package. Funct. Plant Biol. 45, 362–377.
Song Q., Zhang G., Zhu X.-G. 2013. Optimal crop canopy architecture to maximise canopy photosynthetic CO2 uptake under elevated CO2 – a theoretical study using a mechanistic model of canopy photosynthesis. Func. Plant Biol. 40, 109–124.
Townsend A.J., Retkute R., Chinnathambi K., Randall J.W.P., Foulkes J., Carmo-Silva E., Murchie E.H. 2018. Suboptimal acclimation of photosynthesis to light in wheat canopies. Plant Physiol. 176, 1233–1246.
Pietsch S.A., Hasenauer H. 2009. Photosynthesis within large-scale ecosystem models. In: Photosynthesis in silico. Advances in Photosynthesis and Respiration. Eds Laisk A., Nedbal L., Govindjee. Dordrecht: Springer, p. 441–464.
Friend A.D., Geider R.J., Behrenfeld M.J., Still C.J. 2009. Photosynthesis in global-scale models. In: Photosynthesis in silico. Advances in Photosynthesis and Respiration. Eds Laisk A., Nedbal L., Govindjee. Dordrecht: Springer, p. 465–497.
Buck-Sorlin G., de Visser P.H.B., Henke M., Sarlikioti V., van der Heijden G.W., Marcelis L.F., Vos J. 2011. Towards a functional–structural plant model of cut-rose: simulation of light environment, light absorption, photosynthesis and interference with the plant structure. Ann. Bot. 108, 1121–1134.
Knauer J., Zaehle S., Kauwe M.G.D., Bahar N.H.A., Evans J.R., Medlyn B.E., Reichstein M., Werner C. 2019. Effects of mesophyll conductance on vegetation responses to elevated CO2 concentrations in a land surface model. Glob. Chang. Biol. 25, 1820–1838.
Zhu X.-G., Lynch J.P., LeBauer D.S., Millar A.J., Stitt M., Long S.P. 2016. Plants in silico: Why, why now and what? an integrative platform for plant systems biology research. Plant Cell Environ. 39, 1049–1057.
Дополнительные материалы отсутствуют.
Инструменты
Биологические мембраны: Журнал мембранной и клеточной биологии


