Биологические мембраны: Журнал мембранной и клеточной биологии, 2021, T. 38, № 2, стр. 98-108
Взаимодействие пептидов, содержащих CRAC-мотивы, с липидами в мембранах различного состава
П. Е. Волынский a, Т. Р. Галимзянов b, С. А. Акимов b, *
a Институт биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова РАН
117997 Москва, Россия
b Институт физической химии и электрохимии им. А.Н. Фрумкина РАН
119071 Москва, Россия
* E-mail: akimov_sergey@mail.ru
Поступила в редакцию 17.09.2020
После доработки 21.09.2020
Принята к публикации 22.09.2020
Аннотация
Латеральное распределение интегральных и периферических белков, а также липидов в плазматических мембранах клеток млекопитающих крайне неоднородно. Считается, что в мембранах формируются различные липид-белковые домены. Домены, обогащенные сфингомиелином и холестерином, называют рафтами. Предполагается, что распределение белков в рафты в большой степени связано с наличием в их первичной последовательности специфического участка аминокислот, называемого CRAC-мотивом, отвечающего за связывание холестерина. В настоящей работе взаимодействие двух пептидов, содержащих в своей структуре CRAC-мотивы, с мембранами различного состава исследовалось методом молекулярной динамики. Показано, что среднее число контактирующих с каждым пептидом липидных молекул пропорционально мольной доле липида в мембране. Не обнаружено преимущественное взаимодействие с холестерином как пептидов в целом, так и их отдельных аминокислот или аминокислотных последовательностей. Мы предполагаем, что в ряде случаев преимущественное латеральное распределение в рафты пептидов и белков, содержащих CRAC-мотивы, может быть обусловлено амфипатическими свойствами CRAC-мотива, а не специфическим сильным связыванием холестерина.
ВВЕДЕНИЕ
Латеральное распределение интегральных и периферических белков в плазматической мембране крайне неоднородно [1, 2]. Показано, что различные белки формируют кластеры размером 10–200 нм [1]. Имеется как минимум два непересекающихся типа таких кластеров, различающихся по составу белков, формирующих их [3]. Иными словами, часть мембранных белков всегда располагается в кластерах первого типа, а другая часть – всегда в кластерах второго типа, и белки, формирующие первый тип кластеров, практически никогда не оказываются колокализованы с белками, формирующими второй тип кластеров. При обработке клеточных мембран мягким неионным детергентом в низкой концентрации при низкой температуре (∼4°С) и последующем центрифугировании мембранные белки разделяются на две фракции, соответствующие двум типам кластеров [4]. Помимо различия по белковому составу, фракции различаются также содержанием липидов: сфингомиелин практически полностью распределяется во фракцию низкой плотности, в то время как фракция высокой плотности обогащена ненасыщенными липидами [3, 4]. Холестерин, по разным данным, распределяется либо практически равномерно между фракциями [3, 5], либо имеет некоторое предпочтение к фракции низкой плотности [4]. Предполагается, что белковые кластеры в плазматических мембранах в действительности представляют собой липид-белковые домены, составы которых приблизительно совпадают с составами фракций, получающимися при центрифугировании; при этом домены, обогащенные сфингомиелином и холестерином, называются рафтами [6]. Большой интерес к исследованию рафтов связан с тем, что они оказываются вовлечены в процессы, катализируемые находящимися в них мембранными белками, причем наличие рафтового окружения критично для функционирования белков [2, 7, 8].
Малый размер доменов существенно затрудняет их исследование в клеточных мембранах. В модельных чисто липидных мембранах, состав которых близок к составу наружного монослоя плазматических мембран, при понижении температуры происходит фазовое разделение, в результате которого образуются домены микронных размеров, которые могут изучаться различными экспериментальными методами, в том числе оптическими [3, 5, 9–12]. Такие домены также относительно устойчивы к действию детергента и обогащены сфингомиелином и холестерином; они используются в качестве модели клеточных рафтов [5, 13]. В модельных мембранах было обнаружено, что липид в доменах находится в жидко-упорядоченном (Lo) состоянии, в то время как окружающая мембрана – жидко-неупорядоченная (Ld) [10–12]. Вследствие различия упорядоченности толщина бислоя доменов больше толщины окружающей мембраны [13]. Домены характеризуются относительно высокими модулями упругости [14], и в них понижен коэффициент диффузии [10].
Кластеризация различных белков и липидов в ограниченной области плазматической мембраны необходима для нормального протекания жизненно важных клеточных процессов, в частности слияния и деления мембран [15, 16], передачи клеточных сигналов [17, 18] и т.д. Помимо нормальных физиологических процессов, такая организация липид-белковых платформ является ключевой стадией процессов патологических – сборки новых вирусных частиц на мембранах клетки, инфицированной оболочечными вирусами. Экспериментально было показано, что липидный состав мембраны вирусов гриппа и иммунодефицита практически совпадает с липидным составом рафтовой фазы клеточной мембраны [19]. Предполагается, что сборка новых вирионов происходит на доменах жидко-упорядоченной фазы, в которые должны преимущественно распределяться вирусные мембранные белки. Таким образом, эти белки должны обладать к рафтам выраженным сродством.
В ряде работ высказывалось предположение о том, что сродство различных белков к обогащенным холестерином доменам плазматических мембран может обеспечиваться наличием в их структуре специфических последовательностей аминокислотных остатков, предположительно “узнающих” и связывающих холестерин [20], называемых “CRAC” – cholesterol recognition amino acid consensus [21]. CRAC-мотивы описываются общей формулой -L/V-(X)(1-5)-Y/W-(X)(1-5)-R/K-, где (X)(1-5) обозначает от одного до пяти остатков любых аминокислот, символ “/” обозначает “или”. Такие последовательности были обнаружены в первичной структуре различных белков, распределяющихся в рафтовую фазу клеточных мембран, в том числе кавеолина, мембранных рецепторов [20, 22], а также белка слияния (гемагглютинина) [23] и матриксного белка (М1) вируса гриппа [24]. В работе [25] было показано, что синтетические CRAC-содержащие пептиды, соответствующие 3, 6 и 13-й α-спиралям М1-белка, в разной степени модулируют холестерин-зависимое взаимодействие культивируемых макрофагов IC-21 с 2-мкм частицами. В аналогичных экспериментах было обнаружено, что пептид RTKLWEMLVELGNMDKAVKLWRKLKR-NH2, содержащий два CRAC-мотива из 3-й и 6-й α-спиралей М1-белка, значительно и сложным образом влияет на активность макрофагов IC-21 [26].
В работе [20] было высказано предположение, что наряду с посттрансляционным липидированием белков наличие в их структуре аминокислотных последовательностей, связывающих определенные липидные компоненты, может обуславливать распределение белков в мембранные домены, обогащенные такими компонентами. В качестве такой аминокислотной последовательности рассмотрен CRAC-мотив на примере кавеолина-1 и кавеолина-2, относительно которых было показано, что пальмитирование не является необходимым условием их распределения в кавеолы, мембрана которых находится в рафтовом состоянии [2]. При этом кавеолин-3 не содержит CRAC-мотивов, однако, тем не менее, распределяется в рафты, по-видимому, за счет пост-трансляционного пальмитирования [20]. На основании полученных экспериментальных данных в работе [23] была высказана гипотеза о существенной роли CRAC-мотива в распределении в жидко-упорядоченную фазу мембраны гемагглютинина – белка слияния вируса гриппа. Однако наблюдаемая в экспериментах “контрастность” распределения холестерина по плазматической мембране, как правило, значительно ниже, чем белков, ассоциированных с рафтами [3, 27]. В то же время клеточные домены жидко-упорядоченной фазы значительно обогащены сфингомиелином. Это позволяет предполагать, что CRAC-мотивы могут взаимодействовать также и со сфингомиелином, либо специфическое взаимодействие CRAC-мотивов с холестерином может зависеть от наличия сфингомиелина или других липидов. Насколько нам известно, эти предположения систематически не проверялись.
В настоящей работе методами молекулярной динамики (МД) исследовалось взаимодействие пептидов, содержащих в своей структуре CRAC-мотивы, с липидными молекулами в мембранах различного состава. Проведенное моделирование не позволило выявить у исследуемых пептидов повышенного сродства к холестерину вне зависимости от наличия в системе сфингомиелина. Во всех случаях с пептидами взаимодействует 1–2 молекулы холестерина, что соответствует средней концентрации этого липида в системе. Аналогичные результаты были получены и для взаимодействия пептидов со сфингомиелином. Исследование локализации взаимодействующего с пептидом холестерина также не позволило выявить устойчивых мест связывания – холестерин взаимодействует с остатками, ориентированными внутрь мембраны, и не образует долгоживущих комплексов с пептидом. Полученные результаты позволяют заключить, что наличие в структуре пептида CRAC-мотива само по себе не является универсальным критерием сильного специфического связывания этим пептидом холестерина.
МАТЕРИАЛЫ И МЕТОДЫ
В качестве тестовых пептидов использовались участки третьей и шестой амфипатических спиралей матриксного белка М1 вируса гриппа: пептид p1 = LEVLMEWLKTR, пептид p2 = = NNMDKAVKLYRKLKR (жирным шрифтом выделены аминокислоты, образующие CRAC-мотив), впервые описанные в работе [25] как пептиды, содержащие CRAC-мотивы и охарактеризованные по их влиянию на холестерин-зависимое связывание частиц макрофагами IC-21. Для каждого из этих пептидов проводились МД-симуляции длиной 10 мкс в присутствии липидных бислоев следующих составов: 1) диолеоилфосфатидилхолин (DOPC), 200 липидов, обозначение системы – DOPC; 2) DOPC/холестерин (Chol), 180 молекул DOPC, 20 молекул холестерина, обозначение системы – DOPC/Chol; 3) DOPC/дипальмитоилсфингомиелин (DPSM), 180 молекул DOPC, 20 молекул дипальмитоилсфингомиелина, обозначение системы – DOPC/DPSM; 4) DOPC/DPSM/Chol, 160 молекул DOPC, 20 молекул DPSM, 20 молекул Chol, обозначение системы – DOPC/DPSM/Chol.
Сродство пептидов к различным липидам исследовалось методом молекулярной динамики в крупнозернистом приближении. Расчеты проводились с использованием программы gromacs 2016.3 в силовом поле martini2.2P для расчетов с поляризованной водой [28]. Для расчетов применялись видеокарты NVidia GeForce GTX 1080 (AsusTek Computer Inc., Тайвань), позволяющие рассчитывать приблизительно 0.5 мкс траектории в сутки. Для системы каждого состава рассчитывалась одна траектория длиной 10 мкс. Молекулярные топологии липидов (DOPC, DPSM, Chol) брались из имеющейся базы данных липидов [29]. МД-симуляции производили при постоянной температуре (295 К), поддерживаемой с использованием термостата Нозе–Гувера [30, 31]. В процессе расчета поддерживали давление (полуизотропая схема подстройки) с использованием баростата Паринелло–Рамана [32, 33]. Шаг интегрирования в процессе МД составлял 10 фс. При учете дальнодействующих взаимодействий использовали параметры, рекомендованные для выбранного силового поля: ван-дер-ваальсовы взаимодействия – схема shift с радиусами 0.9/1.2 нм, электростатические взаимодействия – схема shift с радиусами 0.0/1.2 нм. Длительность расчетных траекторий составила 10 мкс. Электростатические взаимодействия рассчитывались с использованием диэлектрической проницаемости среды мембраны ε = 2.5. Исследуемые системы состояли из 200 молекул липидов и приблизительно 20 000 молекул воды. На первом этапе проведены расчеты равновесных состояний бислоев. В стартовой конфигурации каждого монослоя липиды распределялись случайным образом на двумерной сетке с шагом 0.8 нм. Два собранных монослоя комбинировались в бислой таким образом, чтобы расстояние между модельными частицами, включающими атомы фосфора, различных монослоев вдоль нормали к бислою составляло 3.4 нм. В полученную систему добавлялась вода. Модельная система уравновешивалась 100 нс. На втором этапе в водную часть системы добавлялся пептид. После стартового уравновешивания системы, при котором минимизировалась энергия в течение 100 нс при постоянном давлении (полуизотропая схема подстройки) с использованием баростата Берендсена [34], запускался основной расчет МД.
Взаимодействие пептидов с липидами оценивалось путем регистрации контактов пептид–липид. Предполагалось, что липид взаимодействует с пептидом в случае, если расстояние между зернами пептида и липида не превышает заданной отсечки 0.6 нм. Такие контакты анализировали для каждого состояния, полученного в ходе МД с шагом в 0.1 нс. Полученные данные отображали в двух вариантах. В первом случае отображалось общее число молекул липида каждого типа, взаимодействующих с пептидом. Во втором случае строили карты интенсивности контактов аминокислотных остатков пептида с холестерином. При наличии сайтов связывания с холестерином на этих картах должны наблюдаться области, с которыми холестерин взаимодействует на протяжении длительных периодов времени.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
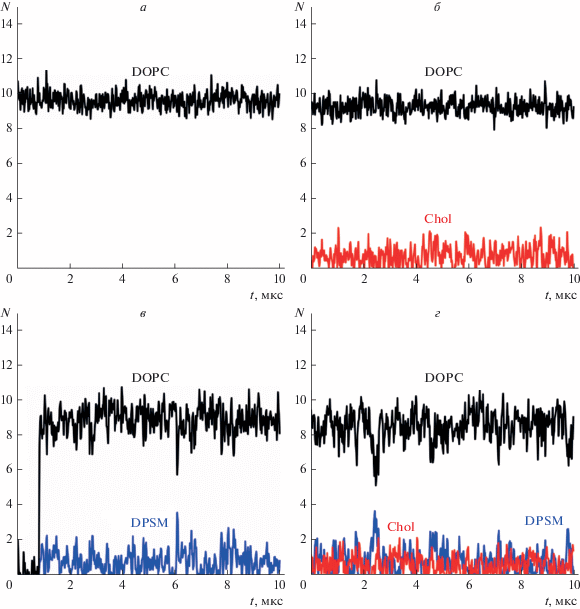
На рис. 1 показана зависимость количества контактирующих с пептидом p1 молекул DOPC (рис. 1а–1г), DPSM (рис. 1в, 1г) и холестерина (рис. 1б, 1г) от времени МД. Из рисунка видно, что среднее количество контактирующих молекул стабилизируется уже после приблизительно 1 мкс динамики (рис. 1в) и остается практически неизменным до конца расчетной траектории. Скачок числа контактов пептида с липидами при t ≈ 1 мкс на рис. 1в связан с тем, что исходно пептид помещался в воду вблизи мембраны; при встраивании пептида в мембрану в момент времени t ≈ 1 мкс количество контактов пептид–липид резко возрастает. Все липидные молекулы были распределены по мембране практически равномерно и не образовывали между собой долгоживущих кластеров (данные не показаны). Среднее количество молекул DPSM и Chol, контактирующих с пептидом, приблизительно соответствует концентрации (мольной доле) этих липидов в мембране. Действительно, в однокомпонентной мембране из чистого DOPC с пептидом контактирует в среднем 10 молекул (рис. 1а). В мембранах состава DOPC/DPSM и DOPC/Chol мольная доля DPSM и Chol составляет 100% × 20/(180 + 20) = = 10%. В этих системах с пептидом контактирует в среднем также десять молекул, из которых девять молекул DOPC и одна молекула DPSM (рис. 1в) или Chol (рис. 1б), в соответствии с мольными долями этих липидов. В мембране состава DOPC/DPSM/Chol 160/20/20 мольная доля DPSM и Chol составляет 10% каждого, а мольная доля DOPC – 80%. В соответствии с этим, в данной системе с пептидом p1 находится в контакте в среднем всего десять молекул, из которых восемь молекул – DOPC, одна молекула – DPSM и одна молекула – Chol (рис. 1г). Из полученных данных можно заключить, что все смоделированные системы (DOPC; DOPC/Chol; DOPC/DPSM; DOPC/DPSM/Chol) являются идеальными в том смысле, что пептид p1 не имеет как предпочтительных (притяжение), так и нежелательных (отталкивание) взаимодействий ни с одним из липидов. Все контакты пептида с липидами являются случайными, и их вероятность пропорциональна мольной доле липида. Если бы пептид в какой-либо мере связывал холестерин, то среднее число контактов пептида с холестерином должно было бы превышать число контактов, пропорциональное мольной доле холестерина в мембране при условии приблизительно равномерного латерального распределения всех липидов. Например, в предельном случае очень сильной долгоживущей связи пептида с одной молекулой холестерина число контактов в среднем должно быть приблизительно на единицу большим, чем в случае идеальной системы.
Рис. 1.
Зависимость количества липидов, контактирующих с пептидом p1, от времени в мембранах состава: а – DOPC; б – DOPC/Chol; в – DOPC/DPSM; г – DOPC/DPSM/Chol. Зависимость количества контактирующих с пептидом молекул DOPC показана черным цветом; Chol – красным цветом; DPSM – синим цветом.
На рис. 2 для пептида p2 показана аналогичная зависимость от времени количества контактирующих липидных молекул: DOPC (рис. 2а–2г), DPSM (рис. 2в, 2г), Chol (рис. 2б, 2г) в мембранах различного состава. Скачок числа контактов пептида с липидами при t ≈ 0.5 мкс на рис. 2а и t ≈ ≈ 3 мкс на рис. 2в связан с тем, что исходно пептид помещался в воду вблизи мембраны; встраивание пептида в мембрану произошло в моменты времени t ≈ 0.5 мкс и t ≈ 3 мкс соответственно, при этом количество контактов пептид–липид с основным липидом (DOPC) резко возросло. Пептид p2 больше (состоит из большего количества аминокислотных остатков), чем пептид p1; соответственно, в мембране из чистого DOPC с пептидом p2 находится в контакте в среднем приблизительно 12 молекул DOPC (ср. рис. 2а и 1а). Так же как и в случае пептида p1, моделированные системы “мембрана + пептид p2” являются идеальными в том смысле, что среднее число контактирующих с пептидом молекул липидов пропорционально их мольной доле. Действительно, в мембране состава DOPC/Chol 180/20 мольная доля холестерина составляет 10%; в такой мембране пептид p2 в среднем контактирует приблизительно с 11 молекулами DOPC и одной молекулой холестерина (рис. 2б). В мембране состава DOPC/DPSM 180/20 мольная доля DPSM также составляет 10%, и пептид p2 находится в контакте в среднем с приблизительно 11 молекулами DOPC и одной молекулой DPSM (рис. 2в).
Рис. 2.
Зависимость количества липидов, контактирующих с пептидом p2, от времени в мембранах состава: а – DOPC; б – DOPC/Chol; в – DOPC/DPSM; г – DOPC/DPSM/Chol. Зависимость количества контактирующих с пептидом молекул DOPC показана черным цветом; Chol – красным цветом; DPSM – синим цветом.
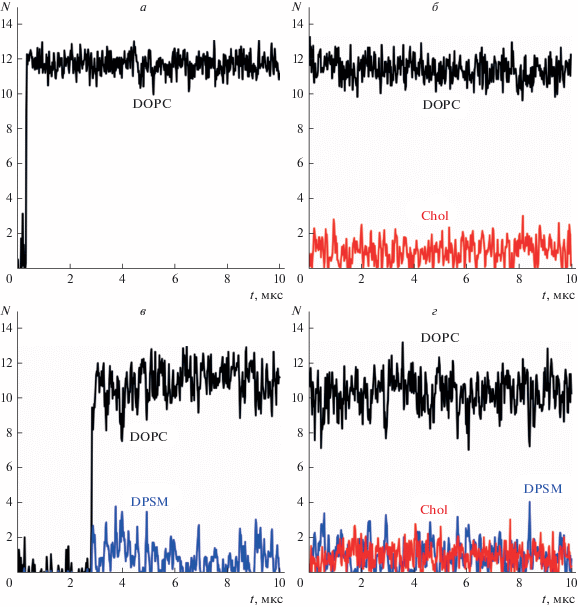
В мембране состава DOPC/DPSM/Chol 160/20/20 мольные доли компонентов составляют 80, 10 и 10% для DOPC, DPSM, Chol соответственно. При этом в контакте с пептидом p2 в среднем находятся приблизительно 10 молекул DOPC, одна молекула DPSM и одна молекула холестерина, пропорционально мольной доле каждого липидного компонента в мембране (рис. 2г). Таким образом, пептид p2 не имеет как предпочтительных (притяжение), так и нежелательных (отталкивание) взаимодействий ни с одним из липидов.
На рис. 3 показаны диаграммы зависимости от времени контактов холестерина с аминокислотными остатками пептидов p1 (рис. 3а, 3б) и p2 (рис. 3в, 3г) в мембранах состава DOPC/Chol (рис. 3а, 3в) и DOPC/DPSM/Chol (рис. 3б, 3г). Контакт какого-либо аминокислотного остатка с холестерином в данный момент времени обозначен на диаграммах вертикальной серой полосой, отсутствие контакта – вертикальной белой полосой.
Рис. 3.
Диаграммы зависимости от времени контактов холестерина с аминокислотными остатками пептидов p1 (а, б) и p2 (в, г) в мембранах состава DOPC/Chol (а, в) и DOPC/DPSM/Chol (б, г). Контакт аминокислотного остатка с холестерином в данный момент времени обозначен на диаграммах вертикальной серой полосой, отсутствие контакта – вертикальной белой полосой.
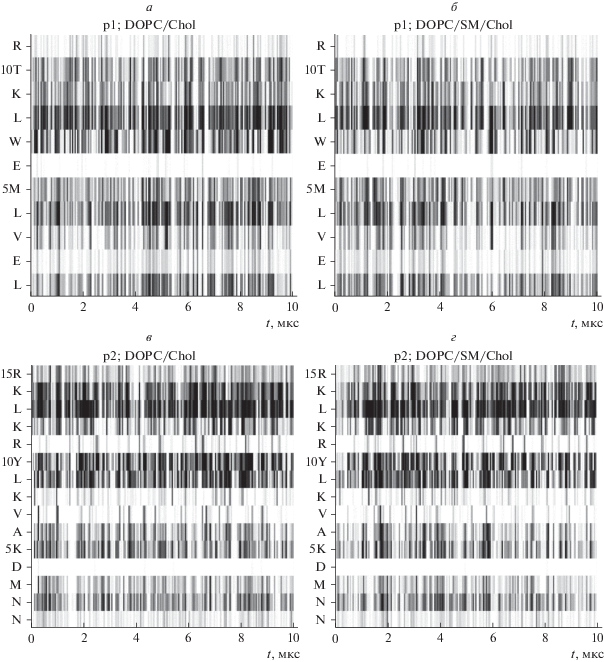
Из рисунка видно, что холестерин взаимодействует преимущественно с гидрофобными аминокислотными остатками, ориентированными внутрь мембраны. При этом ни один из пептидов не имеет устойчивых мест связывания холестерина и не образует с холестерином долгоживущих комплексов. Из того, что характерное время непрерывного нахождения молекулы холестерина вблизи конкретных аминокислотных остатков пептидов относительно мало (<0.4 мкс, см. рис. 3), а среднее число контактирующих с пептидами молекул холестерина пропорционально мольной доле холестерина, можно сделать вывод о случайности взаимодействий пептид-холестерин. Из полученных результатов МД следует, что наличие в структуре пептида CRAC-мотива не является достаточным условием его преимущественного взаимодействия с холестерином.
Каким образом происходит сортировка мембранных белков между Lo- и Ld-фазами мембраны в настоящее время полностью не выяснено. В ряде работ [35–40] систематически исследовалось латеральное распределение трансмембранного белка LAT (Linker for Activation of T-cells) и его различных производных и мутантов. Было обнаружено [39], что предпочтение трансмембранными белками упорядоченной или неупорядоченной фазы определяется тремя особенностями их химической структуры: 1) пост-трансляционная модификация белков (присоединение остатков пальмитиновой или миристиновой кислоты) повышает коэффициент распределения в Lo-фазу; 2) так называемая доступная площадь поверхности трансмембранного домена (ТМД) белка, которая определяется объемом составляющих его аминокислот и коррелирует с диаметром ТМД (меньший диаметр способствует распределению в Lo-фазу); 3) длина ТМД – увеличение длины на одну аминокислоту относительно повышает коэффициент распределения в Lo-фазу приблизительно на 5% [40]. Показано, что такие изменения структуры ТМД белка приводят к приблизительно аддитивным изменениям коэффициента распределения белков между фазами мембраны. Методами молекулярной динамики было показано, что LAT имеет сильное предпочтение к межфазной Lo/Ld-границе [38]. Рассчитанные зависимости энергии (потенциал средней силы) от положения трансмембранного белка относительно межфазной границы хорошо согласуются с аналогичными зависимостями энергии, получаемыми методами континуальной теории упругости [41, 42]. Однако данные работ [35–40] не позволяют объяснить распределение периферических белков между фазами мембраны.
Химическая структура CRAC-мотивов определяется общей формулой: -L/V-(X)(1-5)-Y/W-(X)(1-5)-R/K-, где (X)(1-5) обозначает от одного до пяти остатков любых аминокислот, символ “/” обозначает “или”. Таким образом, CRAC-мотив является амфипатическим, поскольку содержит одновременно заряженные (R/K), ароматические (Y/W) и гидрофобные (L/V) аминокислотные остатки. Ранее в работах [41, 42] теоретически исследовалось преимущественное распределение различных мембранных включений между объемными Lo- и Ld-фазами и межфазной границей. Было показано, что преимущественное распределение в область межфазной Lo/Ld-границы характерно для: 1) всех липидных включений, монослой из которых обладает ненулевой спонтанной кривизной; 2) всех периферических мембранных включений, как амфипатических, так и преимущественно гидрофобных; 3) трансмембранных включений, имеющих нецилиндрическую форму, например “песочных часов” или “бочонка”. Распределение таких мембранных включений на границу домена всегда приводило к понижению граничной энергии. Не имели предпочтения к межфазной границе лишь липидные включения, монослои которых имеют приблизительно нулевую спонтанную кривизну. Кроме того, в объемную Lo- или Ld-фазу предпочитали распределяться цилиндрические трансмембранные включения, длина которых приблизительно совпадала с толщиной липидного бислоя соответствующей фазы [41]. Таким образом, исходя из результатов работ [41, 42], любой периферический пептид, включающий амфипатической CRAC-мотив, должен иметь сильное предпочтение к межфазной Lo/Ld-границе. Для этого пептиду не нужно связываться с холестерином, поскольку движущей силой латерального перераспределения являются взаимодействие индуцируемых пептидом деформаций мембраны, обусловленных амфипатической природой пептида, и деформаций мембраны, возникающих на межфазной Lo/Ld-границе [42, 43]. В трансмембранном пептиде, по-видимому, должна проявляться тенденция к расположению CRAC-мотива вблизи внешних (полярных) границ мембраны, поскольку в мотив входят положительно заряженные аминокислоты (R/K). Характеристические аминокислоты CRAC-мотивов достаточно объемные. Наличие объемных аминокислот в составе трансмембранного участка вблизи поверхностей мембраны может обеспечивать эффективную форму трансмембранного пептида в виде “песочных часов”: большой объем вблизи гидрофильных поверхностей мембраны и малый – в области межмонослойной поверхности. Согласно результатам работы [41], оптимальное положение трансмембранного пептида, имеющего эффективную форму “песочных часов”, – вблизи границы Lo- и Ld-фаз.
Следует отметить, что все рафтозависимые процессы автоматически являются холестерин-зависимыми, однако обратное не верно. Согласно теоретическим результатам работ [41, 42], амфипатические пептиды должны преимущественно распределяться на границу рафтов, изменять их граничную энергию и влиять на свойства ансамбля рафтов. Однако амфипатическая природа пептида не является достаточным условием его влияния на холестерин-зависимые процессы. В работе [26] было показано, что пептид, получающийся объединением пептидов p1 и p2, сильно и сложным образом влияет на холестерин-зависимую активность клеток. При замене ароматических аминокислот в двух CRAC-мотивах на серин влияние пептида практически исчезает [44], хотя замена ароматических аминокислот на серин не изменяет амфипатических свойств пептида.
Ранее в работе [45] исследовалось взаимодействие с мембранами различного состава двух пептидов, содержащих CRAC-мотивы, являющихся частями лейкотоксина LtxA. Исследование проводилось методами полноатомной молекулярной динамики. Был проведен сравнительный анализ связывания пептидов и изменений их вторичной структуры с мембранами, состоящими из чистого димиристоилфосфатидилхолина (DMPC) и смеси DMPC/Chol 60 : 40. Показано, что в мембраны состава DMPC/Chol 60 : 40 оба пептида встраиваются глубже, чем в мембраны из чистого DMPC. При встраивании изменяется вторичная структура пептидов, и эти изменения также выражены сильнее в мембранах состава DMPC/Chol 60 : 40. Однако в данной работе связывание (число контактов) CRAC-мотивов с холестерином напрямую не анализировалось. В принципе, по крайней мере, частично наблюдаемые эффекты могут быть объяснены не специфическим взаимодействием CRAC-мотивов с холестерином, а изменением интегральных свойств мембраны при добавлении холестерина. Встраивание амфипатического пептида в мембрану неизбежно приводит к ее деформации. Энергия возникающих деформаций, в свою очередь, должна влиять на эффективность встраивания и, возможно, итоговую конформацию пептида. Например, в предельном случае очень жесткой мембраны энергия деформаций может быть настолько велика, что пептид вообще не сможет встроиться в мембрану. Известно, что холестерин влияет на толщину и изгибную жесткость мембраны, а также на спонтанную кривизну ее монослоев [13, 14, 46–48]. Эти параметры определяют энергию деформаций, возникающих вблизи встроенного в мембрану амфипатического пептида, и, таким образом, могут влиять на глубину встраивания. В этом случае взаимодействие CRAC-содержащего пептида с мембраной может определяться ее интегральными свойствами, а не эффективностью или специфичностью связывания пептида с холестерином; надежно различить эти два механизма представляется нетривиальной задачей.
В работе [49] методами МД крупнозернистого приближения анализировались сайты преимущественного взаимодействия с холестерином серотонинового рецептора, в структуре которого имеется семь трансмембранных участков и три CRAC-мотива. Было обнаружено, что холестерин в сравнимой степени взаимодействует со всеми трансмембранными спиралями рецептора, причем даже выявленные сайты преимущественного взаимодействия контактируют с молекулами холестерина время, сравнимое со временем занятости других участков трансмембранных спиралей. При этом холестерин многократно связывается (приходит в контакт) с такими сайтами и диссоциирует от них в течение расчетной траектории МД. Повышенное время контакта с холестерином было обнаружено только у одного из трех CRAC-мотивов, причем это время не было максимальным среди выявленных сайтов преимущественного взаимодействия с холестерином. Характерное время взаимодействия трансмембранных спиралей с пальмитоилолеоилфосфатидилхолином (POPC) в мембране состава POPC/Chol 50 : 50 оказалось сравнимым со временем взаимодействия с холестерином, причем связывание конкретного сайта с POPC не исключало его одновременного связывания с холестерином. Таким образом, показано, что селективность выявленных сайтов преимущественного взаимодействия с холестерином невысока.
В работе [50] методами МД крупнозернистого приближения моделировалось взаимодействие с мембранами того же серотонинового рецептора. Был обнаружен всего 41 сайт преимущественных контактов с холестерином, из которых лишь два входили в состав CRAC-мотивов. Количество контактов каждого сайта с холестерином коррелировало с его стерической доступностью для холестерина, т.е. со степенью погружения сайта в гидрофобную часть мембраны и его ориентацией. Для одного из двух сайтов, входящих в состав CRAC-мотива, селективность по отношению к связыванию холестерина оказалась чрезвычайно низкой.
Таким образом, из результатов наших расчетов и имеющихся литературных данных можно заключить, что наличие в составе белка или пептида CRAC-мотива не является универсальным критерием его преимущественного взаимодействия или связывания с холестерином: CRAC-содержащие пептиды или участки белков могут как связывать, так и не связывать холестерин; кроме того, холестерин может связываться и с не содержащими CRAC-мотивы пептидами или участками белков [45, 49, 50]. Преимущественное распределение белков, содержащих в своей структуре CRAC-мотивы, в жидко-упорядоченную фазу мембраны или на ее границу может определяться амфипатической природой этой аминокислотной последовательности, которая обеспечивает определенную молекулярную геометрию пептидов [35–40]. Сильное взаимодействие пептидов, содержащих CRAC-мотивы, с мембранами, в состав которых входит холестерин, помимо специфического взаимодействия CRAC-мотива с холестерином, может также объясняться сильным влиянием холестерина на интегральные физико-химические свойства мембраны, от которых, в свою очередь, зависит характер взаимодействия пептида с мембраной [41, 42, 51].
Работа выполнена при поддержке Министерства науки и высшего образования Российской Федерации, Российского фонда фундаментальных исследований (гранты № 18-04-01363, 20-54-00041), а также при частичной финансовой поддержке гранта Президента Российской Федерации (МК-3119.2019.4).
Список литературы
Lillemeier B.F., Pfeiffer J.R., Surviladze Z., Wilson B.S., Davis M.M. 2006. Plasma membrane-associated proteins are clustered into islands attached to the cytoskeleton. Proc. Natl. Acad. Sci. USA. 103, 18 992–18 997.
Simons K., Ikonen, E. 1997. Functional rafts in cell membranes. Nature. 387, 569–572.
Ayuyan A.G., Cohen F.S. 2008. Raft composition at physiological temperature and pH in the absence of detergents. Biophys. J. 94, 2654–2666.
Edidin M. 2001. Shrinking patches and slippery rafts: Scales of domains in the plasma membrane. Trends Cell Biol. 11, 492–496.
Veatch S.L., Polozov I.V., Gawrisch K., Keller S.L. 2004. Liquid domains in vesicles investigated by NMR and fluorescence microscopy. Biophys. J. 86, 2910–2922.
Pike L.J. 2006. Rafts defined: A report on the Keystone Symposium on lipid rafts and cell function. J. Lip. Res. 47, 1597–1598.
Yang S.T., Kiessling V., Simmons J.A., White J.M., Tamm L.K. 2015. HIV gp41–mediated membrane fusion occurs at edges of cholesterol-rich lipid domains. Nat. Chem. Biol. 11, 424–431.
Allen J.A., Halverson-Tamboli R.A., Rasenick M.M. 2007. Lipid raft microdomains and neurotransmitter signalling. Nat. Rev. Neurosci. 8, 128–140.
Staneva G., Osipenko D.S., Galimzyanov T.R., Pavlov K.V., Akimov S.A. 2016. Metabolic precursor of cholesterol causes formation of chained aggregates of liquid-ordered domains. Langmuir. 32, 1591−1600.
Saitov A., Akimov S.A., Galimzyanov T.R., Glasnov T., Pohl P. 2020. Ordered lipid domains assemble via concerted recruitment of constituents from both membrane leaflets. Phys. Rev. Lett. 124, 108102.
Baumgart T., Hess S.T., Webb W.W. 2003. Imaging coexisting fluid domains in biomembrane models coupling curvature and line tension. Nature. 425, 821–824.
Samsonov A.V., Mihalyov I., Cohen F.S. 2001. Characterization of cholesterol-sphingomyelin domains and their dynamics in bilayer membranes. Biophys. J. 81, 1486–1500.
Rinia H.A., Snel M.M., van der Eerden J.P., de Kruijff B. 2001. Visualizing detergent resistant domains in model membranes with atomic force microscopy. FEBS Lett. 501, 92–96.
Baumgart T., Das S., Webb W.W., Jenkins J.T. 2005. Membrane elasticity in giant vesicles with fluid phase coexistence. Biophys. J. 89, 1067–1080.
Akimov S.A., Molotkovsky R.J., Kuzmin P.I., Galimzyanov T.R., Batishchev O.V. 2020. Continuum models of membrane fusion: Evolution of the theory. Int. J. Mol. Sci. 21, 3875.
Espadas J., Pendin D., Bocanegra R., Escalada A., Misticoni G., Trevisan T., del Olmo A.V., Montagna A., Bova S., Ibarra B., Kuzmin P.I., Bashkirov P.V., Shnyrova A.V., Frolov V.A., Daga A. 2019. Dynamic constriction and fission of endoplasmic reticulum membranes by reticulon. Nat. Comm. 10, 5327.
Bocharov E.V., Mineev K.S., Pavlov K.V., Akimov S.A., Kuznetsov A.S., Efremov R.G., Arseniev A.S. 2017. Helix-helix interactions in membrane domains of bitopic proteins: Specificity and role of lipid environment. Biochim. Biophys. Acta. 1859, 561–576.
Doronin I.I., Vishnyakova P.A., Kholodenko I.V., Ponomarev E.D., Ryazantsev D.Y., Molotkovskaya I.M., Kholodenko R.V. 2014. Ganglioside GD2 in reception and transduction of cell death signal in tumor cells. BMC Cancer. 14, 295.
Polozov I.V., Bezrukov L., Gawrisch K., Zimmerberg J. 2008. Progressive ordering with decreasing temperature of the phospholipids of influenza virus. Nat. Chem. Biol. 4, 248–255.
Epand R.M. 2008. Proteins and cholesterol-rich domains. Biochim. Biophys. Acta. 1778, 1576–1582.
Li H., Papadopoulos V. 1998. Peripheral-type benzodiazepine receptor function in cholesterol transport. Identification of a putative cholesterol recognition/interaction amino acid sequence and consensus pattern. Endocrinology. 139, 4991–4997.
Epand R.M., Sayer B.G., Epand R.F. 2005. Caveolin scaffolding region and cholesterol-rich domains in membranes. J. Mol. Biol. 345, 339–350.
de Vries M., Herrmann A., Veit M. 2015. A cholesterol consensus motif is required for efficient intracellular transport and raft association of a group 2 HA from influenza virus. Biochem. J. 465, 305–314.
Tsfasman T., Kost V., Markushin S., Lotte V., Koptiaeva I., Bogacheva E., Baratova L., Radyukhin V. 2015. Amphipathic alphahelices and putative cholesterol binding domains of the influenza virus matrix M1 protein are crucial for virion structure organization. Virus Res. 210, 114–118.
Дунина-Барковская А.Я., Вишнякова Х.С., Головко А.О., Арутюнян А.М., Баратова Л.А., Батищев О.В., Радюхин В.А. 2018. Амфипатические CRAC-содержащие пептиды-фрагменты белка M1 вируса гриппа модулируют холестерин-зависимую активность макрофагов IC-21. Биохимия. 83, 1236 – 1247.
Дунина-Барковская А.Я., Вишнякова Х.С., Баратова Л.А., Радюхин В.А. 2019. Модуляция холестерин-зависимой активности макрофагов IC-21 пептидом, содержащим два CRAC-мотива из белка M1 вируса гриппа. Биол. мембраны. 36, 271–280.
Frisz J.F., Klitzing H.A., Lou K., Hutcheon I.D., Weber P.K., Zimmerberg J., Kraft M.L. 2013. Sphingolipid domains in the plasma membranes of fibroblasts are not enriched with cholesterol. J. Biol. Chem. 288, 16 855–16 861.
de Jong D.H., Singh G., Drew Bennett W.F., Arnarez C., Wassenaar T.A., Schäfer L.V., Periole X., Tieleman D.P., Marrink S.J. 2013. Improved parameters for the MARTINI coarse-grained protein force field. J. Chem. Theor. Comp. 9, 687–697.
Marrink S.J., Risselada H.J., Yefimov S., Tieleman D.P., de Vries A.H. 2007. The MARTINI force field: Coarse grained model for biomolecular simulations. J. Phys. Chem. B 111, 7812–7824.
Nosé S. 1984. A molecular dynamics method for simulations in the canonical ensemble. Mol. Phys. 52, 255–268.
Hoover W.G. 1985. Canonical dynamics: Equilibrium phase-space distributions. Phys. Rev. A. 31, 1695–1697.
Parrinello M., Rahman A. 1981. Polymorphic transitions in single crystals: A new molecular dynamics method. J. Appl. Phys. 52, 7182–7190.
Nosé S., Klein M.L. 1983. Constant pressure molecular dynamics for molecular systems. Mol. Phys. 50, 1055–1076.
Berendsen H.J.C., Postma J.P.M., DiNola A., Haak J.R. 1984. Molecular dynamics with coupling to an external bath. J. Chem. Phys. 81, 3684–3690.
Levental I., Lingwood D., Grzybek M., Coskun U., Simons K. 2010. Palmitoylation regulates raft affinity for the majority of integral raft proteins. Proc. Natl. Acad. Sci. USA. 107, 22050–22054.
Lorent J.H., Levental I. 2015. Structural determinants of protein partitioning into ordered membrane domains and lipid rafts. Chem. Phys. Lipids. 192, 23–32.
Levental I., Grzybek M., Simons K. 2010. Greasing their way: Lipid modifications determine protein association with membrane rafts. Biochemistry. 49, 6305–6316.
Lin X., Gorfe A.A., Levental I. 2018. Protein partitioning into ordered membrane domains: Insights from simulations. Biophys. J. 114, 1936–1944.
Lorent J.H., Diaz-Rohrer B., Lin X., Spring K., Gorfe A.A., Levental K.R., Levental I. 2017. Structural determinants and functional consequences of protein affinity for membrane rafts. Nat. Commun. 8, 1219.
Diaz-Rohrer B.B., Levental K.R., Simons K., Levental I. 2014. Membrane raft association is a determinant of plasma membrane localization. Proc. Natl. Acad. Sci. USA. 111, 8500–8505.
Pinigin K.V., Kondrashov O.V., Jiménez-Munguía I., Alexandrova V.V., Batishchev O.V., Galimzyanov T.R., Akimov S.A. 2020. Elastic deformations mediate interaction of the raft boundary with membrane inclusions leading to their effective lateral sorting. Sci. Rep. 10, 4087.
Пинигин К.В., Воловик М.В., Батищев О.В., Акимов С.А. 2020. Взаимодействие границ упорядоченных липидных доменов и амфипатических пептидов регулирует вероятность образования пор в мембранах. Биол. мембраны. 37, 337–349.
Галимзянов Т.Р., Молотковский Р.Ю., Кузьмин П.И., Акимов С.А. 2011. Стабилизация бислойной структуры рафтов за счет упругих деформаций мембраны. Биол. мембраны. 28, 307–314.
Дунина-Барковская А.Я., Вишнякова Х.С. 2020. Модуляция холестерин-зависимой активности макрофагов IC-21 CRAC-содержащими пептидами с заменами мотивообразующих аминокислот. Биол. мембраны. 37, 381–395.
Miller C.M., Brown A.C., Mittal J. 2014. Disorder in cholesterol-binding functionality of CRAC peptides: A molecular dynamics study. J. Phys. Chem. B. 118, 13169–13174.
Evans E., Rawicz W. 1990. Entropy-driven tension and bending elasticity in condensed-fluid membranes. Phys. Rev. Lett. 64, 2094.
Gandhavadi M., Allende D., Vidal A., Simon S.A., McIntosh T.J. 2002. Structure, composition, and peptide binding properties of detergent soluble bilayers and detergent resistant rafts. Biophys. J. 82, 1469–1482.
Kollmitzer B., Heftberger P., Rappolt M., Pabst G. 2013. Monolayer spontaneous curvature of raft-forming membrane lipids. Soft Matter. 9, 10877–10884.
Sengupta D., Chattopadhyay A. 2012. Identification of cholesterol binding sites in the serotonin1A receptor. J. Phys. Chem. B. 116, 12991–12996.
Ferraro M., Masetti M., Recanatini M., Cavalli A., Bottegoni G. 2016. Mapping cholesterol interaction sites on serotonin transporter through coarse-grained molecular dynamics. PloS One. 11, e0166196.
Карпунин Д.В., Акимов С.А., Фролов В.А. 2005. Формирование пор в плоских липидных мембранах, содержащих лизолипиды и холестерин. Биол. мембраны. 22, 429–432.
Дополнительные материалы отсутствуют.
Инструменты
Биологические мембраны: Журнал мембранной и клеточной биологии


