Биологические мембраны: Журнал мембранной и клеточной биологии, 2021, T. 38, № 5, стр. 374-387
Нейродегенерация альцгеймеровского типа. Возможная коррекция ухудшения памяти при внутривенном введении препарата экзосом
Р. А. Полтавцева a, *, Н. В. Бобкова b, Д. Ю. Жданова b, Е. В. Свирщевская a, c, Г. Т. Сухих a
a Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии
им. академика В.И. Кулакова Министерства здравоохранения РФ
117997 Москва, Россия
b Институт биофизики клетки РАН, ФИЦ ПНЦБИ РАН
142290 Московская обл., Пущино, Россия
c Институт биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова РАН
117997 Москва, Россия
* E-mail: rimpol@mail.ru
Поступила в редакцию 02.03.2021
После доработки 16.05.2021
Принята к публикации 16.05.2021
Аннотация
Болезнь Альцгеймера (БА) остается одной из социально значимых патологий, при которой до сих пор отсутствует эффективная терапия. Целью данной работы являлся анализ эффективности внутривенного (в/в) введения экзосом из кондиционированной среды, полученной при культивировании мультипотентных мезенхимальных стромальных клеток Вартонова студня пупочного канатика человека. Экзосомы выделяли с помощью колоночной фильтрации в гравитационном поле и характеризовали по экспрессии специфичных маркеров и связыванию с клетками фибробластов мыши L929 in vitro. На модели спорадической формы БА было показано, что в/в введение экзосом предотвращало ухудшение пространственной памяти у ольфакторно бульбэктомированных мышей (ОБЭ). Терапевтический эффект, по-видимому, обусловлен способностью экзосом проникать в мозг ОБЭ животных, что было подтверждено визуализацией флуоресцентно-меченных экзосом в коре и гиппокампе после их в/в введения.
ВВЕДЕНИЕ
Болезнь Альцгеймера (БА) – неизлечимое прогрессирующее нейродегенеративное заболевание, при котором происходит постепенная потеря памяти и ухудшение когнитивных функций [1–3]. Считается, что накопление белка бета-амилоида (Aβ) является ключевым событием в патогенезе БА [1]. Предполагается, что к 2050 году число заболевших БА может достичь 100 миллионов человек, если не будут найдены подходы к лечению, которые способны остановить или замедлить прогрессирование заболевания [4–6]. Одной из причин неудач в разработке эффективных средств лечения этого тяжелого недуга является отсутствие валидированных моделей in vivo наиболее распространенной ненаследственной спорадической формы БА. Ольфакторно бульбэктомированные (ОБЭ) животные демонстрируют основные поведенческие, морфологические, биохимические и иммунологические признаки, характерные для развития БА у человека, что позволяет их использовать как модель данного заболевания [7, 8].
Среди разрабатываемых терапевтических подходов к лечению БА и других нейродегенеративных заболеваний особое место принадлежит клеточной терапии, основанной на использовании трансплантации различных клеток донора в организм реципиента [9, 10]. Наиболее изученными для использования в регенеративной медицине являются мультипотентные мезенхимальные стромальные клетки (ММСК), которые получили широкую известность за счет своей способности направленной миграции в поврежденный орган и участию в его восстановлении [11, 12]. Так, Zhao-Hong Xie и соавт. в своем исследовании на трансгенной APP/PS1 модели БА [13] показали, что после внутривенного (в/в) введения мультипотентных мезенхимальных стромальных клеток из Вартонова студня пупочного канатика (ММСК-ВС) человека происходило значительное улучшение пространственного обучения и замедление ухудшения памяти, что было вызвано уменьшением отложения Aβ и понижением уровня его растворимой формы.
Однако в настоящее время известно, что положительный эффект обусловлен не столько за счет выживания трансплантированных ММСК и их последующей дифференцировки, а главным образом за счет выделяемых ими растворимых факторов, которые включают белковую и везикулярную фракции [9, 14–16]. Белковая фракция содержит различные пептиды, цитокины и ростовые факторы, а везикулярная включает экстраклеточные везикулы, которые подразделяют на микровезикулы и экзосомы [14, 17].
Экзосомы – мембранные образования, диаметром 30–100 нм, представляющие собой биологические наноконтейнеры, которые принимают участие в различных физиологических процессах, перенося заключенные в их составе белки, нуклеотиды и аминокислоты, жирные кислоты, мРНК, микроРНК и другие биологически активные соединения к клеткам-реципиентам, тем самым принимая участие в межклеточной коммуникации [6, 17, 18]. Кроме того, экзосомы лишены таких отрицательных свойств ММСК, как необходимость их иммунологической совместимости с тканью реципиента [10, 19].
В данной работе предпринята попытка визуализации проникновения в мозг меченых экзосом, выделенных из ММСК-ВС, при их системном в/в введении с особым вниманием на возможность их локализации в гиппокампе и височной коре, в структурах мозга, принимающих участие в обучении и памяти. А также оценен терапевтический эффект экзосом на состояние пространственной памяти на модели спорадической формы болезни Альцгеймера у ОБЭ мышей.
МАТЕРИАЛЫ И МЕТОДЫ
Получение ММСК из Вартонова студня ткани пупочного канатика и их характеристика. Первичная культура ММСК была выделена из Вартонова студня ткани пупочного канатика. Забор материала производился с письменного информированного согласия здоровых обследованных рожениц после операции кесарева сечения. Дальнейшее выделение ММСК проводили в соответствии с протоколом, описанным нами ранее [20]. Культивирование клеток проводили в атмосфере 5% CO2 при 37°С в среде DMEM/F12 (1 : 1, Gibco, США) с добавлением 10% фетальной телячьей сыворотки, 2 мM L-глутамина, 100 ед/мл пенициллина и 100 мкг/мл стрептомицина (ПанЭко, Россия) в культуральных флаконах 25 см2 (Сorning, США). Смену среды на 50% проводили, как правило, через трое суток. При достижении состояния 80% конфлюэнтности клетки пассировали в соотношении 1 : 2. Для снятия клеток с поверхности пластика применяли 0.05% раствор трипсина (ПанЭко). Экспрессию поверхностных маркеров ММСК анализировали с помощью проточной цитометрии с использованием первичных антител, конъюгированных с фикоэритрином (PE), к CD90, CD105, CD73, CD19, HLA-DR и конъюгированных с FITC HLA-ABC (BD, США), согласно протоколу фирмы-производителя [21]. Измерения проводили на приборе FACSCalibur (BD, США).
Выделение экзосом из культуральной жидкости ММСК-ВС и их характеристика. Для выделения экзосом использовали кондиционированную среду (КС), полученную при культивировании ММСК-ВС третьего пассажа. При достижении состояния 80% конфлюэнтности монослой отмывали 0.9% физиологическим раствором (ФР), добавляли бессывороточную среду DMEM/F12 (Thermo, США), 2 мM L-глутамина, 100 ед/мл пенициллина и 100 мкг/мл стрептомицина. Клетки культивировали в течение двух суток при 37°C в атмосфере 5% CO2, затем отбирали КС, центрифугировали 10 мин при 200 g с целью удаления клеточного дебриса. Полученную КС использовали для выделения экзосом, которое осуществляли при помощи коммерческого набора для ультрафильтрации Exo:pure (Prostagnost, Россия) согласно протоколу производителя.
Наличие экзосом в выделенной фракции подтверждали с использованием антител к CD9, СD63 и CD81 человека, конъюгированных с PE, APC и FITC соответственно (Miltenyi Biotec, Германия), которые являются специфичными трансмембранными маркерами экзосом [22–24]. Образцы экзосом инкубировали с антителами 60 мин при 4°C, после чего 1 раз отмывали методом центрифугирования при 38 000 g в течение 20 мин и анализировали на цитофлуориметре.
Для анализа проникновения экзосом в головной мозг и их локализации экзосомы окрашивали 1,1'-dioctadecyl-3,3,3',3'-tetramethylindocarbocyanine perchlorate (Dil, Invitrogen, США). Для окрашивания 1 мл экзосом инкубировали с 10 мкл 20 мМ Dil в течение 20 мин, затем 3 раза отмывали ФР с центрифугированием 38 000 g в течение 20 мин. Полученный осадок растворяли в 1 мл ФР.
Для визуализации экзосом использовали клетки фибробластов мыши L929, которые культивировали в атмосфере 5% СО2 при 37°С в среде RPMI-1640 с добавлением 7% фетальной телячьей сыворотки, 2 мM L-глутамина, 100 ед/мл пенициллина и 100 мкг/мл стрептомицина на стерильных покровных стеклах до состояния адгезии. В культуры вносили меченные Dil экзосомы и инкубировали 1 ч при 37°C в атмосфере CO2. Для контрастного окрашивания мембран клеток в последние 10 мин вносили маркер аппарата Гольджи BODYPI-C7-Cer (Sigma, США) и ядерный краситель DAPI (Sigma). По окончании инкубации клетки фиксировали 2% параформальдегидом (Sigma), отмывали ФР и заливали полимеризующей средой Mowiol 4.88 (Calbiochem, США). Анализ проводили на конфокальном микроскопе Eclipse TE2000 (Nikon).
Изучение проникновения экзосом в головной мозг мышей после в/в введения. Для оценки возможного проникновения и распределения экзосом в головном мозге мышей при в/в введении раствор флуоресцентно-меченых экзосом или ФР в объеме 10 мкл/мышь, содержащих приблизительно 108 экзосом, вводили в/в в хвостовую вену заранее подготовленных групп 6-месячных мышей-самцов линии NMRI весом 25–30 г. Спустя 4 ч после введения экзосом мышам вводили внутрибрюшинно летальную дозу нембуталового наркоза (60 мг/кг) и осуществляли транскардиальную перфузию мозга охлажденным ФР. Мозг быстро извлекали на холоде и помещали в 4% раствор параформальдегида для дальнейшего проведения гистологического анализа. С этой целью готовили фронтальные срезы мозга толщиной 30 мкм на микротоме Техном МЗП-01 (Россия). Для анализа распределения экзосом в мозге использовали флуоресцентную и световую микроскопию (Leica DM 6000 B, Германия).
Модель спорадической формы болезни Альцгеймера на мышах. Для проведения экспериментов по анализу возможности проникновения используемых экзосом в головной мозг, а также по изучению влияния в/в введения препарата экзосом на пространственную память были отобраны 6-месячные мыши-самцы линии NMRI весом 25–30 г. Содержание мышей осуществлялось по 5–6 особей в клетке со свободным доступом к воде и стандартизированному корму в условиях естественной освещенности при температуре воздуха 21–23°С. Все исследования проводились в полном соответствии с Руководством по содержанию и уходу за лабораторными животными и правилами надлежащей лабораторной практики (приказ МЗ РФ от 01.04.2016 г., № 199н).
Удаление обонятельных луковиц проводили путем их двухсторонней аспирации через трепанационное отверстие в черепе со стереотаксическими координатами AP – 3, LM – 0, H – 2.5 в стерильных условиях у животных, которые находились под нембуталовым наркозом (40 мг/кг, внутрибрюшинно). При проведении процедуры скальпирования для местного обезболивания подкожно вводили 0.5% раствор новокаина. Контрольными животными являлись ложнооперированные (ЛО) мыши, подвергнутые аналогичной процедуре, за исключением удаления обонятельных луковиц. По окончании операции для профилактики развития инфекции каждому животному в мышцу задней лапы вводили антибиотик бициллин 5 в дозе 6000 ед.
Изучение эффекта в/в введения экзосом на пространственную память. Все животные были распределены по группам, включающим по 5–6 мышей в каждой: контрольные ольфакторно бульбэктомированные (ОБЭ + ФР) и ложнооперированные мыши с в/в введением ФР (ЛО + ФР); ольфакторно бульбэктомированные (ОБЭ + ЭКЗ) и ложнооперированные (ЛО + ЭКЗ) мыши с в/в введением раствора экзосом. Спустя две недели после операции начинали в/в введение раствора экзосом или ФР, которое осуществляли 2 раза в неделю в течение 3 недель.
Для проведения исследований по определению эффекта в/в введения раствора экзосом из ММСК-ВС животным вводили по 10 мкл раствора экзосом в ФР, содержащих приблизительно 108 экзосом, или только ФР в хвостовую вену животного. Через две недели после первого из шести введений экзосом начинали обучение ЛО и ОБЭ животных пространственному навыку в водном лабиринте Морриса. Для этой цели применялся круглый бассейн диаметром 80 см и глубиной 30 см, заполненный водой, с температурой 23°С. Площадь бассейна условно делилась на четыре равных сектора, в один из которых (третий отсек) при обучении помещалась спасательная платформа 5 см в диаметре, которую на 0.5 см погружали под поверхность воды. Для того чтобы животное не могло визуально обнаружить спасательную платформу, вода забелялась раствором сухого молока. До начала обучения в условиях видимой спасательной платформы у животных проверяли умение плавать и сохранность зрения. Смысл обучения состоял в том, чтобы за время теста животное могло найти спасательную платформу и по внешним визуальным стимулам окружающей обстановки запомнить ее местоположение в бассейне. Общая продолжительность обучения составляла пять дней по 4 ежедневных одноминутных сеанса. Скорость обучения оценивали по величине уменьшения латентного периода нахождения скрытой платформы. По истечению суток с момента окончания обучения осуществляли тестирование уровня пространственной памяти в течение одной минуты, но уже в условиях отсутствия спасательной платформы. Состояние пространственной памяти анализировали по двум параметрам: по времени пребывания животного в каждом секторе, а также по количеству заходов в каждый сектор бассейна, выраженному в процентах от общего числа посещений. После завершения поведенческого тестирования проводили морфоконтроль на полноту удаления обонятельных луковиц у ОБЭ мышей. Для статистической обработки данных использовали однофакторный анализ ANOVA с последующим post-hoc анализом с применением критерия Tukey’s HSD, а также двухсторонний критерий Стьюдента. Данные представлены как M ± m. Различия считались значимыми при p < 0.05.
РЕЗУЛЬТАТЫ
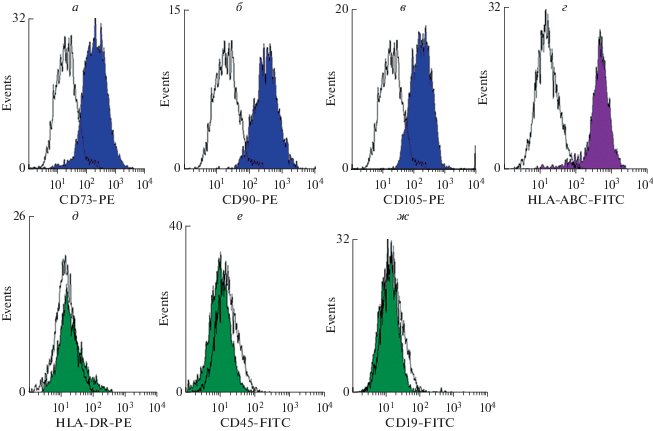
Характеристика экзосом ММСК-ВС. Одной из основных характеристик ММСК является экспрессия маркеров CD73, CD90 и CD105 и отсутствие экспрессии лимфоидных маркеров [21, 25]. Анализ экспрессии специфичных маркеров проводили методом проточной цитометрии. Показали, что ММСК-ВС экспрессируют CD73, CD90 и CD105, HLA-ABC и не экспрессируют ряд лимфоидных маркеров (рис. 1).
Рис. 1.
Анализ экспрессии поверхностных маркеров ММСК Вартонова студня. Экспрессия специфичных маркеров ММСК CD73 (а), CD90 (б), CD105 (в) и HLA-ABC (г); отсутствие экспрессии маркеров лимфоидных клеток HLA-DR (д), CD45 (е) и CD19 (ж) клетками ММСК Вартонова студня.
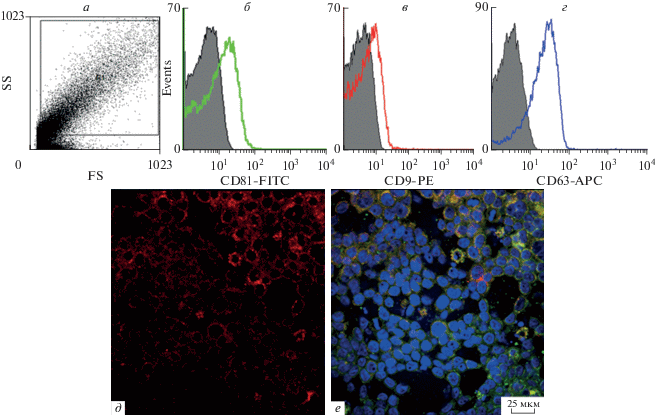
Выделение экзосом проводили методом колоночной фильтрации в гравитационном поле. Экзосомы концентрировали из 25 мл культуральной среды в 1 мл. Принадлежность выделенных микрочастиц к экзосомам оценивали по наличию на их поверхности специфических маркеров экзосом – CD9, CD63 и CD81 [12, 21]. Анализ экспрессии данных маркеров проводили методом проточной цитометрии и показали, что экзосомы, полученные из культуральной жидкости при культивировании ММСК-ВС максимально экспрессируют CD63 (рис. 2г), в меньшей степени маркеры CD81 (рис. 2б) и CD9 (рис. 2в).
Рис. 2.
Характеристика экзосом ММСК-ВС. а–г: Анализ экспрессии специфичных маркеров экзосом CD81 (б), CD9 (в) и CD63 (г) проводили в окне мелких объектов (а). Аутофлуоресценция показана на серой гистограмме. Сдвиг по оси абсцисс соответствует экспрессии маркеров (цветные гистограммы). д–е: Связывание экзосом с мембранами клеток фибробластов L929. Клетки культивировали на покровных стеклах, инкубировали с экзосомами (д, красные), дополнительно окрашивали мембраны маркером аппарата Гольджи (е, зеленый). Ядра окрашены DAPI (синий). Колокализация экзосом с мембранами клеток (е, желтый). Шкала – 25 мкм.
Изучение локализации флуоресцентно окрашенных экзосом в отделах головного мозга мышей. Прежде всего необходимо было исследовать возможность проникновения экзосом в мозг при их в/в введении, и в частности, в такие отделы головного мозга, как гиппокамп и неокортекс, поскольку преимущественно в этих структурах наблюдается гибель нейронов при БА.
Мы показали, что при в/в введении экзосом из ММСК-ВС флуоресцентные частицы обнаруживаются в гиппокампе и неокортексе, что свидетельствует о проникновении экзосом в мозговую паренхиму через гематоэнцефалический барьер [26, 27]. На рис. 3 представлены микрофотографии срезов мозга мышей через 4 ч после в/в введения флуоресцентно меченных экзосом.
Рис. 3.
Примеры распределения экзосом, меченных флуоресцентным красителем Dil, в неокортексе (а, б) и гиппокампе (в, г) ОБЭ (а, в) и ЛО (б, г) мышей через 4 ч после внутривенного введения. Шкала – 25 мкм. На микрофотографиях представлены участки мозга в проходящем свете с наложением соответствующих флуоресцирующих частиц.

На репрезентативных микрофотографиях срезов мозга контрольных животных, которым в/в вводился только ФР, подобное свечение микрочастиц отсутствовало (рис. 4). Таким образом, нами был доказан факт возможности проникновения в головной мозг экзосом из ММСК-ВС при их в/в введении.
Рис. 4.
Репрезентативные микрофотографии срезов неокортекса (а, б) и гиппокампа (в, г) контрольных ЛО (а, в) и ОБЭ (б, г) мышей через 4 ч после внутривенного введения ФР. Шкала – 25 мкм.

Эффект внутривенного введения экзосом ММСК-ВС на пространственную память ОБЭ мышей. В рамках данного исследования проведен анализ эффективности влияния в/в введения экзосом из ММСК-ВС человека на пространственную память ОБЭ мышей, моделирующих спорадическую форму БА.
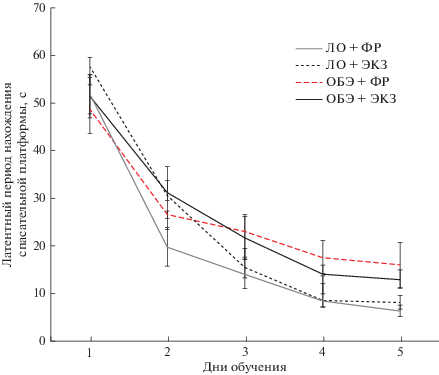
В процессе обучения, проводимого через 4 недели после бульбэктомии или ложной операции, у всех групп экспериментальных животных наблюдалось ежедневное снижение латентного периода нахождения платформы. Было установлено, что в/в введение экзосом не оказывало влияния на способность к пространственному обучению ЛО и ОБЭ животных, о чем свидетельствует отсутствие достоверных различий (p > 0.05) латентных периодов нахождения спасательной платформы у групп ЛО + ФР и ЛО + ЭКЗ, и ОБЭ + ФР и ОБЭ + ЭКЗ в водном лабиринте Морриса ни в один из пяти дней обучения (рис. 5). Важно отметить, что обученность животных перед тестированием памяти у всех групп животных была одинакова, что подтверждается отсутствием достоверных различий (p > 0.05) латентных периодов обнаружения спасательной платформы на пятый день обучения.
Рис. 5.
Динамика латентного периода нахождения спасательной платформы в водном лабиринте Морриса в ходе обучения экспериментальных групп животных в контроле и после в/в введения экзосом ММСК-ВС. Данные представлены как M ± m.
Результаты факторного анализа данных по тестированию пространственной памяти в водном лабиринте Морриса приведены в табл. 1 и на рис. 6.
Таблица 1.
Данные факторного анализа групп животных после в/в введения
| Группа | Значение фактора выделения секторов при тестировании памяти | |||
|---|---|---|---|---|
| по времени пребывания | по количеству заходов | |||
| фактор F | достоверность p < | фактор F | достоверность p < | |
| ЛО + ФР (n = 5) | 45.6 | 0.001 | 63.3 | 0.001 |
| ЛО + ЭКЗ (n = 6) | 18.7 | 0.001 | 27.1 | 0.001 |
| ОБЭ + ФР (n = 6) | 13.4 | 0.001 | 2.46 | 0.1 |
| OБЭ + ЭКЗ (n = 6) | 8.99 | 0.001 | 16.1 | 0.001 |
Рис. 6.
Влияние внутривенного введения экзосом из ММСК-ВС на пространственную память ольфакторно бульбэктомированных мышей: по времени нахождения (а) и числу заходов (б) групп мышей в сектора водного лабиринта Морриса. 1–4 – сектора лабиринта, 3 – сектор с платформой во время обучения. Достоверность различия данных в сравнении с 3 сектором с использованием критерия Tukey: * р < 0.05; ** p < 0.01; *** p < 0.001.
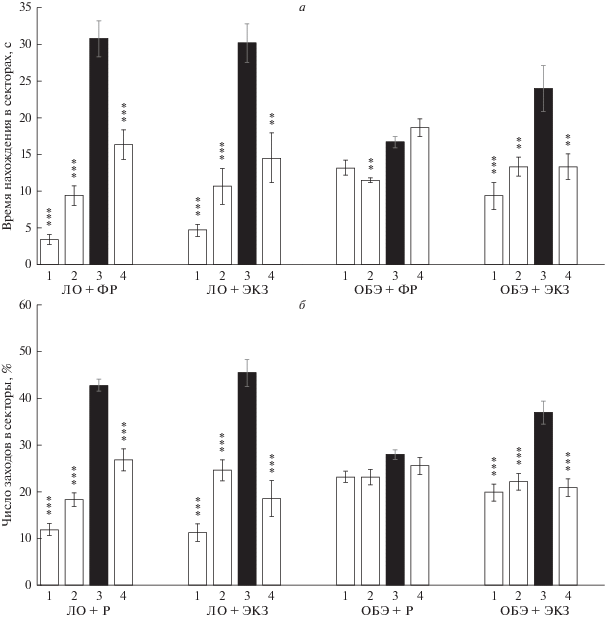
Время нахождения в третьем секторе лабиринта Морриса у групп животных: ЛО + ФР, ЛО + ЭКЗ, ОБЭ + ФР и ОБЭ + ЭКЗ составило (с): 30.8 ± 2.4, 30.2 ± 2.7, 16.7 ± 0.8 и 24 ± 3.1 соответственно. Соотношение количества заходов в третий сектор обучения к общему числу заходов во все сектора водного лабиринта (%): 42.8 ± 1.3, 45.5 ± 2.9, 28 ± 0.9 и 37 ± 2.4 для групп ЛО + ФР, ЛО + ЭКЗ, ОБЭ + ФР и ОБЭ + ЭКЗ соответственно.
Анализ результатов состояния пространственной памяти показал, что в обеих группах ЛО мышей – ЛО + ФР и ЛО + ЭКЗ животные достоверно отличали сектор обучения от индифферентных секторов как по времени нахождения, так и по числу заходов в него, что свидетельствует об отсутствии отрицательного влияния вводимого препарата экзосом на пространственную память животных. Контрольная группа ОБЭ мышей, которым вводился только ФР, во время тестирования показала нарушение способности узнавать сектор обучения. Вместе с тем группа ОБЭ мышей, которым в/в шестикратно вводили раствор экзосом, характеризовалась достоверным предпочтением третьего таргетного сектора бассейна по обоим показателям оценки пространственной памяти (рис. 6). Таким образом, на модели спорадической формы БА было показано, что вводимые экзосомы способны замедлять процесс ухудшения памяти у ОБЭ животных, демонстрирующих характерные признаки данного заболевания.
ОБСУЖДЕНИЕ
В нашем исследовании было показано, что внутривенное введение экзосом, секретируемых ММСК-ВС, имеет выраженный терапевтический эффект, препятствуя потере пространственной памяти у ОБЭ мышей – модели спорадической формы БА. Известно, что ОБЭ мыши характеризуются развитием симптомокомплекса, сходного с наблюдаемым при БА и включающего ухудшение памяти, развитие депрессивно-подобного состояния, что происходит на фоне дефицита ацетилхолин- и серотонинергической систем мозга [28]. Причиной наблюдаемых изменений является развитие нейродегенеративного процесса, сопровождающегося гибелью нейронов в височной коре и полях гиппокампа, а также повышением уровня мозгового Aβ [29]. Ранее мы показали, что внутримозговое и в/в введение ММСК, выделенных из фетального мозга, также купировало развитие ухудшения памяти и повышало нейрональную плотность в гиппокампе ОБЭ мышей [30]. Позитивные эффекты трансплантации ММСК, выделенных из разных источников, были неоднократно показаны на моделях БА и другими исследователями [9, 31, 32].
В настоящее время пристальное внимание уделяется экзосомам, выделенным из ММСК. Предполагается, что действие ММСК в основном опосредовано их экзосомами, которые вызывают эффекты, подобные родительским клеткам [33–35]. При выборе тканевого источника ММСК для выделения экзосом, мы, прежде всего, руководствовались наличием у этих клеток нейропротективного потенциала, обусловленного повышенным уровнем экспрессии нейротрофических и нейроростовых факторов NGF и BDNF, наряду с устойчивостью к стрессу при их выделении и культивировании. ММСК-ВС полностью отвечают этим критериям [36]. Среди отличительных маркеров экзосом выделяют белки семейства тетраспанинов: CD63, CD9, CD37, CD81, и CD82. Известно, что данные белки отсутствуют в других типах везикул [26, 36]. Существуют различные методы выделения экзосом: ультрацентрифугирование, ультрафильтрация, эксклюзионная хроматография, осаждение, методы, основанные на иммуноафинном связывании, а также различные способы в области микрофлюидики [37]. Каждый из перечисленных методов характеризуется своими достоинствами и недостатками, так что выбор конкретного метода выделения экзосом определяется конечной целью их использования. Для характеристики экзосом часто применяются методы анализа: вестерн-блот и иммуноферментный анализ, а также проточная цитометрия. Основным преимуществом первых двух методов является возможность обнаружения характерных для экзосом белков, их размера и количества, однако такие недостатки как низкая специфичность и высокая стоимость проведения процедур, делает более привлекательным метод проточной цитометрии, который отличается своей быстротой, воспроизводимостью, специфичностью и низкой стоимостью [17, 25]. Характеристика частиц, выделяемых ММСК-ВС, используемых в нашем эксперименте, свидетельствует об их принадлежности к экзосомам (рис. 2), поскольку они экспрессировали специфичные маркеры экзосом CD9, CD63 и CD81 [38]. Перечисленные маркеры являются трансмембранными белками, которые задействованы в биогенезе экзосом, поскольку клетки нокаутных по CD9, CD63 мышей характеризуются сниженным количеством выделяемых экзосом [39, 40].
Известно, что использование экзосом, выделенных из разных источников ММСК, оказывало терапевтический эффект как на in vitro и in vivo моделях БА [1, 33], так и на модели индуцибельного поражения нейронов гиппокампа [41]. В нашем исследовании in vivo на модели спорадической формы БА на ОБЭ животных мы впервые показали, что позитивным эффектом обладают и экзосомы, выделенные из ММСК-ВС, при их в/в введении. Наши данные согласуются с результатами других исследователей эффектов в/в введения экзосом из ММСК, полученных из различных типов ткани, наблюдавших функциональное восстановление нарушений в мозге, вызванном индуцированным инсультом или экспериментальной травмой мозга на фоне усиления ремоделирования нейритов, активации нейрогенеза и восстановления нейрональной пластичности [42–44]. Эти факты являются косвенным подтверждением, что в/в введение экзосом является эффективным для восстановления функций центральной нервной системы (ЦНС).
В нашем исследовании флуоресцентно окрашенные экзосомы после в/в введения обнаружены в ткани мозга, что доказывает способность этих частиц преодолевать гематоэнцефалический барьер. Указанное свойство экзосом обеспечивает широкие возможности их применения для терапии нарушений в ЦНС. Такие структуры головного мозга как гиппокамп и неокортекс были выбраны нами не случайно, поскольку известно, что при БА происходит недиффузное развитие амилоидогенеза во всем мозге, а появление амилоидных бляшек наблюдается в отделах прямо или опосредованно связанных с системой обоняния [45], в число которых входят рассматриваемые нами отделы. Факт возможности проникновения вводимых нами экзосом из ММСК в головной мозг при в/в введении важен также ввиду того, что гиппокамп и неокортекс играют ключевую роль в выполнении важнейших когнитивных процессов: восприятии, обучении, памяти, и поражаются в первую очередь при БА [46–48].
Однако наши результаты по визуализации меченых экзосом в мозге после их в/в введения, как и немногочисленные данные других авторов, свидетельствуют о незначительном количестве проникающих в мозг экзосом. Детальное исследование распределения экзосом после их в/в введения показывает, что основное их количество остается в печени, селезенке и легких [49].
Наш метод in vivo исследования, к сожалению, не позволял определить тип клеток-мишеней, с которыми экзосомы взаимодействуют при их попадании в мозг. Однако по данным других исследователей экзосомы, выделенные из стволовых клеток пульпы зуба человека, способствуют восстановлению деятельности дофаминергических нейронов, подвергнутых апоптотическому действию 6-гидроксидофамина [50]. В специальном исследовании, в котором культуру клеток гиппокампа обрабатывали олигомерной формой Aβ и экзосомами ММСК-ВС, показали, что экзосомы локализовались в основном в астроцитах, а не в нейронах [14]. В другой работе на модели травматического поражения мозга, где исследовались эффекты внутримозгового введения экзосом, выделенных из ММСК жировой ткани, путем двойного флуоресцентного окрашивания срезов мозга было установлено, что экзосомы входили в микроглию и макрофаги и через подавление их активации вызывали торможение воспаления [35]. Эффект экзосом, выделенных из ММСК костного мозга, на когнитивные функции при развитии диабета был обусловлен вхождением экзосом в поврежденные нейроны и астроциты [51]. Интересно отметить, что в условиях кислородного или глюкозного дефицита экзосомы, выделяемые олигодендроцитами, входили в нейроны и повышали их выживаемость, принимая участие в регуляции окислительного стресса [12, 52]. Перечисленные данные свидетельствуют, что возможность вхождения экзосом в нейроны определяется как источником экзосом, так и состоянием самих нейронов. Развитие патологии способствует проникновению экзосом в клетки.
В настоящее время механизм нейропротективного и нейрорегенеративного эффектов экзосом, выделенных из ММСК, остается невыясненным. Установлено, что действие экзосом зависит как от их количества, так и от состава и соотношения белков, аминокислот и нуклеотидов, мРНК, микроРНК и мтРНК, липидов и других биологически активных соединений, которые не являются полностью идентичными по своему составу родительским ММСК [5, 53]. Обязательным компонентом внеклеточных везикул, включая и экзосомы, является белок теплового шока БТШ70 [38], который, как было показано в наших и многочисленных исследованиях других авторов, обладает мощным шаперонным и нейропротективным действием, что ярко проявляется в условиях нейродегенерации альцгеймеровского типа и старения [54–56].
Роль токсической олигомерной формы Aβ в индукции гибели нейронов и синапсов признается одной из ключевых при развитии спорадической и фамильной форм БА [57, 58]. Поэтому можно предположить, что подавление нейродегенеративного процесса альцгеймеровского типа под влиянием экзосом может быть опосредовано через присутствие в них нейтральной эндопептидазы (Неприлизин, НЕП), представляющей собой интегральный мембранный белок II типа, находящийся в плазматической мембране, активный центр которого расположен во внеклеточном пространстве. Являясь эктоферментом, НЕП обеспечивает протеолитическое расщепление широкого спектра субстратов [59]. Одна из наиболее важных функций, позволяющая рассматривать его в качестве одного из терапевтических агентов при БА – способность расщеплять на различных участках аминокислотной последовательности бета-амилоидные пептиды, а также олигомерные формы Aβ (1–40) и Aβ (1–42) [1, 59]. В 2013 году Katsuda с соавт. [1] на примере экзосом из ММСК жировой ткани показали присутствие значительного количества НЕП в этих образованиях. В 2018 году Ding и соавт. [47] на модели БА у трансгенных животных (AβPPswe/PS1dE9) продемонстрировали, что при в/в введении экзосом, полученных из ММСК-ВС, наблюдалось увеличение экспрессии НЕП в результате активации клеток микроглии, что способствовало снижению уровня Aβ в головном мозге, в том числе и его растворимой формы.
Антиоксидантный эффект всегда рассматривали как возможный механизм терапевтического действия при БА. В 2019 году были опубликованы данные о присутствии в экзосомах, выделенных из ММСК-ВС, фермента каталазы, который опосредует защиту нейронов гиппокампа от окислительного стресса и повреждения синапсов, индуцируемых олигомерами Aβ [14]. Отдельную роль в очистке мозга от отложений Aβ могут играть и экзосомы, непосредственно выделяемые нейронами, например, через торможение нейтральной сфингомиелиназы, препятствующей превращению сфингомиелина в церамид [60]. Очищению мозга от Aβ отложений может способствовать связывание Aβ с гликосфинголипидами, расположенными на поверхности нейральных экзосом [61]. Экзосомы, выделяемые нейронами, участвуют в регуляции синаптической пластичности, устанавливая число АМРА-рецепторов и влияя на глутаматергическую нейропередачу [62].
Внутриклеточный механизм действия экзосом при БА может быть опосредован их влиянием на состояние митохондрий. Снижение энергетического потенциала в клетках мозга и митохондриальная дисфункция являются ранним признаком развития нейродегенеративного процесса. Одним из факторов, вызывающих нарушение как дыхательной функции, так и биогенеза митохондрий, является накопление внутриклеточного Aβ [63]. Возможно, не случайно 10.3% белкового содержания в экзосомах, выделенных из ММСК костного мозга, приходится на митохондриальные белки [64, 65]. Интересно отметить, что на модели остеоартрита, также характеризующегося митохондриальной дисфункцией, было показано, что применение экзосом, выделенных из ММСК, сопровождалось их проникновением в хондроциты и колокализацией с митохондриями. Наблюдаемый позитивный терапевтический эффект сопровождался нормализацией функций митохондрий [65]. В наших недавних исследованиях также было показано, что восстановление памяти ОБЭ мышей – модели спорадической формы БА наблюдалось под влиянием интраназального введения функционально активных нейрональных митохондрий [66].
ЗАКЛЮЧЕНИЕ
В заключении следует отметить, что, по-видимому, в опосредованном позитивном терапевтическом эффекте экзосом, выделяемых из ММСК-ВС, задействован не один механизм, а многокомпонентная система, включающая и периферические звенья, которая под влиянием содержащихся в экзосомах регуляторных факторов, восстанавливает свою активность, приближая ее к функционированию, характерному для здорового организма. Действительно, как правило, под влиянием экзосом наблюдается одновременное изменение разнообразных показателей, отражающих деятельность, по-видимому, тесно связанных между собой функциональных единиц, включенных в сложную систему поддержания гомеостаза. Следует отметить, что на сегодняшний день пока остается недостаточно изученной функциональная активность отдельных компонентов протеома и транскриптома экзосом из ММСК-ВС, и для более точного анализа механизмов влияния данного препарата на функциональную активность ЦНС в норме и патологии требуется проведение дальнейших исследований, направленных на изучение как действия экзосом из ММСК и самих нейронов, так и рассмотрение роли отдельных биологически активных соединений, которые входят в состав экзосом.
Благодарности. Авторы выражают благодарность фирме “Prostagnost” и лично А.В. Кешелава за помощь в выделении экзосом и В.С. Чернышёву за помощь в оценке размера экзосом.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
Источники финансирования. Исследование выполнено при финансовой поддержке гранта РНФ № 18-15-00392п и гранта РФФИ в рамках научного проекта № 19-315-90 047.
Соответствие принципам этики. Все применимые международные, национальные и/или институциональные принципы ухода и использования животных были соблюдены.
Список литературы
Katsuda T., Tsuchiya R., Kosaka N., Yoshioka Y., Takagaki K., Oki K., Takeshita F., Sakai Y., Kuroda M., Ochiya T. 2013. Human adipose tissue-derived mesenchymal stem cells secrete functional neprilysin-bound exosomes. Sci. Rep. 3 (1), 1–11. https://doi.org/10.1038/srep01197
Cai Z.Y., Xiao M., Quazi S.H., Ke Z.Y. 2018. Exosomes: A novel therapeutic target for Alzheimer’s disease? Neural Regen. Res. 13 (5), 930–935. https://doi.org/10.4103/1673-5374.232490
Polanco J.C., Hand G.R., Briner A., Li C., Götz J. 2021. Exosomes induce endolysosomal permeabilization as a gateway by which exosomal tau seeds escape into the cytosol. Acta neuropathol. 141 (2), 235–256. https://doi.org/10.1007/s00401-020-02254-3
Deane R., Bell R.D., Sagare A., Zlokovic B.V. 2009. Clearance of amyloid-beta peptide across the blood-brain barrier: Implication for therapies in Alzheimer’s disease. CNS Neurol. Disord. Drug Targets. 8 (1), 16–30. https://doi.org/10.2174/187152709787601867
Vlassov A.V., Magdaleno S., Setterquist R., Conrad R. 2012. Exosomes: Current knowledge of their composition, biological functions, and diagnostic and therapeutic potentials. Biochim. Biophys. Acta. 1820 (7), 940–948. https://doi.org/10.1016/j.bbagen.2012.03.017
Izadpanah M., Dargahi L., Ai J., Asgari Taei A., Ebrahimi Barough S., Mowla S.J., TavoosiDana G., Farahmandfar M. 2020. Extracellular vesicles as a neprilysin delivery system memory improvement in Alzheimer’s disease. Iran J. Pharm. Res. 19 (2), 45–60. https://doi.org/10.22037/ijpr.2020.112062.13508
Aleksandrova I.Y., Kuvichkin V.V., Kashparov I.A., Medvinskaya N.I., Nesterova I.V., Lunin S.M., Samokhin A.N., Bobkova N.V. 2004. Increased level of β-amyloid in the brain of bulbectomized mice. Biochemistry. 69 (2), 176–180.
Poltavtseva R.A., Samokhin A.N., Bobkova N.V., Alexandrova M.A., Sukhikh G.T. 2020. Effect of transplantation of neural stem and progenitor cells on memory in animals with Alzheimer’s type neurodegeneration. Bull. Exp. Biol. Med. 168, 589–596.
Regenerative medicine: Laboratory to clinic. 2017. Ed. Mukhopadhyay A. Singapore: Springer, 537 p. https://doi.org/10.1007/978-981-10-3701-6
Жданова Д.Ю., Бобкова Н.В. 2020. Перспективы использования экзосом для диагностики и лечения болезни Альцгеймера. Нейрокомпьютеры: разработка, применение. 22 (4), 55–60.
Kang X., Zuo Z., Hong W., Tang H., Geng W. 2019. Progress of research on exosomes in the protection against ischemic brain injury. Front. Neurosci. 13, 1149. https://doi.org/10.3389/fnins.2019.01149
Guo M., Yin Z., Chen F., Lei P. 2020. Mesenchymal stem cell-derived exosome: A promising alternative in the therapy of Alzheimer’s disease. Alzheimers Res. Ther. 12 (1), 1–14. https://doi.org/10.1186/s13195-020-00670-x
Xie Z.H., Liu Z., Zhang X.R., Yang H., Wei L.F., Wang Y., Xu S.L., Sun L., Lai C., Bi J.Z., Wang X.Y. 2016. Wharton’s Jelly-derived mesenchymal stem cells alleviate memory deficits and reduce amyloid-β deposition in an APP/PS1 transgenic mouse model. Clin. Exp. Med. 16 (1), 89–98. https://doi.org/10.1007/s10238-015-0375-0
Bodart-Santos V., de Carvalho L.R.P., de Godoy M.A., Batista A.F., Saraiva L.M., Lima L.G., Abreu C.A., De Felice F.G., Galina A., Mendez-Otero R., Ferreira S.T. 2019. Extracellular vesicles derived from human Wharton’s jelly mesenchymal stem cells protect hippocampal neurons from oxidative stress and synapse damage induced by amyloid-β oligomers. Stem Cell Res. Ther. 10 (1), 1–13. https://doi.org/10.1186/s13287-019-1432-5
Poltavtseva R.A., Poltavtsev A.V., Lutsenko G.V., Svirshchevskaya E.V. 2019. Myths, reality and future of mesenchymal stem cell therapy. Cell Tissue Res. 375 (3), 563–574. https://doi.org/10.1007/s00441-018-2961-4
Cai G., Cai G., Zhou H., Zhuang Z., Liu K., Pei S., Wang Y., Wang H., Wang X., Xu S., Cui C., Sun M., Guo S., Jia K., Wang X., Zhang D. 2021. Mesenchymal stem cell-derived exosome miR-542-3p suppresses inflammation and prevents cerebral infarction. Stem Cell Research & Therapy. 12 (1), 1–12. https://doi.org/10.1186/s13287-020-02030-w
Rastogi S., Sharma V., Bharti P.S., Rani K., Modi G.P., Nikolajeff F., Kumar S. 2021. The evolving landscape of exosomes in neurodegenerative diseases: Exosomes characteristics and a promising role in early diagnosis. Int. J. Mol. Sci. 22 (1), 440.
Iranifar E., Seresht B.M., Momeni F., Fadaei E., Mehr M.H., Ebrahimi Z., Rahmati M., Kharazinejad E., Mirzaei H. 2019. Exosomes and microRNAs: New potential therapeutic candidates in Alzheimer disease therapy. J. Cell Physiol. 234 (3), 2296–2305. https://doi.org/10.1002/jcp.27214
Jafari D., Malih S., Eslami S.S., Jafari R., Darzi L., Tarighi P., Samadikuchaksaraei A. 2019. The relationship between molecular content of mesenchymal stem cells derived exosomes and their potentials: Opening the way for exosomes based therapeutics. Biochimie. 165, 76–89. https://doi.org/10.1016/j.biochi.2019.07.009
Zhdanova D.Y., Poltavtseva R.A., Svirshchevskaya E.V., Bobkova N.V. 2021. Effect of intranasal administration of multipotent mesenchymal stromal cell exosomes on memory of mice in Alzheimer’s disease Model. Bull. Exp. Biol. Med. 170 (4), 575–582. https://doi.org/10.1007/s10517-021-05109-3
Galipeau J., Krampera M., Barrett J., Dazzi F., Deans R.J., DeBruijn J., Dominici M., Fibbe W.E., Gee A.P., Gimble J.M., Hematti P., Koh M.B., LeBlanc K., Martin I., McNiece I.K., Mendicino M., Oh S., Ortiz L., Phinney D.G., Planat V., Shi Y., Stroncek D.F., Viswanathan S., Weiss D.J., Sensebe L. 2016. International society for cellular therapy perspective on immune functional assays for mesenchymal stromal cells as potency release criterion for advanced phase clinical trials. Cytotherapy. 18 (2), 151–159.
Andreu Z., Yáñez-Mó M. 2014. Tetraspanins in extracellular vesicle formation and function. Front. Immunol. 5, 442. https://doi.org/10.3389/fimmu.2014.00442
Konoshenko M.Y., Lekchnov E.A., Vlassov A.V., Laktionov P.P. 2018. Isolation of extracellular vesicles: General methodologies and latest trends. Biomed Res. Int. (2018), 8545347. https://doi.org/10.1155/2018/8545347
Sidhom K., Obi P.O., Saleem A. 2020. A review of exosomal isolation methods: is size exclusion chromatography the best option? Int. J. Mol. Sci. 21 (18), 6466. https://doi.org/10.3390/ijms21186466
Kalluri R., LeBleu V.S. 2020. The biology, function, and biomedical applications of exosomes. Science. 367, 6478. https://doi.org/10.1126/science.aau6977
Saint-Pol J., Gosselet F., Duban-Deweer S., Pottiez G., Karamanos Y. 2020. Targeting and crossing the blood-brain barrier with extracellular vesicles. Cells. 9 (4), 851. https://doi.org/10.3390/cells9040851
Elliott R.O., He M. 2021. Unlocking the power of exosomes for crossing biological barriers in drug delivery. Pharmaceutics. 13 (1), 122. https://doi.org/10.3390/pharmaceutics13010122
Гуляева Н.В., Бобкова Н.В., Колосова Н.Г., Самохин А.Н., Степаничев М.Ю., Стефанова Н.А. 2017. Молекулярно-клеточные механизмы патогенеза спорадической формы болезни Альцгеймера: исследования in vivo на моделях грызунов. Биохимия. 82 (10), 1427–1443.
Александрова И.Ю., Кувичкин В.В., Кашпаров И.А., Медвинская Н.И., Нестерова И.В., Лунин С.М., Самохин А.Н., Бобкова Н.В. 2004. Повышенный уровень β-амилоида в мозге у бульбэктомированных мышей. Биохимия. 69 (2), 218–224.
Bobkova N.V., Poltavtseva R.A., Samokhin A.N., Sukhikh G.T. 2013. Therapeutic effect of mesenchymal multipotent stromal cells on memory in animals with Alzheimer-type neurodegeneration. Bull. Exp. Biol. Med. 156 (1), 119–121.
Lee J.K., Jin H.K., Bae J.S. 2009. Bone marrow-derived mesenchymal stem cells reduce brain amyloid-β deposition and accelerate the activation of microglia in an acutely induced Alzheimer’s disease mouse model. Neurosci. Lett. 450 (2), 136–141. https://doi.org/10.1016/j.neulet.2008.11.059
Lee H.J., Lee J.K., Lee H., Carter J.E., Chang J.W., Oh W., Yung Y.S., Suh J.G., Lee B.H., Jin H.K., Bae J.S. 2012. Human umbilical cord blood-derived mesenchymal stem cells improve neuropathology and cognitive impairment in an Alzheimer’s disease mouse model through modulation of neuroinflammation. Neurobiol. Aging. 33 (3), 588–602. https://doi.org/10.1016/j.neurobiolaging.2010.03.024
de Godoy M.A., Saraiva L.M., de Carvalho L.R.P., Vasconcelos-Dos-Santos A., Beiral H.J.V., Ramos A.B., Silva L.R.P., Leal R.B., Monteiro V.H.S., Braga C.V., de Araujo-Silva C.A., Sinis L.C., Bodart-Santos V., Kasai-Brunswick T.H., Alcantara C.L., Lima A.P.C.A., da Cunha-E Silva N.L., Galina A., Vieyra A., De Felice F.G., Mendez-Otero R., Ferreira S.T. 2018. Mesenchymal stem cells and cell-derived extracellular vesicles protect hippocampal neurons from oxidative stress and synapse damage induced by amyloid-β oligomers. J. Biol. Chem. 293 (6), 1957–1975.
Mendt M., Rezvani K., Shpall E. 2019. Mesenchymal stem cell-derived exosomes for clinical use. Bone Marrow Transplant. 54 (2), 789–792.
Chen Y., Li J., Ma B., Li N., Wang S., Sun Z., Xue C., Han Q., Wei J., Zhao R.C. 2020. MSC-derived exosomes promote recovery from traumatic brain injury via microglia/macrophages in rat. Aging (Albany NY). 12 (18), 18274–18296. https://doi.org/10.18632/aging.103692
Petrenko Y., Vackova I., Kekulova K., Chudickova M., Koci Z., Turnovcova K., Kupcova Skalnikova H., Vodicka P., Kubinova S. A. 2020. A comparative analysis of multipotent mesenchymal stromal cells derived from different sources, with a focus on neuroregenerative potential. Sci. Rep. 10 (1), 1–15. https://doi.org/10.1038/s41598-020-61167-z
Kurian T.K., Banik S., Gopal D., Chakrabarti S., Mazumder N. 2021. Elucidating methods for isolation and quantification of exosomes: A review. Mol. Biotech. 63 (4), 249–266. https://doi.org/10.1007/s12033-021-00300-3
Kowal J., Arras G., Colombo M., Jouve M., Morath J.P., Primdal-Bengtson B., Dingli F., Loew D., Tkach M., Théry C. 2016. Proteomic comparison defines novel markers to characterize heterogeneous populations of extracellular vesicle subtypes. Proc. Natl. Acad. Sci. USA. 113 (8), E968–E977. https://doi.org/10.1073/pnas.1521230113
Chairoungdua A., Smith D.L., Pochard P., Hull M., Caplan M.J. 2010. Exosome release of β-catenin: a novel mechanism that antagonizes Wnt signaling. J. Cell Biol. 190 (6), 1079–1091. https://doi.org/10.1083/jcb.201002049
Hurwitz S.N., Conlon M.M., Rider M.A., Brownstein N.C., Meckes Jr, D.G. 2016. Nanoparticle analysis sheds budding insights into genetic drivers of extracellular vesicle biogenesis. J. Extracell. Vesicles. 5 (1), 31295. https://doi.org/10.3402/jev.v5.31295
Chen S.Y., Lin M.C., Tsai J.S., He P.L., Luo W.T., Herschman H., Li H.J. 2019. EP4 antagonist-elicited extracellular vesicles from mesenchymal stem cells rescue cognition/learning deficiencies by restoring brain cellular functions. Stem Cells Transl. Med. 8 (7), 707–723. https://doi.org/10.1002/sctm.18-0284
Xin H., Li Y., Cui Y., Yang J.J., Zhang Z.G., Chopp M. 2013. Systemic administration of exosomes released from mesenchymal stromal cells promote functional recovery and neurovascular plasticity after stroke in rats. J. Cereb. Blood Flow Metab. 33 (11), 1711–1715. https://doi.org/10.1038/jcbfm.2013.152
Zhang Y., Chopp M., Meng Y., Katakowski M., Xin H., Mahmood A., Xiong, Y. 2015. Effect of exosomes derived from multipluripotent mesenchymal stromal cells on functional recovery and neurovascular plasticity in rats after traumatic brain injury. J. Neurosurg. 122 (4), 856–867. https://doi.org/10.3171/2014.11.JNS14770
Kim D.K., Nishida H., An S.Y., Shetty A.K., Bartosh T.J., Prockop D.J. 2016. Chromatographically isolated CD63+ CD81+ extracellular vesicles from mesenchymal stromal cells rescue cognitive impairments after TBI. Proc. Natl. Acad. Sci. USA. 113 (1), 170–175.
Brunjes P.C., Frazier L.L. 1986. Maturation and plasticity in the olfactory system of vertebrates. Brain Res. Rev. 11 (1), 1–45. https://doi.org/10.1016/0165-0173(86)90008-1
Tulving E., Markowitsch H.J. 1997. Memory beyond the hippocampus. Curr. Opin. Neurobiol. 7 (2), 209–216. https://doi.org/10.1016/S0959-4388(97)80009-8
Ding M., Shen Y., Wang P., Xie Z., Xu S., Zhu Z., Wang Y., Lyu Y., Wang D., Xu L., Bi J., Yang H. 2018. Exosomes isolated from human umbilical cord mesenchymal stem cells alleviate neuroinflammation and reduce amyloid-beta deposition by modulating microglial activation in Alzheimer’s disease. Neurochem. Res. 43 (11), 2165–2177.
Sekeres M.J., Winocur G., Moscovitch M. 2018. The hippocampus and related neocortical structures in memory transformation. Neurosci. Lett. 680, 39–53. https://doi.org/10.1016/j.neulet.2018.05.006
Wiklander O.P., Nordin J.Z., O’Loughlin A., Gustafsson Y., Corso G., Mäger I., Vader P., Lee Y., Sork H., Seow Y., Heldring N., Alvarez-Erviti L., Smith C.I., Le Blanc K., Macchiarini P., Jungebluth P., Wood M.J., Andaloussi S.E. 2015. Extracellular vesicle in vivo biodistribution is determined by cell source, route of administration and targeting. J. Extracell. Vesicles. 4 (1), 26316. https://doi.org/10.3402/jev.v4.26316
Jarmalavičiūtė A., Tunaitis V., Pivoraitė U., Venalis A., Pivoriūnas A. 2015. Exosomes from dental pulp stem cells rescue human dopaminergic neurons from 6-hydroxy-dopamine–induced apoptosis. Cytotherapy. 17 (7), 932–939. https://doi.org/10.1016/j.jcyt.2014.07.013
Nakano M., Nagaishi K., Konari N., Saito Y., Chikenji T., Mizue Y., Fujimiya M. 2016. Bone marrow-derived mesenchymal stem cells improve diabetes-induced cognitive impairment by exosome transfer into damaged neurons and astrocytes. Sci. Rep. 6 (1), 1–14. https://doi.org/10.1038/srep24805
Fröhlich D., Kuo W.P., Frühbeis C., Sun J.J., Zehendner C.M., Luhmann H.J., Pinto S., Toedling J., Trotter J., Krämer-Albers E.M. 2014. Multifaceted effects of oligodendroglial exosomes on neurons: Impact on neuronal firing rate, signal transduction and gene regulation. Philos. Trans. R. Soc. Lond. B. Biol. Sci. 369 (1652), 20130510. https://doi.org/10.1098/rstb.2013.0510
Haraszti R.A., Didiot M.C., Sapp E., Leszyk J., Shaffer S.A., Rockwell H.E., Gao F., Narain N.R., DiFiglia M., Kiebish M.A., Aronin N., Khvorova A. 2016. High-resolution proteomic and lipidomic analysis of exosomes and microvesicles from different cell sources. J. Extracell. Vesicles. 5 (1), 32570. https://doi.org/10.3402/jev.v5.32570
Bobkova N.V., Garbuz D.G., Nesterova I., Medvinskaya N., Samokhin A., Alexandrova I., Yashin V., Karpov V., Kukharsky M., Ninkina N., Smirnov A., Nudler E., Evgen’ev M. 2014. Therapeutic effect of exogenous hsp70 in mouse models of Alzheimer’s disease. J. Alzheimer’s Dis. 38 (2), 425–435.
Bobkova N.V., Evgen’ev M., Garbuz D.G., Kulikov A.M., Morozov A., Samokhin A., Velmeshev D., Medvinskaya N., Nesterova I., Pollock A., Nudler E. 2015. Exogenous Hsp70 delays senescence and improves cognitive function in aging mice. Proc. Natl. Acad. Sci. 112 (52), 16006–16011.
Evgen’ev M.B., Krasnov G.S., Nesterova I.V., Garbuz D.G., Karpov V.L., Morozov A.V., Snezhkina A., Samokhin A., Sergeev A., Kulikov A., Bobkova N.V. 2017. Molecular mechanisms underlying neuroprotective effect of intranasal administration of human Hsp70 in mouse model of Alzheimer’s disease. J. Alzheimer’s Dis. 59 (4), 1415–1426.
Sadigh-Eteghad S., Sabermarouf B., Majdi A., Talebi M., Farhoudi M., Mahmoudi J. 2015. Amyloid-beta: A crucial factor in Alzheimer’s disease. Med. Princ. Pract. 24 (1), 1–10. https://doi.org/10.1159/000369101
Madav Y., Wairkar S., Prabhakar B. 2019. Recent therapeutic strategies targeting beta amyloid and tauopathies in Alzheimer’s disease. Brain Res. Bull. 146, 171–184.
Malito E., Hulse R.E., Tang W.J. 2008. Amyloid β-degrading cryptidases: Insulin degrading enzyme, presequence peptidase, and neprilysin. Cell. Mol. Life Sci. 65 (16), 2574–2585. https://doi.org/10.1007/s00018-008-8112-4
Dinkins M.B., Dasgupta S., Wang G., Zhu G., Bieberich E. 2014. Exosome reduction in vivo is associated with lower amyloid plaque load in the 5XFAD mouse model of Alzheimer’s disease. Neurobiol. Aging. 35 (8), 1792–1800. https://doi.org/10.1016/j.neurobiolaging.2014.02.012
Yuyama K., Sun H., Sakai S., Mitsutake S., Okada M., Tahara H., Furukawa J., Fujitani N., Shinohara Y., Igarashi Y. 2014. Decreased amyloid-β pathologies by intracerebral loading of glycosphingolipid-enriched exosomes in Alzheimer model mice. J. Biol. Chem. 289 (35), 24488–24498. https://doi.org/10.1074/jbc.M114.577213
Delpech J.C., Herron S., Botros M.B., Ikezu T. 2019. Neuroimmune crosstalk through extracellular vesicles in health and disease. Trends Neurosci. 42 (5), 361–372. https://doi.org/10.1016/j.tins.2019.02.007
Аветисян А.В., Самохин А.Н., Александрова И.Ю., Зиновкин Р.А., Симонян Р.А., Бобкова Н.В. 2016. Функциональное нарушение митохондрий неокортекса и гиппокампа у мышей с бульбэктомией – модели болезни Альцгеймера. Биохимия. 81 (6), 802–812.
Choi D.S., Kim D.K., Kim Y.K., Gho Y.S. 2013. Proteomics, transcriptomics and lipidomics of exosomes and ectosomes. Proteomics. 13 (10–11), 1554–1571. https://doi.org/10.1002/pmic.201200329
Chen P., Zheng L., Wang Y., Tao M., Xie Z., Xia C., Gu C., Chen J., Qiu P., Mei S., Ning L., Shi Y., Fang C., Fan S., Lin X. 2019. Desktop-stereolithography 3D printing of a radially oriented extracellular matrix/mesenchymal stem cell exosome bioink for osteochondral defect regeneration. Theranostics. 9 (9), 2439–2459. https://doi.org/10.7150/thno.31017
Бобкова Н.В., Жданова Д.Ю., Белослудцева Н.В., Миронова Г.Д. Таргетная неинвазивная трансплантация в мозг функционально активных митохондрий для лечения нейродегенеративных заболеваний. Патент Российской Федерации на изобретение. Заявка № 2 019 127 519 от 02.09.2019.
Дополнительные материалы отсутствуют.
Инструменты
Биологические мембраны: Журнал мембранной и клеточной биологии


