Биологические мембраны: Журнал мембранной и клеточной биологии, 2021, T. 38, № 6, стр. 474-477
Анализ клеточных ответов на норадреналин с использованием синхронного мониторинга Сa2+ и сАМР в клетках HEK 293
Е. Н. Кочкина a, *, О. А. Рогачевская a, П. Д. Котова a
a Институт биофизики клетки РАН, ФИЦ ПНЦБИ РАН
142290 Пущино, Московская обл., Россия
* E-mail: kate-kochkina@yandex.ru
Поступила в редакцию 08.05.2021
После доработки 23.07.2021
Принята к публикации 25.07.2021
Аннотация
Норадреналин играет важную роль в регуляции широкого круга физиологических процессов и распознается клетками различных типов с помощью адренергических рецепторов, которые сопряжены с фосфолипазным и аденилатциклазным сигнальными путями. В данной работе мы исследовали адренергическую систему клеток HEK 293 с использованием генетически кодируемых сенсоров GEM-GECO1 и Pink Flamindo для мониторинга внутриклеточных Ca2+ и cAMP соответственно. Нами показано, что в одиночных клетках HEK 293 норадреналин одновременно стимулирует и Са2+-сигнализацию, и продукцию cAMP. Интересной особенностью сАМР- и Са2+-сигналов оказалось то, что с повышением дозы норадреналина амплитуда cAMP-ответов росла градуально, в то время как величина Са2+-ответов не зависела от концентрации агониста. Физиологическая значимость таких зависимостей обсуждается.
ВВЕДЕНИЕ
Адреналин и норадреналин представляют собой катехоламины и функционируют как гормоны и нейромедиаторы, модулирующие активность различных органов и тканей, включая сердечно-сосудистую систему, почки, печень и мозг. Самые разнообразные клетки, от нейронов и кардиомиоцитов до мезенхимных стромальных клеток, экспрессируют гены, кодирующие адренорецепторы. Последние принадлежат к суперсемейству гептаспиральных рецепторов, сигнальная функция которых во многом обеспечивается взаимодействием с G-белками (G-protein coupled receptors). Идентифицировано девять генов, кодирующих адренорецепторы, которые на основе структурных и функциональных свойств отнесены к трем группам: α1 (α1A, α1B, α1D), α2 (α2A, α2B, α2C) и β (β1, β2, β3) [1]. Традиционно считалось, что α1-адренорецепторы преимущественно сопряжены с Gq/11-белком, стимулирующим фосфолипазу С (PLC), α2-адренорецепторы – с Gi/0-белком, ингибирующим активность аденилатциклазы (AC), а β-адренорецепторы связываются с Gs-белком, активирующим аденилатциклазу. Между тем данные, накопленные к настоящему моменту, свидетельствуют о том, что варианты сопряжения адренергических рецепторов с внутриклеточными сигнальными каскадами куда более разнообразны [2, 3]. Так, например, показано, что активация β-адренорецепторов может приводить к мобилизации внутриклеточного Са2+ по cAMP-независимому пути [4].
В наших исследованиях адренергической системы мезенхимных стромальных клеток (МСК), выделенных из жировой ткани человека, было показано, что норадреналин инициирует Ca2+-сигнализацию в МСК. Интересной особенностью этих Са2+-сигналов было то, что в малых концентрациях норадреналин не вызывал детектируемого увеличения уровня внутриклеточного Са2+, но начиная с пороговой дозы инициировал Са2+-ответы, величина которых фактически не зависела от концентрации агониста [5]. Иными словами, клетки генерировали Са2+-ответы на норадреналин по принципу “всё или ничего”; такой характер ответа ставит вопрос о том, как в МСК кодируется информация о величине приходящего стимула для формирования адекватной реакции на него. Было также неясно, насколько универсален данный тип клеточных ответов на агонисты. В данной работе мы установили, что клетки HEK 293 также отвечают на норадреналин мобилизацией Са2+ в цитозоле, при этом Са2+-ответы генерируются по принципу “всё или ничего” (рис. 1а, верхняя кривая, 1б). Таким образом, данный тип Са2+-ответа может быть достаточно универсальным, и в этом случае вопрос о кодировании интенсивности адренергических стимулов уже не сводился к анализу физиологических процессов в МСК. Возможно, клетки экспрессируют такой набор адренорецепторов, что норадреналин способен запускать в их цитозоле параллельные процессы, один из которых – мобилизация Са2+, а другой – например, генерация сАМР, каждый из которых нацелен на решение специфических задач клеточной физиологии. Нам представлялось интересным выяснить, вовлекает ли адренергическая сигнализация в клетках параллельные процессы, например Са2+-сигнализацию и сАМР-сигнализацию.
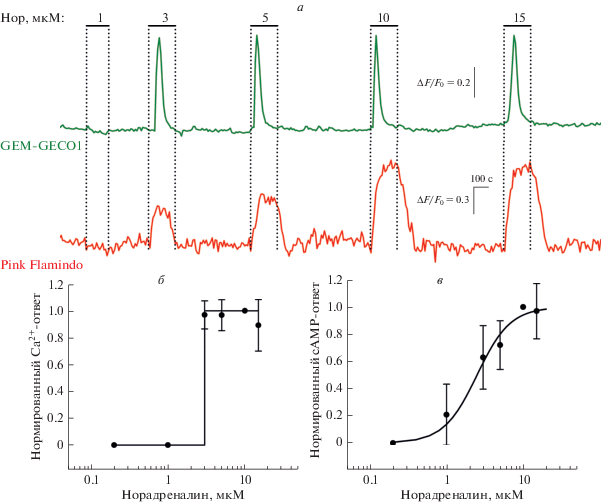
Рис. 1.
Ca2+- и cAMP-ответы одиночных клеток HEK 293 на стимуляцию норадреналином в различных концентрациях. а – Репрезентативная регистрация Ca2+- и cAMP-ответов одиночной клетки HEK 293 на норадреналин (Нор) в различных концентрациях (n = 226). Моменты и продолжительность аппликаций норадреналина обозначены горизонтальными линиями выше экспериментальной кривой. Изменение внутриклеточного Ca2+ характеризовали относительной флуоресценцией GEM-GECO1 ΔF/F0, где ΔF = F0 – F, изменение внутриклеточного cAMP характеризовали относительной флуоресценцией Pink Flamindo ΔF/F0, где ΔF = F – F0, F и F0 – текущая интенсивность эмиссии индикатора и его эмиссии в начале регистрации соответственно. б – Дозозависимость Ca2+-ответов клеток HEK 293, характеризующихся одинаковым порогом чувствительности к норадреналину 3 мкМ (n = 14–20). Каждый ответ был нормирован на ответ, вызванный в соответствующей клетке норадреналином в концентрации 10 мкМ. Экспериментальная зависимость (точки) аппроксимирована функцией Хевисайда cо скачком в точке 3 мкМ (непрерывная линия). Экспериментальные данные представлены как среднее ± стандартное отклонение. в – Дозозависимость cAMP-ответов на норадреналин клеток HEK 293 (n = 201). Каждый ответ был нормирован на ответ, вызванный в данной клетке 10 мкМ норадреналина. Экспериментальная зависимость (точки) аппроксимирована уравнением Хилла: R = Ah/($A_{{0.5}}^{h}$ + Ah), где R – нормированный клеточный ответ, A – концентрация норадреналина, A0.5 – концентрация полуэффекта, h – коэффициент Хилла. Непрерывная линия получена при h = 2 и A0.5 = 2.5 мкМ. Экспериментальные данные представлены как среднее ± стандартное отклонение.
МАТЕРИАЛЫ И МЕТОДЫ
Мониторинг cAMP в живой клетке в режиме реального времени возможен только с помощью генетически кодируемых сенсоров, поскольку синтетических флуоресцентных cAMP-зондов на сегодняшний день не разработано. Поэтому для исследования внутриклеточных cAMP- и Ca2+-сигналов мы использовали генетически кодируемые сенсоры внутриклеточного cAMP Pink Flamindo [6] и цитозольного Са2+ GEM-GECO1 [7]. Эти молекулярные сенсоры были гетерологически экспрессированы в клетках линии HEK 293. Клетки культивировали в среде DMEM (Gibco), содержащей 4.5 г/л глюкозы, 10% эмбриональной бычьей сыворотки (HyClone), 100 мг/мл гентамицина (Sigma), 2 мМ глутамина (Sigma) во влажной атмосфере c 5% содержанием CO2 в воздухе при 37̊°C. Клетки трансфицировали плазмидными векторами Pink Flamindo и CMV-GEM-GECO1 (оба Addgene) с целью индукции экспрессии Pink Flamindo и GEM-GECO1. Для трансфекции использовали набор для липофекции Lipofectamine 3000 (Invitrogen) по оптимизированному согласно рекомендациям производителя протоколу. В физиологических экспериментах использовали клетки через 24–48 ч после трансфекции. Для мониторинга внутриклеточных cAMP и Са2+ клетки прикрепляли ко дну фотометрической камеры с помощью адгезивного материала Cell Tak (Corning) и инкубировали при комнатной температуре 30 мин. Внеклеточный раствор содержал (мМ): NaCl – 130, KCl – 5, CaCl2 – 2, MgCl2 – 1, HEPES – 10, глюкозу – 10. Фотометрические эксперименты проводили с использованием инвертированного флуоресцентного микроскопа Axiovert 135 (Zeiss), оборудованного объективом Plan NeoFluar 20×/0.75 и цифровой EMCCD камерой LucaR (Andor Technology). Флуоресценцию Pink Flamindo и GEM-GECO1 возбуждали поочередно на длинах волн 480 ± 10 нм и 572 ± 17.5 нм, эмиссию регистрировали в области 520 ± 20 нм и 634 ± ± 34 нм соответственно. Изменение концентрации cAMP и Са2+ в цитоплазме оценивали по относительному изменению интенсивности флуоресценции Pink Flamindo и GEM-GECO1 соответственно. Количественный фотометрический анализ изображений осуществляли с использованием программы NIS Elements (Nikon). Полученные экспериментальные данные обрабатывали с помощью программы Sigma Plot 12.5 (Systat Software).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В общей сложности было проанализировано 226 клеток, для которых была характерна флуоресценция, индуцированная экспрессией одновременно обоих флуоресцентных белков – Pink Flamindo и GEM-GECO1. Оказалось, что стимуляция таких клеток норадреналином в различных дозах инициировала увеличение концентраций cAMP и/или Ca2+ в их цитозоле. Так, 152 клетки (67%) генерировали исключительно cAMP-ответы, 25 клеток (11%) генерировали только Ca2+-ответы, а в 49 клетках (22%) наблюдалось увеличение уровня обоих вторичных медиаторов в ответ на норадреналин (рис. 1а). Таким образом, значительное большинство (89%) клеток HEK 293, чувствительных к норадреналину, генерировали cAMP-ответы, тогда как агонист-зависимая мобилизация внутриклеточного Ca2+ наблюдалась лишь в 33% субпопуляции. Такая функциональная гетерогенность клеток HEK 293, видимо, отражает их молекулярную гетерогенность в том отношении, что индивидуальная клетка характеризуется специфическим паттерном экспрессии генов адренорецепторов и/или специфическими механизмами их сопряжения с внутриклеточными сигнальными каскадами. С этих позиций можно объяснить количественное противоречие, состоящее в том, что адренорецепторы экспрессируются в большинстве МСК [8], в то время как норадреналин мобилизует Ca2+ лишь в небольшой (5–15%) популяции этих клеток [5].
Генерация Ca2+-ответов на норадреналин клетками HEK 293 подчинялась принципу “всё или ничего”, т.е. при стимуляции агонистом в подпороговых концентрациях ответы не детектировались, тогда как амплитуда ответов на агонист в любых концентрациях, превышающих пороговую, была практически одинаковой (рис. 1а, верхняя кривая, 1б). Пороговая концентрация норадреналина варьировалась от клетки к клетке и лежала в пределах 1–5 мкМ. Описанный тип дозозависимости Ca2+-ответов на агонисты был обнаружен в МСК в наших предыдущих исследованиях [5, 9, 10]. Результаты этих работ свидетельствовали о том, что ключевым механизмом, обеспечивающим инвариантность формы Са2+-сигналов, индуцированных агонистами в различных дозах, является Са2+-индуцированный выброс депонированного Са2+ (Сa2+-induced Сa2+ release, CICR). По-видимому, универсальность величины и формы Ca2+-ответов на норадреналин в клетках HEK 293 (рис. 1а, верхняя кривая) также обеспечивает CICR. Отметим, что дозозависимость cAMP-ответов клеток HEK 293 носила совершенно иной характер: пороговая концентрация норадреналина лежала в области 1–3 мкМ, а амплитуда сАМР-ответов росла пропорционально концентрации агониста (рис. 1а, нижняя кривая, 1в).
Таким образом, использование генетически кодируемых сенсоров Ca2+ и cAMP позволило продемонстрировать, что норадреналин способен инициировать в клетках HEK 293 сложный паттерн внутриклеточных событий, стимулируя как минимум мобилизацию Са2+ и генерацию cAMP. Поскольку Ca2+-ответы, инициированные короткими аппликациями норадреналина, были инвариантны по форме при разных дозах агониста, то кодирование информации об интенсивности стимула могло осуществляться на уровне cAMP-сигналов, амплитуда которых зависела от концентрации норадреналина (рис. 1). Скорее всего, клетки, которые генерируют Са2+-сигналы в ответ на агонисты по принципу “всё или ничего”, например МСК, могут использовать сходную стратегию кодирования внешних стимулов, генерируя не только Са2+-сигналы, но и сигналы другой природы, например, в форме импульсов cAMP, градуально зависящих от силы стимуляции.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
Источники финансирования. Работа выполнена при поддержке гранта РНФ № 19-75-10 068.
Соответствие принципам этики. Настоящая статья не содержит описания каких-либо исследований с участием людей или животных в качестве объектов.
Список литературы
Guimaraes S., Moura D. 2001. Vascular adrenoceptors: An update. Pharmacol. Rev. 53 (2), 319–356.
Cotecchia S. 2010. The α1-adrenergic receptors: Diversity of signaling networks and regulation. J. Recept. Signal. Transduct. Res. 30, 410–419.
Cottingham C., Chen H., Chen Y., Peng Y., Wang Q. 2011. Genetic variations of α2- adrenergic receptors illuminate the diversity of receptor functions. In: Advances in adrenergic recept or biology. Ed. Wang Q. San Diego: Academic Press, p. 162–190.
Galaz-Montoya M., Wright S.J., Rodriguez G.J., Lichtarge O., Wensel T.G. 2017. β2-Adrenergic receptor activation mobilizes intracellular calcium via a non-canonical cAMP-independent signaling pathway. J. Biol. Chem. 292 (24), 9967–9974.
Kotova P.D., Sysoeva V.Y., Rogachevskaja O.A., Bystrova M.F., Kolesnikova A.S., Tyurin-Kuzmin P.A., Fadeeva J.I., Tkachuk V.A., Kolesnikov S.S. 2014. Functional expression of adrenoreceptors in mesenchymal stromal cells derived from the human adipose tissue. Biochim. Biophys. Acta. 1843, 1899–1908.
Harada K., Ito M., Wang X., Tanaka M., Wongso D., Konno A., Hirai H., Hirase H., Tsuboi T., Kitaguchi T. 2017. Red fluorescent protein-based cAMP indicator applicable to optogenetics and in vivo imaging. Sci. Rep. 7 (1), 7351.
Zhao Y., Araki S., Wu J., Teramoto T., Chang Y.F., Nakano M., Abdelfattah A.S., Fujiwara M., Ishihara T., Nagai T., Campbell R.E. 2011. An expanded palette of genetically encoded Ca2+ indicators. Science. 333 (6051), 1888–1891.
Tyurin-Kuzmin P.A., Fadeeva J.I., Kanareikina M.A., Kalinina N.I., Sysoeva V.Yu., Dyikanov D.T., Stambolsky D.V., Tkachuk V.A. 2016. Activation of β-adrenergic receptors is required for elevated α1A-adrenoreceptors expression and signaling in mesenchymal stromal cells. Sci. Rep. 6, 32835.
Kotova P.D., Bystrova M.F., Rogachevskaja O.A., Khokhlov A.A., Sysoeva V.Yu., Tkachuk V.A., Kolesnikov S.S. 2018. Coupling of P2Y receptors to Ca2+ mobilization in mesenchymal stromal cells from the human adipose tissue. Cell Calcium. 71, 1–14.
Kaimachnikov N.P., Kotova P.D., Kochkina E.N., Rogachevskaja O.A., Khokhlov A.A., Bystrova M.F., Kolesnikov S.S. 2021. Modeling of Ca2+ transients initiated by GPCR agonists in mesenchymal stromal cells. BBA Advances. 1, 100012.
Дополнительные материалы отсутствуют.
Инструменты
Биологические мембраны: Журнал мембранной и клеточной биологии


