Биологические мембраны: Журнал мембранной и клеточной биологии, 2022, T. 39, № 1, стр. 3-17
Гомеостаз кальция в сперматозоидах: механизмы регуляции и биологическая роль
А. Н. Накидкина a, *, Т. И. Кузьмина a
a Всероссийский научно-исследовательский институт генетики и разведения
сельскохозяйственных животных – филиал ФИЦ животноводства – ВИЖ имени Л.К. Эрнста
196625 г. Санкт-Петербург–Пушкин, Россия
* E-mail: alena_boiceva@mail.ru
Поступила в редакцию 28.04.2021
После доработки 07.06.2021
Принята к публикации 08.06.2021
- EDN: PPHRSW
- DOI: 10.31857/S0233475522010078
Аннотация
Кальций – один из наиболее значимых элементов внутриклеточной сигнализации. Его роль настолько велика и сложна, что позволяет выделить многообразные эффекты и каскады реакций с участием этого иона в отдельную сигнальную систему – кальциевую. Мужские гаметы не стали исключением: более того, невозможность транскрипции и незначительный уровень трансляции сделали посттрансляционные процессы, многие из которых активируются/ингибируются при участии кальция, основным способом регуляции функционирования зрелых сперматозоидов. Повышение внутриклеточного уровня кальция является необходимым этапом капацитации, гиперактивации и акросомной реакции – процессов, предшествующих оплодотворению. Кальций необходим как для прогрессивной, так и для гиперактивированной подвижности; сперматозоиды используют этот ион для предотвращения спонтанной акросомной реакции и, когда приходит время, для обеспечения акросомального экзоцитоза. Такие значительные различия в эффектах воздействия одного и того же иона достигаются сложной системой регуляции и специфической локализацией элементов сигнализации, управляющих притоком и выведением кальция из клетки, а также его белков-мишеней. Не будет преувеличением сказать, что успешное оплодотворение невозможно без исправно функционирующей системы регуляции кальциевого гомеостаза в гамете. В последние годы проведено множество исследований, направленных на прояснение механизмов индукции кальциевых сигналов в сперматозоидах разных видов, а также на анализ внутриклеточных эффектов этих сигналов и их локализацию в пространстве и времени. В данном обзоре мы попытались объединить полученные знания и обозначить вопросы, ответы на которые еще предстоит уточнить.
1. ВВЕДЕНИЕ
У сперматозоидов ядро транскрипционно неактивно, уровень трансляции в клетке незначителен, а значит, регуляция функционирования мужских гамет осуществляется главным образом за счет посттрансляционных процессов; скорость их намного выше по сравнению с долгосрочной регуляцией посредством влияния на экспрессию генов, так как достигается путем модификации уже имеющихся в клетке белков и ферментов. Кальциевая сигнализация – неотъемлемая часть системы “быстрой” регуляции функциональной активности сперматозоида; ионы кальция (Ca2+) играют ключевую роль в различных посттрансляционных модификациях (фосфорилирование, нитрозилирование и др.) ферментов и других белков, контролируя таким образом их активность [1]. Именно путем изменения внутриклеточного уровня Ca2+ ([Ca2+]i) в мужских гаметах индуцируются и регулируются основные постэякуляционные процессы сперматозоида: капацитация, гиперактивация и акросомная реакция (АР). Показано, что у индивидов с нарушениями в кальциевом гомеостазе сперматозоидов наблюдается недостаточность репродуктивной функции, а значит, изучение механизмов осуществления Ca2+-сигналов важно для понимания и впоследствии для решения проблем, связанных с бесплодием.
2. ПУТИ ПОВЫШЕНИЯ УРОВНЯ КАЛЬЦИЯ В ЦИТОЗОЛЕ
[Ca2+]i может повышаться двумя путями: притоком из внеклеточного пространства либо из внутриклеточных депо Ca2+ (ВД). И в том, и в другом случае имеет место поступление Ca2+ по градиенту концентрации через ионные каналы, что как минимум в 1000 раз быстрее транспорта через ионные обменники и помпы, а значит, позволяет клетке моментально реагировать на меняющиеся условия [2].
2.1. Кальциевые каналы наружной цитоплазматической мембраны сперматозоидов
В цитоплазматической мембране (ЦПМ) созревающих и зрелых спермиев млекопитающих в разные годы был обнаружен целый ряд ионных каналов, проницаемых для Ca2+, в числе которых потенциал-зависимые Ca2+-каналы (CaV), CNG-каналы (cyclic nucleotide-gated – управляемые циклическим нуклеотидом), TRPC-каналы (transient receptor potential canonical channel – канонические каналы кратковременного рецепторного потенциала), а также депо-управляемые каналы (SOC, store operated channel) ORAI. Однако за последние два десятилетия получено достаточно свидетельств того, что основную роль в обеспечении притока внеклеточного Ca2+ в зрелых сперматозоидах играют каналы CatSper (Cation channel of sperm – катионный канал спермиев). Последние являются наиболее изученными на сегодняшний день Ca2+-каналами мужских гамет. Они были описаны в 2001 г. у мыши как специфичные для сперматозоидов ионные каналы, локализованные в основной части хвостика, являющиеся необходимым элементом cAMP-опосредованного притока Ca2+, подвижности и оплодотворения [3]. Дальнейшие исследования продемонстрировали, что эти слабо потенциал-зависимые pH-чувствительные Ca2+-каналы – гетеротетрамеры и состоят из четырех основных образующих пору субъединиц, каждая из которых кодируется отдельным геном, и функционирование всех этих генов необходимо для обеспечения фертильности. Также сложную структуру канала формируют вспомогательные субъединицы CatSperβ, CatSperγ и CatSperδ, кодируемые как минимум 7 генами [4], и другие пока в полной мере не изученные составляющие [2]. Гены CatSper экспрессируются только в яичках в процессе сперматогенеза. У человека было показано, что мутации в генах CatSper1 и CatSper2 вызывают бесплодие у мужчин [4]. Получено множество свидетельств первостепенного значения CatSper-каналов для гиперактивации: хотя сперматозоиды мышей, нокаутных по генам CatSper1–4, проявляют нормальную Ca2+-независимую подвижность, мутантные клетки неспособны развить гиперактивацию. Мыши с дефектной CatSperδ стерильны, а среди бесплодных мужчин встречаются мутации в CatSper1 и 2, однако до настоящего времени не было обнаружено таких пациентов с мутациями CatSperβ и γ. На сперматозоидах быков показано, что для развития гиперактивации требуется приток Ca2+, индуцирующийся с ростом pH и, по-видимому, осуществляющийся через CatSper-каналы [5], что подтверждается отсутствием у сперматозоидов мыши pH-индуцированного роста [Ca2+]i и способности развивать гиперактивированную подвижность при дефектах CatSper1. Тем не менее в экспериментах с тимеросалом на мышах было показано, что даже в среде без Ca2+ и/или при отсутствии функционирующих CatSper-каналов гиперактивация у 20–40% гамет достигается путем мобилизации Ca2+ из ВД [6]. Позднее на сперматозоидах человека было показано, что вслед за поступлением Ca2+ через CatSper под воздействием прогестерона, происходит Ca2+-индуцированный выброс Ca2+ (CICR, Ca2+-induced Ca2+-release) ВД в области шейки и мобилизация Ca2+ из депо необходима для гиперактивации гамет [7]. Недавние исследования свидетельствуют, что поступление Ca2+ через CatSper, помимо гиперактивации, необходимо для передачи Ca2+-сигнала из хвостика на головку, вслед за этим в ней возрастает концентрация NADH, и мыши с дефектными CatSper-каналами демонстрируют более низкий уровень ATP по сравнению с диким типом. Последнее позволяет предположить, что поступление Ca2+ через каналы CatSper может регулировать и гомеостаз ATP. АР, судя по всему, не требует поступления Ca2+ из внеклеточной среды: щелочная деполяризация и добавление cGMP индуцировали АР у мышей с мутациями (–/–) в генах CatSper1 и 2 [4]. Вызывает интерес тот факт, что CatSper3 и 4 обнаруживаются в области акросомы поздних сперматид и сперматозоидов человека, что свидетельствует о возможной роли этих канальных белков в обеспечении АР мужских гамет человека [8].
Многие аспекты чувствительности CatSper к различным регуляторам отличаются у разных видов, демонстрируя эволюционные расхождения генов этих каналов. Регуляция активности каналов CatSper у человека in vivo подразумевает активацию компонентами фолликулярной жидкости, прогестероном и простагландинами, а также ростом внутриклеточного pH [4]. Все эти активаторы присутствуют в женском репродуктивном тракте и являются индукторами и необходимыми условиями гиперактивации и впоследствии АР. Как и у человека, каналы CatSper макаки-резус также демонстрируют чувствительность к прогестерону, однако же опосредованную белками блестящей оболочки (в отличие от CatSper человека, взаимодействующих с прогестероном напрямую) [9]. В то же время показано, что у сперматозоидов мыши каналы CatSper не чувствительны к прогестерону [10]. Аналогично 8-Br-cNMP (8-Br-циклонуклеотидмонофосфат: 8-Br-cAMP и 8-Br-cGMP) активируют каналы CatSper в сперматозоидах человека, но не в мужских гаметах мыши [4]. Так как для активации CatSper необходимо защелачивание цитоплазмы, в регуляции активности этих каналов принимают участие также переносчики H+ и другие ионные каналы: NHE (Na+/H+-обменник), HV1 (потенциалзависимый Н+-канал 1), SLO3K+ (специфичный для спермы K+-канал). Каналы SLO3K+ принимают участие в гиперполяризации ЦПМ сперматозоида при капацитации. На мышах показано, что активность SLO3K+ необходима для открытия CatSper, однако же дефектные SLO3K+ не мешают сперматозоидам успешно завершить другие этапы капацитации [11]. Самцы мыши с мутантными SLO3K+ и/или CatSper стерильны in vivo и демонстрируют значительно сниженную способность к оплодотворению in vitro [12]. У человека же показано, что помимо SLO3K+ в гиперполяризации мембраны участвует другой K+-канал, предположительно SLO1K+ [13]. SLO1K+ был также детектирован в передней части постакросомальной области, средней и основной части хвостика сперматозоидов хряка, в этом же исследовании приведены свидетельства важности этого канала для роста [Ca2+]i и акросомного экзоцитоза под воздействием прогестерона [14]. HV1 идентифицирован в хвостике сперматозоидов человека [15], где он может влиять на работу pH-зависимых каналов CatSper и SLO3K+. У мышей же показана роль в приобретении способности к оплодотворению другого пути изменения pH – специфичного для спермиев Na+/H+-обменника (sNHE): при отсутствии функционирующего sNHE самцы мыши стерильны [2]. Интересно, что первичная структура sNHE содержит домен связывания циклического нуклеотида: есть основания полагать, что работа обменника регулируется cAMP, концентрация которого повышается на начальных этапах капацитации [2]. Другие регуляторы активности CatSper-каналов – нейромедиаторы, хемокины и одоранты. На сперматозоидах человека показано, что последние способны активировать ток Ca2+ через CatSper, взаимодействуя с каналом напрямую, не вовлекая ни cAMP, ни рецептор, сопряженный с G-белком (GPCR) [4]. На активность CatSper-каналов способны оказывать влияние и такие гормоны, как прегненолона сульфат, оказывающий схожий с прогестероном эффект, а также тестостерон и гидрокортизон, ингибирующие действие прогестерона. Этими же авторами показано, что стероидоподобные молекулы, в частности, растительные тритерпеноиды пристимерин и лупеол, конкурируют как с прогестероном, так и с прегненолона сульфатом, и значительно снижают активацию CatSper этими соединениями. Более того, исследователи наблюдали снижение гиперактивации капацитированных гамет под воздействием пристимерина и лупеола, что делает растительные тритерпеноиды перспективными контрацептивными средствами [16]. Помимо прочего, на человеке продемонстрировано, что широкий спектр EGC (endocrine disrupting chemicals – веществ, нарушающих работу эндокринной системы), содержащихся в продуктах питания, бытовой химии и косметике, способен преждевременно активировать CatSper-каналы, делая их нечувствительными к воздействию прогестерона и других физиологических активаторов, а значит, нарушая механизм оплодотворения [17].
2.1.1. Каналы ORAI (названные в честь хранителей небесных врат в греческой мифологии [18]) – это небольшие белковые молекулы размером 28–33 кДа, расположенные на ЦПМ и образующие канальную пору четырьмя трансмембранными сегментами [19]. Это селективный Ca2+-канал, открывающийся при опустошении ВД и являющийся частью механизма SOCE (store operated Ca2+ entry – депо-управляемый приток Ca2+). В соматических клетках ORAI экспрессируется совместно со STIM (stromal interaction molecule – молекулой стромального взаимодействия), локализованной на мембране хранилищ Ca2+. STIM реагирует на снижение количества Ca2+ в депо, перемещаясь в сторону, примыкающую к цитоплазматической мембране клетки, где она запускает ORAI или, возможно, один из каналов TRPC. Получены свидетельства присутствия различных изоформ ORAI и STIM в сперматозоидах человека: метод иммунофлуоресценции показал локализацию ORAI1, ORAI2 и STIM2 в области акросомы, средней и основной части хвостика (для ORAI2 свечение антител в хвостике было незначительным), STIM1 – в средней части, с ярким свечением в области шейки, а также ORAI3 – в переднем отделе средней части и в области шейки гамет [20]. Также авторы продемонстрировали, что Ca2+-сигнал, запущенный CatSper-каналами хвостика, передается на головку при участии ORAI и SOCE. Показано, что прогестерон, активируя CatSper-каналы, запускает бифазный Ca2+-сигнал, первая фаза которого протекает в передней части хвостика и кратковременна, а за ней следует устойчивый Ca2+-сигнал в области головки и шейки. В данном исследовании предварительная обработка клеток 2-АФБ (2-аминоэтоксидифенил боратом) в концентрации 5 мкМ или лоперамидом, стимулирующими активность ORAI, в обоих случаях усиливала вторую, устойчивую фазу Ca2+-сигнала в области шейки/средней части, индуцированного прогестероном [20]. В другой работе показана роль ORAI1 для сперматогенеза мыши, а также продемонстрировано, что самцы с мутациями ORAI1–/– стерильны [21].
2.1.2. TRPC-каналы – характерные для млекопитающих гомологи семейства TRP, Ca2+-проницаемых каналов, обнаруженных у Drosophila и участвующих в активации фоторецепторов мухи (за что и получили свое название), регулируемой фосфолипазой С (PLC) [22]. Обычно каналы TRP состоят из 6 трансмембранных доменов, а также расположенных внутри клетки крупных амино- и карбоксильных концов [23]. В семействе TRPC 7 представителей, и все они экспрессируются в яичках [24]. Катионные каналы TRPC проницаемы для Na+, K+ и Ca2+ и не потенциал-зависимы, однако являются потенциал-чувствительными: их активность может меняться под воздействием мембранного потенциала [25]. Еще в 2003 г. получены данные о наличии TRPC1, 3, 4 и 6 в зрелых сперматозоидах человека с локализацией TRPC1 в основной части хвостика и в некоторых клетках – в задней части акросомальной области, TRPC3, 4 и 6 – в средней части, помимо этого TRPC3 – в области акросомы, а TRPC6 – точечно в основной части хвостика и незначительно – в головке [26]. В данном исследовании также с использованием ингибитора TRPC (SKF96365) продемонстрирована роль этого канала в обеспечении подвижности гамет. Приведены свидетельства присутствия TRPC2 в области акросомы и экваториальном сегменте сперматозоидов мыши и вклада TRPC2 в устойчивый приток Ca2+ под воздействием белков блестящей оболочки (ZP3) и обеспечение АР. Также показано присутствие TRPC1 и TRPC5 в области акросомы в передней части головки, а также TRPC3 в задней части головки и в основной части хвостика сперматозоидов мыши [27]. Также есть свидетельства, что TRPC, по крайней мере, в некоторых типах клеток, являются депо-управляемыми каналами и активируются как и ORAI при опустошении ВД Ca2+ [28]. Результаты исследования Lee и соавт. говорят о взаимодействии TRPC, STIM и ORAI, и авторами выдвинуто предположение, что механизм SOC на самом деле может обеспечиваться не отдельными канальными структурами (ORAI или TRPC), а сложным комплексом, в состав которого входят все перечисленные компоненты [29]. В сперматозоидах человека обработка SKF96365, ингибитором TRPC и SOCE, приводит к подавлению хемотаксиса, что говорит о возможной роли TRPC-каналов и SOCE с их участием в обеспечении данного процесса [30].
2.1.3. Другие TRP-каналы. Помимо TRPC в сперматозоидах также обнаружены и другие TRP-каналы. Так, показано присутствие каналов TRPM (M – melastatin – меластатин) и TRPV (V – vanilloid – ваниллоид) в сперматозоидах крысы [31], однако их роль до конца не ясна. Bernabò и соавт. в своей работе показали перемещение TRPV1-каналов в процессе капацитации из постакросомальной области в апикальную часть головки сперматозоидов хряка, а также падение [Ca2+]i и ингибирование полимеризации актина в области акросомы при обработке клеток капсазепином (антагонистом TRPV1-каналов) [32]. Активация же капсаицином (агонистом TRPV1-каналов) в данном исследовании приводила к деполимеризации мембраны и последующему открытию CaV-каналов. В недавнем исследовании получены данные, описывающие локализацию TRPV1-каналов в преакросомальной, акросомальной и постакросомальной областях, а также в области хвостика сперматозоидов быка [33]. Авторы привели неоднозначные данные о роли TRPV1 в функционировании гамет: как ингибирование канала капсазепином, так и его активация анандамидом приводили к снижению прямолинейно-поступательной подвижности, а также к индукции гиперактивации и капацитации (что было оценено хлортетрациклиновым тестом). Также получены данные о присутствии каналов TRPM8 в сперматозоидах человека [34]. Этот канал активируется ментолом, а также при понижении температуры; De Blas и соавт. в своей работе показали, что ментол активировал АР гамет, однако этот эффект подавлялся при предварительной обработке капсазепином или BCTC (еще один ингибитор TRPM8). Аналогичное исследование на мышах показало схожие результаты с той разницей, что в отличие от сперматозоидов человека, у которых обработка капсазепином и BCTC не влияла на активацию АР прогестероном и ZP3, у мыши ингибирование TRPM8 приводило к значительному подавлению АР под воздействием указанных физиологических индукторов [35].
2.1.4. CNG-каналы – это неселективные катионные каналы, обнаруженные в ЦПМ различных типов клеток. Они активируются при связывании циклического нуклеотида (cAMP или cGMP), обладают низкой ионной селективностью и являются слабо потенциал-зависимыми [19]. Хотя первым выделенным из яичек мыши ионным каналом спермиев стал именно CNG, долгое время его участие в обеспечении функционирования зрелых мужских гамет ставилось под сомнение [19] и на сегодняшний день роль CNG до конца не ясна. Показана высокая селективность к Ca2+ у CNG сперматозоидов мыши, а также вклад данного канала в поступление внеклеточного Ca2+ в цитозоль гамет и обеспечение капацитации. Авторы продемонстрировали, что циклические нуклеотиды (использовались их аналоги – 8Br-cAMP и 8Br-cGMP) способны увеличивать макроскопические ионные токи у сперматозоидов мыши. Ингибирование же CNG значительно снижало cGMP-индуцированный вход Ca2+ и капацитацию мужских гамет [36].
2.1.5. CaV-каналы. Роль потенциал-зависимых Ca2+-каналов (CaV) в сперматозоидах на сегодняшний день широко обсуждается [37]. Белковые структуры и мРНК CaV-каналов были обнаружены в сперматозоидах многих видов млекопитающих, а также было показано, что CaV3-каналы функционируют в сперматогониях мыши и человека [38] и в тестикулярных спермиях мыши [39]. Показано, что в некапацитированных эпидидимальных сперматозоидах мыши функционируют как минимум 2 CaV-канала: согласно полученным Wennemuth и соавт. данным, наиболее вероятно, что это CaV2.2 и CaV2.3 [40]. Интересно, что сперматозоиды мыши с дефектным CaV2.3, помимо снижения [Ca2+]i в области головки под воздействием α-D-манноза-БСА (БСА – бычий сывороточный альбумин), демонстрируют большую скорость и линейность движения по сравнению с диким типом [41]. Выдвинуто предположение, что CaV1- и CaV2-каналы имеют значение для АР мужских гамет человека, т.к. было показано, что часть притока Ca2+, необходимого для этого процесса, происходит через них [42]. Однако нокаутные по генам CaV3.1 и CaV3.2 (гены CaV3-канала) мыши обладают нормальной фертильностью [43], и в эпидидимальной сперме не было обнаружено функционирующих CaV-каналов. Тем не менее, в более позднем исследовании на мышах получены свидетельства в пользу обратного: мыши с дефектным CaV3.2 демонстрировали измененный Ca2+-сигнал, сниженные способность к АР и процент успешного IVF (субфертильный фенотип). При блокировании CaV3.2 у дикого типа (использовался SNX-482) наблюдалось значительное подавление АР, индуцированной холерным токсином B или ганглиозидом GM1: авторы показали, что мембранные перестройки, такие как выход холестерина и локальное повышение концентрации GM1, модулируют АР посредством влияния на активность CaV3.2-каналов [44].
2.2. Кальциевые каналы внутриклеточных депо сперматозоидов
Поступление Ca2+ из ВД не менее важно для реализации необходимых для оплодотворения процессов, чем вход этого иона извне. Показано участие мобилизации депонированного Ca2+ в капацитации, АР [45, 46] и гиперактивации [6, 7, 47], а термотаксис (вид хемотаксиса, движение гамет в сторону более высокой температуры) и вовсе регулируется исключительно Ca2+-сигналами, генерируемыми внутриклеточными хранилищами [48]. Наиболее распространенными среди различных типов клеток млекопитающих Ca2+-каналами являются инозитол-1,4,5-трифосфат (IP3)-чувствительный Ca2+-канал (или IP3-рецептор, IP3R) и рианодин-чувствительный Ca2+-канал (или Ry-рецептор, RyR), локализующиеся преимущественно на мембране эндоплазматического и саркоплазматического ретикулума (ЭР). Несмотря на разницу в массе (около 260–310 кДа для IP3R и 565 кДа для RyR), эти каналы, в особенности их трансмембранный домен, имеют участки со схожими последовательностями, что обуславливает способность к взаимодействию с одними и теми же соединениями, однако же с разным, иногда противоположным эффектом. Оба канала активируются и ингибируются Ca2+: показана колоколообразная зависимость активности IP3R и RyR от [Ca2+]i, причем максимальная вероятность открытия канала наблюдается при концентрации свободного Ca2+: 0.2 мкМ для IP3R и 1–100 мкМ для RyR [49].
2.2.1. IP3-рецептор – это белковый комплекс, состоящий из 8 трансмембранных доменов, а также имеющий сайты связывания Ca2+, IP3 и ATP, и остатки Ser, фосфорилируемые протеинкиназой А (PKA) и протеинкиназой G (PKG) [50]. В соматических невозбудимых клетках IP3R локализуется преимущественно на мембране ЭР, комплекса Гольджи и на ядерной оболочке [51]. Несмотря на отсутствие ЭР и комплекса Гольджи в зрелых сперматозоидах, подтверждено наличие IP3R в мужских гаметах многих видов млекопитающих с преимущественной локализацией в области акросомы, шейки и, иногда – средней части [52]. Показана роль IP3R, находящихся на мембране акросомы, в индукции АР мужских гамет млекопитающих [46]. Интересно, что, как показано на сперматозоидах человека, экспрессия IP3R1 значительно снижается после АР, тогда как экспрессия IP3R3 не меняется, что может свидетельствовать о роли данного канала в следующих за АР событиях. Помимо акросомы, IP3R присутствует в области шейки – на избыточной ядерной мембране (RNE, redundant nuclear envelope), которая расположена вблизи аксонемы, и есть свидетельства участия IP3R в гиперактивации [53]. Исследования на соматических клетках показали, что одной из функций IP3R является передача ионов Ca2+ митохондриям (МХ) и этот процесс необходим для обеспечения митохондриального дыхания и регуляции апоптоза [54]. Вкупе с данными о повышении [Ca2+]i под воздействием разобщителей митохондриального дыхания (2,4-динитрофенола и карбонилцианид-4-(трифторметокси)фенилгидразона; как известно, для работы митохондриального Ca2+-унипортера (MCU) необходим высокий мембранный потенциал), упомянутыми Correia и соавт. [1], все вышесказанное позволяет предположить, что передача Ca2+ МХ с участием IP3R имеет функциональное значение и для сперматозоидов.
Мобилизация Ca2+ через IP3R запускается активацией рецептора на ЦПМ, что приводит к образованию IP3, который, в свою очередь, образуется путем гидролиза фосфатидилинозитол-4,5-дифосфата (PIP2) PLC. Для открытия IP3-чувствительного Ca2+-канала необходим Ca2+ как соантагонист [50]. Также на активность канала может оказывать влияние множество белков, модулирующих Ca2+-сигналы активацией или ингибированием IP3R [51]. При опустошении ВД IP3R активирует SOC [1], и таким образом, IP3R сперматозоида, объем хранилищ Ca2+ которого невелик, может обеспечивать устойчивый приток Ca2+ в цитозоль.
2.2.2. Ry-рецептор. Другой переносчик Ca2+ соматических клеток – Ry-рецептор (RyR) – Ca2+-канал, названный так из-за чувствительности к алкалоиду рианодину. Присутствие и роль RyR в сперматозоидах изучено не так хорошо, как IP3R. Однако получены свидетельства наличия RyR в области шейки, средней части и, менее выраженно, в области акросомы сперматозоидов человека: были идентифицированы RyR1 и 2 в области шейки [55], есть данные о наличии RyR3 в зрелых сперматозоидах мыши, и исследование 2013 г. детектировало RyR в области акросомы [56]. Тем не менее, есть работы, в которых RyR не был обнаружен в зрелых мужских гаметах [52]. In vivo RyR активируется непосредственно Ca2+ по механизму CICR, причем его активация возможна в более широком диапазоне концентраций Ca2+, чем для IP3R [50]. Еще один физиологический активатор RyR – вторичный посредник cADP-рибоза, синтезирующаяся из NAD при участии фермента ADP-рибозилциклазы (CD-38) [1]. Park и соавт. продемонстрировали, что RyR и CD-38 включаются в состав зрелых сперматозоидов в процессе смешивания с секретом простаты, тогда как CatSper-каналы присутствуют в зрелых спермиях изначально [57].
На работу как IP3R, так и RyR влияют активные формы кислорода (АФК) и азота (АФА), окисляя специфические сайты с цистеиновыми радикалами [1]. АФК обладают как прямым активирующим воздействием на RyR1, усиливая взаимодействие субъединиц канала, так и непрямым – блокируя связывание с Ca2+-кальмодулином и апокальмодулином; в свою очередь, оксид азота (NO) блокирует прямое действие АФК, а также снижет эффективность апокальмодулина. В случае с IP3R процесс несколько усложняется: низкий уровень окисления цистеина сенсибилизирует канал, тогда как усиление оксидативного воздействия при обработке высокими дозами тимеросала ингибирует активность IP3R. Активность IP3R и RyR регулируется различными киназами, такими как PKA, PKG, кальмодулин-зависимая протеинкиназа II (CaMK II), протеинкиназа B (AKT), а также некоторыми тирозинкиназами [1]. Также показано, что в сперматозоидах человека обмен GDP на GTP в соответствующем домене Rap из семейства малых GTP-аз обеспечивает акросомальный экзоцитоз. При этом биологическая роль такого обмена заключается в мобилизации Ca2+ из IP3-чувствительных ВД [58]. В недавних исследованиях был изучен механизм данного процесса: активация Epac (фактор обмена гуаниновых нуклеотидов, активируемый cAMP) в присутствии cAMP приводит к обмену GDP на GTP в малой GTP-азе Rap1, что вызывает активацию PLC с образованием IP3 и последующей мобилизацией Са2+ из акросомы. Также cAMP активирует малые GTP-азы Rab3 и 27, завершающие экзоцитозный каскад [59]. В подтверждение полученных данных другая группа ученых продемонстрировала, что малая GTP-аза Rab3 может иметь различное влияние на акросомальный экзоцитоз в зависимости от типа связанного ею гуанинового нуклеотида, и гидролиз GTP на Rab3 необходим для завершения последних этапов АР [60]. В исследованиях Ghosh и соавт. были получены свидетельства существования переходов Ca2+ между ВД различных типов, активируемые GTP [61]. Авторы впервые экспериментально продемонстрировали разнонаправленное действие GTP на клетках нейробластомы и гладких мышц: GTP мобилизовал Са2+ из ВД, однако в присутствии оксалата (способного стимулировать депонирование Са2+) после быстрого периода мобилизации GTP стимулировал уже приток Са2+ во ВД. Согласно гипотезе Ghosh и соавт., GTP опосредует процесс образования связи между двумя типами ВД – рианодин- и IP3-чувствительными и обеспечивает переход Са2+ из рианодин- в IP3-чувствительные ВД. При совместном действии GTP и IP3 в клетках отмечается дополнительное освобождение Са2+ из ВД, что свидетельствует о перемещении Са2+ между депо. Нами также показано наличие взаимодействия между IP3-чувствительными и IP3-нечувствительными (предположительно, Ry-чувствительными) депо Ca2+ в процессе капацитации и АР [45]. В первом случае в образование связи депо вовлечен фибриллярный актин (F-актин) и ПКА: ингибирование полимеризации микрофиламентов цитохалазином Д, также как и обработка ингибитором ПКА соединением Н-89, подавляло как дополнительную мобилизацию Са2+ при воздействии теофиллина (повышающего уровень cAMP в клетке) в паре с GTP, так и стимулированную данной парой реагентов капацитацию. Можно предположить, что после мобилизации Ca2+ из ВД в области RNE, происходит перемещение мембранных пузырьков, несущих Ca2+ в область акросомы, с помощью актин-зависимого транспорта, основанного на полимеризации актина [62], с последующим слиянием мембраны пузырьков с мембраной акросомы. Вероятно, Ca2+ транспортируется связанным с кальретикулином, и в составе мембраны цитоплазматических пузырьков присутствует PIP2 – предшественник IP3 и диацилглицерола (ДАГ), помимо прочего необходимый для инактивации гельсолина (белка, разрезающего F-актин); косвенным подтверждением этому является тот факт, что для полимеризации актина в области головки необходим Са2+ и СаМК II [63], т.е. все перечисленные участники процесса могут перемещаться в область акросомы совместно. В случае же с АР было обнаружено, что в образовании связи депо под воздействием пары пролактин/GTP участвуют микротрубочки и протеинкиназа С (PKC): дополнительное высвобождение Ca2+ и стимуляция АР подавлялись при предварительной обработке нокодазолом (ингибитор полимеризации микротрубочек) и ингибитором PKC Ro 31-8220 [45]. Мы предполагаем, что в процессе капацитации сперматозоидов млекопитающих после высвобождения Ca2+ из RyR, активируется IP3R и в присутствии GDP происходит перемещение Са2+ из IP3-чувствительных в IP3-нечувствительные ВД. Также согласно нашей гипотезе, в процессе АР наблюдается обратный процесс: после активации IP3R в присутствии уже GTP наблюдается транзит Ca2+ из IP3-нечувствительных в IP3-чувствительные депо Са2+. Возможно, именно таким образом Ca2+-сигнал передается с хвостика на головку на начальных этапах капацитации; помимо этого, перемещение Ca2+ между депо может быть необходимо в сперматозоиде, где несмотря на малый объем цитоплазмы и относительно большую продолжительность повышения [Ca2+]i, клетка должна осуществлять точно локализованные Ca2+-индуцированные реакции, а также избегать перегрузки Ca2+ в МХ и, соответственно, индукции апоптоза.
3. ВЫВЕДЕНИЕ КАЛЬЦИЯ ИЗ КЛЕТКИ
В поддержание низкой концентрации Ca2+ в цитозоле эукариотических клеток основной вклад вносят Ca2+-насосы, или помпы, осуществляющие перенос ионов против электрохимического градиента с затратой энергии гидролиза ATP. Такие переносчики, называемые Ca2+-ATP-азами, расположены как в наружной цитоплазматической мембране – PMCA (plasma membrane Ca2+ ATPase), так и в мембране органелл, выполняющих функции ВД Ca2+ – SERCA (sarcoplasmic–endoplasmic reticulum ATPase) и SPCA (secretory pathway Ca2+ ATPase). Следует заметить, что названия переносчиков отражают правило, из которого бывают и исключения: например, у растений аналог SERCA встречается и в плазмалемме, и наоборот, характерная локализация PMCA – цитоплазматические вакуоли. Все 3 типа Ca2+-ATP-аз относятся к Р-типу (P – phosphorylation), для которого характерно изменение конформации Е1–Е2 с образованием временно фосфорилированного промежуточного состояния (2 Ca2+E1P → → 2 Ca2+E2P), необходимого для переноса Ca2+ через мембрану [64]. Все ATP-азы данного типа состоят из 10 трансмембранных и 3 цитоплазматических доменов: связывания ATP, фосфорилирования и домена, необходимого для перестройки трансмембранных спиралей при транспорте Ca2+.
3.1. Кальциевые ATP-азы ЦПМ сперматозоида
PMCA отличается от других представителей Р-типа ATP-аз наличием домена связывания кальмодулина (CaM) и в связи с этим большей молекулярной массой (130–140 кДа). Кальмодулин увеличивает сродство к Ca2+ и максимальную скорость реакции, являясь, таким образом, активатором исходящего тока Ca2+ в сперматозоиде. Из порядка двенадцати сплайсинговых вариантов PMCA в спермиях крысы и мыши обнаружена в основном PMCA4 – 90% от общего количества с локализацией в основной части хвостика. На мышах показано, что именно PMCA является основным путем удаления Ca2+ из цитозоля сперматозоидов [65]. При этом мутантные по гену PMCA4 мыши демонстрируют бесплодие у самцов [66]. Было также обнаружено, что механизм бесплодия в данном случае связан с неспособностью клеток эффективно снижать уровень Ca2+ в цитозоле: у мутантных по гену PMCA4 мышей наблюдали уровень Ca2+ в покое, равный 370 нМ (вместо 157 нМ у дикого типа), а также значительно сниженную способность к гиперактивации. В исследовании на быках с применением количественного ПЦР-теста было показано, что из двух форм PMCA4 основным сплайсинговым вариантом в яичке, головке и теле придатка является PMCA4b, тогда как в каудальной части эпидидимиса выделяется в основном более активная в отношении транспорта Ca2+ PMCA4a [67]. Предполагают, что смена изоформы при переходе спермиев в хвостик придатка говорит о возрастающей потребности в активном транспорте Ca2+ после попадания в женские половые пути. В исследованиях на спермиях человека показано присутствие PMCA4 в области акросомы, ее внутренней мембраны, а также в задней части головки, шейке, средней части и проксимальном отделе основной части хвостика. Авторы также продемонстрировали совместную локализацию и даже ассоциацию PMCA4 с NO-синтазами, в особенности в капацитированных спермиях с повышенным уровнем Ca2+. Метод коиммунопреципитации показал наличие комплексов c Ca2+/CaM-зависимыми серинкиназами (CASK), PMCA4 и NO-синтазами в простасомах семенной плазмы, откуда, по-видимому, эти комплексы попадают в сперматозоиды [66]. Существование таких комплексов говорит о роли PMCA4 в негативной регуляции активности NO-синтаз сперматозоида (активирующихся при повышении уровня Ca2+ в цитозоле), что уже было показано на моделях клеток эмбриональной почки HEK293 и нейробластомы Neuro-2a мыши. Помимо вышеупомянутого на клетках HEK293 получены данные о взаимодействии PMCA4 с сигнальным путем Ras через рецептор эпидермального фактора роста (EGFR), а значит, вполне вероятно наличие такого взаимодействия и в сперматозоидах, так как показано присутствие в мужских гаметах EGFR. В сперматозоидах человека запуск фосфорилирования белков по тирозину in vivo происходит помимо пути cAMP/киназной индукции, также при взаимодействии лигандов с рецепторами ЦПМ [68]. Рецепторные киназы, какой является и EGFR, стимулируют фосфорилирование белков по тирозину через каскад Ras-Raf-MEK-ERK-MAP (Ras – мембраносвязанные белки, малые GTP-азы; Raf – серин/ треонин-специфичные протеинкиназы; MEK – протеинкиназа, фосфорилирующая MAP) [69]. Таким образом, можно предположить вовлечение PMCA4 в регуляцию фосфорилирования белков по тирозину в процессе капацитации.
Другой группой исследователей было продемонстрировано, что для поддержания Ca2+-гомеостаза в сперматозоидах мыши также необходим баланс между JAM-A (Junctional adhesion molecule-A – соединительной молекулой адгезии А) и PMCA4b: показано, что взаимодействие CASK и PMCA4b приводит к инактивации ATP-азы, тогда как JAM-A косвенно осуществляет положительную регуляцию помпы, также связывая CASK. У мышей с дефективной JAM-A наблюдались значительная недостаточность как прогрессивной, так и, в особенности, гиперактивированной подвижности, электронно-плотные конденсированные МХ и гистопатологический фенотип, повторяющий таковой у мышей с недостаточностью PMCA4b. Исходя из этого, авторы сделали вывод, что при недостаточности JAM-A происходит нарушение оттока Ca2+ вовне через PMCA4b, а также наблюдается абнормальная секвестрация Ca2+ митохондриями [70].
Еще одним возможным для сперматозоидов путем регуляции активности PMCA4b является PKC, способная частично активировать PMCA4b, снимая ингибирование помпы фосфорилированием в области из 20 остатков ниже кальмодулин-связывающего домена. Однако, кальмодулин активирует ATP-азу более эффективно, снимая ингибирование сразу в 2 областях, независимо от сайта ингибирования, фосфорилируемого PKC [71].
3.2. Na+/Са2+-обменник
Помимо PMCA, являющейся основным путем вывода Ca2+ во внеклеточное пространство для невозбудимых клеток, в сперматозоидах присутствует также и Na+/Ca2+-обменник (NCX). Этот переносчик выводит одну молекулу Ca2+ против градиента, одновременно поставляя 3 молекулы натрия (Na+) в цитозоль за счет энергии электрохимического градиента. NCX может также и поставлять Ca2+ в клетку при деполяризации мембраны, либо при недостатке натрия во внеклеточной среде [65]. Есть 2 семейства данного переносчика: NCX и K+-зависимый NCX – NCKX. Показано наличие NCX как в эпидидимальных, так и в эякулированных спермиях быков, причем наблюдались различия в активности переносчика: в эпидидимальных сперматозоидах NCX вразрез со своей прямой функцией транспортировал ионы Ca2+ в цитозоль, а в эякулированных гаметах активность обменника была подавлена белком семенной плазмы. В яичках крысы были обнаружены NCX1.3 и NCX1.7 – 2 сплайсинговых варианта NCX1, а также были получены свидетельства присутствия NCKX3 в яичках мыши. Также на мышах были получены данные о роли NCX в удалении Ca2+ из цитозоля при повышении его концентрации, однако же вклад NCX был значительно меньше, чем у PMCA и, предположительно, роль обменника заключается в большей степени в обратном транспорте Ca2+ в цитозоль при его низких уровнях [65].
Также NCX присутствует в мембране в области акросомы и средней части сперматозоидов человека, и было показано, что при его ингибировании (использовался бепридил, 3',4'-дихлорбензамил гидрохлорид и KB-R7943) происходит повышение [Ca2+]i и значительное подавление подвижности спермиев [72]. Позже другой группой ученых было продемонстрировано, что инкубация спермиев как с ингибитором NCX KB-R7943, так и с ингибитором PMCA эозином приводит к ухудшению всех показателей подвижности CASA (Computer-assisted sperm analysis), тогда как при ингибировании Na+/H+-обменника и Na+/K+-ATP-азы происходит снижение только показателей прямолинейно-поступательного движения [73].
3.3. Кальциевые ATP-азы внутриклеточных депо
Для восполнения уровня Ca2+ ВД и ограничения Ca2+-сигналов служат внутриклеточные Ca2+-помпы – SERCA и SPCA, и их роль в функционировании зрелых сперматозоидов млекопитающих в данный момент широко обсуждается [1]. Главным переносчиком Ca2+ в соматических клетках, транспортирующим этот ион из цитозоля во ВД, является SERCA, и есть данные о ее локализации на везикулах ЭР как с IP3R, так и с RyR. Имеются также свидетельства присутствия аналогичных, а возможно и идентичных SERCA ATP-аз на наружной ядерной мембране клеток печени крысы. Структура внутриклеточной Ca2+-ATP-азы во многом схожа с таковой у PMCA, за тем отличием, что у SERCA отсутствует домен связывания кальмодулина [50], что, по всей видимости, способствует дифференциации помп по механизму регуляции их активности. У млекопитающих SERCA существует в 3 изоформах (SERCA1, SERCA2 и SERCA3), у каждой из которых, в свою очередь, имеется множество различных сплайсинговых форм, отличающихся по размеру белка и его регуляторным свойствам [74]. Наиболее распространенной изоформой является SERCA2, которая присутствует почти во всех типах клеток [1], в том числе и в сперматозоидах: показано наличие SERCA2 в зрелых сперматозоидах мыши, быка и человека. В том же исследовании с помощью метода вестерн-блот были получены данные о наличии в мужских гаметах как минимум 2 изоформ SERCA2, одна из которых локализована в области наружной мембраны акросомы, вторая – в средней части спермия. Активность SERCA может меняться под воздействием окислительного стресса, причем эффект может быть как стимулирующим, так и ингибирующим, в зависимости от окисляемого цистеинового остатка [75]. Интересно, что в яичках мыши показана экспрессия фосфоламбана – мышечного ингибитора SERCA2, и приведены свидетельства снижения уровня Ca2+ в сперматидах при накоплении этого белка, что может вести к нарушению дифференцировки и функционирования будущих гамет [76].
Другой внутриклеточной Ca2+-помпой, удаляющей Ca2+ из цитозоля во ВД соматических клеток, является SPCA. SPCA существует в 2 изоформах: SPCA1 и SPCA2, причем SPCA1 распространена в значительно большей степени. Характерной локализацией SPCA является аппарат Гольджи. Есть свидетельства наличия у сперматозоидов человека SPCA1, которая преимущественно локализована в области шейки спермия, где находится RNE и мембранные пузырьки, содержащие кальретикулин [77]. Интересно, что в сперматозоидах морского ежа иммунофлуоресценция показала локализацию SPCA в области МХ [78].
4. СЕКВЕСТРАЦИЯ КАЛЬЦИЯ МИТОХОНДРИЯМИ
Долгое время МХ рассматривались как основные Ca2+-аккумулирующие органеллы клетки. Перенос Ca2+ в матрикс осуществляется через MCU, расположенный на внутренней мембране. Выявлена природа MCU, как селективного Ca2+-канала с чрезвычайно высокой аффинностью к Ca2+ [79]. Ионы Ca2+ транспортируются через MCU по градиенту потенциала, образующегося на мембране в процессе нормального функционирования МХ. Выход Ca2+ из митохондриального матрикса осуществляется через переносчик, высвобождающий Ca2+ в цитозоль в обмен на H+ или Na+ – NCX. В 2010 г. было выявлено, что представитель семейства NCX – NCLX (Na+(Li+)/Ca2+-обменник – локализуется в кристах МХ и является основным Na+/Са2+-антипортером этих органелл [80].
Показано, что Ca2+ начинает закачиваться в матрикс МХ при повышении [Ca2+]i в покое (то есть без сигналов его длительного повышения [81]), что стимулирует синтез ATP путем окислительного фосфорилирования. И действительно, на сперматозоидах мыши показано, что вклад МХ в буферизацию Ca2+ повышался при ингибировании мембранных Ca2+-ATP-аз, что приводило к росту [Ca2+]i покоя [65]. Поглощение Ca2+ МХ имеет значительный эффект на Ca2+-сигналы соматических клеток, уменьшая их амплитуду и продолжительность, причем конкретная «форма» этого влияния в каждом типе клеток выражена по-своему [81]. Таким путем избегается Ca2+-активированный выброс Ca2+ из ВД. Локализация МХ в средней части зрелых сперматозоидов вполне позволяет осуществлять модуляцию Ca2+-сигналов таким образом: рядом с МХ в гамете находится мембранный вырост, образованный в результате конденсации хроматина, – RNE, несущая на себе, по разным данным, RyR и IP3R. Однако в сперматозоидах быков при мобилизации Ca2+ из ВД в области хвостика, которым признана RNE, не наблюдалось усиления синтеза ATP, что говорит об отсутствии в данном случае участия МХ в распространении Ca2+-сигнала [47]. В том же исследовании показано, что при ингибировании NCX МХ гиперактивация, стимулированная тапсигаргином (специфическим ингибитором SERCA), не подавлялась. Получены данные в пользу того, что в сперматозоидах человека МХ не оказывают влияния на колебания Ca2+, вызванные активацией ВД в области шейки под воздействием NO и прогестерона. Авторы привели данные, согласно которым в гаметах с разобщенным митохондриальным дыханием, предварительно обработанным NO (активирующим мобилизацию Ca2+ из депо), после добавления дитиотреитола (соединения, эффективно устраняющего эффекты S-нитрозилирования) [Ca2+]i возвращалась в норму аналогично тому, как это происходило в клетках с интактными МХ [82]. По всей видимости, в сперматозоидах необходима возможность поддерживать более длительные и интенсивные Ca2+-сигналы с участием ВД. Также не стоит забывать и о том, что при “перегрузке” МХ кальцием в них образуются Ca2+-зависимые поры, увеличивающие проницаемость мембраны (MPTP – mitochondrial permeability transition pore), что ведет к индукции апоптоза [81]. Возможно, для зрелых сперматозоидов, все постэякуляционные процессы в которых сопровождаются Ca2+-сигналами, такой сценарий является весьма вероятным и не менее нежелательным, а значит, “исключение” МХ из цепочки регуляции колебаний [Ca2+]i может иметь адаптивное значение.
5. ФУНКЦИОНАЛЬНОЕ ЗНАЧЕНИЕ КАЛЬЦИЕВОЙ СИГНАЛИЗАЦИИ В СПЕРМАТОЗОИДЕ
Роль Ca2+-сигнализации во всех типах клеток сложно переоценить: дефекты в ее ключевых элементах зачастую приводят к тяжелым патологиям и значительным нарушениям функционирования клеток, в том числе и половых. В сперматозоидах Ca2+ принимает участие во всех постэякуляционных процессах, включая оплодотворение. В цитоплазме спермиев поддерживается очень низкая концентрация Ca2+, а за счет ее повышения осуществляется регуляция посттрансляционных модификаций белков. [Ca2+]i может повышаться посредством притока этого иона извне через Ca2+-каналы наружной ЦПМ, либо посредством мобилизации Ca2+ из ВД, где концентрация иона до 4 раз выше в сравнении с цитоплазмой.
Показана роль колебаний [Ca2+]i в обеспечении подвижности и хемотаксиса сперматозоидов [83]. В аксонеме есть сайты связывания Ca2+, регулирующие изгиб хвостика посредством модуляции динеин-зависимого скольжения, и в процесс вовлечены кальмодулин и CaMK II [2]. Когда сперматозоиды покидают семенную жидкость и проходят цервикальную слизь, в гаметах начинают происходить биохимические изменения, необходимые для приобретения способности к АР и оплодотворению и называемые капацитацией. Эти изменения включают внутриклеточную модуляцию концентрации ионов, алкалинизацию цитоплазмы, перестройку липидного состава ЦПМ и ее гиперполяризацию, повышение активности PKA и фосфорилирование белков по тирозину, а также полимеризацию актина. Показано, что в процессе капацитации (рис. 1) происходит повышение [Ca2+]i путем поступления Ca2+ из внеклеточного пространства через каналы CatSper под воздействием способствующих капацитации агентов (таких как ${\text{HCO}}_{3}^{ - }$ и БСА) [84]. При этом в субпопуляции гамет исследователи наблюдали быстрый рост [Ca2+]i уже после 1 мин инкубации. Поступающий Ca2+ совместно с ${\text{HCO}}_{3}^{ - }$ активирует растворимую аденилатциклазу (рАЦ) спермия [4], за чем следует активация PKA и последующий каскад реакций с участием данного фермента, являющийся неотъемлемой частью капацитации. Помимо этого, Ca2+ необходим для другого необходимого атрибута капацитации – полимеризации актина. Связываясь с кальмодулином, Ca2+ активирует CaMK II, и у человека показано, что данный фермент опосредует образование F-актина в области головки, что, в свою очередь, предотвращает преждевременную АР; способность CaMK II ингибировать спонтанную АР показана также у быка и мыши [63]. У человека и мыши получены данные, говорящие о значении полимеризации актина в области хвостика для гиперактивации. Известно, что гиперактивация запускается подъемом концентрации Ca2+ в области хвостика; этот ион усиливает изгиб жгутика в одну из сторон, в результате чего меняется характер движений с симметричного на асимметричный [6]. Для поддержания гиперактивированной подвижности необходим внеклеточный Ca2+, однако есть свидетельства, что в индукцию гиперактивации вовлекается также Ca2+ ВД. Показано, что мобилизация Ca2+ из RNE и мембранных пузырьков в области шейки регулирует активность хвостика и участвует в гиперактивации, причем стимулированный тимеросалом выход Ca2+ из этих депо приводит к гиперактивации части спермиев мыши [6] и человека [7] даже при отсутствии внеклеточного Ca2+ и/или функционирующих CatSper-каналов. На последующих этапах капацитации [Ca2+]i в области головки растет, происходит деполимеризация актина и становится возможной АР. Экзоцитоз акросомальных ферментов, происходящий после слияния наружной мембраны акросомы и плазмалеммы, является необходимым этапом для преодоления оболочек яйцеклетки. Участие мобилизации Ca2+ из акросомы и SOCE в процессе индукции АР показано у мышей. Показано, что мобилизация Ca2+-депо необходима для запуска АР и является ее ключевым этапом [58]. Физиологические индукторы АР, такие как ZP3 и прогестерон, индуцируют приток Ca2+ через каналы CatSper, вследствие чего происходит активация PLC, катализирующей образование IP3 и диацилглицерина: первый активирует IP3R на наружной мембране акросомы, второй – стимулирует работу PKC, участвующей в обеспечении АР. Опустошение акросомального депо приводит к индукции SOCE и устойчивому притоку Ca2+, что, в свою очередь, индуцирует деполимеризацию актина и запускает АР.
Рис. 1.
Упрощенная модель Ca2+ сигнализации в постэякуляционных процессах сперматозоидов млекопитающих. На начальных этапах капацитации происходит поступление в цитоплазму ионов гидрокарбоната (${\text{HCO}}_{3}^{ - }$) и рост pH, что необходимо для активации растворимой аденилатциклазы (sAC), а также открытия каналов CatSper. Другим ранним событием является генерация активных форм кислорода и азота (АФК и АФА) мембранной оксидазой/NO-синтазой (NOS; в настоящий момент точно не идентифицирована) и/или эндогенно (главным образом митохондриями (MC). АФК окисляют холестерин с образованием оксистеролов, которые при контакте с альбуминами внеклеточного пространства покидают ЦПМ (PM), повышая ее текучесть и проницаемость. Помимо этого, супероксидный анион (${\text{O}}_{2}^{{\centerdot {\kern 1pt} - }}$) способен активировать мембранную аденилатциклазу (mAC), потенциалзависимый Ca2+-канал (CaV), а также фосфолипазу С (PLC); также АФК и АФА модулируют активность IP3–чувствительного и рианодин-чувствительного Ca2+ каналов (IP3R и RyR). По-видимому, незначительное повышение [Ca2+]i на ранних этапах капацитации приводит к активации RyR, находящегося в области избыточной ядерной мембраны (RNE, redundant nuclear envelope), а мобилизованный из депо Ca2+ активирует специфичный для спермиев калиевый канал (SLO3K+), участвующий в гиперполяризации мембраны, что также необходимо для активации CatSper и индукции гиперактивации. Возможно, ВД участвуют в индукции гиперактивации и напрямую, однако механизм данной взаимосвязи еще предстоит прояснить. Защелачивание цитоплазмы также активирует растворимую аденилатциклазу (sAC), запуская сигнальный каскад cAMP/PKA/TK. PKA (протеинкиназа А) и TK (тирозинкиназа) имеют множество субстратов, однако одним из важнейших является гельсолин – белок, который в активированном состоянии разрезает F-актин. Инактивация гельсолина фосфорилированием по тирозину совместно с активацией PLD (фосфолипазы D) и последующим образованием PA (фосфатидной кислоты) приводит к образованию F-актина из G-актина (глобулярного актина), что необходимо для создания барьера между наружной мембраной акросомы и ЦПМ и предотвращения спонтанной АР (sAR). В дальнейшем, после активации каналов CatSper Ca2+-сигнал передается с хвостика на головку; возможно, именно в этом состоит биологический смысл взаимодействия ВД, которое мы наблюдали в своих экспериментах. Также сформулирована гипотеза о роли депо-управляемого притока Ca2+ (SOCE) в данном процессе. SOCE активируется при опустошении ВД Ca2+ и осуществляется через депо-управляемые Ca2+-каналы (SOC – store operated channels: ORAI и TRPC) при посредничестве молекулы стромального взаимодействия (STIM). PLC, активированная АФК и Ca2+, гидролизует PIP2 до IP3 (активируя IP3R и усиливая Ca2+-сигнал) и диацилглицерола (DAG, участвующего в активации SOC и протеин киназы C ‑ PKC). Вероятно, IP3R также участвует в передаче Ca2+ митохондриям (MC) через митохондриальный кальциевый унипортер (MCU), что необходимо для производства ATP. На поздних этапах капацитации переданный на головку Ca2+-сигнал усиливается при участии акросомального хранилища: приток Ca2+ через IP3R приводит к быстрому опустошению депо, имеющего малые объемы, что вкупе с активацией SOCE обеспечивает устойчивый приток Сa2+. Последнее приводит к освобождению гельсолина, разрезанию F-актина, делая возможной индуцированную АР (iАR) при контакте с ZP3 (гликопротеином блестящей оболочки). Неупомянутые сокращения: PMCA – Ca2+-ATP-аза плазматической мембраны; NCX – Na+/Са2+-обменник; SERCA – Са2+-ATP-аза саркоплазматического/эндоплазматического ретикулума; SPCA – Са2+-ATP-аза секреторного пути; cAMP – циклический AMP.
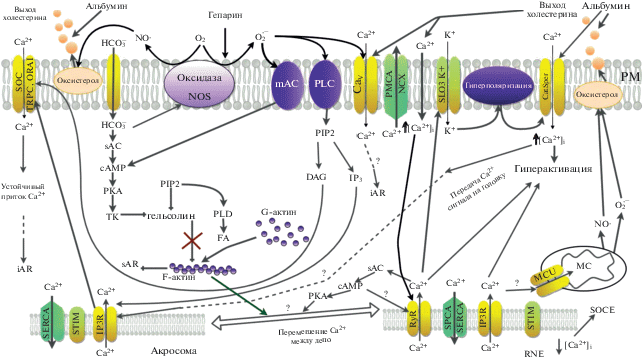
За последние годы исследователи значительно продвинулись в понимании молекулярно-биологических механизмов, определяющих функционирование сперматозоида и приобретение им способности к оплодотворению. Хорошо установлена и подтверждена ключевая роль Ca2+ в обеспечении всех постэякуляционных процессов в мужских гаметах. Однако несмотря на обширность имеющихся данных, существует множество нерешенных вопросов (в том числе: межвидовые различия биохимических механизмов, обеспечивающих фертильность; каким образом Ca2+-сигнал передается с хвостика на головку в процессе капацитации; характер взаимосвязи активации мембранных оксидаз и роста [Ca2+]i на начальных этапах капацитации и др.), нахождение ответов на которые позволит достичь понимания как процессов, детерминирующих оплодотворение in vivo и in vitro, так и механизмов снижения оплодотворяющей способности спермы и мужского бесплодия.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
Источники финансирования. Работа выполнялась в рамках программы исследований в соответствии с Госзаданием № 0445-2021-0005, запланированных во Всероссийском научно-исследовательском институте генетики и разведения сельскохозяйственных животных – филиала ФИЦ животноводства – ВИЖ имени Л.К. Эрнста.
Соответствие принципам этики. Все применимые международные, национальные и/или институциональные принципы ухода и использования животных были соблюдены.
Список литературы
Correia J., Michelangeli F., Publicover S. 2015. Regulation and roles of Ca2+ stores in human sperm. Reproduction. 150 (2), R65–R76.
Wang H., McGoldrick L.L., Chung J.J. 2020. Sperm ion channels and transporters in male fertility and infertility. Nat. Rev. Urol. 18 (1), 46–66.
Ren D., Navarro B., Perez G., Jackson A.C., Hsu S., Shi Q., Tilly J.L., Clapham D.E. 2001. A sperm ion channel required for sperm motility and male fertility. Nature. 413 (6856), 603–609.
Sun X.H., Zhu Y.Y., Wang L., Liu H.L., Ling Y., Li Z.L., Sun L.B. 2017. The CatSper channel and its roles in male fertility: A systematic review. Reprod. Biol. Endocrinol. 15 (65), 1–12.
Marquez B., Suarez S.S. 2007. Bovine sperm hyperactivation is promoted by alkaline-stimulated Ca2+ influx. Biol. Reprod. 76 (4), 660–665.
Marquez B., Ignotz G., Suarez S.S. 2007. Contributions of extracellular and intracellular Ca2+ to regulation of sperm motility: Release of intracellular stores can hyperactivate CatSper1 and CatSper2 null sperm. Dev. Biol. 303, 214–221.
Alasmari W., Barratt C.L., Publicover S.J., Whalley K.M., Foster E., Kay V., Martins da Silva S., Oxenham S.K. 2013. The clinical significance of calcium-signalling pathways mediating human sperm hyperactivation. Hum. Reprod. 28 (4), 866–876.
Jin J.L., O’Doherty A.M., Wang S., Zheng H., Sanders K.M., Yan W. 2005. Catsper3 and catsper4 encode two cation channel-like proteins exclusively expressed in the testis. Biol. Reprod. 73 (6), 1235–1242.
Sumigama S., Mansell S., Miller M., Lishko P.V., Cherr G.N., Meyers S.A., Tollner T. 2015. Progesterone accelerates the completion of sperm capacitation and activates CatSper Channel in spermatozoa from the rhesus macaque. Biol. Reprod. 93 (6), 130.
Lishko P.V., Botchkina I.L., Kirichok Y. 2011. Progesterone activates the principal Ca2+ channel of human sperm. Nature. 471 (7338), 387–391.
Chávez J.C., Ferreira J.J., Butler A., De La Vega Beltrán J.L., Treviño C.L., Darszon A., Salkoff L., Santi C.M. 2014. SLO3 K+ channels control calcium entry through CATSPER channels in sperm. J. Biol. Chem. 289 (46), 32266–32275.
Zeng X.H., Yang C., Kim S.T., Lingle C.J., Xia X.M. 2011. Deletion of the Slo3 gene abolishes alkalization-activated K+ current in mouse spermatozoa. Proc. Natl. Acad. Sci. USA. 108 (14), 5879–5884.
Sanchez-Carranza O., Torres-Rodriguez P., Darszon A., Trevino C.L., Lopez-Gonzalez I. 2015. Pharmacology of hSlo3 channels and their contribution in the capacitation-associated hyper-polarization of human sperm. Biochem. Biophys. Res. Commun. 466, 554–559.
Yeste M., Llavanera M., Pérez G., Scornik F., Puig-Parri J., Brugada R., Bonet S., Pinart E. 2019. Elucidating the role of K+ channels during in vitro capacitation of boar spermatozoa: Do SLO1 channels play a crucial role? Int. J. Mol. Sci. 20 (24), 6330.
Lishko P.V., Botchkina I.L., Fedorenko A., Kirichok Y. 2010. Acid extrusion from human spermatozoa is mediated by flagellar voltage-gated proton channel. Cell. 140, 327–337.
Mannowetz N., Miller M.R., Lishko P.V. 2017. Regulation of the sperm calcium channel CatSper by endogenous steroids and plant triterpenoids. Proc. Natl. Acad. Sci. USA. 114 (22), 5743–5748.
Schiffer C., Müller A., Egeberg D.L., Alvarez L., Brenker C., Rehfeld A., Frederiksen H., Wäschle B., Kaupp U.B., Balbach M., Wachten D., Skakkebaek N.E., Almstrup K., Strünker T. 2014. Direct action of endocrine disrupting chemicals on human sperm. EMBO Rep. 15 (7), 758–765.
Feske S., Gwack Y., Prakriya M., Srikanth S., Puppel S.H., Tanasa B., Hogan P.G., Lewis R.S., Daly M., Rao A. 2006. A mutation in Orai1 causes immune deficiency by abrogating CRAC channel function. Nature. 441 (7090), 179–185.
Darszon A., Nishigaki T., Beltran C., Treviño C.L. 2011. Calcium channels in the development, maturation, and function of spermatozoa. Physiol. Rev. 91 (4), 1305–1355.
Lefièvre L., Nash K., Mansell S., Costello S., Punt E., Correia J., Morris J., Kirkman-Brown J., Wilson S.M., Barratt C.L., Publicover S. 2012. 2-APB-potentiated channels amplify CatSper-induced Ca2+ signals in human sperm. Biochem. J. 448 (2), 189–200.
Davis F.M., Goulding E.H., D’Agostin D.M., Janardhan K.S., Cummings C.A., Bird G.S., Eddy E.M., Putney J.W. 2016. Male infertility in mice lacking the store-operated Ca2+ channel Orai1. Cell Calcium. 59 (4), 189–197.
Vazquez G., Wedel B.J., Aziz O., Trebak M., Putney J.W. Jr. 2004. The mammalian TRPC cation channels. Biochim. Biophys. Acta. 1742 (1–3), 21–36.
Darszon A., Sánchez-Cárdenas C., Orta G., Sánchez-Tusie A.A., Beltrán C., López-González I., Granados-González G., Treviño C.L. 2012. Are TRP channels involved in sperm development and function? Cell Tissue Res. 349 (3), 749–764.
Kumar P.G., Shoeb M. 2011. The role of trp ion channels in testicular function. Adv. Exp. Med. Biol. 704, 881–908.
Beech D.J. 2012. Integration of transient receptor potential canonical channels with lipids. Acta Physiol. (Oxf.). 204 (2), 227–237.
Castellano L.E., Treviño C.L., Rodríguez D., Serrano C.J., Pacheco J., Tsutsumi V., Felix R., Darszon A. 2003. Transient receptor potential (TRPC) channels in human sperm: Expression, cellular localization and involvement in the regulation of flagellar motility. FEBS Lett. 541 (1–3), 69–74.
Sutton K.A., Jungnickel M.K., Wang Y., Cullen K., Lambert S., Florman H.M. 2004. Enkurin is a novel calmodulin and TRPC channel binding protein in sperm. Dev. Biol. 274 (2), 426–435.
Yuan J.P., Zeng W., Huang G.N., Worley P.F., Muallem S. 2007. STIM1 heteromultimerizes TRPC channels to determine their function as store-operated channels. Nat. Cell Biol. 9, 636–645.
Lee K.P., Yuan J.P., Hong J.H., So I., Worley P.F., Muallem S. 2010. An endoplasmic reticulum/plasma membrane junction: STIM1/Orai1/TRPCs. FEBS Lett. 584 (10), 2022–2027.
Teves M.E., Guidobaldi H.A., Uñates D.R., Sanchez R., Miska W., Publicover S.J., Morales Garcia A.A., Giojalas L.C. 2009. Molecular mechanism for human sperm chemotaxis mediated by progesterone. PLoS One. 4 (12), e8211.
Li S., Wang X., Ye H., Gao W., Pu X., Yang Z. 2010. Distribution profiles of transient receptor potential melastatin- and vanilloid-related channels in rat spermatogenic cells and sperm. Mol. Biol. Rep. 37 (3), 1287–1293.
Bernabò N., Pistilli M.G., Mattioli M., Barboni B. 2010. Role of TRPV1 channels in boar spermatozoa acquisition of fertilizing ability. Mol. Cell Endocrinol. 323 (2), 224–231.
Kumar A., Mishra A.K., Singh V., Yadav S., Saxena A., Garg S.K., Swain D.K. 2019. Molecular and functional insights into transient receptor potential vanilloid 1 (TRPV1) in bull spermatozoa. Theriogenology. 128, 207–217.
De Blas G.A., Darszon A., Ocampo A.Y., Serrano C.J., Castellano L.E., Hernández-González E.O., Chirinos M., Larrea F., Beltrán C., Treviño C.L. 2009. TRPM8, a versatile channel in human sperm. PLoS One. 4 (6), e6095.
Martínez-López P., Treviño C.L., de la Vega-Beltrán J.L., De Blas G., Monroy E., Beltrán C., Orta G., Gibbs G.M., O’Bryan M.K., Darszon A. 2011. TRPM8 in mouse sperm detects temperature changes and may influence the acrosome reaction. J. Cell Physiol. 226 (6), 1620–1631.
Cisneros-Mejorado A., Hernández-Soberanis L., Islas-Carbajal M.C., Sánchez D. 2014. Capacitation and Ca2+ influx in spermatozoa: Role of CNG channels and protein kinase G. Andrology. 2 (1), 145–154.
Visconti P.E., Krapf D., De la Vega-Beltrán J.L., Acevedo J.J., Darszon A. 2011. Ion channels, phosphorylation and mammalian sperm capacitation. Asian J. Androl. 13 (3), 395–405.
Lievano A., Santi C.M., Serrano C.J., Treviño C.L., Bellvé A.R. Hernández-Cruz A., Darszon A. 1996. T-type Ca2+ channels and alpha1E expression in spermatogenic cells, and their possible relevance to the sperm acrosome reaction. FEBS Lett. 388, 150–154.
Martınez-Lopez P., Santi C.M., Trevino C.L., Ocampo-Gutierrez A.Y., Acevedo J.J. Alisio A., Salkoff L.B., Darszon A. 2009. Mouse sperm K+ currents stimulated by pH and cAMP possibly coded by Slo3 channels. Biochem. Biophys. Res. Commun. 381, 204–209.
Wennemuth G., Westenbroek R.E., Xu T., Hille B., Babcock D.F. 2000. CaV2.2 and CaV2.3 (N- and R-type) Ca2+ channels in depolarization-evoked entry of Ca2+ into mouse sperm. J. Biol. Chem. 275 (28), 21210–21217.
Sakata Y., Saegusa H., Zong S., Osanai M., Murakoshi T., Shimizu Y., Noda T., Aso T., Tanabe T. 2002. Ca(v)2.3 (alpha1E) Ca2+ channel participates in the control of sperm function. FEBS Lett. 516 (1–3), 229–233.
José O., Hernández-Hernández O., Chirinos M., González-González M.E., Larrea F., Almanza A., Felix R., Darszon A., Treviño C.L. 2010. Recombinant human ZP3-induced sperm acrosome reaction: Evidence for the involvement of T- and L-type voltage-gated calcium channels. Biochem. Biophys. Res. Commun. 395 (4), 530–534.
Stamboulian S., Kim D., Shin H.S., Ronjat M., De Waard M., Arnoult C. 2004. Biophysical and pharmacological characterization of spermatogenic T-type calcium current in mice lacking the CaV3.1 (alpha1G) calcium channel: CaV3.2 (alpha1H) is the main functional calcium channel in wild-type spermatogenic cells. J. Cell Physiol. 200, 116–124.
Cohen R., Buttke D.E., Asano A., Mukai C., Nelson J.L., Ren D., Miller R.J., Cohen-Kutner M., Atlas D., Travis A.J. 2014. Lipid modulation of calcium flux through CaV2.3 regulates acrosome exocytosis and fertilization. Dev. Cell. 28 (3), 310–321.
Денисенко В.Ю. Бойцева Е.Н., Кузьмина Т.И. 2015. Освобождение Ca2+ из внутриклеточных депо сперматозоидов Bos taurus в зависимости от их функционального состояния. Цитология. 57 (3), 233–239.
Li Y.Y., Jia Y.P., Duan L.Y., Li K.M. 2020. Participation of the inositol 1,4,5-trisphosphate-gated calcium channel in the zona pellucida- and progesterone-induced acrosome reaction and calcium influx in human spermatozoa. Asian J. Androl. 22 (2), 192–199.
Ho H.C., Suarez S.S. 2003. Characterization of the intracellular calcium store at the base of the sperm flagellum that regulates hyperactivated motility. Biol. Reprod. 68, 1590–1596.
Bahat A., Eisenbach M. 2010. Human sperm thermotaxis is mediated by phospholipase C and inositol trisphosphate receptor Ca2+ channel. Biol. Reprod. 82 (3), 606–616.
Bezprozvanny I., Watras J., Ehrlich B.E. 1991. Bell-shaped calcium-response curves of Ins(1,4,5)P3- and calcium-gated channels from endoplasmic reticulum of cerebellum. Nature. 351 (6329), 751–754.
Зинченко В.П., Долгачева Л.П. 2003. Внутриклеточная сигнализация: Учеб. пособие. Пущино: Электронное издательство “Аналитическая микроскопия”. 84 с.
Prole D.L., Taylor C.W. 2019. Structure and function of IP3 receptors. Cold Spring Harb. Perspect. Biol. 11 (4), a035063.
Dragileva E., Rubinstein S., Breitbart H. 1999. Intracellular Ca2+-Mg2+-ATPase regulates calcium influx and acrosomal exocytosis in bull and ram spermatozoa. Biol. Reprod. 61 (5), 1226–1234.
Fujinoki M. 2012. Progesterone-enhanced sperm hyperactivation through IP3-PKC and PKA signals. Reprod. Med. Biol. 12 (1), 27–33.
La Rovere R.M., Roest G., Bultynck G., Parys J.B. 2016. Intracellular Ca2+ signaling and Ca2+ microdomains in the control of cell survival, apoptosis and autophagy. Cell Calcium. 60 (2), 74–87.
Lefievre L., Chen Y., Conner S.J., Scott J.L., Publicover S.J., Ford W.C., Barratt C.L. 2007. Human spermatozoa contain multiple targets for protein S-nitrosylation: An alternative mechanism of the modulation of sperm function by nitric oxide? Proteomics. 7, 3066–3084.
Zhou Y., Ru Y., Wang C., Wang S., Zhou Z., Zhang Y. 2013. Tripeptidyl peptidase II regulates sperm function by modulating intracellular Ca2+ stores via the ryanodine receptor. PLoS One. 8 (6), e66634.
Park K.H., Kim B.J., Kang J., Nam T.S., Lim J.M., Kim H.T., Park J.K., Kim Y.G., Chae S.W., Kim U.H. 2011. Ca2+ signaling tools acquired from prostasomes are required for progesterone-induced sperm motility. Sci. Signal. 4 (173), ra31.
Ruete, M.C., Lucchesi O., Bustos M.A., Tomes C.N. 2014. Epac, Rap and Rab3 act in concert to mobilize calcium from sperm’s acrosome during exocytosis. Cell Commun. Signal. 12, 43.
Lucchesi O., Ruete M.C., Bustos M.A., Quevedo M.F., Tomes C.N. 2016. The Signaling module cAMP/epac/Rap1/PLCƐ /IP3 mobilizes acrosomal calcium during sperm exocytosis. Biochim. Biophys. Acta. 1863 (4), 544–561.
Bustos M.A., Roggero C.M., De la Iglesia P.X., Mayorga L.S., Tomes C.N. 2014. GTP-bound Rab3A exhibits consecutive positive and negative roles during human sperm dense-core granule exocytosis. J. Mol. Cell Biol. 6 (4), 286–298.
Ghosh T.K., Mullaney J.M., Tarazi F.I., Gill D.L. 1989. GTP-activated communication between distinct inositol 1,4,5-trisphosphate-sensitive and -insensitive calcium pools. Nature. 340 (6230), 236–239.
Хайтлина С.Ю. 2014. Внутриклеточный транспорт, основанный на полимеризации актина. Биохимия. 79 (9), 1135–1147.
Shabtay O., Breitbart H. 2016. CaMKII prevents spontaneous acrosomal exocytosis in sperm through induction of actin polymerization. Dev. Biol. 415 (1), 64–74.
Jimenez-Gonzalez C., Michelangeli F., Harper C.V., Barratt C.L., Publicover S.J. 2006. Calcium signalling in human spermatozoa: A specialized 'toolkit' of channels, transporters and stores. Hum. Reprod. Update. 12 (3), 253–267.
Wennemuth G., Babcock D.F., Hille B. 2003. Calcium clearance mechanisms of mouse sperm. J. Gen. Physiol. 122, 115–128.
Andrews R.E., Galileo D.S., Martin-DeLeon P.A. 2015. Plasma membrane Ca2+-ATPase 4: Interaction with constitutive nitric oxide synthases in human sperm and prostasomes which carry Ca2+/CaM-dependent serine kinase. Mol. Hum. Reprod. 21 (11), 832–843.
Brandenburger T., Strehler E.E., Filoteo A.G., Caride A.J., Aumüller G., Post H., Schwarz A., Wilhelm B. 2011. Switch of PMCA4 splice variants in bovine epididymis results in altered isoform expression during functional sperm maturation. J. Biol. Chem. 286 (10), 7938–7946.
Gangwar D.K., Atreja S.K. 2015. Signalling events and associated pathways related to the mammalian sperm capacitation. Reprod. Domest. Anim. 50 (5), 705–711.
Roberts P.J., Der C.J. 2007. Targeting the Raf-MEK-ERK mitogen-activated protein kinase cascade for the treatment of cancer. Oncogene. 26, 3291–3310.
Aravindan R.G., Fomin V.P., Naik U.P., Modelski M.J., Naik M.U., Galileo D.S., Duncan R.L., Martin-Deleon P.A. 2012. CASK interacts with PMCA4b and JAM-A on the mouse sperm flagellum to regulate Ca2+ homeostasis and motility. J. Cell Physiol. 227 (8), 3138–3150.
Enyedi A., Verma A.K., Filoteo A.G., Penniston J.T. 1996. Protein kinase C activates the plasma membrane Ca2+ pump isoform 4b by phosphorylation of an inhibitory region downstream of the calmodulin-binding domain. J. Biol. Chem. 271 (50), 32461–32467.
Krasznai Z., Krasznai Z.T., Morisawa M., Bazsáné Z.K., Hernádi Z., Fazekas Z., Trón L., Goda K., Márián T. 2006. Role of the Na+/Ca2+ exchanger in calcium homeostasis and human sperm motility regulation. Cell Motil. Cytoskeleton. 63 (2), 66–76.
Peralta-Arias R.D., Vívenes C.Y., Camejo M.I., Piñero S., Proverbio T., Martínez E., Marín R., Proverbio F. 2015. ATPases, ion exchangers and human sperm motility. Reproduction. 149 (5), 475–484.
Michelangeli F., East J.M. 2011. A diversity of SERCA Ca2+ pump inhibitors. Biochem. Soc. Trans. 39 (3), 789–797.
Csordas G., Hajnoczky G. 2009. SR/ER-mitochondrial local communication: calcium and ROS. Biochim. Biophys. Acta. 1787, 1352–1362.
Niemeyer J., Mentrup T., Heidasch R., Müller S.A., Biswas U., Meyer R., Papadopoulou A.A., Dederer V., Haug-Kröper M., Adamski V., Lüllmann-Rauch R., Bergmann M., Mayerhofer A., Saftig P., Wennemuth G., Jessberger R., Fluhrer R., Lichtenthaler S.F., Lemberg M.K., Schröder B. 2019. The intramembrane protease SPPL2c promotes male germ cell development by cleaving phospholamban. EMBO Rep. 20 (3), e46449.
Harper C., Wootton L., Michelangeli F., Lefièvre L., Barratt C., Publicover S. 2005. Secretory pathway Ca2+-ATPase (SPCA1) Ca2+ pumps, not SERCAs, regulate complex [Ca2+]i signals in human spermatozoa. J. Cell Sci. 118 (8), 1673–1685.
Gunaratne H.J., Vacquier V.D. 2006. Evidence for a secretory pathway Ca2+-ATPase in sea urchin spermatozoa. FEBS Lett. 580 (16), 3900–3904.
Kirichok Y., Krapivinsky G., Clapham D.E. 2004. The mitochondrial calcium uniporter is a highly selective ion channel. Nature. 427 (6972), 360–364.
Palty R., Silverman W.F., Hershfinkel M., Caporale T., Sensi S.L., Parnis J., Nolte C., Fishman D., Shoshan-Barmatz V., Herrmann S., Khananshvili D., Sekler I. 2010. NCLX is an essential component of mitochondrial Na+/Ca2+ exchange. Proc. Natl. Acad. Sci. USA. 107 (1), 436–441.
Gunter T.E., Yule D.I., Gunter K.K., Eliseev R.A., Salter J.D. 2004. Calcium and mitochondria. FEBS Lett. 567 (1), 96–102.
Machado-Oliveira G., Lefievre L., Ford C., Herrero M.B., Barratt C., Connolly T.J., Nash K., Morales-Garcia A., Kirkman-Brown J., Publicover S. 2008. Mobilisation of Ca2+ stores and flagellar regulation in human sperm by S-nitrosylation: a role for NO synthesized in the female reproductive tract. Development. 135, 3677–3686.
Guerrero A., Carneiro J., Pimentel A., Wood C.D., Corkidi G., Darszon A. 2011. Strategies for locating the female gamete: The importance of measuring sperm trajectories in three spatial dimensions. Mol. Hum. Reprod. 17 (8), 511–523.
Luque G.M., Dalotto-Moreno T., Martín-Hidalgo D., Ritagliati C., Puga Molina L.C., Romarowski A., Balestrini P.A., Schiavi-Ehrenhaus L.J., Gilio N., Krapf D., Visconti P.E., Buffone M.G. 2018. Only a subpopulation of mouse sperm displays a rapid increase in intracellular calcium during capacitation. J. Cell Physiol. 233 (12), 9685–9700.
Дополнительные материалы отсутствуют.
Инструменты
Биологические мембраны: Журнал мембранной и клеточной биологии


