Биологические мембраны: Журнал мембранной и клеточной биологии, 2022, T. 39, № 5, стр. 404-416
Слияние мембран пероксисомы и липидной капли: расширение π-образной структуры
Р. Ю. Молотковский a, *, П. И. Кузьмин a
a Институт физической химии и электрохимии им. А.Н. Фрумкина РАН
119071 Москва, Россия
* E-mail: rodion.molotkovsky@gmail.com
Поступила в редакцию 26.04.2022
После доработки 14.05.2022
Принята к публикации 17.05.2022
- EDN: OSTGSM
- DOI: 10.31857/S0233475522050103
Аннотация
Классическая теория слияния рассматривает слияние бислойных мембран как объединение материала самих мембран и окруженных ими водных объемов. Было показано, что слияние мембран сопровождается значительной деформацией липидных монослоев. Оптимальная траектория процесса проходит через несколько промежуточных структур, характеризующихся локальными минимумами свободной энергии системы; минимумы разделены энергетическими барьерами. Ключевыми интермедиатами слияния являются сталк, в котором контактирующие монослои мембран уже слились, а дистальные монослои – еще нет, и диафрагма полуслияния – структура с протяженным липидным бислоем, образованным двумя дистальными монослоями сливающихся мембран, располагающимся в центре между радиально сместившимися слившимися контактными монослоями. В настоящей работе с позиций классической теории изучалось слияние бислойной мембраны и липидного монослоя, находящегося на границе раздела вода–триолеин. Была рассмотрена промежуточная π-образная структура, образующаяся в результате слияния монослоя липидной капли и бислоя пероксисомы, и проанализирована зависимость ее энергии от геометрических параметров и упругих характеристик системы. В частности, было показано, что π-образная структура схожа с диафрагмой полуслияния классической теории слияния бислойных мембран – увеличение радиальных размеров обеих структур становится более энергетически выгодным при уменьшении спонтанной кривизны монослоев мембраны. Этот результат согласуется с имеющимися экспериментальными данными по слиянию липидных капель с пероксисомами.
ВВЕДЕНИЕ
Клетки являются открытыми неравновесными системами. Для нормальной жизнедеятельности им необходимо поддерживать градиенты химических и электрохимических потенциалов различных веществ между цитоплазмой и внеклеточной средой, а также на мембранах различных внутриклеточных органелл. В процессе клеточной жизнедеятельности органеллы, а значит и ограничивающие их липидные мембраны, постоянно сливаются и делятся. Слияние мембран также играет важнейшую роль во многих биологических процессах, таких как экзоцитоз, оплодотворение, секреция, синаптическая передача и т.д. [1]. Под слиянием понимается объединение материала самих мембран и окруженных ими водных объемов; барьерная функция мембраны при этом не должна быть нарушена. Экспериментальные данные, накопленные к началу 1980-х годов, также говорили о том, что слияние мембран не может быть осуществлено просто путем разрыва липидных бислоев и последующего замыкания их в новой топологии [2]. Так, при сближении мембран на небольшое расстояние порядка 1–2 нм между ними наблюдалось сильное отталкивание, препятствовавшее плотному контакту на больших площадях [3, 4]. Кроме того, имевшиеся данные указывали на локальную дестабилизацию мембран в процессе их слияния [5, 6]. Обобщение экспериментальных данных позволило группе ученых из ИЭЛАН под руководством Ю.А. Чизмаджева сформулировать концепцию, согласно которой слияние происходит в несколько этапов через локальные нестационарные контакты между взаимодействующими мембранами и приводит к их структурной реорганизации, осуществляемой путем деформации мембран [7–10].
Согласно разработанной концепции, локальный контакт между мембранами приводил к образованию сталка – структуры в форме песочных часов, в которой контактирующие монослои мембран уже слились, а дистальные монослои – еще нет. Считалось, что именно образование сталка является стадией, лимитирующей скорость процесса слияния мембран, поэтому к этой стадии было привлечено повышенное внимание. В ранних исследованиях сталк был гипотетическим интермедиатом, однако в дальнейшем были получены многочисленные экспериментальные и молекулярно-динамические свидетельства в пользу его существования [11–14]. Расширение сталка приводило к образованию диафрагмы полуслияния – структуры с протяженным бислоем, образованным дистальными монослоями мембран, расположенным в центре между радиально разошедшимися слившимися контактными монослоями [15]. В дальнейшем в диафрагме полуслияния образовывалась сквозная пора, в результате чего диафрагма разрушалась, и слияние завершалось образованием поры слияния [16]. Теоретические представления о структурах слияния развивались и уточнялись. Так, при участии Ю.А. Чизмаджева была разработана теория, учитывающая деформационные моды, связанные с внутренней структурой мембран [17, 18]. Это позволило уточнить структуру интермедиатов слияния, в частности сталка, и более корректно вычислить энергию, необходимую для их образования [15, 18]. Выяснилось, что вероятность слияния сильно зависит от так называемой спонтанной кривизны, характеризующей равновесную форму свободного монослоя, сформированного из липидов данного сорта [10]. Было показано, что в случае положительной спонтанной кривизны контактных монослоев и/или отрицательной спонтанной кривизны дистальных монослоев слияние ингибируется, в то время как в случае отрицательной спонтанной кривизны контактных монослоев и/или положительной спонтанной кривизны дистальных монослоев процесс слияния ускоряется.
Прогресс, достигнутый в моделировании слияния модельных мембран, позволил обобщить имеющуюся теорию на более сложные процессы, в частности, на белок-опосредованное слияние мембран оболочечных вирусов с клеточными мембранами [19–21]. Экспериментальные и теоретические исследования, проводившиеся группой Ю.А. Чизмаджева, получили свое развитие в многочисленных работах сотрудников лаборатории биолектрохимии ИЭЛАН и позднее ИФХЭ РАН, которые ведутся и в настоящее время [22–26].
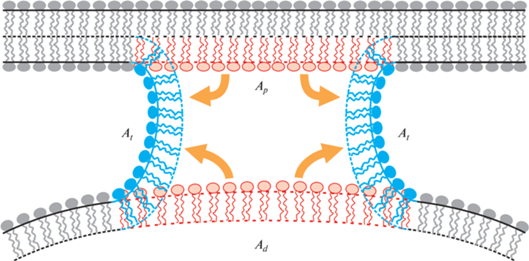
В природе существуют уникальные органеллы, имеющие монослойную, а не бислойную липидную оболочку – так называемые липидные капли, используемые для запасания нейтральных жиров, таких как триолеин. Фосфолипиды монослойной оболочки выступают в роли поверхностно-активных веществ и предотвращают коалесценцию (слияние) в эмульсии жировых капель. Исследования, проведенные в последнее десятилетие, показали, что липидные капли активно взаимодействуют с другими органеллами в клетке [27, 28]. В некоторых случаях плотный контакт липидной капли и органеллы может приводить к слиянию монослоя липидной капли с бислойной мембраной органеллы по механизму, аналогичному классической сталкерной модели [29]. В частности, этот механизм реализуется при взаимодействии липидной капли с пероксисомой – органеллой, отвечающей за окисление длинных жирных кислот [30]. На настоящий момент данный процесс изучен достаточно слабо, однако результаты работы [31] позволяют сделать некоторые выводы о структуре интермедиатов слияния. Данные этой работы показывают, что слияние приводит к образованию π‑образной структуры, в которой монослой липидной капли и внешний монослой пероксисомы слились, а внутренний монослой пероксисомы находится в просвете образовавшейся структуры, отделяя жирнокислотное внутреннее содержимое липидной капли от водного содержимого пероксисомы. Описанные π-образные структуры имеют размер порядка 200 нм, что позволяет регистрировать их методом атомно-силовой микроскопии. Согласно предложенной в работе гипотезе, они являются результатом расширения “сталкообразной” структуры, образующейся в начале процесса слияния. Экспериментальные данные не оставляют сомнений в существовании подобных π-образных структур; помимо цитированной работы имеется ряд других исследований, прямо или косвенно подтверждающих наличие прямого контакта мембран пероксисомы и липидной капли в клетках дрожжей и некоторых растительных клетках [32‒34]. В то же время механизм возникновения и динамика расширения таких структур до сих пор практически не изучены. В частности, до сих пор неизвестно, опосредуется ли образование π-образных структур белками, или этот процесс может происходить в их отсутствие. Кроме того, не исследован вопрос о влиянии липидного состава липидной капли на вероятность возникновения данных структур. Следует отметить, что состав оболочки липидной капли является чрезвычайно важным параметром. Оболочка состоит в основном из двух видов липидов – фосфатидилхолинов (PC) и фосфатидилэтаноламинов (PE) [35]. Соотношение PC/PE влияет на эффективность слияния липидных капель [36]; мы полагаем, что это обусловлено спонтанной кривизной липидной смеси.
В настоящей работе теоретически рассматривается процесс слияния липидной капли с пероксисомой, начиная со стадии после начального объединения контактных монослоев. Мы рассчитали энергию π-образной структуры в зависимости от упругих характеристик мембраны и размеров липидной капли, что позволило исследовать влияние этих параметров на изучаемый процесс, и в частности, ответить на вопрос будет ли структура самопроизвольно расширяться в радиальном направлении. Для расчетов использовалась теория упругости жидких кристаллов, адаптированная к липидным мембранам. Данный метод, разработанный сотрудниками лаборатории под руководством Ю.А. Чизмаджева, был ранее успешно применен для описания множества важнейших процессов, связанных с липидными мембранами, таких как липид-опосредованное взаимодействие белков [37–40], образование и латеральное взаимодействие доменов жидкой упорядоченной фазы [41–45], формирование сквозных пор [46–50] и деление мембран в процессе эндоцитоза [51‒54]. Суть метода состоит в минимизации функционала упругой энергии липидной системы, что позволяет получить равновесную форму мембраны при вариации ее упругих и геометрических характеристик и построить зависимость энергии рассматриваемой системы от характеризующего ее параметра. Сотрудниками лаборатории метод был улучшен и адаптирован для решения все более усложняющихся задач. Так, нами был использован метод спуска энергии по градиенту, позволяющий проводить численную минимизацию энергии с учетом ее нелинейной функциональной зависимости от параметров [46, 47]. Эффективным также оказалось разбиение сильно деформированной мембраны на несколько частей, в каждой из которых деформации можно считать малыми [48]. Сам функционал также был изменен для обеспечения минимизации энергии несимметричной мембраны [55], а также для рассмотрения деформаций мембраны на малых масштабах, сравнимых с толщиной мембраны [56]. Более подробно эволюция моделей слияния мембран, а также их применение в экспериментах и взаимосвязь с данными молекулярно-динамического моделирования описаны в различных обзорах, например, в работе [57].
ПОСТАНОВКА И РЕШЕНИЕ ЗАДАЧИ
π-образная структура. В данной работе изучается энергетика расширения π-образной структуры без рассмотрения деталей ее изначального образования. Монослой будем рассматривать, как сплошную упругую среду, подверженную деформациям поперечного изгиба и наклона. Размер области слияния мал по сравнению с размерами органелл, т.е. последние можно рассматривать как резервуар, с которым система находится в равновесии и который задает латеральное натяжение монослоев σ. Энергия системы полностью определяется деформациями монослоев и их натяжением. Энергию деформаций мембраны будем рассчитывать в рамках теории Хамма–Козлова [17]. Состояние деформированного участка липидного монослоя определяется векторным полем единичных векторов n, называемых директорами, которые характеризуют среднюю ориентацию липидных молекул. Поле директоров задается на специфической поверхности, называемой нейтральной, которая проходит внутри монослоя параллельно его границе с водой в области сочленения полярных головок с гидрофобными цепями липидов. На этой поверхности деформации поперечного изгиба и латерального растяжения/сжатия энергетически независимы [17, 58]. Форма нейтральной поверхности характеризуется векторным полем ее единичных нормалей N. Деформации будем считать малыми и вычислять энергию в квадратичном приближении. Деформация поперечного изгиба характеризуется дивергенцией директора вдоль нейтральной поверхности, div(n). Деформация наклона характеризуется вектором наклона, который для малых деформаций имеет вид: t = n – N [17]. Энергия деформации W участка монослоя площади A может быть записана в виде [17, 43]:
(1)
$\begin{gathered} W = \\ = \int\limits_A {\left\{ {\frac{B}{2}{{{\left( {{\text{div}}{\mathbf{n}} + {{J}_{s}}} \right)}}^{2}} - \frac{B}{2}{{J}_{s}}^{2} + \frac{K}{2}{{{\mathbf{t}}}^{2}} + \sigma } \right\}dS - \sigma {{A}_{0}}} , \\ \end{gathered} $Рис. 1.
Изменение состояния системы при переходе из начального в деформированное состояние. Красным показаны деформирующиеся участки мембраны в начальном состоянии, синим – участки в конечном состоянии. Внизу изображена мембрана липидной капли, наверху – мембрана пероксисомы.
Определим сначала энергию начального состояния W0. Для этого разобьем процесс образования π-образной структуры на две стадии: на первой стадии удаляются два участка монослоя в центре мембран пероксисомы и липидной капли (выделены красным на рис. 1); на второй стадии происходит вытягивание вертикального участка трубы и ее изгиб (выделена синим на рис. 1). Удобно рассмотреть промежуточное состояние (1), в котором участки мембраны, помеченные красным, уже удалены, а вертикальный участок еще не сформирован. Переход из состояния (1) в начальное состояние (0) связан с переносом липида из резервуара; энергия перехода (1) → (0) W1→0 равна
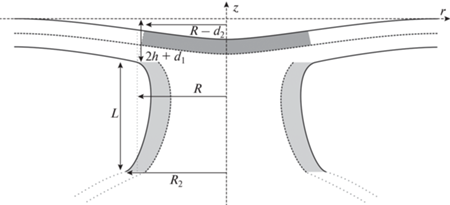
где Ap и Ad – площади удаленных участков мембраны. Переход из состояния (1) в конечное состояние (2) связан с вытягиванием трубы, а затем с деформацией трубы и пероксисомальной мембраны. Соответствующая энергия обозначается как W1→2. где Welastic – полная энергия деформаций мембраны без учета натяжения, At – площадь вытянутой трубы. Здесь мы предполагаем, что пероксисомальная мембрана деформируется слабо, в силу чего ее площадь практически не меняется. Вычитая выражение (2) из выражения (3), получаем: Wtot = Welastic – W0, гдеНайдем теперь энергию деформаций Welastic. Считаем, что рассматриваемая система обладает цилиндрической симметрией. Поскольку мембрана в целом сильно деформирована, а функционал свободной энергии записан в предположении малых деформаций, мы разбиваем мембрану на несколько частей, в каждой из которых по отдельности отклонение формы и деформаций от соответствующего состояния отсчета могут считаться малыми (рис. 2). Мы рассматриваем приблизительно вертикальный (цилиндрический) монослой, описывающий область контакта между пероксисомой и липидной каплей (выделен светло-серым на рис. 2), практически горизонтальный монослой пероксисомы, расположенный в просвете между монослоями вертикальных монослоев (выделен темно-серым на рис. 2), и почти горизонтальный бислой пероксисомы, описывающий остальную часть мембраны пероксисомы.
Рис. 2.
Схематическое изображение модели π-образной структуры с разбиением на области интегрирования. Вертикальная часть длиной L выделена светло-серым; горизонтальный монослойный участок выделен темно-серым; горизонтальный бислой пероксисомы вне монослойного участка не выделен. Радиус π-образной структуры равен R и отсчитывается до точки сшивки вертикальной и горизонтальной частей. Пунктирной линией внизу показана недеформированная часть мембраны липидной капли, аппроксимируемая сферой радиуса Rd. Радиус сшивки мембраны липидной капли с вертикальной частью равен R2. Предполагается цилиндрическая симметрия системы вокруг оси Oz.
В каждой из областей мембрана описывается набором функций, определяющих ее состояние. Функции, относящиеся к вертикальной части, мы обозначаем индексом v; функции, относящиеся к горизонтальному монослою, индексом i; функции, относящиеся к горизонтальному бислою, мы обозначаем индексом e. Мы вводим систему координат {O, z, r} с осью Oz, направленной перпендикулярно мембране пероксисомы посередине между монослоями вертикальной части и осью Or, направленной перпендикулярно оси Oz так, что она касается нейтральной поверхности пероксисомы на бесконечности (рис. 2). В вертикальной части мембрана описывается проекцией директора на ось Oz $v$(z), расстоянием ${{H}_{v}}(z)$ от оси Oz до нейтральной поверхности и поверхностью ${{m}_{v}}$(z) от оси Oz до концов углеводородных хвостов липидов. В горизонтальной части бислойная мембрана описывается пятью функциями – проекциями директоров в верхнем и нижнем монослоях на ось Or (ae(r) и be(r) соответственно), расстояниями от нейтральных поверхностей монослоев до плоскости z = 0 (Hae(r) и Hbe(r)), а также разделяющей монослои поверхностью me(r). В горизонтальной части монослоя вводится только три функции – проекция директора в верхнем монослое ai(r), расстояние Hai(r) и разделяющая поверхность mi(r). Для того чтобы связать между собой эти функции, мы используем условие локальной объемной несжимаемости. Это условие означает, что любой элемент монослоя сохраняет объем при любых деформациях. Данное предположение обосновывается большими значениями модулей объемного сжатия мембран [59] и по своей сути накладывает ограничение на возможные деформации. В предположении малости деформаций условие локальной несжимаемости имеет вид [17]:
где h и h0 – толщины гидрофобных частей монослоев в деформированном и недеформированном состояниях соответственно. При этом толщина h может быть выражена через введенные функции как H – m. Выражение (5) позволяет выразить вектор наклона t только через директор n и его производные. Для этого заметим, что вектор наклона t ≈ n – N [17, 60], и аналогичное выражение верно и для его проекций: te(r) = ne(r) – Ne(r). Поэтому мы получим следующие формулы соответственно для верхнего и нижнего монослоев: ${{t}_{a}}_{e} = {{a}_{e}} - H_{{ae}}^{'},\,\,\,\,{{t}_{{be}}} = {{b}_{e}} + H_{{be}}^{'}$, где штрих означает производную по радиальной координате r. Выражая $H_{{ae}}^{'}$ и $H_{{be}}^{'}$ из уравнения (5), получаем для проекций вектора наклона следующие выражения:(6)
$\begin{gathered} {{t}_{a}}_{e} = {{a}_{e}} - m_{e}^{'} + \frac{{{{h}_{0}}^{2}}}{2}\left( {a_{e}^{{''}} + \frac{{a_{e}^{'}}}{r} - \frac{{{{a}_{e}}}}{{{{r}^{2}}}}} \right),{\text{ }} \hfill \\ {{t}_{{be}}} = {{b}_{e}} + m_{e}^{'} + \frac{{{{h}_{0}}^{2}}}{2}\left( {b_{e}^{{''}} + \frac{{b_{e}^{'}}}{r} - \frac{{{{b}_{e}}}}{{{{r}^{2}}}}} \right). \hfill \\ \end{gathered} $Аналогичные выражения получаются и для вертикальной части [53].
Алгоритм расчета. Функционал энергии, общий вид которого представлен выражением (1), преобразуется для случаев горизонтальной и вертикальной части, затем в него подставляются выражения для проекции вектора наклона. После этого функционал энергии минимизируется, что позволяет найти энергию мембраны и ее равновесную форму, задаваемую функциями Hae(r), Hbe(r), Hi(r) и ${{H}_{v}}(z)$. Данные функции содержат неопределенные коэффициенты, которые находятся из граничных условий, определяемых геометрией системы. Для этого вводятся геометрические параметры: радиус R, на котором происходит сшивка нейтральных поверхностей монослоев пероксисомы и трубы, длина трубы L, радиус сшивки R2 трубы со сферой оболочки липидной капли, а также вспомогательные параметры d1 и d2, описывающие место сшивки мембраны пероксисомы с трубой (рис. 2). Условия сшивки для горизонтальных частей имеют следующий вид:
(7)
$\begin{gathered} {{a}_{i}}\left( {R - {{d}_{2}}} \right) = {{a}_{e}}\left( {R - {{d}_{2}}} \right), \\ {{H}_{{ai}}}\left( {R - {{d}_{2}}} \right) = {{H}_{{ae}}}\left( {R - {{d}_{2}}} \right), \\ {{H}_{{be}}}\left( R \right) = - 2{{h}_{0}} - {{d}_{1}}. \\ \end{gathered} $Для сшивки вертикальной части с монослоем пероксисомы мы используем уравнения, аналогичные приведенным ранее в работе [48]:
(8)
$\begin{gathered} v\left( { - 2{{h}_{0}} - {{d}_{1}}} \right) - {{b}_{e}}\left( R \right) = 1, \\ {{H}_{v}}\left( { - 2{{h}_{0}} - {{d}_{1}}} \right) = R, \\ {{H}_{{be}}}\left( R \right) = - 2{{h}_{0}} - {{d}_{1}}. \\ \end{gathered} $Сшивка вертикальной части со сферой производится в предположении совпадения в точке сшивки направления директора сферы и ее нормали:
(9)
$\begin{gathered} v\left( { - 2{{h}_{0}} - {{d}_{1}} - L} \right) = - \frac{{\sqrt {R_{d}^{2} - R_{2}^{2}} }}{{{{R}_{d}}}}, \\ H\left( { - 2{{h}_{0}} - {{d}_{1}} - L} \right) = {{R}_{2}}, \\ \end{gathered} $(10)
${{J}_{s}} = {{c}_{{{\text{DOPE}}}}}{{j}_{{{\text{DOPE}}}}} + \left( {1 - {{c}_{{{\text{DOPE}}}}}} \right){{j}_{{{\text{DOPC}}}}},$Монослойная мембрана. Рассмотрим отдельно случай монослойной мембраны. В этом случае условие объемной несжимаемости позволяет только получить зависимость функции m(r) от директора и толщины, никак не ограничивая возможные деформации. Это приводит к расцеплению деформаций изгиба и наклона, что видно из анализа функционала упругой энергии. Положим для определенности, что речь идет о верхнем монослое в горизонтальной области. Тогда функционал энергии можно записать в следующем виде:
(11)
$\begin{gathered} {{w}_{i}} = 2\pi r\left( {\frac{B}{2}{{{\left( {\frac{{d{{a}_{i}}}}{{dr}} + \frac{{{{a}_{i}}}}{r} + {{J}_{s}}} \right)}}^{2}} - \frac{B}{2}{{J}_{s}}^{2} + } \right. \\ \left. { + \,\,\frac{K}{2}{{{\left( {{{a}_{i}} - \frac{{d{{H}_{{ai}}}}}{{dr}}} \right)}}^{2}} + \sigma {{{\left( {\frac{{d{{H}_{{ai}}}}}{{dr}}} \right)}}^{2}}} \right). \\ \end{gathered} $Видно, что функционал (11) зависит от производной формы по радиусу $H_{{ai}}^{'}$, а не от самой формы. Это позволяет проводить минимизацию именно по данной функции; в результате получаем функциональную зависимость между производной $H_{{ai}}^{'}$ и директором ai: $H_{{ai}}^{'} = \frac{{K{{a}_{i}}}}{{K + 2\sigma }}$. Учтем, что в реальных системах натяжение мало (≤1 kBT/нм2, где kBT ≈ 4 × 10–21 Дж) по сравнению с модулем наклона (~10 kBT/нм2), т.е. $\sigma \ll K$. Это означает, что $H_{{ai}}^{'} \approx {{a}_{i}}$, в силу чего вклад деформации наклона в энергию становится пренебрежимо малым. Таким образом, оказывается, что в монослойной мембране деформация наклона практически не реализуется.
Сталкообразная структура. В классической теории слияния показывается, что сталку соответствует локальный минимум энергии системы, а расширение сталка и его дальнейшая топологическая перестройка в предпору сопровождается увеличением энергии [18, 22, 61]. Поэтому для корректной оценки энергетического барьера EB в нашей задаче необходимо рассмотреть сталкообразную структуру, в которой произошел контакт монослоя липидной капли с внешним монослоем мембраны пероксисомы (рис. 3).
Рис. 3.
Сталкообразная структура, моделирующая слияние монослоев липидной капли и пероксисомы. Расстояние между нейтральными поверхностями мембран устанавливается равным длине L вертикального участка π-образной структуры; радиус области контакта принимается равным толщине недеформированного монослоя h0. Светло-серым выделен деформированный монослой мембраны липидной капли.
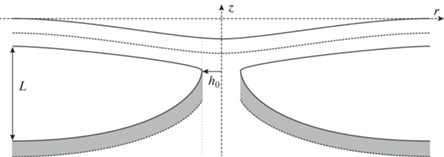
Мы рассматриваем отдельно деформации в нижней (монослойной) и верхней (бислойной) мембранах. Нейтральная поверхность и проекция директора контактирующих монослоев на горизонтальную плоскость сшиваются в точке контакта. При этом мы допускаем разрыв поля директоров в точке сшивки, который может компенсироваться за счет проникновения свободных жиров в область монослойного контакта. Расстояние между мембранами на бесконечности считается равным равновесной длине вертикального участка L, соответствующей минимальному радиусу Rmin = 2 нм π-образной структуры, полученной ранее. Радиус сталка, т.е. радиальную координату точки контакта, считаем равным толщине невозмущенного монослоя h0. Спонтанную кривизну нижнего монослоя мы считаем равной спонтанной кривизне монослоя π-образной структуры, спонтанную кривизну монослоев верхней мембраны считаем равной спонтанной кривизне монослоя DOPC jDOPC. Таким образом, получаем энергию системы, соответствующую радиусу R = h0.
РЕЗУЛЬТАТЫ
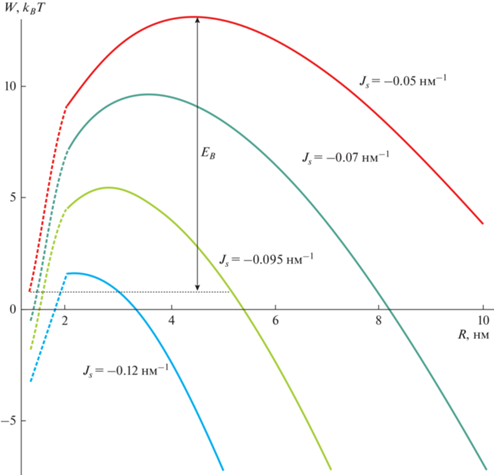
Результаты расчетов представлены на графиках. Мы использовали следующие значения для материальных характеристик системы: модуль изгиба DOPC B = 10 kBT [62]; модуль наклона K = = 10 kBT/нм2 [60]; толщина гидрофобного участка монослоя h0 = 1.3 нм [50]; спонтанная кривизна DOPC = –0.07 нм–1 [63]; спонтанная кривизна DOPE = –0.27 нм–1 [63]; поверхностное натяжение мембраны σ = 0.025 kBT/нм2 [64]. Радиус кривизны липидной капли Rd равен 100 нм; Rd определяет только граничные условия (9) на проекцию директора в вертикальной области, и энергия слабо зависит от его конкретного значения. Мы рассчитали зависимость полной энергии Wtot, а также ее компоненты Welastic и W0 от размера системы R. Типичные результаты расчетов для разных значений спонтанной кривизны приведены на рис. 4. Полученные зависимости Wtot(R) для разных значений спонтанной кривизны Js приведены на рис. 5. Крайняя левая точка – это энергия сталкообразной структуры при R = h0, полученная в результате отдельного расчета.
Рис. 4.
Зависимость компонентов энергии π-образной структуры от ее радиуса R при разной спонтанной кривизне Js монослоя: а – Js = 0; б – Js = –0.05 нм–1. Черным показаны зависимости полной энергии Wtot, красным – энергии деформаций Welastic, синим – энергии W0.
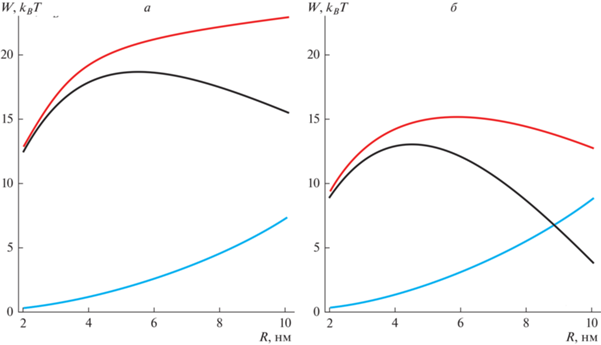
Рис. 5.
Зависимости энергии Wtot от радиуса R π-образной структуры, дополненные энергией сталкообразной структуры, вычисленной при R = h0. Зависимости Wtot показаны сплошными линиями, интерполяция энергии между R = = 2 нм и R = h0 показана пунктиром. В качестве параметра выбрана спонтанная кривизна мембраны; красная кривая соответствует Js = –0.05 нм–1; зеленая кривая соответствует Js = –0.07 нм–1; желто-зеленая кривая соответствует Js = –0.095 нм–1; синяя кривая соответствует Js = –0.12 нм–1. Спонтанная кривизна монослоя DOPC jDOPC принята равной –0.07 нм–1. Радиус липидной капли Rd = 100 нм.
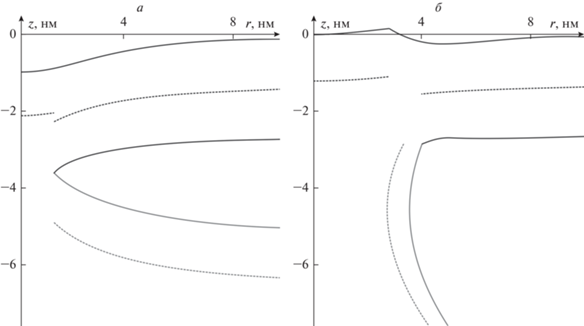
Разработанная модель позволяет получить равновесную форму мембраны как π-образной, так и сталкообразной структуры. В качестве примера мы приводим на рис. 6 рассчитанную форму этих структур для Js = –0.95 нм–1 и R = 1.3 и 4 нм соответственно.
Рис. 6.
Равновесная форма мембраны сталкообразной структуры (а) и π-образной структуры при R = 4 нм (б). Спонтанная кривизна всех участков мембраны, кроме бислоя сталкообразной структуры, равна –0.95 нм–1; спонтанная кривизна этого участка принимается равной –0.07 нм–1.
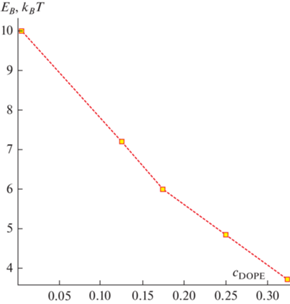
Зависимость энергии Wtot(R) позволяет найти барьер EB раскрытия π-образной структуры, как разность энергий в максимуме и в начале траектории (R = h0). Используя формулу (11) для спонтанной кривизны, а также данные по барьеру EB, мы получаем зависимость EB от доли DOPE в составе мембраны. Эта зависимость показана на рис. 7.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Классическая теория слияния в качестве следующего за сталком устойчивого интермедиата рассматривает диафрагму полуслияния [15, 16, 21]. Рассмотренная в данной работе π-образная структура представляет собой аналог диафрагмы полуслияния в случае слияния липидного монослоя и липидного бислоя. Полученные нами результаты позволяют сопоставить π-образную структуру и классическую диафрагму полуслияния и указывают на схожесть этих структур. В обоих случаях расширение образовавшейся структуры сопряжено с преодолением энергетического барьера, связанного с деформацией мембраны. Ключевое же отличие опосредовано асимметрией профиля деформаций, вызванной монослойностью одной из сливающихся мембран.
Расширение π-образной структуры приводит к образованию контактной области между липидной каплей и внутренним монослоем мембраны пероксисомы; предполагается, что именно через этот контакт происходит транспорт свободных жирных кислот в пероксисому [65]. Считается, что раскрытие π-образной структуры может происходить без участия белков [31]. В этом случае барьер EB на раскрытие должен по порядку величины составлять несколько единиц kBT; в противном случае такое раскрытие не произойдет за физически разумное время. Наши расчеты показывают, что для этого необходимо присутствие в составе мембраны значительного количества DOPE, примерно 20% или более (рис. 7). Это примерно соответствует доле DOPE, имеющейся в липидных каплях в норме [66]. В то же время для мембраны, состоящей из чистого DOPC, барьер составляет 10 kBT, т.е. раскрытие маловероятно. Этот результат коррелирует с имеющимися данными по слиянию липидных капель друг с другом. Именно увеличение содержания DOPE – липида с отрицательной спонтанной кривизной – приводит к увеличению размеров липидных капель, что говорит об облегчении их слияния [36]. Предполагается, что локальное повышение концентрации липидов с отрицательной спонтанной кривизной приводит к дестабилизации поверхностных слоев капель, что понижает энергетический барьер их слияния. На это же указывает увеличение вероятности безбелкового слияния капель в мутантах с отсутствием PC в поверхностном монослое [67].
Наблюдаемое понижение барьера EB обусловлено зависимостью упругой энергии Welastic от спонтанной кривизны, проиллюстрированной на рис. 4, поскольку энергия W0 связана только с площадью мембраны и от спонтанной кривизны не зависит. Видно, что при отрицательной спонтанной кривизне облегчается расширение π-образной структуры, в то время как при нулевой спонтанной кривизне энергия π-образной структуры возрастает с ростом ее размера. Аналогичный результат был получен для случая диафрагмы полуслияния в работе [61]: расширение диафрагмы становилось возможным только при наличии во внешнем монослое мембраны липидного компонента с отрицательной спонтанной кривизной. Данную зависимость можно качественно объяснить, исходя из упрощенного анализа деформаций мембраны.
Наши расчеты показывают, что упругая составляющая энергии обусловлена в основном деформацией вертикального участка длины L (показан светло-серым на рис. 2). Это видно по равновесной форме мембраны, которая показана на рис. 6: бислойная часть π-образной структуры практически не деформирована, в то время как максимально деформирована вертикальная часть. Таким образом, энергию деформаций можно считать приближенно равной энергии вертикальной части мембраны. Наибольший вклад в энергию вертикальной части мы связываем с ее деформацией в области контакта с бислойной мембраной. Как видно из рис. 6, в этом месте мембрана локально сильно изогнута; в то же время остальная часть вертикального монослоя имеет полную кривизну, примерно равную нулю. Данный изгиб в области контакта обусловлен асимметрией системы: деформация вертикального монослоя, пусть и сильная, оказывается энергетически выгоднее, чем деформация горизонтального бислоя. Как было показано выше, в монослойном участке мембраны деформацией наклона можно пренебречь. Это означает, что директор мало отклоняется от нормали, что позволяет характеризовать деформации введением геометрической кривизны J согласно соотношению div(n) = div (N) = –J. Поскольку полная кривизна мембраны мало отличается от нуля, то и энергия в этой области тоже будет мала. Недалеко от области контакта с бислоем пероксисомы директор вертикальной части испытывает дополнительный скачок Δn ~ 0.1 в силу большего искривления мембраны. Этот скачок происходит на длине λ порядка 1–2 нм. В этом случае дивергенцию директора можно оценить, как
(12)
${\text{div}}\left( {\mathbf{n}} \right) = n{\kern 1pt} ' - \frac{1}{R} \approx \frac{{\Delta n}}{\lambda } - \frac{1}{R}.$Энергия, связанная с этим участком, оценивается нами по формуле:
(13)
${{W}_{\Delta }} = \pi RB\lambda \left\{ {{{{\left( {\frac{{\Delta n}}{\lambda } - \frac{1}{R} + {{J}_{s}}} \right)}}^{2}} - J_{s}^{2}} \right\}.$Отсюда видно, что энергия Welastic имеет при больших значениях R линейную асимптотику с коэффициентом, равным $\pi B\frac{{\Delta n}}{\lambda }\left( {2{{J}_{s}}\lambda + \Delta n} \right).$ При соблюдении неравенства $2\lambda \left| {{{J}_{s}}} \right| > \Delta n$ этот коэффициент меняет свой знак (при отрицательной Js) , в силу чего производная энергии по радиусу R становится отрицательной. Мы видим, таким образом, что на больших радиусах при нулевой спонтанной кривизне энергия возрастает, а при отрицательной – убывает.
Еще одной особенностью задачи является практически полное отсутствие “провисания” монослоя пероксисомы в области между вертикальными монослоями (рис. 6б). Такое провисание на величину порядка 50 нм регистрировалось для раскрытых π-образных структур размерами порядка 200 нм [31]. Полученный нами результат можно было бы объяснить наличием слабого поверхностного натяжения в системе, однако дополнительное уменьшение его на два порядка не приводит к появлению провисания. Мы объясняем это упоминавшейся выше асимметрией системы: провисание мембраны в центре должно привести к деформации бислоя в области пероксисомы, окаймляющей горизонтальный монослой. Это энергетически менее выгодно, чем дополнительная деформация вертикальной части мембраны при отсутствии деформации горизонтальной части. В то же время провисание мембраны, описанное в работе [31], наблюдается на больших масштабах, порядка 100 нм, и скорее всего, объясняется поверхностными эффектами, выходящими за рамки рассматриваемой модели. Гипотетически, это может быть вызвано взаимодействием нейтральных жиров с углеводородными хвостами липидов в области контакта монослоя пероксисомы с ядром липидной капли. В том случае, если этот контакт окажется энергетически выгоднее, чем контакт липидных хвостов друг с другом, система будет стремиться увеличить площадь зоны такого контакта. Об этом, в частности, может свидетельствовать образование так называемых пексоподий – наблюдавшихся в ряде случаев тубул, направленных от места контакта в сторону центра липидных капель [31].
В процессе расчетов мы не учитывали ряд факторов, которые могут быть важны в контексте энергетики π-образной структуры. Во-первых, не учитывалось взаимодействие жирных кислот с липидами в области контакта; оно сводится к эффективному отрицательному натяжению и должно приводить к еще большему понижению энергии. К сожалению, величина этого натяжения неизвестна и принципиально может быть оценена только методами молекулярной динамики. Во-вторых, наличие двух липидных компонентов в области больших деформаций должно приводить к сложным эффектам, связанным с их латеральным перераспределением, в частности, к понижению модуля изгиба [68]. В данной работе нами не была построена полная траектория образования π-образной структуры от момента сближения сливающихся мембран до момента достижения системой глобального минимума. Мы ограничились рассмотрением системы при малых значениях радиуса R, когда размер зоны слияния много меньше размеров везикул. В этом случае поведение системы определяется в основном деформациями мембран. В то же время глобальный минимум достигается системой при больших (порядка 100 нм) радиусах; в этом случае кривизна мембраны становится незначительной, а поведение системы определяется в основном такими поверхностными явлениями, как баланс площадей монослоев и латеральное натяжение, что значительно усложняет анализ. Например, уже нельзя пренебрегать площадью зоны контакта по сравнению с площадями взаимодействующих объектов. Решение этой задачи актуально, поскольку могло бы позволить выявить факторы, влияющие на размер мембранного контакта пероксисома–липидная капля и на вероятность его возникновения или исчезновения.
Авторы выражают глубокую признательность сотрудникам лаборатории биоэлектрохимии ИФХЭ РАН С.А. Акимову и Т.Р. Галимзянову за конструктивные замечания при выполнении расчетов и подготовке рукописи.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
Источники финансирования. Работа выполнена при поддержке Российского научного фонда (грант № 22-23-00551).
Соответствие принципам этики. Настоящая статья не содержит описания каких-либо исследований с участием людей или животных в качестве объектов.
Список литературы
Poste G., Allison A.C. 1973. Membrane fusion. Biochim. Biophys. Acta – Rev. Biomembr. 300, 421–465.
Pinto da Silva P., Nogueira M.L. 1977. Membrane fusion during secretion. A hypothesis based on electron microscope observation of Phytophthora Palmivora zoospores during encystment. J. Cell Biol. 73, 161–181.
LeNeveu D.M., Rand R.P. 1977. Measurement and modification of forces between lecithin bilayers. Biophys. J. 18, 209–230.
Rand R.P. 1981. Interacting phospholipid bilayers: Measured forces and induced structural changes. Annu. Rev. Biophys. Bioeng. 10, 277–314.
Papahadjopoulos D., Poste G., Vail W.J. 1979. Studies on membrane fusion with natural and model membranes. In: Methods in Membrane Biology. Eds. Korn E.D. Boston, MA: Springer, p. 1–121.
Cullis P.R., Hope M.J. 1978. Effects of fusogenic agent on membrane structure of erythrocyte ghosts and the mechanism of membrane fusion. Nature. 271, 672–674.
Козлов М.М., Маркин В.С. 1983. Возможный механизм слияния мембран. Биофизика. 28, 242–247.
Markin V., Kozlov M., Borovjagin V. 1984. On the theory of membrane fusion. The stalk mechanism. Gen. Physiol. Biophys. 5, 361–377.
Leikin S.L., Kozlov M.M., Chernomordik L.V., Markin V.S., Chizmadzhev Y.A. 1987. Membrane fusion: Overcoming of the hydration barrier and local restructuring. J. Theor. Biol. 129, 411–425.
Chernomordik L.V., Kozlov M.M., Melikyan G.B., Abidor I.G., Markin V.S., Chizmadzhev Y.A. 1985. The shape of lipid molecules and monolayer membrane fusion. Biochim. Biophys. Acta – Biomembr. 812, 643–655.
Chernomordik L.V., Kozlov M.M., Zimmerberg J. 1995. Lipids in biological membrane fusion. J. Membr. Biol. 146, 1–14.
Yang L., Huang H.W. 2002. Observation of a membrane fusion intermediate structure. Science. 297, 1877–1879.
Marrink S.J., de Vries A.H., Tieleman D.P. 2009. Lipids on the move: Simulations of membrane pores, domains, stalks and curves. Biochim. Biophys. Acta – Biomembr. 1788, 149–168.
Aeffner S., Reusch T., Weinhausen B., Salditt T. 2012. Energetics of stalk intermediates in membrane fusion are controlled by lipid composition. Proc. Natl. Acad. Sci. USA. 109, E1609–E1618.
Cohen F.S., Melikyan G.B. 2004. The energetics of membrane fusion from binding, through hemifusion, pore formation, and pore enlargement. J. Membr. Biol. 199, 1–14.
Chernomordik L.V., Kozlov M.M. 2008. Mechanics of membrane fusion. Nat. Struct. Mol. Biol. 15, 675–683.
Hamm M., Kozlov M.M. 2000. Elastic energy of tilt and bending of fluid membranes. Eur. Phys. J. E. 3, 323–335.
Kuzmin P.I., Zimmerberg J., Chizmadzhev Y.A., Cohen F.S. 2001. A quantitative model for membrane fusion based on low-energy intermediates. Proc. Natl. Acad. Sci. USA. 98, 7235–7240.
Kozlov M.M., Chernomordik L.V. 1998. A mechanism of protein-mediated fusion: Coupling between refolding of the influenza hemagglutinin and lipid rearrangements. Biophys. J. 75, 1384–1396.
Chernomordik L.V., Frolov V.A., Leikina E., Bronk P., Zimmerberg J. 1998. The pathway of membrane fusion catalyzed by influenza hemagglutinin: Restriction of lipids, hemifusion, and lipidic fusion pore formation. J. Cell Biol. 140, 1369–1382.
Chizmadzhev Y.A. 2004. The mechanisms of lipid–protein rearrangements during viral infection. Bioelectrochemistry. 63, 129–136.
Акимов С.А., Молотковский Р.Ю., Галимзянов Т.Р., Радаев А.В., Шилова Л.А., Кузьмин П.И., Батищев О.В., Воронина Г.Ф., Чизмаджев Ю.А. 2014. Модель слияния мембран: непрерывный переход в пору слияния с учетом гидрофобных и гидратационных взаимодействий. Биол. мембраны. 31, 14–24.
Молотковский Р.Ю., Кузьмин П.И., Акимов С. А. 2015. Слияние мембран. Два возможных механизма понижения высоты энергетического барьера при участии белков слияния. Биол. мембраны. 32, 79–79.
Molotkovsky R.J., Galimzyanov T.R., Jiménez-Munguía I., Pavlov K.V., Batishchev O.V., Akimov S.A. 2017. Switching between successful and dead-end intermediates in membrane fusion. Int. J. Mol. Sci. 18, 2598.
Molotkovsky R.J., Alexandrova V.V., Galimzyanov T.R., Jiménez-Munguía I., Pavlov K.V., Batishchev O.V., Akimov S.A. 2018. Lateral membrane heterogeneity regulates viral-induced membrane fusion during HIV entry. Int. J. Mol. Sci. 19, 1483.
Akimov S.A., Polynkin M.A., Jiménez-Munguía I., Pavlov K.V., Batishchev O.V. 2018. Phosphatidylcholine membrane fusion is pH-dependent. Int. J. Mol. Sci. 19, 1358.
Olzmann J.A., Carvalho P. 2019. Dynamics and functions of lipid droplets. Nat. Rev. Mol. Cell Biol. 20, 137–155.
Gao Q., Goodman J.M. 2015. The lipid droplet–a well-connected organelle. Front. Cell Dev. Biol. 3, 49.
Murphy S., Martin S., Parton R.G. 2009. Lipid droplet-organelle interactions; sharing the fats. Biochim. Biophys. Acta – Mol. Cell Biol. Lipids 1791, 441–447.
Joshi A.S. 2021. Peroxisomal membrane contact sites in yeasts. Front. Cell Dev. Biol. 9, 735031.
Binns D., Januszewski T., Chen Y., Hill J., Markin V.S., Zhao Y., Gilpin C., Chapman K.D., Anderson R.G.W., Goodman J.M. 2006. An intimate collaboration between peroxisomes and lipid bodies. J. Cell Biol. 173, 719–731.
Hayashi Y., Hayashi M., Hayashi H., Hara-Nishimura I., Nishimura M. 2001. Direct interaction between glyoxysomes and lipid bodies in cotyledons of the Arabidopsis thaliana ped1 mutant. Protoplasma. 218, 83–94.
Bascom R.A., Chan H. Rachubinski R.A. 2003. Peroxisome biogenesis occurs in an unsynchronized manner in close association with the endoplasmic reticulum in temperature-sensitive yarrowia lipolytica Pex3p mutants. Mol. Biol. Cell. 14, 939–957.
Thazar-Poulot N., Miquel M., Fobis-Loisy I., Gaude T. 2015. Peroxisome extensions deliver the Arabidopsis SDP1 lipase to oil bodies. Proc. Natl. Acad. Sci. USA. 112, 4158–4163.
Bartz R., Li W.H., Venables B., Zehmer J.K., Roth M.R., Welti R., Anderson R.G.W., Liu P., Chapman K.D. 2007. Lipidomics reveals that adiposomes store ether lipids and mediate phospholipid traffic. J. Lipid Res. 48, 837–847.
Fei W., Shui G., Zhang Y., Krahmer N., Ferguson C., Kapterian T.S., Lin R.C., Dawes I.W., Brown A.J., Li P., Huang X., Parton R.G., Wenk M.R., Yang H. 2011. A role for phosphatidic acid in the formation of “supersized” lipid droplets. PLoS Genet. 7, e1002201.
Осипенко Д.С., Галимзянов Т.Р., Акимов С.А. 2016. Латеральное перераспределение трансмембранных белков и жидко-упорядоченных доменов в липидных мембранах с неоднородной кривизной. Биол. мембраны 33, 176–186.
Kondrashov O.V., Galimzyanov T.R., Molotkovsky R.J., Batishchev O.V., Akimov S.A. 2020. Membrane-mediated lateral interactions regulate the lifetime of gramicidin channels. Membranes. 10, 368.
Kondrashov O.V., Pinigin K.V., Akimov S.A. 2021. Characteristic lengths of transmembrane peptides controlling their tilt and lateral distribution between membrane domains. Phys. Rev. E. 104, 044411.
Kondrashov O.V., Kuzmin P.I., Akimov S.A. 2022. Hydrophobic mismatch controls the mode of membrane-mediated interactions of transmembrane peptides. Membranes. 12, 89.
Kuzmin P.I., Akimov S.A., Chizmadzhev Y.A., Zimmerberg J., Cohen F.S. 2005. Line tension and interaction energies of membrane rafts calculated from lipid splay and tilt. Biophys. J. 88, 1120–1133.
Galimzyanov T.R., Molotkovsky R.J., Kheyfets B.B., Akimov S.A. 2013. Energy of the interaction between membrane lipid domains calculated from splay and tilt deformations. JETP Lett. 96, 681–686.
Galimzyanov T.R., Molotkovsky R.J., Bozdaganyan M.E., Cohen F.S., Pohl P., Akimov S.A. 2015. Elastic membrane deformations govern interleaflet coupling of lipid-ordered domains. Phys. Rev. Lett. 115, 088101.
Molotkovsky R.J., Galimzyanov T.R., Batishchev O.V., Akimov S.A. 2019. The effect of transmembrane protein shape on surrounding lipid domain formation by wetting. Biomolecules. 9, 729.
Pinigin K.V., Kondrashov O.V., Jiménez-Munguía I., Alexandrova V.V., Batishchev O.V., Galimzyanov T.R., Akimov S.A. 2020. Elastic deformations mediate interaction of the raft boundary with membrane inclusions leading to their effective lateral sorting. Sci. Rep. 10, 4087.
Молотковский Р.Ю., Акимов С.А. 2009. Расчет линейного натяжения в различных моделях кромки поры в липидном бислое. Биол. мембраны. 26, 149–158.
Акимов С.А., Муковозов А.А., Воронина Г.Ф., Чизмаджев Ю.А., Батищев О.В. 2014. Линейное натяжение и структура кромки сквозной поры в липидном бислое. Биол. мембраны. 31, 323–330.
Akimov S.A., Volynsky P.E., Galimzyanov T.R., Kuzmin P.I., Pavlov K.V., Batishchev O.V. 2017. Pore formation in lipid membrane I: Continuous reversible trajectory from intact bilayer through hydrophobic defect to transversal pore. Sci. Rep. 7, 12152.
Akimov S.A., Volynsky P.E., Galimzyanov T.R., Kuzmin P.I., Pavlov K.V., Batishchev O.V. 2017. Pore formation in lipid membrane II: Energy landscape under external stress. Sci. Rep. 7, 12509.
Пинигин К.В., Воловик М.В., Батищев О.В., Акимов С.А. 2020. Взаимодействие границ упорядоченных липидных доменов и амфипатических пептидов регулирует вероятность образования пор в мембранах. Биол. мембраны. 37, 337–349.
Bashkirov P.V., Akimov S.A., Evseev A.I., Schmid S.L., Zimmerberg J., Frolov V.A. 2008. GTPase cycle of dynamin is coupled to membrane squeeze and release, leading to spontaneous fission. Cell. 135, 1276–1286.
Frolov V.A., Escalada A., Akimov S.A. Shnyrova A.V. 2015. Geometry of membrane fission. Chem. Phys. Lipids. 185, 129–140.
Shnyrova A.V., Bashkirov P.V., Akimov S.A., Pucadyil T.J., Zimmerberg J., Schmid S.L., Frolov V.A. 2013. Geometric catalysis of membrane fission driven by flexible dynamin rings. Science. 339, 1433–1436.
Espadas J., Pendin D., Bocanegra R., Escalada A., Misticoni G., Trevisan T., del Olmo A.V., Montagna A., Bova S., Ibarra B., Kuzmin P.I., Bashkirov P.V., Shnyrova A.V., Frolov V.A., Daga A. 2019. Dynamic constriction and fission of endoplasmic reticulum membranes by reticulon. Nat. Commun. 10, 5327.
Kondrashov O.V., Galimzyanov T.R., Jiménez-Munguía I., Batishchev O.V., Akimov S.A. 2019. Membrane-mediated interaction of amphipathic peptides can be described by a one-dimensional approach. Phys. Rev. E. 99, 022401.
Pinigin K.V., Kuzmin P.I., Akimov S.A., Galimzyanov T.R. 2020. Additional contributions to elastic energy of lipid membranes: Tilt-curvature coupling and curvature gradient. Phys. Rev. E. 102, 042406.
Akimov S.A., Molotkovsky R.J., Kuzmin P.I., Galimzyanov T.R. Batishchev O.V. 2020. Continuum models of membrane fusion: Evolution of the theory. Int. J. Mol. Sci. 21, 3875.
Leikin S., Kozlov M.M., Fuller N.L., Rand R.P. 1996. Measured effects of diacylglycerol on structural and elastic properties of phospholipid membranes. Biophys. J. 71, 2623–2632.
Nagle J.F., Tristram-Nagle S. 2000. Lipid bilayer structure. Curr. Opin. Struct. Biol. 10, 474–480.
Hamm M., Kozlov M.M. 1998. Tilt model of inverted amphiphilic mesophases. Eur. Phys. J. B. 6, 519–528.
Ryham R.J., Klotz T.S., Yao L., Cohen F. S. 2016. Calculating transition energy barriers and characterizing activation states for steps of fusion. Biophys. J. 110, 1110–1124.
Rawicz W., Olbrich K.C., McIntosh T., Needham D., Evans E. 2000. Effect of chain length and unsaturation on elasticity of lipid bilayers. Biophys. J. 79, 328–339.
Hossein A., Deserno M. 2020. Spontaneous curvature, differential stress, and bending modulus of asymmetric lipid membranes. Biophys. J. 118, 624–642.
Pinigin K.V., Galimzyanov T.R., Akimov, S.A. 2021. Amphipathic peptides impede lipid domain fusion in phase-separated membranes. Membranes. 11, 797.
akotonirina-Ricquebourg R., Costa V., Teixeira V. 2022. Hello from the other side: Membrane contact of lipid droplets with other organelles and subsequent functional implications. Prog. Lipid Res. 85, 101141
Penno A., Hackenbroich G., Thiele C. 2013. Phospholipids and lipid droplets. Biochim. Biophys. Acta – Mol. Cell Biol. Lipids 1831, 589–594.
Yang H., Galea A., Sytnyk V., Crossley M. 2012. Controlling the size of lipid droplets: lipid and protein factors. Curr. Opin. Cell Biol. 24, 509–516.
Башкиров П.В., Чекашкина К.В., Акимов С.А., Кузьмин П.И., Фролов В.А. 2011. Изменение состава липидной мембраны при сильном изгибе. Биол. мембраны. 28, 145–152.
Дополнительные материалы отсутствуют.
Инструменты
Биологические мембраны: Журнал мембранной и клеточной биологии