Биология моря, 2019, T. 45, № 3, стр. 159-170
Популяционные и репродуктивные характеристики рака-отшельника Pagurus brachiomastus (Thallwitz, 1892) (Decapoda: Paguridae) из залива Петра Великого Японского моря
Е. С. Корниенко 1, *, Н. И. Селин 1
1 Национальный научный центр морской биологии им. А.В. Жирмунского (ННЦМБ) ДВО РАН
690041 Владивосток, Россия
* E-mail: kornielena@mail.ru
Поступила в редакцию 08.10.2018
После доработки 28.12.2018
Принята к публикации 07.02.2019
Аннотация
Изучены популяционные и репродуктивные характеристики рака-отшельника Pagurus brachiomastus (Thallwitz, 1892) из зал. Восток (зал. Петра Великого, Японское море). Средняя плотность поселения P. brachiomastus была наиболее низкой весной (2.4 ± 0.6 экз/м2) и самой высокой летом (3.1 ± 0.4 экз/м2); биомасса составляла соответственно 18.24 ± 3.75 и 22.83 ± 2.80 г/м2. Раки-отшельники встречались во всем диапазоне исследованных глубин (0–12 м), но основное скопление было приурочено к горизонту 5–6 м, где в летний период плотность поселения животных в среднем составляла 8.3 ± 3.7 экз/м2, а биомасса – 39.09 ± 8.51 г/м2. Длина карапакса самцов варьировала от 1.3 до 10.3 мм (в среднем составляла 5.3 ± 2.2 мм), самок – от 1.3 до 10.6 мм (в среднем 4.3 ± 1.5 мм), яйценосных самок – от 1.5 до 8.4 мм (в среднем 4.4 ± 1.5 мм). В течение периода наблюдений соотношение самцов и самок изменялось от 0.8 до 3.3 и в среднем за период исследований составило 1.7. Нерест длился с марта по август включительно, доля яйценосных самок увеличивалась от 8.5% в марте до 82.8% в мае, эмбрионы в кладках оставались на ранних стадиях развития до второй декады мая. Развитие яиц возобновлялось при температуре воды 10°С. Размножение было несинхронным: в июне–августе встречались самки с эмбрионами, завершающими развитие, и самки с недавно отложенными яйцами, что указывает на возможность повторного нереста. Полученные данные показали, что благоприятное сосуществование P. brachiomastus с другими симпатрическими видами в районе исследования обеспечивается пространственной разобщенностью их скоплений, различиями размерных характеристик, а также присутствием у части самок эмбриональной диапаузы в развитии яиц и возможностью повторного нереста.
Раки-отшельники, обычный компонент литоральных и сублиторальных бентосных сообществ, чаще всего обитают в пустых раковинах брюхоногих моллюсков. Раковина обеспечивает безопасность самого животного и эмбрионов, развивающихся на плеоподах самок. От наличия подходящих раковин зависят выживание, продолжительность жизни раков-отшельников, их плодовитость и, в конечном итоге, репродуктивный успех вида. Подходящие раковины – это ограниченный ресурс, определяющий репродуктивную стратегию видов и влияющий на их обилие и популяционную структуру (Vance, 1972; Abrams, 1980; Lancaster, 1990). Раковины необходимы не только растущим взрослым особям, но и молоди, которая при массовом оседании должна найти первое в своей жизни убежище (Fotheringham, Bagnal, 1976; Asakura, 1991; Oba, Goshima, 2004). Особенно напряженная межвидовая конкуренция за ресурс раковин наблюдается среди симпатрических видов (Vance, 1972; Abrams, 1980; Imazu, Asakura, 1994; Gherardi, Nardone, 1997). Межвидовые различия в репродуктивных характеристиках могут быть одним из механизмов, позволяющих сосуществовать нескольким видам раков-отшельников (Reese, 1968; Carlon, Ebersole, 1995; Turra, Leite, 2000; Wada et al., 2000, 2005).
Ранее в зал. Восток, который по гидрофизическим показателям среды и составу населения характеризует обширную акваторию зал. Петра Великого Японского моря, на мониторинговом участке дна на глубине от 0.5 до 12 м мы изучали видовой состав и особенности распределения раков-отшельников (Селин и др., 2016). Согласно полученным данным, здесь обитают семь видов раков-отшельников: Pagurus minutus, P. proximus, P. brachiomastus, P. pectinatus, P. ochotensis, P. middendorffii и Areopaguristes hirsutimanus. Из них первые три вида наиболее массовые, их численность составляла соответственно около 53, 31.5 и 11.2% от суммарной среднегодовой численности раков-отшельников на участке. Были исследованы и проанализированы популяционные и репродуктивные характеристики P. minutus и P. proximus (см.: Kornienko et al., 2017; Korn et al., 2018), для которых зал. Восток – это северная граница ареала. В отличие от них P. brachiomastus обитает в холодных водах северо-восточной Азии: в прибрежье о-ва Сахалин, Курильских островов и северной Японии, включая о-в Хоккайдо; у материкового побережья встречается в зал. Петра Великого (Komai, 2000; Komai et al., 2015). Северная граница распространения P. brachiomastus вдоль материкового побережья – зал. Де-Кастри (Макаров, 1938), южная – северо-восточная Корея (Jung, 2017). Возможно, разная географическая принадлежность этих видов раков-отшельников вносит в их репродуктивные характеристики отличия, которые, несмотря на практически одновременное появление личинок в планктоне (Корниенко, Корн, 2016), позволяют снизить конкуренцию за раковины при их оседании.
В литературе сведения о биологии P. brachiomastus отрывочны и немногочисленны (Волвенко, 1995; Oba et al., 2008; Kostina, Tsurpalo, 2016; Селин и др., 2016; Jung, 2017). К тому же до 2000 г. название P. brachiomastus объединяло три вида – P. proximus, P. simulans и P. brachiomastus (см.: Komai, 2000), поэтому данные, приведенные в ранних работах (например, Волвенко, 1995), не отражают действительные характеристики этого вида.
Изучение пространственного распределения и биологии P. brachiomastus – третьего по численности рака-отшельника из зал. Восток, позволит сравнить популяционные и репродуктивные характеристики трех массовых видов, что внесет определенный вклад в понимание механизмов их сосуществования.
МАТЕРИАЛ И МЕТОДИКА
Численность P. brachiomastus учитывали ежемесячно с июня 2014 г. по июнь 2015 г. (за исключением ноября 2014 г.) в зал. Восток (зал. Петра Великого, Японское море, 42°53′36.8″ N; 132°43′56.4″ E) на глубине от 0.5 до 12 м на обширном мониторинговом участке дна, представляющем собой смешанный биотоп (подробнее см.: Селин и др., 2016). Раков-отшельников собирали из учетной рамки площадью 1 м2, которую располагали случайным образом 50–66 раз на исследуемом участке дна. В лабораторных условиях из общей пробы отбирали особей P. brachiomastus, пользуясь описанием Комаи (Komai, 2000). Рассчитывали среднюю для сезона плотность поселения животных, биомассу и стандартную ошибку этих показателей. Для анализа распределения раков-отшельников по глубине в июне–сентябре 2015 г. оценивали их численность на горизонтах 0–1, 2–3, 5–6, 8–9 и 11–12 м. При этом учетную рамку располагали на дне в пределах каждого горизонта случайным образом в 25–30 повторностях.
У всех собранных животных (1465 самцов и 871 самка) с помощью стереомикроскопа МБС-10 с точностью до 0.1 мм измеряли длину передней обызвествленной части карапакса (далее по тексту SL или “размер”). Результаты измерений служили основой для построения гистограмм размерного состава населения.
Пол определяли по наличию четырех непарных плеоподов у самок и трех – у самцов (Komai, 2000; Tudge et al., 2012). У самок отмечали присутствие яиц на плеоподах. По степени развития яиц в кладке самок делили на 3 группы. К первой группе относили самок, на плеоподах которых находились равномерно заполненные желтком яйца на начальных стадиях развития; ко второй группе – самок с развивающимися эмбрионами (от начала формирования зародышевого диска, когда в яйце образуется зона, свободная от желтка, до появления глазного пигмента и формирования глаз); к третьей группе – самок, завершавших процесс вынашивания: эмбрионы занимали все пространство внутри яйца и у них были сформированы круглые хорошо видимые глаза. Индивидуальную плодовитость (F) определяли прямым подсчетом количества яиц на плеоподах 25 самок. Для аппроксимации зависимости плодовитости от размера тела использовали степенное уравнение. Диаметр 40 недавно отложенных яиц от двух самок (SL 4.5 и 5.8 мм) измеряли с точностью 0.01 мм с помощью микроскопа Primo Star (Carl Zeiss) и вычисляли среднее ± стандартное отклонение.
Статистическую обработку материалов производили с использованием стандартных приемов корреляционно-регрессионного и дисперсионного анализов, реализованных в пакетах прикладных компьютерных программ Statgraphics Plus for Windows и SPSS 17. С помощью непараметрического Н-критерия Крускала–Уоллиса выполняли множественное сравнение размерного состава скоплений животных на разной глубине (данные за июнь–август и сентябрь 2015 г.) и в разное время года на всем участке дна. Апостериорные попарные сравнения распределений проводили с помощью U-теста Манна–Уитни с учетом поправки Бонферрони.
Данные по динамике температуры поверхностных вод предоставлены гидрометеорологическим постом Морской биологической станции “Восток” ННЦМБ ДВО РАН.
РЕЗУЛЬТАТЫ
Обилие
В течение года плотность поселения и биомасса P. brachiomastus изменялись незначительно. Самые высокие средние величины этих показателей были характерны для лета (3.1 ± 0.4 экз/м2 и 22.83 ± 2.83 г/м2; Хср. ± стандартная ошибка), самые низкие – для весны (2.4 ± 0.6 экз/м2 и 18.24 ± 3.75 г/м2). Осенью плотность поселения и биомасса раков составляли соответственно 3.0 ± 0.5 экз/м2 и 21.80 ± 3.27 г/м2, зимой – 2.8 ± 0.5 экз/м2 и 21.28 ± 3.90 г/м2.
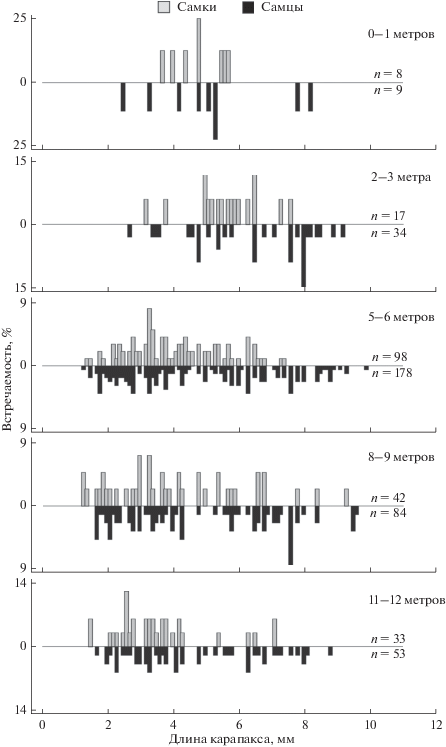
Наиболее часто раки-отшельники встречались на глубине 5–6 м. Например, в июне 2015 г. плотность поселения P. brachiomastus на этом горизонте составляла 6.1 ± 1.2 экз/м2, биомасса – 31.40 ± 3.32 г/м2. На меньшей глубине, как и на большей, плотность поселения раков-отшельников в среднем составляла 0.1–1.9 экз/м2, биомасса – 0.24–7.27 г/м2 (рис. 1). Подобная картина вертикального распределения животных сохранялась в течение всего летнего периода и в сентябре. Зимой раки-отшельники этого вида встречались глубже 2 м.
Размерный состав
Скопление P. brachiomastus на обследованном участке дна формировали самки размером от 1.3 до 10.6 мм (в среднем 4.3 ± 1.5 мм; Хср. ± стандартное отклонение) и самцы размером от 1.3 до 10.3 мм (в среднем 5.3 ± 2.2 мм). Самки, как правило, были представлены особями размером 1.8–7.0 мм (95.0%), самцы – 1.8–9.0 мм (96.5%). Размерные распределения суммарной пробы самок и самцов значимо различались (U-тест, P < 0.05).
В течение периода исследований размерный состав P. brachiomastus существенно изменялся (рис. 2). Например, летом 2014 г. доля раков крупнее 8 мм составляла 5.7% от численности населения, осенью этого же года – 9.9%, а зимой – 6.1%; весной 2015 г. – 5.0%, летом – 7.6% и осенью – более 15%. При множественном сравнении размерных распределений критерий Крускала–Уоллиса показал значимые различия как для самок (χ2 = 92.38; df = 14; Р < 0.001), так и для самцов (χ2 = 136.30; df = 14; Р < 0.001). Парное сравнение свидетельствует о наличии значимых различий между размерным распределением самок в зимние месяцы, в марте (U-тест; Р ≤ 0.005) и в июле–августе (Р < 0.025). У самцов значимые различия были менее масштабными, чем у самок, и относились к зимнему периоду и к июлю–августу (Р < 0.025).
Рис. 2.
Сезонные изменения размерного состава самок и самцов Pagurus brachiomastus в 2014 и 2015 годах. Здесь и на рис. 3: n – объем пробы, экз.

С увеличением глубины размерный состав раков-отшельников также заметно изменялся (рис. 3): от береговой черты до глубины 5–6 м возрастал размерный диапазон, уменьшалась дискретность. Обратная тенденция наблюдалась с увеличением глубины до 11–12 м. При множественном сравнении размерных распределений животных из скоплений на разных горизонтах критерий Крускала–Уоллиса показал значимые различия как для самок (χ2 = 23.11; df = 4; Р < 0.000), так и для самцов (χ2 = 18.07; df = 44; Р = 0.001). Размерный состав животных в скоплении на глубине 2–3 м значимо отличался от такового на бóльших глубинах (U-тест; Р < 0.005).
Половая структура
Соотношение самцов и самок P. brachiomastus в среднем за весь период исследований составило 1.7. Численность самцов была значимо выше среди наиболее мелких особей с SL 1.3–2.0 мм и среди животных крупнее 6.0 мм (биномиальный тест, Р < 0.001) (рис. 4а).
Рис. 4.
Размерные (а) и сезонные (б) изменения соотношения полов у Pagurus brachiomastus. Числа в колонках – объем выборки животных каждого пола. Значимые различия между соотношением полов отмечены звездочкой (биномиальный тест; *Р < 0.05; **Р < 0.01; ***Р < 0.001).

В летний период (июнь–август) на глубине около 1 м особи обоих полов встречались с равной частотой (Р > 0.05), глубже отчетливо доминировали самцы (Р < 0.01).
Соотношение самцов и самок изменялось в течение периода исследований от 0.8 в мае 2015 г. до 3.3 в сентябре этого же года, но в большинстве случаев по численности преобладали самцы (Р < 0.05) (рис. 4б). Какой-либо отчетливой тенденции сезонной изменчивости этого показателя не выявлено.
Репродуктивные характеристики
Самки P. brachiomastus откладывают яйца черного цвета диаметром 0.48–0.58 мм (в среднем 0.54 ± 0.03; Хср. ± стандартное отклонение). Среди самок с SL от 1.8 до 7.1 мм количество яиц на плеоподах изменялось от 59 до 3612 и в среднем составляло 1407 ± 1200 экз. (рис. 5). Зависимость индивидуальной плодовитости самок от размера тела хорошо аппроксимируется степенным уравнением вида: F = 7.1838SL3.2212 (стандартная ошибка линейного коэффициента равна 1.3049, степенного – 0.1764; коэффициент детерминации равен 93.5%; объем выборки составил 25 экз.).
Рис. 5.
Эмпирические точки и линия регрессии зависимости плодовитости от размера самок Pagurus brachiomastus.

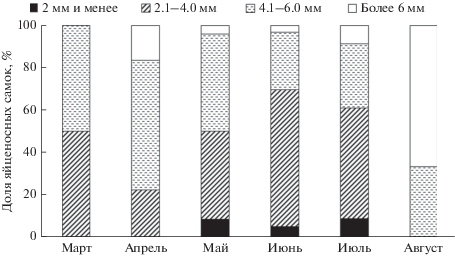
Первые яйценосные самки (около 8.5% от общего числа самок в выборке) появились в марте (рис. 6а), их размер варьировал от 2.4 до 5.8 мм (рис. 7). Ко второй декаде мая доля самок с яйцами на плеоподах превышала 80% (SL от 1.7 до 8.3 мм); они относились к первой группе, поскольку яйца находились на ранних стадиях развития и были равномерно заполнены желтком (рис. 6б). В начале второй декады июня доля яйценосных самок, размер которых варьировал от 2 до 8.4 мм, снизилась до 60%; присутствовали самки всех трех групп. В июле доля яйценосных самок уменьшилась до 50%, но вклад самок первой группы был приблизительно таким же, как и в июне. В августе отмечена яйценосная самка минимального размера (SL = 1.5 мм). Яйценосные самки всех трех групп встречались до конца августа, их доля уменьшалась до 20%; это были крупные особи с SL от 5.3 до 7.3 мм (рис. 7). В сентябре яйценосные самки P. brachiomastus в пробах отсутствовали (рис. 6).
ОБСУЖДЕНИЕ
Распределение и состав населения
Обилие и состав населения P. brachiomastus тесно сопряжены с циклическими сезонными изменениями условий среды обитания и отражают естественные жизненные процессы: рождаемость, рост и смертность животных. Наиболее значимые изменения в размерном составе P. brachiomastus происходят зимой – в начале весны и во второй половине лета. В первом случае это связано с сокращением численности животных (наиболее крупных старых особей) в результате отмирания по естественным причинам. Во втором случае изменение размерного состава обусловлено пополнением населения молодью и ростом животных.
В районе исследования P. brachiomastus – один из наиболее многочисленных раков-отшельников наряду с P. minutus и P. proximus (Селин и др., 2016). В летнее время он встречается от уреза воды и до максимальных обследованных глубин, достигая наибольшей численности на глубине 5–6 м, т.е. чуть ниже границы летнего термоклина, который во внутренних частях бухт и заливов зал. Петра Великого характерен для горизонта 3–5 м (Степанов, 1976). Для P. brachiomastus зал. Петра Великого – это южная часть ареала, тогда как для более теплолюбивых P. minutus и P. proximus – северная граница распространения (Komai et al., 2015). Отчасти поэтому в теплое время года основные скопления P. minutus приурочены к глубине около 1 м (Korn et al., 2018), а P. proximus – к глубине 2–3 м (Kornienko et al., 2017). Опубликованные данные свидетельствуют о том, что одной из причин вертикального распределения раков-отшельников, как и других гидробионтов, является их термопатия, которая в значительной мере определяет пространственную разобщенность основных скоплений трех видов раков-отшельников, влияя на уровень их конкурентных взаимодействий. На глубине более 6–7 м эти животные малочисленны, что связано со значительным заилением осадка и ограниченностью твердого субстрата, на котором, как правило, были обнаружены животные (Селин и др., 2016).
В переописании вида P. brachiomastus указаны размеры особей, обнаруженных у берегов о-ва Хоккайдо: самцы от 2.0 до 11.7 мм; самки – от 2.7 до 9.0 мм, в том числе яйценосные от 4.4 до 9.0 мм (Komai, 2000). Размеры P. brachiomastus из зал. Аккеси (северо-восточная часть Хоккайдо) варьировали от 1.14 до 13.86 мм, в том числе шести яйценосных самок – от 5.94 до 10.94 мм (Oba et al., 2008). На обследованном нами участке в зал. Восток максимальный размер P. brachiomastus составил 10.3–10.6 мм, что значительно выше размерных характеристик, установленных ранее для P. proximus и P. minutus: 7.8 и 7.0 мм соответственно (Kornienko et al., 2017; Korn et al., 2018). Около 90–95% населения этих видов составляют животные с SL менее 4 мм. Очевидно, что только в данной размерной группе симпатрических видов 37.8% особей P. brachiomastus находится в напряженных взаимоотношениях с другими раками-отшельниками, конкурируя за основные ресурсы, прежде всего за раковины брюхоногих моллюсков. Это свидетельствует также о том, что около трети особей P. brachiomastus с длиной карапакса более 6.0 мм не испытывает острой конкуренции со стороны наиболее крупных особей P. proximus и P. minutus, которые редко встречаются в этом биотопе.
Известно, что заметное отклонение соотношения полов от 1 : 1 широко распространено среди морских ракообразных (Wenner, 1972). У раков-отшельников соотношение полов обычно зависит от размера: среди мелких особей преобладают самки, а крупные особи представлены в основном самцами. В целом же соотношение полов может приближаться к 1 : 1, как, например, у P. proximus (см.: Wada, Mima, 2003; Kornienko et al., 2017) и Discorsopagurus schmitti (см.: Gherardi, Cassidy, 1995); могут преобладать самки, как у P. minutus (см.: Korn et al., 2018), P. geminus, P. lanuginosus и Clibanarius virescens (см.: Imazu, Asakura, 1994), или самцы, как, например, у Loxopagurus loxochelis (см.: Martinelli et al., 2002) и P. brachiomastus (наши данные). Высказано предположение, что распространенность самок в популяции – одна из причин, определяющих репродуктивный успех и высокую численность P. minutus (см.: Korn et al., 2018).
Репродуктивные характеристики
Как и у других видов раков-отшельников, количество яиц на плеоподах P. brachiomastus коррелировало с размером самок. В нашем исследовании плодовитость самок P. brachiomastus варьировала от 59 до 3612 яиц. Самки более мелких P. proximus и P. minutus (см.: Kornienko et al., 2017; Korn et al., 2018) откладывали яйца такого же диаметра, но плодовитость самок этих видов была ниже (табл. 1).
Таблица 1.
Некоторые характеристики трех массовых видов раков-отшельников из зал. Восток (зал. Петра Великого, Японское море)
| Характеристика | Pagurus minutus (Korn et al., 2018) | Pagurus proximus (Kornienko et al., 2017) | Pagurus brachiomastus (наши данные) |
| Максимальный размер самцов (SL), мм | 7.0 | 7.8 | 10.3 |
| Максимальный размер самок (SL), мм | 4.7 | 6.7 | 10.6 |
| Максимальный размер яйценосных самок (SL), мм | 3.9 | 5.7 | 8.4 |
| Минимальный размер яйценосных самок (SL), мм | 1.2 | 1.3 | 1.5 |
| Плодовитость, экз. | 37–721 | 28–2085 | 59–3612 |
| Диаметр яиц, мм | 0.46–0.62 | 0.49–0.53 | 0.48–0.58 |
| Период встречаемости самок с яйцами | Май–сентябрь | Декабрь–август | Март–август |
В зал. Аккеси (северо-восточная часть Хоккайдо) яйценосные самки P. brachiomastus с недавно отложенными яйцами обнаружены в апреле–мае, а в июле отмечена самка с яйцами в начале развития (Oba et al., 2008). Согласно нашим наблюдениям, в зал. Восток репродуктивный сезон P. brachiomastus начинался в марте, когда температура воды в заливе достигала положительных значений, и завершался к началу сентября. Количество самок c яйцами на плеоподах увеличивалось постепенно и достигало максимума (80%) в начале мая при температуре воды около 10°С (рис. 6а). Все это время яйца, находившиеся в состоянии физиологического покоя или эмбриональной диапаузы (Алексеев, 1990), не развивались, т.е. все яйценосные самки относились к первой группе. В середине мая развитие яиц возобновилось, поскольку в середине июня присутствовали яйценосные самки трех групп, а доля самок без яиц увеличилась за счет особей, освободившихся от потомства. Это подтверждается появлением в начале июня личинок P. brachiomastus в планктоне (Корниенко, Корн, 2016).
Самки всех трех групп присутствовали на протяжении июля–августа, но общая доля яйценосных самок постепенно уменьшалась. Следовательно, несмотря на наличие у части самок эмбриональной паузы в развитии яиц, приводящей к синхронизации выхода личинок в первой половине июня, остальные особи в июле–августе приступали к нересту асинхронно. Вероятно, некоторые из них нерестились повторно, но для подтверждения этого необходимо исследовать их гонадный цикл. В сентябре яйценосные самки P. brachiomastus в пробах отсутствовали, что противоречит данным Корниенко и Корн (2016), согласно которым личинки этого рака-отшельника в планктоне зал. Восток встречаются до середины октября. Возможно, в октябре это были личинки P. lanuginosus, по внешнему виду (соотношение длины карапакса и рострума, эндоподита и экзоподита антенны) сходные с зоэа P. brachiomastus (см.: Konishi, Quintana, 1987; Sultana, Asakura, 2015). До недавнего времени считали, что в зал. Восток P. lanuginosus не встречается (Марин, Корниенко, 2014), но летом 2017 г. в непосредственной близости от мониторингового участка были обнаружены две особи этого вида (наши неопубликованные данные). В зал. Хакодате (северная часть о-ва Хоккайдо) самки P. lanuginosus с яйцами на плеоподах встречаются в течение всего года, кроме августа и сентября; они вынашивают две или несколько кладок (Wada et al., 2000). Период размножения P. lanuginosus в северо-западной части Японского моря неизвестен.
Размерный состав яйценосных самок варьировал в течение репродуктивного сезона. В марте–апреле сезон размножения начинали самки с SL от 2.4 до 7.2 мм; в мае–июле появлялись мелкие (менее 2 мм) впервые нерестящиеся особи, их доля среди яйценосных самок составляла 5–8%. Завершали сезон размножения в августе крупные самки (средняя SL = 6.43 ± 0.60 мм) (рис. 7). Вариации в сроках размножения самок разных размерных групп у раков-отшельников наблюдали и ранее. Так, у P. middendorffii и P. filholi крупные самки приступали к нересту в начале репродуктивного сезона, а большинство мелких особей начинали нереститься в последующие месяцы (Wada et al., 1996; Yoshino et al., 2002). Однако это не является общей тенденцией, например, у P. ochotensis мелкие самки размножаются раньше, чем крупные (Wada, 2001).
Сравнение репродуктивных характеристик трех массовых видов раков-отшельников из зал. Восток показало, что они используют одинаковую репродуктивную стратегию, которая предполагает раннюю зрелость и значительные репродуктивные усилия, направленные на преодоление высокой смертности взрослого населения (Carlon, Ebersole, 1995). Однако у этих видов раков-отшельников период развития и оседания личинок ограничен в основном летними месяцами (Корниенко, Корн, 2016), поэтому для достижения репродуктивного успеха и снижения конкуренции виды применяют разные тактики.
Самки с яйцами самого мелкого и мелководного P. minutus встречаются с мая по сентябрь, приступают к размножению асинхронно; развитие яиц начинается сразу после откладки; за сезон размножения самка неоднократно откладывает яйца (Korn et al., 2018). Для P. proximus и P. brachiomastus характерны длительный инкубационный период и наличие эмбриональной диапаузы в развитии яиц, которая позволяет обеспечить выход личинок в наиболее подходящее время – в начале июня. У P. proximus самки с яйцами появляются в декабре; в мае 100% самок несут на плеоподах яйца в состоянии диапаузы; развитие яиц начинается синхронно с повышением температуры воды. У этого вида отмечен также менее продуктивный и несинхронный повторный нерест (Kornienko et al., 2017). У P. brachiomastus яйценосные самки появляются в марте; и в середине мая, когда у самок, отложивших яйца в марте–апреле, возобновляется развитие эмбрионов, почти 20% самок к нересту еще не приступали. Синхронность нереста нарушается, выход личинок растягивается во времени. В июле–августе при постепенном снижении доли яйценосных самок (рис. 6а), вклад первой группы остается на том же уровне, что и в июне (рис. 6б); в это время возможен повторный нерест крупных особей P. brachiomastus, характеризующихся высокой плодовитостью.
Известно, что присутствие паразитических изопод и корнеголовых ракообразных может стать фактором, лимитирующим численность раков-отшельников (McDermott et al., 2010; Williams, Boyko, 2012). Поэтому следует отметить, что в зал. Восток у P. proximus паразиты не обнаружены, а у P. brachiomastus экстенсивность инвазии превышала 10% (Корниенко и др., 2018). Этим можно объяснить то, что при общем сходстве тактики размножения P. proximus и P. brachiomastus численность последнего заметно ниже.
В целом наше исследование подтверждает применимую для раков-отшельников умеренных вод гипотезу Вады с соавторами (Wada et al., 2000), согласно которой раки-отшельники могут максимизировать репродуктивный успех за счет выживаемости личинок или благодаря увеличению количества кладок за сезон размножения. В первом случае (у P. proximus и P. brachiomastus) увеличение периода инкубации и синхронизация развития яиц обеспечивают массовый выход личинок в наиболее благоприятное время. Во втором случае (у P. minutus) на протяжении сезона размножения личинки появляются в планктоне несколько раз и в разное время, что позволяет скорректировать влияние негативных последствий непредсказуемых условий среды. Очевидно, что повторный нерест P. proximus и P. brachiomastus, как и сдвиг соотношения полов в пользу самок в популяции P. minutus, усиливают репродуктивный успех этих видов, обеспечивая их преобладание на исследованном участке, а различия в размерном составе и пространственном распределении позволяют снизить конкуренцию за обладание доступными раковинами брюхоногих моллюсков.
Список литературы
Алексеев В.Р. Диапауза ракообразных. Эколого-физиологические аспекты. М.: Наука. 1990. 144 с.
Волвенко И.В. Механизмы регуляции динамики численности и продукционная биология раков-отшельников. Владивосток: Дальнаука. 1995. 248 с.
Корниенко Е.С., Корн О.М. Ключ к определению зоэа массовых видов раков-отшельников (Decapoda: Paguroidea) залива Восток Японского моря // Биол. моря. 2016. Т. 42. № 5. С. 368–374.
Корниенко Е.С., Корн О.М., Селин Н.И. Паразитофауна массовых видов раков-отшельников залива Восток (Японское море) // Биол. моря. 2018. Т. 44. № 2. С. 80–85.
Макаров В.В. Anomura. Фауна СССР. Ракообразные. М.; Л.: Изд-во АН СССР. 1938. Т. 10. Вып. 3. 324 с.
Марин И.Н., Корниенко Е.С. Десятиногие ракообразные (Decapoda) залива Восток Японского моря // Биота и среда заповедников Дальнего Востока. 2014. № 2. С. 49–71.
Селин Н.И., Корниенко Е.С., Корн О.М. Видовой состав и особенности распределения раков-отшельников (Decapoda: Paguroidea) в заливе Восток Японского моря // Биол. моря. 2016. Т. 42. № 6. С. 458–464.
Степанов В.В. Характеристика температуры и солености вод залива Восток Японского моря // Биологические исследования залива Восток. Владивосток: ДВНЦ АН СССР. 1976. С. 12–22.
Abrams P.A. Resource partitioning and interspecific competition in a tropical hermit crab community // Oecologia. 1980. V. 46. P. 365–379.
Asakura A. Population ecology of the sand-dwelling hermit crab Diogenes nitidimanus. IV. Larval settlement // Mar. Ecol. Prog. Ser. 1991. V. 78. P. 139–146.
Carlon D., Ebersole J.P. Life-history variation among three temperate hermit crabs: the importance of size in reproductive strategies // Biol. Bull. 1995. V. 188. P. 329–337.
Fotheringham N., Bagnal A. Seasonal variation in the occurrence of planktonic larvae of sympatric hermit crabs // J. Exp. Mar. Biol. Ecol. 1976. V. 21. P. 279–287.
Gherardi F., Cassidy P.M. Life history patterns of Discorsopagurus schmitti, a hermit crab inhabiting polychaete tubes // Biol. Bull. 1995. V. 188. № 1. P. 68–77.
Gherardi F., Nardone F. The question of coexistence in hermit crabs: population ecology of a tropical intertidal assemblage // Crustaceana. 1997. V. 70. № 5. P. 608–629.
Imazu M., Asakura A. Distribution, reproduction and shell utilization patterns in three species of intertidal hermit crabs on a rocky shore on the Pacific coast of Japan // J. Exp. Mar. Biol. Ecol. 1994. V. 184. P. 41–65.
Jung J. Systematic study of the superfamily Paguroidea (Crustacea: Decapoda: Anomura) from Korea // College of Natural Sciences. Dept. of Biological Sciences. Theses (Ph.D. / Sc.D.). 2017. http://s-space.snu.ac.kr/handle/10371/137154?mode=full
Komai T. The identity of Pagurus brachiomastus and description of two new species of Pagurus (Crustacea: Decapoda: Anomura: Paguridae) from the Northwestern Pacific // Species Diversity. 2000. V. 5. P. 229–265.
Komai T., Saito Y., Myorin E. A new species of the hermit crab genus Pagurus Fabricius, 1775 (Crustacea: Decapoda: Anomura: Paguridae) from shallow coastal waters in Japan, with a checklist of the East Asian species of the genus // Zootaxa. 2015. V. 3918. P. 224–238.
Konishi K., Quintana R. The larval stages of Pagurus brachiomastus (Thallwitz, (1892) (Crustacea: Anomura) reared in the laboratory // Zool. Sci. 1987. V. 4. P. 349–365.
Korn O.M., Kornienko E.S., Selin N.I. Population biology and reproductive characteristics of the hermit crab Pagurus minutus Hess, 1865 (Decapoda: Anomura: Paguridae) in the northern part of the species range (Peter the Great Bay, the Sea of Japan) // Mar. Biol. Res. 2018. V. 14. № 8. P. 846–855.
Kornienko E.S., Selin N.I., Korn O.M. Population and reproductive characteristics of the hermit crab Pagurus proximus Komai, 2000 (Decapoda: Anomura: Paguridae) in the northern part of the species range // J. Mar. Biol. Assoc. U.K. 2017.https://doi.org/10.1017/S0025315417001679
Kostina E.E., Tsurpalo A.P. Species composition and distribution of macrobenthos in the intertidal zone of Kunashir Island (South Kurile Islands), Russia // Publ. Seto Mar. Biol. Lab. 2016. V. 44. P. 53–133.
Lancaster I. Reproduction and life history strategy of the hermit crab Pagurus bernhardus // J. Mar. Biol. Assoc. U.K. 1990. V. 70. P. 129–142.
Martinelli J.M., Mantelatto F.L.M., Fransozo A. Population structure and breeding season of the South Atlantic hermit crab, Loxopagurus loxochelis (Anomura, Diogenidae) from the Ubatuba region, Brazil // Crustaceana. 2002. V. 75. № 6. P. 791–802.
McDermott J.J., Williams J.D., Boyko C.B. The unwanted guests of hermits: a global review of the diversity and natural history of hermit crab parasites // J. Exp. Mar. Biol. Ecol. 2010. V. 394. P. 2–44.
Oba T., Goshima S. Temporal and spatial settlement patterns of sympatric hermit crabs and the influence of shell resource availability // Mar. Biol. 2004. V. 144. P. 871–879.
Oba T., Wada S., Goshima S. Shell partitioning of two sympatric hermit crabs, Pagurus middendorffii and P. brachiomastus, in north-eastern Hokkaido, Japan // J. Mar. Biol. Assoc. U.K. 2008. V. 88. № 1. P. 103–109.
Reese E.S. Annual breeding seasons of three sympatric species of tropical intertidal hermit crabs, with a discussion of factors controlling breeding // J. Exp. Mar. Biol. Ecol. 1968. V. 2. P. 308–318.
Sultana Z., Asakura A. The complete larval development of Pagurus lanuginosus De Haan, 1849 (Decapoda, Anomura, Paguridae) reared in the laboratory, with emphasis on the post-larval stage // Zootaxa. 2015. V. 3915. № 2. P. 206–232.
Tudge C.C., Asakura A., Ahyong S.T. Infraorder Anomura MacLeay, 1838 // The Crustacea. Leiden; Boston: Brill. 2012. V. 9. Pt. B. P. 221–335.
Turra A., Leite F.P.P. Population biology and growth of three sympatric species of intertidal hermit crabs in southeastern Brazil // J. Mar. Biol. Assoc. U.K. 2000. V. 80. P. 1061–1069.
Vance R.R. Competition and mechanism of coexistence in three sympatric species of intertidal hermit crabs // Ecology. 1972. V. 53. P. 1062–1074.
Wada S. Reproductive characters and population structure of the subtidal hermit crab Pagurus ochotensis (Anomura: Paguridae) // Benthos Res. 2001. V. 56. № 1. P. 43–46.
Wada S., Kitaoka H., Goshima S. Reproduction of the hermit crab Pagurus lanuginosus and comparison of reproductive traits among sympatric species // J. Crustacean Biol. 2000. V. 20. № 3. P. 474–478.
Wada S., Mima A. Reproductive characters of the hermit crab Pagurus proximus Komai, 2000 in Hakodate Bay, southern Hokkaido, Japan // Crustacean Res. 2003. V. 32. P. 73–78.
Wada S., Mima A., Ito A. Reproductive phenology of sympatric hermit crabs in temperate Japan // J. Mar. Biol. Assoc. U.K. 2005. V. 85. P. 889–894.
Wada S., Sonoda T., Goshima S. Temporal size covariation of mating pairs of the hermit crab Pagurus middendorffii (Decapoda: Anomura: Paguridae) during a single breeding season // Crustacean Res. 1996. V. 25. P. 158–164.
Wenner A.M. Sex ratio as a function of size in marine crustacea // Am. Nat. 1972. V. 106. P. 321–350.
Williams J.D., Boyko C.B. The global diversity of parasitic isopods associated with crustacean hosts (Isopoda: Bopyroidea and Cryptoniscoidea) // PLoS ONE. 2012. V. 7. № 4. e35350. P. 1–9. https://doi.org/10.1371/journal.pone.0035350
Yoshino K., Goshima S., Nakao S. Temporal reproductive patterns within a breeding season of the hermit crab Pagurus filholi: effects of crab size and shell species // Mar. Biol. 2002. V. 141. P. 1069–1075.
Дополнительные материалы отсутствуют.