Биология моря, 2020, T. 46, № 5, стр. 357-360
Активность О-гликозидгидролаз и других полисахарид-деградирующих ферментов у культивируемых бактериальных изолятов красной водоросли Ahnfeltia tobuchiensis (Kanno et Matsubara, 1932) Makienko, 1970
И. Ю. Бакунина 1, *, О. И. Недашковская 1, Л. А. Балабанова 1, А. Д. Кухлевский 2, О. С. Белоус 2
1 Тихоокеанский институт биоорганической химии им. Г.Б. Елякова ДВО РАН
690022 Владивосток, Россия
2 Национальный научный центр морской биологии им. А.В. Жирмунского ДВО РАН
690041 Владивосток, Россия
* E-mail: bakun@list.ru
Поступила в редакцию 21.11.2019
После доработки 26.01.2020
Принята к публикации 30.01.2020
Аннотация
Впервые дана характеристика профилям активности O-гликозидгидролаз и альгинат-лиаз бактерий, ассоциированных с красной водорослью Ahnfeltia tobuchiensis, которые играют важную роль в трофических взаимоотношениях организмов хозяина и бактерий.
В дальневосточных морях России неприкрепленная к субстрату красная водоросль Ahnfeltia tobuchiensis (Kanno et Matsubara, 1932) Makienko, 1970 (рис. 1) формирует обширные пласты толщиной от 0.1 до 1 м на илистом или илисто-песчаном грунте, которые могут занимать несколько десятков квадратных километров поверхности дна. Этот вид является важным компонентом морских экосистем из-за его вклада в очистку прибрежных вод, подверженных антропогенному загрязнению. К тому же A. tobuchiensis имеет значительную экономическую ценность как промышленный источник агара. Данный полисахарид нашел широкое применение в микробиологии и различных отраслях пищевой промышленности.
Хорошо известно, что бактерии колонизируют поверхность макроводорослей и в большинстве случаев эпифитные бактериальные сообщества весьма видоспецифичны (Goecke et al., 2010). Многие штаммы бактерий, выделенные из разных водорослей, способны разлагать продуцируемые водорослями-хозяевами полисахариды − альгинаты, целлюлозу и др. Считается, что бактерии участвуют в процессе распада водорослей благодаря ферментным системам, разлагающим полисахариды клеточной стенки до моно- и олигосахаридов. Сравнительное изучение таксономического положения штаммов с высокой степенью гидролитической активности необходимо для проведения направленного скрининга ферментов, представляющих интерес для медицины и биотехнологии.
Цели настоящей работы − изучение разнообразия активности O-гликозидгидролаз и других углевод-деградирующих ферментов в бактериях, выделенных из микробного сообщества красной водоросли A. tobuchiensis, а также анализ распространения активности этих ферментов среди бактериальных продуцентов с разным таксономическим статусом.
Штаммы бактерий выделяли методом прямого высева из таллома красной водоросли A. tobuchiensis (рис. 1б), собранного со стороны Охотского моря вблизи о-ва Итуруп (Курильские острова) во время экспедиции на НИС “Академик Опарин”. Бактерии, изолированные в данном эксперименте, идентифицировали на основе стандартных фенотипических, хемотаксономических и генотипических характеристик, как описано ранее (Nedashkovskaya et al., 2007). Принадлежность к роду и виду определяли по последовательности нуклеотидов в гене 16S рРНК, а также по комбинации физиологических и биохимических характеристик штаммов (Бакунина и др., 2012).
Бактерии культивировали, получали бактериальные гомогенаты и экстракты, а также определяли концентрации белка и активность ферментов по стандартным методикам (Bakunina et al., 2013). В качестве субстратов для гликозидаз использовали хромогенные гликозиды (“Sigma-Aldrich”, США). За единицу стандартной активности (U) гликозидазы принимали такое количество фермента в 1 мл экстракта, под действием которого образуется 1 мкмоль п-НФ за 1 мин в условиях эксперимента. Удельную активность рассчитывали как отношение стандартных единиц на 1 мг белка.
Активность полисахарид-гидролаз (EC 3.2.1.-) и альгинат-лиаз (4.2.2.-) определяли по нарастанию восстанавливающих сахаров, как описано ранее (Bakunina et al., 2013). Количество восстанавливающих сахаров рассчитывали по оптической плотности растворов при 750 нм с помощью метода Шомоги−Нельсона. Калибровочные кривые строили для модельных растворов D-глюкозы (“Merck”, США) или L-фукозы (для фукоиданазы). За одну единицу стандартной активности фермента принимали такое его количество в 1 мл экстракта, под действием которого высвобождается 1 мкмоль восстанавливающих сахаров за 1 мин.
В качестве субстратов для α- и β-галактозидазы, α- и β-глюкозидазы, α-N-ацетилгалактозаминидазы, α-фукозидазы, α-маннозидазы, α-ксилозидазы и β-N-ацетилглюкозаминидазы использовали п-нитрофенил-α- и β-D-галактопиранозиды, п-нитрофенил-α- и β-D-глюкопиранозиды, п-нитрофенил-α-N-ацетилгалактозаминид, п-нитрофенил-α-L-фукопиранозид, п-нитрофенил-α-D-маннопиранозид, п-нитрофенил-α-D-ксилопиранозид и п-нитрофенил-β-N-D-ацетилглюкозаминид соответственно.
Для детектирования активности ферментов, разлагающих полисахариды, в качестве субстратов использовали декстран, водорастворимый агар, амилозу, карбоксиметилцеллюлозу и полигулуроновую кислоту, полученные от “Sigma-Aldrich” (США). Фукоидан из Fucus evanescens (α-1,3; 1,4-L-фукансульфат) (Урванцева и др., 2004), пустулан из лишайника Umbilicaria rossica (β-1,6-D-глюкан) (Звягинцева и др., 1986), ламинаран из Laminaria cichorioides (β-1,3;1,6-D-глюкан) (Zvyagintseva et al., 2003), а также полиманнуроновую кислоту из Alaria fistulosa (см.: Zvyagintseva et al., 2005) выделяли и очищали в лаборатории.
С поверхности красной водоросли A. tobuchiensis были выделены 284 чистые культуры бактерий. Детально были изучены профили O-гликозидгидролаз и полисахарид-лиаз 92 штаммов гетеротрофных бактерий. Сравнительный филогенетический анализ последовательностей 16S рРНК показал, что полученные бактерии-продуценты характеризовались богатым видовым разнообразием и относились к 69 филотипам четырех филумов, среди которых доминировали Bacteroidetes (45 штаммов – 48.9%) и Proteobacteria (39 штаммов – 42.4%); представителей Actinobacteria (7 штаммов – 7.6%) и Firmicutes (1 штамм – 1.1%) было значительно меньше. Следует отметить, что при полифазном анализе таксономической структуры данного сообщества было установлено точное таксономическое положение двух новых для науки штаммов флавобактерий, которые обладали гликозидгидролазной активностью. Им были присвоены валидные названия Flavobacterium ahnfeltiae sp. nov. и Polaribacter staleyi sp. nov. (см.: Nedashkovskaya et al., 2014, 2018).
В результате скрининга были отобраны штаммы, показавшие наиболее высокую активность полисахарид-гидролаз и гликозидаз (22 и 16 соответственно). Продуценты полисахарид-гидролаз включали представителей 14 родов, среди которых наиболее часто встречались Polaribacter, Winogradskyella и Zobellia филума Bacteroidetes. Высокая активность гликозидаз отмечена у 16 штаммов, принадлежащих к 9 родам; преобладали представители Amylibacter филума Proteobacteria, Salinibacterium филума Actinobacteria и Zobellia филума Bacteroidetes.
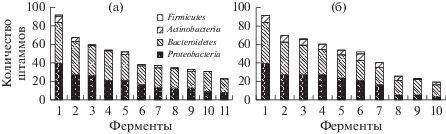
Анализ распределения активности полисахарид-гидролаз и полисахарид-лиаз среди представителей четырех филумов микробного сообщества показал, что все сырые экстракты штаммов проявляли активность α-амилазы и α-глюкозидазы (рис. 2а, 2б: колонка 2 соответственно), которые участвуют в деградации крахмала – резервного полисахарида A. tobuchiensis. Активность полиманнуронат-лиаз, ламинариназ и полигулуронат-лиаз (рис. 2а: колонки 3, 4 и 5 соответственно), типичная для обитателей морской среды, также отмечена во всех экстрактах бактерий. Наиболее распространенными среди изолятов микробного сообщества A. tobuchiensis оказались β-N-ацетилглюкозаминидазы (рис. 2б: колонка 2). Эти гликозидазы часто детектировались у обитателей морской среды (Иванова и др., 1998; Бакунина и др., 2012; Балабанова и др., 2018). Они участвуют во многих важных физиологических процессах и входят в состав хитинлитического комплекса микроорганизмов. Редко встречались продуценты α-N-ацетилгалактозаминидазы (рис. 2б: колонка 9), а также фукоиданазы и каррагиназы, субстраты для которых (фукоидан и каррагинан) A. tobuchiensis не синтезируются.
Рис. 2.
Распределение активности полисахарид-гидролаз и полисахарид-лиаз среди представителей четырех филумов микробного сообщества (а), а также профили гликозидазной активности бактерий (б). (а): 2 – α-амилаза, 3 – полиманнуронат-лиаза, 4 – ламинариназа, 5 – полигулуронат-лиаза, 6 – фукоиданаза, 7 – декстраназа, 8 – каррагинаназа, 9 – пустуланаза, 10 – целлюлаза, 11 – агараза; (б): 2 – β-N-ацетилглюкозаминидаза, 3 – α-глюкозидаза, 4 – β-галактозидаза, 5 – β-глюкозидаза, 6 – α-галактозидаза, 7 – α-ксилозидаза, 8 – α-маннозидаза, 9 – α-фукозидаза, 10 – α-N-ацетилгалактозаминидаза; 1 – общее количество изученных штаммов.
Таким образом, впервые получены сведения о полисахарид-деградирующей активности культивируемых бактерий микробного сообщества красной водоросли A. tobuchiensis, которые характеризуются высоким метаболическим потенциалом, позволяющим бактериям определять жизненную стратегию и играть важную роль во взаимоотношениях с организмом-хозяином.
Список литературы
Бакунина И.Ю., Недашковская О.И., Ким С.Б. и др. Разнообразие гликозидазных активностей бактерий филума Bacteroidetes, изолированных из морских водорослей // Микробиология. 2012. Т. 81. № 6. С. 688–695.
Балабанова Л.А., Бакунина И.Ю., Слепченко Л.В. и др. Полисахарид-деградирующая активность морских и наземных штаммов мицелиальных грибов // Биоорган. химия. 2018. Т. 44. № 4. С. 431–437.
Звягинцева Т.Н. А.с. № 1227199 CCCP МКИ4 А 61 К 35/78. Способ получения пустулана / Звягинцева Т.Н., Елякова Л.А., Сундукова Е.В., Кривощекова О.Е., Мищенко Н.П. // заявл. 16.12.83.; опубл. 30.04.86. № 3741257/28-14. Бюл. № 16. 2 с.
Иванова Е.П., Бакунина И.Ю., Недашковская О.И. и др. Распространение морских микроорганизмов, продуцирующих β-N-ацетилглюкозаминидазы, α-галактозидазы, α-N-ацетилгалактозаминидазы // Биол. моря. 1998. Т. 24. № 6. С. 365–372.
Урванцева А.М., Бакунина И.Ю., Ким Н.Ю. и др. Выделение очищенного фукоидана из природного комплекса с полифенолами и его характеристика // Химия раст. сырья. 2004. № 3. С. 15–24.
Bakunina I.Y., Nedashkovskaya O.I., Balabanova L.A. et al. Comparative analysis of glycoside hydrolases activities from phylogenetically diverse marine bacteria of the genus Arenibacter // Mar. Drugs. 2013. V. 11. № 6. P. 1977–1998.
Goecke F., Labes A., Wiese J., Imhoff J.F. Chemical interactions between marine macroalgae and bacteria // Mar. Ecol. Prog. Ser. 2010. V. 409. P. 267–299.
Nedashkovskaya O.I., Kim S.B., Shin D.S. et al. Echinicola vietnamencis sp. nov., a member of the phylum Bacteroidetes isolated from seawater // Int. J. Syst. Evol. Microbiol. 2007. V. 57. 761–763. https://doi.org/10.1099/ijs.0.64546-0
Nedashkovskaya O.I., Balabanova L.A., Zhukova N.V. et al. Flavobacterium ahnfeltiae sp. nov., a new marine polysaccharide degrading bacterium isolated from Pacific red alga // Arch. Microbiol. 2014. V. 196. № 10. P. 745–752.
Nedashkovskaya O.I., Kim S.-G., Balabanova L.A. et al. Polaribacter staleyi sp. nov., a polysaccharide-degrading marine bacterim isolated from the red alga Ahnfeltia tobuchiensis // Int. J. Syst. Evol. Microbiol. 2018. V. 68. № 2. P. 623–629. https://doi.org/10.1099/ijsem.0.002554
Zvyagintseva T.N., Shevchenko N.M., Chizhov A.O. et al. Water-soluble polysaccharides of some far Eastern brown algae. Distribution, structure and their dependence on developmental conditions // J. Exp. Mar. Biol. Ecol. 2003. V. 294. № 1. P. 1–13.
Zvyagintseva T.N., Shevchenko N.M., Nazarenko E.L. et al. Water-soluble polysaccharides of some brown algae of the Russian Far East. Structure and biological action of low-molecular mass polyuronans // J. Exp. Mar. Biol. Ecol. 2005. V. 320. № 2. P. 123–131.
Дополнительные материалы отсутствуют.
Инструменты
Биология моря



