Биология моря, 2020, T. 46, № 5, стр. 291-303
Симбиотические взаимоотношения микроводорослей зооксантелл и полипов рифостроящих кораллов в процессе автотрофного и гетеротрофного питания
Э. А. Титлянов 1, *, Т. В. Титлянова 1
1 Национальный научный центр морской биологии им. А.В. Жирмунского ДВО РАН
690041 Владивосток, Россия
* E-mail: etitlyanov@mail.ru
Поступила в редакцию 07.12.2019
После доработки 31.01.2020
Принята к публикации 02.02.2020
Аннотация
В обзоре обобщены результаты работ авторов и их коллег по совместным публикациям и исследованиям на коралловых рифах Индо-Пацифики, начиная с конца 1970-х годов. Экспериментальные полевые и лабораторные работы были проведены во время рейсов на НИС “Каллисто” и “Академик Александр Несмеянов”, а также на морских биологических станциях Японии, Китая, Вьетнама и Израиля. Основная цель этих исследований − получение данных о разнообразии и механизмах симбиотических связей между животным-“хозяином” и его внутриклеточными симбионтами при выполнении организмом наиболее важных жизненных функций.
Коралловые рифы – распространенная и наиболее продуктивная прибрежная экосистема в тропическом биогеографическом регионе (Lüning, 1990; Crossland et al., 1991; Литтлер и др., 1991; Fong, Paul, 2011; Stambler, 2011). Системообразующими организмами на коралловых рифах являются рифостроящие кораллы. К современным рифостроящим, или герматипным, кораллам относятся беспозвоночные животные представители таксономического типа Coelenterata, главным образом класса Anthozoa подкласса Hexacorallia (шестилучевые кораллы) отряда Scleractinia. Среди герматипных кораллов имеются представители других отрядов и даже классов кишечнополостных (Veron, 1986), однако большинство среди рифостроителей представляют склерактинии и именно они являются предметом нашего исследования (рис. 1).
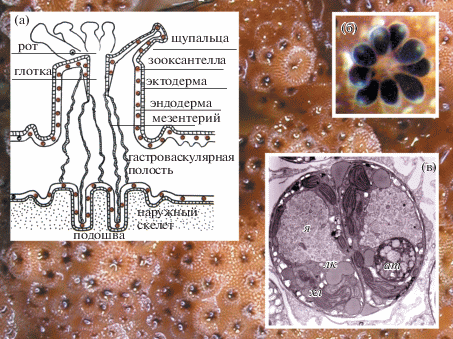
Склерактиниевые кораллы – главным образом колониальные животные. Жизненной формой кораллов является полип (рис. 2а, 2б), имеющий бокаловидное тело с ротовым диском в верхней его части и с подошвой на противоположном конце. В центре диска находится рот, а по его периферии располагаются щупальца. Рот ведет в кишечную полость, которая представлена складками ткани мезентерия. Наружная поверхность полипа от щупалец до подошвы покрыта тканью, состоящей из двух рядов клеток: эктодермы и эндодермы. В каждой эндодермальной клетке ткани полипа содержится от одной до трех-четырех клеток симбиотических водорослей – зооксантелл (рис. 2в). Живая ткань покрывает наружный карбонатный скелет колонии коралловых полипов (Veron, 1986).
Рис. 2.
Морфология и анатомия полипов склерактиниевого коралла Acropora sp. а – анатомия полипа; б – полип с выпущенными щупальцами; в – клетка зооксантеллы в стадии деления. Условные обозначения здесь, а также на рис. 3 и 4: я − ядро, хл − хлоропласты, ат − аккумулятивное тело, лк − липидные капли.
У склерактиниевых кораллов зооксантеллы – это в основном разные генетически детерминированные формы одноклеточной водоросли Symbiodinium microadriaticum LaJeunesse, относящейся к семейству Symbiodiniaceae порядка Suessiales класса Dinophyceae (Stambler, 2011). Зооксантелла обладает одним хлоропластом сложной формы с одним или двумя пиреноидами (рис. 2в). Хлоропласт содержит фотосинтетические пигменты, свойственные всем динофлагеллатам: хлорофиллы a и c2, перидинин, диадиноксантин, диноксантин и β-каротин (Звалинский и др., 1978; Titlyanov et al., 1980). Отличительной структурой симбиотической клетки является большое аккумулятивное тело сферической формы, служащее для “сброса” отходов метаболизма. Запасные вещества зооксантелл – это жиры, находящиеся в цитоплазме в виде капель, и крахмалоподобный полисахарид, располагающийся преимущественно по периферии белкового тела пиреноида.
В клетках кораллов зооксантеллы находятся в виде неподвижной цисты. Симбионты передаются от родителей к потомству с половыми продуктами, а также асексуально с планулами или почками (Сорокин, 1990; Titlyanov et al., 1998, 2001a; Harrison, 2011). Установлено, что взрослые полипы могут инфицироваться зооксантеллами из морской воды (Colley, Trench, 1985). Животное-полип и водоросли-зооксантелы находятся в симбиотических взаимовыгодных (мутуалистических) отношениях (Титлянов, 1999; Титлянов, Титлянова, 2002а, 2002б). Эти взаимоотношения настолько глубокие, что колония коралловых полипов может пройти весь жизненный цикл как организм лишь при сосуществовании животного и водорослей. При разрыве функциональных связей между животными клетками полипа и водорослями полип погибает.
Целью настоящего обзора является анализ опубликованных ранее нами и нашими коллегами данных о разнообразии симбиотических связей между животным-“хозяином” и его внутриклеточными симбионтами при выполнении организмом наиболее важных жизненных функций.
ЗООКСАНТЕЛЛЫ В ГЕРМАТИПНЫХ КОРАЛЛАХ
Морфофизиологические формы зооксантелл
Три морфофизиологические формы симбиотических динофлагеллят, различающихся по морфологии, физиологии и биохимии, были найдены в герматипных кораллах на краевом рифе о-ва Сесоко (Окинава, Япония): форма “L” (крупные), форма “B” (бурые) и форма “G” (зеленые) (рис. 3).
Рис. 3.
Морфофункциональные типы зооксантелл коралла Stilophora pistillata. А – форма “B” (а − ультраструктура клетки, б − зооксантеллы в клетке животного, в − делящаяся клетка); Б – форма “G” (а − ультраструктура клетки; б, в − морфология клеток). Условное обозначение: п − пиреноид.
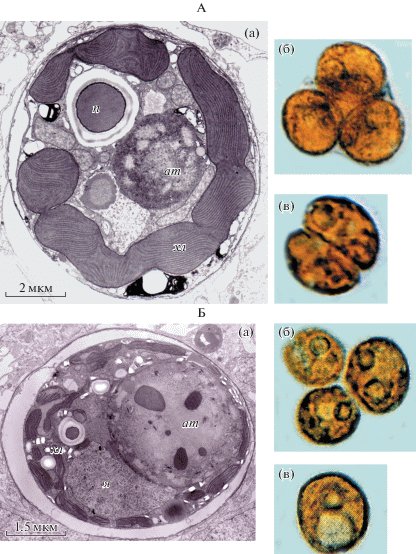
Колонии гидрокоралла Millepora intricata содержали симбионты только формы “L”, склерактиниевые кораллы содержали симбионты форм “B” и “G” (Titlyanov et al., 2001b). Клетки формы “L” имели сферическую форму, их диаметр составлял более 15 мкм; цвет водорослей варьировал от темно-бурого до светло-коричневого. Сферические, золотисто-коричневые клетки формы “B” были меньше клеток формы “L”, их размер составлял 8−14 мкм.
Размер клеток формы “G” был наименьшим − от 7 до 11 мкм; оливковые или зеленые клетки имели овальную форму. Все три типа зооксантелл, обитавших в одинаковых условиях освещения, значительно различались по химико-физиологическим показателям. Так, например, симбионты формы “L” аккумулировали наибольшее количество фотосинтетических пигментов – до 19.8 мкг/мм3 объема клетки. Наименьшее количество пигментов было найдено в зооксантеллах формы “G” – 1.3 мкг/мм3 объема клетки. Сравнение фотосинтетических возможностей всех трех типов водорослей in hospite (в кораллах, акклимированных к 30% фотосинтетически активной радиации, падающей на поверхность воды, − ФАРп) показало, что наибольшей скоростью валового фотосинтеза (211 мкгО2/мм3 объема клетки в час) обладали симбионты формы “G”; скорость валового фотосинтеза у симбионтов формы “L” была в 3.5 раза меньше (Titlyanov et al., 2001b).
Обоснованность выделения морфофункциональных форм клеток “G” и “B” была подтверждена молекулярно-генетическими методами (Loh et al., 2002), а также анализом липидов и жирных кислот (Zhukova, Titlyanov, 2003, 2006). Мы показали также, что симбионты форм “G” и “B” обитают во всех изученных нами склерактиниевых кораллах, а количество и соотношение данных форм в тканях полипов зависит преимущественно от освещенности в месте обитания (Titlyanov et al., 2001b).
Репродукция и деградация зооксантелл
В эндодерме коралла, находящегося в стабильных условиях, в течение суток можно обнаружить зооксантеллы на разных этапах онтогенеза: ~90% взрослых активно функционирующих клеток, 1–3% делящихся клеток и 1–3% деградирующих клеток (Titlyanov et al., 1996; Leletkin et al., 1999; Титлянов и др., 2006). Диаметр взрослых клеток разных видов герматипных кораллов изменяется от 7 до 17 мкм, а цвет варьирует от светло-оливкового до темно-бурого (Titlyanov et al., 2001b).
Зооксантеллы в тканях полипа воспроизводятся путем митотического деления материнской клетки на две дочерние. Делящиеся клетки встречаются в эндодерме всех органов полипа. Клетки делятся, как правило, ночью, максимум деления приходится на середину ночи (Titlyanov et al., 1996). Деление зооксантелл в теле полипа − цикличный процесс, он имеет четыре типа периодичности (Titlyanov et al., 2000a; Титлянов и др., 2006). Первый тип периодичности, изученный на коралле Seriatopora caliendrum, представляет собой суточные колебания интенсивности процесса с максимумом в ночное время. Второй тип периодичности, описанный нами на S. caliendrum и гидрокоралле M. intricata, – это колебание интенсивности деления клеток с периодом 3 сут. Третий тип периодичности − колебание деления клеток симбионтов с периодом 5−6 сут, а четвертый − 15−20 сут.
В эндодерме всех органов коралловых полипов встречаются зооксантеллы с признаками деградации. В стационарных природных условиях количество таких клеток обычно равно числу вновь образованных клеток (Titlyanov et al., 1996).
АВТОТРОФНОЕ ПИТАНИЕ КОРАЛЛОВ
Герматипные кораллы имеют несколько способов питания: 1) утилизация продуктов фотосинтеза зооксантелл, 2) питание продуктами охоты (хищничество), 3) питание органическими седиментами животного происхождения, 4) поглощение растворенного органического вещества (РОВ) и 5) использование продуктов деградации зооксантелл (Титлянов, Титлянова, 2002а, 2002б).
Первичные, промежуточные и конечные продукты фотосинтеза зооксантелл и их использование полипом
На фрагментах колоний склерактиниевых кораллов Stylophora pistillata и Seriatopora caliendrum и зооксантелл, выделенных из них методом радиоуглеродного анализа, установлено, что первичная фотоассимиляция углерода коралловыми динофлагеллятами происходит в восстановительном пентозофосфатном цикле. Самыми ранними промежуточными продуктами фотосинтеза были 3-фосфоглицериновая кислота и фосфорные эфиры сахаров, а конечными продуктами – гексозы, глицерол и аминокислоты (глицин, серин, аланин, аспартат, глутамат, яблочная кислота). При длительной экспозиции на сильном свету (80–60% ФАРп) преобладал синтез гексоз (глюкозы, сахарозы, фруктозы), на слабом свету (10–5% ФАРп) в конечных продуктах фотосинтеза преобладал глицерол (Биль и др., 1991; Eden et al., 1996; Malkin et al., 1996; Titlyanov et al., 2000a). Продукты фотосинтеза накапливаются в виде крахмала в хлоропластах и в виде липидных капель в цитоплазме, а также экскретируются в цитоплазму животной клетки и используются в ней или транспортируются в другие клетки кораллового полипа (Muscatine, Cernichiari, 1969; Patton et al., 1977; Blanquet et al., 1979; Биль и др., 1991). Продукты фотосинтеза зооксантелл составляют от 30 до 90% всей пищи коралловых полипов (Muscatine et al., 1983; Muscatine, 1990). Однако первичные продукты фотосинтеза зооксантелл бедны соединениями азота, при этом в них отсутствует фосфор, что ограничивает их прямое использование в синтезе многих сложных высокомолекулярных веществ и дает основание отнести к разряду “пустой” пищи.
Сорокин (1990) на основании собственных и литературных данных, полученных при исследовании коралловых рифов морей Индо-Пацифики, показал, что в среднем для рифостроящих кораллов этого региона валовый фотосинтез, измеренный в середине дня, составлял 10–50 мкг О2/см2 поверхности коралла в час, достигая иногда 100 мкг О2/см2 в час. В наших экспериментах на ветвистых кораллах S. pistillata, Pocillopora verrucosa и P. damicornis было показано, что кораллы, обитавшие в световом диапазоне от 90–80 до 30–20% ФАРп, имели близкий уровень валового фотосинтеза в середине солнечного дня – в пределах 90–150 мг С/м2 в час. Это свидетельствует об эффективной онтогенетической адаптации кораллов к свету, падающему в месте обитания, обеспечивающей стабильный уровень первичной продукции кораллов в широком световом диапазоне (Titlyanov, 1991b). Скорость и направленность фотосинтеза зооксантелл может регулироваться так называемым “хост-фактором” – комплексом веществ, синтезируемых клетками хозяина (Muscatine, 1967), что подтверждено и нашими исследованиями (Malkin et al., 1996).
Адаптация рифостроящих кораллов к свету
Рациональные формы колоний, эффективно поглощающих свет различной интенсивности, и разнообразие способов питания позволяют рифостроящим кораллам обитать в пределах почти всей фотической зоны шельфа при освещенности от 100 до ≥0.3% ФАРп. Анализ распределения 64 видов рифостроящих кораллов на коралловых рифах островов Антхой, Тхотю и Кондао в Южно-Китайском море показал, что все найденные виды обитали в диапазоне освещенности от 30 до 3% ФАРп, 50% видов – от 95 до 10% ФАРп и только несколько видов кораллов из рода Porites были найдены в гротах при освещенности около 0.3% ФАРп (Титлянов и др., 1988а; Titlyanov, Latypov, 1991).
Широкий световой диапазон распространения рифостроящих кораллов и их эффективная адаптация к свету во многом обусловлены симбиотическими взаимоотношениями растительной и животной компонент в коралловых полипах. Способность кораллов адаптироваться к количеству и качеству света заложена в геномах животных и растительных клеток; она проявляется на всех этапах онтогенетического развития организма. В симбиотическом организме рифостроящего коралла и симбионт, и хозяин участвуют в адаптационном процессе. В онтогенетической адаптации кораллов к свету проявляются мутуалистические взаимоотношения животных и растительных клеток. Фотоадаптивные реакции – это изменения в структуре и функциях организма, происходящие под влиянием света и направленные на жизнеобеспечение организма в данных условиях обитания. В природе адаптация кораллов к свету в процессе онтогенеза возможна при закреплении планул кораллов на грунте и при их развитии в колонию коралловых полипов (Titlyanov et al., 1998), при самозатенении в процессе роста и формирования колоний ветвистых кораллов (Titlyanov, 1991a), при затенении другими колониями или талломами макрофитов (Титлянов и др., 1988а; Titlyanov, Latypov, 1991), во время сезонных изменений освещенности, а также после сильных штормов, способных разрушить или оторвать колонии кораллов от грунта и переместить их или фрагменты кораллов в другое место.
При описании онтогенетической адаптации рифостроящих кораллов к свету мы рассматриваем ее пути, механизмы и реакции. Путь, или направление адаптации характеризует весь комплекс механизмов и реакций адаптации, наблюдающихся в определенном диапазоне освещенности. На основании анализа распределения отдельных видов кораллов на шельфе в зависимости от освещенности нами были выделены три направления адаптации кораллов к количеству света: 1) к умеренному затенению (50–10% ФАРп), 2) к крайне слабому свету (≤5% ФАРп) и 3) к яркому свету (≥70% ФАРп).
Адаптация к умеренному затенению (50–10% ФАРп)
Максимизация поглощения ФАР и рациональная утилизация поглощенной ФАР являются двумя доказанными и наиболее изученными механизмами фотоакклимации кораллов к умеренному затенению. В механизме максимизации поглощения ФАР участвует большое количество адаптивных реакций, происходящих на морфологическом, анатомическом, ультраструктурном и молекулярном уровнях, которые способствуют максимальному (часто полному) поглощению солнечной радиации, достигающей колонии коралла. Было показано, что общим морфологическим признаком глубоководных и затененных колоний кораллов является их уплощенная форма, наиболее эффективная при поглощении слабого света (Barnes, Taylor, 1973; Graus, Macintyre, 1976, 1982; Dustan, 1979).
В наших исследованиях масса колоний ветвистых кораллов P. verrucosa и S. pistillata, обитавших в затененных местах, была меньше, чем хорошо освещенных (Титлянов, 1987). Влияние недостатка света на морфологию колоний проявлялось также в увеличении отношения максимального диаметра колонии к ее высоте, в меньшем количестве ветвей последующих порядков на ветвях предыдущих порядков и в уплощенной форме ветвей.
Одна из адаптивных реакций животного-полипа, максимизирующая поглощение падающего света зооксантеллами, − формирование на щупальцах у некоторых видов кораллов специальных светопринимающих органов (тонкостенных пузырей), содержащих зооксантеллы, которые полип способен “распускать” или “сжимать” в зависимости от освещенности (Vareschi, Friske, 1986).
Наиболее общей адаптивной реакцией рифостроящих кораллов и других бентосных животных, содержащих зооксантеллы, направленной на максимизацию поглощения света, является увеличение плотности популяции симбионтов в тканях хозяина. Показано, что в наружных ветвях кораллов, обитающих в затенении или на средних глубинах при освещенности 60–30% ФАРп, плотность зооксантелл больше, чем у кораллов с освещенного мелководья (100–80% ФАРп) (Звалинский и др., 1978; Титлянов и др., 1978; Titlyanov et al., 1980; Титлянов и др., 1983; Титлянов и др., 1988a, 1988б; Титлянов и др., 1990; Titlyanov, 1991a; Leletkin et al., 1999; Titlyanov et al., 1999, 2001a, 2001b). Плотность популяции зооксантелл у колоний кораллов с освещенного мелководья и из затененных мест или с большой глубины может различаться более чем в два раза. В экспериментах накопление зооксантелл в клетках эндодермы коралловых фрагментов проявлялось уже на следующие сутки после пересадки фрагментов колоний с яркого на умеренный свет и продолжалось в течение 30–40 сут (Titlyanov et al., 2001c).
Плотность популяции зооксантелл в ткани кораллового полипа зависит преимущественно от интенсивности процессов деления и деградации зооксантелл. Если скорость деления зооксантелл выше скорости их деградации, плотность популяции симбионтов увеличивается. Подсчитано, что при постоянной плотности популяции зооксантелл в ткани полипа доля вновь образованных клеток в течение 1 сут составляет 2–4% от их общего количества, что почти совпадает с количеством деградирующих клеток (Titlyanov et al., 1996; Титлянов и др., 2006).
Выдерживание фрагментов коралла S. pistillata в морской воде, обогащенной питательными веществами, содержавшими азот и фосфор, а также кормление полипов зоопланктоном стимулировало процесс накопления зооксантелл в ткани коралла на слабом свету (Titlyanov et al., 2000a, 2001d), а голодание тормозило этот процесс (Titlyanov et al., 2000b, 2001d). Мы предполагаем, что полип путем дозированного снабжения симбионтов соединениями азота и фосфора, необходимыми в процессе деления и роста симбиотических клеток (Titlyanov et al., 2000a), а также изменением уровней деления и деградации зооксантелл может регулировать плотность их популяции. Не исключено также и стимулирующее действие на процесс деления клеток симбионтов “хост фактора” (Muscatine, 1967).
Одной из наиболее эффективных реакций максимизации поглощения света зооксантеллами является увеличение в хлоропластах содержания всех фотосинтетических пигментов без существенных сдвигов в их соотношении, что позволяет предположить, что в данном процессе происходит построение тилакоидных мембран de novo. Содержание фотосинтетических пигментов у зооксантелл, выделенных из колоний с большой глубины, из затенения и с открытого мелководья, может различаться в расчете на клетку более чем в 2–2.5 раза (Titlyanov et al., 1980, 1999, 2001a, 2001b, 2001c; Титлянов и др., 1981). При накоплении пигментов у зооксантелл увеличиваются концентрация тилакоидных мембран в хлоропластах (Машанский и др., 1979) и размеры фотосинтетических единиц (ФСЕ) (Звалинский, 1988).
Эксперименты, проведенные на фрагментах колоний S. pistillata при перенесении их с яркого (95% ФАРп) света на умеренный (30% ФАРп), показали, что накопление пигментов начинается сразу после снижения уровня освещенности и прекращается на 4–5-е сутки эксперимента. Прямого влияния животного-хозяина на скорость или характер накопления фотосинтетических пигментов в симбионтах нами не отмечено.
Эффективная утилизация поглощенной ФАР (уменьшение энергетических потерь при превращении энергии квантов в энергию химических связей), как и максимизация поглощения ФАР, является механизмом адаптации кораллов к пониженной интенсивности света. Было показано (Лелеткин и др., 1980), что при снижении освещенности в месте обитания квантовая эффективность фотосинтеза зооксантелл на линейном участке световой кривой повышается более чем в 2 раза. Предполагают, что увеличение квантового выхода фотосинтеза обеспечивают следующие реакции: увеличение доли высоко агрегированных длинноволновых форм хлорофиллов и перидинина по сравнению с таковой коротковолновых формам, а также относительно большее накопление пигментов-светосборщиков (хлорофиллов и перидинина), чем пигментов-протекторов (диноксантина, диадиноксантина, β-каротина) (Звалинский и др., 1978; Titlyanov et al., 1980).
На этапе превращения первичных продуктов фотосинтеза в вещества, расходуемые на рост и развитие организмов, мы предполагаем, по крайней мере, две реакции адаптации к пониженной интенсивности света. Первая – это увеличение включения во вторичные синтезы и процесс катаболизма промежуточных продуктов фотосинтеза без их предварительного восстановления и полимеризации до запасных углеводов и жиров (Биль и др., 1991; Bil et al., 1992; Titlyanov et al., 2000a), вторая – снижение энергетических затрат на дыхание (Титлянов и др., 1988б; Leletkin et al., 1996).
Адаптация кораллов к крайне низкой интенсивности света (≤5% ФАРп)
Большинство видов рифостроящих кораллов способны обитать при крайне низкой освещенности – приблизительно до 0.3% ФАРп (Титлянов и др., 1988a; Titlyanov, Latypov, 1991). При снижении интенсивности света в месте обитания кораллов, например, с 30% ФАРп до 1% ФАРп уже не действуют такие реакции адаптации к низкой интенсивности света, как накопление пигментов в зооксантеллах или накопление зооксантелл в тканях коралловых полипов, которые функционировали в зоне светового комфорта (80–20% ФАРп). При экстремально низкой интенсивности света выгода от этих адаптивных изменений минимальна, а расходы энергии и вещества значительны. Основные реакции адаптации кораллов к крайне слабому свету − это сокращение расходов энергии на рост и жизнеобеспечение кораллов, а также снижение плотности популяции симбионтов (Titlyanov et al., 2002).
В природе масса колоний кораллов P. damicornis и P. verrucosa, обитающих при освещенности около 5% ФАРп, в 1.5–2.5 раза меньше, массы колоний, обитающих в зоне светового комфорта. Отношение площади поверхности колонии к ее массе у колоний, обитающих в условиях крайне низкой освещенности больше, чем у колоний из зоны комфорта. Отмеченные изменения в морфологии колоний способствуют максимизации поглощения света (Титлянов и др., 1988в; Titlyanov et al., 2001a, 2001b).
Скорость темнового дыхания кораллов S. pistillata, P. damicornis и P. verrucosa, адаптированных к освещенности 10–7% ФАРп, в среднем была в 2–3 раза ниже, чем адаптированных к освещенности 60% ФАРп (Titlyanov, 1981, 1991b; Титлянов и др., 1988в).
Плотность популяции зооксантелл в кораллах, перенесенных с освещенности 30% ФАРп в освещенность 5–0.1% ФАРп, постепенно уменьшалась у всех исследованных кораллов. Например, у S. pistillata с 40 × 103 клеток на полип (при 30% ФАРп) она снизилась до 0.5 × 103 клеток на полип (при 0.8% ФАРп). Снижение плотности зооксантелл в теле полипа обусловлено снижением уровня деления симбиотических клеток и повышением скорости их деградации (Titlyanov et al., 2002).
В зоне экстремально низких показателей освещенности у полипов удваивалась активность хищничества, причем увеличивалась скорость обеих компонент – убийства и поедания жертвы. Стимуляция хищничества у кораллов проявлялась при освещенности ниже 30% ФАРп (Titlyanov et al., 2000b).
Рифостроящие кораллы выживают при экстремально низкой освещенности (≤0.1% ФАРп) в течение 90–120 сут и в полной темноте в течение 30–40 сут за счет хищничества и переваривания собственных зооксантелл. На 2-е сут пребывания в полной темноте резко снижается скорость деления зооксантелл и повышается скорость их переваривания. На 10-е сут темноты переваривается уже более 20% зооксантелл в сутки. На 30–40-е сут пребывания кораллов в темноте их ткани отмирают и отделяются от скелета. В отмирающей ткани полипов присутствуют зооксантеллы увеличенного размера, содержащие фотосинтетические пигменты, способные к делению и не имеющие признаков деградации. Если полип, длительное время находившийся при экстремально низкой освещенности или в полной темноте и содержащий несколько сотен или даже десятков зооксантелл, выставить на свет, то через 2–3 мес полностью восстановится плотность популяции симбионтов, соответствующая новой освещенности в месте обитания.
Адаптация кораллов к яркому свету (≥70% ФАРп)
В процессе адаптации кораллов к яркому свету участвуют, по крайней мере, два механизма: оптимизация поглощения ФАР и комплекс светозащитных реакций. Морфология колоний P. damicornis и P. verrucosa, обитающих на ярком свету, способствует его максимальному поглощению всей поверхностью колоний. Масса и площадь поверхности колоний кораллов, обитающих на ярком свету (при 90% ФАРп), могут быть в 2 раза больше, чем колоний, обитавших на умеренном свету (30% ФАРп), как и количество ветвей последующих порядков на ветвях предыдущих порядков (Титлянов и др., 1988в). У некоторых видов ветвистых кораллов, обитавших на ярком свету, ветви последних порядков на поперечном срезе имели форму эллипса и были повернуты узкой стороной к падающему свету, что также максимизировало поглощение света колонией (Титлянов, 1987).
Симбионты неравномерно распределены по колонии коралла. Плотность популяции зооксантелл в колонии коралловых полипов зависит как от внешних, так и от внутренних факторов. Среди первых наибольшее значение имеет световой фактор, среди вторых – возраст полипов (Titlyanov, 1991a). Так, наибольшая плотность популяции зооксантелл в колонии ветвистого склерактиниевого коралла P. verrucosa, обитающего на глубине 1 м (90% ФАРп), отмечена в молодых ветвях третьего порядка. В то же время в колонии, взятой с этой же глубины, но из затененного места, плотность зооксантелл была наибольшей в ветвях первого порядка, а наименьшей − в ветвях второго порядка. Следует отметить, что в растущих верхних частях молодых ветвей коралла плотность популяции симбиотических клеток при любом режиме освещения была наименьшей (Titlyanov, 1991a).
В экспериментах снижение численности зооксантелл в кораллах на ярком свету происходило за счет уменьшения скорости деления зооксантелл и стимулирования их переваривания полипом. При переносе кораллов на яркий свет содержание хлорофиллов в расчете на единицу объема клетки симбионта снижалось в 1.5 раза в течение четырех суток (Титлянов и др., 1988в, 2002). В процессе адаптации коралла к яркому свету популяция зооксантелл обогащалась мелкими клетками светоустойчивого типа “G”, имеющими наименьшее количество хлорофилла, но наибольшую продуктивность (Titlyanov et al., 2001b; Титлянов и др., 2002).
Поглощение света фотосинтетическими пигментами регулируется также светозащитными реакциями организма кораллов. При свете высокой интенсивности в зооксантеллах увеличивается относительное содержание светозащитных пигментов: β-каротина, лютеина и некоторых других каротиноидов, которые способны принять электрон от возбужденного хлорофилла в триплетном состоянии, а также от активного кислорода в синглетном состоянии, защитив таким образом цепь передачи от избытка “возбужденных” электронов (Звалинский, 1988). Роль низкомолекулярных антиоксидантов в тканях полипа играют не только каротиноиды хлоропластов, но и некоторые из микоспорин-подобных аминокислот (Yakovleva, Hidaka, 2004; Yakovleva et al., 2004), а также высокомолекулярные антиоксиданты − ферменты супероксиддисмутаза, каталаза и аскорбат-глютатионпероксидаза (Yakovleva, Titlyanov, 2001; Yakovleva et al., 2009).
Таким образом, разнообразие существенных перестроек в структуре и функциях обеих компонент рифостроящих кораллов, находящихся в симбиотических взаимоотношениях под действием света как крайне низкой, так и высокой интенсивности, позволяет абсолютному большинству видов обитать в широком световом диапазоне и иметь стабильный уровень продукции.
ГЕТЕРОТРОФНОЕ ПИТАНИЕ КОРАЛЛОВ
Хищничество
За счет хищничества коралловые полипы получают в среднем от 10 до 40% пищи (Сорокин, 1990). Способы охоты кораллов многообразны: ловля и захват жертв щупальцами, поражение нематоцистами и последующий транспорт обездвиженных жертв ко рту с помощью слизевых тяжей, ловля подвижных жертв слизевыми сетями и др. Большинство кораллов наиболее активно питаются в ночное время и в ранние утренние часы (Сорокин, 1990; Titlyanov et al., 2000b). Наши эксперименты с кораллом S. pistillata, который охотился за науплиями артемии (Artemia salina), показали, что интенсивность добычи и переваривания науплиев зависит от количества света в месте обитания. Скорость убийства и переваривания науплиев была наибольшей на слабом свету (5–10% ФАРп) и составляла соответственно 2 и 1.5 науплия на один полип в 1 час, а наименьшей − на самом ярком свету (90% ФАРп), соответственно 1.5 и 0.7 науплия. При снижении интенсивности света в месте обитания увеличивалось отношение скорости переваривания жертвы к скорости ее добычи. Таким образом, снижение интенсивности света в месте обитания коралла стимулировало хищничество, особенно скорость переваривания пищи; кораллы, обитавшие в сильно затененных местах, активно охотились и ночью, и днем. На активность охоты и утилизацию добычи влияют и другие (кроме света) условия содержания кораллов. Так, при предварительном содержании фрагментов ветвей кораллов в условиях усиленного минерального питания соединениями азота и фосфора или животного питания на слабом свету их хищническая активность увеличивалась в 1.2–2.8 раза (Titlyanov et al., 2000a, 2000b).
Поглощение растворенных органических веществ животными клетками коралла
Источником пищи для кораллов, как и для других водных животных и растительных организмов, является органотрофия, т.е. поглощение и усвоение растворенных органических веществ из окружающей среды. Известно, что кораллы поглощают такие низкомолекулярные соединения, как сахара (глюкозу и рибозу), аминокислоты (глицин, аланин и глютаминовую кислоту), органические кислоты (яблочную и фумаровую) (Goreau et al., 1971; Титлянов и др., 1988в). Показано, что за счет поглощенных РОВ кораллы могут компенсировать около 10% своих суммарных энергетических потребностей (Сорокин, 1990).
В наших экспериментах была определена радиоактивность фрагментов колоний коралла P. damicornis после выдерживания их на свету или в темноте в течение 30 мин в растворах низкомолекулярных соединений, меченных радиоактивным углеродом (Титлянов и др., 1988в). Установлено, что относительная радиоактивность образцов, выдержанных в растворах радиоактивных веществ, была следующей: с аланином – 100% (15 тыс. импульсов в 1 мин/см2 высушенного образца), с яблочной кислотой – 43%, с фумаровой кислотой – 36%, с глутаминовой кислотой – 20%, с глюкозой – 16% и с рибозой – 13%. Все испытанные соединения на свету поглощались на 20–30% лучше, чем в темноте. В экспериментах по изучению распределения гетеротрофного и фотогетеротрофного (на свету) поглощения РОВ различными частями колоний кораллов использовали аланин как вещество, наиболее ассимилируемое кораллом. Оказалось, что наибольшей способностью поглощать аланин и на свету, и в темноте обладали внешние наиболее молодые ветви кораллов, содержавшиеся при умеренном затенении (10–30% ФАРп).
Поглощение из воды взвешенных частиц животного происхождения
Все склерактиниевые кораллы способны к фильтрационно-седиментационному питанию (Сорокин, 1979, 1990). Отфильтровывая из воды бактерии, фитопланктон, останки животных и растений, а также детрит и неорганические соединения, полипы утилизируют только бактерии и остатки животного происхождения (McCloskey, Chester, 1971). Принято считать, что остатки растительного происхождения кораллы не переваривают (Yonge, 1930a, 1930b, 1973).
В экспериментах по питанию мы кормили коралловые полипы S. pistillata коловраткой Branchionus plicatilis, которая перед экспериментом питалась зеленой водорослью хлореллой. Было отмечено, что полипы переваривали коловратку и не переваривали хлореллу, находящуюся в ней (Titlyanov et al., 2000b, 2001d). По расчетам Сорокина (1979), питание бактериопланктоном, составляющим основную часть пищевых частиц, обеспечивает не более 10% суммарных энергетических потребностей коралловых полипов, однако эта величина во многом видоспецифична.
Внутриклеточное переваривание водорослей-симбионтов
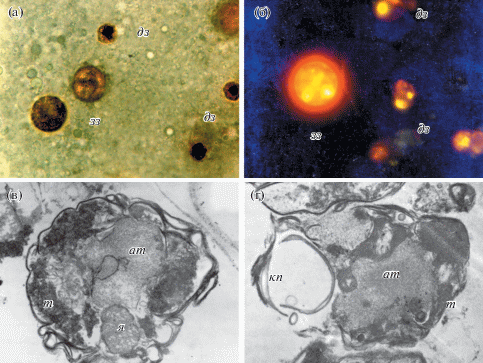
Клетки зооксантелл кораллов Porites cylindrica, S. caliendrum и S. pistillata на разных стадиях деградации встречались во всех органах полипа. На первой стадии деградации в клетках появлялись мелкие вакуоли, и цвет клеток изменялся с оливкового на коричневый. В дальнейшем клеточные стенки водорослей частично разрушались, хлоропласт сжимался, на поверхности клетки появлялись светлые капли. На последней стадии деградации зооксантеллы светлели, приобретали оранжевый цвет и теряли сферическую форму, превращаясь в бесформенные комочки. На электронных фотографиях деградированных зооксантелл можно видеть “аккумулятивное тело”, беспорядочно лежащие тилакоиды хлоропластов, глобулы крахмала и остатки крахмального покрытия пиреноидов. Ядро, пиреноид и липидные капли в остатках зооксантелл отсутствуют (рис. 4). Кроме этого, в полупереваренных клетках не найдено хлорофилла c, а количество хлорофилла а сократилось в два раза. Деградация зооксантелл происходит, как правило, в ночное время с максимальной интенсивностью между 0 и 3-мя часами. Вероятно, за внутриклеточное переваривание зооксантелл отвечают лизосомы (Colley, Trench, 1985). Полип в первую очередь переваривает вещества, богатые азотом и фосфором, это ДНК ядра и белок пиреноидов. Полисахариды зооксантелл остаются нетронутыми и выбрасываются полипом через глотку вместе с остатками мембран тилакоидов, аккумулятивным телом и другими непереваренными остатками в виде отдельных частиц или агрегатов разной величины (от сотен до нескольких тысяч деградированных клеток) (Titlyanov et al., 1996).
Рис. 4.
Здоровые и деградированные зооксантеллы коралла Stylophora pistillata. а – зооксантеллы под микроскопом в видимом свете; б – зооксантеллы под микроскопом в ультрафиолетовом свете; в – деградирующая клетка зооксантеллы; г – остаток от зооксантеллы. Условные обозначения: зз − здоровые зооксантеллы, дз − деградирующие зооксантеллы, т − тилакоиды, кп − крахмал пиреноида.
Обнаружены и описаны три типа ритмических изменений деградации зооксантелл. Первый тип изменений, отмеченный у S. caliendrum и у гидрокоралла M. intricata, представлял собой суточные колебания интенсивности процесса с максимумом в ночное время. Второй тип ритмических изменений имел период в 3 сут, а третий – в 5–6 сут. Наивысшая плотность деградированных зооксантелл была определена около 24:00 ч в покрывающей ткани и около 03:00 ч – в щупальцах и мезентерии. Доля зооксантелл, переваренных за сутки, варьировала от 1.1 до 7.6% от их общего количества. Процесс стимулировался гетеротрофным голоданием и сменой светового режима с умеренного затенения на яркий свет или на экстремально низкую освещенность (Titlyanov et al., 1996).
ГОЛОДАНИЕ КОРАЛЛОВ
Гетеротрофное голодание
Влияние усиленного питания и голодания на продукционную функцию зооксантелл было изучено на фрагментах колоний коралла S. pistillata при адаптации к сильному (90% ФАРп), умеренному (20%) и слабому (3%) свету, а также при выживании фрагментов кораллов в полной темноте. В аквариальных экспериментах коралловые полипы подкармливали коловраткой Branchionus plicatilis (см.: Titlyanov et al., 2001b, 2001d) и науплиями Artemia salina (см.: Titlyanov et al., 2000a). Усиленное питание коловратками и науплиями стимулировало все описанные нами ранее реакции адаптации к свету, но не помогло полипам выжить в полной темноте.
При отсутствии хищничества (выдерживание в отфильтрованной воде) полипы не смогли адаптироваться к новому световому режиму. Во всех вариантах опытов в полипах S. pistillata уменьшалась плотность популяции зооксантелл, при этом снижался уровень пролиферации и повышался уровень деградации зооксантелл. Скорость валового фотосинтеза клеток в расчете на один полип падала, а в расчете на одну зооксантеллу почти не изменялась; количество хлорофиллов в расчете на объем клетки симбионта также не изменялось. Скорость темнового дыхания при обоих способах расчета изменялась незначительно.
ОСМОТИЧЕСКИЙ ШОК
Как показано выше, склерактиниевые кораллы выбрасывали не только остатки переваренных зооксантелл, но и живые клетки. В экспериментах с фрагментами колоний коралла S. pistillata, выдержанных в аквариумах с добавками животной пищи и при гетеротрофном голодании (фильтрованная морская вода), была рассчитана скорость выброса живых зооксантелл, которая на 15-е сут выдерживания в обоих вариантах опыта составляла 5–7 экз./сут на один полип. В то же время скорость выброса полупереваренных клеток у полипов в варианте с пищевой подкормкой составляла около 3 × 103 кл./сут на один полип, а в варианте с гетеротрофным голоданием − 15 × 103 кл./сут.
На 18-е сут эксперимента с голодающими полипами фрагменты коралла были подвержены осмотическому шоку − опреснению воды в аквариумах с 34 до 17 PSU. Через 12 ч выдерживания кораллов в этих условиях каждый полип потерял в среднем 3–4 тыс. живых клеток зооксантелл. За это время кораллы выбросили приблизительно столько же полупереваренных клеток. Через 3 сут после шока у коралловых полипов уровень выброса как деградированных, так и здоровых зооксантелл восстановился. Таким образом, было показано, что массовый выброс живых зооксантелл из тканей коралла происходит только в стрессовых ситуациях и не является механизмом регуляции плотности симбионтов в ткани полипа.
ЗАКЛЮЧЕНИЕ
В настоящем обзоре обсуждаются результаты экспериментальных полевых и лабораторных работ авторов и их коллег по экологии, физиологии, биофизике и биохимии рифостроящих кораллов, объединенные идеей поиска и изучения связей между животным (коралловым полипом) и его внутриклеточными симбионтами (водорослями динофлагеллятами). Показаны тесные мутуалистические связи между коралловыми полипами и их симбионтами микроводорослями-зооксантеллами в едином организме – колонии коралловых полипов. Жизненной стратегией микроводорослей-зооксантелл является автотрофное существование в клетках ткани животного в виде цист за счет использования в процессе фотосинтеза углекислоты, выделяемой хозяином при дыхании, и его богатых биогенными элементами метаболитов. Максимальной и эффективной работе фотосинтетического аппарата зооксантелл способствуют использование животным продуктов фотосинтеза, а также регулирование им количества и качества поступающей пищи.
На основе полученных результатов и литературных данных предполагаются следующие основные механизмы, регулирующие фотосинтетическую функцию зооксантелл и поступление продуктов фотосинтеза в клетки животного. (1) Регулирование плотности популяции зооксантелл путем изменения скорости их деления и деградации в процессе адаптации кораллов к определенному количеству света; стимулирование деления зооксантелл подачей биогенных элементов (N и P) и воздействием “хост фактора”; повышение или снижение интенсивности деградации (переваривания) зооксантелл. (2) Регулирование количества поглощенного колонией света путем изменения морфологии скелета в процессе адаптации к свету в месте обитания, а также мягких тканей коралла в зависимости от действующего света. (3) Стимулирование или ингибирование продукционной функции зооксантелл “хост фактором”. (4) Изменение способности животной клетки использовать продукты фотосинтеза зооксантелл через увеличение или уменьшение гетеротрофного питания, в том числе переваривания собственных зооксантелл.
Доступность продуктов автотрофного и гетеротрофного питания кораллов позволяет им обитать почти во всем световом диапазоне фотической зоны шельфа, длительное время выживать в условиях автотрофного или гетеротрофного голодания, переживать стрессовые ситуации, а также полностью восстанавливаться после негативных воздействий.
Список литературы
Биль К.Я., Колмаков П.В., Пярник Т.Р. и др. Продукты фотосинтеза зооксантелл симбиотических кораллов Stylophora pistillata и Seriatopora coliendrum, обитающих на разных глубинах // Физиол. раст. 1991. Т. 38. № 5. С. 846−854.
Звалинский В.И. Световая зависимость фотосинтеза зооксантелл в непрерывном и импульсном свете // Биология коралловых рифов. Фотосинтез зооксантелл и водорослей макрофитов. Владивосток: ДВО АН СССР. 1988. С. 100−111.
Звалинский В.И., Титлянов Э.А., Лелеткин В.А., Новожилов А.В. Адаптация кораллов к свету // Биология коралловых рифов. Фотосинтез зооксантелл и водорослей макрофитов. Владивосток: ДВО АН СССР. 1978. С. 29−52.
Лелеткин В.А., Звалинский В.И., Титлянов Э.А. Фотосинтез зооксантелл кораллов разных глубин // Физиол. раст. 1980. Т. 27. № 6. С. 1163−1171.
Литтлер М.М., Литтлер Д.С., Титлянов Э.А. Основные автотрофные продуценты органического вещества на тропических рифах и условия доминирования некоторых из них // Биол. моря. 1991. № 6. С. 3−14.
Машанский В.Ф., Ли С.Е., Титлянов Э.А., Преображенский В.Б. Морфофункциональные корреляции ультраструктуры кальциферных клеток кораллов в зависимости от освещенности // Биол. моря. 1979. № 4. С. 80−82.
Сорокин Ю.И. Экспериментальное исследование гетеротрофного питания массовых видов кораллов-строителей // ДАН СССР. 1979. Т. 249. С. 509−512.
Сорокин Ю.И. Экосистемы коралловых рифов. М.: Наука. 1990. 503 с.
Титлянов Э.А. Морфологические различия колоний рифообразующих ветвистых кораллов, обитающих в различных световых режимах // Биол. моря. 1987. № 1. С. 32−36.
Титлянов Э.А. Зооксантеллы в герматипных кораллах: жизненная стратегия. Владивосток: Дальнаука. 1999. 63 с.
Титлянов Э.А., Звалинский В.И., Лелеткин В.А. Некоторые механизмы адаптации зооксантелл кораллов к свету // Докл. Акад. Наук СССР. 1978. Т. 238. № 5. С. 1231−1234.
Титлянов Э.А., Звалинский В.И., Лелеткин В.А., Шапошникова М.Г. Фотосинтез зооксантелл рифостроящих кораллов в разных условиях освещения // Биология коралловых рифов. Исследования на банке Фантом (Тиморское море). Владивосток. 1983. С. 51−74.
Титлянов Э.А., Звалинский В.И., Шапошникова М.Г., Лелеткин В.А. Некоторые механизмы адаптации рифообразующих кораллов Австралии к интенсивности света // Биол. моря. 1981. № 2. С. 22−31.
Титлянов Э.А., Колмаков П.В., Хиеу Л.Н. Структура и продукционная функция колоний кораллов рода Pocillopora в пределах светового диапазона их обитания // Биология коралловых рифов. Владивосток: ДВО АН СССР. 1988в. С. 52−71.
Титлянов Э.А., Латыпов Ю.Я., Ермак В.Д. Влияние света на распределение склерактиний в сублиторали островов Антхой, Тхотю (Сиамский залив) и Кондао (Южно-Китайское море) // Биология коралловых рифов. Владивосток: ДВО АН СССР. 1988б. С. 5−18.
Титлянов Э.А., Магомедов И.М., Колмаков П.В., Буторин П.В. Адаптация к свету, первичная продукция ее использование у массовых видов рифостроящих кораллов Индо-Пацифики // Биология коралловых рифов. Владивосток: ДВО АН СССР. 1988а. С. 19–45.
Титлянов Э.А., Лелеткин В.А., Ермак В.Д., Воскобойников Г.М. Адаптация массовых видов рифостроящих кораллов к разной освещенности // Биол. моря. 1990. № 1. С. 30−37.
Титлянов Э.А., Титлянова Т.В. Рифостроящие кораллы − симбиотические автотрофные организмы. 1. Общие черты строения, способы питания, светозависимое распределение на шельфе // Биол. моря. 2002а. Т. 28. № 4. С. 239−253.
Титлянов Э.А., Титлянова Т.В. Рифостроящие кораллы − симбиотические автотрофные организмы. 2. Пути и механизмы адаптации к свету // Биол. моря. 2002б. Т. 28. № 5. С. 319−333.
Титлянов Э.А., Титлянова Т.В., ван Воесик Р., Ямазато К. Адаптация герматипного коралла Stylophora pistillata к яркому свету // Биол. моря. 2002. Т. 28. № 6. С. 436–441.
Титлянов Э.А., Титлянова Т.В., Яковлева И.М., Калита Т.Л. Ритмические изменения в процессах деления и деградации симбиотических водорослей герматипных кораллов // Биол. моря. 2006. Т. 32. № 1. С. 17−25.
Barnes D.J., Taylor D.L. In situ studies of calcification and photosynthetic carbon fixation in the coral Montastrea annularis // Helgol. Wiss. Meeresunters. 1973. V. 24. P. 284−291.
Bil’ K.Y., Kolmakov P.V., Muscatine L. Chapter 13: Photosynthetic products of zooxanthellae of the reef-building corals Stylophora pistillata and Seriatopora caliendrum from different depths of the Seychelles Islands // Atoll Res. Bull. 1992. № 377. P. 1−8.
Blanquet R.S., Nevenzel J.C., Benson A.A. Acetate incorporation into the lipids of the anemone Anthopleura elegantissima and its associated zooxanthellae // Mar. Biol. 1979. V. 54. № 2. P. 185−194.
Colley N.J., Trench R.K. Cellular events in the reestablishment of a symbiosis between a marine dinoflagellate and coelenterate // Cell Tissue Res. 1985. V. 239. P. 93−103.
Crossland C.J., Hatcher B.G., Smith S.V. Role of coral reefs in global ocean production // Coral Reefs. 1991. V. 10. P. 55−64.
Dustan P. Distribution of zooxanthellae and photosynthetic chloroplast pigments of the reef-building coral Montastrea annularis Ellis and Solanders in relation to depth on a West Indian coral reef // Bull. Mar. Sci. 1979. V. 29. № 1. P. 79–85.
Eden N., Fomina I., Bil K. et al. Photosynthetic capacity and composition of 14C fixation products in symbiotic zooxanthellae of Stylophora pistillata in vivo under different light and nutrient conditions // Proc. VI Int. Conf. “Preservation of Our World in the Wake of Change” / Ed. Y. Steinberger. Jerusalem, Israel: Israel Soc. Ecol. Environ. Qual. Sci. 1996. V. 6A/B. P. 462–463.
Fong P., Paul V.J. Coral reef algae // Coral Reefs: An Ecosystem in Transition / Eds. Z. Dubinsky, N. Stambler. Dordrecht, the Netherlands: Springer-Verlag. 2011. P. 241−272.
Goreau T.F., Goreau N.I., Yonge C.M. Reef corals: autotrophs or heterotrophs? // Biol. Bull. 1971. V. 141. № 2. P. 247–260.
Graus R.R., Macintyre I.G. Light control of growth form in colonial reef corals: computer simulation // Science. 1976. V. 193. № 4256. P. 895–897.
Graus R.R., Macintyre I.G. Variation in growth forms of the reef coral Montastrea annularis (Ellis and Solander): A quantitative evaluation of growth response to light distribution using computer simulation // The Atlantic Barrier Reef Ecosystem at Carrie Bow Cay, Belize. I. Structure and Communities / Eds. K. Rützler, I.G. Macintyre. Smithsonian Contribution to Marine Sciences. Washington, DC: Smithsonian Inst. 1982. V. 12. P. 441–464.
Harrison P.L. Sexual reproduction of scleractinian corals // Coral Reefs: An Ecosystem in Transition / Eds. Z. Dubinsky, N. Stambler. Dordrecht, the Netherlands: Springer-Verlag. 2011. P. 59–87.
Leletkin V.A., Titlyanov E.A., Dubinsky Z. Photosynthesis and respiration of the zooxanthellae in hermatypic corals habitated on different depths of the Gulf of Eilat // Photosynthetica. 1996. V. 32. № 4. P. 481–490.
Leletkin V.A., Titlyanov E.A., Yamazato Y., Kamosawa M. Morpho-functional characteristics of some common branching corals from light an shade habitats on Sesoko Island (Okinawa, Japan) // Asian Mar. Biol. 1999. V. 16. P. 13–22.
Loh W., Hidaka M., Hirose M., Titlyanov E.A. Genotypic diversity of symbiotic dinoflagellates associated with hermatypic corals from a fringing reef at Sesoko Island, Okinawa // Galaxea. 2002. V. 2002. № 4. P. 1−9.
Lüning K. Seaweeds: Their Environment, Biogeography and Ecophysiology; Hoboken, NJ: Wiley. 1990. 527 p.
Malkin A., Dubinsky Z., Titlyanov E. et al. Composition and translocation of symbiotic algae photosynthates at different nutritions in presence of host factor // Proc. VI Int. Conf. “Preservation of Our World in the Wake of Change” / Ed. Y. Steinberger. Jerusalem, Israel: Israel Soc. Ecol. Environ. Qual. Sci. 1996. V. 6A/B. P. 459–461.
McCloskey L.R., Chester R.H. Effects of man-made pollution on the dynamics of coral reefs // Tektite 2: Scientists in the Sea / Eds. J.W. Miller, J.G. van Derwalker, R.A Waller. Washington, DC: U. S. Dep. of the Interior. 1971. Pt. 4. P. 229−238.
Muscatine L. Glycerol excretion by symbiotic algae from corals and Tridacna and its control by the host // Science. 1967. V. 156. P. 516–519.
Muscatine L. The role of symbiotic algae in carbon and energy flux in reef corals // Ecosystems of the World: Coral reefs / Ed. Z. Dubinsky. Amsterdam, the Netherlands: Elsevier. 1990. P. 75–87.
Muscatine L., Cernichiari E. Assimilation of photosynthetic products of zooxanthellae by a reef coral // Biol. Bull. 1969. V. 137. № 3. P. 506–523.
Muscatine L., Falkowski P.G., Dubinsky Z. Carbon budgets in symbiotic associations // Endocytobiology II: Intracellular Space as Oligogenetic Ecosystem / Eds. W. Schwemmler, H.E.A. Schenk. Berlin: W. de Gruyter. 1983. V. 2. P. 649–658.
Patton J.S., Abraham S., Benson A.A. Lipogenesis in the intact coral Pocillopora capitata and its isolated zooxanthellae: evidence for a light-driven carbon cycle between symbiont and host // Mar. Biol. 1977. V. 44. № 3. P. 235–247.
Stambler N. Zooxanthellae: The yellow symbionts inside animals // Coral Reefs: An Ecosystem in Transition / Eds. Z. Dubinsky, N. Stambler. Dordrecht, the Netherlands: Springer-Verlag. 2011. P. 87–106.
Titlyanov E.A. Adaptation of reef-building corals to low light intensity // Proc. 4th Coral Reef Symp. Manila, Philippines: Univ. of Philippines. 1981. V. 2. P. 39–43.
Titlyanov E.A. Light adaptation and production characteristics of branches differing by age and illumination of the hermatypic coral Pocillopora verrucosa // Symbiosis. 1991a. V. 10. P. 249–260.
Titlyanov E.A. The stable level of coral primary production in a wide light range // Hydrobiologia. 1991b. V. 216. P. 383–387.
Titlyanov E.A., Latypov Y.Y. Light-dependence in scleractinian distribution in the sublittoral zone of South China Sea Islands // Coral Reefs. 1991. V. 10. P. 133–138.
Titlyanov E.A., Bil’ K., Fomina I. et al. Effects of dissolved ammonium addition and host feeding with Artemia salina on photoacclimation of the hermatypic coral Stylophora pistillata // Mar. Biol. 2000a. V. 137. P. 463–472.
Titlyanov E.A., Leletkin V.A., Dubinsky Z. Autotrophy and predation in the hermatypic coral Stylophora pistillata in different light habitats // Symbiosis. 2000b. V. 29. P. 263–281.
Titlyanov E.A., Shaposhnikova M.G., Zvalinsky V.I. Photosynthesis and adaptation of corals to irradiance. 1. Contents and native state of photosynthetic pigments in symbiotic microalgae // Photosynthetica. 1980. V. 14. № 3. P. 413–421.
Titlyanov E.A., Titlyanova T.V., Yamazato K. Formation, growth and photo-acclimation of colonies of the hermatypic coral Galaxea fascicularis under different light conditions // Symbiosis. 2001a. V. 30. P. 257–274.
Titlyanov E.A., Titlyanova T.V., Yamazato K. Acclimation of symbiotic reef-building corals to extremely low light // Symbiosis. 2002. V. 33. P. 125–143.
Titlyanov E.A., Titlyanova T.V., Leletkin V.A. et al. Degradation of zooxanthellae and regulation of their density in hermatypic corals // Mar. Ecol.: Prog. Ser. 1996. V. 139. P. 167–178.
Titlyanov E.A., Titlyanova T.V., Loya Y., Yamazato K. Degradation and proliferation of zooxanthellae in planulae of the hermatypic coral Stylophora pistillata // Mar. Biol. 1998. V. 130. P. 471–477.
Titlyanov E.A., Titlyanova T.V., Tsukahara J. et al. Experimental increases of zooxanthellae density in the coral Stylophora pistillata elucidate adaptive mechanisms for zooxanthellae regulation // Symbiosis. 1999. V. 26. P. 347–362.
Titlyanov E.A., Titlyanova T.V., Amat A., Yamazato K. Morphophysiological variations of symbiotic dinoflagellates in hermatypic corals from a fringing reef at Sesoko Island // Galaxea. 2001b. V. 2001. № 3. P. 51–63.
Titlyanov E.A., Titlyanova T.V., Yamazato K., Van Woesik R. Photo-acclimation dynamics of the coral Sylophora pistillata to low and extremely low light // J. Exp. Mar. Biol. Ecol. 2001c. V. 263. P. 211–225.
Titlyanov E.A., Titlyanova T.V., Yamazato K., Van Woesik R. Photo-acclimation of the hermatypic coral Sylophora pistillata while subjected to either starvation or food provisioning // J. Exp. Mar. Biol. Ecol. 2001d. V. 257. P. 163–181.
Titlyanov E.A., Tsukahara J., Titlyanova T.V. et al. Zooxanthellae population density and physiological state of the coral Stylophora pistillata during starvation and osmotic shock // Symbiosis. 2000b. V. 28. P. 303–322.
Vareschi E., Fricke H. Light responses of scleractinian coral (Plerogyra sinuosa) // Mar. Biol. 1986. V. 90. № 3. P. 395–402.
Veron J.E.N. Corals of Australia and the Indo-Pacific. North Ryde, NSW, Australia: Angus & Robertson. 1986. 644 p.
Yakovleva I., Hidaka M. Diel fluctuations of mycosporine-like amino acids in shallow-water scleractinian corals // Mar. Biol. 2004. V. 145. № 5. P. 863–873.
Yakovleva I.M., Titlyanov E.A. Effect of high visible and UV irradiance on subtidal Chondrus crispus: stress, photoinhibition and protective mechanisms // Aquat. Bot. 2001. V. 71. P. 47–61.
Yakovleva I., Bhagooli R., Takemura A., Hidaka M. Differential susceptibility to oxidative stress of two scleractinian corals: antioxidant functioning of mycosporine-glycine // Comp. Biochem. Physiol., Part B: Biochem. Mol. Biol. 2004. V. 139. P. 721–730.
Yakovleva I.M., Baird A.H., Yamamoto H.H. et al. Algal symbionts increase oxidative damage and death in coral larvae at high temperatures // Mar. Ecol.: Prog. Ser. 2009. V. 378. P. 105–112.
Yonge C.M. Studies on the physiology of corals. I. Feeding mechanisms and food // Great Barrier Reef Expeditions 1928–29: Scientific Reports. London: Br. Mus. Nat. Hist. 1930a. V. 1. № 2. P. 13–37.
Yonge C.M. Food assimilation and excretion in corals // Great Barrier Reef Expeditions 1928–29: Scientific Reports. London: Br. Mus. Nat. Hist. 1930b. V. 1. P. 14–57.
Yonge C.M. The nature of hermatypic reef-building corals // Bull. Mar. Sci. 1973. V. 23. P. 1–15.
Zhukova N.V., Titlyanov E.A. Fatty acid variations in symbiotic dinoflagellates from Okinawan corals // Phytochemistry. 2003. V. 62. P. 191–195.
Zhukova N.V., Titlyanov E.A. Effect of light intensity on the fatty acid composition of dinoflagellates symbiotic with hermatypic corals // Bot. Mar. 2006. V. 49. P. 339–346.
Дополнительные материалы отсутствуют.
Инструменты
Биология моря



