Биология моря, 2020, T. 46, № 6, стр. 363-376
Вариативность механизмов регенерации у иглокожих
И. Ю. Долматов *
Национальный научный центр морской биологии им. А.В. Жирмунского ДВО РАН
690041 Владивосток, Россия
* E-mail: idolmatov@mail.ru
Поступила в редакцию 15.06.2020
После доработки 10.07.2020
Принята к публикации 12.07.2020
Аннотация
На примере пищеварительной системы иглокожих описан феномен наличия нескольких принципиально разных вариантов восстановления какой-либо структуры у близкородственных видов или у одного вида многоклеточных животных. Данное явление предлагается назвать вариативностью механизмов регенерации. У иглокожих этот феномен проявляется в различиях пространственной организации процесса восстановления и в использовании разных клеточных источников регенерации. Предполагается, что вариативность механизмов регенерации в типе Echinodermata обусловлена наличием у предковых форм вторичноротых животных нескольких вариантов восстановления, которые различаются вовлеченностью разных типов клеток, глубиной процесса репрограммирования их генома (дедифференцировка или трансдифференцировка) и ролью эпителио-мезенхимной трансформации.
Способность к регенерации – одно из важнейших свойств живых существ, которое, вероятно, сформировалось у первых многоклеточных животных и видоизменялось в процессе эволюции вместе с усложнением их строения. Помимо теоретического интереса к регенерации как к биологическому явлению внимание к этому процессу определяется и его практической значимостью. Известно, что у высших позвоночных, в том числе у человека, способность к восстановлению значительно ниже, чем у животных многих других групп (Carlson, 2007; Maden, 2018). И хотя изучению разных аспектов регенерации посвящено большое число работ (см., например, обзоры: Grillo et al., 2016; Lai, Aboobaker, 2018; Maden, 2018; Mokalled, Poss, 2018; West et al., 2019; Ельчанинов, Фатхудинов, 2020), многие вопросы, связанные с восстановлением утраченных органов, до сих пор обсуждаются.
Одной из особенностей восстановительных морфогенезов является их значительная гетерогенность (Короткова, 1997). Полнота и механизмы регенерации варьируют в зависимости от характера повреждения, локализации раны, стадии индивидуального развития животного и других факторов (Воронцова, Лиознер, 1957; Короткова, 1997). Даже у близких видов способность к восстановлению и процесс формирования утраченной структуры могут сильно различаться (Borisov, 1999; Bely, Nyberg, 2010; Biressi et al., 2010; Sikes, Newmark, 2013). Тем не менее во многих случаях такая гетерогенность имеет “количественный” характер и связана с видовыми особенностями строения, а также с различиями в величине и клеточном составе оставшейся части органа, уровнях экспрессии определенных генов и/или функциональной активности задействованных в регенерации белков.
В то же время известны примеры регенерации, когда одни и те же структуры формируются за счет кардинально различающихся механизмов. В частности, стенка тела у губок класса Demospongiae восстанавливается в результате миграции отдельных клеток, их дедифференцировки и образования бластемы, а у представителей классов Homoscleromorpha и Calcarea – за счет эпителиального морфогенеза (Ereskovsky et al., 2020). Наличие столь разных механизмов регенерации одних и тех же структур нельзя объяснить лишь количественными флуктуациями морфогенетических механизмов. К сожалению, это интересное явление практически не изучено, что, вероятно, связано с большой трудоемкостью подобных исследований, поскольку для поиска различий в механизмах регенерации какого-то органа у определенной группы животных необходимо проводить сравнительный анализ морфогенезов у большого числа видов.
Несмотря на плохую изученность, имеющийся фактический материал позволяет предположить, что феномен наличия разных механизмов регенерации одних и тех же органов у близких видов достаточно широко распространен в животном мире. Он известен не только у Porifera, но и у Platyhelminthes (Maden, 2018; Reddien, 2018), Annelida (Bely et al., 2014; Костюченко и др., 2016; Ribeiro et al., 2019; Никанорова и др., 2020), Echinodermata (Долматов, 2009; Mashanov, García-Arrarás, 2011; Dolmatov et al., 2020) и Chordata, в том числе у Mammalia (Borisov, 1999; Ельчанинов, Фатхудинов, 2020). Изучение этого феномена, несомненно, имеет большое значение для понимания сути регенерации. Для более четкого определения данного явления предлагается использовать термин “вариативность механизмов регенерации”, под которым подразумевается наличие нескольких принципиально разных вариантов формирования какой-либо структуры у близкородственных видов или у одного вида.
Рассматривая данный феномен, мы исходим только из морфологических характеристик восстановительных морфогенезов, таких как клеточная миграция, преобразование эпителиев, эпителио-мезенхимный или мезенхимо-эпителиальный переходы (соответственно ЭМП и МЭП), клеточная пролиферация, тип изменения фенотипа клеток (редифференцировка или трансдифференцировка) и происхождение клеточного материала (клеточные источники регенерации). Очевидно, что в конечном итоге все эти процессы можно представить в виде межгенных и белок-белковых взаимодействий, однако данных по молекулярным особенностям регенерации для проведения сравнительного анализа пока недостаточно.
Следует заметить, что до сих пор отсутствует четкое определение понятия “механизм регенерации”. В разных публикациях под ним понимают разные события − от динамики активности отдельных генов (Sebastião et al., 2019) до таких сложных явлений, как эпиморфоз и морфаллаксис (Bely, Nyberg, 2010). Рассмотрение понятия “механизм регенерации” не является целью данной статьи. Укажем только, что в своих рассуждениях мы исходим из следующих соображений. Очевидно, что при восстановлении любого органа или части тела запускается множество строго скоординированных и взаимосвязанных процессов. Соответственно, в качестве “механизма регенерации” логично рассматривать совокупность процессов, разворачивающихся в организме после его повреждения и направленных на формирование утраченной структуры. Это образование бластемы, ЭМП, эпителиальный морфогенез, дедифференцировка, активация стволовых клеток и другие. Такой подход к пониманию механизмов регенерации позволяет проводить комплексный анализ восстановления конкретной структуры и выявлять сходные и отличающиеся компоненты (процессы) морфогенеза у разных видов.
Иглокожие – одна из групп животных, наиболее удобных для детального рассмотрения феномена вариативности механизмов регенерации. Данные по регенерации одних и тех же структур, прежде всего пищеварительной системы, известны для большого числа видов типа Echinodermata (Долматов, 1999; Candia Carnevali, 2006; Долматов, Машанов, 2007; Долматов, 2009; Gahn, Baumiller, 2010; García-Arrarás, Dolmatov, 2010; Mashanov, García-Arrarás, 2011; Lawrence, 2013). Во многих случаях у этой группы животных достаточно детально описаны механизмы регенерации на тканевом и клеточном уровнях. Представленный обзор посвящен анализу вариативности механизмов регенерации на примере восстановления пищеварительной системы у иглокожих.
РЕГЕНЕРАЦИЯ У ИГЛОКОЖИХ
О способности иглокожих терять, а затем регенерировать части тела известно уже несколько столетий. Первое упоминание о том, что у морских лилий можно легко удалить висцеральную массу (комплекс расположенных в чашечке внутренних органов, состоящий главным образом из пищеварительной системы и осевого органа), встречается в работах итальянского ботаника Фабио Колонны (Fabius Columna, 1592, цит. по: Dendy, 1886). Способность голотурий к аутотомии была хорошо известна в первой половине XIX века (Quatrefages, 1842; Фогт, 1864), а во второй его половине и позже появились работы, посвященные изучению регенерации у разных видов иглокожих (Dendy, 1886; Monticelli, 1896; Clark, 1921; Hyman, 1955).
Говоря о регенерации у иглокожих, необходимо отметить одну особенность этих животных. Дело в том, что до сих пор отсутствуют достоверные доказательства наличия у них стволовых клеток (Долматов, Машанов, 2007; Vogt, 2012). Исключением являются первичные половые клетки и, вероятно, стволовые клетки целомоцитов (Eliseikina et al., 2010; Завальная и др., 2020). Регенерация у иглокожих осуществляется лишь за счет дифференцированных клеток остатка органа (Mladenov et al., 1989; Dolmatov et al., 1996; Долматов, 1999; Dolmatov, Ginanova, 2001, 2009; Frolova, Dolmatov, 2010; García-Arrarás, Dolmatov, 2010; Mashanov, García-Arrarás, 2011). Хорошие способности к регенерации у этих животных обусловлены легкостью дедифференцировки и трансдифференцировки специализированных клеток, в частности, целомического эпителия (Долматов, Машанов, 2007). В последнее время некоторые авторы предлагают считать стволовыми клетками дифференцированные клетки взрослого организма, которые при повреждении легко дедифференцируются и способны к пролиферации и трансдифференцировке (adult stem cells) (см.: Funayama, 2018; Ereskovsky et al., 2020). Однако нам кажется, что называть, например, миоэпителиальные клетки целомического эпителия иглокожих стволовыми лишь на основании того, что они легко подвергаются де- и трансдифференцировке, не совсем верно. Поэтому в данной статье предполагается, что у иглокожих стволовые клетки не принимают участия в регенерации; при обсуждении вариативности механизмов регенерации они не учитываются.
Несмотря на то, что у иглокожих стволовые клетки отсутствуют или не принимают участия в регенерации, восстановительные реакции у этих животных достаточно разнообразны. Иглокожие способны заживлять кожные раны и регенерировать небольшие придатки тела, такие как щупальца, амбулакральные ножки, цирри и иглы. У этих животных восстанавливаются практически все внутренние органы, в том числе гонада (Kille, 1942; Долматов, 1999; Candia Carnevali, Bonasoro, 2001; Candia Carnevali, 2006; Dolmatov, 2014). Кроме этого иглокожие могут регенерировать крупные отделы тела (например, лучи), а также восстанавливаться из небольшого фрагмента после поперечного деления или разрезания на две или три части (Monticelli, 1896; Torelle, 1910; Hyman, 1955; Долматов, 1999, 2014). При этом отмечены различия в регенерации одних и тех же структур у близких видов (Долматов, 2009; Biressi et al., 2010; Dolmatov et al., 2020). Однако наиболее ярко вариативность механизмов регенерации у иглокожих проявляется при восстановлении пищеварительной системы.
РЕГЕНЕРАЦИЯ ПИЩЕВАРИТЕЛЬНОЙ СИСТЕМЫ У МОРСКИХ ЛИЛИЙ
Формирование пищеварительной системы в той или иной степени исследовано у 18 видов отряда Comatulida (см.: Dendy, 1886; Mozzi et al., 2006; Kalacheva et al., 2017; Kalacheva, Dolmatov, 2019; Dolmatov et al., 2020). Показано, что у морских лилий имеются межвидовые вариации в скорости восстановления кишки и всей висцеральной массы. Наиболее быстро восстановление происходит у видов надсемейства Himerometroidea, у которых ротовое отверстие появляется уже через 2 сут, а анальный конус – через 4 сут после полного удаления висцеральной массы (Kalacheva et al., 2017; Dolmatov et al., 2020). У видов надсемейств Antedonoidea и Comatuloidea формирование кишки происходит медленнее, регенерация занимает 7–25 сут (Mozzi et al., 2006; Kalacheva, Dolmatov, 2019; Dolmatov et al., 2020).
Такое различие в сроках регенерации зависит, вероятно, не от внешних факторов, поскольку эксперименты в большинстве случаев проводились в сходных условиях, а от видовых особенностей исследованных животных: строения висцеральной массы, наличия или отсутствия способности к аутотомии внутренностей, от различий в механизмах регенерации (Dolmatov et al., 2020). Показано, что к аутотомии висцеральной массы способны все виды с быстрыми темпами регенерации (надсемейство Himerometroidea). Детальное исследование регенерации кишки у представителей этого надсемейства Himerometra robustipinna (Carpenter, 1881) и Lamprometra palmata (Müller, 1841) показало, что формирование пищеварительного эпителия у данных видов осуществляется за счет трансдифференцировки юксталигаментных клеток – специфического типа мезенхимо-подобных клеток (Kalacheva et al., 2017; Kalacheva, Dolmatov, 2019). Эти клетки, расположенные в соединительной ткани дна чашечки, по-видимому, участвуют в аутотомии висцеральной массы (Wilkie, 2001; Bobrovskaya, Dolmatov, 2014). После удаления внутренностей оставшиеся юксталигаментные клетки мигрируют на поверхность чашечки, где образуют обширные скопления (рис. 1а, 1б). В процессе перемещения юксталигаментные клетки трансформируются в предшественников энтероцитов, которые затем претерпевают МЭП и формируют пищеварительный эпителий (рис. 1в, 1г). Показано, что у данных видов пролиферация не играет заметной роли в восстановительном процессе (Kalacheva et al., 2017). Таким образом, основой регенерации кишки у Himerometroidea является миграция клеток-предшественников мезенхимной природы (юксталигаментных клеток), их трансдифференцировка и МЭП.
Рис. 1.
Схема регенерации кишечного эпителия после аутотомии висцеральной массы у разных групп Crinoidea. а – поверхность чашечки сразу после аутотомии у представителей надсемейства Himerometroidea; б – выселение юксталигаментных клеток из соединительной ткани на поверхность чашечки у представителей надсемейства Himerometroidea; в – трансдифференцировка юксталигаментных клеток в энтероциты у представителей надсемейства Himerometroidea; г – формирование кишечного эпителия у представителей надсемейства Himerometroidea; д – поверхность чашечки сразу после аутотомии у представителей надсемейств Antedonoidea и Comatuloidea; е – эпителио-мезенхимный переход клеток целомического эпителия и их миграция на поверхность чашечки у представителей надсемейств Antedonoidea и Comatuloidea; ж – трансдифференцировка клеток целомического эпителия в энтероциты у представителей надсемейств Antedonoidea и Comatuloidea; з – формирование кишечного эпителия у представителей надсемейств Antedonoidea и Comatuloidea. Условные обозначения: c – чашечка, ce – целомический эпителий, en – энтероциты, ep – эпидермис, jlc – юксталигаментные клетки, mc – мигрирующие клетки целомического эпителия, mj – мигрирующие юксталигаментные клетки, s – септа аборального целома, tc – клетки целомического эпителия на разных стадиях трансдифференцировки в энтероциты, tj – юксталигаментные клетки на разных стадиях трансдифференцировки в энтероциты.

Представители надсемейств Antedonoidea и Comatuloidea, у которых восстановление кишки идет более медленными темпами, не способны к аутотомии висцеральной массы (Dolmatov et al., 2020). У них в процессе регенерации отмечена заметная митотическая активность (Mozzi et al., 2006), формирование пищеварительного эпителия происходит за счет мезодермальных клеток (Mozzi et al., 2006; Kalacheva, Dolmatov, 2019). В качестве клеточного источника регенерации задействованы клетки целомического эпителия (рис. 1д–1з), которые в процессе трансдифференцировки претерпевают ЭМП и мигрируют на поверхность чашечки, где формируют пищеварительный эпителий. Следовательно, у представителей надсемейств Antedonoidea и Comatuloidea восстановительный морфогенез характеризуется трансдифференцировкой клеток целомического эпителия, их ЭМП, заметным вкладом пролиферации и МЭП.
Таким образом, у морских лилий отчетливо прослеживается вариативность механизмов регенерации пищеварительной системы. В одном и том же отряде при сходном повреждении (полное удаление висцеральной массы) разворачиваются разные механизмы восстановления, которые различаются вкладом пролиферации и ЭМП в морфогенез, а также клеточными источниками регенерации пищеварительного эпителия.
РЕГЕНЕРАЦИЯ ПИЩЕВАРИТЕЛЬНОЙ СИСТЕМЫ У ГОЛОТУРИЙ
Из шести отрядов голотурий способность к регенерации пищеварительной системы описана у представителей четырех отрядов: Apodida, Dendrochirotida, Holothuriida и Synallactida. Регенерация в каждом из данных таксонов обладает определенными особенностями. К настоящему времени этот феномен в разной степени исследован у 21 вида голотурий.
Отряд Apodida
Голотурии этого отряда могут аутотомировать задние отделы тела (Hyman, 1955; Smith Jr., 1971a, 1971b; Emson, Wilkie, 1980). У всех исследованных видов только передние фрагменты способны регенерировать утраченные органы; неспособные к восстановлению задние фрагменты погибают. После поперечного разрезания голотурий на разных уровнях вдоль передне-задней оси тела передние части также могут формировать задние структуры (Smith Jr., 1971b).
Более детально регенерация кишки в передних фрагментах исследована у двух голотурий рода Leptosynapta: L. crassipatina Clark, 1924 и L. clarki Heding, 1928. Животных разрезали поперек между кишкой и желудком (рис. 2а). После такой операции у голотурий оставался пищевод и желудок, а длина остатка пищеварительной системы приблизительно соответствовала длине самого фрагмента тела (рис. 2б). На всех стадиях регенерации сохранялась целостность пищеварительного эпителия; ни выселения клеток, ни формирования бластемы не происходило. Восстановление кишки осуществлялось за счет морфаллактической перестройки желудочного отдела (рис. 2в) (см.: Smith Jr., 1971a; Gibson, Burke, 1983). Энтероциты задней части желудка постепенно трансформировались в энтероциты кишки. В итоге в переднем фрагменте голотурии восстанавливалось характерное для нормы соотношение между отделами пищеварительной трубки. Несмотря на сходство морфогенезов, регенерация у этих двух голотурий различается по вкладу клеточного размножения и, соответственно, эпиморфоза. По данным Смита (Smith Jr., 1971a), у L. crassipatina в процессе восстановления происходит активная пролиферация клеток пищеварительного тракта и стенки тела вблизи заднего конца животного. У L. clarki ни на одной из стадий регенерации ДНК-синтезирующие клетки в тканях пищеварительного тракта не обнаружены (Gibson, Burke, 1983).
Рис. 2.
Схема регенерации кишки у голотурий отряда Apodida после аутотомии или поперечного разрезания (вид с дорзальной стороны). а – неповрежденная особь; б – передний фрагмент голотурии сразу после удаления задней части тела; в – регенерация кишки за счет трансформации оставшейся части пищеварительной трубки. Условные обозначения: ab – аквафарингеальный комплекс, bw – стенка тела, cl – клоака, es – пищевод, g – кишка, lc – плоскость аутотомии или разреза, st – желудок, t – щупальца, ts – трансформирующийся желудок.

Таким образом, аподиды способны регенерировать только заднюю часть пищеварительной системы. Кишечная выстилка формируется за счет перестройки оставшейся части желудка и трансформации энтероцитов. При этом отмечены видовые различия в участии в восстановительном процессе элементов эпиморфоза, в частности, клеточного размножения.
Отряд Dendrochirotida
Многие виды этого отряда способны к аутотомии пищеварительной системы (эвисцерации). Одни виды выбрасывают кишку через передний конец тела (передняя эвисцерация), другие – через анальное отверстие (задняя эвисцерация) (Emson, Wilkie, 1980; Долматов, 2014). У видов с передней эвисцерацией удаляются вся пищеварительная трубка и передний комплекс органов (аквафарингеальный комплекс, АК) (Kille, 1935; Tracey, 1972; Emson, Wilkie, 1980; Лейбсон, Долматов, 1989; Leibson, 1992). В результате у животных из пищеварительной системы сохраняются лишь клоака и кишечный мезентерий (рис. 3а). При задней эвисцерации удаляется бóльшая часть кишки; у животных сохраняются клоака на заднем конце и АК с участком пищеварительной трубки (желудок) на переднем конце, а также кишечный мезентерий (рис. 4а).
Рис. 3.
Схема регенерации кишки у голотурий после передней эвисцерации. а – строение животного сразу после эвисцерации (вид с дорзальной стороны); б – формирование переднего и заднего зачатков кишечной трубки (вид с дорзальной стороны); в – рост зачатков по кишечному мезентерию (вид с дорзальной стороны); г – продольный дорзо-вентральный срез передней части кишечного мезентерия сразу после эвисцерации; д – продольный дорзо-вентральный срез переднего зачатка кишки на стадии погружения целомического эпителия; е – продольный дорзо-вентральный срез растущего конца переднего зачатка кишки; ж – продольный дорзо-вентральный срез передней части клоаки сразу после эвисцерации; з – продольный дорзо-вентральный срез заднего зачатка кишки; и – продольный дорзо-вентральный срез растущего конца заднего зачатка кишки. Условные обозначения: aa – передний зачаток кишки, ab – аквафарингеальный комплекс, bw – стенка тела, ce – целомический эпителий, cl – клоака, dc – пищеварительный эпителий, de – дедифференцированный энтероцит, gm – кишечный мезентерий, ic – место погружения целомического эпителия в зачаток кишки, pa – задний зачаток кишки, t – щупальца, tc – трансдифференцировка клеток целомического эпителия.

Рис. 4.
Схема регенерации кишки у голотурий после задней эвисцерации. а – строение животного сразу после эвисцерации (вид с дорзальной стороны); б – формирование переднего и заднего зачатков кишечной трубки (вид с дорзальной стороны); в – рост зачатков по кишечному мезентерию (вид с дорзальной стороны); г – продольный дорзо-вентральный срез концевого участка переднего остатка кишки сразу после эвисцерации; д – продольный дорзо-вентральный срез переднего зачатка кишки; е – продольный дорзо-вентральный срез растущего конца переднего зачатка кишки; ж – продольный дорзо-вентральный срез передней части клоаки сразу после эвисцерации; з – продольный дорзо-вентральный срез заднего зачатка кишки; и – продольный дорзо-вентральный срез растущего конца заднего зачатка кишки. Условные обозначения: aa – передний зачаток кишки, ab – аквафарингеальный комплекс, bw – стенка тела, ce – целомический эпителий, cl – клоака, dc – пищеварительный эпителий, de – дедифференцированный энтероцит, es – пищевод, gm – кишечный мезентерий, pa – задний зачаток кишки, t – щупальца.

Регенерация после эвисцерации. Регенерация кишки после передней эвисцерации у всех исследованных видов происходит примерно одинаково (Kille, 1935; Tracey, 1972; Лейбсон, Долматов, 1989; Leibson, 1992; Mashanov et al., 2005). Вначале на переднем конце животного развивается зачаток АК, от него по краю кишечного мезентерия отрастает передний зачаток кишки в виде соединительно-тканного тяжа (рис. 3б). Сходный тяж (задний зачаток кишки) появляется по краю мезентерия на границе с клоакой. Последующая регенерация сводится к формированию пищеварительного эпителия, врастанию его в соединительно-тканный тяж и к росту зачатков кишки навстречу друг другу по мезентерию (рис. 3в), что в конечном итоге приводит к их слиянию и образованию непрерывной пищеварительной трубки.
Ультраструктурные особенности регенерации кишки у дендрохиротид после передней эвисцерации описаны для голотурии Eupentacta fraudatrix (D’yakonov & Baranova in D’yakonov, Baranova & Savel’eva, 1958) (Leibson, 1992; Mashanov et al., 2005; Долматов, Машанов, 2007). Показано, что после такого повреждения пищеварительный эпителий образуется за счет двух клеточных источников (рис. 3г–3и). В заднем зачатке он формируется из внутреннего эпителия передней части клоаки, имеющего у голотурий энтодермальное происхождение (рис. 3в, 3ж) (Машанов и др., 2004; Kamenev et al., 2013; Dolmatov et al., 2017). Энтероциты клоаки начинают дедифференцироваться и митотически делиться. При этом клетки не теряют связь друг с другом и межклеточные контакты не разрушаются (рис. 3з). В результате пролиферации и миграции наблюдаются врастание внутреннего эпителия клоаки в соединительно-тканное утолщение и его дальнейший рост в составе заднего зачатка (рис. 3и). В передней части животного клетки энтодермального происхождения не сохраняются (рис. 3а, 3г). Пищеварительный эпителий в переднем зачатке образуется за счет клеток целомического эпителия, покрывающего кишечный мезентерий (рис. 3д). Группы клеток целомического эпителия погружаются в соединительную ткань зачатка, претерпевают трансдифференцировку и дают начало энтероцитам передней части кишки (рис. 3в, 3е) (Mashanov et al., 2005).
В настоящее время имеются только макроморфологические данные по регенерации кишки после задней эвисцерации у голотурий отряда Dendrochirotida (см.: Долматов, 2014). Пищеварительная система восстанавливается с формированием двух зачатков (рис. 4а–4в). Пищеварительный эпителий в обоих зачатках образуется за счет оставшихся энтероцитов клоаки (задний зачаток) и переднего конца кишечной трубки (передний зачаток). Сохранившийся пищеварительный эпителий врастает в соединительно-тканные утолщения и вместе с ними распространяется по краю мезентерия навстречу друг другу.
Регенерация после поперечного разрезания. Некоторые виды дендрохиротид могут регенерировать после поперечного разрезания на две части. После такой операции в переднем фрагменте сохраняются АК, гонада и передняя половина кишечной трубки, а в заднем фрагменте – задняя часть кишки, клоака и органы дыхания (водные легкие) (рис. 5). Полная регенерация обеих половинок, за небольшим исключением, характерна только для видов, способных к бесполому размножению (Torelle, 1910; Долматов, 2014; Dolmatov, 2014).
Рис. 5.
Схема регенерации кишки у голотурий после поперечного разрезания (вид с дорзальной стороны). а – неповрежденная особь; б – передний фрагмент голотурии сразу после разрезания; в – формирование заднего зачатка кишки; г – рост зачатка кишки по кишечному мезентерию; д – задний фрагмент голотурии сразу после разрезания; е – формирование переднего зачатка кишки; ж – рост зачатка кишки по кишечному мезентерию. Условные обозначения: aa – передний зачаток кишки, ab – аквафарингеальный комплекс, bw – стенка тела, cl – клоака, es – пищевод, g – кишка, gm – кишечный мезентерий, lc – плоскость разреза, pa – задний зачаток кишки, rt – водные легкие, t – щупальца.
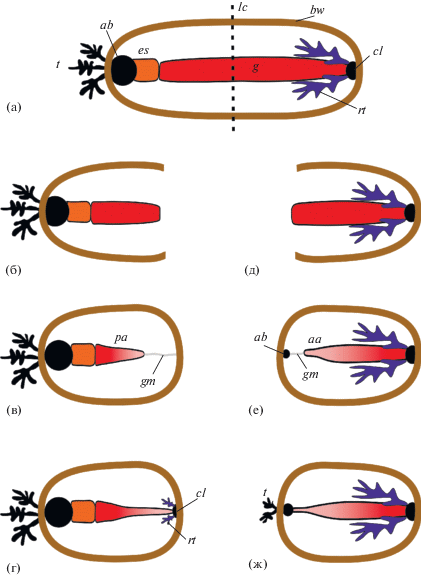
Наиболее подробно регенерация пищеварительной системы в обоих фрагментах исследована у голотурии Cladolabes schmeltzii (Ludwig, 1875) (см.: Kamenev, Dolmatov, 2015, 2017). В переднем фрагменте C. schmeltzii в первые дни после повреждения начинается трансформация оставшейся части кишки. Она немного укорачивается, вероятно, за счет разрушения части клеток, а ее концевой участок утончается (рис. 5в). От кишки по краю кишечного мезентерия отрастает соединительно-тканное утолщение, которое постепенно распространяется назад. Одновременно с этим процессом энтероциты в районе раны начинают дедифференцироваться и митотически делиться. Межклеточные контакты между ними не разрушаются. Пищеварительный эпителий врастает в соединительно-тканное утолщение. В дальнейшем зачаток постепенно растет назад и достигает задней стенки тела, где к этому времени уже сформировалась клоака (рис. 5г). Регенерация кишки в заднем фрагменте происходит сходным образом, за счет преобразования передней части пищеварительной трубки (рис. 5е, 5ж). У всех изученных к настоящему времени видов дендрохиротид, не обладающих бесполым размножением, способность к регенерации имеется только у задних фрагментов. Передняя часть кишки у этих видов формируется так же, как и у C. schmeltzii (Nace, 1972; Долматов, 2014) (рис. 5д–5ж).
У голотурии E. fraudatrix способность регенерировать передние и задние структуры после поперечного разрезания меняется в онтогенезе (Долматов, 1994). У пятимесячных особей E. fraudatrix восстанавливаются только задние отделы тела. Пищеварительный эпителий в передних фрагментах формируется за счет трансформации и роста внутреннего эпителия сохранившейся части пищеварительного тракта (рис. 5в, 5г) (Mashanov, Dolmatov, 2001). При этом наблюдается заметная митотическая активность энтероцитов. У животных в возрасте одного года и передние, и задние фрагменты могут регенерировать утраченные структуры (рис. 5). Половозрелые особи E. fraudatrix теряют способность восстанавливать клоаку; после поперечного разрезания передняя половина животного погибает. Задний фрагмент эвисцерирует оставшуюся часть кишки и восстанавливает пищеварительную систему и АК. Регенерация кишки происходит так же, как после передней эвисцерации (рис. 3).
Таким образом, у дендрохиротид выявлено два варианта регенерации кишки, которые различаются происхождением энтероцитов. После передней эвисцерации восстановление пищеварительного эпителия происходит за счет двух источников. В переднем зачатке пищеварительный эпителий формируется из производных мезодермы (целомический эпителий), а в заднем – из энтодермального эпителия клоаки. После задней эвисцерации и при поперечном разрезании регенерация кишки осуществляется за счет перестройки оставшихся частей пищеварительной системы, а также дедифференцировки энтероцитов. Для E. fraudatrix показано наличие вариативности механизмов регенерации кишки в онтогенезе.
Отряды Holothuriida и Synallactida
Эти таксоны выделены недавно в результате разделения отряда Aspidochirotida (Miller et al., 2017). У представителей данных отрядов регенерация протекает сходным образом, поэтому рассмотрена в одном разделе.
Регенерация после эвисцерации. Эвисцерация у представителей Holothuriida и Synallactida осуществляется через задний конец тела или в результате разрыва стенки тела (Emson, Wilkie, 1980; Долматов и др., 2012). В обоих случаях удаляется бóльшая часть пищеварительной трубки (рис. 4а). В передней части голотурий сохраняются АК и небольшой участок кишки (пищевод и/или желудок), а в задней части остается клоака. Регенерация у большинства изученных видов осуществляется в результате образования двух зачатков (рис. 4б, 4в), как и у дендрохиротид после задней эвисцерации. Пищеварительный эпителий формируется за счет энтероцитов оставшихся частей пищеварительной системы (рис. 4г–4и) (Bertolini, 1932; Kille, 1936; Leibson, 1992; García-Arrarás et al., 1998; García-Arrarás, Greenberg, 2001; Шукалюк, Долматов, 2001; Odintsova et al., 2005; Долматов и др., 2012).
Для некоторых представителей отрядов Holothuriida и Synallactida описан совершенно иной способ регенерации кишки. У голотурий Actinopyga agassizii (Selenka, 1867) (Holothuriida), Parastichopus (Stichopus) regalis (Cuvier, 1817) и Australostichopus (Stichopus) mollis (Hutton, 1872) (Synallactida) зачаток пищеварительной трубки в виде соединительно-тканного утолщения развивается сразу по всей длине свободного края кишечного мезентерия − от пищевода до клоаки (Bertolini, 1930; Dawbin, 1949; Mosher, 1956). Цитируемые авторы высказали предположение, что пищеварительный эпителий формируется за счет мезенхимных клеток мезодермального происхождения (Dawbin, 1949) или благодаря погружению целомического эпителия в подлежащую соединительную ткань зачатка (Mosher, 1956), а пищевод и клоака не принимают участия в регенерации. Однако эти данные нуждаются в проверке. Во-первых, анализ регенерации у A. agassizii, P. regalis и A. mollis проводили с использованием парафиновых срезов и световой микроскопии, что не позволяет достоверно проследить преобразование клеток при восстановлении кишки. Во-вторых, такой же способ регенерации изначально был описан и для голотурии Holothuria (Metriatyla) scabra Jaeger, 1833 (см.: Bai, 1971). Более детальное исследование показало, что у этого вида формируются два зачатка, как и у большинства видов отрядов Holothuriida и Synallactida (Долматов и др., 2012). Ошибка в определении способа регенерации могла произойти из-за высокой скорости восстановления кишки у данного вида.
Регенерация после поперечного разрезания. Передние и задние половинки голотурий обоих отрядов обладают разным восстановительным потенциалом (Reichenbach, Holloway, 1995; Reichenbach et al., 1996; Долматов и др., 2012). Как и дендрохиротиды, большинство исследованных представителей Holothuriida и Synallactida способны регенерировать лишь передние структуры в задних фрагментах тела. Клоака и задние отделы кишки восстанавливаются только у видов, способных к бесполому размножению, за редким исключением.
Во фрагментах, способных к регенерации, формирование утраченных отделов пищеварительной системы происходит за счет клеток оставшихся частей кишки (рис. 5). Данные о клеточных механизмах регенерации отсутствуют, однако на основе макроморфологических наблюдений и по аналогии с голотуриями отряда Dendrochirotida можно предположить, что происходит перестройка концевого участка кишки в месте повреждения. Вероятно, этот процесс сопровождается дедифференцировкой оставшихся энтероцитов и эпителиальным морфогенезом.
Регенерация после эвисцерации и поперечного разрезания. У голотурий обоих отрядов можно экспериментально удалить почти всю пищеварительную систему и сымитировать состояние, свойственное дендрохиротидам после передней эвисцерации. Этого можно достичь, если у животного сначала вызвать заднюю эвисцерацию, а затем разрезать его поперечно на две половины. В результате операции задний фрагмент тела утрачивает АК, а также всю кишечную трубку и содержит лишь клоаку и кишечный мезентерий (рис. 3а). Регенерация после такого способа повреждения изучена лишь у Apostichopus japonicus (Selenka, 1867) и только макроморфологически, без применения методов микроскопии (Долматов, Машанов, 2007). Как показали проведенные исследования, несмотря на высокий процент гибели животных, регенерация пищеварительной системы у выживших особей все-таки происходила. Восстановление осуществлялось в результате формирования двух зачатков, как у голотурии E. fraudatrix. Это позволяет предположить, что образование пищеварительного эпителия в переднем зачатке может происходить за счет трансдифференцировки клеток целомического эпителия.
Как осуществляется регенерация пищеварительной системы у передних половинок A. japonicus после такой операции, неизвестно. Тем не менее наличие АК, переднего участка кишки (пищевод) и отсутствие клоаки позволяют предположить, что утраченные структуры в данном фрагменте формируются аналогично тому, как это происходит у аподид (рис. 2) и в раннем онтогенезе у E. fraudatrix (рис. 5б–5г).
Таким образом, у Holothuriida и Synallactida выявлено несколько вариантов регенерации кишки в зависимости от вида повреждения и наличия остатка органа. После эвисцерации у голотурий, образующих два отдельных зачатка, пищеварительный эпителий развивается за счет преобразования и роста эпителиев оставшихся частей пищеварительной системы (клоаки и пищевода). У животных, формирующих единственный зачаток, источником энтероцитов, возможно, являются клетки целомического эпителия, мигрирующие с поверхности соединительно-тканного утолщения. Этот вариант регенерации близок к варианту, описанному для половозрелых особей E. fraudatrix (рис. 3). При поперечном разрезании утраченные части кишки, скорее всего, развиваются из клеток остатка пищеварительной системы. При полном удалении кишечной трубки в результате эвисцерации и последующего поперечного разрезания восстановление в заднем фрагменте голотурии может происходить аналогично формированию кишки у взрослых особей E. fraudatrix, а в переднем – как у аподид и пятимесячных особей E. fraudatrix.
Вариативность механизмов регенерации кишки у голотурий
Анализ опубликованных данных показал, что в целом голотурии обладают достаточно широким спектром способов регенерации пищеварительной системы. В зависимости от того, на каком уровне происходит разрыв, утраченные части могут восстанавливаться за счет разных отделов кишечной трубки и, соответственно, разных типов энтероцитов. В ряде случаев, например, после задней эвисцерации, кишечник регенерирует за счет пищевода или желудка, которые, предположительно, имеют эктодермальное происхождение (Féral, Massin, 1982; Машанов, Долматов, 2001; Машанов и др., 2004; Kamenev et al., 2013). Кроме этого, по-видимому, имеются различия в пролиферативной активности, зависящие от вида животного и способа повреждения. Но в большинстве случаев отличия способов восстановления пищеварительной системы у голотурий носят количественный характер.
Среди представителей класса Holothuroidea отмечена ярко выраженная вариативность механизмов регенерации пищеварительной системы. У голотурий четко выявляются три варианта восстановления кишки, которые реализуются в зависимости от размера оставшейся части пищеварительной системы. Первый вариант запускается, если у животного или его фрагмента сохраняется значительный участок кишки (рис. 2, 5). Это происходит при аутотомии, бесполом размножении или искусственном разрезании. После данных типов повреждений формируется один зачаток, а пищеварительный эпителий утраченных отделов кишки образуется из эпителия оставшейся ее части. Второй вариант реализуется при задней эвисцерации (рис. 4). В этом случае у голотурий сохраняются небольшой передний отдел (пищевод и/или желудок) и клоака, за счет преобразования которых закладываются два зачатка и в дальнейшем формируется кишка. Третий вариант восстановительного морфогенеза у голотурий наблюдается после передней эвисцерации (рис. 3). При таком повреждении энтодермальные ткани у животного сохраняются только в составе клоаки. Как и в предыдущем варианте, закладываются два зачатка, однако пищеварительный эпителий в переднем зачатке формируется из клеток целомического эпителия в результате их трансдифференцировки. Насколько распространен такой тип регенерации у голотурий, пока непонятно, поскольку участие мезодермальных клеток в морфогенезе достоверно подтверждено только для одного вида дендрохиротид − E. fraudatrix (см.: Mashanov et al., 2005). Однако предварительные данные, полученные для A. japonicus (Synallactida), дают основание говорить об участии механизмов трансдифференцировки при формировании кишечного эпителия и в других отрядах Holothuroidea.
Интересно, что один и тот же вид голотурий может обладать не одним, а двумя или даже всеми тремя вариантами восстановительных морфогенезов, которые реализуются в зависимости от нанесенного повреждения. У E. fraudatrix в раннем онтогенезе запускается первый вариант, а у взрослых особей – третий. У A. japonicus, по-видимому, возможны все три механизма регенерации кишки, которые активируются в зависимости от степени травмирующего воздействия (эвисцерация, поперечное разрезание или сочетание обоих способов повреждения).
Таким образом, у голотурий вариативность механизмов регенерации кишки наблюдается как между видами, так и у одного вида. Она проявляется в различиях пространственной организации процесса восстановления и в используемых источниках регенерации энтероцитов.
ВОЗМОЖНЫЕ ПРИЧИНЫ ВАРИАТИВНОСТИ МЕХАНИЗМОВ РЕГЕНЕРАЦИИ У ИГЛОКОЖИХ
В настоящем обзоре представлен материал, показывающий, что у иглокожих имеется несколько механизмов регенерации пищеварительной системы. Они различаются по вкладу пролиферации, роли МЭП, типам клеток, за счет которых формируется пищеварительный эпителий, и по участию механизмов репрограммирования генома (дедифференцировка и/или трансдифференцировка). У морских лилий вариативность механизмов регенерации имеет, по-видимому, только межвидовой характер, так как пока отсутствуют данные о том, что у одного и того же вида Crinoidea регенерация кишки может осуществляться с помощью разных механизмов. У голотурий вариативность проявляется как на межвидовом, так и внутривидовом уровнях. В зависимости от стадии онтогенеза и/или способа повреждения пищеварительный эпителий может регенерировать либо за счет энтероцитов остатка кишки, либо в результате трансдифференцировки клеток целомического эпителия.
Представленный материал показывает, что у современных видов Echinodermata в случае сохранения части пищеварительной системы регенерация кишки происходит за счет оставшихся энтероцитов. Помимо голотурий дедифференцировка энтероцитов и вовлечение их в восстановительный процесс описаны также у офиур (Фролова, Долматов, 2006; Frolova, Dolmatov, 2010). В связи с этим можно предположить, что способность к дедифференцировке энтероцитов является общей для всех иглокожих. Отсутствие сведений для других классов Echinodermata можно объяснить меньшей изученностью данных групп. Регенерация за счет дедифференцировки клеток оставшихся органов известна и в таких группах низших вторичноротых, как Hemichordata (Humphreys et al., 2010; Arimoto, Tagawa, 2018) и Cephalochordata (Somorjai et al., 2012), что может указывать на наличие этого механизма у общего предка Deuterostomia.
При удалении всей пищеварительной системы или ее значительной части для формирования кишечного эпителия должны быть задействованы клетки других тканей, имеющих мезодермальное или эктодермальное происхождение. Механизмы регенерации кишечного эпителия на основе трансдифференцировки можно считать анцестральными для современных иглокожих, поскольку они встречаются у наиболее древних из ныне живущих представителей Echinodermata – у морских лилий. У морских звезд, офиур и морских ежей регенерация пищеварительной системы за счет трансдифференцировки не описана. Непонятно, связано это с утратой способности к глубокой трансформации клеток или с малой изученностью регенерации у представителей данных классов. В то же время трансдифференцировка обнаружена у других представителей Deuterostomia, например, у асцидий (Fujiwara, Kawamura, 1992; Kawamura, Fujiwara, 1994; Kawamura et al., 2008; Scelzo et al., 2019). Это может означать, что у общего предка всех вторичноротых имелись и механизмы трансдифференцировки, следовательно, предковые формы Deuterostomia обладали вариативностью механизмов регенерации пищеварительной системы. Разные варианты могли запускаться в зависимости от типа повреждения и/или стадии онтогенеза.
Несмотря на использование трансдифференцировки и даже сходных источников регенерации (целомический эпителий), механизмы регенерации пищеварительной системы у морских лилий и голотурий существенно различаются по одному важному компоненту – участию ЭМП в морфогенезе. У всех изученных видов Crinoidea клетки, задействованные в формировании пищеварительного эпителия, либо изначально имеют мезенхимную природу (юксталигаментные клетки) (Kalacheva et al., 2017; Kalacheva, Dolmatov, 2019), либо претерпевают ЭМП при трансформации (целомический эпителий) (Kalacheva, Dolmatov, 2019). У голотурий наличие ЭМП не установлено ни для одного варианта регенерации. Основой восстановления даже в случае трансдифференцировки является эпителиальный морфогенез (García-Arrarás et al., 1998; Шукалюк, Долматов, 2001; Mashanov et al., 2005). Неизвестно, на каком этапе эволюции Echinodermata сформировался вариант восстановления кишки без участия ЭМП, за счет эпителиального морфогенеза, а также не ясно, стал ли он новоприобретением голотурий или существовал у предковых форм иглокожих. Интересно, что анализ транскриптома регенерирующей кишки у E. fraudatrix выявил значительный кластер генов, связанных с ЭМП (Boyko et al., 2020). Авторы предположили, что при преобразовании целомического эпителия в пищеварительный может происходить частичный ЭМП, как при росте трубчатых органов (Schöck, Perrimon, 2002). В этом случае клетки, не теряя межклеточные контакты, приобретают некоторые мезенхимные черты: уплощаются, формируют псевдоподии и проявляют способность к миграции в составе эпителия. Поскольку Holothuroidea более молодой таксон по сравнению с Crinoidea, можно предположить, что трансдифференцировка с участием ЭМП – это более древняя форма регенерации кишечного эпителия, а сокращение полноты ЭМП могло произойти в филогенезе иглокожих, например, для оптимизации морфогенеза и ускорения процесса восстановления.
Таким образом, вариативность механизмов регенерации у иглокожих, очевидно, обусловлена наличием у предковых форм вторичноротых животных нескольких вариантов восстановления, различающихся вовлеченностью разных типов клеток, глубиной процесса репрограммирования их генома (дедифференцировка или трансдифференцировка) и ролью эпителио-мезенхимной трансформации.
Вариативность механизмов регенерации представляет собой интересную, но пока практически не исследованную область регенерации. Анализ имеющихся данных по иглокожим обозначил несколько общих проблем, связанных с этим феноменом, в том числе проблему происхождения разных вариантов механизмов регенерации. Представляют ли эти варианты самостоятельные не связанные друг с другом механизмы или же они сформировались на базе одного древнего механизма, а затем дивергировали и менялись в разных таксонах? С одной стороны, вариативность механизмов регенерации, очевидно, возникла еще у первых многоклеточных животных, на что указывает наличие разных механизмов восстановления у Porifera (Ereskovsky et al., 2020). С другой стороны, вариативность механизмов регенерации могла сформироваться в эволюции многоклеточных животных позднее. В этом случае ее причиной могла стать полифилетичность восстановительных процессов (Долматов, 1996; Долматов, Машанов, 2007; Bely, Nyberg, 2010). Предполагается, что регенерация возникла на основе механизмов развития, бесполого размножения и роста (Долматов, 1996; Короткова, 1997; Carlson, 2007; Bely, Nyberg, 2010; Ribeiro et al., 2019). Соответственно, восстановление разных структур могло сформироваться на основе разных морфогенезов. Возможно, такая “первичная” вариативность сохранилась в филогенезе многоклеточных животных и может проявляться в наличии разных механизмов восстановления одних и тех же структур у близких таксонов.
Нельзя исключить и возникновение регенерации de novo в какой-то группе организмов в результате активации имеющихся морфогенетических механизмов развития или роста (Bely, Nyberg, 2010). Если эта гипотеза верна, она может объяснить наличие разных механизмов восстановления одной и той же структуры у близких видов или у одного вида. Причиной вариативности механизмов регенерации может быть также использование в восстановлении травмированного органа процессов, которые свойственны морфогенезу другого органа. В настоящее время вовлечение (co-option) отдельных звеньев генных сетей в регуляцию новых для них процессов рассматривается как одна из причин становления разнообразия структур в эволюции животных (Shubin et al., 2009; Hu et al., 2018).
Важной проблемой, связанной с феноменом вариативности механизмов регенерации и требующей изучения, является проблема регуляции вариантов восстановительных морфогенезов. Каким образом организм “понимает”, какой механизм необходимо активировать при данном повреждении? Как запускаются разные варианты морфогенеза? Имеется ли единый пусковой механизм, а регенерация в дальнейшем протекает в зависимости от конкретных особенностей (состояние животного, степень повреждения органа, внешние условия и т.д.) или же для каждого варианта восстановительного морфогенеза существует своя регуляторная система? Можно ли запустить вариант регенерации, который в норме у данного вида не реализуется? Получить ответы на эти вопросы важно как для понимания сущности феномена регенерации, так и для разработки методов стимуляции регенерации тех органов и тканей, которые не имели или утратили эту способность.
Список литературы
Воронцова М.А., Лиознер Л.Д. Бесполое размножение и регенерация. М.: Советская наука. 1957. 416 с.
Долматов И.Ю. Способность к регенерации и ее изменение в онтогенезе у голотурий // Онтогенез. 1994. Т. 25. № 1. С. 31–37.
Долматов И.Ю. Бесполое размножение, эвисцерация и регенерация у голотурий // Онтогенез. 1996. Т. 27. № 4. С. 256–265.
Долматов И.Ю. Регенерация у иглокожих // Биол. моря. 1999. Т. 25. № 3. С. 191–200.
Долматов И.Ю. Регенерация пищеварительной системы у голотурий // Журн. общ. биол. 2009. Т. 70. № 4. С. 316–327.
Долматов И.Ю. Новые данные по бесполому размножению, аутотомии и регенерации голотурий из отряда Dendrochirotida // Биол. моря. 2014. Т. 40. № 3. С. 240–244.
Долматов И.Ю., Машанов В.С. Регенерация у иглокожих. Владивосток: Дальнаука. 2007. 212 с.
Долматов И.Ю., Нгуен Ан Хан, Каменев Я.О. Особенности бесполого размножения, эвисцерации и регенерация у голотурий (Holothuroidea) из залива Нячанг Южно-Китайского моря // Биол. моря. 2012. Т. 38. № 3. С. 227–236.
Ельчанинов А.В., Фатхудинов Т.Х. Регенерация печени млекопитающих. Межклеточные взаимодействия. М.: Наука. 2020. 126 с.
Завальная Е.Г., Шамшурина Е.В., Елисейкина М.Г. Иммуноцитохимическая идентификация PIWI-позитивных клеток в ходе восстановления популяции целомоцитов после эвисцерации у голотурии Eupentacta fraudatrix (Djakonov et Baranova, 1958) (Holothuroidea: Dendrochirota) // Биол. моря. 2020. Т. 46. № 2. С. 117–125.
Короткова Г.П. Регенерация животных. СПб.: Изд-во С.-Петербург. ун-та. 1997. 480 с.
Костюченко Р.П., Козин В.В., Купряшова Е.Е. Регенерация и бесполое размножение у аннелид: клетки, гены и эволюция // Изв. РАН. Сер. биол. 2016. Т. 43. № 3. С. 231–241.
Лейбсон Н.Л., Долматов И.Ю. Эвисцерация и регенерация внутреннего комплекса голотурии Eupentacta fraudatrix (Holothuroidea, Dendrochirota) // Зоол. журн. 1989. Т. 68. № 8. С. 67–74.
Машанов В.С., Долматов И.Ю. Ультраструктура пищеварительного тракта у пятимесячных пентактул голотурии Eupentacta fraudatrix // Биол. моря. 2001. Т. 27. № 5. С. 363–371.
Машанов В.С., Фролова Л.Т., Долматов И.Ю. Строение пищеварительной трубки у голотурии Eupentacta fraudatrix (Holothuroidea, Dendrochirota) // Биол. моря. 2004. Т. 30. № 5. С. 366–374.
Никанорова Д.Д., Купряшова Е.Е., Костюченко Р.П. Регенерация у аннелид: клеточные источники, тканевые перестройки и дифференциальная экспрессия генов // Онтогенез. 2020. Т. 51. № 3. С. 177–192.
Фогт К. Из жизни людей и животных. СПб.: Типография О.И. Бакста. 1864. 347 с.
Фролова Л.Т., Долматов И.Ю. Регенерация эпителиальной выстилки желудка после аутотомии диска у офиуры Amphipholis kochii (Lütken) (Echinodermata: Ophiuroidea) // Биол. моря. 2006. Т. 32. № 1. С. 73–75.
Шукалюк А.И., Долматов И.Ю. Регенерация пищеварительной трубки у голотурии Apostichopus japonicus после эвисцерации // Биол. моря. 2001. Т. 27. № 3. С. 202–206.
Arimoto A., Tagawa K. Regeneration in the enteropneust hemichordate, Ptychodera flava, and its evolutionary implications // Dev., Growth Differ. 2018. V. 60. P. 400–408.
Bai M.M. Regeneration in the holothurian, Holothuria scabra Jager // Indian J. Exp. Biol. 1971. V. 9. P. 467–471.
Bely A.E., Nyberg K.G. Evolution of animal regeneration: re-emergence of a field // Trends Ecol. Evol. 2010. V. 25. P. 161–170.
Bely A.E., Zattara E.E., Sikes J.M. Regeneration in spiralians: evolutionary patterns and developmental processes // Int. J. Dev. Biol. 2014. V. 58. P. 623–634.
Bertolini F. Rigenerazione dell’apparato digerente nello Stichopus regalis // Pubbl. Staz. Zool. Napoli. 1930. V. 10. P. 439–449.
Bertolini F. Rigenerazione dell’apparato digerente nello Holothuria // Pubbl. Staz. Zool. Napoli. 1932. V. 12. P. 432–443.
Biressi A.C.M., Zou T., Dupont S. et al. Wound healing and arm regeneration in Ophioderma longicaudum and Amphiura filiformis (Ophiuroidea, Echinodermata): comparative morphogenesis and histogenesis // Zoomorphology. 2010. V. 129. P. 1–19.
Bobrovskaya N.V., Dolmatov I.Yu. Autotomy of the visceral mass in the feather star Himerometra robustipinna (Crinoidea, Comatulida) // Biol. Bull. 2014. V. 226. P. 81–91.
Borisov A.B. Regeneration of skeletal and cardiac muscle in mammals: do nonprimate models resemble human pathology? // Wound Repair Regener. 1999. V. 7. P. 26–35.
Boyko A.V., Girich A.S., Tkacheva E.S., Dolmatov I.Y. The Eupentacta fraudatrix transcriptome provides insights into regulation of cell transdifferentiation // Sci. Rep. 2020. V. 10. № 1. P. 1522.
Candia Carnevali M.D., Bonasoro F. Microscopic overview of crinoid regeneration // Microsc. Res. Tech. 2001. V. 55. P. 403–426.
Candia Carnevali M.D. Regeneration in echinoderms: repair, regrowth, cloning // Invertebr. Survival J. 2006. V. 3. P. 64–76.
Carlson B.M. Principles of regenerative biology. San Diego, CA: Academic Press-Elsevier. 2007. 379 p.
Clark A.H. A monograph of the existing crinoids. V. 1. The comatulids. Part 2 // United States National Museum, Bulletin 82. Washington: Goverment Printing Office. 1921. 795 p.
Dawbin W.H. Auto-evisceration and the regeneration of viscera in the holothurian Stichopus mollis (Hutton) // Trans. R. Soc. N. Z. 1949. V. 77. P. 497–523.
Dendy A. On the regeneration of the visceral mass in Antedon rosaceus // Stud. Biol. Lab. Owens Coll. 1886. V. 1. P. 299–312.
Dolmatov I.Yu. Asexual reproduction in holothurians // Sci. World J. 2014. V. 2014. Art. ID 527234. https://doi.org/10.1155/2014/527234
Dolmatov I.Y., Eliseikina M.G., Ginanova T.T. et al. Muscle regeneration in the holothurian Stichopus japonicus // Roux’s Arch. Dev. Biol. 1996. V. 205. P. 486–493.
Dolmatov I.Yu., Ginanova T.T. Muscle regeneration in holothurians // Microsc. Res. Tech. 2001. V. 55. P. 452–463.
Dolmatov I.Y., Ginanova T.T. Post-autotomy regeneration of respiratory trees in the holothurian Apostichopus japonicus (Holothurioidea, Aspidochirotida) // Cell Tissue Res. 2009. V. 336. P. 41–58.
Dolmatov I.Yu., Ginanova T.T., Frolova L.T. Digestive system formation during the metamorphosis and definitive organogenesis in Apostichopus japonicus // Zoomorphology. 2017. V. 136. P. 191–204.
Dolmatov I.Yu., Kalacheva N.V., Mekhova E.S., Frolova L.T. Autotomy and regeneration of the visceral mass in feather stars // Zoomorphology. 2020. V. 139. P. 171–187.
Eliseikina M.G., Magarlamov T.Y., Dolmatov I.Y. Stem cells of holothuroid coelomocytes // Echinoderms: Durham. Boca Raton: CRC Press. 2010. P. 163–166.
Emson R.H., Wilkie I.C. Fission and autotomy in echinoderms // Oceanogr. Mar. Biol. Annu. Rev. 1980. V. 18. P. 155–250.
Ereskovsky A.V., Tokina D.B., Saidov D.M. et al. Transdifferentiation and mesenchymal-to-epithelial transition during regeneration in Demospongiae (Porifera) // J. Exp. Zool., Part B. 2020. V. 334. P. 37–58.
Féral J.P., Massin C. Digestive systems: Holothuroidea // Echinoderm nutrition. Rotterdam: Balkema. 1982. P. 191–212.
Frolova L.T., Dolmatov I.Yu. Microscopic anatomy of the digestive system in normal and regenerating specimens of the brittlestar Amphipholis kochii // Biol. Bull. 2010. V. 218. P. 303–316.
Fujiwara S., Kawamura K. Ascidian budding as a transdifferentiation-like system: multipotent epithelium is not undifferentiated // Dev., Growth Differ. 1992. V. 34. P. 463–472.
Funayama N. The cellular and molecular bases of the sponge stem cell systems underlying reproduction, homeostasis and regeneration // Int. J. Dev. Biol. 2018. V. 62. P. 513–525.
Gahn F.J., Baumiller T.K. Evolutionary history of regeneration in crinoids (Echinodermata) // Integr. Comp. Biol. 2010. V. 50. P. 514a–514m.
García-Arrarás J.E., Dolmatov I.Yu. Echinoderms: potential model systems for studies on muscle regeneration // Curr. Pharm. Des. 2010. V. 16. P. 942–955.
García-Arrarás J.E., Estrada-Rodgers L., Santiago R. et al. Cellular mechanisms of intestine regeneration in the sea cucumber, Holothuria glaberrima Selenka (Holothuroidea: Echinodermata) // J. Exp. Zool. 1998. V. 281. P. 288–304.
García-Arrarás J.E., Greenberg M.J. Visceral regeneration in holothurians // Microsc. Res. Tech. 2001. V. 55. P. 438–451.
Gibson A.W., Burke R.D. Gut regeneration by morphallaxis in the sea cucumber Leptosynapta clarki (Heding, 1928) // Can. J. Zool. 1983. V. 61. P. 2720–2732.
Grillo M., Konstantinides N., Averof M. Old questions, new models: unraveling complex organ regeneration with new experimental approaches // Curr. Opin. Genet. Dev. 2016. V. 40. P. 23–31.
Hu Y., Schmitt-Engel C., Schwirz J. et al. A morphological novelty evolved by co-option of a reduced gene regulatory network and gene recruitment in a beetle // Proc. R. Soc. B. 2018. V. 285. N. 1885. https://doi.org/10.1098/rspb.2018.1373
Humphreys T., Sasaki A., Uenishi G. et al. Regeneration in the Hemichordate Ptychodera flava // Zool. Sci. 2010. V. 27. P. 91–95.
Hyman L.H. The invertebrates: Echinodermata // The coelome Bilateria. New York: McGraw-Hill. 1955. 763 p.
Kalacheva N.V., Dolmatov I.Y. Cellular source of digestive system regeneration in Lamprometra palmata and Aneissia bennetti // Abstracts of 10th European conference on echinoderms, Borissiak Paleontological Institute RAS, Moscow. 2019. P. 42.
Kalacheva N.V., Eliseikina M.G., Frolova L.T., Dolmatov I.Yu. Regeneration of the digestive system in the crinoid Himerometra robustipinna occurs by transdifferentiation of neurosecretory-like cells // PLoS One. 2017. V. 12. Art. ID. e0182001. https://doi.org/10.1371/journal.pone.0182001
Kamenev Ya.O., Dolmatov I.Yu. Posterior regeneration following fission in the holothurian Cladolabes schmeltzii (Dendrochirotida: Holothuroidea) // Microsc. Res. Tech. 2015. V. 78. P. 540–552.
Kamenev Ya.O., Dolmatov I.Y. Anterior regeneration after fission in the holothurian Cladolabes schmeltzii (Dendrochirotida: Holothuroidea) // Microsc. Res. Tech. 2017. V. 80. P. 183–194.
Kamenev Ya.O., Dolmatov I.Yu., Frolova L.T., Khang N.A. The morphology of the digestive tract and respiratory organs of the holothurian Cladolabes schmeltzii (Holothuroidea, Dendrochirotida) // Tissue Cell. 2013. V. 45. P. 126–139.
Kawamura K., Fujiwara S. Transdifferentiation of pigmented multipotent epithelium during morphallactic development of budding tunicates // Int. J. Dev. Biol. 1994. V. 38. P. 369–377.
Kawamura K., Sugino Y., Sunanaga T., Fujiwara S. Multipotent epithelial cells in the process of regeneration and asexual reproduction in colonial tunicates // Dev., Growth Differ. 2008. V. 50. P. 1–11.
Kille F.R. Regeneration in Thyone briareus Lesueur following induced autotomy // Biol. Bull. 1935. V. 69. P. 82–108.
Kille F.R. Regeneration in holothurians // Annu. Rep. Tortugas Lab., Carnegie Inst. Wash. 1936. V. 35. P. 85–86.
Kille F.R. Regeneration of the reproductive system following binary fission in the sea-cucumber, Holothuria parvula (Selanka) // Biol. Bull. 1942. V. 83. P. 55–66.
Lai A.G., Aboobaker A.A. EvoRegen in animals: Time to uncover deep conservation or convergence of adult stem cell evolution and regenerative processes // Dev. Biol. 2018. V. 433. P. 118–131.
Lawrence J.M. Arm loss and regeneration in stellate echinoderms: an organismal view // Echinoderms in a changing world. Boca Raton: CRC Press. 2013. P. 53–66.
Leibson N.L. Regeneration of digestive tube in holothurians Stichopus japonicus and Eupentacta fraudatrix // Monogr. Dev. Biol. 1992.V. 23. P. 51–61.
Maden M. The evolution of regeneration – where does that leave mammals? // Int. J. Dev. Biol. 2018. V. 62. P. 369–372.
Mashanov V.S., Dolmatov I.Yu. Regeneration of digestive tract in the pentactulae of the far-eastern holothurian Eupentacta fraudatrix (Holothuroidea, Dendrochirota) // Invertebr. Reprod. Dev. 2001. V. 39. P. 143–151.
Mashanov V.S., Dolmatov I.Yu., Heinzeller T. Transdifferentiation in holothurian gut regeneration // Biol. Bull. 2005. V. 209. P. 184–193.
Mashanov V.S., García-Arrarás J.E. Gut regeneration in holothurians: a snapshot of recent developments // Biol. Bull. 2011. V. 221. P. 93–109.
Miller A.K., Kerr A.M., Paulay G. et al. Molecular phylogeny of extant Holothuroidea (Echinodermata) // Mol. Phylogenet. Evol. 2017. V. 111. P. 110–131.
Mladenov P.V., Bisgrove B., Asotra S., Burke R.D. Mechanisms of arm-tip regeneration in the sea star, Leptasterias hexactis // Roux’s Arch. Dev. Biol. 1989. V. 198. P. 19–28.
Mokalled M.H., Poss K.D. A regeneration toolkit // Dev. Cell. 2018. V. 47. P. 267–280.
Monticelli F.S. Sull’ autotomia delle Cucumaria planci (Br.) // Atti Accad. Naz. Lincei, Cl. Sci. Fis., Mat. Nat., Rend., Sez. 5. 1896. V. 5. P. 231–239.
Mosher C. Observation on evisceration and visceral regeneration in the sea cucumber, Actinopyga agassizi Selenka // Zoologica. 1956. V. 41. P. 17–26.
Mozzi D., Dolmatov I.Yu., Bonasoro F., Candia Carnevali M.D. Visceral regeneration in the crinoid Antedon mediterranea: basic mechanisms, tissues and cells involved in gut regrowth // Centr. Eur. J. Biol. 2006. V. 1. P. 609–635.
Nace A.G. The digestive system and lantern complex of Thyonella gemmata (Pourtales): structure and regeneration // PhD Dissertation, Florida State University. 1972. V. 32B. P. 5539.
Odintsova N.A., Dolmatov I.Yu., Mashanov V.S. Regenerating holothurian tissues as a source of cells for long-term cell cultures // Mar. Biol. 2005. V. 146. P. 915–921.
Quatrefages A. de. Memoire sur la Synapte de Duvernoy (Synapta Duvernaea A. de Q.) // Ann. Sci. Nat., Ser. 2. 1842. V. 17. P. 19–93.
Reddien P.W. The cellular and molecular basis for planarian regeneration // Cell. 2018. V. 175. P. 327–345.
Reichenbach N., Holloway S. Potential for asexual propagation of several commercially important species of tropical sea cucumbers (Echinodermata) // J. World Aquacult. Soc. 1995. V. 26. P. 272–278.
Reichenbach N., Nishar Y., Saeed A. Species and size-related trends in asexual propagation of commercially important species of tropical sea cucumbers (Holothuroidea) // J. World Aquacult. Soc. 1996. V. 27. P. 475–482.
Ribeiro R.P., Ponz-Segrelles G., Bleidorn C., Aguado M.T. Comparative transcriptomics in Syllidae (Annelida) indicates that posterior regeneration and regular growth are comparable, while anterior regeneration is a distinct process // BMC Genomics. 2019. V. 20. Art. ID 855. https://doi.org/10.1186/s12864-019-6223-y
Scelzo M., Alié A., Pagnotta S. et al. Novel budding mode in Polyandrocarpa zorritensis: a model for comparative studies on asexual development and whole body regeneration // EvoDevo. 2019. V. 10. Art. ID 7. https://doi.org/10.1186/s13227-019-0121-x
Schöck F., Perrimon N. Molecular mechanisms of epithelial morphogenesis // Annu. Rev. Cell Dev. Biol. 2002. V. 18. P. 463–493.
Sebastião M.J., Serra M., Pereira R. et al. Human cardiac progenitor cell activation and regeneration mechanisms: exploring a novel myocardial ischemia/reperfusion in vitro model // Stem Cell Res. Ther. 2019. V. 10. Art. ID 77. https://doi.org/10.1186/s13287-019-1174-4
Shubin N., Tabin C., Carroll S. Deep homology and the origins of evolutionary novelty // Nature. 2009. V. 457. P. 818–823.
Sikes J.M., Newmark P.A. Restoration of anterior regeneration in a planarian with limited regenerative ability // Nature. 2013. V. 500. P. 77–80.
Smith G.N. Jr. Regeneration in the sea cucumber Leptosynapta. I. The process of regeneration // J. Exp. Zool. 1971a. V. 177. P. 319–330.
Smith G.N. Jr. Regeneration in the sea cucumber Leptosynapta. II. The regenerative capacity // J. Exp. Zool. 1971b. V. 177. P. 331–342.
Somorjai I.M.L., Somorjai R.L., Garcia-Fernàndez J., Escrivà H. Vertebrate-like regeneration in the invertebrate chordate amphioxus // Proc. Natl. Acad. Sci. U.S.A. 2012. V. 109. P. 517–522.
Torelle E. Regeneration in holothuria // Zool. Anz. 1910. V. 35. P. 15–22.
Tracey D.J. Evisceration and regeneration in Thyone okeni (Bell 1884) // Proc. Linn. Soc. N. S. W. 1972. V. 97. P. 72–81.
Vogt G. Hidden treasures in stem cells of indeterminately growing bilaterian invertebrates // Stem Cell Rev. Rep. 2012. V. 8. P. 305–317.
West M.D., Sternberg H., Labat I. et al. Toward a unified theory of aging and regeneration // Regener. Med. 2019. V. 14. P. 867–886.
Wilkie I.C. Autotomy as a prelude to regeneration in echinoderms // Microsc. Res. Tech. 2001. V. 55. P. 369–396.
Дополнительные материалы отсутствуют.
Инструменты
Биология моря


