Биология моря, 2022, T. 48, № 1, стр. 3-11
Формирование биологического разнообразия амфидромных и пресноводных бычков-подкаменщиков (Cottoidei: Cottidae) юга Дальнего Востока
В. Н. Долганов 1, *, П. А. Савельев 1
1 Национальный научный центр морской биологии им. А.В. Жирмунского ДВО РАН
690041 Владивосток, Россия
* E-mail: vndolganov@mail.ru
Поступила в редакцию 27.12.2020
После доработки 24.02.2021
Принята к публикации 22.04.2021
- EDN: RBCTJR
- DOI: 10.31857/S0134347522010041
Аннотация
Показаны последовательность и время адаптации морских бычков к пресноводному образу жизни. Обсуждаются основные причины этого процесса: вынужденное освоение пресных вод вследствие похолодания климата, а также миграция постличиночной молоди из более сложных биоценозов прибрежья в эстуарии и нижнее течение рек. Ареалы двух филогенетических линий подкаменщиков (автохтонной приазиатской и сформированной от нее в Арктике) изоляцией Японского моря на границе плиоцена и плейстоцена были разделены на три части: в Охотском море, Японском море и южнее его. Разные условия жизни изолятов в течение длительного времени привели к формированию трех новых таксонов в первой филогенетической линии и четырех – во второй. Исходная ветвь подкаменщиков сформировала в Восточно-Китайском море Trachidermus fasciatus, в Японском море Rheopresbe kazika и в Охотском – Mesocottus haitej, а производная от нее арктическая – соответственно Cottus reinii в Восточно-Китайском море, C. czerskii и C. hangiongensis – в Японском море и C. amblystomopsis – в Охотском. Во время плейстоценовых изоляций Японского моря и миграций подкаменщиков, вызванных колебаниями климата, в южной части Японского моря от C. reinii отделился C. pollux, а наиболее южные пресноводные популяции амфидромных C. amblystomopsis и C. hangiongensis обособились соответственно в C. nozawae и C. koreanus.
Пресноводные и близкие к ним амфидромные и прибрежные формы бычков-подкаменщиков – это более 100 видов, в разной степени адаптированных к пресноводному образу жизни, обитающих в умеренных и холодных водах Северного полушария. Наибольшее экологическое и биологическое разнообразие подкаменщиков наблюдается в водоемах юга Дальнего Востока, где по морфологическим, эколого-биологическим и генетическим признакам они подразделяются на три группы (Берг, 1949; Nakabo, 2002; Goto et al., 2015; Balakirev et al., 2017): 1) предковая группа – нерестящиеся в море Trachidermus fasciatus и Rheopresbe kazika, пресноводный Mesocottus haitej; 2) группа амфидромных бычков с пресноводным нерестом и близких к ним пресноводных видов – Cottus amblystomopsis, C. nozawae, C. hangiongensis, C. koreanus, C. czerskii, C. reinii и C. pollux; 3) пресноводные подкаменщики Амура и рек материкового побережья – С. szanaga и C. volki.
У представителей этих групп разные экология и биология размножения, но хорошо прослеживается их преобразование по направлению от предковой группы к более адаптированным к пресным водам. Однако до сих пор отсутствует понимание того, как шел эволюционный процесс и какие были побудительные причины для освоения пресных вод исходно морскими представителями семейства Cottidae. Неизвестны место, время, условия происхождения и расселения видов бычков-подкаменщиков Дальнего Востока. Отсутствует обоснование их филогенетического родства. Поскольку традиционными морфоэкологическими и генетическими методами решить эти задачи невозможно, в работе использовали метод исторической биогеографии.
На основании анализа данных о распространении, экологии, биологии и генетике представителей семейства Cottidae, а также о геологических и климатических процессах, происходивших в регионе, предлагается эволюционный сценарий формирования биологического разнообразия бычков-подкаменщиков юга Дальнего Востока.
Формирование предковой группы бычков-подкаменщиков
Усиливающееся кайнозойское похолодание определило направление эволюционного процесса мелководной прибрежной ихтиофауны в сторону адаптации к холоду и, как следствие, привело к освоению распресненных и пресных вод. Процесс адаптации, вероятно, начался во второй половине миоцена после окончания среднемиоценового оптимума, когда сильное похолодание (Douglas, Savin, 1973; Лисицын, 1980; Zachos et al., 2001) положило начало образованию в северной части Тихого океана амфипацифических ареалов рыб (Андрияшев, 1939). Исходная для современных бычков-подкаменщиков форма разделилась на две, от которых у американского побережья сформировался род Leptocottus, а у азиатского – род Trachidermus. Единственный вид рода Leptocottus – L. armatus, обитающий ныне от Калифорнии до Аляски (Miller, Lea, 1972) в условиях умеренного климата, сохранил прибрежный образ жизни, размножение в соленых водах и нагул от эстуариев рек до глубин 90 м (Eschmeyer, Herald, 1983). Адаптация этого вида к пресным водам заключается только в миграции постличиночной молоди в эстуарии и нижнее течение рек, где они в условиях меньшего пресса хищников подрастают в течение 1.5–3.0 мес. и затем снова уходят в более соленые воды (Jones, 1962; Moyle, 1976; Morrow, 1980).
У азиатского побережья, где в результате сильного похолодания климата в позднем миоцене (Короткий и др., 1996; Гладенков и др., 2002; Цой и др., 2003; Плетнев, 2015; Matsuzaki et al., 2018) произошло значительное выхолаживание прибрежных вод, бычки-подкаменщики, как и многие другие прибрежные рыбы, были вынуждены постепенно адаптироваться к зимовке в более теплых условиях эстуариев и нижнего течения рек. Данная стратегия выживания привела к необходимости весенней катадромной миграции к местам нереста, которые находились, как и в настоящее время, в прибрежных водах с достаточно широким диапазоном солености. Вследствие того, что небольшие миграции энергетически более выгодны, естественный отбор шел в сторону размножения в расположенных ближе к берегам более распресненных водах. По направлению к северным широтам этот процесс усиливался длительной зимовкой и менее продолжительным сезоном нереста. Наиболее благоприятные условия для освоения размножения в пресных водах находились в обширном распресненном лимане Амура, где миграции к местам нереста с высокой соленостью вод для не приспособленных к активному плаванию бычков невозможны.
Параллельно с освоением взрослыми особями пресных вод для зимовки происходила адаптация к пресным водам и ранней молоди бычков, которые после окончания личиночной стадии развития (1.5–2.0 мес.) подобно L. armatus мигрируют в эстуарии и нижнее течение рек, где несколько месяцев растут при меньшем, чем в море, прессе хищников. При усиливающемся похолодании и сокращении теплого сезона года пресноводный “мальковый” период сливается с зимовальным и к настоящему времени нерестящиеся еще в соленой среде T. fasciatus и R. kazika, созревающие в возрасте 1 года, выходят из пресных вод в море только для размножения (Takita, Chikamoto, 1994; Takeshita et al., 1999; Onikura et al., 1999a, 2002).
Формирование таксономического и биологического разнообразия в предковой линии бычков-подкаменщиков побережья Азии было вызвано длительной изоляцией Японского моря в раннем плейстоцене11 в результате усиления Сахалинской фазы складчатости и значительного похолодания в Северном полушарии, приведшего к понижению уровня Мирового океана (Пушкарь, Черепанова, 2001; Цой и др., 2003; Плетнев, 2004; Kitamura, Kimoto, 2006; Itaki, 2016). Изоляция Японского моря разделила ареал исходного вида побережья Дальнего Востока, обитавшего в пресных водах почти круглогодично, на три части, оказавшиеся в разных климатических условиях (рис. 1). Наименьшее влияние наступившего похолодания испытывали популяции бычков Восточно-Китайского моря, сохранившие предковые черты в наибольшей степени. Сформировавшийся здесь T. fasciatus в настоящее время размножается при солености воды около 30‰ (при солености ниже 20‰ эмбриогенез останавливается) и температуре 6–16°С (Takeshita et al., 1995; Onikura et al., 1999b, 2002). Дивергировавший в Японском море R. kazika формировался в значительно более холодных условиях, что привело к дальнейшему приближению мест его нереста к побережью и, соответственно, к снижению нижнего порога солености воды при размножении до 20‰, к остановке эмбриогенеза при солености ниже 10‰ и к снижению температуры нереста до 7–13°С (Takeshita et al., 1995, 1999). В Японском море такие условия для размножения в настоящее время существуют лишь в его юго-восточной части в зоне влияния теплого Цусимского течения (рис. 1). Крайне интересна трансформация наиболее северных популяций предковой формы, изолированных в Охотском море и севернее. При усиливающемся похолодании размножение подкаменщиков в море стало невозможным. Единственным местом их размножения оставался лиман Амура, где постепенно была вынуждена формироваться амфидромная форма с нерестом в сильно распресненной и полностью пресной воде. Дальнейшее похолодание климата и усиление ледовой обстановки на границе плиоцена и плейстоцена (Цой и др., 2003; Плетнев, 2004) привели к исчезновению амфидромной части популяции Амурского лимана и образованию в Амуре полностью пресноводного вида M. haitej. В это же время пресноводными стали также изолированные холодными течениями в лимане Амура калуга Huso dauricus, амурский осетр Acipenser schrenkii, девятииглая колюшка Pungitius cf. sinensis, жилые популяции симы Oncorhynchus masou и мальмы Salvelinus curilus р. Уссури и др.
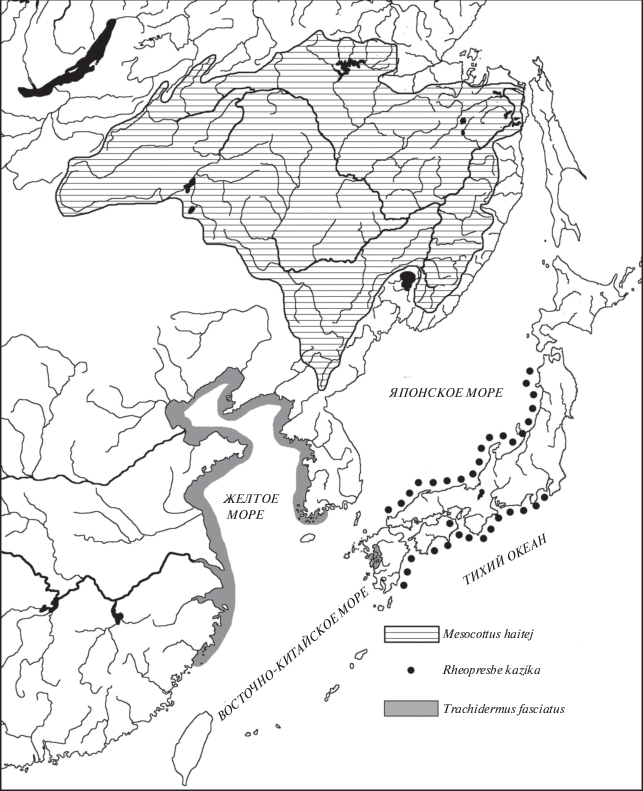
Рис. 1.
Распространение предковой группы бычков-подкаменщиков (Nakabo, 2002; Сиделева, 2003; Wang, Chen, 2010; собственные данные).
Формирование группы амфидромных подкаменщиков и их производных
Закономерности процесса адаптации подкаменщиков к пресноводному образу жизни позволяют предположить, что освоение пресных вод данной группой бычков происходило по сравнению с предковой в более холодных северных широтах и началось раньше. Скорее всего, исходная форма амфидромной группы бычков-подкаменщиков сформировалась от общего с рассмотренной выше группой предка в Полярном бассейне, куда он проник из Берингова моря после открытия Берингова пролива в конце миоцена 5.5–5.4 млн лет назад (Marincovich, Gladenkov, 2001; Gladenkov et al., 2002). Закрытие Берингова пролива в начале плиоцена (Свиточ, Талденкова, 1994; Гладенков, Гладенков, 2004) и наступившее вследствие этого значительное похолодание климата Полярного бассейна привели к максимальному воздействию холода на изолированные в нем популяции бычков. У них в условиях “стрессовой” эволюции более быстрыми темпами, чем у тихоокеанских популяций, происходила вынужденная адаптация к обитанию в пресных водах, процесс которой описан выше. Учитывая, что в Арктике освоение подкаменщиками пресных вод началось раньше, чем в Тихом океане, и проходило в более экстремальных условиях, можно полагать, что предковая форма этой группы, проникшая в северную часть Тихого океана после открытия Берингова пролива в конце раннего плиоцена (Свиточ, Tалденкова, 1994), уже была практически пресноводной. Она размножалась в низовьях рек, и единственная связь с морем заключалась в обитании в прибрежье пелагических личинок, выносимых в море течением рек. Во второй половине плиоцена при продолжающемся похолодании климата вышедшие из Арктики амфидромные бычки расселились вдоль азиатского побережья далеко на юг, образовав со своей предковой формой почти симпатрический ареал, так как из-за разницы в биологии конкуренция между ними отсутствовала.
Разделение ареала этой амфидромной формы на три части в начале плейстоцена было аналогичным по последствиям изоляции ее предковой формы. В результате изоляции Японского моря и дивергенции амфидромной формы в сильно отличающихся условиях среды в Охотском море сформировался C. amblystomopsis, южнее Японии обособился C. reinii, в холодной материковой части Японского моря – C. czerskii, а в более теплой островной – C. hangiongensis (рис. 2). При формировании этих видов предковые черты амфидромности в большей степени сохранили не виды Охотского и Японского морей, подвергавшиеся максимальному прессу холода, а наиболее южный изолят – C. reinii, который при неблагоприятных условиях среды мог мигрировать южнее. В плейстоцене после открытия проливов Японского моря началось взаимопроникновение видов в ареалы друг друга, которое вследствие усиления миграций достигло максимума в эпоху оледенений.
Рис. 2.
Распространение группы амфидромных бычков-подкаменщиков и их производных (Nakabo, 2002; Сафронов, Никифоров, 2003; Сиделева, 2003; Tsukagoshi et al., 2013; Baek et al., 2018; Yamamoto, 2019; собственные данные).

Наибольший интерес представляет периодическое открытие и закрытие Корейского пролива, оказывавшее максимальное влияние на климат Японского моря. При открытии пролива мощное Цусимское течение способствовало проникновению южной фауны далеко на север. Так, в начале плейстоцена около 1.9 млн. лет назад (Kitamura, Kimoto, 2006) в южную часть моря вселился C. reinii, войдя в контакт с C. czerskii и C. hangiongensis. В результате последующего разделения ареала C. reinii закрывшимся Корейским проливом в южной части Японского моря сформировался более холодноводный и более адаптированный к пресным водам, но еще амфидромный, C. pollux.
После переноса нереста в пресные воды эстуариев и в нижнее течение рек наиболее уязвимой частью жизненного цикла подкаменщиков по-прежнему оставалось нахождение в морском прибрежье пелагических личинок, куда они выносились течением рек. Для увеличения выживаемости личинок естественный отбор шел параллельно в сторону их перехода к донному образу жизни и освоению подкаменщиками среднего и верхнего течения рек, откуда даже пелагические личинки в море не выносились. В результате этих процессов в настоящее время в большинстве водотоков (особенно крупных) у каждого амфидромного вида имеются жилые популяции, отличающиеся от амфидромных популяций нижнего течения наличием донных личинок, более крупной икрой и меньшей плодовитостью (Goto, 1990; Goto et al., 2015). Во время значительного колебания климата в эпоху оледенений второй половины плейстоцена амфидромные популяции бычков далеко и надолго смещались к югу и к северу, а вынужденные остаться в реках жилые популяции в сильно изменившихся условиях жизни дивергировали до уровня подвидов и видов. Так, не позднее предпоследнего оледенения (240–130 тыс. лет назад) в южных частях ареалов от C. hangiongensis обособился C. koreanus, а от C. amblystomopsis – C. nozawae (рис. 2). Самые северные популяции C. amblystomopsis, обитающие на севере Сахалина и в реках лимана Амура, также обособившиеся во время эпохи оледенений, еще не имеют таксономического статуса.
Интересная ситуация сложилась у южной Японии. Амфидромный вид C. reinii и образовавшийся от него C. pollux в силу географического распространения при изменении климата не имели возможности совершать значительные и, следовательно, длительные по времени широтные миграции. Поэтому речные изоляты этих близкородственных видов дивергировали в меньшей степени, чем у C. amblystomopsis и C. hangiongensis, практически не различаются между собой и в отдельные таксоны не выделяются. От амфидромных форм C. reinii и C. pollux, обитающих в нижнем течении рек, жилые формы среднего и верхнего течения хорошо отличаются лишь размерами икринок и плодовитостью. Плодовитость амфидромной формы C. reinii достигает 600–1500 икринок диаметром 1.8–2.4 мм, а C. pollux – 400–1000 икринок диаметром 2.4–2.8 мм. Жилые популяции обоих видов, встречающиеся в реках Хонсю, имеют плодовитость всего 150–300 икринок, однако их диаметр значительно больше – 2.5–3.7 мм (Goto et al., 2002; Goto, Arai, 2003; Yoshigou, 2010; Yamamoto, 2019). Формирование пресноводных форм у данных видов свидетельствует об изоляции жилых популяций от амфидромных, которая в этом регионе может быть связана с длительным закрытием Корейского пролива во время предпоследнего оледенения 240–130 тыс. лет назад (Плетнев, 2004). Наиболее ранняя утрата амфидромных популяций среди подкаменщиков этой линии произошла у C. czerskii. Этот вид материкового побережья Японского моря обособился от островного C. hangiongensis вследствие суровых климатических условий в северной части Японского моря, по-видимому, еще в раннем плейстоцене (Короткий и др., 1996, 1997; Цой и др., 2003; Плетнев, 2004). Обитание в наиболее холодных условиях материкового побережья привело к выпадению из жизненного цикла C. czerskii морского периода жизни пелагических личинок и лишило этот вид возможности расселения морским путем. Современный ареал C. czerskii находится только у материкового побережья от р. Серебрянка до р. Северный Нандей (Савельев, Колпаков, 2018), а южнее, у восточного побережья Кореи, обитает ныне “островной” по происхождению C. hangiongensis, мигрировавший туда после окончания оледенения из Восточно-Китайского моря (рис. 2). Современный ареал C. hangiongensis, наличие в реках западного побережья Кореи сформировавшегося от него пресноводного C. koreanus и отсутствие жилых форм C. czerskii на востоке Корейского полуострова указывают на утрату способности к расселению C. czerskii еще до предпоследнего оледенения, начавшегося 240 тыс. лет назад.
Формирование биоразнообразия пресноводных бычков-подкаменщиков Амура и рек материкового побережья
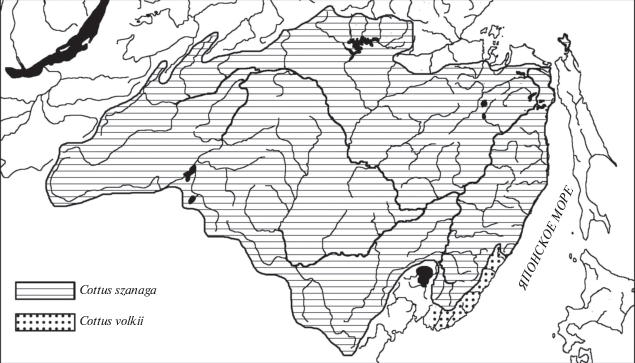
Пресноводные бычки-подкаменщики Амура и материкового побережья юга Дальнего Востока С. szanaga и C. volki занимают южную периферию ареала широко распространенного в Голарктике комплекса бычков-подкаменщиков, близких к С. poecilopus (рис. 3). Возможность обмена фауной между реками Северного Ледовитого океана (в первую очередь р. Лена) и р. Амур существовала неоднократно в течение плиоплейстоцена (Шапошникова, 1976; Карасев, 1987), что подтверждается неоднородностью амурских популяций С. szanaga (Yokoyama et al., 2008; Савельев и др., 2017). Ареал близкого к С. szanaga вида C. volki, обитающего только в небольших реках побережья Приморья, указывает на обособление его от С. szanaga после перехвата реками побережья верховьев рек бассейна р. Амур в результате геологических преобразований Сихотэ-Алиня в плейстоцене (Парпура, 1989; Короткий, 2010).
Рис. 3.
Распространение пресноводных бычков-подкаменщиков Амура и рек материкового побережья (Сиделева, 2003; собственные данные).
Таким образом, сильное похолодание климата в конце кайнозоя привело к вынужденной энергетически выгодной адаптации прибрежных бычков-подкаменщиков – зимовать в более теплых пресных водах. Освоению пресных вод в значительной степени способствовала миграция постличиночной молоди в более безопасные для нее условия эстуариев и рек, обеспечивающая ее большее выживание. При дальнейшем похолодании время зимовки увеличивалось и соединилось со временем пребывания в эстуариях и нижнем течении рек подрастающей молоди, которая обратной миграции в море уже не совершала. Круглогодичное пребывание в пресных водах прерывалось лишь нерестовой миграцией в прибрежье. Энергетически более выгодные для ведущих малоподвижный образ жизни подкаменщиков короткие миграции привели к их нересту в солоноватой и затем в пресной воде. Дальнейший переход к полностью пресноводному образу жизни реализовывался по двум направлениям: исчезновение прибрежного нереста вследствие усиления похолодания (лиман Амура) и освоение популяциями из низовьев рек, уже нерестящимися в пресных водах, средних и верхних участков водотоков. Второй вариант способствовал формированию новых пресноводных форм и видов подкаменщиков при изоляции от их амфидромных предков во время миграций фауны в ледниковое время.
Большое разнообразие таксонов и экологических форм подкаменщиков Дальнего Востока появилось в результате сложного процесса формообразования, вызванного многими факторами, в первую очередь благодаря значительному изменению климата в условиях многократной изоляции Японского моря. Ареалы автохтонного приазиатского вида с морским нерестом и произошедшего от него в Арктике амфидромного вида с размножением в пресных водах в раннем плейстоцене при полной изоляции Японского моря разделились на три части. Под воздействием сильно различающихся условий среды обитания древняя автохтонная форма образовала катадромные виды в Восточно-Китайском море (T. fasciatus) и Японском море (R. kazika), а также пресноводный вид в бассейне Охотского моря (M. haitej). Амфидромный предок арктического происхождения сформировал в Восточно-Китайском море C. reinii, в Японском море у материкового побережья – C. czerskii и у островного – C. hangiongensis, а в Охотском море и у северо-восточного побережья Японии – C. amblystomopsis. В начале плейстоцена через открывшиеся проливы произошла взаимная миграция этих видов в ареалы друг друга. Проникший через Корейский пролив в южную часть Японского моря C. reinii, в наибольшей степени сохранивший амфидромные черты, после последующего закрытия пролива обособился в Японском море до уровня нового вида C. pollux.
Масштабные широтные миграции фаун эпохи оледенений второй половины плейстоцена привели к значительной географической и временной изоляции способных к миграциям амфидромных популяций бычков-подкаменщиков от их жилых популяций. В результате изолированные в реках наиболее южной части своих ареалов жилые популяции C. hangiongensis дивергировали до уровня C. koreanus, а жилые популяции C. amblystomopsis обособились в C. nozawae. Результатом изменения условий обитания в Японском море после закрытия Корейского пролива в течение предпоследнего и последнего оледенений стало образование видами C. reinii и C. pollux пресноводных форм в верхнем и среднем течении рек.
Пресноводные подкаменщики материкового побережья Японского и Охотского морей проникли на границе плиоцена и плейстоцена из бассейна р. Лена в р. Амур, где сформировался С. szanaga, от которого в плейстоцене после перехвата реками побережья Японского моря верховьев рек амурского бассейна обособился C. volki.
Проведенный анализ показал, что биоразнообразие бычков-подкаменщиков юга Дальнего Востока формировалось со второй половины миоцена из трех источников: бычков автохтонного приазиатского вида, произошедшего от него в Полярном бассейне амфидромного вида и из подкаменщиков группы С. poecilopus, мигрировавших из Голарктики в бассейн Амура.
Список литературы
Андрияшев А.П. Об амфипацифическом (Японо-Орегонском) распространении морской фауны в северной части Тихого океана // Зоол. журн. 1939. Т. 18. № 2. С. 181–195.
Берг Л.С. Рыбы пресных вод СССР и сопредельных стран. М.; Л.: Изд-во АН СССР. 1949. Ч. 3. С. 935–1381.
Гладенков А.Ю., Гладенков Ю.Б. Начало формирования межокеанических связей Пацифики и Арктики через Берингов пролив в неогене // Стратиграфия, геол. корреляция. 2004. Т. 12. № 2. С. 72–89.
Гладенков Ю.Б., Баженова О.К., Гречин В.И. и др. Кайнозой Сахалина и его нефтегазоносность. М.: ГЕОС. 2002. 222 с.
Карасев Г.Л. Рыбы Забайкалья. Новосибирск: Наука. 1987. 295 с.
Короткий А.М. Перестройки речной сети в Приморье: причины, механизмы и влияние на геоморфологические процессы // Геоморфология. 2010. № 2. С. 78–91.
Короткий А.М., Гребенникова В.А., Пушкарь В.С. и др. Климатические смены на территории юга Дальнего Востока в позднем кайнозое (миоцен−плейстоцен). Владивосток: Тихоокеан. ин-т географии ДВО РАН. 1996. 56 с.
Короткий А.М., Пушкарь В.С., Гребенникова В.А. Морские террасы и четвертичная история шельфа Сахалина. Владивосток: Дальнаука. 1997. 194 с.
Лисицын А.П. Палеоокеанология / Океанология. Геология океана. Геологическая история океана. М.: Наука. 1980. С. 386–405.
Парпура И.З. О происхождении ихтиофауны рек северного Приморья // Вопр. ихтиологии. 1989. Т. 29. № 3. С. 506–508.
Плетнев С.П. Историко-геологическое развитие острова Сахалин // Растительный и животный мир острова Сахалин. Владивосток: Дальнаука. 2004. С. 11–22.
Плетнев С.П. Палеоокеанология Японского моря на раннем этапе развития // Геология и полезные ископаемые Мирового океана. 2015. № 2. С. 159–169.
Пушкарь В.С., Черепанова М.В. Диатомеи плиоцена и антропогена Северной Пацифики: стратиграфия и палеоэкология. Владивосток: Дальнаука. 2001. 228 с.
Савельев П.А., Золотухин С.Ф., Канзепарова А.Н. О нахождении амурской широколобки Mesocottus haitej и амурского подкаменщика Cottus szanaga (Cottidae) в бассейне р. Тугур (Хабаровский край) // Вопр. ихтиологии. 2017. Т. 57. № 4. С. 481–484.
Савельев П.А., Колпаков Е.В. Морфологическое описание, внутривидовая изменчивость и родственные связи подкаменщика Черского Cottus czerskii (Cottidae) // Вопр. ихтиол. 2018. Т. 58. № 2. С. 144–153.
Сафронов С.Н., Никифоров С.Н. Список рыбообразных и рыб пресных и солоноватых вод Сахалина // Вопр. ихтиологии. 2003. Т. 43. № 1. С. 42–53.
Свиточ А.А., Талденкова Е.Е. Новейшая история Берингова пролива // Океанология. 1994. Т. 34. № 3. С. 439–443.
Сиделева В.Г. Отр. XIII Scorpaeniformes – Скорпенообразные. Подотряд Cottoidei. Сем. 31. Cottidae – Керчаковые // Атлас пресноводных рыб России. Вып. 2. М.: Наука. 2003. С. 144–215.
Цой И.Б., Терехов Е.П., Горовая М.Т. и др. Кайнозойское осадконакопление на западном склоне южно-охотской котловины Охотского моря // Тихоокеан. геол. 2003. Т. 22. № 4. С. 19–34.
Шапошникова Г.Х. История расселения сигов рода Coregonus // Зоогеография и систематика рыб. Л.: Изд-во Зоол. ин-та АН СССР. 1976. С. 54–67.
Шкатова В.К., Грундан Е.Л. Совершенствование стратиграфических схем неогена и квартера регионов России в объеме 3.6–1.8 млн лет // Постановления межведомственного стратиграфического комитета и его постоянных комиссий. 2019. Вып. 46. С. 21–25.
Baek S.Y., Kang J.H., Jo S.H. et al. Contrasting life histories contribute to divergent patterns of genetic diversity and population connectivity in freshwater sculpin fishes // BMC Evol. Biol. 2018. V. 18. Art. ID 52. https://doi.org/10.1186/s12862-018-1171-8
Balakirev E.S., Saveliev P.A., Ayala F.J. Complete mitochondrial genomes of the Cherskii’s sculpin Cottus czerskii and Siberian taimen Hucho taimen reveal GenBank entry errors: Incorrect species identification and recombinant mitochondrial genome // Evol. Bioinf. 2017. V. 13. P. 1–7.
Douglas R.G., Savin S.M. Oxygen and carbon isotope analyses of Cretaceous and Tertiary foraminifera from the central North Pacific // Initial Reports of the Deep Sea Drilling Project. Winterer E.L. (Eds). Washington, DC: US Government Printing Office. 1973. V. 17, ch. 20. P. 591–605.
Eschmeyer W.N., Herald E.S. Field guide to Pacific coast fishes of North America: From the Gulf of Alaska to Baja California. Boston: Houghton Mifflin. 1983. 336 p.
Gladenkov A.Yu., Oleinik A.E., Marincovich L., Jr., Barinov K.B. A refined age for the earliest opening of Bering Strait // Palaeogeogr., Palaeoclimatol., Palaeoecol. 2002. V. 183. P. 321–328.
Goto A. Alternative life-history styles of Japanese freshwater sculpins revisited // Environ. Biol. Fishes. 1990. V. 28. P. 101–112.
Goto A., Arai T. Migratory histories of three types of Cottus pollux (small-egg, middle-egg, and large-egg types) as revealed by otolith microchemistry // Ichthyol. Res. 2003. V. 50. № 1. P. 0067–0072.
Goto A., Yokoyama R., Sideleva V.G. Evolutionary diversification in freshwater sculpins (Cottoidea): a review of two major adaptive radiations // Environ. Biol. Fishes. 2015. V. 98. № 1. P. 307–335.
Goto A., Yokoyama R., Yamada M. A fluvial population of Cottus pollux (middle-egg type) from the Honmyo River, Kyushu Island, Japan // Ichthyol. Res. 2002. V. 49. № 4. P. 318–323.
Itaki T. Transitional changes in microfossil assemblages in the Japan Sea from the Late Pliocene to Early Pleistocene related to global climatic and local tectonic events // Prog. Earth Planet. Sci. 2016. V. 3. Art. ID 11. https://doi.org/10.1186/s40645-016-0087-4
Jones A.C. The biology of the euryhaline fish Leptocottus armatus Girard (Cottidae) // Univ. Calif. Publ. Zool. 1962. V. 67. № 4. P. 321–367.
Kitamura A., Kimoto K. History of the inflow of the warm Tsushima Current into the Sea of Japan between 3.5 and 0.8 Ma // Palaeogeogr., Palaeoclimatol., Palaeoecol. 2006. V. 236. № 3–4. P. 355–366.
Marincovich L., Jr., Gladenkov A.Y. New evidence for the age of Bering Strait // Quat. Sci. Rev. 2001. V. 20. P. 329–335.
Matsuzaki K.M., Itaki T., Tada R., Kamikuri S. Paleoceanographic history of the Japan Sea over the last 9.5 million years inferred from radiolarian assemblages (IODP Expedition 346 Sites U1425 and U1430) // Prog. Earth Planet. Sci. 2018. V. 5. Art. ID 54. https://doi.org/10.1186/s40645-018-0204-7
Miller D.J., Lea R.N. Guide to the coastal marine fishes of California // Fish Bulletin 157. Sacramento: Calif. Department of Fish and Game. 1972. 235 p.
Morrow J.E. The freshwater fishes of Alaska. Anchorage: Alaska Northwest Publishing Company. 1980. 248 p.
Moyle P.B. Inland fishes of California. Berkeley: Univ. of California Press. 1976. 405 p.
Nakabo T. Cottidae // Fishes of Japan with pictorial keys to the species. Tokyo: Tokai Univ. Press. 2002. P. 628–650.
Onikura N., Takeshita N., Matsui S., Kimura S. Distribution area and optimum salinity of larvae and juveniles of Trachidermus fasciatus, Cottidae // Nippon Suisan Gakkaishi. 1999a. V. 65. P. 42–47 (in Japanese with English abstract).
Onikura N., Takeshita N., Matsui S., Kimura S. Growth and migration of the roughskin sculpin, Trachidermus fasciatus, in the Kashima River, Kyushu Island, Japan // Jpn. J. Ichthyol. 1999b. V. 46. № 1. P. 31–37 (in Japanese with English abstract).
Onikura N., Takeshita N., Matsui S., Kimura S. Spawning grounds and nests of Trachidermus fasciatus (Cottidae) in the Kashima and Shiota estuaries system facing Ariake Bay, Japan // Ichthyol. Res. 2002. V. 49. № 2. P. 198–201.
Takeshita N., Matsui S., Onikura N., Kimura S. The effect of salinity on the viability of eggs of the roughskin sculpin Trachidermus fasciatus // Fish. Sci. 1995. V. 61. № 5. P. 888–889.
Takeshita N., Onikura N., Nagata S. et al. A note on the reproductive ecology of the catadromous fourspine sculpin, Cottus kazika (Scorpaeniformes: Cottidae) // Ichthyol. Res. 1999. V. 46. № 3. P. 309–313.
Takita T., Chikamoto H. Distribution and life history of Trachidermus fasciatus in rivers around Ariake Sound, Kyushu, Japan // Jpn. J. Ichthyol. 1994. V. 41. № 2. P. 123–129 (In Japanese with English abstract).
Tsukagoshi H., Sakai K., Yamamoto K., Goto A. Non-indigenous amphidromous sculpin Cottus pollux small-egg type (Teleostei: Cottidae) detected in rivers entering the Sea of Japan off Honshu Island, Japan // Ichthyol. Res. 2013. V. 60. № 1. P. 93–97.
Wang J., Chen G. The historical variance and causes of geographical distribution of a roughskin sculpin (Trachidermus fasciatus Heckel) in Chinese territory. Acta Ecol. Sin. 2010. V. 30. P. 6845–6853 (in Chinese with English abstract).
Yamamoto S. Genetic population structure of Japanese river sculpin Cottus pollux (Cottidae) large-egg type, inferred from mitochondrial DNA sequences // J. Fish Biol. 2019. V. 94. № 2. P. 325–329.
Yokoyama R., Sideleva V.G., Shedko S.V., Goto A. Broad-scale phylogeography of the Palearctic freshwater fish Cottus poecilopus complex (Pisces: Cottidae) // Mol. Phylogenet. Evol. 2008. V. 48. № 3. P. 1244–1251.
Yoshigou H. The morphological variations and distributions of the Cottus pollux species complex (Ostichthyes, Scorpaeniformes, Cottidae) in the Hiroshima Prefecture, Japan // Misc. Rep. Hiwa Mus. Nat. Hist. 2010. V. 51. P. 255–275.
Zachos J., Pagani M., Sloan L. et al. Trends, rhythms, and aberrations in global climate 65 Ma to present // Science. 2001. V. 292. P. 686–693.
Дополнительные материалы отсутствуют.
Инструменты
Биология моря


