Биология моря, 2022, T. 48, № 3, стр. 171-179
Вододвигательная активность беломорской губки Halichondria panicea (Pallas, 1766) (Porifera: Demospongiae)
В. В. Халаман 1, *, П. А. Лезин 1
1 Зоологический институт РАН
199034 Санкт-Петербург, Россия
* E-mail: VKhalaman@gmail.com
Поступила в редакцию 08.11.2021
После доработки 31.01.2022
Принята к публикации 04.03.2022
- EDN: PASAXJ
- DOI: 10.31857/S0134347522030056
Аннотация
В лабораторных условиях оценена вододвигательная активность беломорской губки Halichondria panicea (Pallas, 1766) (Porifera: Demospongiae). Масса использованных в эксперименте живых особей составляла 3.5–35.5 г; они имели от одного до восьми оскулюмов. Вододвигательную активность губки определяли как сумму вододвигательной активности всех оскулюмов, которую рассчитывали как произведение максимальной скорости исходящего из оскулюма потока воды на площадь поперечного сечения данного оскулюма. Скорость измеряли с помощью микротермисторного датчика. Показано, что вододвигательная активность губки и ее масса связаны степенной зависимостью с показателем степени около 3. Особи губки массой 25 г и более по вододвигательной активности превосходят таких солитарных животных, как двустворчатые моллюски Mytilus edulis, Hiatella arctica и асцидия Styela rustica, у которых данная зависимость носит линейный или степенной характер с показателем степени меньше 1. Преимущество губки над солитарными организмами, вероятно, определяется ее модульной организацией, которая по мере роста особи обеспечивает постоянное увеличение числа и размера оскулюмов, а также, возможно, ведет к периодической перестройке ирригационной системы.
В Северной Атлантике и Пацифике губка Hali-chondria panicea (Pallas, 1766) – один из широко распространенных видов в эпибентосных сообществах, формирующихся как на естественных, так и на искусственных субстратах (Плоткин и др., 2005; Ходаковская, 2005; Халаман, Комендантов, 2011; Hoare, Peattie, 1979; Barthel, 1986; Knowlton, Highsmith, 2000; Dijkstra et al., 2007). Этот вид губок встречается также в Средиземном море и Индийском океане (Erpenbeck et al., 2004; Purushottama et al., 2009).
Известно, что H. panicea характеризуется высокой скоростью роста (Thomassen, Riisgård, 1995; Leichter, Witman, 1997), устойчивостью к эпибиозу (Barthel, Wolfrath, 1989) и значительной эврибионтностью, обитая не только в сублиторали, но и на литорали (Ересковский, 1994; Knowlton, Highsmith, 2000). Кроме того, H. panicea обладает токсическими свойствами (Dyrynda, 1983; Халаман и др., 2008, 2014, 2017), которые, по-видимому, обеспечиваются симбиотическими бактериями (Althoff et al., 1998; Kobayashi, Kitagawa, 1998; Schneemann et al., 2010). Все это позволяет говорить о H. panicea как о высоко конкурентном экологически агрессивном организме. Однако конкурентные потенции эпибентосных организмов обеспечиваются не только этими свойствами. Одним из важных аспектов конкурентных отношений между седентарными животными-фильтраторами является борьба за пищу (Zajac et al., 1989; Lesser et al., 1992; Dalby, Young, 1993; Leblanc et al., 2003; Daigle, Herbinger, 2009; Comeau et al., 2015). В то же время некоторые авторы считают, что межвидовая пищевая конкуренция в эпибентосных сообществах не является определяющей из-за избытка пищи в планктоне или различий в спектрах питания (Stuart, Klumpp, 1984; Lohse, 2002; Dubois et al., 2007), однако необходимо учитывать и эту сторону взаимоотношений. Конкурентные возможности фильтраторов складываются из таких показателей, как эффективность осаждения взвеси, ее усвояемость, перекрывание пищевого спектра и особенности поведенческих реакций. Способность перехватывать водные потоки, напрямую зависящая от вододвигательной активности животного, является важнейшим механизмом в пищевой конкуренции (Troost et al., 2009).
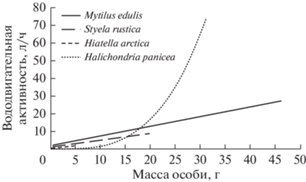
Исследования наиболее массовых видов животных, образующих основу многолетних сообществ обрастания в Кандалакшском заливе Белого моря, позволили ранжировать их в порядке убывания вододвигательной активности: мидия Mytilus edulis ‒ одиночная асцидия Styela rustica ‒ двустворчатый моллюск Hiatella arctica (Лезин и др., 2006). Такая последовательность хорошо соотносится с положением, которое занимает каждый из указанных видов в сообществах обрастания: доминирующие виды ‒ M. edulis и S. rustica, субдоминант ‒ H. arctica (Ошурков, 2000; Халаман, 2001). В настоящей работе изучена вододвигательная активность губки H. panicea, также играющей заметную роль в сообществах обрастания Белого моря (Халаман, Комендантов, 2011). Поскольку конкурентные возможности H. panicea достаточно велики (Халаман, Комендантов, 2016), в качестве проверяемой гипотезы мы предположили, что вододвигательная активность H. panicea превышает таковую мидии M. edulis и асцидии S. rustica, беломорские представители которых ранее уже были оценены по этому показателю (Лезин и др., 2006).
МАТЕРИАЛ И МЕТОДИКА
Исследование выполнено на Беломорской биологической станции “Мыс Картеш” Зоологического института РАН, расположенной в губе Чупа Кандалакшского залива Белого моря (66°20.230′ N; 33°38.972′ E). Тестируемые животные были собраны в окрестностях станции c обрастаний канатов на глубине 1.0‒2.5 м. Губок аккуратно отделяли от субстрата и перед началом тестирования для акклимации к лабораторным условиям на 2 сут помещали в проточные 10-литровые аквариумы с интенсивной аэрацией. Использовали естественную морскую воду (соленость 24‰, температура 10°С). Поскольку вододвигательная активность организмов-фильтраторов зависит от температуры воды (Riisgård et al., 2016; Черняев и др., 1998), эксперименты с животными проводили при постоянной температуре 10°С. Всего было собрано и протестировано 20 особей (сырая масса от 3.5 до 35.5 г), имевших от одного до восьми оскулюмов.
Расход воды (вододвигательная активность) для одной особи определяли как сумму расхода воды всех обнаруженных у нее оскулюмов. Расход воды отдельного оскулюма определяли как произведение скорости истекающей из него воды на площадь поперечного сечения оскулюма. Скорость воды определяли с помощью установки, разработанной на основе системы, предложенной для измерения скорости потока жидкости (Riedl, Machan, 1972; LaBarbera, Vogel, 1976). Принцип работы прибора заключается в измерении сопротивления термисторного датчика, нагреваемого постоянным током. Находящийся в потоке термистор охлаждается за счет движения жидкости пропорционально скорости потока (Riedl, Machan, 1972). В качестве измерительного элемента в приборе использовали микротермисторный датчик МТ-54 (сопротивление 2.5 кОм), который был включен в несимметричный резисторный мост, подключенный к измерительному прибору (Лезин и др., 2006).
Перед началом работы прибор калибровали, искусственно создавая потоки воды с разной скоростью. Для этой цели использовали набор бюреток с известным расходом. Полученные значения падения напряжения на выходе моста (разность напряжений в спокойной воде и потоке) использовали для построения калибровочной кривой вида:
где V – скорость потока воды (мм/с), ΔU – падение напряжения (мВ).При измерении вододвигательной активности датчик помещали в центре потока воды из оскулюма на возможно близком от него расстоянии и последовательно регистрировали не менее 10 показаний. Для анализа использовали максимальное значение из каждой серии измерений. На основе полученных значений скорости потока воды вычисляли расход воды по формуле:
где E – расход воды (л/ч); V – скорость потока воды (мм/ч); Ss – площадь сечения оскулюма (мм2), которую рассчитывали как площадь круга. Диаметр каждого оскулюма измеряли под бинокулярной лупой с помощью окуляр-микрометра сразу после регистрации максимальной скорости воды, истекающей из данного оскулюма. После всех измерений определяли сырую массу губок, взвешивая их на электрических весах ВЛКТ-500 с точностью до 0.1 г. Предварительно животных подсушивали на фильтровальной бумаге до прекращения выделения воды из тела.Помимо вододвигательной активности (E) рассчитывали интенсивность вододвигательной активности (удельную вододвигательную активность, I) − количество прокачанной животным воды в единицу времени, отнесенное к единице массы особи. Кроме того, рассчитывали показатели “производительности” оскулюмов: отношение суммарной вододвигательной активности к суммарной площади сечений всех оскулюмов и отношение интенсивности вододвигательной активности к суммарной площади всех оскулюмов.
Математическая обработка данных выполнена с помощью пакетов программ StatSoft Statistica 7 и OriginLab OriginPro 9.0. В тексте и таблицах в качестве показателя варьирования признака (если это не оговорено) указана ошибка среднего.
РЕЗУЛЬТАТЫ
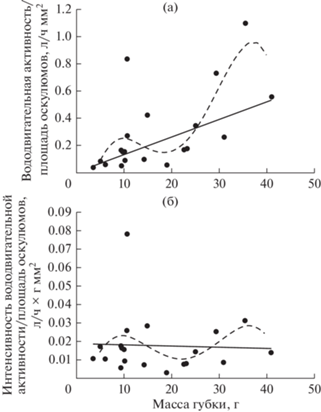
Зависимости общей вододвигательной активности и интенсивности вододвигательной активности от массы тела у Halichondria panicea наилучшим образом описываются показательной E(I) = abW или аллометрической (степенной) E(I) = aWb функциями, где E – вододвигательная активность, л/ч; I – интенсивность вододвигательной активности, л/ч × г; W – масса особи, г; a и b – коэффициенты уравнения (рис. 1, табл. 1). При этом вододвигательная активность и интенсивность вододвигательной активности были приблизительно одинаковы у губок с массой тела до 20 г. Значительное увеличение этих показателей наблюдалось у особей, масса которых превышала 20 г. Повышение общей вододвигательной активности губки обеспечивается увеличением общей площади поперечного сечения оскулюмов, которая складывается из увеличения количества и размеров оскулюмов. Связь этих параметров с массой губки может быть описана линейной зависимостью (рис. 2, табл. 2).
Рис. 1.
Зависимость вододвигательной активности (а) и интенсивности вододвигательной активности (б) у Halichondria panicea от массы тела. Точки – эмпирические данные; линии – расчетные линии регрессии: сплошная линия – аллометрическая (степенная) функция, пунктирная линия – показательная функция.
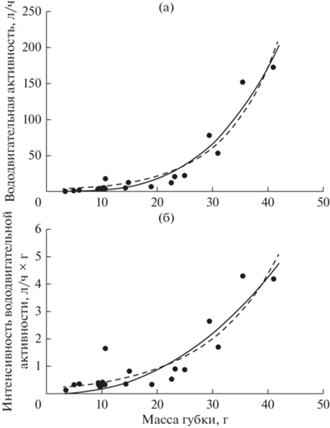
Таблица 1.
Параметры уравнений нелинейной регрессии между вододвигательной активностью (E, л/ч)/интенсивностью вододвигательной активности (I, л/ч × г) и массой тела (W, г) у губки Halichondria panicea
| Вид | Показательная функция, E(I) = abW | Аллометрическая (степенная) функция, E(I) = aWb | n | ||||
|---|---|---|---|---|---|---|---|
| a | b | R2 | a | b | R2 | ||
| Вододвигательная активность, E | 2.6 ± 1.01 | 1.11 ± 0.011 | 0.91 | 0.00078 ± 0.000958 | 3.3 ± 0.34 | 0.93 | 20 |
| Интенсивность вододвигательной активности, I | 0.19 ± 0.1066 | 1.08 ± 0.01 | 0.82 | 0.0009 ± 0.00121 | 2.3 ± 0.37 | 0.80 | 20 |
Рис. 2.
Зависимость общей площади сечения оскулюмов (а), количества оскулюмов (б) и средней площади оскулюмов (в) от массы губки Halichondria panicea. Точки – эмпирические данные, пунктирные линии – расчетные линии регрессии.
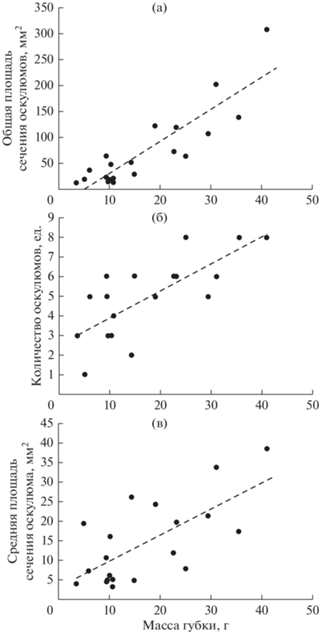
Таблица 2.
Параметры уравнения линейной регрессии (y = a + bx) зависимости числа оскулюмов (Nos), средней площади (Sos) и общей площади (S) поперечного сечения выходного отверстия оскулюмов от массы тела губки Halichondria panicea
| Вид | а | b | R2 | n |
|---|---|---|---|---|
| Nos | 2.5 ± 0.57 | 0.14 ± 0.028 | 0.57 | 20 |
| Sos | 3.2 ± 3.33 | 0.7 ± 0.17 | 0.47 | 20 |
| S | –30 ± 16 | 6.1 ± 0.79 | 0.77 | 20 |
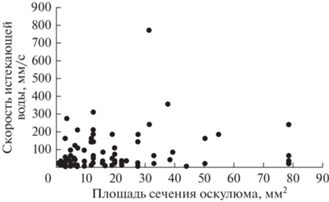
Вместе с тем какой-либо общей зависимости между площадью отдельного оскулюма и максимальной скоростью истекающей из него воды выявить не удалось (рис. 3). Скорость воды, истекающей из оскулюмов, варьировала в широких пределах от 2 до 773 мм/с и в среднем составляла 71 ± 10 мм/с. Медиана (30 мм/с) была меньше среднего значения, поскольку большинство протестированных оскулюмов имело относительно низкие или умеренные потоки. При этом скорость воды, исходящей из разных оскулюмов одной и той же особи, не была одинаковой. У семи из 20 протестированных особей обнаружена статистически значимая положительная корреляция между площадью сечения оскулюма и скоростью истекающей из него воды (r = 0.74–0.99). У остальных особей корреляция была статистически недостоверной, в том числе у четырех особей – отрицательной.
Рис. 3.
Зависимость между площадью поперечного сечения оскулюма (мм2) и максимальной скоростью истекающей из него воды (мм/с).
Заслуживает внимания характер зависимости эффективности оскулюмов (вододвигательной активности губки, отнесенной к площади всех оскулюмов) и удельной эффективности оскулюмов (интенсивности вододвигательной активности губки, отнесенной к площади всех оскулюмов) от массы губки (рис. 4). Первый показатель растет с увеличением массы губки, что наилучшим образом можно описать линейной регрессией. Однако точность такой аппроксимации невелика, коэффициент детерминации составляет лишь 0.32. Второй показатель можно считать константным, не зависящим от массы губки. В то же время при средней величине 0.017 ± 0.0036 для всех протестированных нами губок он флуктуирует в значительных пределах − от 0.0029 до 0.078. Возможно, данные зависимости не являются монотонными функциями. Расположение точек на графиках позволяет предполагать наличие двух максимумов. Первый максимум отмечен при массе губки около 10 г, а второй – при массе особи 30 г. Для лучшей визуализации на графиках (рис. 4) эти максимумы описаны полиномом четвертой степени.
Рис. 4.
Зависимость эффективности оскулюмов (вододвигательной активности, отнесенной к площади всех оскулюмов) (а) и удельной эффективности оскулюмов (интенсивности вододвигательной активности губки, отнесенной к площади всех оскулюмов) (б) от массы губки. Точки – эмпирические данные; линии – расчетные линии регрессии: сплошная линия – линейная зависимость, пунктирная – полиномиальная 4-го порядка.
Представленные зависимости вододвигательной активности фильтраторов, доминирующих в сообществах обрастания в Белом море, от массы их тела (рис. 5) показывают, что особи H. panicea массой до 15−20 г по этой характеристике не превосходят своих конкурентов – двустворчатых моллюсков Mytilus edulis, Hiatella arctica и асцидию Styela rustica, имеющих такую же массу тела, или даже уступают им. Однако более крупные губки по вододвигательной активности значительно превосходят солитарные организмы-фильтраторы.
ОБСУЖДЕНИЕ
Известно, что вододвигательная активность губок – величина непостоянная, зависящая от внешних условий: температуры и скорости течения воды (Reiswig, 1971; Hadas et al., 2008; Riisgård et al., 2016). Кроме того, у губок может наблюдаться периодическое краткосрочное снижение вододвигательной активности, не связанное с факторами внешней среды (Reiswig, 1971; Kumala et al., 2017). Согласно методике регистрации вододвигательной активности губок, использованной в нашем исследовании, для каждого отдельного оскулюма и, следовательно, для всей особи в целом регистрировался максимально возможный уровень этой активности.
Полученные нами данные противоречат утверждению некоторых авторов, что у Halichondria panicea скорость воды, истекающей из оскулюма, – величина постоянная, равная 23 ± 1.3 (доверительный интервал) мм/с (Kumala et al., 2017). Согласно нашим измерениям, скорость истекающей воды варьирует от 2 до 773 мм/с. Поэтому константной ее можно считать лишь в том узком смысле, что она не зависит от площади сечения оскулюма (рис. 3). На наш взгляд, различия в оценках вызваны тем, что цитируемые авторы скорость воды определяли косвенным способом − как отношение фильтрационной активности, установленной по степени осветления воды, к площади сечения оскулюма (Kumala et al., 2017). Нами применено прямое определение скорости течения. Вероятно, важен и тот факт, что в экспериментах мы использовали как однооскулюмных, так и многооскулюмных особей.
Данные авторы (Kumala et al., 2017) указывают, что скорость фильтрации однооскулюмных эксплантов, на которых они проводили исследование, составляла 0.28 ± 0.06 (доверительный интервал) мл/мин. Согласно нашим результатам, такой вододвигательной активностью должны обладать особи массой около 2.5 г, что приблизительно соответствует размерам особей, указанным в цитируемой работе. При определении скорости истекающей воды у однооскулюмных эксплантов H. panicea с помощью видеосъемки (Goldstein et al., 2019) было показано, что скорость варьировала в достаточно широких пределах от 5.9 до 53 мм/с, что соответствует нашим данным. Вместе с тем цитируемые авторы установили, что между скоростью истекающей воды и площадью сечения оскулюма существует положительная связь, описываемая степенной функцией: U0 = 2.59OSA0.45 (R2 = 0.55), где U0 – скорость течения воды, мм/с; OSA – площадь поперечного сечения оскулюма, мм2. Используя преимущественно многооскулюмных особей, мы не нашли убедительных доказательств существования связи между этими параметрами. По-видимому, данная зависимость хорошо прослеживается у однооскулюмных особей, представляющих единый водоносный модуль, тогда как у многооскулюмных особей она выражена менее четко из-за более сложной многомодульной ирригационной системы.
Томассен и Риисгорд (Thomassen, Riisgård, 1995) установили, что скорость фильтрации H. panicea описывается аллометрическим уравнением: F = 28.35DW 0.914, где F – скорость фильтрации, мл/мин; DW – масса сухой губки, г. Поскольку показатель степени близок к единице, эта зависимость является практически линейной. Согласно нашим данным, связь между вододвигательной активностью и массой губки также описывается аллометрической зависимостью, но с показателем степени около 3, и функция нелинейная. Для особей с сырой массой до 10 г оценки фильтрационной активности H. panicea, данные нами, а также Томассеном и Риисгордом (Tho-massen, Riisgård, 1995), близки, однако для губок с большей массой они существенно расходятся, что, на наш взгляд, и в этом случае определяется разными методологическими подходами в определении вододвигательной активности. Как уже сказано, оценки, полученные нами, отражают максимально возможную вододвигательную активность особи. Томассен и Риисгорд (Thomassen, Riisgård, 1995) оценивали вододвигательную активность по степени осветления воды от взвеси. При таком косвенном способе оценки результат отражает единовременную работу всей ирригационной системы губки. Однако во время тестирования некоторые оскулюмы могут оказаться в неактивном состоянии из-за присущего им свойства периодически открываться и закрываться, в том числе реагируя на различные внешние воздействия (Hartman, Reiswig, 1973; Riisgård et al., 2016). И чем большее количество оскулюмов у особи, тем выше вероятность занижения результатов. Кроме того, оценка вододвигательной активности по степени осветления воды зависит от качества частиц, используемых для этой цели, в связи с чем данный метод был подвергнут критике (Frost, 1978).
Как отмечено выше, Гольдштейн с соавторами (Goldstein et al., 2019) определяли скорость воды, истекающей из оскулюма, с помощью видеосъемки, что можно считать прямым способом измерения. Однако эти авторы рассчитали, что зависимость между вододвигательной активностью и объемом однооскулюмной губки H. panicea носит линейный характер: F ≈ 2.3 × Vs, где F – вододвигательная активность, мл/мин, а Vs – объем губки, см3. Это противоречит результатам наших исследований, которые свидетельствуют о том, что такая зависимость имеет степенной или аллометрический характер. Расхождение может быть вызвано следующим. Полученная нами зависимость между средней площадью оскулюмов и массой губки линейная, тогда как Гольдштейн с соавторами (Goldstein et al., 2019) описывают ее как параболическую: OSA = 1.31 × Vs0.66, где OSA – площадь оскулюма (мм2), а Vs – объем губки (см3). Именно это определяет линейный характер полученной ими зависимости между объемом губки и вододвигательной активностью. Мы провели расчеты, используя данные Гольдштейн с соавторами (Goldstein et al., 2019). Связь между площадью оскулюмов и объемом губки лучше описывается линейной функцией: OSA = 1.33 × Vs + 0.19. Коэффициент детерминации для линейной функции составляет 0.83, тогда как для параболической – 0.66. Остается только догадываться, почему цитируемые авторы использовали именно параболическую функцию. Скорее всего, это связано с тем, что она хорошо подходила под теоретические построения авторов, связанные с характером расположения хоаноцитных камер у губки H. panicea (см.: Goldstein et al., 2019). Заметим, что в работе, выполненной на 20 видах как однооскулюмных, так и многооскулюмных Demospongiae (см.: Morganti et al., 2021), показано, что объем губки и площадь ее оскулюмов связаны аллометрической зависимостью с показателем степени от 0.6 до 1.0 у разных видов. Возможно, в пределах однооскулюмных индивидуумов математическая модель, предложенная Гольдштейн с соавторами (Goldstein et al., 2019), работает удовлетворительно, но она непригодна для многооскулюмных особей H. panicea. Безусловно, однооскулюмные экспланты H. panicea – это относительно простая и удобная биологическая модель для исследований фильтрационной активности губок, однако полученные на однооскулюмных особях закономерности нельзя полностью экстраполировать на многооскулюмных животных.
Как следует из сравнения вододвигательной активности животных-обрастателей (рис. 5), экземпляры H. panicea массой менее 15 г обладают умеренной вододвигательной активностью, а особи массой 25 г и более по этому показателю превосходят самых крупных мидий и в Белом море оказываются вне конкуренции в мелководных сообществах обрастания. Особи массой 40 г прокачивают около 150 л воды в час. Вероятно, столь мощная вододвигательная активность наряду с токсичностью (Dyrynda, 1983; Kobayashi, Kitagawa, 1998; Халаман и др., 2008, 2014, 2017) и высокими темпами соматического роста (Barthel, 1986; Tho-massen, Riisgård, 1995) вносит свой вклад в высокую конкурентную способность H. panicea (Халаман, Комендантов, 2016).
Превосходство H. panicea в вододвигательной активности над конкурентами обусловлено тем, что эта характеристика и масса тела губки связаны степенной зависимостью с показателем степени больше единицы. У двустворчатых моллюсков Mytilus edulis и Hiatella arctica и у асцидии Styela rustica эта же зависимость описывается функциями с показателем степени меньше единицы (Sukhotin et al., 2003; Sejr et al., 2004) или равным единице (Лезин и др., 2006). Особенность H. panicea можно объяснить ее модульной организацией, дающей губке преимущества перед солитарными организмами, развитие фильтрационного аппарата которых ограничено (Marfenin, 1997; Ересковский, 2003).
По мере роста губки не только увеличиваются число, а также средняя и общая площадь сечения оскулюмов, но, по-видимому, периодически перестраивается и ирригационная система губки. Перестройка наступает, когда производительность системы достигает некоего максимума. На это указывает характер зависимости “производительности” оскулюмов от массы губки, которая, в отличие от числа и общей площади оскулюмов (рис. 2), представляет не монотонную функцию, а смену минимумов и максимумов (рис. 4). Полученные нами данные позволяют предполагать, что перестройка ирригационной системы происходит у особей H. panicea, достигших массы около 20 г. Безусловно, данная гипотеза нуждается в дальнейшей проверке. Однако А.С. Плоткин с соавторами (1999), анализируя морфометрические параметры беломорской губки Polymastia mammillaris, пришли к аналогичному выводу: “Складывается впечатление, что P. mammillaris в процессе роста может решать задачи внутренней гидродинамики как путем увеличения числа ирригационных модулей, так и совершенствованием ирригационной системы уже существующих модулей” (Плоткин и др., 1999, с. 25–26).
Список литературы
Ересковский А.В. Некоторые закономерности обитания и распределения губок на литорали Восточного Мурмана // Зоол. журн. 1994. Т. 73. № 4. С. 5–17.
Ересковский А.В. Проблема колониальности, модулярности и индивидуальности губок и особенности их морфогенезов при росте и бесполом размножении // Биол. моря. 2003. Т. 29. № 1. С. 3–12.
Лезин П.А., Агатьева Н.А., Халаман В.В. Сравнительное исследование вододвигательной активности некоторых животных-обрастателей из Белого моря // Биол. моря. 2006. Т. 32. № 4. С. 286–290.
Плоткин А.С., Ересковский А.В., Халаман В.В. Анализ модульной организации Porifera на примере беломорской губки Polymastia mammillaris (Muller, 1806) (Demospongiae, Tetractinomorpha) // Журн. общ. биол. 1999. Т. 60. № 1. С. 18–28.
Плоткин А.С., Раилкин А.И., Герасимова Е.И. и др. Сообщества подводных скал сублиторали Белого моря: структура и взаимодействие с придонным течением // Биол. моря. 2005. Т. 31. № 6. С. 398–405.
Ошурков В.В. Сукцессии и динамика эпибентосных сообществ верхней сублиторали бореальных вод. Владивосток: Дальнаука. 2000. 206 с.
Халаман В.В. Сообщества обрастания мидиевых установок в Белом море // Биол. моря. 2001. Т. 27. № 4. С. 268–278.
Халаман В.В., Беляева Д.В., Флячинская Л.П. Влияние экскреторно-секреторных продуктов некоторых животных-обрастателей на оседание и метаморфоз личинок Styela rustica (Ascidiae) // Биол. моря. 2008. Т. 34. № 3. С. 200–204.
Халаман В.В., Корчагина Н.М., Комендантов А.Ю. Воздействие веществ, выделяемых во внешнюю среду особями своего и чужого видов, на личинок Halichondria panicea Pallas, 1766 (Porifera: Demospongiae) // Биол. моря. 2014. Т. 40. № 1. С. 38–45.
Халаман В.В., Комендантов А.Ю. Структура сообществ обрастания, образованных Halichondria panicea (Porifera: Demospongiae) в Белом море // Экология. 2011. № 6. С. 449–458.
Халаман В.В., Комендантов А.Ю. Экспериментальная проверка способности губки Halichondria panicea (Porifera: Demospongiae) конкурировать за субстрат в мелководных сообществах обрастания Белого моря // Изв. РАН. Сер. биол. 2016. № 1. С. 81–87.
Халаман В.В., Шаров А.Н., Холодкевич С.В. и др. Влияние беломорской губки Halichondria panicea (Pallas, 1766) на физиологическое состояние мидий Mytilus edulis Linnaeus, 1758, оцениваемое по характеристикам кардиоритма // Журн. эвол. биохим. и физиол. 2017. Т. 53. С. 201–207.
Ходаковская А.В. Фауна губок (Porifera) залива Петра Великого Японского моря // Биол. моря. 2005. Т. 31. С. 251–255.
Черняев М.Ж., Родионов И.А., Селин Н.И. Вододвигательная активность мидии Mytilus trossulus при разных условиях обитания // Биол. моря. 1998. Т. 24. № 2. С. 132–134.
Althoff K., Schutt C., Steffen R. et al. Evidence for a symbiosis between bacteria of the genus Rhodobacter and the marine sponge Halichondria panicea: harbor also for putatively toxic bacteria? // Mar. Biol. 1998. V. 130. P. 529–536.
Barthel D. On the ecophysiology of the sponge Halichondria panicea in Kel Bight. I. Substrate specificity, growth and reproduction // Mar. Ecol.: Prog. Ser. 1986. V. 33. P. 291–298.
Barthel D., Wolfrath R. Tissue sloughing in the sponge Ha-lichondria panicea: a fouling organism prevents being fouled // Oecologia. 1989. V. 78. P. 357–360.
Comeau L.A., Filgueira R., Guyondet T., Sonier R. The impact of invasive tunicates on the demand for phytoplankton in longline mussel farms // Aquaculture. 2015. V. 441. P. 95–105.
Daigle R.M., Herbinger C.M. Ecological interactions between the vase tunicate (Ciona intestinalis) and the farmed blue mussel (Mytilus edulis) in Nova Scotia, Canada // Aquat. Invasions. 2009. V. 4. P. 177–187.
Dalby J.E.Jr., Young C.M. Variable effects of ascidian competitors on oysters in a Florida epifaunal community // J. Exp. Mar. Biol. Ecol. 1993. V. 167. P. 47−57.
Dijkstra J., Sherman H., Harris L.G. The role of colonial ascidians in altering biodiversity in marine fouling communities // J. Exp. Mar. Biol. Ecol. 2007. V. 342. P. 169–171.
Dubois S., Orvain F., Martin-Léal J.C. et al. Small-scale spatial variability of food partitioning between cultivated oysters and associated suspension-feeding species, as revealed by stable isotopes // Mar. Ecol.: Prog. Ser. 2007. V. 336. P. 151–160.
Dyrynda P.E.J. Modular sessile invertebrates contain larvotoxic allelochemicals // Dev. Comp. Immunol. 1983. V. 7. P. 621–624.
Erpenbeck D., Knowlton A.L., Talbot S.L. et al. A molecular comparison of Alaskan and North East Atlantic Halichondria panicea (Pallas 1766) (Porifera: Demospongiae) populations // Boll. Mus. Ist. Biol. Univ. Genova. 2004. V. 68. P. 319–325.
Frost T.M. In situ measurements of clearance rates for the freshwater sponge Spongilla lacustris // Limnol. Oceanogr. 1978. V. 23. P. 1034–1039.
Goldstein J., Riisgård H.U., Larsen P.S. Exhalant jet speed of single-osculum explants of the demosponge Halichondria panicea and basic properties of the sponge-pump // J. Exp. Mar. Biol. Ecol. 2019. V. 511. P. 82–90.
Hadas E., Ilan M., Shpigel M. Oxygen consumption by a coral reef sponge // J. Exp. Biol. 2008. V. 211. P. 2185–2190.
Hartman W.D., Reiswig H.M. The individuality of sponges // Animal colonies. Stroudsburg, Pa: Dowden, Hutchinson and Ross Inc. 1973. P. 567–584.
Hoare R., Peattie M.E. The sublittoral ecology of the Menai Strait. I. Temporal and spatial variation in the fauna and flora along a transect // Estuarine Coastal Mar. Sci. 1979. V. 9. P. 663–675.
Knowlton A.S., Highsmith R.C. Convergence in the time-space continuum: a predator-prey interaction // Mar. Ecol.: Prog. Ser. 2000. V. 197. P. 285–291.
Kobayashi M., Kitagawa I. Likely microbial participation in the production of bioactive marine sponge chemical constituents // Sponge sciences: multidisciplinary perspectives. Tokyo: Springer-Verlag. 1998. P. 379–389.
Kumala L., Riisgård H.U., Canfield D.E. Osculum dynamics and filtration activity in small single-osculum explants of the demosponge Halichondria panicea // Mar. Ecol.: Prog. Ser. 2017. V. 572. P. 117–128.
LaBarbera M., Vogel S. An inexpensive thermistor flow meter for aquatic biology // Limnol. Oceanol. 1976. V. 21. № 5. P. 750–756.
Leblanc A.R., Landry T., Miron G. Fouling organisms of the blue mussel Mytilus edulis: their effect on nutrient uptake and release // J. Shellfish Res. 2003. V. 22. № 3. P. 633–638.
Leichter J.J., Witman J.D. Water flow over subtidal rock walls: relation to distributions and growth rates of sessile suspension feeders in the Gulf of Maine Water flow and growth rates // J. Exp. Mar. Biol. Ecol. 1997. V. 209. P. 293–307.
Lesser M.P., Shumway S.E., Cucci T., Smith J. Impact of fouling organisms on mussel rope culture: interspecific competition for food among suspension-feeding invertebrates // J. Exp. Mar. Biol. Ecol. 1992. V. 165. P. 91–102.
Lohse D.P. Relative strengths of competition for space and food in a sessile filter feeder // Biol. Bull. 2002. V. 203. P. 173–180.
Marfenin N.N. Sponges viewed in the light of up-to-date conception on coloniality // Berl. Geowiss. Abh. Reihe E. 1997. V. 20. P. 17–23.
Morganti T.M., Ribes M., Moskovich R. et al. In situ pumping rate of 20 marine Demosponges is a function of osculum area // Front. Mar. Sci. 2021. V. 8. Art. ID 583188.
Purushottama G.B., Venkateshvaran K., Pani Prasad K., Nalini P. Bioactivities of extracts from the marine sponge Halichondria panicea // J. Venomous Anim. Toxins Incl. Trop. Dis. 2009. V. 15. P. 444–459.
Reiswig H.M. In situ pumping activities of tropical Demospongiae // Mar. Biol. 1971. V. 9. P. 38–50.
Riedl R.J., Machan R. Hydrodynamic patterns in lotic intertidal sands and their bioclimatological implications // Mar. Biol. 1972. V. 13. P. 179–209.
Riisgård H.U., Kumala L., Charitonidou K. Using the F/R-ratio for an evaluation of the ability of the demosponge Halichondria panicea to nourish solely on phytoplankton versus free-living bacteria in the sea // Mar. Biol. Res. 2016. V. 12. P. 907–916.
Schneemann I., Nagel K., Kajahn I. et al. Comprehensive investigation of marine Actinobacteria associated with the sponge Halichondria panicea // Appl. Env. Microbiol. 2010. V. 76. P. 3702–3714.
Sejr M.K., Petersen J.K., Jensen K.T., Rysgaard S. Effects of food concentration on clearance rate and energy budget of the Arctic bivalve Hiatella arctica (L) at subzero temperature // J. Exp. Mar. Biol. Ecol. 2004. V. 311. P. 171–183.
Stuart V., Klumpp D.W. Evidence for food-resource partitioning by kelp bed filter feeders // Mar. Ecol.: Progr. Ser. 1984. V. 16. P. 27–37.
Sukhotin A.A., Lajus D.L., Lesin P.A. Influence of age and size on pumping activity and stress resistance in the marine bivalve Mytilus edulis L. // J. Exp. Mar. Biol. Ecol. 2003. V. 284. P. 129–144.
Thomassen S., Riisgård H.U. Growth and energetics of the sponge Halichondria panicea // Mar. Ecol.: Prog. Ser. 1995. V. 128. P. 239–246.
Troost K., Stamhuis E.J., van Duren L.A., Wolff W.J. Feeding current characteristics of three morphologically different bivalve suspension feeders, Crassostrea gigas, Mytilus edulis and Cerastoderma edule, in relation to food competition // Mar. Biol. 2009. V. 156. P. 355–372.
Zajac R.N., Whitlatch R.B., Osman R.W. Effects of inter-specific density and food supply on survivorship and growth of newly settled benthos // Mar. Ecol.: Prog. Ser. 1989. V. 56. № 1. P. 127–132.
Дополнительные материалы отсутствуют.