Биология моря, 2022, T. 48, № 3, стр. 190-200
Многолетняя динамика структуры сообщества Phyllospadix iwatensis Makino, 1931 (Alismatales: Zosteraceae) на литорали бухты Крабовая (остров Шикотан, Курильские острова)
А. П. Цурпало 1, *, Л. И. Сабитова 1, М. Б. Иванова 1
1 Национальный научный центр морской биологии им. А.В. Жирмунского (ННЦМБ) ДВО РАН
690041 Владивосток, Россия
* E-mail: tsurpalo@mail.ru
Поступила в редакцию 30.06.2021
После доработки 16.12.2021
Принята к публикации 27.01.2022
- EDN: DIKAKO
- DOI: 10.31857/S0134347522030093
Аннотация
По материалам экспедиций 1987, 1997 и 2013 гг., дополненным литературными данными 1949, 1955 и 1963 гг., описаны многолетние изменения структуры сообщества Phyllospadix iwatensis на литорали б. Крабовая (о-в Шикотан, Курильские острова) под влиянием природных и антропогенных факторов. В течение периода исследований в сообществе наряду с Ph. iwatensis всегда присутствовали губка Halichondria panicea, сипункулида Phascolosoma agassizii, изопода Idotea ochotensis, рак-отшельник Pagurus middendorffii, а также брюхоногие моллюски Buccinum percrassum, Nucella heyseana и Littorina sitkana. Органическое загрязнение бухты привело к увеличению числа сопутствующих видов и плотности их поселения, но к уменьшению доли биомассы доминантного вида. После землетрясения и тектонического опускания острова отмечено снижение видового богатства и увеличение доли биомассы доминантного вида в сообществе. Увеличение общей биомассы сообщества происходило в течение всего периода исследований. Степень изменения экологического состояния сообщества филлоспадикса на литорали б. Крабовая оценена методом сравнения кумулятивных кривых численность/биомасса.
Сообщества морских трав широко распространены в прибрежной зоне Мирового океана. Род Phyllospadix, включающий 5 видов, отмечен в умеренных водах северной Пацифики. Вдоль западного побережья Канады и США обитают Ph. scouleri W.J. Hooker, 1838, Ph. serrulatus Ruprecht ex Ascherson, 1868 и Ph. torreyi S. Watson, 1879; Ph. japonicus Makino, 1897 и Ph. iwatensis Makino, 1931 распространены вдоль восточного побережья Азии (Den Hartog, Kuo, 2006). В акватории российского Дальнего Востока сообщество Ph. iwatensis встречается в низкобореальных водах (прибрежные воды южного Сахалина, южных Курильских островов, Приморского края и Хабаровского края) и является одним из самых устойчивых климаксных поясообразующих сообществ, богатых по видовому составу (Кусакин, 1994; Иванова, Цурпало, 2017).
Многолетние исследования изменения структуры литоральных сообществ особенно актуальны в связи с усилением антропогенной нагрузки на морские экосистемы и с сокращением их биоразнообразия. Структура сообществ может изменяться как под воздействием естественных факторов среды (сезонные и годовые флуктуации температуры, солености и увлажнения, воздействие тектонических сдвигов и т.д.), так и в результате деятельности человека (загрязнение, промысел, морское гидростроительство и т.д.) (Гульбин и др., 2003; McGary, 2005; Meena et al., 2019, и др.).
В течение многих лет в б. Крабовая (о-в Шикотан, Курильские острова) происходило прогрессирующее загрязнение акватории отходами рыбообрабатывающего производства. Первые исследования, проведенные в 1949 г., показали незначительное загрязнение средней части бухты (Кусакин, 1958а, 1958б), которое возрастало (Кусакин, 1978) и достигло максимума к 1987 г., когда в результате деятельности крупного рыбокомбината, расположенного в кутовой части бухты, плавающие органические отходы достигали входных мысов, где быстро устранялись прибоем и течениями (Кусакин и др., 1999б; Цурпало, 2016). Необходимо отметить, что до 1963 г. сообщество Ph. iwatensis встречалось не только на входных мысах, но и на мысах в средней части б. Крабовая, где впоследствии оно исчезло из-за загрязнения (Иванова, Цурпало, 2017).
Из природных факторов наиболее сильное воздействие на литоральные сообщества оказало землетрясение 1994 г., в результате которого произошло общее тектоническое погружение о-ва Шикотан на 0.5–0.7 м (Иващенко и др., 1996). На острове произошли обвалы, образовались многочисленные осыпи, богато населенные скалистые платформы почти полностью погрузились ниже 0 глубин, площадь литорали на мысах значительно уменьшилась. Известно, что гетерогенность и стабильность субстрата определяют характеристики бентосных сообществ, а нестабильность оказывает на них негативное влияние (Duan et al., 2007a, 2007b; Blöcher et al., 2020). Если учесть, что величина прилива и, следовательно, протяженность по вертикали литоральной зоны на о-ве Шикотан составляет около 1.5 м, то резкое погружение берега на 0.6 м, когда 40% литорали оказалось ниже 0 глубин, можно считать катастрофическим для многих литоральных сообществ (Кусакин, 1994; Кусакин, Цурпало, 1999). Землетрясение привело к разрушению рыбоперерабатывающего комплекса острова более чем на 80% (https://ostrovnoy.ru). Частичное самоочищение литоральной зоны от многолетних органических отложений, произошедшее в б. Крабовая, предоставило уникальную возможность для изучения изменений структуры литоральных сообществ. Однако уже к 1997 г. рыбокомбинат был восстановлен, и вновь было отмечено загрязнение литоральной зоны (Латышев и др., 1999; Малиновская, 1999). В настоящее время на рыбокомбинате “Островной” по-прежнему перерабатываются морские биоресурсы (https://sakhalin.info/).
Многолетние изменения литорального макробентоса б. Крабовая в условиях разной степени органического загрязнения и неполное восстановление сообществ литорали после опускания берега в результате землетрясения в 1994 г. частично изучены ранее (Кусакин и др., 1999а, 1999б; Кусакин, Цурпало, 1999). Однако в этих исследованиях структуру сообщества филлоспадикса как индикатора состояния окружающей среды подробно не рассматривали. К тому же в настоящее время имевшиеся сведения дополнены результатами, полученными в экспедиции на о-в Шикотан в 2013 г.
Цель данного исследования – на основе собственных и литературных сведений проанализировать многолетнюю динамику структуры сообщества Ph. iwatensis в б. Крабовая и оценить воздействие природных и антропогенных факторов на состояние этого сообщества.
МАТЕРИАЛ И МЕТОДИКА
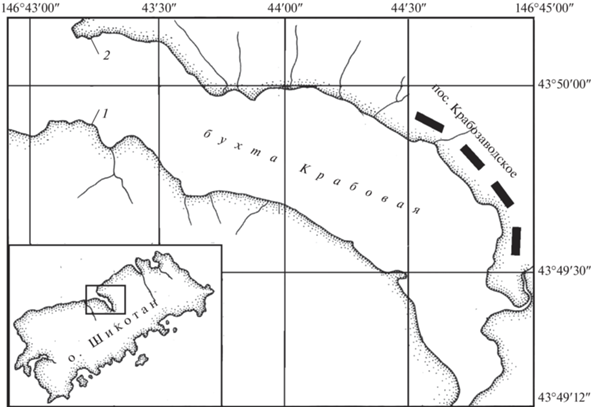
Бухта Крабовая (о-в Шикотан, Курильские острова) находится на северо-западном побережье острова, вдается в него примерно на 3 км и открывается в Южно-Курильский пролив узким горлом (рис. 1). На входных мысах летом температура воды изменяется от 6.2 до 11.4°С, соленость в среднем составляет 33.7‰ (Кусакин, 1978).
Рис. 1.
Район исследований. 1, 2 – участки, на которых выполняли гидробиологические разрезы на литорали б. Крабовая (о-в Шикотан) в 1949, 1955, 1963, 1987, 1997 и 2013 гг.
Зона литорали ограничена самым высоким и самым низким уровнями воды, обусловленными астрономическими причинами; высота приливо-отливной зоны в б. Крабовая составляет 1.47 м, приливы относятся к неправильным полусуточным (Лоция…, 1984). Принцип Вайана в некоторой модификации вполне применим для литорали с неправильными полусуточными приливами (Ушаков, 1951; Кусакин, 1961). Верхний горизонт литорали большую часть времени остается над водой, так как в период квадратурных приливов он не покрывается водой. Нижний горизонт литорали большую часть времени находится под водой и обнажается лишь в период больших (сизигийных) отливов. Средний горизонт характеризуется периодическим ежедневным погружением и осыханием.
Заросли Phyllospadix iwatensis располагаются на скалистом субстрате в нижнем горизонте литорали. В отличие от зостеры, которая предпочитает рыхлые субстраты, филлоспадикс растет как на горизонтальных, так и на вертикальных поверхностях, прикрепляясь к скалам корневищами. На Курильских островах на нижней границе распространения филлоспадикс конкурирует за место с бурыми водорослями родов Alaria, Saccharina и Arthrothamnus.
Материалом для работы послужили сборы, выполненные во время экспедиций Института биологии моря (ныне ННЦМБ ДВО РАН) в июле–августе 1987, 1997 и 2013 гг. на литорали б. Крабовая. Гидробиологическую съемку выполняли на тех же участках, что и в 1949 (август–сентябрь), 1955 (март–май) и 1963 (июль) гг. (Кусакин, 1958а, 1958б, 1961, 1978): участок 1 – южный входной мыс, 43°49′53.59″ N, 146°43′28.40″ E; участок 2 – северный входной мыс, 43°50′09.22″ N, 146°43′18.28″ E (рис. 1).
Материал собирали во время сизигийных отливов по общепринятой методике хорологических исследований на литорали (Кусакин и др., 1974), что позволило сравнить полученные в разные годы данные и считать их репрезентативными. На литорали предварительно визуально оценивали распределение сообщества, выбирали наиболее характерные участки при 100% покрытии филлоспадиксом. Пробные площадки ограничивали металлическими рамками площадью 250, 500 или 10 000 см2. Собранные пробы разбирали, организмы подсчитывали и, обсушив на фильтровальной бумаге, взвешивали на аптекарских весах с точностью до 10 мг. Полученные данные экстраполировали на 1 м2. Коллекции фиксировали 75% спиртом или 4% формалином. В 1987, 1997 и 2013 гг. было собрано 13 проб макробентоса в сообществе филлоспадикса.
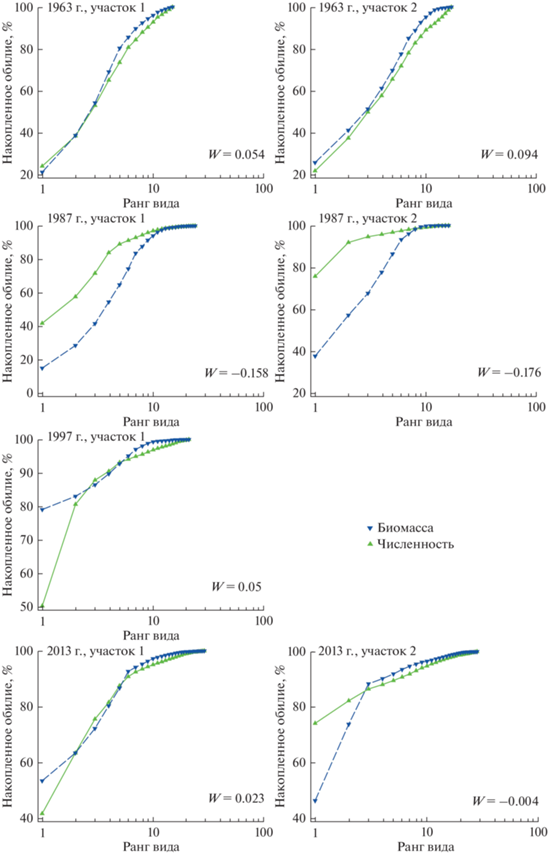
Для выявления сходства видового состава сообщества Ph. iwatensis проведен кластерный анализ, основанный на индексе ценотического сходства Брея–Кертиса для качественных данных (присутствие/отсутствие видов). Экологическое состояние сообщества оценивали методом сравнения кумулятивных кривых численности и биомассы (Abundance/Biomass Comparisons или АВС-метод) (Warwick, 1986). Для оценки величины и знака АВС-эффекта использовали W-статистику:
Кроме собственных данных в анализ включены сведения о составе сообщества Ph. iwatensis в б. Крабовая в 1949, 1955 и 1963 гг., приведенные в работах О.Г. Кусакина (1958а, 1958б, 1961, 1978). Все расчеты выполнены в пакете статистических программ PRIMER v.6 (Clarke, 1990; Warwick, Clarke, 1994; UNEP, 1995; Clarke, Gorley, 2006).
РЕЗУЛЬТАТЫ
За период исследований (1949–2013 гг.) в сообществе Phyllospadix iwatensis на входных мысах в приливо-отливной зоне б. Крабовая, обнаружено 149 видов макробентоса. Наряду с Ph. iwatensis на протяжении всех лет в сборах встречались губка Halichondria panicea, сипункулида Phascolosoma agassizii, равноногий рак Idotea ochotensis, рак-отшельник Pagurus middendorffii и брюхоногие моллюски Buccinum percrassum, Nucella heyseana и Littorina sitkana. Еще 15 видов животных и растений отмечены в 80% случаев: известковая красная водоросль Corallina pilulifera, брюхоногие моллюски Nucella freycinetti, Falsicingula kurilensis и Epheria turrita, двустворчатый моллюск Turtonia minuta, десятиногие раки Dermaturus mandtii и Telmessus cheiragonus, актиния Cnidopus japonicus, голотурия Eupentacta fraudatrix, а также многощетинковые черви Nereis multignatha, Naineris jacutica, Cirratulus cirratus, Lumbrineris inflata, Nereis vexillosa и Capitella capitata.
Максимальное число видов в сообществе (73) отмечено в первые годы исследований (1949, 1955), в 1963 г. оно уменьшилось до 49 видов (Кусакин, 1978), но к 1987 г. возросло до 70. В 1997 г. число видов в сообществе снова резко сократилось до 28, а в 2013 г. вновь возросло до 54.
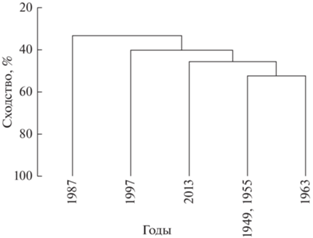
Согласно проведенному кластерному анализу, сообщество филлоспадикса в ранние годы исследований (1949, 1955, 1963) обладало высоким сходством видового состава, поэтому объединено в один кластер (уровень сходства 52.5%); отмечено относительно высокое сходство (45.7%) указанного кластера с составом сообщества в 2013 г. (рис. 2). Видовой состав сообщества в 1987 г. (при максимальном загрязнении бухты) и в 1997 г. (после землетрясения) наиболее заметно отличается от объединенного кластера 1949, 1955, 1963 гг. и последнего года исследований (рис. 2).
Рис. 2.
Дендрограмма сходства видового состава в сообществе Phyllospadix iwatensis на литорали б. Крабовая (о-в Шикотан) в разные годы по результатам кластерного анализа (индекс ценотического сходства Брея–Кертиса).
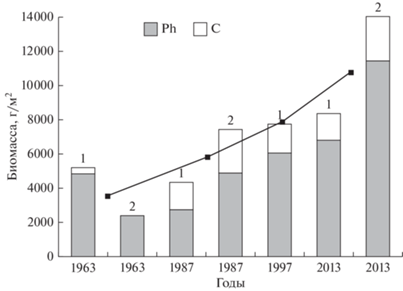
Первые количественные данные, полученные в 1963 г., показали, что биомасса сообщества Ph. iwatensis на входных мысах в среднем составляла 3833.6 ± 1980.8 г/м2. В 1987 г. она была равна 5883.9 ± 5424.1 г/м2, в 1997 г. (на участке 1) – 7746.8 г/м2 и в 2013 г. – 10 274.2 ± 3334.5 г/м2 (рис. 3), т.е. биомасса сообщества постоянно увеличивалась. Структура сообщества на обоих участках в течение всего периода наблюдений претерпевала сходные изменения. В 1963 г. доля доминантного вида Ph. iwatensis в среднем составляла 94% от общей биомассы сообщества, при эвтрофикации она уменьшилась до 64% (1987 г.) и при формировании сообщества после землетрясения увеличилась от 77% (1997 г.) до 80.5% (2013 г.), приближаясь к значениям 1963 г.
Рис. 3.
Структура сообщества Phyllospadix iwatensis (Ph – филлоспадикс, C – сопутствующие виды) на участках 1 и 2 литорали б. Крабовая (о-в Шикотан). Линия показывает средние значения биомассы сообщества для обоих участков.
В 1987 г. в общей биомассе сообщества филлоспадикса в верхней части пояса была велика доля усоногого рака Chthamalus dalli (11%), в нижней – бурых водорослей Saccharina angustata (15%) и Arthrothamnus bifidus (6%). В 1997 и в 2013 гг. отмечен значительный вклад полихеты N. jacutica − 14 и 8% соответственно. В 2013 г. заметной была доля полихеты Pseudopotamilla ocellata (5%) и молоди морского ежа Strongylocentrotus intermedius (3%).
Показатели плотности поселения (численности) ряда сопутствующих видов животных в сообществе филлоспадикса существенно варьировали на протяжении всего периода исследований (см. табл. 1). Кроме того, для некоторых видов отмечены высокие значения плотности в отдельные годы. Так, в 1963 г. довольно высокой была численность полихеты Bispira polymorpha (200 экз./м2) и молоди морского ежа S. intermedius (70 экз./м2); в 1987 г. наблюдалась высокая численность усоного рака Chthamalus dalli (34 200 экз./м2), рака-отшельника P. middendorffii (100 экз./м2) и брюхоногого моллюска B. percrassum (300 экз./м2). Численность многощетинкового червя Naineris jacutica, в 1997 г. составлявшая 6160 экз./м2, в 2013 г. достигла 9920 ± 776 экз./м2. В 1997 г. многочисленными были гастропода Margarites pilsbryi (880 экз./м2), полихета Nereis vexillosa (320 экз./м2) и двустворчатый моллюск Protothaca euglypta (100 экз./м2). В 2013 г. заметной численности достигали брюхоногий моллюск Margarites helicinus – 740 ± 85 экз./м2, а также полихеты Branchiomaldane simplex (1140 экз./м2) и Cirratulus cirratus (2820 ± 594 экз./м2).
Таблица 1.
Плотность поселения (численность) (экз./м2) некоторых сопутствующих видов в сообществе Phyllospadix iwatensis
| Вид | Таксономическая группа | 1963 г. | 1987 г. | 1997 г. | 2013 г. |
|---|---|---|---|---|---|
| Littorina sitkana | Ga | 10 | 2680 ± 2727 | 20 | 100 ± 85 |
| Idotea ochotensis | Is | 30 ± 14 | 380 ± 429 | 120 | 967 ± 1312 |
| Nucella heyseana | Ga | 10 | 300 ± 434 | 80 | 153 ± 214 |
| Phascolosoma agassizii | Si | 20 | 260 ± 339 | 80 | 153 ± 145 |
| Turtonia minuta | Bi | 30 | 80 150 ± 112 925 | – | 100 ± 28 |
| Buccinum percrassum | Ga | – | 300 | 20 | 40 ± 0 |
| Falsicingula kurilensis | Ga | – | 3587 ± 4033 | – | 160 ± 208 |
| Cliamenella fraudatrix | Is | – | 1390 ± 1711 | – | 27 ± 12 |
| Nereis multignatha | Po | 140 | 1320 ± 396 | – | 993 ± 751 |
На входных мысах высокие значения численности многих сопутствующих видов зарегистрированы при значительном загрязнении кутовой части бухты. Например, в 1963 г., когда загрязнение было незначительным, численность T. minuta составляла 30 экз./м2, по мере увеличения загрязнения бухты к 1987 г. она возросла до 80 150 ± ± 112 925 экз./м2 (см. табл. 1). Еще один показательный пример – численность L. sitkana, которая в 1963 г. не превышала 10 экз./м2, а в 1987 г. достигла 2680 ± 2727 экз./м2. В 1997 г. после землетрясения плотность поселения многих видов резко сократилась, однако к 2013 г. увеличилась (см. табл. 1).
Результаты АВС-анализа показали, что для обобщенных данных по каждому из участков кумулятивная кривая относительной биомассы в 1963, 1997 и 2013 гг. лежит выше кумулятивной кривой численности (рис. 4) в отличие от кривых 1987 г., когда индекс W принимает отрицательные значения (–0.158; –0.176).
ОБСУЖДЕНИЕ
Всего на литорали б. Крабовая выделено 39 сообществ макробентоса (Цурпало, 2009), для каждого из них характерен свой доминантный вид. Сложность рельефа в приливно-отливной зоне, особенно на скалисто-каменистых платформах, приводит к тому, что даже в пределах одного острова в составе одного и того же сообщества (группировки) часто не бывает общих видов, кроме 2–3 наиболее обычных (Кусакин, 1969). Среди представителей макробентоса, отмеченных в сообществе Phyllospadix iwatensis в течение всего периода исследований, виды Ph. iwatensis, Idotea ochotensis, Pagurus middendorffii, Littorina sitkana и Nucella heyseana были общими и для сообщества филлоспадикса, описанного на других островах Малой Курильской гряды (о-ва Полонского, Анучина и Танфильева) по материалам экспедиции 1987 г. (Иванова, Цурпало, 2017). Кроме того, двустворчатый моллюск Turtonia minuta и красная водоросль Corallina pilulifera, входящие в состав сообщества филлоспадикса всех перечисленных островов Малой Курильской гряды (включая Шикотан), на входных мысах б. Крабовая не найдены только в 1997 г.
Видовое богатство. В первые годы исследований в сообществе Ph. iwatensis было отмечено 73 вида (Кусакин, 1958а, 1958б). В 1987 г. на фоне сильного загрязнения кутовой части бухты число видов на входных мысах в сообществе увеличилось по сравнению с таковым в 1963 г. в 1.4 раза. Это согласуется с мнением многих авторов, отмечавших, что при эвтрофикации акватории и переходе от олиготрофных условий к мезотрофным происходит увеличение общего числа видов в сообществах (Алимов, 1989; Lopez Gappa et al., 1990; Ошурков, 2000, и др.). Дальнейшие изменения в сообществах могут происходить без увеличения видового богатства, часто при достижении высокой степени трофности наблюдается уменьшение общего числа видов (Ревков и др., 1999; Белогурова, Звягинцев, 2006; Мощенко, Белан, 2008). В целом степень эвтрофирования влияет на число видов в сообществе, наибольшее видовое богатство отмечается при “среднем” уровне загрязнения, при крайних вариантах эвтрофикации оно уменьшается (Lopez Gappa et al., 1990).
Результаты исследования показали, что после землетрясения в течение трех лет (1994–1997 гг.) сообщество филлоспадикса, формировавшееся на новом уровне литорали, постепенно насыщалось видами, число которых в 1997 г. достигло 28, а к 2013 г. увеличилось почти в 2 раза (54 вида).
По данным кластерного анализа видового состава сообщества, его сходство в ранние годы (1949–1963) и в последний год исследований может свидетельствовать о достижении сообществом Ph. iwatensis к 2013 г. климаксной стадии. Это предположение подтверждается присутствием в сообществе помимо общих видов, отмеченных за весь период исследований, представителей макробентоса, которые встречались только в указанные годы (Strongylocentrotus intermedius, Pugettia quadridens, Mitrella burchardi, Margarites helicinus и Protothaca euglypta).
Значения индексов биоразнообразия Шеннона (H') для второстепенных видов изменялись от 1.7 (на участке 1 в 1997 г.) и 1.6 (на участке 2 в 2013 г.) для сообщества филлоспадикса, формирующегося на новом уровне литорали после землетрясения, до 2.2 для сформировавшегося сообщества.
Биомасса. В сообществе филлоспадикса на входных мысах б. Крабовая отмечены не только качественные, но и количественные изменения. За 50 лет (с 1963 по 2013 г.) средняя биомасса сообщества на литорали увеличилась, что было связано с продолжающейся эвтрофикацией бухты. Известно, что при слабом и умеренном органическом загрязнении биомасса сообщества часто возрастает, иногда весьма значительно (Кусакин, Цурпало, 1999; Ревков и др., 1999; Ansari et al., 2014 и др.).
Антропогенное загрязнение б. Крабовая в 1991 и 1997 гг. подтверждено исследованиями микроэлементного состава литорального организма-индикатора (бурая водоросль Fucus evanescens), в котором обнаружены повышенные концентрации цинка и меди (Малиновская, 1999). Загрязнение акватории органическими отходами рыбного производства (Латышев и др., 1999) привело не только к увеличению числа сопутствующих видов в сообществе, но и к увеличению их доли в общей биомассе сообщества и, соответственно, к уменьшению почти в 1.5 раза доли доминантного вида. Подобную закономерность наблюдали во многих литоральных сообществах б. Крабовая (Цурпало, 2009).
В 1997 г. спустя 3 года после землетрясения на участке 2 сообщество филлоспадикса не сформировалось. Очевидно, это обусловлено тем, что узкая площадь литорали на северном входном мысе еще больше сократилась после погружения берега. Однако в сообществе ламинариевой водоросли Alaria marginata, которая обычно обитает вместе с Ph. iwatensis в нижней части литорали, филлоспадикс присутствовал и его доля составляла 2.2% от общей биомассы сообщества алярии (9214 г/м2).
В 2013 г. сообщество филлоспадикса было отмечено на обоих участках, причем на участке 2 его биомасса достигала максимальных (14 069 г/м2) значений за весь период наблюдений. Вероятно, это связано с тем, что на фоне продолжающейся эвтрофикации основной перенос богатых органическим веществом вод из кутовой части бухты, обусловленный циклонической циркуляцией вод, происходит преимущественно по правому берегу по направлению к участку 2 (Малиновская, 1999).
Мощность зарослей филлоспадикса на отдельных участках может значительно колебаться в зависимости от рельефа, грунта и гидрологии (Подкорытова, 2005). Биомасса сообщества филлоспадикса часто достигает больших значений. Так, на о-ве Шикотан в бухтах Димитрова, Церковная, Гальцева, Отрадная и Горобец в среднем она составляла 9499.1 ± 4666.9 г/м2, максимальное значение (16 500.0 г/м2) отмечено в б. Церковная. На других островах Малой Курильской гряды биомасса достигала 15 886.0 ± 8600.0 г/м2 с максимумом 26 998.2 г/м2 на о-ве Анучина (неопубликованные данные) и 19580.3 г/м2 на о-ве Симушир (Большая Курильская гряда) (неопубликованные данные). В зал. Петра Великого (Японское море) биомасса сообщества филлоспадикса на о-ве Фуругельма составляла 13995.5 г/м2 (Гульбин и др., 1987), на о-ве Русский – 13247.1 г/м2 (Ivanova et al., 2009) и на о-ве Путятина – 8033.7 ± 2755.8 г/м2 (Иванова, Цурпало, 2013). Минимальные значения биомассы сообщества филлоспадикса зарегистрированы на литорали о-ва Кунашир вблизи мыса Круглый – 795.7 г/м2 (Kostina, Tsurpalo, 2016).
Доля филлоспадикса от общей биомассы сообщества в большей степени зависит от гидродинамических условий местообитания и варьирует в широких пределах. Например, на одном и том же участке литорали б. Отрадная (о-в Шикотан) в открытой части рифа доля филлоспадикса от общей биомассы сообщества составляла 95.1%, в защищенной – 79.1% (неопубликованные данные). В целом доля доминантного вида в сообществе филлоспадикса может варьировать от 98.0% (о-в Полонского) (неопубликованные данные), 96.6% (о-в Фуругельма) (Гульбин и др., 1987) и 95.0% (о-в Кунашир) (Kostina, Tsurpalo, 2016) до 62.5% (о-в Русский) (Ivanova et al., 2009).
Метод АВС-диаграмм и W-статистика тщательно протестированы и подтверждены для морских и пресноводных сообществ (Beukema, 1988; Dauer et al., 1993), поэтому широко применяются в настоящее время (Wijeyaratne, Bellanthudawa, 2018; Zhao et al., 2020; Zhang et al., 2021, и др.). Результаты статистической оценки экологического состояния сообщества Ph. iwatensis в б. Крабовая, полученные методом сравнения численности и биомассы (АВС) видов сообщества (рис. 4), подтвердили отсутствие нарушений структуры сообщества и отрицательных воздействий в начальный период исследований (1963 г.). Такая картина (кривая биомассы лежит выше кривой численности) характерна для естественных природных сообществ, состоящих из крупных особей с большой биомассой (Attrill, Depledge, 1997). На графике по данным 1987 г. расположение кривых изменилось, кривая биомассы лежит ниже кривой численности, что свидетельствует о негативном воздействии растущего загрязнения на сообщество на обоих участках, которое проявляется как появление в составе сообщества более мелких видов (Warwick, 1986). На участке 2 показатели W-статистики всегда были ниже, принимали минимальные и отрицательные значения, что связано с циркуляцией вод внутри бухты. Воздействие загрязнения на сообщество здесь было значительным (W = –0.176) и сравнимо с таковым (W = –0.178) в средней части б. Золотой Рог зал. Петра Великого (Японское море) в 1996 г. (Мощенко, Белан, 2008).
Таким образом, в результате многолетних исследований изучено и статистически подтверждено влияние загрязнения и землетрясения на динамику структуры сообщества Ph. iwatensis. Относительное увеличение загрязнения акватории органическими отходами рыбного производства приводило к увеличению видового состава сообщества (происходило максимальное “насыщение” сообщества сопутствующими видами) и к увеличению доли сопутствующих видов от общей биомассы сообщества. После землетрясения и тектонического погружения острова верхняя граница зарослей филлоспадикса повысилась относительно уровня прошлых лет; отмечено уменьшение видового богатства и увеличение доли биомассы доминантного вида в сообществе.
В ходе эволюции и адаптации к стрессам природные экосистемы приобрели значительную резистентность и упругость, что позволяет им переносить периодические тяжелые или острые нарушающие воздействия (Ошурков, 2000). Для сообществ прибойной скалистой литорали характерна крайне высокая приспособительная стабильность (Кусакин и др., 1999б). По прошествии определенного времени сообщества приобретают состав, основой которого являются эврибионтные широко распространенные виды макробентоса.
Восемь видов макробентоса, входящих в состав сообщества филлоспадикса б. Крабовая, которые присутствовали на протяжении всего периода исследований, на 62.5% совпадают с составом сообщества филлоспадикса, выделенным в биоценотической системе всех островов Малой Курильской гряды (Иванова, Цурпало, 2017), что свидетельствует о высокой устойчивости этого сообщества во времени (более 60 лет) и в пространстве.
Список литературы
Алимов А.Ф. Введение в продукционную гидробиологию. Л.: Гидрометеоиздат. 1989. 152 с.
Белогурова Л.С., Звягинцев А.Ю. Динамические аспекты мейо- и макрофауны обрастания в условиях хронического антропогенного загрязнения (б. Золотой Рог, Японское море) // Изв. ТИНРО. 2006. Т. 144. С. 331–350.
Гульбин В.В., Иванова М.Б., Кепель А.А. Поясообразующие группировки островной литорали Дальневосточного государственного морского заповедника // Исследования литорали Дальневосточного морского заповедника и сопредельных районов. Владивосток: ДВО АН СССР. 1987. С. 83–111.
Гульбин В.В., Арзамасцев И.С., Шулькин В.М. Экологический мониторинг акватории порта Восточный (бухта Врангеля) Японского моря (1995–2002) // Биол. моря. 2003. Т. 29. № 5. С. 320–330.
Иванова М.Б., Цурпало А.П. Состав и распределение сообществ макробентоса на литорали острова Путятина (залив Петра Великого, Японское море // Изв. ТИНРО. 2013. Т. 172. С. 149–160.
Иванова М.Б., Цурпало А.П. Сообщество Phyllospadix iwatensis на литорали дальневосточных морей России // Изв. ТИНРО. 2017. Т. 188. С. 173–180.
Иващенко А.И., Гусяков В.К., Джумагалиев В.А. и др. Шикотанское цунами 5 октября 1994 г. // Докл. РАН. 1996. Т. 348. № 4. С. 532–538.
Кусакин О.Г. Литораль южных Курильских островов и ее фауна и флора: Автореф. дис. … канд. биол. наук. Л. 1958а. 20 с.
Кусакин О.Г. Сезонные изменения на литорали южных Курильских островов // Вестн. Ленинград. ун-та. Сер. биол. 1958б. Т. 3. С. 116–130.
Кусакин О.Г. Некоторые закономерности распределения фауны и флоры в осушной зоне южных Курильских островов // Исслед. дальневост. морей СССР. 1961. Т. 7. С. 312–343.
Кусакин О.Г. Некоторые особенности населения осушной зоны Курильских островов // Реф. науч. работ Ин-та биологии моря ДВФ СО АН СССР. 1969. Вып. 1. С. 101–104.
Кусакин О.Г. Биономия и фенология литорали бухты Крабовой острова Шикотан Курильской гряды // Животный и растительный мир шельфовых зон Курильских островов. М.: Наука. 1978. С. 5–46.
Кусакин О.Г. Биологическое разнообразие в морских прибрежных экосистемах Дальнего Востока в связи с их устойчивостью // Вестн. ДВО РАН. 1994. № 1. С. 85–94.
Кусакин О.Г., Иванова М.Б., Цурпало А.П. Частичное восстановление биоты литорали бухты Крабовая (остров Шикотан) в процессе самоочищения // Биол. моря. 1999а. Т. 25. № 2. С. 134–135.
Кусакин О.Г., Иванова М.Б., Цурпало А.П. Восстановление сообществ скалистой литорали после опускания берега в результате землетрясения // Докл. РАН. 1999б. Т. 366. № 6. С. 846–848.
Кусакин О.Г., Кудряшов В.А., Тараканова Т.Ф., Шорников Е.И. Поясообразующие флоро-фаунистические группировки литорали Курильских островов // Растительный и животный мир литорали Курильских островов. Новосибирск: Наука. 1974. С. 5–75.
Кусакин О.Г., Цурпало А.П. Многолетние изменения литорального макробентоса бухты Крабовая (остров Шикотан) в условиях разной степени органического загрязнения // Биол. моря. 1999. Т. 25. № 3. С. 209–216.
Латышев Н.А., Кусакин О.Г., Светашев В.И., Кияшко С.И. Определение спектра питания литорин при антропогенном загрязнении жирами с помощью липидных изотопных маркеров // Докл. РАН. 1999. Т. 366. № 5. С. 715–717.
Лоция Охотского моря. Вып. 1. Южная часть моря. М.: МО СССР, ГУ навигации и океанографии. 1984. 337 с.
Малиновская Т.М. Мониторинг прибрежных вод бухты Крабовая (остров Шикотан) с использованием бурой водоросли Fucus evanescens // Биол. моря. 1999. Т. 25. № 2. С. 137–138.
Мощенко А.В., Белан Т.А. Метод оценки антропогенного нарушения сообществ макрозообентоса рыхлых грунтов // Биол. моря. 2008. Т. 34. № 4. С. 279–292.
Ошурков В.В. Сукцессии и динамика эпибентосных сообществ верхней сублиторали бореальных вод. Владивосток: Дальнаука. 2000. 205 с.
Подкорытова А.В. Морские водоросли-макрофиты и травы. М.: Изд-во ВНИРО. 2005. 175 с.
Ревков Н.К., Валовая Н.А., Колесникова Е.А. и др. К вопросу о реакции Черноморского макрозообентоса на эвтрофирование // Экологическая безопасность прибрежной и шельфовой зон и комплексное использование ресурсов шельфа. Сб. науч. тр. НАН Украины. Севастополь. 1999. С. 199–212.
Ушаков П.В. О морской донной фауне в районе южных Курильских островов // Докл. АН СССР. 1951. Т. 80. № 1. С. 125–128.
Цурпало А.П. Макробентос литорали бухты Крабовой (остров Шикотан, Курильские острова) и его многолетние изменения // Автореф. дис. … канд. биол. наук. Владивосток. 2009. 22 с.
Цурпало А.П. Литоральные сообщества кутовой части б. Крабовой (о-в Шикотан, Курильские острова): многолетний аспект // Программа и материалы науч. конф. “Биоразнообразие и эволюция”, посвященной памяти академика О.Г. Кусакина. Владивосток: ННЦМБ ДВО РАН. 4–6 октября. 2016. С. 165–169.
Ansari Z.A., Ingole B.S., Abidi A.H. Organic enrichment and benthic fauna – some ecological consideration // Ind. J. Geo–Mar. Sci. 2014. V. 43. № 4. P. 554–560.
Attrill M.J., Depledge M.H. Community and populations indicators of ecosystem health: targeting links between levels of biological organization // Aquat. Toxicol. 1997. V. 38. P. 183–197.
Beukema J.J. An evaluation of the ABC-method (abundance/biomass comparison) as applied to macrozoobenthic communities living on tidal flats in the Dutch Wadden Sea // Mar. Biol. (Heidelberg, Ger.). 1988. V. 99. P. 425–433.
Blöcher J.R., Ward M.R., Matthaei C.D., Piggott J.J. Multiple stressors and stream macroinvertebrate community dynamics: interactions between fine sediment grain size and flow velocity // Sci. Total Environ. 2020. V. 717. 137070.
Clarke K.R. Comparisons of dominance curves // J. Exp. Mar. Biol. Ecol. 1990. V. 138. P. 143–157.
Clarke K.R., Gorley R.N. PRIMER V6: User Manual/Tutorial. Plymouth: PRIMER-E. 2006. 192 p.
Dauer D.M., Luckenbach M.W., Rodi Jr. Abundance biomass comparison (ABC method): effects of an estuarine gradient, anoxic/hypoxic events and contaminated sediments // Mar. Biol. (Heidelberg, Ger.). 1993. V. 116. P. 507–518.
Den Hartog C., Kuo J. Taxonomy and biogeography of seagrasses // Seagrasses: Biology, Ecology and Conservation. Netherlands: Springer. 2006. P. 1–23.
Duan X.H., Wang Z.Y., Cheng D.S. Benthic macroinvertebrates communities and biodiversity in various stream substrata // Acta Ecol. Sin. 2007a. V. 27. № 4. P. 1664–1672.
Duan X.H., Wang Z., Tian S. Field experiment on the effect of streambed substrate on macroinvertebrate diversity // J. Tsinghua Univ. 2007b. V. 47. № 9. P. 1553–1556.
Ivanova М.В., Belogurova L.S., Tsurpalo А.Р. Composition and distribution of benthos in the intertidal zonе of Russky Island (Рeteг the Great Вау, Sea of Japan) // Ecological Studies and State of the Ecosystem of Аmursky Вау апd Estuarine Zone of Razdolnaya River (Sea of Jарап). Vladivostok: Dalʼnauka. 2009. V. 2. Р. 87–146.
Kostina E.E., Tsurpalo A.P. Species composition and distribution of macrobenthos in the intertidal zone of Kunashir Island (South Kurile Islands), Russia // Publ. Seto Mar. Biol. Lab. 2016. V. 44. P. 53–133.
Lopez Gappa J.J., Tablado A., Magaldi N.H. Influence of sewage pollution on a rocky intertidal community do-minated by the mytilid Brachidontes rodriguezi // Mar. Ecol.: Prog. Ser. 1990. V. 63. P. 163–175.
McGary C.L. A long term comparison of rocky intertidal communities in Redwood National and State Parks // Thesis Master Art Biol. Sciences. Fac. Humboldt St. Univ. 2005. 56 p.
Meena D.K., Lianthuamluaia L., Mishal P. et al. Assemblage patterns and community structure of macro-zoobenthos and temporal dynamics of eco-physiological indices of two wetlands, in lower gangetic plains under varying ecological regimes: A tool for wetland management // Ecol. Eng. 2019. V. 130. P. 1–10.
Reference Methods for Marine Pollution Studies, no. 64: Statistical Analysis and Interpretation of Marine Community Data, United Nations Environment Program, 1995.
Warwick R.M. A new method for detecting pollution effects on marine macrobenthic communities // Mar. Biol. (Heidelberg, Ger.). 1986. V. 92. P. 557–562.
Warwick R.M., Clarke K.R. Relearning the ABC–taxono-mic changes and abundance biomass relationships in disturbed benthic communities // Mar. Biol. (Heidelberg, Ger.). 1994. V. 118. P. 739–744.
Wijeyaratne D., Bellanthudawa B.K.A. Abundance-biomass comparison approach to assess the environmental stressors in Diyawannawa wetland in monsoonal and non-monsoonal seasons // Sri Lanka J. Aquat. Sci. 2018. V. 23. № 2. P. 135–149.
Zhao G., Pan B., Li Y. et al. Phytoplankton in the heavy se-diment-laden Weihe River and its tributaries from the northern foot of the Qinling Mountains: community structure and environmental drivers // Environ. Sci. Pollut. Res. 2020. V. 27. № 8. P. 8359–8370.
Zhang Q., Yang T., Wan X. et al. Community characteristics of benthic macroinvertebrates and identification of environmental driving factors in rivers in semi-arid areas – A case study of Wei river Basin, China // Ecol. Indic. 2021. V. 121. 107153.
Дополнительные материалы отсутствуют.