Биология моря, 2022, T. 48, № 5, стр. 351-356
Особенности накопления каротиноидов в тканях двустворчатого моллюска-фильтратора Polititapes aureus (Gmelin, 1791) из Чёрного моря
А. В. Бородина 1, *, П. А. Задорожный 2
1 Институт биологии южных морей РАН
299011 Севастополь, Россия
2 Институт химии ДВО РАН
690022 Владивосток, Россия
* E-mail: borodinaav@mail.ru
Поступила в редакцию 15.12.2021
После доработки 21.04.2022
Принята к публикации 02.06.2022
- EDN: DSWTTW
- DOI: 10.31857/S0134347522050035
Аннотация
Представлены результаты изучения состава каротиноидов в тканях морского двустворчатого моллюска-фильтратора Polititapes aureus (Gmelin, 1791), обитающего в Чёрном море в одной из кутовых зон б. Казачья в районе г. Севастополь. В течение годового цикла динамика суммарных каротиноидов в мягких тканях моллюска была максимальной (1.7 ± 0.47 мг/100 г сырой ткани) весной в начале марта, к лету этот показатель снижался до 0.41 ± 0.10 мг/100 г сырой ткани и оставался практически неизменным до конца года (менее 0.5 мг/100 г сырой ткани). Качественный состав каротиноидов был исследован в весенних и осенних пробах. Идентифицированы β-каротин, эхиненон, лютеин, зеаксантин, аллоксантин, фукоксантин, амароциаксантин A, гетероксантин и мактраксантин, доля которых составляла около 80% от общего количества каротиноидов. Обсуждаются качественный состав каротиноидов у моллюсков-фильтраторов, обитающих в этом экотопе вместе с P. aureus, и возможные пути трансформации растительных каротиноидов в тканях P. aureus. Проведено сравнение состава каротиноидов в тканях P. aureus и других двустворчатых моллюсков рода Polititapes из разных регионов Мирового океана.
Polititapes aureus (Gmelin, 1791) − морской вид двустворчатых моллюсков-фильтраторов из семейства Veneridae, обитающий в смешанных донных сообществах на илисто-песчаных грунтах (Киселева 1981; Промысловые биоресурсы…, 2011). Сведения о распространении этого моллюска в шельфовой зоне крымского побережья Черного моря в основном касаются глубоководной части (25–50 м) (Киселева, 1981; Промысловые биоресурсы…, 2011). Нами были обнаружены моллюски P. aureus в составе смешанного сообщества двустворчатых моллюсков Chamelea gallina (Bruguiere, 1789) и Cerastoderma glaucum (Linnaeus, 1758) на песчаном грунте в верховье б. Казачья на глубине 0–0.5 м. В это же время в данном районе проводился мониторинг состава зообентоса (Макаров, 2020).
Работы по исследованию моллюсков кутовых зон бухт (в зоне заплеска воды) немногочисленны, хотя очевидно, что условия жизни животных, обитающих в прибрежной зоне, по гидрохимическим, трофическим и кислородным условиям обитания отличаются от таковых в глубоководной части шельфовой зоны. Эти факторы влияют на участвующую в адаптации к изменяющимся внешним условиям обитания антиоксидантную систему двустворчатых моллюсков, приводя к количественному или качественному изменению состава каротиноидов (Бородина, Задорожный, 2020, 2021). Наиболее полно состав каротиноидов у двустворчатых моллюсков рода Polititapes (ранее Paphia) изучен у обитающих в тихоокеанском регионе видов Paphia amabillis и P. euglypta, у которых обнаружен амароциаксантин А – видоспецифичный каротиноид, являющийся своеобразным маркером рода Polititapes (Matsuno et al., 1985; Maoka et al., 2008; Maoka, 2011). Каротиноид животного происхождения амароциаксантин А − продукт метаболической трансформации; в тканях моллюсков рода Polititapes он происходит от фукоксантина − каротиноида диатомовых и динофитовых микроводорослей (Maoka, 2011). Показано, что для P. amabillis и P. euglypta характерно увеличение пути метаболизма перидинина до образования гидратоперидинина и циклопирроксантина (Matsuno et al., 1985; Maoka et al., 2008; Maoka, 2011). Изменения экологии и гидрохимии Чёрного моря (Елкин и др., 2018) приводят к изменениям в организмах моллюсков, культивируемых на морских фермах (Трощенко и др., 2019) и обитающих в природных бентосных сообществах (Бородина, Солдатов, 2014; Бородина, Задорожный, 2021). Ранее были рассмотрены различия состава каротиноидов у черноморских двустворчатых моллюсков-фильтраторов и у моллюсков этих же видов или видов того же рода из других регионов Мирового океана (МО) (Бородина, Солдатов, 2014; Бородина, Задорожный, 2021). Настоящая работа является продолжением исследования сезонной годовой динамики состава каротиноидов у двустворчатых моллюсков-фильтраторов, обитающих в кутовой части бухт крымского побережья Чёрного моря (Бородина, Задорожный, 2020, 2021; Borodina, Zadorozhny, 2021). Цель работы – изучение состава каротиноидов в тканях P. aureus, обитающего в смешанном донном сообществе с C. glaucum и Ch. galina, а также сравнение состава каротиноидов у этих моллюсков и у представителей рода Polititapes из других регионов МО.
МАТЕРИАЛ И МЕТОДИКА
Объект исследования – двустворчатый моллюск Polititapes aureus (Gmelin, 1791), обитающий в составе смешанного донного сообщества песчаной зоны верхней сублиторали (глубина 0–1 м) б. Казачья у г. Севастополь. Для определения годовой динамики содержания суммарных каротиноидов в тканях моллюска в течение 2019 и 2021 гг. один раз в месяц отбирали по 8–15 особей с длиной раковины 10–20 мм. Для изучения качественного состава каротиноидов использовали две выборки по 30 животных, взятые весной (апрель, май) и осенью (сентябрь, октябрь). Суммарное содержание каротиноидов (ССК) определяли спектрофотометрическим методом (Карнаухов, Федоров, 1982; Карнаухов, 1988). Мягкие ткани гомогенизировали в фарфоровой ступке, затем в ней же проводили экстракцию 100% ацетоном. Суммарный экстракт каротиноидов герметично упаковывали в атмосфере азота и при низкой температуре транспортировали в Институт химии ДВО РАН для идентификации методами высокоэффективной жидкостной хроматографии (ВЭЖХ) и масс-спектрометрии (MS).
Хроматографические методы и масс-спектрометрия
Разделение пигментов проводили методом ВЭЖХ, как описано ранее (Бородина, Задорожный, 2020, 2021). Для разделения использовали хроматограф Shimadzu LC-20 с диодно-матричным детектором SPD-M20A; колонку Zorbax Sil 4.6 × 250 мм, скорость потока 1 мл/мин, в градиенте гексан : ацетон (0–20 мин гексан : ацетон 8 : 2, изократические условия; с 20 до 25 мин линейный градиент от 20 до 80% ацетона; 25–35 мин гексан : ацетон 2 : 8, изократический режим). Фракции каротиноидов собирали после разделения (10–15 разделений), объединяли, упаривали досуха на роторном испарителе при температуре 40°C, перерастворяли в метаноле и прописывали масс-спектры с использованием масс-спектрометрического детектора низкого разрешения Shimadzu LCMS-2010EV, источник APCI, в режиме положительных ионов. Омыление каротиноидов проводили повторным растворением их в 5%-ном растворе KOH в метаноле.
На основе данных ВЭЖХ при 450 нм оценивали содержание отдельных каротиноидов методом нормирования площадей пиков пигментов с использованием коэффициента А 1%/1 см: для фукоксантина – 2500, для его производных – 1600. Отношение максимумов III/II, % в спектрах поглощения рассчитывали, как описано ранее (Carotenoids…, 1994; Бородина, Задорожный, 2020, 2021). Количество каротиноидов в этерифицированном виде оценивали после щелочного гидролиза.
Статистический анализ
Статистическая обработка и графическое оформление полученной информации проводились при помощи пакета “Grapher-7”. Результаты расчета суммарных каротиноидов на графике представлены как среднее арифметическое ($\bar {x}$) и стандартная ошибка средней (S$\bar {x}$). Для сравнения содержания каротиноидов в мягких тканях моллюсков в течение года применяли U-критерий Манна−Уитни.
РЕЗУЛЬТАТЫ
Большая часть тканей Polititapes aureus окрашена в бледный розово-серый цвет, исключение составляют ярко-желтые гонады и темный зелено-коричневый гепатопанкреас, скрытый под ногой моллюска (рис. 1). Фотография сделана в марте, когда суммарный уровень каротиноидов максимально высок (рис. 2).
Рис. 2.
Годовая динамика содержания суммарных каротиноидов в тканях двустворчатого моллюска Polititapes aureus. ССК – содержание суммарных каротиноидов.
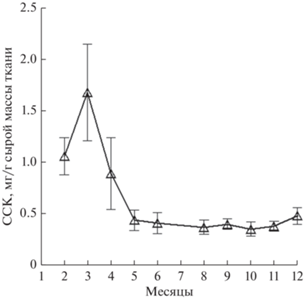
Наиболее высокое суммарное содержание каротиноидов в тканях P. aureus 1.68 ± 0.47 мг/100 г сырой массы отмечено в весенние месяцы с пиком в марте (рис. 2). В данный период начинается созревание гонад, которые в это время заметны при визуальном обследовании животных (рис. 1).
Качественный состав каротиноидов определяли весной и осенью. В суммарных экстрактах обеих проб методом ВЭЖХ идентифицированы следующие каротиноиды и их эфиры (рис. 3, табл. 1):
Рис. 3.
Высокоэффективная жидкостная хроматография неомыленного экстракта каротиноидов мягких тканей двустворчатого моллюска Polititapes aureus из весенней (а) и осенней (б) выборок. Обозначения пиков: 1 – β-каротин, 2 – эхиненон, 3 – эфиры каротиноидов, преимущественно гетероксантина, 4 – лютеин, 5 – зеаксантин, 6 – аллоксантин, 7 – фукоксантин, 8 – гетероксантин, 9 – амароциаксантин А, 10 – мактраксантин, Chl – хорофилл и его производные, Х1 и Х2 – неидентифицированные каротиноиды.
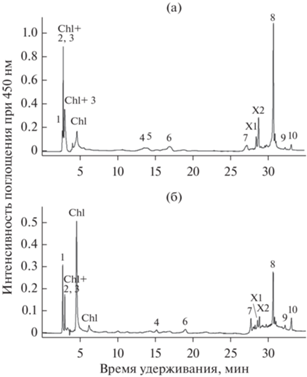
Таблица 1.
Состав и содержание каротиноидов в мягких тканях двустворчатого моллюска Polititapes aureus
| Каротиноиды | Проба, % | |
|---|---|---|
| весенняя | осенняя | |
| Каротины | 6.1 | 23.1 |
| Эхиненон | 0.9 | 0.1 |
| Эфиры каротиноидов | 5.8 | 2.0 |
| Лютеин | 0.7 | 0.9 |
| Зеаксантин | 0.1 | 0.2 |
| Аллоксантин | 10.2 | 6.7 |
| Фукоксантин | 10.9 | 8.5 |
| Гетероксантин | 42.4 | 25.8 |
| Амароциаксантин A | 1.4 | 2.4 |
| Мактраксантин | 2.9 | 8.5 |
| Неидентифицированные | 18.6 | 21.8 |
β-каротин: время удерживания (Rt) – 2.74 мин, максимумы поглощения в элюенте (λmax) – 425, 448 и 474, отношение III/II, % – 15, отношение массы иона к его заряду (m/z [M + H]+) – 537;
эхиненон: Rt – 2.9 мин, λmax – 452, III/II, % – 0;
фракция этерифицированных каротиноидов: Rt – 2.9–3.2 мин, после омыления основной пик Rt – 30.72 мин, λmax – 427, 449 и 479, III/II, % – 65;
лютеин: Rt – 13.8 мин, λmax – 448 и 473, III/II, % – 44, m/z [M + H]+ – 569;
зеаксантин: Rt – 14.1 мин, λmax – 451 и 475, III/II, % – 5;
аллоксантин: Rt – 17.1 мин, λmax – 452 и 481, III/II, % – 50, m/z [M + H]+ – 565;
фукоксантин: Rt – 27.16 мин, λmax – 448 и (469), III/II, % – 0, m/z [M + H]+ − 659, m/z [M + Na]+ – 681, фракция неразделима со стандартом, выделенным из Laminaria sp.;
гетероксантин: Rt – 30.72 мин, λmax – 425, 448 и 477, III/II, % – 62, m/z [M + H]+ – 601;
амароциаксантин А: Rt – 32.27 мин, λmax – 440, III/II, % – 0;
мактраксантин: Rt – 33.09 мин, λmax – 418, 442 и 471, III/II, % – 91, m/z [M + H]+ – 637.
ОБСУЖДЕНИЕ
В течение года из-за смены состава фитопланктона (сезонная сукцессия) у многих видов двустворчатых моллюсков суммарный состав каротиноидов меняется (Бородина, Солдатов, 2014; Бородина, Задорожный, 2020, 2021; Borodina, Zadorozhny, 2021). Весной обильный спектр питания и благоприятная температура стимулируют репродуктивный цикл у многих видов моллюсков (Холодов и др., 2010; Черноморские моллюски…, 2014). В эти периоды спектр каротиноидов в тканях Bivalvia обогащается и количественно, и качественно.
Согласно полученным результатам, гетероксантин был основным каротиноидом мягких тканей Polititapes aureus, в значительных количествах присутствовали также аллоксантин, фукоксантин и фракция каротинов (табл. 1). Сравнение весенней и осенних выборок показало, что основные различия между ними связаны с изменениями относительного содержания фракции каротинов и гетероксантина. В весенний период содержание каротинов было минимальным, а доля гетероксантина и других ксантофиллов увеличена.
Качественный состав каротиноидов в тканях P. aureus был близок к таковому у обитающих в этом же биотопе Cerastoderma glaucum и Chamelea galina (Бородина, Задорожный, 2020, 2021). При одинаковых внешних экологических условиях (спектр питания, температура и т.д.) эти моллюски накапливали в мягких тканях не менее шести одинаковых каротиноидов: каротины, лютеин, диатоксантин, аллоксантин, фукоксантин и гетероксантин; в неидентифицированных фракциях было возможно наличие других общих каротиноидов. Среди этих общих для P. aureus, C. glaucum и Ch. galina каротиноидов можно выделить каротиноиды, ассимилирующиеся из пищи, например, лютеин, диатоксантин, фукоксантин и гетероксантин. Однако с точки зрения энергетических затрат организма для моллюсков более важны их собственные каротиноиды, образующиеся в тканях по определенным метаболическим путям в процессе преобразований растительных каротиноидов; это фукоксантин → … амароциаксантин A (Maoka, 2011) и (виолаксантин?) → … мактраксантин (табл. 1) (Бородина, Задорожный, 2020). Путь образования мактраксантина изучен не полностью, предполагается, что его предшественником может быть виолаксантин − каротиноид зеленых микроводорослей (Бородина, Задорожный, 2020). У P. aureus, в отличие от C. glaucum и Ch. galina из этого же сообщества, отмечено накопление эхиненона, низкое содержание эфиров каротиноидов, отсутствие диадиноксантина и галоцинтиаксантина, а также зеаксантина, обнаруженного у C. glaucum. Это подтверждает наличие видовых особенностей в накоплении каротиноидов в тканях разных видов моллюсков из одного местообитания.
При сравнении состава каротиноидов у P. aureus и у видов этого рода из других регионов Мирового океана обнаружены существенные отличия. В тканях пафий из Японского моря (Matsuno et al., 1985; Maoka et al., 2008; Maoka, 2011) описан наиболее сложный путь трансформации растительного перидинина: перидинин → … → гидратпирроксантин (эфиры). Согласно нашим результатам, у черноморского P. aureus среди идентифицированных соединений каротиноиды этого пути отсутствуют, из общих каротиноидов в тканях P. amabillis и P. euglypta из Японского моря, а также P. aureus из Черного моря отмечен только амароциаксантин A.
Таким образом, у двустворчатого моллюска P. aureus, обитающего в кутовой части б. Казачья крымского побережья Чёрного моря, наблюдается только один (весенний) максимум накопления ССК; в течение года состав каротиноидов в тканях моллюска изменяется незначительно. Качественный состав каротиноидов на 80% представлен каротином, эхиненоном, лютеином, зеаксантином, аллоксантином, фукоксантином, амаруциаксантином А, гетероксантином, мактраксантином. У моллюсков-фильтраторов P. aureus, C. glaucum и Ch. galina набор каротиноидов может меняться в соответствии с условиями обитания, при этом сохраняются неизменными видоспецифичные каротиноиды животного происхождения.
Список литературы
Бородина А.В., Задорожный П.А. Динамика каротиноидов в тканях моллюска-фильтратора Cerastoderma glaucum (Bruguiere, 1789) в годовом цикле // Журн. эвол. биохим. и физиол. 2020. Т. 56. № 1. С. 3–12.
Бородина А.В., Задорожный П.А. Сезонная динамика каротиноидов двустворчатого моллюска Chamelea gallina (Linnaeus, 1758) в Черном море // Журн. эвол. биохим. и физиол. 2021. Т. 57. № 3. С. 250–256.
Бородина А.В., Солдатов А.А. Каротиноиды тканей массовых видов черноморских моллюсков // Черноморские моллюски: элементы сравнительной и экологической биохимии. Севастополь: ЭКОСИ-Гидрофизика. 2014. С. 87–168.
Елкин Д.Н., Журбас В.М., Ижицкий А.С. и др. Гидрофизические и экологические процессы в прибрежной зоне Чёрного моря. М.: Научный мир. 2018. 414 с.
Карнаухов В.Н. Биологические функции каротиноидов. М.: Наука. 1988. 240 с.
Карнаухов В.Н., Федоров Г.Г. Методы определения содержания каротиноидов и витамина А в клетках животных. Пущино: НЦБИ АН СССР. 1982. 28 с.
Киселева М.И. Бентос рыхлых грунтов Черного моря. Киев: Наукова думка. 1981. 409 с.
Макаров М.В. Современное состояние малакофауны рыхлых грунтов в вершинной части бухты Казачьей (Черное море) // Экологическая безопасность прибрежной и шельфовой зон моря. 2020. № 1. С. 119–130.
Промысловые биоресурсы Чёрного и Азовского морей / Ред. В.Н. Еремеев, А.В. Гаевская, Г.Е. Шульман, Ю.А. Загородняя. Севастополь: ЭКОСИ–Гидрофизика. 2011. 367 с.
Трощенко О.А., Субботин А.А., Еремин И.Ю. Изменчивость основных лимитирующих факторов среды в процессе выращивания двустворчатых моллюсков на ферме в районе Севастополя // Уч. зап. Крымск. фед. ун-та им. В.И. Вернадского. География. Геология. 2019. Т. 5 (71). № 2. С. 308–321.
Холодов В.И., Пиркова А.В., Ладыгина Л.В. Выращивание мидий и устриц в Черном море. Севастополь: Ин-т биол. южных морей им. А.О. Ковалевского НАНУ. 2010. 424 с.
Черноморские моллюски: элементы сравнительной и экологической биохимии / Ред. Г.Е. Шульман, А.А. Солдатов. Севастополь: ЭКОСИ-Гидрофизика. 2014. 323 с.
Borodina A.V., Zadorozhny P.A. Ecological features of the accumulation of carotenoids in the Black Sea mollusks // IOP Conference Series: Earth and Environmental Science. 2021. V. 937. Art. 022077.
Carotenoids. V. 1B: Spectroscopy. Basel: Birkhäuser. 1994. 360 p.
Maoka T., Akimoto N., Yim M.J. et al. New C37 skeletal carotenoid from the clam, Paphia amabillis // J. Agric. Food Chem. 2008. V. 56. № 24. P. 12069–12072.
Maoka T. Carotenoids in Marine Animals // Mar. Drugs. 2011. V. 9. P. 278–293.
Matsuno T., Sakaguchi S., Ookubo M., Maoka T. Isolationand identification of amarouciaxanthin A from the bivalve Paphia euglypta (Sudaregai in Japanese) // Bull. Jpn. Soc. Sci. Fish. 1985. V. 51. № 11. P. 1909–1985.
Дополнительные материалы отсутствуют.
Инструменты
Биология моря



