Биология моря, 2022, T. 48, № 5, стр. 306-314
Оценка взаимного влияния микроводорослей Heterosigma akashiwo (Raphidophyceae) и Thalassiosira pseudonana (Bacillariophyta)
Ж. В. Маркина *
Национальный научный центр морской биологии им. А.В. Жирмунского (ННЦМБ) ДВО РАН
690041 Владивосток, Россия
* E-mail: zhannav@mail.ru
Поступила в редакцию 28.09.2021
После доработки 25.02.2022
Принята к публикации 24.03.2022
- EDN: JBCNGR
- DOI: 10.31857/S0134347522050060
Аннотация
В экспериментальных условиях исследовано взаимное влияние рафидофитовой микроводоросли Heterosigma akashiwo, вызывающей “цветения” в морских акваториях, и диатомеи Thalassiosira pseudonana, регулярно регистрируемой в водах морей. Эксперименты проводили с монокультурами, их фильтратами и со смешанными культурами при разных исходных концентрациях. Рост и физиологическое состояние микроводорослей оценивали методом проточной цитометрии. Показано, что в совместной культуре и при выращивании на фильтратах ингибировался рост обеих водорослей, но у T. pseudonana рост подавлялся в большей степени. У H. akashiwo, выращенной на фильтрате T. pseudonana, снижались флуоресценция хлорофилла а, содержание активных форм кислорода и нейтральных липидов. Подобные изменения отмечены и у T. pseudonana, выращенной на фильтрате H. akashiwo. На основе этого сделан вывод, что изученные водоросли проявляют аллелопатическую активность в отношении друг друга.
В разных районах Мирового океана рафидофитовая водоросль Heterosigma akashiwo вызывает “цветения” (Shikata et al., 2008; Dursun et al., 2016), приводящие к массовой гибели рыб (Taylor, 1993; Fuica et al., 2007) в результате выделения водорослью активных форм кислорода (Marshall et al., 2005). Концентрация ее клеток при “цветении” может достигать 400 тыс. кл/мл (Branco et al., 2014). В связи с этим важно исследовать экологию вида, воздействие на него как биотических, так и абиотических факторов. Работ по изучению влияния биотических факторов на H. akashiwo, в том числе о её взаимодействии с диатомовыми водорослями, в настоящее время немного (Yamasaki et al., 2007, 2009; Wang et al., 2017; Long et al., 2018).
Непосредственное взаимное влияние конкретных видов микроводорослей можно оценить в контролируемых условиях в лабораторном эксперименте. Одним из способов исследования биотических взаимодействий являются эксперименты с фильтратами монокультур, позволяющие исследовать отношения “среда−популяция”. Смешанные культуры позволяют оценить отношения “популяция−популяция”, а также изучить условия доминирования и элиминации видов (Михеев и др., 2018). Cмешанные культуры – это не просто смесь монокультур, так как их рост, биохимический состав и другие показатели у конкретного вида могут значительно отличатся от показателей этого же вида, регистрируемых в монокультуре (Huang et al., 2011).
Для оценки аллелопатического взаимного влияния на физиологическое состояние водорослей предлагается использовать следующие показатели: флуоресценция хлорофилла а как индикатор состояния фотосинтетического аппарата (Jamers et al., 2009; Hyka et al., 2013); содержание активных форм кислорода (АФК), возрастающее при неблагоприятном воздействии на живой организм (Gomes et al., 2005), а также содержание нейтральных липидов для оценки стрессового воздействия неблагоприятных условий на водоросли (Felpeto et al., 2019).
Диатомовая водоросль Thalassiosira pseudonana участвует в сукцессионном цикле фитопланктона и имеет важное экологическое значение как вид, влияющий на формирование “цветений” (Ianora et al., 2011), в том числе в умеренных и полярных водах (Harris et al., 1995). В дальневосточных морях в осенний сезон эта водоросль может встречаться одновременно с H. akashiwo (Орлова и др., 2009; Стоник, 2018; Шевченко и др., 2022). Представители данных родов в виде цист обнаружены совместно в донных отложениях (Орлова, Морозова, 2009).
Цель настоящей работы − исследование взаимного влияния микроводорослей H. akashiwo (Raphidophiceae) и T. pseudonana (Bacillariophyceae).
МАТЕРИАЛ И МЕТОДИКА
Объектами исследования служили культуры одноклеточных водорослей Heterosigma akashiwo MBRU_HAK-SR11 (Y. Hada) Y. Hada ex Y. Hara, M. Chihara (Raphidophyceae) и Thalassiosira pseu-donana MBRU_TSP-02 Hasle & Heimdal (Bacillariophyta). Водоросли выращивали на среде f (Guillard, Ryther, 1962), приготовленной на основе фильтрованной и стерилизованной морской воды соленостью 32‰, в 250-миллилитровых колбах Эрленмейера с объемом культуральной среды 100 мл при температуре 18°С, интенсивности освещения 70 мкмоль/м2/с в области видимого света и свето-темновым периодом 14 ч свет : 10 ч темнота. В качестве инокулята использовали культуры на экспоненциальной стадии роста. Начальные концентрации клеток (НКК) составляли 1.5 × 104 и 3.0 × 104 кл/мл для H. akashiwo, а также 10 × 104 и 30 × 104 кл/мл для T. pseudonana.
Экспериментальную работу проводили в три этапа. На первом этапе изучали динамику численности микроводорослей и их физиологические показатели (флуоресценция хлорофилла а, содержание АФК и нейтральных липидов) в монокультурах при разной начальной концентрации. На втором этапе исследовали рост и физиологические показатели в культуре H. akashiwo, выращенной на фильтратах T. pseudonana, а также в культуре T. pseudonana, выращенной на фильтратах H. akashiwo. На третьем этапе изучали рост микроводорослей в смешанных культурах H. akashiwo и T. pseudonana без оценки физиологических показателей.
Фильтраты микроводорослей H. akashiwo и T. pseudonana получали фильтрованием культур через мембраны МФАС-ОС-2 (“Владипор”, Россия); культуру второго вида предварительно центрифугировали в течение 10 мин при 7000 оборотов/мин. Для получения фильтратов культуры обеих водорослей отбирали на 10-е сут; в это время они находятся на одной и той же фазе роста, а культура H. akashiwo обладает наибольшей токсичностью (Yamasaki et al., 2007). Фильтраты проверяли под микроскопом, чтобы исключить присутствие в них клеток водорослей.
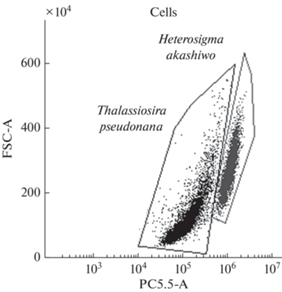
Продолжительность экспериментов составила 14 сут. Пробы для подсчета клеток отбирали через 3, 7, 10 и 14 сут. Для оценки флуоресценции хлорофилла а, определения содержания АФК и нейтральных липидов пробы отбирали через 7 и 14 сут опыта. Показатели измеряли на проточном цитометре CytoFLEX (Beckman Coulter, США). Для анализа в течение каждого измерения записали 10 000 событий (частиц, регистрируемых в пробе). Выбор клеток водорослей из общего числа событий, детектируемых цитометром, проводили по флуоресценции хлорофилла а (Hyka et al., 2013; Маркина, 2019). Размер клеток косвенно определяют на цитометре по показателю прямого светорассеяния (forward scattering – FSC): чем меньше данный показатель, тем меньше клетка. Клетки H. akashiwo обладают более интенсивной флуоресценцией хлорофилла а, чем клетки T. pseudonana. Благодаря этим особенностям детектируемые клетки можно отнести к конкретному виду исследуемых водорослей при их совместном культивировании (рис. 1).
Рис. 1.
Диаграмма разделения клеток популяций He-terosigma akashiwo и Thalassiosira pseudonana на проточном цитометре согласно размеру и флуоресценции хлорофилла а. По оси абсцисс – флуоресценция хлорофилла а клеток в канале PC5.5; по оси ординат – прямое светорассеяние, параметр FSC, который косвенно отображает размер клеток.
Интенсивность флуоресценции хлорофилла а регистрировали на длине волны 690 нм; длина волны возбуждения составляла 488 нм – канал PC 5.5 (Hyka et al., 2013). Продукцию АФК оценивали с помощью флуоресцентного красителя 2',7'-дихлородигидрофлуоресцеин диацетата, окрашивание проводили в течение 1 ч при комнатной температуре в темноте. Показатель флуоресценции его окисленного и диацетилированного продукта определяли на длине волны 525 нм; длина волны возбуждения 488 нм – канал FITC (Gomes et al., 2005). Содержание нейтральных липидов определяли по флуоресценции флуорохрома Nile Red в концентрации 1 мкг/мл; окрашивание проводили в течение 15 мин при комнатной температуре в темноте; длина волны возбуждения 488 нм, испускания 580 нм – канал PE (Alemán-Nava et al., 2016).
Эксперименты проводили в трех повторностях. Статистическую обработку выполняли с помощью программы Excel. На графиках представлены средние значения и стандартные отклонения.
РЕЗУЛЬТАТЫ
Рост и физиологические показатели Heterosigma akashiwo и Thalassiosira pseudonana в монокультуре
В популяции Heterosigma akashiwo с НКК 1.5 × × 104 кл/мл отмечена выраженная лаг-фаза (рис. 2а); в 2 раза число клеток увеличилось только на 7-е сут опыта, затем их численность возрастала более интенсивно. Рост популяции микроводоросли с НКК 3 × 104 кл/мл был отмечен уже в начале опыта, численность клеток монотонно увеличивалась и к концу эксперимента составляла 21.6 × 104 кл/мл. Флуоресценция хлорофилла а у H. akashiwo в монокультурах с разной НКК на 7-е и 14-е сут экспозиции достоверно не различалась (рис. 3а), но к завершению эксперимента несколько снизилась. Содержание АФК у водоросли на 14-е сут было выше, чем на 7-е (рис. 4а). В целом более высокое содержание АФК отмечено у культуры с НКК 1.5 × 104 кл/мл. Независимо от начальной концентрации водоросли содержание нейтральных липидов у H. akashiwo на 14-е сут было выше, чем на 7-е (рис. 5а).
Рис. 2.
Динамика численности клеток водорослей с разной исходной концентрацией в монокультурах (а – Heterosigma akashiwo, б – Thalassiosira pseudonana) и культурах, выращенных на фильтратах друг друга (в – H. akashiwo, культивируемая на фильтрате T. pseudonana; г – T. pseudonana, культивируемая на фильтрате H. akashiwo).
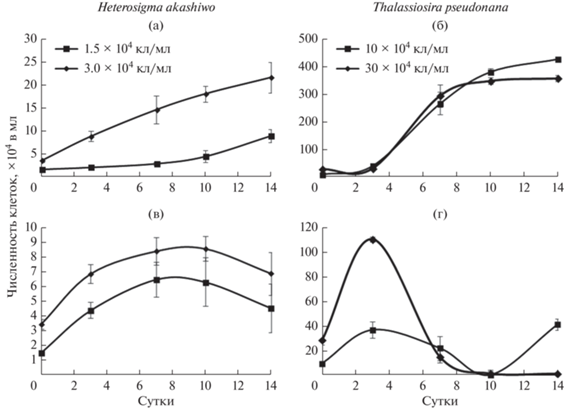
Рис. 3.
Детектированная на канале PC 5.5 флуоресценция хлорофилла а у водорослей с разной исходной концентрацией в монокультурах (а – Heterosigma akashiwo, б – Thalassiosira pseudonana) и в культурах, выращенных на фильтратах друг друга (в – H. akashiwo, культивируемая на фильтрате T. pseudonana; г – T. pseudonana, культивируемая на фильтрате H. akashiwo).
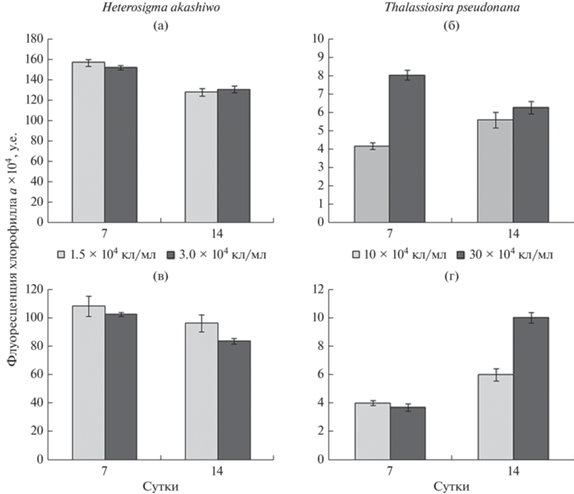
Рис. 4.
Флуоресценция клеток, окрашенных индикатором содержания активных форм кислорода 2',7'-дихлородигидрофлуоресцеин диацетатом, у водорослей с разной исходной концентрацией в монокультурах (а – Heterosigma akashiwo, б – Thalassiosira pseudonana) и в культурах, выращенных на фильтратах друг друга (в – H. akashiwo, культивируемая на фильтрате T. pseudonana; г – T. pseudonana, культивируемая на фильтрате H. akashiwo).
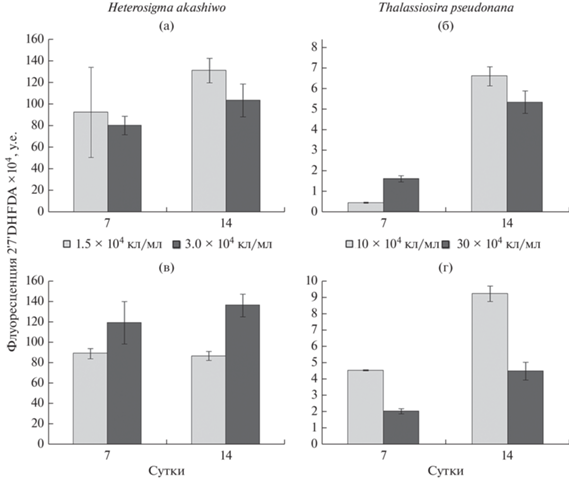
Рис. 5.
Флуоресценция клеток, окрашенных индикатором содержания нейтральных липидов Nile Red, у водорослей с разной исходной концентрацией в монокультурах (а – Heterosigma akashiwo, б – Thalassiosira pseudonana) и в культурах, выращенных на фильтратах друг друга (в – H. akashiwo, культивируемая на фильтрате T. pseudonana; г – T. pseudonana, культивируемая на фильтрате H. akashiwo).
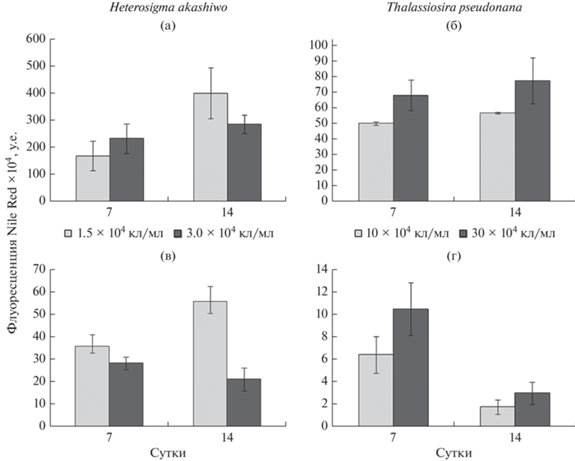
В монокультуре у Thalassiosira pseudonana при обеих начальных концентрациях лаг-фаза продолжалась до трех суток, с 3-х по 7-е сут наблюдалась экспоненциальная фаза, а с 7-х по 14-е – стационарная (рис. 2б). При НКК 10 × 104 и 30 × 104 кл/мл максимальная численность составляла 430 × 104 и 356 × 104 кл/мл соответственно. Флуоресценция хлорофилла а при НКК 10 × 104 кл/мл к концу эксперимента увеличилась, а при более высокой НКК, напротив, снизилась (рис. 3б). Содержание АФК у T. pseudonana в начале стационарной фазы возрастало при обеих начальных концентрациях клеток (рис. 4б). Содержание нейтральных липидов в культуре с НКК 10 × 104 кл/мл на протяжении всего опыта было ниже, чем в культуре с более высокой начальной концентрацией (рис. 5б)
Рост и физиологические показатели культур Heterosigma akashiwo и Thalassiosira pseudonana на фильтратах
При культивировании H. akashiwo на фильтратах T. pseudonana увеличение числа клеток отмечено в первые трое суток (рис. 2в); при НКК 1.5 × 104 кл/мл рост H. akashiwo был более интенсивным, чем в монокультуре. Однако при более высокой НКК количество клеток на протяжении всего опыта было ниже, чем в монокультуре. После 10 сут численность клеток в обоих случаях снижалась. Независимо от начальной концентрации флуоресценция хлорофилла а у H. akashiwo в течение всего опыта была ниже, чем в культуре, выращенной на чистой среде (рис. 3в). Содержание АФК было выше у культуры с НКК 3 × 104 кл/мл (рис. 4в); этот показатель оставался на одном уровне на 7-е и 14-е сут эксперимента. У культуры, выращенной на фильтратах T. pseudonana, содержание нейтральных липидов было более низким, чем у монокультуры, однако оно также увеличилось к завершению эксперимента (рис. 5в)
На фильтратах H. akashiwo численность клеток T. pseudonana при отсутствии лаг-фазы на 3-и сут увеличилась до 370 × 104 и 111 × 104 кл/мл при НКК 10 × 104 и 30 × 104 кл/мл соответственно (рис. 2г). К концу экспоненциальной фазы роста культуры численность клеток падала и продолжала снижаться до 10-х сут. На 14-е сут в культуре с низкой НКК численность клеток увеличилась до 41.5 × 104 кл/мл, а в культуре с НКК 30 × 104 кл/мл осталась на уровне 10-х сут – 1.5 × 104 кл/мл. Флуоресценция хлорофилла а в культуре с НКК 10 × 104 кл/мл не отличалась от этого показателя у водоросли в монокультуре (рис. 3г). В культуре с более высокой НКК флуоресценция изначально была ниже, чем в монокультуре, однако к концу экспозиции была выше, чем в монокультуре. Содержание АФК возрастало к концу экспозиции и в культуре с НКК 30 × 104 кл/мл было выше, чем в культуре с НКК 10 × 104 кл/мл (рис. 4г). Содержание нейтральных липидов при выращивании T. pseu-donana на фильтратах H. akashiwo существенно снижалось к концу опыта (рис. 5г).
Рост Heterosigma akashiwo и Thalassiosira pseu-donana при совместном культивировании
При совместном культивировании H. akashiwo и T. pseudonana с НКК 15 × 104 кл/мл численность H. akashiwo увеличивалась в начале эксперимента и в течение 10 сут не отличалась от этого показателя в монокультуре (рис. 6а). К концу экспозиции рост водоросли замедлился, и ее численность была ниже, чем в монокультуре. У культуры с НКК 3 × 104 кл/мл зарегистрированы 3-суточная лаг-фаза, а затем интенсивный рост, однако количество клеток в культуре было меньше, чем в контроле. Как и в монокультуре, число клеток интенсивнее увеличивалось при более высокой НКК. Рост H. akashiwo при совместном культивировании с T. pseudonana не зависел от концентрации T. pseudonana.
Рис. 6.
Динамика численности клеток водорослей Heterosigma akashiwo (а) и Thalassiosira pseudonana (б) в смешанной культуре. Условные обозначения: 1 – культуры H. akashiwo с начальной концентрацией клеток (НКК) 1.5 × 104 кл/мл и T. pseudonana с НКК 10 × 104 кл/мл; 2 – культуры H. akashiwo с НКК 1.5 × 104 кл/мл и T. pseudonana с НКК 30 × 104 кл/мл; 3 – культуры H. akashiwo с НКК 3 × 104 кл/мл и T. pseu-donana с НКК 10 × 104 кл/мл.
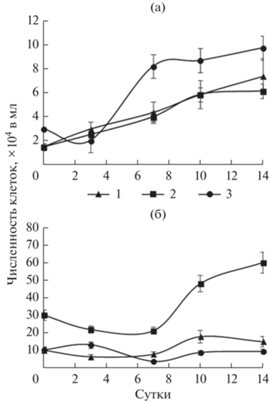
Рост T. pseudonana с НКК 10 × 104 кл/мл в смешанной культуре ингибировался в течение всего эксперимента и оставался на одном уровне (рис. 6б). В культуре с НКК 30 × 104 кл/мл количество клеток незначительно снижалось в течение семи суток и только к 10-м сут увеличилось до 60 × 104 кл/мл.
ОБСУЖДЕНИЕ
Проведенное исследование показало, что при совместном культивировании и выращивании на фильтратах культура Heterosigma akashiwo оказывала на Thalassiosira pseudonana большее влияние, чем культура T. pseudonana на H. akashiwo. Ранее было установлено, что при совместном культивировании H. akashiwo и Skeletonema costatum изменялся рост только S. costatum, который снижался на 13% по сравнению с таковым в монокультуре (Yamasaki et al., 2007). В тоже время при выращивании H. akashiwo на экстрактах Phaeodactylum tricornutum отмечена гибель большинства клеток H. akashiwo в результате лизиса. У выживших клеток наблюдали повреждение мембран, а также снижение эстеразной активности и флуоресценции хлорофилла а (Wang et al., 2017).
Культура водоросли T. pseudonana с НКК 30 × × 104 кл/мл при совместном культивировании с H. akashiwo росла более интенсивно, чем с НКК 10 × 104 кл/мл, однако при выращивании на фильтратах отмечен обратный эффект. Ранее было показано, что при экспонировании S. costatum на фильтратах H. akashiwo при низкой НКК S. costatum наблюдалось ингибирование ее роста, однако этого не происходило в культуре с высокой НКК (Yamasaki et al., 2007, 2009). Возможно, ингибирование роста T. pseudonana, отмеченное в экспериментах, связано в том числе и с более мелкими, чем у H. akashiwo, размерами. Небольшие виды с быстрым метаболизмом более чувствительны к веществам с аллелопатической активностью (Felpeto et al., 2019). Отметим, что при выращивании T. pseudonana на фильтратах численность клеток сначала увеличивалась, а затем выраженно снижалась. Такую же тенденцию наблюдали при выращивании пресноводной зеленой водоросли Chlorella vulgaris на фильтратах разных цианобактерий (Leão et al., 2009).
Несмотря на то, что рост популяций T. pseu-donana и H. akashiwo подавлялся, к концу эксперимента они не погибали, хотя известно, что вещества, выделяемые микроводорослями, например, представителями рода Alexandrium, способны вызвать иммобилизацию и лизис клеток в течение нескольких часов (Hatlenarth-Lehmann, Gobler, 2011; Fernández-Herrera et al., 2016; Zheng et al., 2016; Long et al., 2018).
При совместном культивировании высокий конкурентный эффект может достигаться не только за счет подавления одной культуры другой токсичными экзометаболитами, но и из-за изъятия питательных веществ при более быстром росте одной из культур или из-за бóльшей потребности в биогенах у одного вида, чем у другого. У мелких диатомовых часто наблюдается высокая скорость роста популяции, которая может приводить к более быстрому изъятию питательных веществ из среды по сравнению с таковым у конкурентных видов (Михеев и др., 2018). Возможно, по этой причине у H. akashiwo отмечено ингибирование роста при совместном культивировании с T. pseudonana, хотя и более слабое, чем при выращивании на фильтратах T. pseudonana. Ранее было показано, что фильтраты диатомовых Skeletonema marinoi и Thalassiosira sp. ингибировали рост Ostreopsis cf. ovata соответственно до 56 и 78% от роста в монокультуре (Pichierri et al., 2017). Авторы связали это с высоким производством диатомовыми полиненасыщенных альдегидов и жирных кислот, которые оказывают влияние на другие виды водорослей. Альдегиды диатомовых действуют как сигнальные молекулы, вызывая в клетке каскад реакций таргетного вида, что приводит к ее гибели. Виды рода Thalassiosira негативно воздействуют на клеточный цикл и вызывают апоптоз у других видов микроводорослей (Ianora et al., 2011; Felpeto, Vasconcelos, 2016).
В настоящем исследовании отмечено, что рост культуры T. pseudonana при НКК H. akashiwo 3 × 104 кл/мл подавлялся в большей степени, чем при НКК 1.5 × 104 кл/мл. Вероятно, важна концентрация обоих видов, а не только более аллелопатически агрессивного вида, так как при НКК T. pseudonana 30 × 104 кл/мл, несмотря на 7-суточную лаг-фазу, наблюдали выраженное увеличение числа клеток, не отмеченное при НКК 10 × 104 кл/мл. В эксперименте по совместному культивированию Trichormus doliolum и Anabaena variabilis установлено, что аллелопатически активный вид должен достигнуть определенной концентрации, прежде чем начнет доминировать (Hulot, Huisman, 2004).
В проведенном нами исследовании зарегистрировано снижение интенсивности флуоресценции хлорофилла а у H. akashiwo, выращенной на фильтрате T. pseudonana. Ранее Лонг с соавторами (Long et al., 2018) обнаружили, что фильтрат Alexandrium tamarense приводит к такому же эффекту с одновременным изменением липидного состава у Chaetoceros muelleri. На основе оценки эстеразной активности C. muelleri авторы пришли к выводу, что данные нарушения являются результатом повреждения наружных мембран, в том числе за счет продуцирования водорослью АФК. Одной из причин снижения флуоресценции хлорофилла а может быть разрушение мембран хлоропластов, которое наблюдали у P. tricornutum при совместном культивировании с A. tamarense (Zheng et al., 2016). Такой же эффект отмечен у водорослей разных отделов во время совместного культивирования с Sinechocystis sp. (Śliwińska-Wilczewska et al., 2018; Felpeto et al., 2019), а также у Ostreopsis cf. ovata при совместном культивировании с диатомовой водорослью Licmophora paradoxa (Ternon et al., 2018).
У T. pseudonana, выращенной на фильтрате H. akashiwo, отмечено небольшое увеличение АФК в течение эксперимента. Ранее такое явление наблюдали у C. muelleri при совместном культивировании c A. tamarense (Long et al., 2018). АФК могут выступать в роли сигнальных молекул, влияя на генетические процессы в клетках, что приводит как к появлению нежизнеспособных клеток, так и к возникновению организмов, более адаптированных к негативному воздействию (Felpeto, Vasconcelos, 2016).
В нашем эксперименте при культивировании на фильтратах в культурах обеих водорослей содержание нейтральных липидов снижалось. Ранее Поулин с соавторами (Poulin et al., 2018) отметили, что метаболиты Karenia brevis одновременно с ингибированием роста разрушают липиды мембран у T. pseudonana и Asterionellopsis gracialis.
Таким образом, согласно полученным результатам, микроводоросли H. akashiwo и T. pseu-donana не только влияют на рост, но и меняют физиологическое состояние друг друга. У обеих водорослей отмечено снижение флуоресценции хлорофилла а и содержания нейтральных липидов. Содержание АФК у H. akashiwo в монокультуре было выше, чем у водоросли, выращенной на фильтрате. Это позволяет предположить, что при моновидовом “цветении” H. akashiwo более токсична, чем в смешанных фитопланктонных сообществах. Так как рост и физиологическое состояние водорослей подавлялись при их выращивании на фильтратах, можно сделать вывод, что изученные микроводоросли оказывают друг на друга больше аллелопатическое, чем конкурентное, влияние. При более высокой НКК численность клеток в культурах H. akashiwo и T. pseu-donana достигает более высоких значений.
Список литературы
Маркина Ж.В. Проточная цитометрия как метод исследования морских одноклеточных водорослей: развитие, проблемы, перспективы // Биол. моря. 2019. Т. 45. № 5. С. 291–298.
Михеев М.А., Ипатова В.И., Спиркина Н.Е. Биотические взаимоотношения двух видов микроводорослей в смешанной культуре // Вестн. Моск. ун-та. Сер. 16. Биология. 2018. Т. 73. № 2. С. 78–84.
Орлова Т.Ю., Морозова Т.В. Покоящиеся стадии микроводорослей в поверхностных осадках залива Петра Великого Японского моря // Биол. моря. 2009. Т. 35. № 4. С. 256–265.
Орлова Т.Ю., Стоник И.В., Шевченко О.Г. Флора микроводорослей планктона Амурского залива Японского моря // Биол. моря. 2009. Т. 35. № 4. С. 48–61.
Стоник И.В. Качественный и количественный состав фитопланктона бухты Золотой Рог Японского моря // Изв. ТИНРО. 2018. Т. 194. С. 167–174.
Шевченко О.Г., Тевс К.О., Шулькин В.М., Шульгина М.А. Мониторинг фитопланктона и гидрохимических параметров прибрежных вод острова Русский (залив Петра Великого, Японское море) // Биол. моря. 2022. Т. 48. № 1. С. 44–53.
Alemán-Nava G.S., Cuellar-Bermudez S.P., Cuaresma M. et al. How to use Nile Red, a selective fluorescent stain for microalgal neutral lipids // J. Microbiol. Methods. 2016. V. 128. P. 74–79.
Branco S., Menezes M., Alves-de-Souza C. et al. Recurrent blooms of Heterosigma akashiwo (Raphidophyceae) in the Piraquê Channel, Rodrigo de Freitas Lagoon, southeast Brazil // Braz. J. Biol. 2014. V. 74. P. 529–537.
Dursun F., Taş S., Koray T. Spring bloom of the raphidophycean Heterosigma akashiwo in the Golden Horn Estuary at the northeast of Sea of Marmara // Ege J. Fish. Aquat. Sci. V. 2016. 33. P. 201–207.
Felpeto A.B., Śliwińska-Wilczewska S., Klin M. et al. Temperature-dependent impacts of allelopathy on growth, pigment, and lipid content between a subpolar strain of Synechocystis sp. CCBA MA-01 and coexisting microalgae // Hydrobiologia. 2019. V. 835. P. 117–128.
Felpeto A.B., Vasconcelos V.M. Allelopathic interactions in phytoplankton population ecology // JAI. 2016. V. 2. № 2. P. 25–34.
Fernández-Herrera L.J., Band-Schmidt C.J., López-Cortés D.J. et al. Allelopathic effect of Chattonella marina var. marina (Raphidophyceae) on Gymnodinium catenatum (Dinophycea) // Harmful Algae. 2016. V. 51. P. 1–9.
Fuica N., Rojas X., Clément A. et al. Ocurrencia e impacto de las FANs en la salmonicultura en el sur de Chile: análisis del programa de monitoreo de INTESAL de Salmón Chile // Salmociencia. 2007. V. 2. P. 61–71.
Gomes F., Ferdandes E., Lima J.F.L.C. Fluorescence probes used for detection of reactive oxygen species // J. Biophys. Biochem. Methods. 2005. V. 65. P. 45–80.
Guillard R.R.L., Ryther J.H. Studies of marine planktonic diatoms. 1. Cyclotella nana Hustedt, and Detonula confervacea (Cleve) Gran. // Can. J. Microbiol. 1962. V. 8. P. 229–239.
Harris A.S.D., Medlin L.K., Lewis J., Jones K.J. Thalassiosira species (Bacillariophyceae) from a Scottish sea-loch // Eur. J. Phycol. 1995. V. 30. 117–131.
Hatlenarth-Lehmann T.H., Gobler C.J. Allelopathic inhibition of competing phytoplankton by North American strains of the toxic dinoflagellate, Alexandrium fundyense: Evidence from field experiments, laboratory experiments, and bloom events 2011 // Harmful Algae. 2011. V. 11. P. 106–116.
Huang W.-W., Dong B.-Zh., Cai Zh.-P., Duan Sh.-Sh. Growth effects on mixed culture of Dunaliella salina and Phaeodactylum tricornutum under different inoculation densities and nitrogen concentrations // Afr. J. Biotechnol. 2011. V. 10. P. 13164−13174.
Hulot F., Huisman J. Allelopathic interactions between phytoplankton species: The roles of heterotrophic bacteria and mixing intensity // Limnol. Oceanogr. 2004. V. 49. P. 1424–1434.
Hyka P., Lickova S., Přibyl P. et al. Flow cytometry for deve-lopment of biotechnological processes with microalgae // Biotechnol. Adv. 2013. V. 31. P. 2–16.
Jamers A., Lenjou M., Deraedt P. et al. Flom cytometric analysis of the cadmium exploset green alga Chlamydomonas reinhardtii (Chlorophyceae) // Eur. J. Phycol. 2009. V. 44. P. 541–550.
Ianora A., Matthew G. B., Caldwell G.S. et al. The Relevance of Marine Chemical Ecology to Plankton and Ecosystem Function: An Emerging Field // Mar. Drugs. 2011 V. 9. P. 1625–1648.
Leão P.N., Teresa M., Vasconcelos S.D., Vítor M. Allelopa-thic activity of cyanobacteria on green microalgae at low cell densities // Eur. J. Phycol. 2009. V. 44. P. 347–355.
Long M., Tallec K., Soudant P. et al. Allelochemicals from Alexandrium minutum induce rapid inhibition of metabolism and modify the membranes from Chaetoceros muelleri // Algal Res. 2018. V. 35. P. 508–518.
Marshall J.-A., de Salas M., Oda Tatsuya, Hallegraeff G. Superoxide production by marine microalgae // Mar. Biol. 2005. V. 147. P. 533–540.
Pichierri S., Accoroni S., Pezzolesi L. et al. Allelopathic effects of diatom filtrates on the toxic benthic dinoflagellate Ostreopsis cf. Ovata // Mar. Envir. Res. 2017. V. 131. P. 116–122.
Poulin R.X., Poulson-Ellestad K.L., Roy J.S., Kubanek J. Variable allelopathy among phytoplankton reflected in red tide metabolome // Harmful Algae. 2018. V. 71. P. 50–56.
Shikata T., Yoshikawa S., Matsubara T. et al. Growth dynamics of Heterosigma akashiwo (Raphidophyceae) in Hakata Bay, Japan // Eur. J. Phycol. 2008. V. 43. № 4. P. 395–411.
Śliwińska-Wilczewska S., Felpeto A.B., Maculewicz J. et al. Allelopathic activity of the picocyanobacterium Sy-nechococcus sp. on unicellular eukaryote planktonic microalgae // Mar. Freshwater Res. 2018. https://doi.org/10.1071/MF18024
Taylor F.J.R. Current problems with harmful phytoplankton blooms in British Columbia waters // Toxic Phytoplankton Blooms in the Sea. Amsterdam: Elsevier. 1993. P. 699–704.
Ternon E., Pavaux A.-S., Marro S. et al. Allelopathic interactions between the benthic toxic dinoflagellate Ostreopsis cf. ovata and a co-occurring diatom 2018 // Harmful Algae. 2018. V. 75. P. 35–44.
Wang R., Xue Q., Wang J. et al. Effects of an allelochemical in Phaeodactylum tricornutum filtrate on Heterosigma akashiwo: morphological, physiological and growth effects // Chemosphere. 2017. V. 186. P. 527–534.
Yamasaki Y., Nagasoe S., Matsubara T. et al. Allelopathic interactions between the bacillariophyte Skeletonema costatum and the raphidophyte Heterosigma akashiwo // Mar. Ecol. Prog. Ser. 2007. V. 339. P. 83–92.
Yamasaki Ya., Shikata T., Nukata A. et al. Extracellular polysaccharide-protein complexes of a harmful alga mediate the allelopathic control it exerts within the phytoplankton community 2009 // ISME J. 2009. V. 3. P. 808–817.
Zheng J.-W., Li D.-W., Yang L. et al. Molecular exploration of algal interaction between the diatom Phaeodactylum tricornutum and the dinoflagellate Alexandrium tamarense // Algal Res. 2016. V. 17. P. 132–141.
Дополнительные материалы отсутствуют.


