Биология моря, 2023, T. 49, № 1, стр. 17-26
Влияние голодания на антиоксидантный комплекс двустворчатого моллюска Anadara kagoshimensis (Tokunaga, 1906) из Черного моря
О. Л. Гостюхина 1, *, А. А. Солдатов 1, 2
1 Институт биологии южных морей им. А.О. Ковалевского РАН
299011 Севастополь, Россия
2 ФГАОУ ВО Севастопольский государственный университет
299053 Севастополь, ул. Университетская, 33, Россия
* E-mail: gostolga@yandex.ru
Поступила в редакцию 01.04.2022
После доработки 28.06.2022
Принята к публикации 06.10.2022
- EDN: LRSBCY
- DOI: 10.31857/S0134347523010047
Аннотация
Исследовано влияние 30-суточного голодания на состояние антиоксидантного комплекса и перекисного окисления липидов в тканях черноморского двустворчатого моллюска Anadara kagoshimensis (Tokunaga, 1906). Животных содержали в аквариумах с системой закрытого водообмена и биофильтрацией воды. Определяли активность глутатионпероксидазы, глутатионредуктазы, супероксиддисмутазы и каталазы, а также содержание восстановленного глутатиона и ТБК-активных продуктов. Выявленные у анадары реакции антиоксидантного комплекса и перекисного окисления липидов имели тканевую специфику: в условиях голодания содержание ТБК-активных продуктов в гепатопанкреасе и ноге моллюска уменьшалось, а в жабрах не изменялось. Наиболее выраженные изменения антиоксидантного комплекса выявлены в гепатопанкреасе, где показано увеличение всех исследованных параметров. В ноге отмечен рост только показателей антиоксидантной глутатионовой системы, а в жабрах – только активности глутатионпероксидазы и содержания восстановленного глутатиона. Полученные результаты свидетельствуют об устойчивом антиоксидантно-прооксидантном равновесии двустворчатого моллюска A. kagoshimensis в условиях голодания.
Моллюски рода Anadara относятся к числу эврибионтных морских организмов, одним из наиболее устойчивых к действию таких экологически значимых факторов среды, как дефицит кислорода, эвтрофикация и заиление, что нередко наблюдают в Черном море (Анистратенко, Халиман, 2006; Ревков, 2016). У двустворчатого моллюска-вселенеца Anadara kagoshimensis (Tokunaga, 1906) (Bivalvia: Arcidae) отмечены особенности, отличающие его от других моллюсков, обитающих в Черном море. В эритроцитах A. kagoshimensis, как и других видов рода Anadara, содержится гемоглобин (Novitskaya, Soldatov, 2013) – белок, связывающий и запасающий кислород. Анадара устойчива и даже тяготеет к условиям заиления и гипоксии, эвтрофированным акваториям (Ревков, 2016). Она способна выживать при аноксии, гипоксии и даже заморах при очень низком содержании кислорода в среде (до 0.5 мл/л) в течение 5–7 сут (Miyamoto, Iwanaga, 2017). Отчасти это связывают с интенсивностью потребления кислорода, которая у анадары даже при нормоксии в 5–6 раз ниже, чем у массового черноморского моллюска Mytilus galloprovincialis Lamarck, 1819, а в метаболизме некоторых тканей вселенца преобладают анаэробные процессы (Солдатов и др., 2010).
Активность ферментов энергетического обмена лактат- (ЛДГ) и малатдегидрогеназы (МДГ) в тканях A. kagoshimensis в 2–6 раз выше, чем в тканях M. galloprovincialis (см.: Golovina et al., 2016). У A. kagoshimensis более низкий уровень перекисного окисления липидов (ПОЛ), но более высокие показатели антиоксидантного (АО) комплекса и других систем (уровень глутатиона, мочевины, аминокислот, каротиноидов и активность глутатионредуктазы и аланинаминотрансферазы), чем у таких двустворчатых моллюсков Черного моря, как аборигенный вид M. galloprovincialis и интродуцент Crassostrea gigas (Thunberg, 1793) (см.: Гостюхина, Андреенко, 2019; Gostiukhina, Golovina, 2013; Golovina et al., 2016). Вероятно, эти особенности наряду с другими чертами метаболизма определяют адаптации A. kagoshimensis к условиям обитания и место моллюска в структуре бентосных сообществ Черного моря (Ревков, 2016).
Среди экологически значимых факторов, действующих в водной среде, можно выделить голодание (дефицит пищи), которое является одним из видов гипометаболизма (Almeida, Di Mascio, 2011). Для большинства гидробионтов голодание является естественным и периодически может чередоваться с состоянием насыщения, например, при сезонной флуктуации биомассы первичных продуцентов (Истомина, Челомин, 2018), когда многие бентосные виды не питаются в течение недель и даже месяцев (Almeida, Di Mascio, 2011).
Голодание способствует развитию состояния стресса, когда организм либо лишен пищевых субстратов, либо получает их в недостаточном количестве, что характеризуется глубокими изменениями в метаболизме и может приводить к общему ослаблению организма (Горомосова, Шапиро, 1984). При голодании развивается ряд приспособительных реакций, ферментные системы организма адаптируются к отсутствию пищи, что сопровождается переходом к эндогенному питанию и затрагивает белково-углеводный, липидный и энергетический обмен (Зайчик, Чурилов, 2001; Андреенко и др., 2009; Almeida, Di Mascio, 2011), при этом у моллюсков меняется антиоксидантно-прооксидантный баланс (Ansaldo et al., 2007).
Предполагают, что основное негативное действие голодания связано с усилением генерации активных форм кислорода (АФК) в этот период. Отмечают, что организмы, устойчивые к гипометаболическим состояниям, обладают высокоэффективными защитными системами (Almeida, Di Mascio, 2011). Одной из важнейших защитных систем организма в условиях любого стрессорного воздействия является АО комплекс. Реакции показателей АО комплекса и ПОЛ в тканях гидробионтов при голодании разнообразны, имеют видовую и тканевую специфику, а также зависят от продолжительности периода пищевой депривации.
Исследовано влияние дефицита пищи на АО комплекс мидии Crenomytilus grayanus (Dunker, 1853) в течение двух недель (Истомина, Челомин, 2018), двустворчатого моллюска Sinonovacula constricta (Lamarck, 1818) в течение 6 сут (Zhang et al., 2010) и камбалы калкан Scophthalmus maeoticus (Pallas, 1814) – 8 сут (Гостюхина, Головина, 2011). Адаптивные реакции АО системы при голодании выявлены и у других моллюсков, например, у наземного вида Otala lactea (Müller, 1774) (см.: Ramnanan, Storey, 2006), у брюхоногого моллюска Nacella concinna (Strebel, 1908) (см.: Ansaldo et al., 2007), у пресноводного моллюска Pila globosa (Swainson, 1822) (см.: Bhunia et al., 2016) и др.
Опубликованы результаты изучения АО системы и ПОЛ у гидробионтов при голодании (Гостюхина, Головина, 2011; Истомина, Челомин, 2018; Ramnanan, Storey, 2006; Ansaldo et al., 2007; Zhang et al., 2010). Однако механизмы и особенности метаболизма, обеспечивающие адаптации животных к пищевой депривации, еще не ясны. Особенно актуальны такие исследования у видов с высокой устойчивостью к различным стресс-факторам среды, к числу которых относят A. kagoshimensis. В связи с этим цель настоящего исследования – выявить реакции защитного АО комплекса моллюска-вселенца в Черное море A. kagoshimensis на действие голодания как экологически значимого фактора. Полученные сведения позволят расширить представление об адаптивных возможностях и о функциональном разнообразии адаптационных реакций у этого вида в условиях его обитания.
МАТЕРИАЛ И МЕТОДИКА
Половозрелых особей анадары Anadara kagoshimensis собирали в апреле 2020 г. на мидиево-устричной ферме в районе пос. Кацивели (Южный берег Крыма, Черное море) на глубине 1.5–2.0 м при температуре воды 14–15°С и солености 17–18‰. Длина раковины моллюсков составляла 32–36 мм. После транспортировки животных 2–3 сут выдерживали в проточных аквариумах для акклимации, затем их разделили на две группы (контрольную и опытную) и на 30 сут поместили в непроточные аквариумы (объем 150 л) с аэрацией. Во время эксперимента параметры морской воды в аквариумах были такими же, как в море: температура – 14–15°С, соленость – 17–18‰, концентрация кислорода – 7.3–7.6 мг/л.
В аквариумах была установлена система закрытого водообмена с биофильтрацией воды: на фильтрах формируется бактериальная флора, которая поглощает нитраты и нитриты, происходит денитрификация воды, что препятствует развитию бактерий и микроводорослей. В аквариумах ежедневно заменяли 10% объема воды для удаления продуктов обмена.
Моллюсков контрольной группы ежедневно кормили микроводорослями (Tetraselmis viridis, штамм IBSS-25, 5–10 мл/50 л морской воды), а особи опытной группы пищу не получали. Визуально наблюдали снижение интенсивности открытия и закрытия створок у моллюсков опытной группы, что указывало на уменьшение их фильтрационной активности. Поступление питательных веществ к моллюскам было ограничено, так как в аквариумы подавалась фильтрованная морская вода лишь с остаточным количеством пищевых частиц, не удаленных фильтрами. В течение эксперимента гибели моллюсков не наблюдали. Через 30 сут у моллюсков выделяли гепатопанкреас, жабры и ногу; ткани сразу замораживали и хранили при температуре –80°С. В дальнейшем ткани гомогенизировали при температуре 0–4°С. Гомогенаты центрифугировали (3200 g, 15 мин) (Centrifuge 5424 R, Eppendorf).
Активность ГП определяли по накоплению окисленного глутатиона (Paglia, Valentine, 1967), активность ГР – по уменьшению уровня НАДФН (Marques et al., 2016). Активность СОД оценивали по степени ингибирования восстановления нитросинего тетразолия (НСТ) (Nishikimi et al., 1972), а каталазы – по реакции остаточных количеств пероксида водорода с молибдатом аммония (Goth, 1991). Активность ферментов определяли при температуре 25.0 ± 0.5°С. Содержание восстановленного глутатиона (GSH) оценивали по реакции с аллоксановым реактивом (Путилина, 1982). Интенсивность ПОЛ измеряли по уровню продуктов, реагирующих с 2-тиобарбитуровой кислотой (ТБК-активных продуктов) (Ohkawa et al., 1979).
Для статистической обработки цифрового материала использовали стандартные программы Past 3 и Grapher 7. В каждой группе было по 21 моллюску. Рассчитывали среднее арифметическое и ошибку среднего. Для оценки достоверности различий применяли U-критерий Манна–Уитни. Различия считали статистически достоверными при значении р ≤ 0.05. На рисунках результаты представлены как среднее ± ошибка среднего.
РЕЗУЛЬТАТЫ
В гепатопанкреасе и ноге голодавших моллюсков содержание ТБК-активных продуктов по сравнению с таковым у питавшихся особей было ниже соответственно – в 1.6 (р ≤ 0.05) и 2.2 раза (р ≤ 0.01). В жабрах анадары изменений не выявлено (рис. 1а).
Рис. 1.
Содержание ТБК-активных продуктов (а) и восстановленного глутатиона (GSH) (б) в тканях анадары Anadara kagoshimensis при 30-суточном голодании. А – контрольная группа, Б – голодание; 1 – гепатопанкреас, 2 – жабры, 3 – нога. *Отличия достоверны при р ≤ 0.05–0.01 (критерий Манна–Уитни).
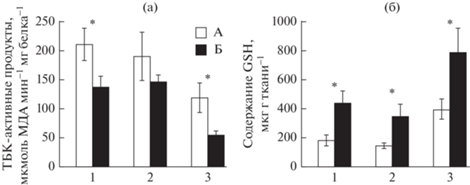
Показатели АО комплекса, напротив, преимущественно увеличились. Так, содержание GSH в тканях возросло в 1.9–2.3 раза (р ≤ 0.05–0.01) (рис. 1б). На этом фоне активность ГП и ГР при голодании во всех исследованных тканях анадары увеличилась в 1.7–3.3 раза, за исключением активности ГР в жабрах (рис. 2а, 2б). Наибольшее увеличение активности ГП отмечено в гепатопанкреасе – в 3.3 раза (р ≤ 0.01), а ГР в ноге – в 1.8 раза (р ≤ 0.01). В жабрах выявлена тенденция к увеличению активности ГР в 1.4 раза, однако отличия не были достоверными.
Рис. 2.
Активность ГП (а) и ГР (б) в тканях анадары Anadara kagoshimensis при 30-суточном голодании. A – контрольная группа, Б – голодание; 1 – гепатопанкреас, 2 – жабры, 3 – нога. *Отличия достоверны при р ≤ 0.05–0.01 (критерий Манна–Уитни).
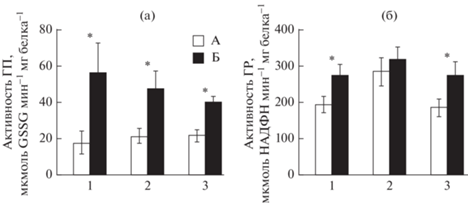
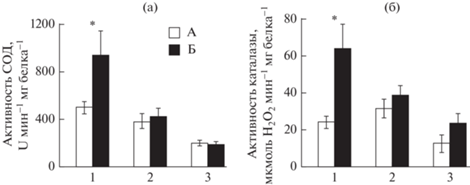
Повышение активности СОД и каталазы в условиях голодания зарегистрировано только в гепатопанкреасе анадары – в 1.9 и 2.6 раза (р ≤ 0.05–0.01) соответственно. В жабрах и ноге моллюска эти показатели оставались на прежнем уровне (рис. 3а, 3б).
Рис. 3.
Активность СОД (а) и каталазы (б) в тканях анадары Anadara kagoshimensis при 30-суточном голодании. А – контрольная группа, Б – голодание; 1 – гепатопанкреас, 2 – жабры, 3 – нога. *Отличия достоверны при р ≤ 0.05–0.01 (критерий Манна–Уитни).
Для повышения информативности полученных результатов были рассчитаны коэффициенты корреляции для двух групп моллюсков в трех исследованных тканях в норме и при голодании (см. табл. 1). Наиболее высокие значения коэффициента получены в жабрах голодавших особей для следующих пар показателей: активность ГП и уровень GSH, активность ГП и ГР, СОД и каталазы (прямая связь), а также для активности СОД и уровня GSH (обратная связь). В гепатопанкреасе наиболее высокий коэффициент корреляции рассчитан для активности СОД и каталазы, а также для активности ГП и уровня GSH (прямая связь). Более низкими были коэффициенты корреляции для следующих пар показателей: активность ГП и ГР (прямая связь), а также активность СОД–уровень GSH (обратная связь), что отражает взаимосвязь средней силы. О взаимосвязи средней силы у моллюсков обеих групп в ноге свидетельствуют коэффициенты корреляции для показателей: активность ГП–уровень GSH (прямая связь у моллюсков обеих групп), активность СОД–уровень GSH (обратная – у голодавших особей).
Таблица 1.
Коэффициенты корреляции для показателей антиоксидантного комплекса в тканях анадары в норме и при голодании
| Пара показателей | Вид ткани | |||||
|---|---|---|---|---|---|---|
| гепатопанкреас | жабры | нога | ||||
| контроль | голодание | контроль | голодание | контроль | голодание | |
| Активность ГП–уровень GSH | 0.683 | 0.756 | 0.814 | 0.870 | 0.590 | 0.658 |
| Активность ГП и ГР | 0.526 | 0.586 | 0.842 | 0.985 | 0.275 | 0.304 |
| Активность СОД–уровень GSH | –0.528 | –0.581 | –0.653 | –0.793 | –0.542 | –0.885 |
| Активность СОД и каталазы | 0.896 | 0.923 | 0.881 | 0.900 | 0.374 | 0.411 |
ОБСУЖДЕНИЕ
Известно, что адаптация к состоянию голодания протекает как ряд процессов, связанных с общим снижением скорости метаболизма и направленных на поддержание энергии в клетке и на выживание организма. Происходит снижение основного обмена, ферментативной активности и ограничение аэробных процессов (Зайчик, Чурилов, 2010). Основное негативное действие голодания связывают с ростом генерации активных форм кислорода (АФК) в данный период, что можно объяснить участием АФК в стрессовых реакциях, клеточном цикле, энергетическом обмене, работе фагоцитирующих клеток (Almeida, Di Mascio, 2011). Эти процессы, очевидно, влияют на состояние АО комплекса и ПОЛ моллюска.
Интенсивность ПОЛ
Снижение уровня ПОЛ, очевидно, связано со снижением скорости обмена в целом и, в частности, с уменьшением уровня биосинтеза жирных кислот и липидов в условиях снижения/прекращения поступления необходимых питательных веществ. Как известно, жиры – это основной запасной энергетический субстрат организма, и для получения энергии при голодании они используются в первую очередь. Снижение жировых запасов при голодании выявлено у многих видов рыб. На начальных этапах дефицита пищи используются триацилглицериды, идет катаболизм жирных кислот, снижается ресурс холестерина. В целом процессы синтеза жирных кислот и липогенеза у голодающих животных замедляются или прекращаются (Shikata, Shimeno, 1997; Gao et al., 2004).
Установленные нами изменения, вероятно, связаны с длительностью пищевой депривации. В первые сутки голодания уровень ПОЛ может повышаться в связи с увеличением синтеза АФК (Almeida, Di Mascio, 2011) и наличием определенных запасов липидных субстратов. При 30-суточном дефиците пищи нами отмечено снижение ПОЛ, что, очевидно, связано со снижением количества липидов и других окисляемых субстратов в тканях. Уменьшение скорости процессов ПОЛ у моллюсков при голодании вследствие замедления метаболизма и снижения уровня свободно-радикального окисления (СРО) отмечали и другие исследователи: в гепатопанкреасе двустворчатых моллюсков Nacella concinna (см.: Ansaldo et al., 2007) и Crenomytilus grayanus (см.: Истомина, Челомин, 2018), а также в нервной ткани брюхоногого моллюска Lymnaea stagnalis (Linnaeus, 1758) (см.: Sidorov, Maslova, 2009).
Одной из причин снижения содержания продуктов ПОЛ у моллюсков при дефиците пищи считают также активацию в этих условиях лизосомальной аутофагии, что исследовано в гепатопанкреасе мидии M. galloprovincialis (см.: Moore et al., 2007). В данном процессе утилизируются части поврежденных клеток и молекул, а также продукты распада, образующиеся при голодании. Следовательно, это может способствовать снижению количества окисляемых субстратов, общего содержания АФК в клетке и уменьшению интенсивности ПОЛ в целом. С данными причинами связывают снижение уровня ПОЛ в гепатопанкреасе дальневосточной мидии M. galloprovincialis при голодании (Истомина, Челомин, 2018).
Антиоксидантный комплекс
Полученные результаты можно связать как со специфическими для каждой ткани анадары особенностями, так и с общими для всего организма процессами при голодании у моллюсков.
Тканевые особенности. При голодании и других состояниях гипометаболизма у моллюсков отмечают тканеспецифические изменения в АО активности и уровне ПОЛ (Hermes-Lima, Storey, 1995; Nowakowska et al., 2009). В настоящем исследовании у A. kagoshimensis также выявлены тканевые особенности реакций АО комплекса и ПОЛ на дефицит пищи.
Гепатопанкреас. При голодании рост параметров антиоксидантной глутатионовой системы (АГС) наблюдали во всех исследованных тканях анадары. В гепатопанкреасе моллюска отмечено также увеличение активности каталазы и СОД на фоне снижения уровня ПОЛ. Причем в гепатопанкреасе голодавших особей выявлены наибольшая активность каталазы, а также ее наибольший рост среди исследованных показателей моллюсков. Увеличение активности СОД отмечено только в этом органе моллюска. Данные реакции указывают на высокий уровень АО защиты в гепатопанкреасе анадары, где протекают основные метаболические реакции и высокий уровень обмена веществ в целом, в том числе интенсивность СРО. Такой тип отклика АО комплекса на стресс в гепатопанкреасе анадары вполне согласуется с ее конститутивными особенностями (Гостюхина, Андреенко, 2019), а именно с активным участием в АО защите как ферментного, так и низкомолекулярного звена. Эти выводы подтверждены и значениями коэффициента корреляции r в гепатопанкреасе при голодании. Наиболее высокие величины найдены между активностью ГП и уровнем GSH (0.75), а также активностью СОД и каталазы (0.92), что отражает тесную положительную взаимосвязь между этими показателями и синергизм в процессах АО защиты гепатопанкреаса.
Наиболее высокие значения показателей АО комплекса у моллюсков при гипометаболизме исследователи также определяют в гепатопанкреасе. Так, в пищеварительной железе спящего летом моллюска O. lactea выявлена наибольшая активность глутатионзависимых ферментов (Hermes-Lima, Storey, 1995). Напротив, у моллюска Helix pomatia Linnaeus, 1758 в состоянии летней спячки наибольшими значениями в гепатопанкреасе отличались не ферменты, а низкомолекулярный глутатион, что, по мнению авторов, обеспечило наименьший уровень ПОЛ в этом органе. Относительно постоянный высокий уровень глутатиона предполагает наличие эффективной АО защиты при возврате моллюска H. pomatia к активному состоянию (Nowakowska et al., 2009). Это отмечают и другие авторы. У покоящихся особей Helix aspersa уровень глутатиона в гепатопанкреасе был значительно выше, чем у пробудившихся моллюсков (Ramos-Vasconcelos, Hermes-Lima, 2003).
Нога. В ноге анадары в состоянии голодания нами выявлено увеличение всех показателей АГС, а также отмечена тенденция к росту активности каталазы. При этом снижение уровня ПОЛ в ноге голодавшей анадары было больше, чем падение данного показателя в гепатопанкреасе. В ноге у голодавших моллюсков по сравнению с питавшимися особями на фоне активации ГП отмечен одновременный рост активности ГР и уровня GSH, что, очевидно, связано с наращиванием ресурса этого антиоксиданта. GSH – важнейшее низкомолекулярное соединение, обеспечивающее защиту от АФК и продуктов ПОЛ. Причем содержание GSH в ноге анадары было наибольшим по сравнению с его содержанием в других тканях как у питавшихся, так и у голодавших моллюсков. На этом фоне активность СОД в условиях отсутствия пищи не менялась, а активность каталазы показала лишь тенденцию к росту. Данные результаты свидетельствуют о доминировании АГС в АО защите ноги анадары при голодании. GSH способен инактивировать супероксидный радикал (${\text{O}}_{2}^{{ - \,\centerdot }}$), дополняя или замещая работу СОД, т.е. ферментного звена АО комплекса (Окислительный…, 2006). Этим свойством можно объяснить отсутствие изменений в активности СОД у голодавшей анадары: рост ресурса GSH, возможно, связан с участием данного метаболита в обезвреживании ${\text{O}}_{2}^{{ - \,\centerdot }}$, что не потребовало дополнительной активации СОД в ноге моллюска. Подобную взаимосвязь активности СОД и уровня GSH может подтвердить и то, что в естественных условиях обитания в тканях анадары высокий ресурс GSH сочетается с низкой активностью СОД, и наоборот (Гостюхина, Андреенко, 2019). С этим согласуются величины коэффициента корреляции r в ноге анадары: при голодании наиболее высокие значения получены для пары уровень глутатиона–активность СОД (–0.885), что указывает на высокую степень обратной взаимосвязи между данными показателями, а также для пары уровень глутатиона–активность ГП (0.659), что отражает синергическое взаимодействие глутатиона и фермента при инактивации перекисей.
Нога моллюска A. kagoshimensis обладает богатым количественным и качественным составом каротиноидов, имеющих АО свойства. В этом массивном органе происходит запасание данных веществ. Ранее показано (Gostyukhina et al., 2013), что в тканях анадары каротиноиды могут проявлять АО действие совместно с компонентами АО комплекса, в том числе с глутатионом. Кроме того, известна способность каротиноидов к потенцированию функции низкомолекулярных антиоксидантов, таких как GSH, и активности глутатионовых ферментов (Шашкина и др., 2010). Возможно, исходно высокий уровень каротиноидов в ноге моллюска способствовал длительному поддержанию высокого ресурса GSH даже в условиях окислительного стресса при депривации пищи. Как и в нашей работе, у моллюска Olivella lactea при гипометаболизме (во время летней спячки) увеличивалась активность глутатионовых ферментов (Hermes-Lima, Storey, 1995).
Жабры. В отличие от гепатопанкреаса и ноги, в жабрах наблюдали лишь рост активности ГП и уровня GSH на фоне постоянного уровня ПОЛ. Известно, что жабры характеризуются не столь высокими пластическими ресурсами и уровнем метаболизма, как гепатопанкреас. Тем не менее, жабры и в норме испытывают высокую окислительную нагрузку в силу функций фильтрации и газообмена. Однако при голодании интенсивность данных процессов, очевидно, существенно снижается на фоне общего падения скорости метаболизма. Это могло послужить причиной снижения уровня ПОЛ и активации в жабрах анадары показателей АГС – основной защитной системы жабр моллюсков, которая создает в них глутатион-зависимый защитный барьер и обеспечивает антиоксидантно-прооксидантное равновесие (Trevisan et al., 2016). Наши результаты также показали, что основную АО защиту жабр анадары при голодании, вероятно, обеспечивают ферменты ГП, ГР и ресурс GSH, в то время как активность ключевых ферментов СОД и каталазы не изменяется.
Тем не менее в жабрах отмечены наиболее высокие значения коэффициента корреляции r при голодании (для активности ГП и ГР – 0.985; для активности СОД и уровня глутатиона –0.793), а также в обеих группах (контрольная и голодание) для активности ГП и уровня глутатиона (0.814 и 0.870), активности СОД и каталазы (0.880 и 0.900). Это подчеркивает особую роль разных компонентов АО системы в защите жабр от окислительного повреждения ввиду уязвимости данного органа при различных неблагоприятных воздействиях.
Отсутствие изменений активности СОД и каталазы в жабрах и ноге анадары, выявленное нами при дефиците пищи, косвенно подтверждают и результаты исследования активности генов, кодирующих эти ферменты. У моллюска Laternula elliptica (King and Broderip, 1832) при голодании были выявлены лишь незначительные изменения в экспрессии данных генов в ответ на отсутствие пищи (Husmann et al., 2014), что указывает на высокую устойчивость АО системы этого моллюска.
Общие процессы. Полученные результаты могут быть связаны с рядом общих для организма процессов при голодании.
Известно, что на начальных этапах действия стресс-факторов, в том числе голодания, как правило, происходят активизация метаболизма, поддержание уровня энергетических субстратов, а затем, напротив, снижение интенсивности метаболизма, сокращение количества основных питательных веществ (углеводов, липидов, белков), падение уровня биосинтеза и общее истощение организма (Горомосова, Шапиро, 1984; Зайчик, Чурилов, 2001). В работе Головиной (2019) показано, что голодание анадары в течение 16 сут привело к снижению активности ЛДГ и увеличению активности МДГ, и, как следствие, – к росту индекса МДГ/ЛДГ в 2 раза в мышечной ткани анадары, а затем – к снижению этого индекса к 65-м сут голодания. Это указывает на постепенное истощение энергетических резервов моллюска при длительном голодании и подтверждает общую тенденцию к адаптации к стрессорному воздействию, в том числе к пищевой депривации.
У брюхоногого моллюска Nacella concinna после 1 мес. голодания также отмечали рост АО показателей – активности СОД, каталазы и ресурса GSH. Примечательно, что существенный рост уровня ПОЛ и содержания белка у моллюска наблюдали только в течение первой недели голодания, а затем данные показатели вернулись к исходным значениям (Ansaldo et al., 2007). Это позволяет предположить, что активация АО комплекса в таких условиях, вероятно, сдерживала рост ПОЛ и способствовала поддержанию АО-прооксидантного баланса. Сходные результаты в изменении общего содержания белка и интенсивности его синтеза в тканях в условиях пищевой депривации получены и для анадары (Андреенко и др., 2009; Shcherban, 2012).
Подобные процессы при голодании у моллюсков подтверждены и в ряде других исследований. У пресноводного моллюска Pila globosa (Swainson, 1822) в периоды гипометаболизма (летняя спячка, пробуждение, голодание) общее число гемоцитов было выше, чем во время обычной активности, при этом в тканях моллюска отмечали высокий уровень генерации ${\text{O}}_{2}^{{ - \,\centerdot }}$ и оксида азота. В гемоцитах голодавших моллюсков была выявлена наибольшая активность СОД и каталазы, несмотря на снижение уровня белка (Bhunia et al., 2016). Это может быть связано с тем, что гемоциты моллюсков генерируют ряд цитотоксических молекул, таких как ${\text{O}}_{2}^{{ - \,\centerdot }}$ и оксид азота, необходимых для осуществления фагоцитоза – важнейшего процесса иммунной защиты (Manduzio et al., 2005; Bhunia et al., 2016). Данные защитные реакции особенно важны при стрессе, в том числе в условиях голодания. Очевидно, что интенсивнее они могут протекать в гепатопанкреасе исследованной нами анадары, где высока общая метаболическая активность. При голодании в гепатопанкреасе усиливаются процессы катаболизма многих веществ и структур клетки, что также ведет к росту уровня АФК (Manduzio et al., 2005). Эти процессы (иммунные и детоксикации) могут объяснить выявленный нами в гепатопанкреасе голодавшей анадары рост активности СОД и каталазы, которые регулируют уровень ${\text{O}}_{2}^{{ - \,\centerdot }}$ и пероксида водорода в клетке, а также защищают ткани от окислительного повреждения.
Необходимо рассмотреть и усиление активности отдельных АО ферментов, выявленное нами при голодании у анадары. Так, рост активности ГР в гепатопанкреасе и ноге моллюска может быть обусловлен ростом активности основного фермента пентозофосфатного шунта – глюкозо-6-фосфатдегидрогеназы (Г6ФДГ). Г6ФДГ поддерживает клеточный пул НАДФН, необходимый в работе ГР по восстановлению глутатиона – ключевого низкомолекулярного антиоксиданта. Усиление активности Г6ФДГ при голодании показано в гепатопанкреасе наземного моллюска Olivella lactea: обнаружено две изоформы этого фермента, одна из которых более активна у питающихся моллюсков, а другая – у голодающих (Ramnanan, Storey, 2006). К сожалению, подобная информация о морских моллюсках отсутствует. Если допустить наличие особой изоформы Г6ФДГ и в тканях анадары при голодании, то это может прямо влиять на активность ГР и обеспечивать в условиях стресса рост ее активности. Это необходимо для поддержания ресурса GSH, критически важного для АО-прооксидантного равновесия в клетке. Дополнительным аргументом в пользу активации Г6ФДГ могут служить и изменения в углеводном метаболизме. Как известно, во время голодания содержание глюкозы в тканях снижается (Зайчик, Чурилов, 2001; Shikata, Shimeno, 1997). Для восполнения дефицита глюкозы активизируются процессы глюконеогенеза с участием свободных аминокислот. Так, у черноморской анадары Anadara inaequivalvis (Bruguiera, 1789), голодавшей 18 сут, уровень свободных аминокислот снижался, что связывают отчасти и с глюконеогенезом (Андреенко и др., 2009).
Выявленное нами увеличение активности ряда АО ферментов у анадары при голодании может быть и результатом дефицита в рационе питания низкомолекулярных веществ, таких как аскорбиновая кислота, α-токоферол и каротиноиды, которые являются хорошо известными антиоксидантами. Дефицит этих соединений может стать критическим фактором для АО статуса голодающих животных (Albentosa et al., 2007). Анадара A. kagoshimensis отличается высоким содержанием и разнообразием каротиноидов, особенно в ноге (Golovina et al., 2016). Как ранее показал корреляционный анализ, каротиноиды, обладающие АО действием, в тканях анадары проявляют положительную взаимосвязь с уровнем GSH, но отрицательную – с активностью ГП, ГР, СОД и каталазы, что может быть обусловлено конкурентными отношениями этих двух систем за одни и те же субстраты (Gostyukhina et al., 2013). Возможно, снижение уровня каротиноидов и других низкомолекулярных антиоксидантов в отсутствие пищи приводит к компенсаторной активации АО ферментов, утилизирующих те же виды АФК, что и каротиноиды. Это позволяет моллюску поддерживать в тканях необходимый АО-прооксидантный баланс. Ранее нами показано, что в тканях анадары подобный баланс поддерживается благодаря эффективному взаимодействию и частичному замещению функций друг друга компонентами низкомолекулярного и ферментного звена АО комплекса (Гостюхина, Андреенко, 2019).
ЗАКЛЮЧЕНИЕ
Таким образом, в тканях двустворчатого моллюска-вселенца Anadara kagoshimensis в условиях 30-суточного голодания реакции АО комплекса и ПОЛ имели тканевую специфику. Интенсивность ПОЛ снижалась в гепатопанкреасе и ноге, тогда как в жабрах оставалась неизменной. Наиболее выраженные реакции АО комплекса выявлены в гепатопанкреасе, что проявлялось в росте активности всех исследованных ферментов и ресурса глутатиона. В ноге анадары отмечено увеличение уровня глутатиона и активности ГП и ГР. В жабрах моллюска, в отличие от гепатопанкреаса и ноги, отмечено увеличение только активности ГП и уровня глутатиона на фоне постоянного уровня ПОЛ. В антиоксидантных реакциях в тканях голодавших моллюсков преобладали глутатион и ферменты глутатионовой системы. Выявленные реакции АО комплекса и ПОЛ у анадары при 30-суточном голодании свидетельствуют об устойчивом антиоксидантно-прооксидантном равновесии в тканях моллюска в этих условиях. Полученные результаты расширяют представления о функциональном разнообразии адаптационных реакций A. kagoshimensis при голодании.
Список литературы
Андреенко Т.И., Солдатов А.А., Головина И.В. Особенности реорганизации тканевого метаболизма у двустворчатого моллюска Anadara inaequivalvis (Bruguiere, 1978) в условиях экспериментального голодания // Мор. экол. журн. 2009. Т. 8. № 3. С. 15–24.
Анистратенко В.В., Халиман И.А. Двустворчатый моллюск Anadara inaequivalvis (Bivalvia, Arcidae) в северной части Азовского моря: завершение колонизации Азово-Черноморского бассейна // Вестн. зоологии. 2006. Т. 40. № 6. С. 505–511.
Головина И.В. Устойчивость к негативным воздействиям и соотношение активности ферментов энергетического обмена в тканях черноморских моллюсков Mytilus galloprovincialis Lamarck, 1819 и Anadara kagoshimensis (Tokunaga, 1906) // Мор. биол. журн. 2019. Т. 4. № 3. С. 37–47.
Горомосова С.А., Шапиро А.З. Основные черты биохимии энергетического обмена у мидий. М.: Легкая и пищевая промышленность. 1984. 120 с.
Гостюхина О.Л., Андреенко Т.И. Тканевый обмен и состояние антиоксидантного комплекса у черноморских моллюсков Mytilus galloprovincialis Lamarck, 1819 и Anadara kagoshimensis (Tokunaga, 1906) с разной устойчивостью к окислительному стрессу // Биол. моря. 2019. Т. 45. С. 197–207.
Гостюхина О.Л., Головина И.В. Особенности системы антиоксидантной защиты тканей черноморской камбалы калкан при кратковременном голодании // Доповiдi НАН України. 2011. № 4. С. 143–147.
Истомина А.А., Челомин В.П. Влияние совместного действия голодания и меди на антиоксидантную систему Crenomytilus grayanus (Dunker, 1853) // Изв. Самарского научного центра РАН. 2018. Т. 20. № 5. С. 97–103.
Зайчик А.Ш., Чурилов Л.П. Основы патохимии. В 3 т.: Т. 2. Патофизиология. СПб.: ЭЛБИ. 2001. 687 с.
Окислительный стресс. Прооксиданты и антиоксиданты / Под ред. Е.Б. Меньщиковой, В.З. Ланкина, И.А. Бондарь и др. М.: Фирма “Слово”. 2006. 556 с.
Путилина Ф.Е. Определение содержания восстановленного глутатиона в тканях // Методы биохимических исследований. Л.: Изд-во ЛГУ. 1982. С. 183–187.
Ревков Н.К. Особенности колонизации Черного моря недавним вселенцем – двустворчатым моллюском Anadara kagoshimensis (Bivalvia: Arcidae) // Мор. биол. журн. 2016. Т. 1. № 2. С. 3–17.
Солдатов А.А., Андреенко Т.И., Головина И.В., Столбов А.Я. Особенности организации тканевого метаболизма у моллюсков с различной толерантностью к внешней гипоксии // Журн. эвол. биохим. и физиол. 2010. Т. 46. № 4. С. 341–349.
Шашкина М.Я., Шашкин П.Н., Сергеев А.В. Роль каротиноидов в профилактике наиболее распространенных заболеваний // Рос. биотерапевт. журн. 2010. Т. 9. № 1. С. 77–86.
Albentosa M., Fernandez-Reiriz M.J., Labarta U., Pérez-Camacho A. Response of two species of clams, Ruditapes decussatus and Venerupis pullastra, to starvation: physiological and biochemical parameters // Comp. Biochem. Physiol. 2007. V. 146. № 2. P. 241–249.
Almeid A.E., Di Mascio P. Hypometabolism and antioxidative defense systems in marine invertebrates // Hypometabolism: Strategies of Survival in Vertebrates and Invertebrates. ISBN: 978-81-308-0471-2 / Ed. A. Nowakowska. Moscow: Caputa, 2011, P. 39–55.
Ansaldo M., Sacristan H., Wider E. Does starvation influence the antioxidant status of the digestive gland of Nacella concinna in experimental conditions? // Comp. Biochem. Physiol. Part C: Toxicol. Pharmacol. 2007. V. 146. № 1–2. P. 118–123.
Bhunia A.S., Mukherjee S., Bhunia N.S. et al. Immunological resilience of a freshwater Indian mollusk during aestivation and starvation // Aquacult. Rep. 2016. V. 3. P. 1–11.
Gao L., Chen L., Song B. Effect of starvation and compensatory growth on feeding, growth and body biochemical composition in Acipenser schrenckii juveniles // J. Fish. China. 2004. V. 28. № 3. P. 279–284.
Golovina I.V., Gostyukhina O.L., Andreyenko T.I. Specific metabolic features in tissues of ark clam Anadara kagoshimensis Tokunaga, 1906 (Bivalvia: Arcidae), a Black Sea invader // Russ. J. Biol. Invasions. 2016. V. 7. № 2. P. 137–145.
Gostiukhina O.L., Golovina I.V. Comparative analysis of antioxidant complex of the Black Sea mollusks Mytilus galloprovincialis, Anadara inaequivalvis and Crassostrea gigas // Hydrobiol. J. 2013. V. 49. № 3. P. 77–84.
Gostyukhina O.L., Soldatov A.A., Golovina I.V., Borodina A.V. Content of carotenoids and the state of tissue antioxidant enzymatic complex in bivalve mollusc Anadara ina-equivalvis Br. // J. Evol. Biochem. Physiol. 2013. V. 49. № 3. C. 309–315.
Goth L.A. A simple method for determination of serum ca-talase activity and revision of reference range // Clin. Chim. Acta. 1991. V. 196. № 2–3. P. 143–151.
Hermes-Lima M., Storey K.B. Antioxidant defenses and metabolic depression in a pulmonate land snail // Am. J. Physiol., Regular., Integrated and Comp. Physiol. 1995. V. 268. № 6. P. 1386–1393.
Husmann G., Abele D., Rosenstiel P. et al. Age-dependent expression of stress and antimicrobial genes in the hemocytes and siphon tissue of the Antarctic bivalve, Laternula elliptica, exposed to injury and starvation // Cell Stress and Chaperones. 2014. V. 19. № 1. P. 15–32.
Manduzio H., Rocher B., Durand F. et al. The point about oxidative stress in mollusks: A review // ISJ. 2005. V. 2. P. 91–104.
Marques A., Piló D., Araújo O. et al. Propensity to metal accumulation and oxidative stress responses of two benthic species (Cerastoderma edule and Nephtys hombergii): are tolerance processes limiting their responsiveness? // Ecotoxicology. 2016. V. 25. № 4. P. 664–676.
Miyamoto Y., Iwanaga C. Effects of sulphide on anoxia-driven mortality and anaerobic metabolism in the ark shell Anadara kagoshimensis // J. Mar. Biol. Association UK. 2017. V. 97. № 2. P. 329–336.
Moore M.N., Viarengo A., Donkin P., Hawkins A.J. Autophagic and lysosomal reactions to stress in the hepatopancreas of blue mussels // Aquat. Toxicol. 2007. V. 84. № 1. P. 80–91.
Nishikimi M., Rao N.A., Yagi K. The occurrence of supero-xide anion in the reaction of reduced phenazine methosulphate and molecular oxygen // Biochem. Biophys. Res. Commun. 1972. V. 46. № 2. P. 849–854.
Novitskaya V.N., Soldatov A.A. Peculiarities of functional morphology of erythroid elements of hemolymph of the Bivalve mollusk Anadara inaequivalvis, the Black Sea // Hydrobiol. J. 2013. V. 49. № 6. P. 64–71.
Nowakowska A., Swiderska-Kolacz G., Rogalska J., Caputa M. Antioxidants and oxidative stress in Helix pomatia snails during estivation // Comp. Biochem. Physiol. Part C: Toxicol. Pharmacol. 2009. V. 150. № 4. P. 481–486.
Ohkawa H., Ohishi N., Yagi K. Assay for lipid peroxides in animal tissues by thiobarbituric acid reaction // Anal. Biochem. 1979. V. 95. № 2. P. 351–358.
Paglia D., Valentine W. Studies on the quantitative and qua-litative characterization of erythrocyte glutathione pe-roxidase // J. Lab. Clin. Med. 1967. V. 70. № 1. P. 158–169.
Ramnanan C.J., Storey K.B. Glucose-6-phosphate dehydrogenase regulation during hypometabolism // Biochem. Biophys. Res. Com. 2006. V. 339. № 1. P. 7–16.
Ramos-Vasconcelos G.R., Hermes-Lima M. Hypometabolism, antioxidant defenses and free radical metabolism in the pulmonate land snail Helix aspersa // J. Exp. Biol. 2003. V. 206. № 4. P. 675–685.
Sidorov A.V., Maslova G.T. Antioxidant defense in the central nervous ganglions of mollusk Lymnaea stagnalis // Proc. Natl. Acad. Sci., Belarus, Biol. ser. 2009. № 1. P. 91–95.
Shcherban S.A. Tissue peculiarities of the protein anabolism in bivalve mollusk Anadara inaequivalvis in norm, under food deficit and anoxia // Hydrobiol. J. 2012. V. 48. № 2. P. 21–29.
Shikata T., Shimeno S. Effects of feed restriction and starvation on fatty acid synthesis and oxidation of glucose and alanine in carp hepatopancreas // Fish. Sci. Tokyo. 1997. V. 63. № 2. P. 301–303.
Trevisan R., Mello D., Delapedra G. et al. Gills as a glutathione-dependent metabolic barrier in Pacific oysters Crassostrea gigas: Absorption, metabolism and excretion of a model electrophile // Aquat. Toxicol. 2016. V. 173. P. 105–119.
Zhang C.J., Liu J., Chen J.H. et al. Effects of starvation and refeeding on digestive enzyme activity and antioxidative capacity of razor clam (Sinonovacula constricta) // J. Fish. China. 2010. V. 34. № 7. P. 1106–1112.
Дополнительные материалы отсутствуют.


