Биология моря, 2023, T. 49, № 2, стр. 94-104
Сравнительный морфометрический анализ азовского (Engraulis encrasicolus maeoticus Pusanov, 1926) и черноморского (E. encrasicolus ponticus Alexandrov, 1927) анчоусов по форме тела
М. В. Чесалин 1, *, В. Н. Никольский 1
1 Институт биологии южных морей имени А.О. Ковалевского РАН
299011 Севастополь, Россия
* E-mail: chesalin.mikhail@yandex.ru
Поступила в редакцию 24.08.2022
После доработки 18.10.2022
Принята к публикации 24.11.2022
- EDN: DVFNOQ
- DOI: 10.31857/S0134347523020043
Аннотация
Выполнен сравнительный анализ по форме тела 841 анчоуса из 21 улова в Азовском море, Керченском проливе и в Черном море у побережья Крыма и северо-восточного побережья Кавказа в 2006–2007 и 2016–2017 гг. В качестве признаков были выбраны 23 измерения между 12 гомологичными точкам тела каждой особи по схеме “Truss Network System”. Выявлены значимые различия между азовским анчоусом Engraulis encrasicolus maeoticus Pusanov, 1926 и черноморским анчоусом E. encrasicolus ponticus Alexandrov, 1927 по 15 признакам. Особи азовского подвида имели бóльшие относительные размеры по всем признакам головного отдела, высоте туловищного отдела, относительной длине оснований спинного и анального плавников, высоте основания хвостового плавника. У особей черноморского подвида оказались больше постдорсальная длина и расстояние от конца основания спинного плавника до конца основания анального. На основании многомерного анализа методом главных компонент установлено, что наибольшую изменчивость проявляют признаки, характеризующие высоту тела, которая зависит от упитанности рыб и демонстрирует сезонную динамику. Вторая группа объединяет признаки, которые не имеют сезонной составляющей (размеры головного отдела, длины оснований спинного и анального плавников, постдорсальное расстояние) и могут быть использованы для различения формы азовского и черноморского анчоусов. Успешность классификации азовского и черноморского анчоусов по признакам формы тела методом дискриминантного анализа составила 83.4%.
Европейский анчоус Engraulis encrasicolus (Linnaeus, 1758) распространен в восточной части Атлантического океана от берегов Норвегии до Южной Африки, а также в бассейне Средиземного моря, включая Черное и Азовское (Whitehead et al., 1988). В настоящее время Генеральная комиссия по рыболовству в Средиземном море (GFCM) и Научно-технический и экономический комитет по рыболовству (STECF) выделяют две промысловые популяции европейского анчоуса в Восточной Атлантике, пять популяций в Средиземном море и два подвида в Черном море (GFCM, 2014; STECF, 2015). Эти популяции и подвиды рассматриваются как отдельные единицы запасов, и к ним применяются разные методы оценки величины биомассы и регулирования промысла.
В Азово-Черноморском бассейне европейский анчоус представлен двумя подвидами: азовским (Engraulis encrasicolus maeoticus Pusanov, 1926) и черноморским (E. encrasicolus ponticus Alexandrov, 1927). В настоящее время азовский анчоус добывается почти исключительно Российской Федерацией во время осенней миграции через Керченский пролив и на местах зимовки у побережья Северного Кавказа и Крыма. Азовский анчоус – это основной биоресурс российского промысла в Азово-Черноморском бассейне, составляющий около половины рыбных уловов. В отдельные годы его уловы достигали почти 50 тыс. тонн (Шляхов и др., 2018). Черноморский анчоус является основной промысловой рыбой в Черном море (около 85% от общих уловов всех черноморских рыб) и добывается всеми причерноморскими странами, но в основном Турцией (в среднем более 220 тыс. т). Российской Федерацией в 2014–2020 гг. у побережья Крыма было добыто от 0.3 до 5.7 тыс. тонн черноморского анчоуса. Согласно современным правилам российского рыболовства (Шляхов и др., 2018), анчоусов из уловов западнее мыса Сарыч относят к черноморскому подвиду, а восточнее – к азовскому подвиду. В связи с таким формальным подходом существует проблема достоверности статистики уловов и оценки запасов, которые необходимы для установления лимитов вылова и рациональной организации промысла. Следовательно, разработка методов для идентификации азовского и черноморского анчоусов в уловах имеет важное практическое значение.
Азовский и черноморский анчоусы могут образовывать смешанные зимовальные скопления у побережья Кавказа, а также у берегов Крыма (Майорова, 1950; Зуев и др., 2007; Chashchin, 1996). Известны находки азовского анчоуса в западной части Черного моря у берегов Болгарии (Chashchin, 1996). Недавние исследования показали, что часть популяции азовского анчоуса может весной не возвращаться в Азовское море, а перемещаться вдоль южного побережья Кавказа в воды Турции (Düzgüneş et al., 2018). Более того, выйдя осенью из Керченского пролива, азовский анчоус может пересекать Черное море по периферии восточного циклонического круговорота, следуя к берегам Турции в район Синопа (Guraslan et al., 2017). С другой стороны, черноморский анчоус может заходить также и в Азовское море (Данилевский, 1960).
Специалисты из разных стран использовали разнообразные подходы для идентификации азовского и черноморского анчоусов. В результате традиционных морфологических исследований показаны некоторые отличия между двумя подвидами по ряду пластических и меристических признаков (Пузанов, Цееб, 1926; Александров, 1927; Шевченко, 1980). Показаны отличия между азовской и черноморской хамсой по форме отолитов (Сказкина, 1965; Водясова, Солдатов, 2017). Найдены различия в интенсивности зараженности этих подвидов паразитическими нематодами (Терехов, 1979; Чащин, 1981). Ю.П. Алтухов с соавторами (Алтухов и др., 1969) обнаружили две группы крови у черноморского и три группы крови у азовского анчоусов. Выявлены отличия этих анчоусов по ряду биохимических показателей (Доброволов, 1978; Калнин, Калнина, 1984а, 1984б; Ivanova, Dobrovolov, 2006), а также по жирности и жирнокислотному составу липидов (Юнева и др., 2014). Недавние генетические исследования показали высокую степень обмена генами между азовским и черноморским анчоусами и отсутствие у них различий подвидового ранга (Водясова, Абрамсон, 2017; Düzgüneş et al., 2018). Однако существует и противоположная точка зрения, согласно которой азовский анчоус относится к прибрежному экотипу и должен рассматриваться как отдельный вид E. maeoticus (Pusanov & Tzeeb, 1926) (Bonhomme et al., 2022). К сожалению, большинство методов определения трудоемки и неприменимы для оперативной идентификации этих подвидов в уловах. Простой метод различения азовского и черноморского анчоусов по соотношению длины и ширины их отолитов (Сказкина, 1965) не нашел широкого применения, за исключением работ Г.В. Зуева с соавторами (2007, 2011, 2014).
В качестве альтернативы традиционной морфометрии была предложена система измерений формы тела рыб между гомологичными точками (“landmarks”) по схеме, подобной расположению ферм железнодорожного моста (“Truss Network System”) (Strauss, Bookstein, 1982; Bookstein, 1991; Rohlf, Marcus, 1993). Эта система чувствительна к изменчивости формы тела рыб и совместно с методами многомерного анализа данных представляет собой мощный инструмент для дифференциации запасов рыб (Cadrin et al., 2014). Такой подход применяли при изучении структуры запасов европейского анчоуса Восточной Атлантики, Средиземноморских морей и Черного моря (Bembo et al., 1996; Caneco et al., 2004; Turan et al., 2004; Kristoffersen, Magoulas, 2008; Erdoğan et al., 2009).
В данном исследовании мы поставили задачу провести сравнение изменчивости формы тела азовского и черноморского анчоусов с помощью многомерных методов анализа данных на основе схемы измерений по “Truss Network System” и оценить возможность применения этого подхода для дифференциации подвидов анчоуса в российских водах Черного моря.
МАТЕРИАЛ И МЕТОДИКА
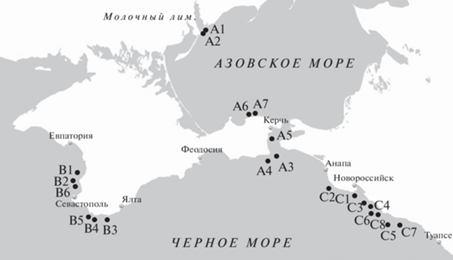
Морфометрические измерения выполнены на 841 экз. анчоусов, отобранных из 10 уловов в 2006–2007 гг. и 11 уловов в 2016–2017 гг. (табл. 1, рис. 1). Нумерация проб включает обозначение района сбора: A – Азовское море и Керченский пролив; B – у западного и южного побережья Крыма; С – у Северного Кавказа. В соответствии с особенностями географического распределения и миграционного поведения анчоусов, а также на основе информации о ходе промысла, предполагалось, что уловы у южного и юго-западного побережья Крыма представлены черноморским подвидом, а из Азовского моря, Керченского пролива и у Кавказского побережья – азовским.
Таблица 1.
Информация о пробах анчоуса для морфометрического анализа
| Код пробы | Дата поимки | Район | Число рыб |
Длина рыб,* мм |
Предполагаемый подвид анчоуса |
|---|---|---|---|---|---|
| A1 | 15.08.2006 | Азовское море (Молочный лиман) | 40 | 85 (70–110) | Азовский |
| A2 | 15.10.2006 | Азовское море (Молочный лиман) | 33 | 93 (64–115) | Азовский |
| A3 | 12.11.2006 | Керченский пролив | 40 | 103 (90–117) | Азовский |
| A4 | 19.11.2006 | Керченский пролив | 40 | 95 (87–108) | Азовский |
| B1 | 01.12.2006 | Крым (мыс Лукулл) | 40 | 97 (91–113) | Черноморский |
| B2 | 05.12.2006 | Крым (мыс Лукулл) | 40 | 107 (85–132) | Черноморский |
| B3 | 07.11.2006 | Крым (Симеиз) | 40 | 104 (87–115) | Черноморский |
| B4 | 15.12.2006 | Крым (Форос) | 40 | 102 (92–115) | Черноморский |
| B5 | 27.11.2006 | Крым (мыс Айя) | 40 | 101 (88–111) | Черноморский |
| A5 | 10.04.2007 | Керченский пролив | 40 | 96 (85–106) | Азовский |
| A6 | 25.10.2016 | Азовское море (пос. Золотое) | 40 | 96 (85–106) | Азовский |
| A7 | 24.11.2016 | Азовское море (пос. Золотое) | 40 | 93 (84–104) | Азовский |
| C1 | 18.12.2016 | АнапаТуапсе | 40 | 96 (83–110) | Азовский |
| C2 | 20.01.2017 | Анапа–Туапсе | 43 | 97 (87–111) | Азовский |
| C3 | 28.01.2017 | Анапа–Туапсе | 40 | 98 (87–112) | Азовский |
| C4 | 29.01.2017 | Анапа–Туапсе | 40 | 98 (90–111) | Азовский |
| C5 | 02.02.2017 | Анапа–Туапсе | 40 | 99 (89–110) | Азовский |
| C6 | 18.02.2017 | Анапа–Туапсе | 40 | 98 (88–108) | Азовский |
| C7 | 03.03.2017 | Анапа–Туапсе | 40 | 96 (88–104) | Азовский |
| C8 | 13.03.2017 | Анапа–Туапсе | 40 | 95 (87–103) | Азовский |
| B6 | 08.05.2017 | Крым (мыс Лукулл) | 45 | 88 (54–115) | Черноморский |
Рис. 1.
Карта расположения мест отбора проб для морфометрического анализа азовского и черноморского анчоусов.
Из каждого улова отбирали выборку по 40 экз. После проведения комплекса промеров все рыбы подвергались стандартному биологическому анализу, включая определение пола по гонадам и возраста по отолитам. Морфометрические измерения выполняли следующим образом. Рыбу укладывали правой стороной тела на плотную прозрачную пленку (ацетатный лист, под который был подложен белый лист бумаги A4 с разметкой), выравнивали вдоль горизонтальной линии, расправляли ее плавники, а затем обкалывали вокруг тела с помощью препаровальной иглы по 12 характерным меткам (рис. 2а). Метки располагали так же, как в подобных работах по европейскому анчоусу (Caneco et al., 2004; Turan et al., 2004; Erdoğan et al., 2009). Далее с помощью планшетного сканера получали цифровое изображение листа с морфологическими метками. Двумерные координаты меток тела каждой рыбы оцифровывали с помощью свободно распространяемой программы обработки изображений ImageJ. В качестве признаков, характеризующих форму тела рыб, использовали 23 расстояния между выбранными метками, которые образуют каркас по схеме, представленной на рис. 2б. Описание измерений приведено в табл. 2. Расстояния по полученным координатам рассчитывали с помощью разработанного нами макроса в программе Excel.
Рис. 2.
Расположение характерных морфологических меток (точек) вокруг тела рыбы (а) и схема измеряемых расстояний между метками (каркасная решетка), использованная при морфометрическом анализе анчоусов (б).

Таблица 2.
Измеряемые расстояния между метками, используемые для характеристики формы тела рыбы
| Расстояние | Описание |
|---|---|
| 1–6 | От конца рыла до конца позвоночного столба (стандартная длина, SL) |
| 1–2 | От конца рыла до конца основания черепа |
| 1–11 | От конца рыла до начала основания грудного плавника |
| 1–12 | От конца рыла до конца нижней челюсти (длина нижней челюсти) |
| 2–3 | От конца основания черепа до начала основания спинного плавника |
| 2–10 | От конца основания черепа до конца основания брюшного плавника |
| 2–11 | От конца основания черепа до начала основания грудного плавника |
| 2–12 | От конца основания черепа до конца нижней челюсти |
| 3–4 | Длина основания спинного плавника |
| 3–9 | От начала основания спинного плавника до начала основания анального плавника |
| 3–10 | От начала основания спинного плавника до конца основания брюшного плавника |
| 3–11 | От начала основания спинного плавника до начала основания грудного плавника |
| 4–5 | От конца основания спинного плавника до начала хвостового плавника (постдорсальная длина) |
| 4–8 | От конца основания спинного плавника до конца основания анального плавника |
| 4–9 | От конца основания спинного плавника до начала основания анального плавника |
| 4–10 | От конца основания спинного плавника до конца основания брюшного плавника |
| 5–7 | От начала хвостового плавника со спинной стороны до начала хвостового плавника с брюшной стороны (высота основания хвостового плавника) |
| 5–8 | От начала хвостового плавника с дорсальной стороны до конца основания анального плавника |
| 5–9 | От начала хвостового плавника с дорсальной стороны до начала основания анального плавника |
| 7–8 | От начала хвостового плавника с брюшной стороны до конца анального плавника (длина хвостового стебля) |
| 8–9 | Длина основания анального плавника |
| 9–10 | От начала анального плавника до конца основания брюшного плавника |
| 10–11 | От конца основания брюшного плавника до начала основания грудного плавника |
| 11–12 | От начала грудного плавника до конца нижней челюсти |
Для сравнительного анализа сначала традиционно использовали относительные значения признаков в процентах от стандартной длины рыбы (расстояние 1–6). Для многомерного анализа все измерения были трансформированы по формуле аллометрического преобразования относительно средней длины рыб (Elliott et al., 1995):
(1)
${{M}_{t}} = {{M}_{o}}{{({{{{L}_{m}}} \mathord{\left/ {\vphantom {{{{L}_{m}}} {{{L}_{o}}}}} \right. \kern-0em} {{{L}_{o}}}})}^{b}},$Статистический анализ данных выполняли также с помощью программы PAST. Проверку соответствия признаков нормальному распределению осуществляли по критерию Шапиро−Уилка. Анализировали отличия средних значений по каждому признаку в отдельности в случае соответствия выборок нормальному распределению по критерию Стьюдента, в противном случае, ориентировались на значения непараметрического критерия – перестановочного теста Монте-Карло. Нулевая гипотеза принималась при уровне значимости α > 0.05 и отвергалась при α < 0.01. Анализ общей изменчивости формы тела рыб проводили с помощью метода главных компонент (Principal Component Analysis – PCA) по ковариационной матрице размерно-корректированных признаков всех рыб без учета подвидовой принадлежности. Для визуализации отношений между отдельными индивидами и выборками рыб были построены графики рассеяния с локализацией центроидов выборок в проекции на плоскость первых двух главных компонент. Для оценки возможности классификации азовского и черноморского анчоусов по форме тела использовали линейный дискриминантный анализ (Linear Discriminant Analysis – LDA), априорно задав принадлежность рыб к определенному подвиду согласно табл. 1. Успешность классификации оценивали по той же выборке, по которой вычисляли дискриминантную функцию, поэтому применяли метод “складного ножа” (jackknife), как один из методов перекрестной проверки и генерации повторных выборок, используемый для оценки погрешности в статистическом выводе.
РЕЗУЛЬТАТЫ
Относительные размеры тела
Стандартная длина тела исследованных анчоусов значительно варьировала (54–132 мм), составив в среднем 95.9 ± 0.6 мм для азовского анчоуса и 99.7 ± 1.4 мм для черноморского. Для сравнительного анализа были рассчитаны относительные размеры для 23 морфометрических признаков в процентах от стандартной длины тела. Однофакторный дисперсионный анализ не выявил (P > 0.05) статистически значимых различий между самками и самцами по каждому измеряемому морфометрическому признаку, поэтому в дальнейшем анализ выполняли на смешанном по полу материале. Выборки азовского и черноморского анчоусов значимо различались по большинству (15 из 23) признаков (табл. 3). Особи азовского подвида имели бóльшие относительные размеры по всем признакам головного отдела, по высоте туловищного отдела (2–10, 3–9, 3–10 и 4–10), по относительной длине оснований спинного (3–4) и анального (8–9) плавников, а также по высоте основания хвостового плавника (5–7). У особей черноморского подвида оказалась больше постдорсальная длина (4–5) и расстояние от конца основания спинного до конца основания анального (4–8) плавников. Следует отметить, что большинство (13 из 23) рассматриваемых признаков характеризуются достоверной отрицательной аллометрией (т.е. по мере увеличения длины рыб относительное значение признака снижается), по шести признакам, наоборот, установлена положительная аллометрия, и только по четырем признакам значимых отклонений от изометрического роста не выявлено. В связи с этим найденные различия между выборками могут быть связаны не только с различиями в пропорциях тела, но и с разницей в размерах рыб.
Таблица 3.
Одномерная статистика отдельных признаков формы тела анчоусов
| Отдел тела | Измеряемое расстояние | Аллометрия | Пределы варьирования (%) | Средние значения (%) | P* | ||
|---|---|---|---|---|---|---|---|
| А | В | А | В | ||||
| Головной | 1–2 | – | 14.2–21.7 | 12.5–20.0 | 17.3 | 15.9 | <0.01 |
| 1–11 | – | 23.4–31.1 | 22.4–30.5 | 28.0 | 27.0 | <0.01 | |
| 1–12 | – | 7.6–12.7 | 7.1–12.2 | 9.9 | 9.5 | <0.01 | |
| 2–11 | нет | 14.6–23.9 | 15.9–21.0 | 19.1 | 18.3 | <0.01 | |
| 2–12 | – | 9.3–19.7 | 9.8–17.0 | 14.9 | 13.4 | <0.01 | |
| 11–12 | – | 14.6–21.7 | 14.9–21.7 | 18.9 | 18.2 | <0.01 | |
| Туловищный | 2–3 | + | 28.8–39.9 | 29.5–41.3 | 34.1 | 34.3 | 0.09 |
| 2–10 | + | 28.8–40.0 | 26.8–38.4 | 35.1 | 34.4 | <0.01 | |
| 9–10 | + | 15.0–26.1 | 16.2–24.7 | 21.2 | 21.3 | 0.34 | |
| 10–11 | + | 16.7–25.3 | 17.3–26.7 | 20.5 | 20.6 | 0.60 | |
| 3–9 | – | 18.5–28.8 | 19.8–27.2 | 24.0 | 23.5 | <0.01 | |
| 3–10 | – | 11.6–22.8 | 10.9–19.8 | 17.2 | 16.4 | <0.01 | |
| 3–11 | нет | 23.7–33.9 | 23.6–32.6 | 28.5 | 28.4 | 0.21 | |
| 4–8 | нет | 18.9–28.7 | 19.4–28.6 | 24.1 | 24.5 | <0.01 | |
| 4–9 | – | 11.8–19.9 | 10.5–19.2 | 15.5 | 15.6 | 0.22 | |
| 4–10 | – | 17.5–27.7 | 16.0–26.7 | 21.8 | 21.1 | <0.01 | |
| Хвостовой | 4–5 | + | 32.0–40.1 | 32.7–41.7 | 36.3 | 37.1 | <0.01 |
| 5–7 | – | 5.6–10.0 | 5.4–9.1 | 7.9 | 7.2 | <0.01 | |
| 5–8 | нет | 13.7–22.8 | 14.0–22.5 | 17.6 | 17.7 | 0.17 | |
| 5–9 | – | 27.8–36.1 | 27.1–37.3 | 32.0 | 31.8 | 0.08 | |
| 7–8 | + | 10.5–21.6 | 10.6–20.7 | 15.0 | 15.3 | 0.03 | |
| Плавники | 3–4 | – | 8.7–15.4 | 8.3–15.4 | 12.5 | 11.5 | <0.01 |
| 8–9 | – | 10.5–18.9 | 10.8–19.8 | 15.0 | 14.7 | <0.01 | |
Общая изменчивость формы тела
Средняя стандартная длина тела анчоусов по всем пробам составила 97 мм, и для дальнейшего сравнительного анализа все измерения были приведены к этой “эталонной” длине по формуле (1). После аллометрического преобразования значимость различий азовского и черноморского подвидов по отдельным признакам сохраняется, за исключением признака 8–9 (табл. 4). Преобразованные признаки не коррелируют с длиной рыб, их распределения становятся симметричными и приближаются к нормальному по коэффициенту асимметрии (P > 0.4), однако большинство признаков не соответствует строго нормальному распределению по эксцессу, так как имеет более острую вершину. При применении многомерных методов ординации, таких как анализ главных компонент, требование нормальности исходных переменных не обязательно, но оно является основной предпосылкой для применения линейного дискриминантного анализа (Афифи, Эйзен, 1982). На графике, построенном по результатам анализа главных компонент, каждая рыба представлена точкой на плоскости двух первых главных компонент (рис. 3а). Облака точек азовского и черноморского подвидов значительно перекрываются, при этом полигон точек азовского подвида гораздо обширнее и практически покрывает полигон черноморского подвида. Но центроиды выборок азовского и черноморского анчоусов расположены в противоположных квадрантах и различия между ними статистически значимы: в меньшей степени по первой главной компоненте (Р = 0.003) и в большей степени − по второй (Р < 0.001).
Таблица 4.
Одномерная статистика признаков формы тела анчоусов после аллометрического преобразования (приведения к средней длине 97 мм)
| Отдел тела | Измеряемое расстояние | Корреляция с Ку |
Среднее значение и 95% предел варьирования признака (мм) | P* | |
|---|---|---|---|---|---|
| А | В | ||||
| Головной | 1–2 | –0.19 | 16.7 ± 2.3 | 15.5 ± 2.1 | <0.01 |
| 1–11 | –0.16 | 27.1 ± 2.1 | 26.3 ± 2.8 | <0.01 | |
| 1–12 | −0.06 | 9.6 ± 1.5 | 9.3 ± 1.8 | <0.01 | |
| 2–11 | 0.18 | 18.5 ± 2.2 | 17.7 ± 2.1 | <0.01 | |
| 2–12 | –0.09 | 14.3 ± 2.4 | 13.1 ±2.2 | <0.01 | |
| 11–12 | –0.15 | 18.3 ± 2.0 | 17.7 ± 2.1 | <0.01 | |
| Туловищный | 2–3 | 0.10 | 33.2 ± 2.9 | 33.2 ± 3.0 | 0.96 |
| 2–10 | 0.23 | 34.1 ± 3.0 | 33.4 ± 3.3 | <0.01 | |
| 9–10 | 0.18 | 20.6 ± 2.7 | 20.6 ± 2.8 | 0.86 | |
| 10–11 | 0.13 | 19.9 ± 2.4 | 19.9 ± 2.5 | 0.69 | |
| 3–9 | 0.43 | 23.3 ± 2.6 | 22.9 ± 2.6 | <0.01 | |
| 3–10 | 0.41 | 16.6 ± 3.0 | 16.0 ± 2.7 | <0.01 | |
| 3–11 | 0.29 | 27.7 ± 2.6 | 27.5 ± 3.1 | 0.12 | |
| 4–8 | 0.15 | 23.3 ± 2.8 | 23.8 ± 3.2 | <0.01 | |
| 4–9 | 0.39 | 15.0 ± 2.7 | 15.1 ± 2.6 | 0.12 | |
| 4–10 | 0.34 | 21.1 ± 2.9 | 20.5 ± 3.2 | <0.01 | |
| Хвостовой | 4–5 | 0.01 | 35.2 ± 2.5 | 36.0 ± 3.3 | <0.01 |
| 5–7 | 0.13 | 7.6 ± 1.0 | 7.1 ± 1.2 | <0.01 | |
| 5–8 | 0.06 | 17.1 ± 2.6 | 17.2 ± 2.7 | 0.16 | |
| 5–9 | –0.03 | 30.9 ± 2.4 | 26.6 ± 3.0 | 0.58 | |
| 7–8 | 0.05 | 14.6 ± 2.9 | 14.8 ± 3.1 | 0.08 | |
| Плавники | 3–4 | 0.14 | 12.1 ± 1.9 | 11.3 ± 2.2 | <0.01 |
| 8–9 | –0.09 | 14.5 ± 2.5 | 14.3 ± 2.8 | 0.023 | |
Рис. 3.
Результаты анализа общей изменчивости формы тела анчоусов по 23 признакам в проекции на плоскость первых двух главных компонент: а – относительное положение отдельных особей (азовский анчоус отмечен кружками, черноморский – точками) и расположение центроидов для азовского (А) и черноморского (В) подвидов; б – векторы нагрузок признаков; в – относительное положение центроидов выборок, объединенных по месяцам с октября 2016 по май 2017 гг.; г – положение центроидов всех исследованных проб.

Наибольший вклад в первую главную компоненту ГК1, объясняющую 18.5% общей изменчивости, вносят признаки, связанные с высотой тела: 3–9, 3–10, 3–11, 4–9, 4–10 (рис. 3б). Это расстояния, измеряемые от точек 9, 10, 11, расположенных на брюшной части тела. Характерно, что эти признаки положительно коррелируют с коэффициентом упитанности рыб (r = 0.3–0.4, P < 0.001) в отличие от других признаков, корреляция которых с упитанностью рыб мала, либо отсутствует (табл. 4). Поскольку упитанность рыб имеет ярко выраженный сезонный характер, изменчивость формы рыб в направлении первой главной компоненты имеет сезонную составляющую, что отчетливо прослеживается в последовательном смещении центроидов выборок азовского анчоуса, объединенных по месяцам, от октября к маю вдоль первой главной компоненты в сторону уменьшения (рис. 3в). Вторая главная компонента ГК2, объясняющая 15.3% общей изменчивости, объединяет признаки, связанные с размерами головного отдела (1–2, 1–11, 2–12, 11–12), длинами оснований спинного (3–4) и анального (8–9) плавников – с положительным знаком, а также связанные с размерами хвостового отдела (4–5, 5–8, 7–8) – с отрицательным знаком. Эти признаки не коррелируют с упитанностью рыб и могут рассматриваться как потенциальные для различения формы азовского и черноморского анчоусов.
На рис. 3г показано относительное положение центроидов исследованных проб в проекции на ту же плоскость первых двух главных компонент, из которого следует, что пробы черноморского анчоуса (за исключением В6) расположены в нижней части графика, а пробы азовского подвида (за исключением А1, А4 и С2) занимают верхнюю половину. В горизонтальном направлении крайне правое положение занимают пробы А6 и А4, собранные по завершению нагульного периода в октябре и ноябре, а крайне левое положение – С7, А5 и В6, собранные после зимовки с марта по май.
Результаты линейного дискриминантного анализа показывают, что наибольший вклад в дискриминирующую функцию вносят признаки, связанные с размерами головы (1−2, 1−11, 2−12, 11−12), длина основания спинного плавника (3–4) и постдорсальное расстояние (4−5) (рис. 4). На результирующей гистограмме видно, что полигоны частот подвидов широко перекрываются, тем не менее моды их существенно различаются (рис. 5). В целом, успешность отнесения рыб по форме тела к азовскому или черноморскому подвидам (по методу “складного ножа”) оценивается в 84.3% (табл. 5).
Рис. 4.
Коэффициенты нагрузки разных признаков на дискриминантную функцию классификации азовского и черноморского анчоусов.

ОБСУЖДЕНИЕ
Согласно полученным результатам, азовский анчоус отличается от черноморского подвида бóльшими относительными размерами головного отдела, высотой тела в туловищном отделе и основании хвостового плавника и длинами оснований спинного и анального плавников. Это согласуется с ранее известными данными по морфометрии этих подвидов (Александров, 1927; Павлов, 1980). С другой стороны, постдорсальное расстояние у азовского анчоуса меньше, чем у черноморского, т.е. спинной плавник расположен ближе к хвосту, что отмечалось ранее как отличительный признак для так называемого прибрежного экотипа анчоусов (Bonhomme et al., 2022).
В целом, схема измерений “Truss network system” предпочтительнее для изучения изменчивости формы тела рыб, чем традиционная морфометрия, так как более полно охватывает тело продольными и поперечными измерениями. К тому же, в силу связанности измерений в сеть, путем вычислений можно легко выявить любые ошибки измерений или оцифровки данных. Очевидно, что для сравнительного морфометрического анализа нужно отбирать пробы таким образом, чтобы исключить влияние онтогенетических, размерно-возрастных и сезонных различий. Однако применение многомерных методов анализа данных позволили выделить группы признаков, связанных с сезонной изменчивостью формы тела и не зависящих от нее.
Эффективность применения “Truss Network System” и многомерных методов анализа данных для дифференциации запасов европейского анчоуса по форме тела была показана в ряде работ (Bembo et al., 1996; Caneco et al., 2004; Kristoffersen, Magoulas, 2008), в том числе и для анчоусов Черного моря (Turan et al., 2004; Erdoğan et al., 2009). Выявлены статистически значимые различия в форме тела анчоусов, собранных у черноморского побережья Турции в центральной и юго-восточной части моря, а также в Эгейском море и северо-восточной части Средиземного моря (Turan et al., 2004), показано, что наиболее важными дискриминирующими признаками служат измерения головы и задней части тела рыб. Корректность классификации особей по исследованным районам в общем составила 78%. Комплексный морфометрический и генетический анализ анчоусов из разных районов Черного, Мраморного и Эгейского морей (Erdoğan et al., 2009) показал, что анчоусы из Черного моря (районы Трабзона и Синопа) по форме тела существенно отличались от всех других, но рыбы из района Стамбула были больше похожими на анчоусов из Мраморного моря. Наиболее важными отличительными признаками между пробами стали измерения, связанные с высотой тела и размерами головы. Успешность классификации с помощью дискриминантного анализа в целом составила 77%.
В нашем исследовании с применением метода главных компонент показано, что общая изменчивость формы тела анчоусов в основном обусловлена двумя группами признаков, связанными, во-первых, с высотой тела и, во-вторых, с размерами головы, спинного и анального плавников, а также с размерами хвостового отдела. Наибольшую изменчивость в направлении первой главной компоненты проявляют признаки, характеризующие высоту тела в туловищном отделе, они коррелируют с упитанностью рыб и подвержены сезонной изменчивости. Известно, что в период зимовки анчоус использует накопленные летом жировые запасы, содержание жира и масса тела рыб от осени до весны закономерно уменьшаются (Шульман, 1972), они “худеют”, что и проявляется в изменении формы тела. Вторая группа признаков не имеет сезонной составляющей и представляет интерес для различения азовского и черноморского анчоусов. По результатам дискриминантного анализа, признаки, связанные с размерами головы, а также длина основания спинного плавника и постдорсальное расстояние оказались ведущими для классификации двух подвидов. Существенные различия в относительной длине головы и пропорциях частей головы, а также различия в антедорсальном расстоянии, как одни из основных признаков для различения азовского и черноморского анчоусов отмечал еще А.И. Александров (1927). Причины этих различий связаны с эволюционными и экологическими особенностями двух подвидов. Согласно А.И. Александрову, азовский анчоус, имеющий спинной плавник, расположенный дальше от головы, ближе к прародительской форме, чем более эволюционно молодая черноморская форма. С другой стороны, более прогонистое тело и более длинный задний отдел у черноморского анчоуса можно объяснить его адаптацией к протяженным зимовальным миграциям из северо-западной части Черного моря в его юго-восточную часть, тогда как азовский анчоус совершает относительно небольшие миграции на зимовку из Азовского моря к северному побережью Кавказа и берегам Крыма.
Результаты нашей работы показали эффективность применения методов многомерного анализа к данным измерений формы тела для дифференциации запасов азово-черноморских анчоусов. Методом анализа главных компонент в исследованном районе объективно выявляются две группы выборок, что соответствует имеющимся представлениям о распространении азовского и черноморского анчоусов. Выделена группа характерных признаков, которые могут быть использованы для идентификации анчоусов. По результатам дискриминантного анализа успешность отнесения рыб по форме тела к азовскому или черноморскому подвидам может превышать 84%, что соответствует уровню, полученному в аналогичных исследованиях европейского анчоуса, описанных выше. Однако для целей оперативной идентификации азовского и черноморского анчоусов, особенно в полевых условиях, такой подход вряд ли применим в силу значительных затрат времени и трудоемкости. Для этой цели предпочтительнее использовать форму отолитов рыб (более консервативных, чем форма тела, структур) для анализа которых уже разработаны эффективные методы и прикладные компьютерные программы.
Список литературы
Александров А.И. Анчоусы Азовско-Черноморского бассейна, их происхождение и таксономическое обозначение // Тр. Керчен. научно-рыбохоз. ст. 1927. Т. 1. Вып. 2–3. С. 37–99.
Алтухов Ю.П., Лиманский В.В., Паюсова А.Н., Трувелер К.А. Иммуногенетический анализ внутривидовой дифференциации европейского анчоуса, обитающего в Черном и Азовском морях. 1. Группы крови анчоуса и возможный механизм генного контроля // Генетика. 1969. Т. 5. № 4. С. 50–64.
Афифи А., Эйзен С. Статистический анализ. Подход с использованием ЭВМ. М.: Мир. 1982. 488 с.
Водясова Е.А., Абрамсон Н.И. Генетическая изменчивость анчоуса в Азово-Черноморском бассейне // Генетика. 2017. Т. 53. № 6. С. 696–704.
Водясова Е.А., Солдатов А.А. Идентификация подвидов европейского анчоуса Engraulis encrasicolus (Engraulidae) в зимовальных скоплениях на основе морфологических параметров отолита // Вопр. ихтиологии. 2017. Т. 57. № 4. С. 1–8.
Данилевский Н.Н. О проникновении черноморской хамсы в Азовское море и сопутствующих условий среды // Тр. АзчерНИРО. 1960. Вып. 18. С. 118–130.
Доброволов И. Полиморфизм мышечных протеинов хамсы Engraulis encrasicholus (L.) Азово-Черноморского бассейна и Атлантического океана // Вопр. ихтиологии. 1978. Т. 18. Вып. 3. С. 534–540.
Зуев Г.В., Гуцал Д.К., Мельникова Е.Б., Бондарев В.А. К вопросу о внутривидовой неоднородности зимующей у побережья Крыма хамсы // Рыбн. хоз-во Украины. 2007. № 6. С. 2–9.
Зуев Г.В., Гуцал Д.К., Горалевич К.Г. и др. Внутривидовая морфо-экологическая и биологическая изменчивость азово-черноморской хамсы Engraulis encrasicolus (Pisces: Engraulidae), зимующей у побережья Крыма // Мор. экол. журн. 2011. Т. 10. № 1. С. 5–18.
Зуев Г.В., Бондарев В.А., Мурзин Ю.Л., Самотой Ю.В. Многолетняя и годовая изменчивость внутривидовой и биологической структуры хамсы Engraulis encrasicolus (L.) (Pisces: Engraulidae), зимующей у восточного побережья Крыма // Мор. экол. журн. 2014. Т. 8. № 2. С. 31–40.
Калнин В.В., Калнина О.В. Генетическая дифференциация и репродуктивные взаимоотношения азовской и черноморской рас европейского анчоуса. Сообщение. 1. Биохимический полиморфизм // Генетика. 1984а. Т. 20. № 2. С. 303–308.
Калнина О.В., Калнин В.В. Генетическая дифференциация и репродуктивные взаимоотношения азовской и черноморской рас европейского анчоуса. Сообщение 2. Генетические отличия и внутренняя гетерогенность азовской и черноморской рас анчоуса // Генетика. 1984б. Т. 20. № 2. С. 309–313.
Майорова А.А. Распределение и промысел черноморской хамсы (предварительное сообщение) // Тр. АзчерНИРО. 1950. Вып. 14. С. 11–34.
Павлов П.И. Фауна Украины. Т. 8. Рыбы. Вып. 1. Киев: Наукова думка. 1980. 352 с.
Пузанов И.И., Цееб Я.Я. О расах анчоуса, водящихся в Черном и Азовском морях // Тр. Крымск. научно-исслед. ин-та. 1926. Т. 1. С. 86–95.
Сказкина Е.П. Различие азовской и черноморской хамсы (Engraulis encrasicolus maeoticus Puzanov, Engraulis encrasicolus ponticus Alex.) по отолитам // Вопр. ихтиологии. 1965. Т. 5. Вып. 3. С. 600–605.
Терехов П.А. О контрацекозе азовской хамсы Engraulis encrasiсolus maeoticus Pusanov // Вопр. ихтиологии. 1979. Т. 19. С. 759–761.
Чащин А.К. Нематодное заражение черноморского анчоуса // Экспресс-информация ЦНИИТЕИРХ. 1981. Вып. 3. С. 7–11.
Шевченко Н.Ф. Географическая изменчивость анчоуса в морях средиземноморского бассейна // Вопр. ихтиологии. 1980. Т. 20. Вып. 1. С. 20–31.
Шляхов В.А., Шляхова О.В., Надолинский В.П., Перевалов О.А. Промыслово-биологические показатели рыболовства для важнейших распределенных запасов водных биоресурсов Черного моря как основа их регионального оценивания // Водн. биоресурсы и среда обитания. 2018. Т. 1. № 1. С. 86–103.
Шульман Г.Е. Физиолого-биохимические особенности годовых циклов рыб. М.: Пищ. пром-сть. 1972. 367 с.
Юнева Т.В., Забелинский С.А., Никольский В.Н. и др. Идентификация азовской и черноморской хамсы в Черном море у берегов Украины и Турции в промысловый период 2006–2012 гг. на основе содержания в фосфолипидах докозагексаеновой кислоты // Мор. экол. журн. 2014. Т. 13. № 2. С. 82–89.
Bembo D.G., Carvalho G.R., Cingolani N. et al. Allozymic and morphometric evidence for two stocks of the European anchovy Engraulis encrasicolus in Adriatic waters // Mar. Biol. 1996. V. 126. P. 529–538.
Bonhomme F., Meyer L., Arbiol C. et al. Systematics of European coastal anchovies (genus Engraulis Cuvier) // J. Fish Biol. 2022. V. 100. P. 594–600.
Bookstein F.L. Morphometric tools for landmark data: geometry and biology. N.Y.: Cambridge Univ. Press. 1991. 435 p.
Cadrin S.X., Kerr L.A., Mariani S.E. Stock identification methods: applications in fishery science. San Diego: Acad. Press. 2014. 566 p.
Caneco B., Silva A., Morais A. Morphometric variation among anchovy (Engraulis encrasicholus, L.) populations from the Bay of Biscay and Iberian waters. ICES Council Meeting. 2004. ICES CM 2004/EE:24.
Chashchin A. The Black Sea populations of anchovy // Sci. Mar. 1996. V. 60. № 2. P. 219–225.
Düzgüneş Z.D., Eroğlu O., Firidin Ş., Çakmak E. Genetic diversity for anchovy populations (Engraulis encrasicolus L.) in the Azov, Marmara and Black Sea // Genet. Aqua. Org. 2018. V. 2. P. 53–60.
Elliott N.G., Haskard K., Koslow J.A. Morphometric analysis of orange roughy (Hoplostethus atlanticus) off the continental slope of southern Australia // J. Fish Biol. 1995. V. 46. P. 202–220.
Erdoğan Z., Turan C., Koc H.T. Morphologic and allozyme analyses of European anchovy (Engraulis encrasicolus (L. 1758)) in the Black, Marmara and Aegean Seas // Acta Adriat. 2009. V. 50. № 1. P. 77–90.
GFCM. Stock assessment form small pelagics – Anchovy 2012–2013. Black Sea Ukrainian waters. Ver. 0.9. GFCM–FAO. 2014. 21 p.
Guraslan C., Fach B.A., Oguz T. Understanding the impact of environmental variability on anchovy overwintering migration in Black Sea and its implications for the fishing industry // Front. Mar. Sci. 2017. V. 4. № 275. P. 1–24.
Hammer Ø., Harper D.A.T., Ryan P.D. PAST: Paleontolo-gical statistics software package for education and data analysis // Paleontol. Electron. 2001. V. 4. Suppl. 1. 9 p.
Ivanova P.P., Dobrovolov I.S. Population-genetic structure on European anchovy (Engraulis encrasicolus Linnaeus, 1758) (Osteichthyes: Engraulide) from Mediterranean Basin and Atlantic Ocean // Acta Adriat. 2006. V. 47. № 1. P. 13–22.
Kristoffersen J.B., Magoulas A. Population structure of anchovy Engraulis encrasicolus L. in the Mediterranean Sea inferred from multiple methods // Fish. Res. 2008. V. 91. P. 187–195.
Rohlf F.J., Marcus L.F. A revolution in morphometrics // Trends Ecol. Evol. 1993. V. 8. № 4. P. 129–132.
STECF. Black Sea assessments / Eds M. Cardinale, D. Damalas. Luxembourg: Publ. Office of the European Union. EUR 27517 EN. JRC 98095. 2015. 284 p.
Strauss R.E., Bookstein F. The truss: body form reconstructions in morphometrics // Syst. Zool. 1982. V. 31. P. 113–135.
Turan C., Ergüden D., Gürlek M. et al. Morphometric structuring of the anchovy (Engraulis encrasicolus L.) in the Black, Aegean and Northeastern Mediterranean Seas // Turk. J. Vet. Anim. Sci. 2004. V. 28. № 5. P. 865–871.
Whitehead P.J.P., Nelson G.J., Wongratana T. FAO species catalogue. V. 7. Clupeoid fishes of the world (Suborder Clupeoidei). An annotated and illustrated catalogue of the herrings, sardines, pilchards, sprats, shads, anchovies and wolf-herrings. FAO Fish. Synop. № 125. V. 7. Pt. 2. Rome. 1988. P. 305–579.
Дополнительные материалы отсутствуют.



