Биология моря, 2023, T. 49, № 3, стр. 205-214
Морфофункциональный анализ клеточного состава гемолимфы двустворчатого моллюска Anadara broughtonii (Schrenck, 1867) (Японское море)
Е. С. Кладченко 1, *, Т. А. Кухарева 1, В. Н. Рычкова 1, Э. С. Челебиева 1, А. Ю. Андреева 1
1 Институт биологии южных морей им. А.О. Ковалевского РАН
299011 Севастополь, Россия
* E-mail: kladchenko_ekaterina@bk.ru
Поступила в редакцию 30.08.2022
После доработки 09.01.2023
Принята к публикации 26.01.2023
- EDN: SBJWRE
- DOI: 10.31857/S0134347523030087
Аннотация
Клетки гемолимфы анадары Броутона Anadara broughtonii исследовали с помощью световой микроскопии, проточной цитометрии и градиентного центрифугирования. Все три метода анализа позволили идентифицировать в гемолимфе двустворчатого моллюска A. broughtonii два основных типа клеток – крупные гранулярные эритроциты и небольшие агранулярные амебоциты. Эритроциты составили 95.6 ± 0.9% от общего количества клеток гемолимфы. Эритроциты представляли собой гемоглобин-содержащие клетки с большим числом гранул в цитоплазме, низким ядерно-цитоплазматическим отношением (ЯЦО) и более низкой интенсивностью клеточного дыхания по сравнению с амебоцитами. Амебоциты – клетки преимущественно неправильной формы с высоким ЯЦО, не содержащие или содержащие не более 10 гранулярных включений в цитоплазме. Все типы гемоцитов, обнаруженные в гемолимфе анадары, продемонстрировали одинаковую способность к спонтанной продукции активных форм кислорода. Впервые показано, что эритроциты анадары Броутона способны к фагоцитозу, однако они поглощали в среднем в 2 раза меньше частиц зимозана (5.3 ± 0.1 шт.), чем амебоциты (10.3 ± 0.7 шт.).
Двустворчатый моллюск анадара Броутона Anadara broughtonii (Schrenck, 1867) – массовый вид и ценный объект прибрежного промысла в Приморском крае Российской Федерации (Афейчук, 2021). Несмотря на широкое распространение анадары, экономическая эффективность ее разведения может зависеть от факторов окружающей среды. Стрессовые факторы в первую очередь способствуют подавлению наиболее энергозатратных функций организма, таких как способность к иммунному ответу. Колебания температуры воды, солености и концентрации кислорода, а также патогены и загрязнения могут стать причиной вспышки заболеваний на фермах и массовой гибели моллюсков (Rosa et al., 2015; Parisi et al., 2017). Для снижения рисков негативного влияния абиотических, биотических и антропогенных факторов среды на продуктивность хозяйств марикультуры необходимо на регулярной основе контролировать не только численность, но и физиологический статус моллюсков, в частности состояние их иммунной системы.
Гемоциты как клетки, участвующие в транспорте веществ, пищеварении, заживлении тканей и неспецифическом клеточном иммунном ответе, являются общепринятым модельным объектом для оценки общего функционального статуса организма двустворчатых моллюсков (Анисимова, 2013; Mello et al., 2012; Bachère et al., 2015; Matozzo et al., 2016). Наиболее целесообразна комплексная оценка показателей неспецифического иммунитета (Kolyuchkina, Ismailov, 2011; Novoa, Figueras, 2012; Gerdol et al., 2018), проводимая с применением методов проточной цитометрии и световой микроскопии (Allam et al., 2002; Travers et al., 2008). Проточная цитометрия позволяет быстро оценить функциональные характеристики гемоцитов, такие как уровень генерации активных форм кислорода (АФК), фагоцитарная активность, скорость пролиферации и т.д. Вместе с тем для интерпретации результатов исследования необходима четкая классификация клеток гемолимфы, основанная не только на морфологической, но и на функциональной характеристике гемоцитов.
Клеточные типы гемолимфы стали предметом обсуждений в 1970-х годах, однако до настоящего времени нет единого мнения об их классификации (De la Ballina et al., 2022). Клеточный состав гемолимфы двустворчатых моллюсков и морфофизиологические особенности гемоцитов могут варьировать в достаточно широком диапазоне как среди представителей одного семейства, так и среди особей одного вида, что следует учитывать при анализе и интерпретации данных (Cao et al., 2003; Donaghy et al., 2009; Andreyeva et al., 2019; Kim et al., 2020; Kladchenko et al., 2022). Это разнообразие частично можно объяснить истинными межвидовыми различиями, но в большинстве случаев оно скорее связано с отсутствием унификации критериев и экспериментальных схем. В превалирующем числе работ выделение тех или иных типов гемоцитов основано на морфологических особенностях клеток, а именно гранулярности или окраске цитоплазмы (базофильной или эозинофильной) (Анисимова, 2013; Funakoshi, 2000; De la Ballina et al., 2022; Fonseca et al., 2022).
Ряд авторов выделяют дополнительные подтипы, основываясь на размерных характеристиках клеток, например, малые, средние и крупные гемоциты (Присный и др., 2011; Ford et al., 1994; De la Ballina et al., 2022). Функциональная характеристика гемоцитов, хотя и является предметом изучения, выбирается авторами в качестве основного критерия для их классификации лишь в некоторых работах. Комбинация классического морфологического подхода с методом проточной цитометрии и дальнейшее сопоставление морфофункциональных особенностей гемоцитов у разных видов Bivalvia могут стать фундаментальной основой для общей номенклатуры клеток гемолимфы двустворчатых моллюсков.
C точки зрения классификации гемоцитов Bivalvia наиболее “проблемной” группой являются представители семейства Arcidae. Сведения о клетках их гемолимфы фрагментарны, и большинство данных ограничивается описанием морфотипов гемоцитов на основании световой и электронной микроскопии (Cohen, Nemhauser, 1980; Holden et al., 1994; De Zwaan et al., 1995; Novitskaya, Soldatov, 2013; Zhou et al., 2013, 2017, 2019; Hameed et al., 2018). В зависимости от выбранного критерия, у гемоглобин-содержащих моллюсков выделяли от 2 до 5 типов клеток (Rodrick, Ulrich, 1984; Holden et al., 1994; Kolyuchkina, Ismailov, 2011; Dang et al., 2013; Zhou et al., 2013, 2017, 2019; Hameed et al., 2018; Kim et al., 2020). Отдельно стоит отметить подход к классификации гемоцитов A. broughtonii Чжоу с соавторами (Zhou et al., 2013, 2017, 2019), которые провели идентификацию типов клеток в гемолимфе Scapharca broughtonii (= A. broughtonii) по аналогии с классификацией клеток крови позвоночных, выделив 3 типа – эритроциты, лейкоциты и тромбоциты. Прямое сопоставление морфологических и функциональных характеристик гемоцитов представителей семейства Arcidae с особенностями системы крови позвоночных можно объяснить наличием гемоглобина в эритроцитах анадары. На этом основании ряд авторов приходит к выводу, что основной функцией эритроцитов анадары, как и эритроцитов позвоночных, является транспорт кислорода, при этом исключается их роль в иммунном ответе (Dang et al., 2013; Kim et al., 2020; De la Ballina et al., 2022). Однако, согласно литературным данным, доля эритроцитов у анадары составляет более 80% от общего числа гемоцитов (Dang et al., 2013). У двустворчатых моллюсков отсутствует специфический иммунитет, поэтому маловероятно, что преобладающий тип клеток не задействован в иммунном ответе.
Слабая изученность функциональной роли клеток гемолимфы анадары и отсутствие оценки степени участия гемоцитов в реализации иммунного ответа определили цель настоящей работы – исследовать особенности морфологии и функциональной специализации клеток гемолимфы A. broughtonii.
МАТЕРИАЛ И МЕТОДИКА
Взрослых особей Anadara broughtonii обоих полов (длина створки 80.5 ± 9.0 мм, масса 216.5 ± 12.9 г, n = 15) отлавливали в прибрежной зоне зал. Петра Великого, Японское море (42.46° N, 131.51° E) в июне 2021 г. Для акклиматизации к лабораторным условиям моллюсков помещали на 7 сут в 50-литровые аквариумы с искусственной морской водой (соленость 33.0 ± 0.5‰) и содержали при температуре воды 15 ± 1°C, рН 8.0 и концентрации растворенного кислорода 7.9–8.3 мг О2/л. Гемолимфу (2–4 мл) отбирали из экстрапалиальной полости моллюсков. В работе использовали индивидуальные образцы клеток. После забора образцы гемолимфы немедленно помещали в стерильные пластиковые пробирки. Все манипуляции с клетками проводили при температуре 4°С для предотвращения склеивания и агрегации гемоцитов. Образцы гемолимфы отфильтровали от крупных фрагментов и агрегатов (диаметр ячейки фильтра 20 мкм, Minisart® PA, Sartorius, Германия) и центрифугировали в рефрижераторной центрифуге Eppendorf 5430R (Германия) (500 g, 5 мин). Клетки трижды отмывали от плазмы в эквивалентном объеме стерильной морской воды (500 g, 5 мин). По окончании отмывки часть (1–2 мл) концентрированных клеток гемолимфы моллюсков использовали для приготовления мазков и разделения клеток в градиенте плотности для последующего морфометрического анализа. Оставшуюся часть гемоцитов ресуспендировали в стерильной морской воде (концентрация клеток 2–4 × 106 кл/мл) для анализа методом проточной цитометрии.
Метод оптической микроскопии
Окраску мазков проводили по комбинированному методу Паппенгейма. Мазки анализировали при помощи люминесцентного микроскопа Biomed PR-2 Lum (Россия), оборудованного камерой Levenhuk C NG Series (США). Диаметр клетки (без учета псевдоподий) и ядра измеряли в программе ImageJ 1.44 p. На каждом мазке подсчитывали минимум 1000 клеток. Ядерно-цитоплазматическое отношение (ЯЦО) рассчитывали по следующей формуле:
Метод проточной цитометрии
Измерения проводили на проточном цитофлуориметре Cytomics FC 500 (Beckman Coulter, США), оборудованном однофазным аргоновым лазером (длина волны 488 нм). Каждое измерение выполняли в трех повторностях. Для каждого измерения записывали 50 000 событий. Об изменении характера флуоресценции красителей и светорассеяния клеток судили по безразмерным двухпараметрическим логарифмическим диаграммам в программе Kaluza Analysis 2.0.
Гемоциты дифференцировали от дебриса по интенсивности флуоресценции красителя SYBR Green I (Merck, Германия). Финальная концентрация красителя в пробе составила 10 мкМ, гемоциты соответствовали пику флуоресценции красителя. Окраску проводили в течение 30 мин в темноте при 4°С и анализировали на проточном цитофлуориметре. Для определения размеров гемоцитов прибор калибровали перед каждым анализом с помощью флуоресцентных латексных микрочастиц (Merck, Германия). Идентификацию типов гемоцитов анадары проводили на основании распределения клеток по величине условного размера (прямое светорассеяние, FS) и гранулярности (боковое светорассеяние, SS) на двухпараметрических точечных диаграммах.
Уровень спонтанной (нестимулированной) продукции АФК гемоцитами моллюсков анализировали на основании интенсивности окрашивания клеток красителем 2',7'-дихлорофлуоресцеин диацетат (DCF-DA) (Sigma-Aldrich, США); 1 мл суспензии гемоцитов инкубировали с 10 мкл раствора DCF-DA в течение 30 мин в темноте. Финальная концентрация красителя в пробе составила 10 мкМ. Интенсивность флуоресценции красителя анализировали в канале FL1.
Величину мембранного потенциала митохондрий определяли на основании оценки уровня флуоресценции гемоцитов, окрашенных флуоресцентным зондом родамин 123 (Rh123) (Sigma-Aldrich, США). Суспензию гемоцитов (1 мл) инкубировали с 10 мкл Rh123 в течение 45 мин в темноте (финальная концентрация красителя в пробе составила 0.1 мг/мл). Интенсивность флуоресценции клеток оценивали в канале FL1 проточного цитофлуориметра.
Жизнеспособность гемоцитов определяли с использованием флуоресцентного красителя йодистого пропидия (PI) (Sigma-Aldrich, США). К 1 мл суспензии гемоцитов добавляли 10 мкл раствора PI и инкубировали в темноте в течение 30 мин при 4°C. Долю мертвых клеток в общем числе гемоцитов оценивали по гистограмме флуоресценции PI в канале FL2 проточного цитофлуориметра.
Метод конфокальной микроскопии
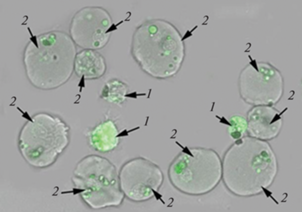
Для оценки способности гемоцитов фагоцитировать чужеродные частицы применяли флуоресцентно-меченый зимозан (Abcam, Великобритания). Интенсивность фагоцитоза оценивали согласно протоколу производителя. Суспензию гемоцитов (10 мкл) разводили в 90 мкл стерильной морской воды и инкубировали с раствором зимозана (40 мкл) в течение 90 мин при температуре 20°С в темноте. По окончании времени инкубации гемоциты трижды отмывали от частиц зимозана в эквивалентном объеме стерильной морской воды (5 мин, 400 g) и проводили прижизненную микрофотосъемку на конфокальном микроскопе Leica Stellaris 5 (Leica Microsystems, Германия). Фотосъемку осуществляли в проходящем свете с использованием флуоресцентного фильтра (488 нм), для визуализации границ клеток делали микрофотографии с помощью метода фазового контраста. На микрофотографиях визуально оценивали способность разных типов гемоцитов к фагоцитозу.
Метод градиентного центрифугирования
Разделение гемоцитов при помощи изоосмотического сорбента Percoll (Sigma-Aldrich, США) проводили согласно рекомендациям производителя путем создания градиента плотности и центрифугирования пробирок объемом 1.5 мл при 15 000 g в течение 20 мин (центрифуга Eppendorf 5430R, Германия). После создания плотностного градиента (10, 20, 30 и 40% Percoll) поверх рабочего раствора сорбента в пробирки наслаивали 0.25 мл суспензии гемоцитов для последующего центрифугирования в течение 10 мин при 800 g. Слои клеток каждого градиента отбирали в отдельные пробирки объемом 1.5 мл. Отмывку гемоцитов от частиц сорбента производили в эквивалентном объеме стерильной морской воды в течение 10 мин при 200 g (3 раза). Полученные суспензии клеток каждой фракции анализировали на проточном цитофлуориметре Cytomics FC 500 (Beckman Coulter, США).
Статистическая обработка данных
Статистическую обработку проводили с помощью программного обеспечения RStudio версия 4.1.0. Нормальность распределения проверяли при помощи теста Колмогорова-Смирнова. Данные световой микроскопии подчинялись нормальному закону распределения, поэтому для выявления различий использовали дисперсионный анализ (ANOVA). Достоверность результатов проверяли при помощи критерия Тьюки с доверительным интервалом 95%. Данные по функциональным показателям гемоцитов не подчинялись нормальному закону распределения, поэтому их анализировали при помощи непараметрического критерия Манна–Уитни. Результаты выражали как среднее значение ± стандартная ошибка среднего.
РЕЗУЛЬТАТЫ
Клеточный состав гемолимфы Anadara broughtonii
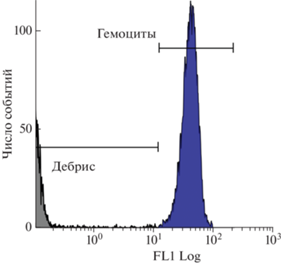
Гемоциты, согласно данным проточной цитометрии, имели высокий коэффициент вариации (CV) диплоидного пика ДНК – 22.1 ± 1.2% (рис. 1). Доля мертвых гемоцитов в образцах не превышала 2%.
Рис. 1.
Распределение гемоцитов двустворчатого моллюска Anadara broughtonii, окрашенных SYBR Green I, по содержанию ДНК: FL1 – интенсивность флуоресценции в канале FL1 проточного цитофлуориметра.
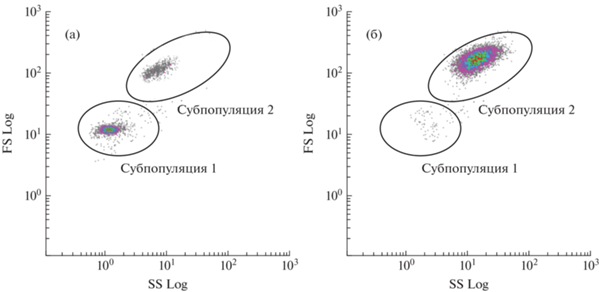
В гемолимфе анадары с помощью цитометрического и микроскопического анализа идентифицированы 2 типа клеток: амебоциты и эритроциты (рис. 2а). Амебоциты (рис. 2в) – клетки наименьшего размера с диаметром в пределах от 4.5 до 8 мкм (в среднем 6.2 ± 0.1 мкм) (рис. 3а). Они характеризовались высоким ЯЦО (0.6 ± 0.01) (рис. 3в), имели преимущественно округлую, реже амебовидную форму и ацентрично расположенное ядро диаметром 3.7 ± 0.1 мкм (рис. 3б), занимающее большую часть базофильной цитоплазмы. У некоторых клеток цитоплазма имела эозинофильную окраску, гранулы в цитоплазме большинства из них отсутствовали. Однако среди клеток встречались единичные амебоциты, содержащие до 10 гранулярных включений.
Рис. 2.
Клеточный состав гемолимфы двустворчатого моллюска Anadara broughtonii: а – распределение клеток гемолимфы на основании прямого (относительный размер) и бокового (относительная гранулярность) светорассеяния, субпопуляции клеток выделены овалами и обозначены цифрами 1 и 2; б – микрофотографии эритроцитов; в − амебоцитов.
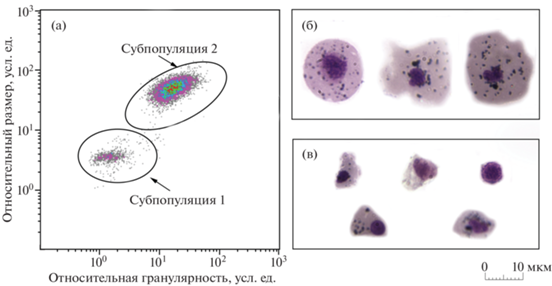
Рис. 3.
Размерные характеристики (а − диаметр клетки, б − диаметр ядра, в − ЯЦО) клеток гемолимфы двустворчатого моллюска Anadara broughtonii. *Различия между группами достоверны при p < 0.05.
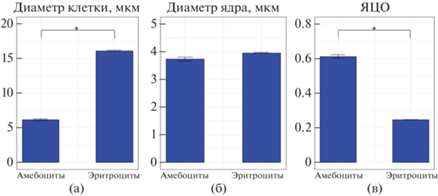
Наиболее крупные клетки гемолимфы – эритроциты (рис. 2б) – имели овальную, округлую либо амебовидную форму и базофильную цитоплазму, содержащую до 50 гранул. Средний диаметр клеток этого типа составил 16.1 ± 0.1 мкм, минимальный – 10 мкм, а максимальный – 24 мкм. Средний диаметр эритроцитов достоверно отличался от среднего диаметра амебоцитов (p ≤ 0.05, n = 15) (рис. 3а). Небольшое относительно цитоплазмы округлое ядро эритроцитов (средний диаметр 3.9 ± 0.02 мкм) (рис. 3б), располагалось ацентрично (рис. 2б). ЯЦО составило 0.3 ± 0.002 (рис. 3в).
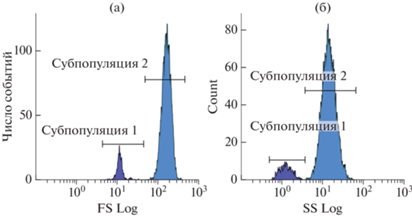
Методом проточной цитометрии также выявлены две субпопуляции клеток, которые достоверно отличались по показателям относительного размера и уровня гранулярности (p ≤ 0.05, n = 15) (рис. 4). Согласно данным калибровки латексными микросферами, средний диаметр клеток субпопуляции 1 соответствовал 5–8 мкм. Эта субпопуляция, предположительно состоящая из амебоцитов, была гетерогенной по значениям FS и SS. Клетки, входящие в ее состав, имели диаметр меньший, чем клетки субпопуляции 2, и невысокий уровень гранулярности. Вытянутость облака распределения клеток по оси SS (рис. 2а) свидетельствует о большом разбросе уровня гранулярности клеток в субпопуляции. Доля амебоцитов в гемолимфе составила 4.4 ± 0.9%. Субпопуляция 2 также была неоднородна по значениям прямого и бокового светорассеяния и имела сравнительно высокие значения показателя FS, что соответствовало среднему диаметру клеток 13–16 мкм. Клетки субпопуляции 2 были идентифицированы как эритроциты, их доля составила 95.6 ± 0.9% от общего числа клеток.
Рис. 4.
Цитометрический анализ субпопуляций клеток гемолимфы двустворчатого моллюска Anadara broughtonii: а – условный диаметр клеток, б – уровень гранулярности клеток.
В результате центрифугирования в градиенте плотности Percoll в гемолимфе анадары выделены 2 фракции клеток (рис. 5). Нижняя фракция (40% Percoll), согласно микроскопическому анализу, сформирована преимущественно гранулярными клетками – эритроцитами, а верхняя (30% Percoll) – мелкими агранулярными клетками. В каждом слое присутствовали единичные клетки нетипичного размера: мелкие эритроциты обнаружены в верхнем градиентном слое, а крупные агранулоциты – в нижнем. Анализ методом проточной цитометрии каждой из двух фракций гемолимфы показал, что субпопуляция 1 на цитограммах соответствует клеткам верхней фракции, т.е. преимущественно амебоцитам, в то время как наиболее массовая субпопуляция 2 сформирована в основном эритроцитами из нижней фракции.
Функциональные показатели гемоцитов
Уровень продукции АФК, который оценивали по флуоресценции красителя DCF-DA, для крупных клеток субпопуляции 2 составил 91.1 ± 5.3 у.ед., для мелких клеток субпопуляции 1 – 102.2 ± 9.0 у.ед. (рис. 6а). Однако различия не были достоверны (p ≥ 0.05, n = 15).
Рис. 6.
Функциональные особенности гемоцитов двустворчатого моллюска Anadara broughtonii: а – различия в способности гемоцитов разных субпопуляций (амебоцитов и эритроцитов) к продукции АФК; б – различия в мембранном потенциале митохондрий гемоцитов разных субпопуляций (амебоцитов и эритроцитов). *Различия между группами достоверны при p < 0.05.
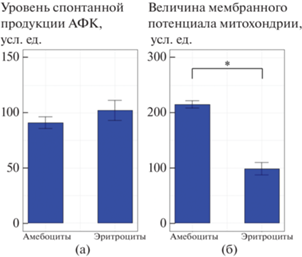
Наиболее высокая интенсивность клеточного дыхания (215.5 ± 11.4 у.ед.) характерна для амебоцитов – агранулярных клеток субпопуляции 1, у которых уровень флуоресценции Rh123 более чем в 2 раза выше, чем у гранулярных клеток субпопуляции 2 – эритроцитов (98.5 ± 6.6 у. ед.) (p ≤ 0.05, n = 15) (рис. 6б).
В настоящем исследовании показано, что оба типа гемоцитов анадары способны к поглощению частиц зимозана (рис. 7). При этом способность к фагоцитозу у амебоцитов была выше, чем у эритроцитов: амебоциты поглощали в среднем 10.3 ± 0.7 шт. частиц зимозана, в то время как эритроциты – 5.3 ± 0.1 шт.
ОБСУЖДЕНИЕ
В зависимости от принципа, положенного в основу классификации клеток, в гемолимфе представителей рода Anadara выделяют от 2 до 5 типов гемоцитов (Rodrick, Ulrich, 1984; Holden et al., 1994; Kolyuchkina, Ismailov, 2011; Dang et al., 2013; Hameed et al., 2018; Kim et al., 2020; Zhou et al., 2013, 2017, 2019). На основании результатов световой микроскопии, проточной цитометрии и градиентного центрифугирования мы идентифицировали в гемолимфе A. broughtonii 2 типа гемоцитов: амебоциты и эритроциты.
Обнаруженные на мазках наиболее мелкие клетки – амебоциты – формировали субпопуляцию 1 на цитометрических диаграммах и составляли верхнюю фракцию в градиенте плотности Percoll. Этот тип клеток упоминается во всех работах по описанию клеточного состава гемолимфы гемоглобин-содержащих моллюсков Anadara trapezia, A. kagoshimensis, A. broughtonii и Tegillarca granosa (см.: Dang et al., 2013; Kim et al., 2020). Морфологические профили амебоцитов анадары Броутона, описанные в настоящей работе, по большинству признаков близки к агранулоцитам других видов двустворчатых моллюсков (Wang et al., 2017). Описанные нами размеры и морфологические особенности амебоцитов также схожи с характеристиками гиалиноцитов и гранулоцитов A. broughtonii, A. kagoshimensis и T. granosa (см.: Kim et al., 2020), а также амебоцитов A. trapezia (см.: Dang et al., 2013).
Многочисленные крупные эритроциты A. broughtonii, содержащие большое количество гранул, формировали субпопуляцию 2 и обнаруживались в составе нижней фракции в градиенте плотности Percoll. Считается, что наличие большого числа включений с гемоглобином свидетельствует о том, что эритроциты анадары являются специализированными клетками, осуществляющими транспорт кислорода (Wang et al., 2020). Для Scapharca inaequivalvis показано (Holden et al., 1994), что, аналогично эритроцитам других беспозвоночных и низших позвоночных, гемоглобин-содержащие клетки гемолимфы моллюска имеют развитую внутреннюю структуру, включая крупное ядро, шероховатый эндоплазматический ретикулум, аппарат Гольджи и многочисленные митохондрии.
В то же время, согласно результатам нашего исследования, эритроциты анадары Броутона по своим морфофункциональным свойствам в целом близки к непигментированным/слабопигментированным гранулоцитам других видов двустворчатых моллюсков (Wang et al., 2017). Ранее показано (Dang et al., 2013), что из всех амебоцитов двустворчатых моллюсков, в частности мидий и устриц, лишь бластоподобные агранулоциты не участвуют в реализации клеточного иммунного ответа, тогда как гранулярные клетки в большей степени, чем агранулоциты, способны к фагоцитозу, продукции защитных пептидов и генерации АФК (Hegaret et al., 2003; Nakahara et al., 2009). Нами обнаружено, что оба типа гемоцитов анадары – амебоциты и эритроциты – в равной степени способны к продукции АФК. Это может свидетельствовать, что эритроциты анадары, как и амебоциты, участвуют в иммунном ответе. Фагоцитарная активность эритроцитов анадары в отношении частиц зимозана, впервые установленная в настоящей работе, подтверждает это предположение и косвенно согласуется с литературными данными о повышении экспрессии генов, кодирующих субъединицы гемоглобина в гемоцитах гемоглобин-содержащих моллюсков в ответ на инвазию патогенов и стимуляцию иммунной системы.
Таким образом, принципиальное отличие клеточного состава гемолимфы анадары от других представителей двустворчатых моллюсков, например устриц и мидий, состоит в наличии гемоглобин-содержащих эритроцитов, обладающих определенными морфологическими особенностями. Однако следует отметить, что, несмотря на эти различия, общие признаки, в первую очередь наличие гранул в цитоплазме, низкое ЯЦО и функциональные активности, сходные с таковыми амебоцитов, объединяют эритроциты анадары с гранулоцитами других двустворчатых моллюсков. Полученные в работе факты заставляют шире взглянуть на проблему морфологической и функциональной классификации гемоцитов внутри класса Bivalvia, они могут стать подтверждением гипотезы о единстве происхождения разных типов гемоцитов, которая выдвинута ранее в отношении двустворчатых моллюсков, не содержащих гемоглобин (Анисимова и др., 2022; Mix, 1976; Ottaviani et al., 1998; Rebelo et al., 2013). Наличие особенностей, проявляющихся в присутствии пигментов в клетках гемолимфы, разной интенсивности грануляции цитоплазмы и окраски гранул гемоцитов, вероятно, свидетельствует о существовании эволюционно закрепленной специализации некоторых типов гемоцитов, обеспечивающей адаптацию конкретных видов к особенностям среды обитания.
Список литературы
Анисимова А.А. Морфофункциональные параметры гемоцитов в оценке физиологического состояния двустворчатых моллюсков // Биол. моря. 2013. Т. 39. № 6. С. 389−399.
Анисимова А.А., Дягилева М.Н., Карушева О.А. и др. Состав и кинетика клеточной популяции гемоцитов у двустворчатого моллюска Crenomytilus grayanus (Dunker, 1853) // Биол. моря. 2022. Т. 48. № 4. С. 251–261.
Афейчук Л.С. Оценка состояния промысловых скоплений анадары Броутона (Anadara broughtonii) в заливе Петра Великого (Японское море) по результатам мониторинга 2010–2020 годов // Национальная (всероссийская) научно-практическая конференция “Природные ресурсы, их современное состояние, охрана, промысловое и техническое использование”. Камчатский государственный технический университет. 2021. № 12. С. 11–15.
Присный А.А., Пигалева Т.А., Кулько С.В. Морфофункциональные особенности гемоцитов сухопутных брюхоногих моллюсков // Фундаментальные исследования. 2011. № 5. С. 206–210.
Allam B., Ashton-Alcox K.A., Ford S.E. Flow cytometric comparison of haemocytes from three species of bivalve molluscs // Fish Shellfish Immunol. 2002. V. 13. № 2. P. 141–158.
Andreyeva A.Y., Efremova E.S., Kukhareva T.A. et al. Morphological and functional characterization of hemocytes in cultivated mussel (Mytilus galloprovincialis) and effect of hypoxia on hemocyte parameters // Fish Shellfish Immunol. 2019. V. 89. P. 361–367.
Bachère E., Rosa R.D., Schmitt P. et al. The new insights into the oyster antimicrobial defense: Cellular, molecular and genetic view // Fish Shellfish Immunol. 2015. V. 46. № 1. P. 50–64.
Cao A., Mercado L., Ramos-Martinez J.I. et al. Primary cultures of hemocytes from Mytilus galloprovincialis Lmk.: expression of IL-2Rα subunit // Aquaculture. 2003. V. 216. № 1–4. P. 1–8.
Cohen W.D., Nemhauser I. Association of centrioles with the marginal band of a molluscan erythrocyte // J. Cell Biol. 1980. V. 86. № 1. P. 286–291.
Dang C., Cribb T.H., Osborne G. et al. Effect of a hemiuroid trematode on the hemocyte immune parameters of the cockle Anadara trapezia // Fish Shellfish Immunol. 2013. V. 35. № 3. P. 951–956.
De la Ballina N.R., Maresca F., Cao A. et al. Bivalve haemocyte subpopulations: A Review // Frontiers in Immunology. 2022. V. 13.
De Zwaan A., Isani G., Cattani O., Cortesi P. Long-term ana-erobic metabolism of erythrocytes of the arcid clam Scapharca inaequivalvis // J. Exp. Mar. Biol. Ecol. 1995. V. 187. № 1. P. 27–37.
Donaghy L., Kim B.K., Hong H.K. et al. Flow cytometry studies on the populations and immune parameters of the hemocytes of the Suminoe oyster, Crassostrea ariakensis // Fish Shellfish Immunol. 2009. V. 27. № 2. P. 296–301.
Fonseca V.B., Cruz B.P., da Silva S.S. et al. Morphological characterization of hemocytes of the brown mussel Perna perna: an update // Fish Shellfish Immunol. 2022. V. 120. P. 139–141.
Ford S.E., Ashton-Alcox K.A., Kanaley S.A. Comparative cytometric and microscopic analyses of oyster hemocytes // J. Invertebr. Pathol. 1994. V. 64. № 2. P. 114–122.
Funakoshi S. Studies on the classification, structure and function of hemocytes in bivalves // Bull. Natl. Res. Inst. Aquac. (Jpn.). 2000. V. 29. P. 1–103.
Gerdol M., Gomez-Chiarri M., Castillo M.G. et al. Immunity in molluscs: recognition and effector mechanisms, with a focus on Bivalvia // Adv. Immunol. Springer Cham. 2018. P. 225–341.
Hameed A., Muhammad F., Muhammad A.A. et al. Morphological and structural characterization of blood cells of Anadara antiquata // Iran. J. Fish. Sci. 2018. V. 17. № 3. P. 613–619.
Hegaret H., Wikfors G.H., Soudant P. Flow cytometric ana-lysis of haemocytes from eastern oysters, Crassostrea virginica, subjected to a sudden temperature elevation: II. Haemocyte functions: aggregation, viability, phagocytosis, and respiratory burst // J. Exp. Mar. Biol. Ecol. 2003. V. 293. № 2. P. 249–265.
Holden J.A., Pipe R.K., Quaglia A., Ciani G. Blood cells of the arcid clam, Scapharca inaequivalvis // J. Mar. Biol. Ass. U.K. 1994. V. 74. № 2. P. 287–299.
Kim J.H., Lee H.M., Cho Y.G. et al. Flow cytometric cha-racterization of the hemocytes of blood cockles Anadara broughtonii (Schrenck, 1867), Anadara kagoshimensis (Lischke, 1869), and Tegillarca granosa (Linnaeus, 1758) as a biomarker for coastal environmental monitoring // Mar. Pollut. Bull. 2020. V. 160. Article 111654.
Kladchenko E.S., Andreyeva A.Y., Kukhareva T.A. Effect of ranged short-term hypoxia on functional and morphological parameters of hemocytes in the Pacific oyster Crassostrea gigas (Thunberg, 1793) // J. Evol. Biochem. Physiol. 2022. V. 58. № 1. P. 45–53.
Kolyuchkina G.A., Ismailov A.D. Morpho-functional cha-racteristics of bivalve mollusks under the experimental environmental pollution by heavy metals // Oceanology. 2011. V. 51. № 5. P. 804. https://doi.org/10.1134/S0001437011050092
Matozzo V. Aspects of eco-immunology in molluscs // Invertebr. Surviv. J. 2016. V. 13. № 1. P. 116–121.
Mello D.F., De Oliveira E.S., Vieira R.C. et al. Cellular and transcriptional responses of Crassostrea gigas hemocytes exposed in vitro to brevetoxin (PbTx-2) // Mar. Drugs. 2012. V. 10. № 3. P. 583–597.
Mix M.C. A general model for leukocyte cell renewal in bivalve mollusks // Mar. Fish. Rev. 1976. V. 38. № 10. P. 37–41.
Nakahara Y., Shimura S., Ueno C. et al. Purification and characterization of silkworm hemocytes by flow cyto-metry // Dev. Comp. Immunol. 2009. V. 33. № 4. P. 439–448.
Novitskaya V.N., Soldatov A.A. Peculiarities of functional morphology of erythroid elements of hemolymph of the bivalve mollusk Anadara inaequivalvis, the Black Sea // Hydrobiol. J. 2013. V. 49. № 6. P. 64−71.
Novoa B., Figueras A. Immune responses in molluscs and their implications for disease control // Infectious Di-sease in Aquaculture, Cambridge: Woodhead Publi-shing. 2012. P. 88–110.
Ottaviani E., Franchini A., Barbieri D., Kletsas D. Compa-rative and morphofunctional studies on Mytilus galloprovincialis hemocytes: Presence of two aging-related hemocyte stages // Ital. J. Zool. 1998. V. 65. № 4. P. 349–354.
Parisi M.G. Mauro M., Sarà G., Cammarata M. Temperature increases, hypoxia, and changes in food availability affect immunological biomarkers in the marine mussel Mytilus galloprovincialis // J. Comp. Physiol. B. 2017. V. 187. № 8. P. 1117–1126.
Rebelo M.d.F., Figueiredo E.d.S., Mariante R.M. et al. New insights from the oyster Crassostrea rhizophorae on bivalve circulating hemocytes // PLoS One. 2013. V. 8. № 2. art. ID e57384. https://doi.org/10.1371/journal.pone.0057384
Rodrick G.E., Ulrich S.A. Microscopical studies on the hemocytes of bivalves and their phagocytic interaction with selected bacteria // Helgoländer Wiss. Meeresunters. 1984. V. 37. № 1. P. 167–176.
Rosa I.C., Garrido R., Re A. et al. Sensitivity of the invasive bivalve Corbicula fluminea to candidate control chemicals: the role of dissolved oxygen conditions // Sci. Total Environ. 2015. V. 536. P. 825–830.
Travers M.A., Da Silva P.M., Le Goïc N. et al. Morphologic, cytometric and functional characterisation of abalone (Haliotis tuberculata) haemocytes // Fish Shellfish Immunol. 2008. V. 24. № 4. P. 400–411.
Wang W., Li M., Wang L. et al. The granulocytes are the main immunocompetent hemocytes in Crassostrea gigas // Dev. Comp. Immunol. 2017. V. 67. P. 221–228.
Wang Y., Zhou S., Liu T. et al. De novo transcriptome ana-lysis of stressed blood clam (Anadara broughtonii) and identification of genes associated with hemoglobin // Genes Genomics. 2020. V. 42. № 2. P. 189–202.
Zhou L., Yang A., Liu Z. et al. Changes in hemolymph cha-racteristics of ark shell Scapharca broughtonii dealt with Vibrio anguillarum challenge in vivo and various of anticoagulants in vitro // Fish Shellfish Immunol. 2017. V. 61. P. 9–15.
Zhou L., Yang A., Wang Q. et al. Studies on the hemocytes types and their immunological functions in bloody clam (Scapharca broughtonii) // J. Fish. China. 2013. V. 37. № 4. P. 599–606.
Zhou L., Zhao D., Wu B. et al. Ark shell Scapharca broughtonii hemocyte response against Vibrio anguillarum challenge // Fish Shellfish Immunol. 2019. V. 84. P. 304–311. https://doi.org/10.1016/j.fsi.2018.09.039
Дополнительные материалы отсутствуют.