Биотехнология, 2023, T. 39, № 1, стр. 102-112
Влияние фульвокислот из различных почв юга России на эффективность полимеразной цепной реакции
В. С. Флоринская 1, 2, И. В. Корниенко 1, 2, *, О. Ю. Арамова 1, 2, Т. Г. Фалеева 1, 3, 4, О. С. Безуглова 2, Е. В. Вдовченков 2
1 Федеральный исследовательский центр Южный научный центр Российской академии наук
344006 Ростов-на-Дону, Россия
2 Южный федеральный университет
344090 Ростов-на-Дону, Россия
3 Санкт-Петербургское государственное бюджетное учреждение здравоохранения
“Бюро судебно-медицинской экспертизы”
195067 Санкт-Петербург, Россия
4 Северо-Западный государственный медицинский университет
имени И.И. Мечникова
191015 Санкт-Петербург, Россия
* E-mail: ikornienko@yandex.ru
Поступила в редакцию 03.08.2022
После доработки 16.11.2022
Принята к публикации 21.11.2022
Аннотация
Юг Российской Федерации, в частности Ростовская область, богат археологическими памятниками древних народов (сарматов, меотов, хазар), заселявших в прошлом территорию региона и представляющих в настоящее время большой научный интерес для палеогенетических исследований. Учитывая, что древние останки человека обнаруживаются обычно в толще почвы, исследование влияния фульвокислот (неотъемлемых водорастворимых компонентов всех почв и почвенных горизонтов) на энзиматическую амплификацию становится значимым и актуальным. С использованием методов УФ спектрофотометрии и флуориметрии в настоящей работе проведен анализ влияния фульвокислот, выделенных из разных почвенных горизонтов (Апахотный, В и С) и почв (чернозем обыкновенный карбонатный, чернозем южный, каштановая) Юга России, на полимеразную цепную реакцию (ПЦР). Показано, что наибольшее ингибирующее влияние оказывают фульвокислоты в конечной концентрации 100 нг/мкл, выделенные из горизонтов Апахотный и В чернозема обыкновенного карбонатного и каштановой почвы, а также из горизонтов В и С чернозема южного. Наименьшее ингибирующее влияние на ПЦР среди трех видов изученных почв оказывали фульвокислоты каждого из трех горизонтов каштановой почвы. Использование в ходе палеогенетических исследований костных останков, обнаруженных в горизонтах Апахотный и В чернозема обыкновенного карбонатного или в любом из трех горизонтов чернозема южного, требует разработки и применения дополнительных манипуляций по уменьшению действия фульвокислот на ПЦР.
ВВЕДЕНИЕ
Различные биологические объекты, обнаруживаемые в почве, могут являться предметом молекулярно-генетических исследований для различных целей и задач, в частности, для ДНК-идентификации и палеогенетики. Продолжительное пребывание таких объектов в почве может существенно осложнить процесс их ДНК-анализа, в результате деградации генетического материала, либо вследствие наличия различных ингибиторов. Если на процесс деградации ДНК влияют различные биологические (например, ДНКазы микроорганизмов), либо физико-химические факторы (влажность, температура и др.) [1], то наличие ингибиторов, вероятно, будет зависеть от типа почвы и глубины залегания в ней исследуемого биологического образца.
Стоит отметить, что территория Нижнего Дона хорошо обследована археологически. Начиная с эпохи энеолита нам известны погребальные комплексы, которые дают хорошую возможность для исследования прошлого. На Дону представлены погребальные комплексы всех времен и самых разных культур – энеолита (V–IV тысячелетия до н.э.), палеометалла, раннего железного века и средневековья. На рубеже II–I тыс. до н. э. происходит формирование номадизма как особого хозяйственно-культурного типа, при котором большинство населения занимается экстенсивным кочевым скотоводством. Так, Подонье становится одним из ключевых центров у кочевников – скифов, сарматов, затем хазар, болгар, печенегов, половцев, татар. Важной особенностью Подонья является также то, что оно было контактной зоной между оседлым миром и миром номадов, нам известны как города и поселения, так и находящиеся в непосредственной близости от них курганные могильники кочевников. Среди самых известных памятников стоит упомянуть Ливенцовскую крепость позднего бронзового века, Елизаветинское городище скифского времени, Танаис, Саркел, Азак.
Толща почв чаще всего является местом обнаружения костных останков, служащих материалом для палеогенетического анализа, основная цель которого – установление генетических характеристик древних популяций по биологическим образцам такого рода. Археологические памятники на территории Нижнего Дона, Поволжья и Северного Кавказа уже были исследованы с точки зрения территориальных особенностей почвы: восстановлена динамика увлажненности и аридизации (процесс уменьшения степени увлажненности территории), созданы модели палеоклимата от эпохи бронзы до средневековья, отслежены особенности почвообразования, что очень важно для понимания образования культурного слоя [2–4]. В настоящее время для некоторых древних останков можно установить зональные почвы, в которых они были обнаружены (табл. 1).
Таблица 1.
Соотнесение местонахождений костных останков, обнаруженных в ходе археологических раскопок, и зональных почв Table 1. Comparison of the locations of bone remains (discovered during archaeological excavations) and zonal soils
| № | Местонахождение, датировка | Зональные почвы |
|---|---|---|
| 1 | Мг. Кировский V, курган № 2, погребение 1, VII–IX вв. н.э. [5]. Мартыновский р-н., х. Новосадковка |
Чернозем южный |
| 2 | Мг. Вербовый лог IX, курган № 3, погребение 1, VII–VIII вв. н.э. [6]. Дубовский р-н., х. Вербовый лог |
Каштановая |
| 3 | Мг. Кутейников 11, курган № 2, погребение 1, конец VII–начало VIII в. н.э. [7]. Зимовниковский р-н., ст. Кутейниковская |
Каштановая |
| 4 | Мг. Таловый, курган № 3, погребение 1, вторая половина VIII–начало IX в. н.э. [8]. Орловский р-н., х. Камышовка | Каштановая |
| 5 | Мг. Койсугский, курган № 1, погребение 2, новотитаровская культура, III–II в. до н. э. [9], Азовский р-н., с. Кулешовка | Чернозем обыкновенный карбонатный |
Такие объекты исследований, будучи извлеченными из почвы, несут на себе еe компоненты, в частности гумусовые кислоты – фульвокислоты (ФК), гуминовые кислоты (ГК) и гиматомелановые кислоты (ГМК). Гумусовые кислоты различаются по своим химическим свойствам, в частности по растворимости. Так, ГК от других компонентов щелочной вытяжки отделяют подкислением ее до рН 1–2. ГМК представляют собой спирторастворимую фракцию ГК, и их содержание настолько мало, что ими обычно пренебрегают. Содержание ФК сопоставимо с количеством ГК, к тому же именно ФК, будучи водорастворимой фракцией, вызывают наибольшие затруднения при молекулярно-генетических исследованиях, поскольку они соосаждаются вместе с ДНК [10].
Несмотря на то, что о способности гумусовых кислот препятствовать анализу нуклеиновых кислот путем ингибирования ими полимеразной цепной реакции (ПЦР) известно давно [11], интерес к этой проблеме остается на высоком уровне [12].
Стоит отметить, что большинство научных работ по влиянию гумусовых кислот на ПЦР посвящены нерастворимым в воде представителям этих соединений, при этом влияние фракции ФК, являющихся водорастворимыми, на ПЦР подробно не исследовалось. Кроме того, ряд исследователей использовали не те или иные гумусовые кислоты из конкретных видов почв, а коммерческие препараты этих кислот [12–14]. Так же отсутствуют сведения о силе ингибиторного воздействия на энзиматическую амплификацию ДНК ФК из различных почв и почвенных горизонтов.
В связи с этим целью настоящей работы явилось сравнительное исследование влияния фульвокислот, выделенных из разных почв и почвенных горизонтов Юга России на ПЦР.
УСЛОВИЯ ЭКСПЕРИМЕНТА
Объекты исследования
Для молекулярно-генетического исследования были использованы ФК, выделенные из трех горизонтов (Апахотный, В и С) каждой из типов почв, наиболее распространенных на территории Ростовской области: чернозем южный (30%), чернозем обыкновенный карбонатный (22,4% почв региона) и каштановая почва (6%) [15] (рис. 1).
Рис. 1.
Распределение преобладающих типов почв на территории Ростовской области. Fig. 1. Distribution of the predominant soil types in the Rostov region.
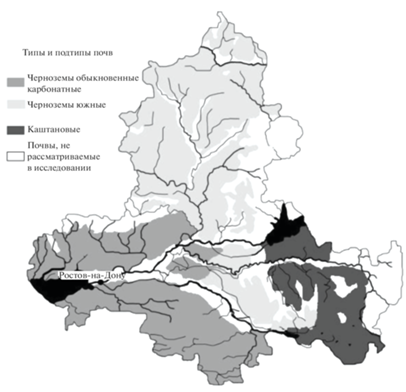
Почвенные горизонты располагаются в следующем порядке по глубине залегания от поверхности почвы: Апахотный, В и С – наиболее глубокие. Во всех почвах для пахотного слоя (Апахотный) глубина отбора образцов составляла 0–20 см. Для других горизонтов она варьировала, что связано с различиями в генезисе и в морфологических свойствах почв. Если в обоих черноземах глубина отбора в горизонте В почти совпадала – 60–80 см, то в каштановой почве горизонт В лежит гораздо ближе к поверхности, соответственно и глубина отбора пробы составила 30–40 см. Примерно такая же ситуация и с глубиной залегания материнской породы – горизонта С. В черноземе обыкновенном карбонатном образец отбирали с глубины 120–130 см, в черноземе южном – 80–90 см, в каштановой почве – 70–80 см.
Выделение ФК проводили по методу Форсита [10]. Для этого из образца почвы, предварительно декальцинированной раствором 10%-ной соляной кислоты от карбонатного и поглощенного кальция, экстрагировали смесь ГК и ФК 0.1М раствором NaOH в течение 24 ч, повторяя эту операцию несколько раз до полного осветления надосадочной жидкости. Объединенные экстракты подкисляли 0.5М H2SO4 до рН 2, отделяли осадок ГК фильтрованием через запаренный фильтр. Содержащиеся в супернатанте ФК, сорбировали на очищенном древесном активированном угле марки АГ-3. Активированный уголь промывали ацетоном и дистиллированной водой до обесцвечивания вытекающей жидкости и элюировали ФК с помощью 0.5М NaOH. Элюат упаривали при 35°С в сушильном шкафу (“SNOL”, Россия) до объема примерно 100 мл. Дополнительную очистку ФК проводили в электродиализаторе (“СКФУ”, Россия), выдерживая в нем упаренный элюат до окончания реакции на платиновых электродах, затем высушивали в суховоздушном термостате при температуре +35°С.
Оценка оптических характеристик и концентрации ДНК
Изменение оптических характеристик смесей ФК с ДНК относительно растворов ДНК и ФК оценивали спектрофотометрически, регистрируя ультрафиолетовые (УФ) спектры с помощью спектрофотометра ND-1000 (NanoDrop Technologies, США).
Для оценки изменений оптических характеристик чистых водных растворов ДНК по сравнению с их смесями с гумусовыми кислотами использовали флуориметр MAXLIFE H100 Mod.2 (“МВМ-Диагностик”, Россия). Спектры флуоресценции регистрировали при длине волны возбуждения 470+/–10 нм; и детекции >520 нм. Измерения проводили в 3 повторностях.
Оценка ингибирования ПЦР
При постановке ПЦР “в реальном времени” (ПЦР-РВ) в реакционную смесь с различными контрольными ДНК человека (указаны ниже) добавляли ФК до конечной концентрации 20, 50 и 100 нг/мкл. Оценку влияния ФК на ПЦР-РВ проводили с помощью термоциклера с мультиканальным детектором iQ5 (Bio-Rad, США) с использованием коммерческой тест-системы “XY-Детект” (“Синтол”, Россия), а также набора реактивов в присутствии красителя EVA Green (“Синтол”) с добавлением праймеров, специфичных к фрагменту гена HBB (hemoglobin subunit beta), расположенного на 11 хромосоме (NCBI Reference Sequence: NC_000011.10, позиция данного локуса 5226946-5227065) [16].
Амплификацию локуса HBB проводили с помощью набора реактивов для проведения ПЦР‑РВ в присутствии красителя EVA Green с добавлением ДНК человека 9947А (Applied Biosystems, США) в конечной концентрации 0.025 нг/мкл и пары праймеров:
HBB1: 5'-GCTTCTGACACAACTGTGTTCACTAGC-3'
HBB2: 5'-CACCAACTTCATCCACGTTCACC-3' [17].
по следующей программе: предварительная инкубация при 95°С в течение 4.5 мин, затем 45 циклов, каждый из которых включал денатурацию (95°С, 15 с), отжиг праймеров (58°С, 15 с) и элонгацию цепи ДНК-матрицы (72°С, 35 с).
Регистрацию накопления ампликонов в реальном времени, основанную на усилении флуоресценции при связывании интеркалятора EVA Green с двухцепочечной ДНК, и построение калибровочных кривых проводили по каналу FAM с помощью программы “iQ5 Optical System Software” (версия 2.0) (Bio-Rad).
ПЦР-амплификацию с использованием коммерческой тест-системы “XY-Детект” проводили с использованием контрольной человеческой ДНК, входящей в состав коммерческого набора, в конечной концентрации 0.025 нг/мкл по следующей программе: предварительная инкубация при 95°С в течение 5 мин, затем 44 цикла, каждый из которых включал денатурацию (95°С, 15 с), отжиг праймеров (61°С, 35 с) и элонгацию цепи (68°С, 10 с).
Оценку ингибиторного воздействия ФК на ПЦР проводили по каналам FAM (в присутствии красителя EVA Green) и Cy5 (“XY-Детект”) путем сравнения числовых значений пороговых циклов (Сt).
Статистическая обработка полученных данных осуществлялась с помощью программы “Statistica” (версия 10.0) с использованием непараметрического метода оценки данных – по критерию Манна–Уитни.
Расчет показателя ингибирования ПЦР-РВ производили по формуле:
где I – показатель ингибирования ПЦР, E – значение эффективности ПЦР, ΔСt – разница между пороговыми циклами опытной (с добавлением ФК) и контрольной (без добавления ФК) пробы. При этом эффективность ПЦР, вычисленная исходя из тангенса угла наклона (углового коэффициента) концентрационной прямой значений Ct с использованием разных концентраций ДНК (канал FAM, фрагмент гена HBB), составляла в среднем 0.92. Эффективность в случае канала Су5 (канал регистрации накопления внутреннего положительного контроля (ВПК)) принимали равной 1.РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Оценка оптических характеристик и концентрации ДНК
На первом этапе работы было исследовано влияние ФК на оптические характеристики препаратов ДНК для установления возможных искажений полученных результатов при оценке концентраций нуклеиновых кислот, контаминированных гумусовыми кислотами, с использованием методов ультрафиолетовой спектроскопии и флуориметрии.
Для этого снимали отдельные спектры поглощения водного раствора ДНК с концентрацией 30 нг/мкл, спектры водных растворов ФК с концентрацией 50 нг/мкл. На заключительном этапе были получены спектры поглощения смешанных растворов ДНК с ФК, конечные концентрации которых составляли 30 и 50 нг/мкл соответственно. Измерения проводили в 5 повторностях.
В результате были выявлены изменения оптических характеристик, выражающиеся в искажении морфологии спектральных пиков смесей ФК с ДНК (рис. 2а) относительно водных растворов ДНК (рис. 2b) и ФК (рис. 2c). Кроме того, отмечено увеличение оптической плотности смешанного раствора при длине волны 260 нм по сравнению с аутентичными растворами ДНК и ФК. Таким образом, смесь ДНК с ФК сильно искажает показатель концентрации, полученный с помощью УФ-спектроскопии, что не дает возможность использовать данный метод при оценке препаратов ДНК, загрязненных гумусовыми кислотами.
Рис. 2.
Спектры поглощения в диапазоне от 220 до 350 нм; максимум поглощения целевого пика (ДНК) 260 нм: а) смеси ДНК (в конечной концентрации 30 нг/мкл) с ФК из горизонта В чернозема обыкновенного карбонатного (в конечной концентрации 50 нг/мкл); b) водный раствор ДНК в концентрации 30 нг/мкл; c) водный раствор ФК из горизонта В чернозема обыкновенного карбонатного в концентрации 50 нг/мкл. Fig. 2. Absorption spectra in the range from 220 to 350 nm; the maximum absorption of the target peak (DNA) 260 nm: a) a mixture of DNA (at a final concentration of 30 ng/mL) with FAs from the horizon B of Ordinary Chernozem Calcareous (at a final concentration of 50 ng/mL); b) an aqueous solution of DNA at a concentration of 30 ng/mL; c) an aqueous solution of FAs from the horizon B of Ordinary Chernozem Calcareous at a concentration of 50 ng/mL.
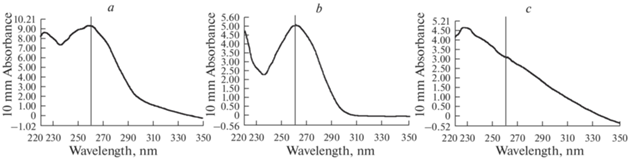
Изменение оптических характеристик смеси ДНК с ФК можно объяснить особенностями химической структуры ФК, представляющих собой множественные сочленения ароматических колец, к которым наряду с карбоксильными, фенольными и многими другими функциональными группами могут присоединяться целые пептидные цепи. Дифрактограммы препаратов ФК из чернозема и каштановой почвы свидетельствуют, что в этих соединениях, в отличие от ГК, конденсированные структуры ароматической природы (так называемое “ядро”) отсутствуют. А цепочечные структуры отличаются в 2–3 раза меньшей толщиной пакетов, чем цепочечные пакеты гуминовых кислот из этих же почвенных горизонтов [18]. Наблюдаемые в настоящей работе изменения оптических показателей при УФ-спектроскопии в присутствии ФК при длине волны 260 нм, вероятно, обусловлены присутствием структурных фрагментов, содержащих бензольные (пиридиновые) кольца [10]. Таким образом, именно химическая структура ФК является основной причиной, препятствующей объективной оценке свойств ДНК в растворе с ФК с помощью методов, базирующихся на ее УФ-спектральных характеристиках.
Результаты флуориметрии (табл. 2) водного раствора ДНК (30 нг/мкл), различных ФК (50 нг/мкл), а также смеси ДНК и ФК (в конечной концентрации 30 и 50 нг/мкл соответственно) свидетельствуют о том, что наличие ФК в смеси с ДНК практически не препятствуют объективной оценке концентрации ДНК в растворе с помощью методов, основанных на измерении флуоресценции.
Таблица 2.
Изменение медианных значений концентраций одного и того же препарата ДНК при добавлении к нему различных ФК Table 2. Change in median concentrations of the same DNA preparation when different FAs added
| Образец | Медиана концентрации ДНК (нг/мкл) |
|---|---|
| ДНК (водный раствор) | 30.3 |
| ФК из чернозема обыкновенного карбонатного (Апахотный) | <5 |
| ФК из чернозема обыкновенного карбонатного (В) | <5 |
| ФК из чернозема обыкновенного карбонатного (С) | <5 |
| ФК из чернозема южного (Апахотный) | <5 |
| ФК из чернозема южного (В) | <5 |
| ФК из чернозема южного (С) | <5 |
| ФК из каштановой почвы (Апахотный) | <5 |
| ФК из каштановой почвы (В) | <5 |
| ФК из каштановой почвы (С) | <5 |
| ДНК + ФК из чернозема обыкновенного карбонатного (Апахотный) | 30.3 |
| ДНК + ФК из чернозема обыкновенного карбонатного (В) | 30.6 |
| ДНК + ФК из чернозема обыкновенного карбонатного (С) | 30.3 |
| ДНК + ФК из чернозема южного (Апахотный) | 40.1 |
| ДНК + ФК из чернозема южного (В) | 40.0 |
| ДНК + ФК из чернозема южного (С) | 30.3 |
| ДНК + ФК из каштановой почвы (Апахотный) | 30.4 |
| ДНК + ФК из каштановой почвы (В) | 30.3 |
| ДНК + ФК из каштановой почвы (С) | 30.3 |
Оценка ингибирования
Оценку влияния различных концентраций ФК из трех почв на процесс энзиматической амплификации ДНК проводили методом ПЦР-РВ с последующим сравнением значений пороговых циклов (ΔСt) кривых опытных проб (с добавлением ФК в конечных концентрациях 20, 50 и 100 нг/мкл) по отношению к контрольным образцам (без добавления ФК). Результаты сравнения отражены в табл. 3.
Таблица 3.
Влияние различных концентраций ФК из трех почв и почвенных горизонтов на эффективность ПЦР-РВ при использовании двух различных наборов реагентов Table 3. Effect of different concentrations of FAs from three soils and soil horizons on the efficiency of real-time PCR using two different reagent kits
| Почва | Горизонт | Конечная концентрация ФК, нг/мкл | Тест-система “XY-Детект” (“Синтол”), Сt ВПК (флуорофор Cy5) | Набор реагентов для проведения ПЦР‑РВ в присутствии красителя EVA Green (“Синтол”), Сt по фрагменту гена HBB (флуорофор FAM) | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| N | Me | P25 | P75 | ΔСt | I | N | Me | P25 | P75 | ΔСt | I | |||
| Контроль | – | – | 22 | 34.33 | 34.25 | 34.64 | – | – | 21 | 31.72 | 31.38 | 32.16 | – | – |
| Чернозем обыкновенный карбонатный | Aпахотный | 20 | 6 | 35.09 | 35.02 | 35.26 | 0.77 | 1.71 | 6 | 32.65 | 32.14 | 32.73 | 0.93 | 1.83 |
| 50 | 6 | 36.33 | 35.85 | 36.42 | 2.01 | 4.03 | 6 | 37.4 | 37.21 | 38.03 | 5.68 | 40.72 | ||
| 100 | 6 | 38.83 | 37.91 | 39.12 | 4.5 | 22.63 | 6 | N/A | – | – | – | – | ||
| B | 20 | 6 | 34.95 | 34.84 | 35.08 | 0.63 | 1.55 | 6 | 32.49 | 32.26 | 32.74 | 0.77 | 1.65 | |
| 50 | 6 | 36 | 35.34 | 36.23 | 1.68 | 3.20 | 6 | 32.87 | 32.65 | 33.38 | 1.15 | 2.11 | ||
| 100 | 6 | 37.16 | 36.33 | 38.34 | 2.83 | 7.11 | 6 | N/A | – | – | – | – | ||
| C | 20 | 6 | 35.06 | 35.03 | 35.34 | 0.74 | 1.67 | 6 | 32.88 | 32.6 | 33.05 | 1.16 | 2.13 | |
| 50 | 6 | 34.99 | 34.99 | 35.19 | 0.66 | 1.58 | 6 | 32.11 | 30.32 | 32.83 | 0.39 | 1.29 | ||
| 100 | 6 | 37.26 | 36.55 | 37.37 | 2.93 | 7.62 | 6 | 39.48 | 39.09 | 40.3 | 7.76 | 157.79 | ||
| Чернозем южный | Aпахотный | 20 | 6 | 35.27 | 35.26 | 35.27 | 0.95 | 1.93 | 6 | 31.6 | 30.6 | 32.27 | –0.12 | – |
| 50 | 6 | 36.45 | 35.52 | 36.71 | 2.13 | 4.38 | 6 | 33 | 32.79 | 33.27 | 1.28 | 2.31 | ||
| 100 | 6 | 37.73 | 37.21 | 38.05 | 3.41 | 10.63 | 6 | 39.92 | 39.92 | 39.92 | 8.2 | 210.45 | ||
| B | 20 | 6 | 36.93 | 36.61 | 37.1 | 2.6 | 6.06 | 6 | N/A | – | – | – | – | |
| 50 | 6 | 41.34 | 40.22 | 41.89 | 7.01 | 128.89 | 6 | N/A | – | – | – | – | ||
| 100 | 6 | N/A | – | – | – | – | 6 | N/A | – | – | – | – | ||
| C | 20 | 6 | 34.95 | 34.83 | 35.21 | 0.62 | 1.54 | 6 | 31.95 | 31.55 | 32.59 | 0.23 | 1.16 | |
| 50 | 6 | 36.33 | 36.27 | 36.76 | 2.01 | 4.03 | 6 | 33.77 | 33.44 | 34.23 | 2.05 | 3.81 | ||
| 100 | 6 | 37.65 | 37.56 | 38.08 | 3.33 | 10.06 | 6 | N/A | – | – | – | – | ||
| Каштановая | Aпахотный | 20 | 6 | 35.27 | 35.24 | 35.33 | 0.94 | 1.92 | 6 | 32.53 | 32.07 | 33.05 | 0.81 | 1.7 |
| 50 | 6 | 37.34 | 37.12 | 37.41 | 3.01 | 8.06 | 6 | 33.23 | 33.07 | 33.68 | 1.51 | 2.68 | ||
| 100 | 6 | 38.11 | 38.02 | 38.56 | 3.78 | 13.74 | 6 | 43.32 | 43.32 | 43.32 | 11.6 | 1929.74 | ||
| B | 20 | 6 | 35.53 | 35.39 | 35.82 | 1.2 | 2.30 | 6 | 32.54 | 32.34 | 32.95 | 0.82 | 1.71 | |
| 50 | 6 | 37.06 | 36.9 | 37.31 | 2.73 | 6.63 | 6 | 33.33 | 33.1 | 33.55 | 1.61 | 2.86 | ||
| 100 | 6 | 38.12 | 37.71 | 38.4 | 3.8 | 13.93 | 6 | 41.05 | 41.05 | 41.05 | 9.33 | 440.67 | ||
| C | 20 | 6 | 35.13 | 35.07 | 35.3 | 0.81 | 1.75 | 6 | 31.77 | 31.72 | 31.93 | 0.05 | 1.03 | |
| 50 | 6 | 35.78 | 35.7 | 35.8 | 1.45 | 2.73 | 6 | 32.22 | 31.88 | 32.88 | 0.5 | 1.39 | ||
| 100 | 6 | 36.37 | 35.9 | 36.89 | 2.05 | 4.14 | 6 | 31.44 | 31.42 | 31.62 | –0.28 | – | ||
Примечание: ВПК – внутренний положительный контроль, I – показатель ингибирования ПЦР, Ме – медианное значение, N – количество повторностей образца, N/A – отсутствие продукта амплификации, P25 – 25-й процентиль, P75 – 75-й процентиль, “—“ – отсутствие результата, в связи с невозможностью проведения расчета, ΔСt – изменение значения медианного порогового цикла опытного образца относительно контрольного образца. Note. IPC – an internal positive control, I – the PCR inhibition index, Me – the median value, N – the number of sample repetitions, N/A – no amplification product, P25 – the 25th percentile, P75 – the 75th percentile, “–” – no result, due to the impossibility of calculating, ΔT – change in the value of the median threshold cycle of the experimental sample relative to the control sample.
При сравнении значений пороговых циклов флуорофора Cy5, который служил внутренним положительным контролем (ВПК), с использованием коммерческой тест-системы “XY-Детект” (“Синтол”), отмечена тенденция к увеличению ингибиторного влияния ФК с ростом их концентрации. То есть чем выше концентрация ФК, тем выше величина Ct, и, соответственно, тем выше степень ингибирования ПЦР для всех изученных почвенных горизонтов и типов почв. При этом наибольшее ингибирующее влияние оказывали ФК, выделенные из горизонта Апахотный чернозема обыкновенного карбонатного и каштановой почвы, а для чернозема южного – из горизонта В. Для образцов с добавлением ФК горизонта В чернозема южного в конечной концентрации 100 нг/мкл наблюдали полное ингибирование энзиматической амплификации ВПК (табл. 3).
В случае же проведения ПЦР-РВ с набором реактивов в присутствии красителя EVA Green (“Синтол”) наблюдали полное ингибирование энзиматической амплификации при добавлении ФК из горизонтов Апахотный и В чернозема обыкновенного карбонатного, а также ФК из горизонтов В и С чернозема южного (табл. 3) в конечной концентрации 100 нг/мкл.
Стоит отметить, что ФК из горизонта В чернозема южного полностью ингибировали ПЦР уже при конечной концентрации 20 нг/мкл, тогда как при добавлении ФК из других горизонтов этой почвы полное ингибирования ПЦР наблюдали только при конечной концентрации 100 нг/мкл для горизонта С, либо не наблюдали вовсе в случае горизонта Апахотный. Такой эффект, оказываемый ФК из горизонта В чернозема обыкновенного, скорее всего, связан с особенностями их химической структуры. По сравнению с другими почвами в ФК горизонта В чернозема южного процентное содержание углерода по отношению к общему углероду почвы понижено, что свидетельствует о наличии в них меньшего количества циклических структур. Однако, соотношение содержания углерода в ФК и в почве чернозема южного карбонатного мало различается между горизонтами этой почвы. Вероятно, такая сильная ингибирующая способность ФК горизонта В чернозема южного, обуславливается содержанием в их составе других веществ, обладающих этим эффектом [19].
Полученные результаты оценки ингибирования ПЦР ФК из горизонта B чернозема южного в конечной концентрации 100 нг/мкл с использованием двух наборов реактивов (“XY-Детект” и в присутствии красителя EVA Green (“Синтол”)) соответствуют друг другу.
Достоверность различий показателей пороговых циклов (Ct) для концентрации ФК 20, 50 и 100 нг/мкл из горизонтов Апахотный, В и С чернозема обыкновенного карбонатного, чернозема южного и каштановой почвы относительно положительного контроля рассчитана по U-критерию Манна–Уитни и представлена в табл. 4.
Таблица 4.
Влияние различных концентраций ФК из трех горизонтов чернозема обыкновенного карбонатного, чернозема южного и каштановой почвы на ПЦР в сравнении с контролем Table 4. The effect of various concentrations of FA from three horizons of ordinary carbonate chernozem, southern chernozem, and chestnut soil on PCR in comparison with control
| Переменные | Тест-система “XY-Детект” (“Синтол”), ВПК (флуорофор Cy5) | Набор реагентов для проведения ПЦР‑РВ в присутствии красителя EVA Green (“Синтол”), фрагмент гена HBB (флуорофор FAM) | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| почва | горизонт | концентрация ФК, нг/мкл | ||||||||
| N К+ | U | Z adjusted | 2 × 1 sided exact р | N К+ | U | Z adjusted | 2 × 1 sided exact р | |||
| Чернозем обыкновенный карбонатный | А | 20 | 22 | 0 | 3.69 | 4 × 10–6 | 21 | 29 | –1.95 | 0.0488 |
| А | 50 | 22 | 0 | –3.69 | 4 × 10–6 | 21 | 0 | –3.65 | 7 × 10–6 | |
| А | 100 | 22 | 0 | –3.69 | 4 × 10–6 | 21 | – | – | – | |
| В | 20 | 22 | 6 | 3.36 | 0.0001 | 21 | 27 | –2.07 | 0.0359 | |
| В | 50 | 22 | 0 | –3.69 | 4 × 10–6 | 21 | 18 | –2.6 | 0.0067 | |
| В | 100 | 22 | 0 | –3.69 | 4 × 10–6 | 21 | – | – | – | |
| С | 20 | 22 | 0 | –3.69 | 4 × 10–6 | 21 | 29 | –1.95 | 0.0488 | |
| С | 50 | 22 | 0 | –3.69 | 4 × 10–6 | 21 | 113 | –0.08 | 0.9378 | |
| С | 100 | 22 | 0 | –3.69 | 4 × 10–6 | 21 | 0 | –4.07 | 0 | |
| Чернозем южный | А | 20 | 22 | 0 | –3.69 | 4 × 10–6 | 21 | 58 | 0.26 | 0.7983 |
| А | 50 | 22 | 0 | –3.69 | 4 × 10–6 | 21 | 9 | –3.12 | 0.0006 | |
| А | 100 | 22 | 19 | –2.66 | 0.0052 | 21 | –4 | 0 | 7 × 10–6 | |
| В | 20 | 22 | 0 | –3.69 | 4 × 10–6 | 21 | – | – | – | |
| В | 50 | 22 | 0 | –3.69 | 4 × 10–6 | 21 | – | – | – | |
| В | 100 | 22 | – | – | – | 21 | – | – | – | |
| С | 20 | 22 | 12 | –3.04 | 0.001 | 21 | 85 | –0.41 | 0.6892 | |
| С | 50 | 22 | 0 | –3.69 | 4 × 10–6 | 21 | 0 | –3.65 | 7 × 10–6 | |
| С | 100 | 22 | 0 | –3.69 | 4 × 10–6 | 21 | – | – | – | |
| Каштановая почва | А | 20 | 22 | 0 | –3.69 | 4 × 10–6 | 21 | 26 | –2.13 | 0.0305 |
| А | 50 | 22 | 0 | –3.69 | 4 × 10–6 | 21 | 2 | –3.53 | 3 × 10–5 | |
| А | 100 | 22 | 0 | –3.69 | 4 × 10–6 | 21 | 0 | –3.87 | 2 × 10–6 | |
| В | 20 | 22 | 0 | –3.69 | 4 × 10–6 | 21 | 25 | –2.19 | 0.0258 | |
| В | 50 | 22 | 0 | –3.69 | 4 × 10–6 | 21 | 3 | –3.47 | 5 × 10–5 | |
| В | 100 | 22 | 0 | –3.69 | 4 × 10–6 | 21 | 0 | –3.87 | 2 × 10–6 | |
| С | 20 | 22 | 0 | –3.69 | 4 × 10–6 | 21 | 53 | –0.55 | 0.5888 | |
| С | 50 | 22 | 0 | –3.69 | 4 × 10–6 | 21 | 39 | –1.37 | 0.1752 | |
| С | 100 | 22 | 0 | –3.69 | 4 × 10–6 | 21 | 48 | 1.33 | 0.1893 | |
Примечание: К+ – положительный контроль (без ФК), N – количество повторностей образца (во всех случаях для опытных образцов N = 6), U – значение критерия Манна-Уитни, Z adjusted – скорректированный Z-критерий Фишера, 2 × 1 sided exact р – р-уровень по точному критерию Фишера, значимые отклонения выделены жирным. Note. K+ – a positive control (without FAs), N – the number of sample repetitions (in all cases, for an experimental samples N = 6), U – the value of the Mann–Whitney criterion, Z adjusted – the adjusted Fisher Z–criterion, 2 × 1 sided exact p – the p-level according to the exact Fisher criterion, significant deviations are highlighted in bold.
Что касается ВПК (набор реагентов “XY-Детект”), достоверное ингибирование относительно положительно контроля (р < 0.05) наблюдается для всех концентраций ФК из трех горизонтов изученных почв и находится в границах от 4 × 10–6 до 0,0052. Значение U–критерия Манна–Уитни равно 0 во всех случаях, кроме горизонта В (U = 6; Z = 3.36; p = 0.0001) чернозема обыкновенного карбонатного при концентрации ФК 20 нг/мкл, а также горизонтов Апахотный (U = 19; Z = 2.66; p = = 0.0052) при концентрации ФК 100 нг/мкл и С (U = 12; Z = –3.04; p = 0.001) при концентрации ФК 20 нг/мкл чернозема южного.
В случае реагентов для проведения ПЦР‑РВ в присутствии красителя EVA Green достоверные различия относительно положительно контроля (р < 0.05) находятся в границах от 7 × 10–6 до 0.0488 и наблюдаются в случае всех изученных образцов, за исключением образцов с добавлением ФК из горизонта С в концентрации 50 нг/мкл (U = 113; Z = –0.08; р = 0.9378) чернозема обыкновенного карбонатного, горизонтов Апахотный (U = 58; Z = 0.26; р = 0.7983) и С (U = 85; Z = –0.41; р = = 0.6892) в концентрации 20 нг/мкл чернозема южного и всех изученных концентраций ФК горизонта С каштановой почвы – 20 нг/мкл (U = 53; Z = –0.55; р = 0.5888), 50 нг/мкл (U = 39; Z = –1.37; р = 0.1752) и 100 нг/мкл (U = 48; Z = 1.33; р = 0.1893).
Таким образом ФК, выделенные из всех горизонтов трех видов почв, оказывают влияние на ПЦР. Использование метода ультрафиолетовой спектроскопии не применимо для оценки концентраций препаратов ДНК, загрязненных гумусовыми кислотами, так как выявлено изменение морфологии спектральных пиков смесей ФК с ДНК, что искажает показатель концентрации ДНК. В то же время наличие ФК в смеси с ДНК практически не препятствуют объективной оценке концентрации ДНК в растворе с помощью методов, основанных на измерении флуоресценции. Применение флуориметрического метода с использованием двух коммерческих диагностических наборов подтвердило ингибирующее действие на ПЦР добавленных ФК, причем эффективность ингибирования зависит от их концентрации.
Подводя итоги, следует отметить, что в литературных данных, посвященных проблеме ингибирования ПЦР гумусовыми кислотами, отсутствует единая точка зрения на механизм их воздействия на ПЦР. Эти механизмы, по мнению ряда авторов, основаны либо на связывании гумусовых кислот с ДНК [13], либо на хелатировании ионов Mg2+ [20], либо на гашении флуоресценции, препятствующем детекции [21], либо на нарушении работы ДНК-полимеразы [14]. Таким образом, в настоящее время все еще отсутствует четкое понимание механизма ингибирования ПЦР ФК. В этой связи важно отметить, что гумусовые кислоты являются стабильными ингибиторами ПЦР, поэтому единственным эффективным и доступным способом уменьшения их негативного эффекта на ПЦР в настоящее время является разбавление экстрактов ДНК, что неизбежно приводит к снижению ее концентрации в реакционной среде. Стоит отметить, что для палеогенетических и криминалистических исследований, где концентрация активной ДНК-матрицы в образце, как правило, незначительна, данный способ не является приемлемым. Кроме того, на сегодняшний день в литературных источниках при описании проведенных исследований, отсутствует указание конкретных типов почв, в которых был обнаружен тот или иной объект. Это не позволяет провести сравнительный анализ полученных нами данных относительно ингибирования ПЦР и изменения оптических характеристик по результатам спектроскопии относительно других типов почв.
Наименьшее ингибирующее влияние на ПЦР оказывали ФК каждого из трех горизонтов каштановой почвы. Однако, использование в ходе палеогенетических исследований костных останков, обнаруженных в горизонтах Апахотный и В чернозема обыкновенного карбонатного или в любом из трех горизонтов чернозема южного, требует разработки и применения дополнительных манипуляций по нивелированию ингибирующего действия ФК на ПЦР.
Список литературы
Корниенко И.В., Харламов С.Г. Методы исследования ДНК человека. Выделение ДНК и ее количественная оценка в аспекте судебно-медицинского исследования вещественных доказательств биологического происхождения: учебно-методическое пособие. 2012, Ростов-на-Дону: Изд-во ЮФУ.
Демкин В.А., Скрипкин А.С., Ельцов М.В., Золотарева Б.Н., Демкина Т.С., Хомутова Т.Э., Кузнецова Т.В., Удальцов С.Н., Каширская Н.Н., Плеханова Л.Н. Природная среда волго-уральских степей в савромато-сарматскую эпоху (VI в. до н.э. – IV в. н.э.). 2012, Пущино, Институт физико-химических и биологических проблем почвоведения РАН.
Хохлова О.С., Хохлов А.А., Олейник С.А., Габуев Т.А., Малашев В.Ю. Особенности палеопочв курганных могильников, вовлеченных в современное землепользование (на примере курганов ранних алан на Северном Кавказе). Почвоведение, 2007, 10, 1179–1189.
Хохлова О.С., Дюжова К.В., Гольева А.А., Трифонова Т.А., Бунин Д.С., Ильяшенко С.М., Хохлов А.А. Климат и растительность античного Танаиса (III в. до н.э.–V в. н.э.) по данным палеопочвенного и палеоботанического анализа. Известия Российской академии наук. Серия географическая, 2018, 5, 55–69. https://doi.org/10.1134/S2587556618050072
Ильюков Л.С. (1983) Отчет об исследовании курганного могильника у х. Нового Мартыновского района Ростовской области в 1982 году. Архив Археологической лаборатории РГУ, Ф-10, д-1.
Иванов А.А., Копылов В.П. Xазарские серебряные поясные наборы из курганов междуречья Дона и Сала. Донская археология, 2000, 1, 81–90.
Парусимов И.Н. Раскопки курганов в Зимовниковском районе. Могильник Кутейникова И.И. Тр. Новочеркасской археол. экспедиции, 1998, 3, 15–16.
Глебов В.П., Иванов А.А. (2007) Кочевническое погребение хазарского времени из курганного могильника Таловый II. В: Средневековые древности Дона: Материалы и исследования по археологии Дона. вып. 2. Москва/Иерусалим: Мосты культуры/Гешарим, сс. 154–176.
Максименко В.Е., Яценко В.С. Погребение новотитаровского облика близ села Кулешовка Азовского района Ростовской области. Известия высших учебных заведений. Северо-Кавказский регион. Общественные науки, 2012, 3(169), 33–35.
Орлов Д.С., Гришина Л.А., Ерошичева Н.Л. Практикум по биохимии гумуса. 1969, Москва: Изд-во Моск. ун-та.
Tsai Y.L., Olson B.H. Detection of low numbers of bacterial cells in soils and sediments by polymerase chain reaction. Appl. Environ Microbiol., 1992, 58(2), 754–757. https://doi.org/10.1128/aem.58.2.754-757.1992
Seo S.B., Lee H.Y., Zhang A.H., Kim H.Y., Shin D.H., Lee S.D. Effects of humic acid on DNA quantification with Quantifiler® Human DNA Quantification kit and short tandem repeat amplification efficiency. Int. J. Legal Med., 2012, 126(6), 961–968. https://doi.org/10.1007/s00414-011-0616-z
Opel K.L., Chung D., McCord B.R. A study of PCR inhibition mechanisms using real time PCR. J. Forensic Sci., 2010, 55(1), 25–33. https://doi.org/10.1111/j.1556-4029.2009.01245.x
Sutlović D., Gojanović M., Andelinović S., Gugić D., Primorac D. Taq polymerase reverses inhibition of quantitative real time polymerase chain reaction by humic acid. Croat. Med. J., 2005, 46(4), 556–62.
Безуглова О.С., Хырхырова М.М. Почвы Ростовской области: учебное пособие. 2012, Ростов-на-Дону: Изд-во ЮФУ.
Фалеева Т.Г., Иванов И.Н., Мишин Е.С., Внукова Н.В., Корниенко И.В. Проблемы молекулярно-генетической идентификации потожировых следов отпечатков пальцев человека. Судебно-медицинская экспертиза, 2016, 59(2), 14–18. https://doi.org/10.17116/sudmed201659214-18
Cawthon R.M. Telomere measurement by quantitative PCR. Nucleic Acids Res., 2002, 30(10), e47. https://doi.org/10.1093/NAR/30.10.E47
Bezuglova O. Molecular structure of humus acids in soils. J. Plant Nutr. Soil Sci., 2019, 182(2), 676–682 https://doi.org/10.1002/jpln.201900043
Безуглова О.С. Элементный состав гумусовых кислот черноземов и каштановых почв Ростовской области. Научные доклады высшей школы. Биологические науки., 1980, 5, 91–95.
Tipping E. Cation Binding by Humic Substances. 2005, Cambridge, Cambridge University Press.
Sidstedt M., Jansson L., Nilsson E., Noppa L., Forsman M., Rådström P., Hedman J. Humic substances cause fluorescence inhibition in real-time polymerase chain reaction. Anal. Biochem., 2015, 487, 30–37. https://doi.org/10.1016/j.ab.2015.07.002
Дополнительные материалы отсутствуют.
Инструменты
Биотехнология


