Биология внутренних вод, 2019, № 2-1, стр. 42-49
Распространение и динамика численности экстремально галотолерантного вида Eucypris mareotica (Fischer, 1855) (Crustacea, Ostracoda) в гиперсоленых озерах Крыма
Е. В. Ануфриева 1, *, Е. А. Колесникова 1, Н. В. Шадрин 1
1 Институт морских биологических исследований им. А.О. Ковалевского Российской академии наук
299011 Севастополь, пр. Нахимова, д. 2, Россия
* E-mail: lena_anufriieva@mail.ru
Поступила в редакцию 26.05.2017
После доработки 07.08.2017
Принята к публикации 04.09.2017
Аннотация
На основании многолетних наблюдений (2005–2016 гг.) проанализированы распространение, динамика численности и влияние разных факторов среды на Ostracoda в гиперсоленых озерах Крыма. Показано, что в водоемах встречается только один представитель класса – Eucypris mareotica (Fischer, 1855). Вид отмечен в озерах Крыма при максимальной солености 300 г/л. Частота встречаемости вида имеет обратную связь с соленостью. Рачки достигают высокой численности в планктоне (650 тыс. экз./м3), бентосе (565 тыс. экз./м2) и плавучих матах нитчатых зеленых водорослей Cladophora spp. (9.9 млн экз./на 1 кг сырой массы мата). Используя кальций и магний для построения своих раковин, остракоды снижают концентрацию этих элементов в воде. Отмечена возможность использования раковин остракод для палеоклиматических и палеолимнологических реконструкций.
ВВЕДЕНИЕ
Остракоды – класс ракообразных, который включает более 8550 ныне живущих видов. Они играют важную экологическую роль в водных экосистемах, являясь чрезвычайно древней группой животных, существующей ≥425 млн лет [19, 20]. Представители этого класса смогли приспособиться к существованию не только в водной среде, но и в сырых почвах (Mesocypris spp.) в Южной Африке, Австралии и Новой Зеландии [37]. Уже в ордовике остракоды начали заселять гиперсоленые водоемы [18, 38]. Ряд видов успешно адаптировался к существованию в таких озерах, которые относятся к наиболее полиэкстремальным биотопам планеты [10, 16, 21, 22, 26, 27, 31]. Не менее восьми видов, обитающих на разных континентах, способны существовать при солености ≥150 г/л. Eucypris mareotica (Fischer, 1855) (его младший синоним Eucypris inflata (Sars, 1903)) – наиболее галотолерантный вид среди остракод, встречается в природе при солености 3–325 г/л [10, 13, 16, 21, 25, 39] и широко распространен в Евразии и Северной Африке [16, 21, 39, 40]. Будучи теплолюбивым видом, он заходит далеко на север, например, в массовом количестве отмечен на островах Белого моря (67°09′ с.ш.) [33]. Широкому распространению рачка способствуют наличие покоящихся яиц [36] и возможность существовать в виде двуполых и партеногенетических популяций [16]. Недавно выполнено переописание вида с использованием особей крымских популяций, на основе которого сделан вывод, что E. mareotica не относится к роду Eucypris, однако его название пока предложено не изменять [30]. Изучение распространения и экологии данного вида важно не только для лучшего понимания функционирования современных водных экосистем, но и для палеоклиматических и палеолимнологических реконструкций [24, 28].
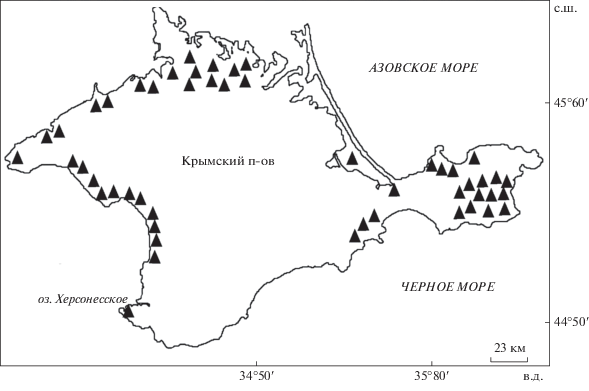
На Крымском п-ве, крупнейшем на Черном море, расположено ~50 крупных и множество мелких гиперсоленых водоемов, включая залив Азовского моря Сиваш (рис. 1). Все водоемы полимиктические, мелководные и характеризуются широкими диапазонами колебания солености, температуры и рН, многие из них частично или полностью пересыхают [11, 15]. По происхождению они делятся на морские и континентальные. Кроме естественных водоемов на Керченском п-ве существует ряд искусственных водоемов (пруды, водохранилища), которые вследствие аридности климата становятся гиперсолеными [15].
Комплексные исследования биоразнообразия гиперсоленых озер Крыма проводили в 2000–2016 гг. [3, 12, 17]. В ряде работ отмечено массовое развитие вида E. mareotica, но в целом изучению остракод не уделялось должного внимания [2, 5, 6, 34]. Исследования кернов, взятых при бурении скважин, показали, что вид существовал в регионе уже в верхнем миоцене [7]. Поэтому изучение современного распространения и динамики численности E. mareotica в водоемах Крыма могут быть использованы при палеореконструкциях среды за последние 10–20 млн лет.
Цель работы – анализ многолетних данных по изучению распространения и динамики численности остракоды E. mareotica в модельном оз. Херсонесское и в других гиперсоленых озерах Крыма и определение влияния различных факторов среды на данный вид.
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
В настоящей работе основное внимание уделено изучению остракод оз. Херсонесское (44°35′10″ c.ш., 33°23′32″ в.д.), которое было выбрано в качестве модельного. Озеро находится на мысе Херсонес, крайней западной точке г. Севастополь. Озеро представляет замкнутую морскую лагуну, отделенную от моря валунно-галечной пересыпью, через которую осуществляется фильтрационное питание морской водой. Это небольшой (площадь зеркала 0.05 км2) мелководный (средняя глубина 0.38 м) водоем удлиненно-овальной формы с малой (0.92 км2) площадью водосбора [4, 9]. Интенсивный прогрев воды начинается в апреле и в августе достигает максимума (29.5–36.0°С), зимой температура воды в озере может опускаться ниже 0°С. Наименьшие значения температуры воды (<7°С) отмечены в конце декабря–начале марта 2005–2006 гг. В отдельные периоды наблюдалась значительная пространственная неоднородность поля солености. В 2005–2016 гг. максимальная минерализация воды в основной части озера достигала 120 г/л, в южной – 340 г/л (август 2009 г.), минимальная у моря – 35 г/л (февраль 2006 г.). Соотношение основных ионов в воде, как и в других гиперсоленых озерах морского происхождения, фактически не отличалось от такового в Черном море [4]. Уровень рН обычно слабощелочной (8.1–9.7), максимальные значения достигают рН 10, что обусловлено высокой интенсивностью фотосинтеза.
За период наблюдений в фитопланктоне озера зарегистрирован 61 вид [2]. Макрофиты представлены шестью видами, пять из которых относятся к зеленым нитчатым водорослям отд. Chlorophyta, и один – к морским травам отд. Angiospermae [9]. Нитчатые зеленые водоросли часто формируют мощные донные и плавучие маты, в которых в отдельные периоды важную роль играют пурпурные бактерии – аноксигенные фототрофы. Массово развиваются планктонные инфузории, среди них 24 вида аэробных инфузорий и ряд неидентифицированных анаэробных видов [8]. Наибольшее их видовое разнообразие и численность (до 15 ⋅ 107 экз./м3) отмечены в плавучих матах нитчатых зеленых водорослей Cladophora spp. в летне-осенний период. Экосистема озера может находиться в нескольких устойчивых состояниях, которые различаются видовой структурой биоты и характером функционирования [2].
Исследования биоты гиперсоленых водоемов Крыма проводили в 2007–2016 гг. Всего проанализировано 445 проб в 38 водоемах, включая оз. Херсонесское (416 проб планктона, 12 проб бентоса и 17 проб плавучих матов нитчатых зеленых водорослей). Водоемы существенно различались по солености, размеру и другим характеристикам [3, 15, 17]. Кроме того, в период с 16.02.2005 г. по 19.04.2006 г. в оз. Херсонесское собраны 74 количественные пробы планктона, 32 пробы бентоса и 15 проб плавучих матов нитчатых зеленых водорослей (всего 121 проба). Сборы проводили 2–3 раза в месяц на трех постоянных станциях. Результаты анализа бентосных проб опубликованы ранее [22] и здесь детально не рассматриваются.
Количественные пробы зоопланктона отбирали путем фильтрации 50–100 л воды через планктонную сеть с размером ячеи 110 мкм, дополнительно собирали качественные пробы. Пробы бентоса отбирали на участках с глубиной 0.2–0.6 м бентосными трубками площадью 0.018 м2, высотой 10 см. Плавучие маты нитчатых водорослей собирали с площади 0.25 м2, массу обсушенных водорослей определяли на электронных весах. Относительную численность животных в матах определяли делением числа подсчитанных особей на массу фрагмента мата. Пробы фиксировали 4%-ным формалином и обрабатывали с использованием стереомикроскопов Olympus SZ-ST и ЛОМО МБС-9. Соленость, температуру и рН воды определяли с помощью рефрактометра (Kelilong WZ212) и рН-метра (PHH-830). Концентрацию ионов кальция и магния в 2005–2006 гг. в оз. Херсонесское определяли стандартными гидрохимическими методами [4].
Встречаемость вида (Y) рассчитывали по формуле:
где Kc – количество проб в определенном интервале солености или месяце, в котором присутствовал вид, K – общее количество проб в этом интервале или месяце.Для регрессионного анализа зависимости численности вида от факторов среды использованы только количественные пробы. Уравнения регрессий рассчитывали по методу наименьших квадратов. Значимость различий средних значений оценивали с помощью t-критерия Стьюдента, уровень достоверности коэффициентов корреляции определяли по таблице [29].
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Озеро Херсонесское. В период исследований особи E. mareotica массово присутствовали в бентосе, планктоне и плавучих матах нитчатой зеленой водоросли Cladophora, другие виды остракод в водоеме не обнаружены. Рачки встречались хотя бы в одном из биотопов почти во все сроки наблюдений. Встречаемость вида не коррелировала с соленостью. Численность особей колебалась в широких пределах (0–>150 млн экз./м2) (рис. 2а и рис. 3). В 2005–2006 гг. максимальная концентрация рачков в планктоне озера превышала 650 тыс. экз./м3, в бентосе – 565 тыс. экз./м2. Наиболее высокой она была в водорослевых матах (>9.9 млн экз./ на 1 кг сырой массы, что эквивалентно 90–150 млн экз./м2).
Рис. 2.
Сезонные изменения численности E. mareotica в планктоне (а), плавучих кладофоровых матах (б) и бентосе (в) в оз. Херсонесскоe (2005–2006 гг.). Шкала ординат логарифмирована.
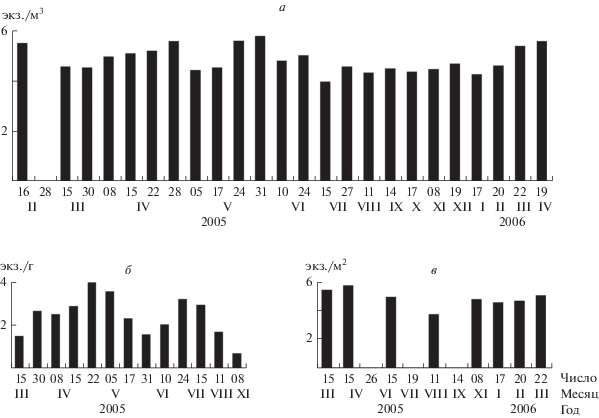
Численность рачков в планктоне, бентосе и плавучих кладофоровых матах существенно изменялась в течение сезона (рис. 2). В разных биотопах динамика обилия вида различалась, достоверной корреляции не выявлено. При интенсивном развитии плавучих матов остракоды в бентосе чаще всего отсутствовали.
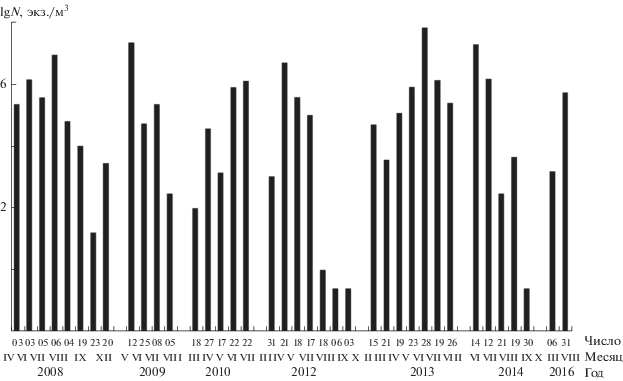
В 2008–2016 гг. в планктоне обнаружены некоторые межгодовые различия в сезонном ходе развития E. mareotica, касающиеся длительности периода планктонной фазы и сроков достижения максимальной численности (рис. 3). Пики численности отмечали в апреле‒июне и августе, в среднем для ряда лет в апреле она достигала 9 тыс. экз./м2, мае – 15, июне – 39 и августе – 6 тыс. экз./м2 при стандартном отклонении (SD) в пределах 9–55 тыс. экз./м2. Год от года популяция достигала максимальной численности в разные месяцы. В остальное время года остракоды отсутствовали или были малочисленны (<400 экз./м2).
Рис. 3.
Сезонные и межгодовые изменения численности E. mareotica в планктоне оз. Херсонесскоe (2008–2016 гг.). Шкала ординат логарифмирована.
В 2005–2006 гг. отмечена достоверная обратная зависимость между численностью E. mareotica в планктоне и соленостью в диапазоне 40–110 г/л (r = –0.56, p = 0.005), которую можно аппроксимировать уравнением:
где lg N – десятичный логарифм численности, экз./м3, S – соленость, г/л.При анализе данных 2007–2016 гг. подобной зависимости не выявлено, однако установлена прямая корреляция между численностью вида и температурой воды в диапазоне 7–28°С (r = 0.49, p = 0.005), формула (3). В 2005–2006 гг. достоверная зависимость численности от температуры отсутствовала.
где T – температура воды, °С.Показатель рН изменялся в пределах 8.1–9.7, его влияние на численность остракод не обнаружено. В 2005–2006 гг. численность E. mareotica в планктоне достоверно отрицательно коррелировала с содержанием в воде кальция (r = –0.72, р = 0.03) и магния (r = –0.77, р = 0.01). Выявлены значительные вариации концентраций кальция (0.08–1.53 г/л) и магния (1.7–4.7 г/л). Максимумы обилия остракод в планктоне и плавучих матах нитчатых водорослей приходились на минимальное содержание двухвалентных катионов в воде озера. Время от времени после пика развития E. mareotica в озере наблюдалась массовая гибель рачков, вследствие этого на берегу выше уреза воды из пустых раковин остракод образовывались наносы в виде валов до 10–20 м длиной, 7–10 см шириной и 5–7 см высотой.
В планктоне пространственное распределение обилия рачков в большинстве сроков наблюдения было неоднородным (зимой – близкое к однородному или случайному и летом – агрегированное). Коэффициент вариации обилия вида по акватории достигал 1.5–1.7. Агрегированность остракод летом вызвана распределением плавучих матов кладофоры.
Другие гиперсоленые водоемы Крыма. Анализ сборов показал, что E. mareotica – единственный вид остракод в Крыму, который встречается в гиперсоленых озерах морского и континентального происхождения. Рачки в массе присутствовали в бентосе, планктоне и плавучих матах кладофоры. E. mareotica ни разу не был найден в бывших пресноводных, но быстро засоляющихся (до 40‒50 г/л) антропогенных водоемах Керченского п-ва. Максимальная соленость, при которой вид обнаружен в планктоне, достигала 300 г/л. Однако его встречаемость была очень низкой в континентальных сульфатных озерах и водоемах с постоянно высокой соленостью (>150 г/л). В ряде эпизодически пересыхающих озер остракоды присутствовали не каждый год.
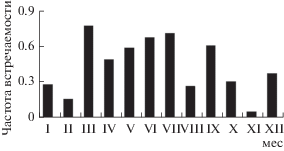
Для всей совокупности исследованных в 2007–2016 гг. водоемов встречаемость E. mareotica (Y) неизменно зависела от солености (S) (r = = ‒0.72 p = 0.005) (рис. 4):
Рис. 4.
Зависимость частоты встречаемости E. mareotica от солености в гиперсоленых водоемах Крыма (2007–2016 гг.).
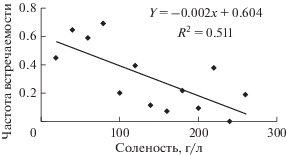
Исходя из значения коэффициента детерминации (R2 = 0.52), можно считать, что на 50% вероятность присутствия E. mareotica в водоемах определялась соленостью.
Встречаемость вида изменялась в течение года (рис. 5), чаще всего вид обнаруживали в марте, июне и июле, реже – в августе и октябре–феврале. Встречаемость была рассчитана по совокупности проб, взятых в течение месяца в разные годы.
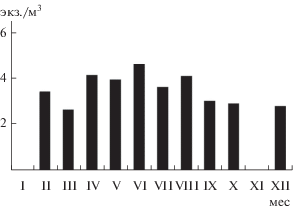
Для анализа сезонной изменчивости в отдельных озерах данных было недостаточно, поэтому рассчитывали среднюю численность в планктоне для каждого месяца, используя весь массив данных. Максимальная численность E. mareotica в планктоне наблюдалась в апреле–августе (рис. 6), в среднем для всех лет она достигала 32 тыс. экз./м3 (SD = 60 тыс.) в июне и 10–11 тыс. экз./м3 (SD = = 20 тыс.) в апреле или августе. В целом, сезонный ход численности вида в планктоне большинства озер был близок к отмеченному в оз. Херсонесскоe в 2005–2006 гг.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Eucypris mareotica – обычный массовый вид гиперсоленых водоемов Крыма. Результаты исследования подтверждают его ранее отмеченную высокую галотолерантность и способность существовать в водоемах разного типа при солености ≤300 г/л. Часто находки этого вида в Азово-Черноморском регионе в миоцене при палеореконструкциях интерпретируют как показатель наличия пресных вод [7], что противоречит современным данным, по которым он фактически не встречается при солености <10 г/л.
Осмоадаптационные механизмы вида изучены в диапазоне от 1 до 100–110 г/л, в этих пределах рачки активно регулируют концентрацию солей в жидкостях тела и демонстрируют в олигогалинных условиях гиперосмотический тип регуляции, а в гипергалинных условиях – гипоосмотический [1, 13]. Н.В. Аладин с соавт. [13, 22] предполагает, что этот вид по своим осморегуляторным способностям приближается к жаброногому рачку Artemia salina. Авторы этих статей считают, что при солености >150 г/л активная осморегуляция требует больших затрат энергии и вряд ли энергетически выгодна маленьким рачкам. К тому же, вид при солености >250 г/л присутствует лишь при вспышках развития зеленой водоросли Dunaliella, которая интенсивно продуцирует осмолит глицерол [14]. Поэтому можно предположить, что E. mareotica при высокой солености поглощает с пищей осмолиты, синтезированные водорослями (т.е. является в этом диапазоне солености скорее осмоконформером), что показано для копепод [14, 35]. Для проверки этой гипотезы необходимы дальнейшие исследования.
Вышеизложенные данные позволяют сделать вывод, что распространение вида и динамика его численности зависят от многих факторов, причем абиотические (температура, соленость и рН) ‒ неосновные. Большую роль играют биотические факторы, например, уровень развития плавучих матов кладофоры, в которых наблюдалась максимальная численность остракод, или наличие микроводорослей – продуцентов осмолитов. Для распространения Eucypris mareotica не менее важно происхождение водоема (морское или континентальное).
В одни и те же сроки в экосистемах гиперсоленых озер Крыма маты нитчатых зеленых водорослей развиваются интенсивно, в других они фактически отсутствуют [11], например в озерах Бакальское и Тобечикское [3, 34]. В соответствии с этим существенно различается и численность остракод. Образование матов нередко сопровождается формированием под ними на дне аноксии с присутствием сероводорода [9], при этом остракоды покидают придонный слой и переходят в плавучие маты и планктон.
Интерпретация зависимости между численностью остракод в планктоне и содержанием кальция и магния в воде затруднена определением, что есть функция, а что – аргумент. Представляется, что остракоды используют кальций и магний для формирования своих раковин в период массового развития и влияют на концентрацию этих элементов в воде. Это предположение подтверждается фактом формирования наносов из выброшенных на берег раковин остракод. Ранее подобное наблюдали в крымском гиперсоленом оз. Круглое, ныне засыпанном при строительстве дороги: “В марте 1926 г. трупы Eucypris были прибиты волнением к южному берегу и образовали как бы песчаный, или вернее, мелко-бисерный нанос в 20 м длины, от 1 до 5 м ширины и высотою до 9 см. Впоследствии границы озера передвинулись (в связи с усыханием), обнаружив подводный нанос, не менее мощный… ” [5]. В литературе отсутствует информация о накоплении кальция в раковинах E. mareotica, поэтому для примерной оценки содержания этого элемента использовали данные о нем у близкого по размеру вида остракод Нerpetocypris brevicaudata Kaufmann, 1990 [32] и о численности Eucypris mareotica в период минимума концентрации кальция в воде оз. Херсонесскоe. Суммарно в раковинах живых рачков могло содержаться до 1.1–1.2 г/л карбоната кальция. Дополнительно к этому какое-то количество карбоната кальция содержалось в мертвых остракодах и сброшенных ювенильных раковинах. В своем развитии остракоды проходят 8–9 линек, раковина начинает образовываться после пятой линьки, при последующих линьках ювенильные раковины сбрасываются.
Накопление кальция и магния в раковинах рачков ведет к уменьшению их концентрации в воде. Вероятно, этим вызвано уменьшение на 60–70% концентрации двухвалентных катионов в воде при массовом развитии остракод. Процессы биологической кальцификации ускоряются с ростом температуры, поскольку растворение раковин умерших остракод происходит быстрее при низких температурах, так как увеличивается растворимость карбоната кальция. Максимальные концентрации кальция и магния наблюдали зимой перед началом интенсивного роста численности остракод, когда, вероятно, большая часть карбоната кальция створок отмерших остракод растворялась и переходила в воду. Таким образом, два процесса – изъятие ионов из воды для формирования раковин растущих рачков и растворение мертвых раковин – в основном, и определяют колебания содержания ионов кальция и магния в воде озера. Существует и обратная связь – уменьшение концентрации двухвалентных катионов и изменение их соотношения в воде тормозят процессы кальцификации и роста рачков [32], что отражается на их численности. По-видимому, эти взаимодействия играют важную роль в функционировании уникальных экосистем гиперсоленых водоемов и требуют более глубокого изучения.
Выводы. E. mareotica – высоко галотолерантный вид, встречается во всех биотопах гиперсоленых водоемов Крыма. Наиболее высокая его численность отмечена в плавучих матах нитчатых зеленых водорослей (>9.9 млн экз./на 1 кг сырой массы мата). Распространение и динамика численности вида зависят не только от абиотических факторов (температуры и солености), но и от биотических (уровень развития плавучих кладофоровых матов). Используя кальций и магний для формирования своих раковин, остракоды влияют на концентрацию этих элементов в воде. Этот процесс важен для функционирования уникальных экосистем гиперсоленых водоемов и требует более глубокого изучения, как и биология и функциональная роль вида E. mareotica в уникальных экосистемах.
Список литературы
Аладин Н.В. Соленостные адаптации Ostracoda и Branchiopoda. СПб.: Зоол. ин-т РАН, 1996. 207 с.
Ануфриева Е.В., Шадрин Н.В. Разнообразие ракообразных в гиперсоленом озере Херсонесское (Крым) // Экосистемы, их оптимизация и охрана. 2012. Вып. 7. С. 55–61.
Балушкина Е.В., Голубков С.М., Голубков М.С. и др. Влияние абиотических и биотических факторов на структурно-функциональную организацию экосистем соленых озер Крыма // Журн. общ. биол. 2009. Т. 70. № 6. С. 504–514.
Губанов В.И., Бобко Н.И. Гидролого-гидрохимическая характеристика соляного озера на мысе Херсонес (Севастополь, Крым) // Мор. экол. журн. 2012. Т. 11. № 4. С. 18–26.
Дагаева В.Н. Наблюдения над жизнью соленого озера у бухты Круглой у Севастополя // Изв. АН СССР. Сер. VI. 1927. Т. 21. Вып. 7. С. 1319–1346.
Загородняя Ю.А., Батогова Е.А., Шадрин Н.В. Многолетние трансформации планктона в гипергалинном Бакальском озере (Украина, Крым) при колебаниях солености // Мор. экол. журн. 2008. Т. 7. № 4. С. 41–50.
Коваленко В. Характерні комплекси остракодів пізнього міоцену південної України // Палеонтологічний збірник. 2013. № 45. С. 54–65.
Павловская Т.М., Празукин А.В., Шадрин Н.В. Сезонные явления в сообществе инфузорий гиперсоленого озера Херсонесское (Крым) // Мор. экол. журн. 2009. Т. 8. № 2. С. 53–63.
Празукин А.В., Бобкова А.Н., Евстигнеева И.К. и др. Структура и сезонная динамика фитокомпоненты биокосной системы морского гиперсоленого озера на мысе Херсонес (Крым) // Мор. экол. журн. 2008. Т. 7. № 1. С. 61–79.
Шадрин Н.В. Ракообразные в гиперсоленых водоемах: специфика существования и адаптации // Актуальные проблемы изучения ракообразных континентальных вод: Матер. лекций и докл. Междунар. шк.-конф. Кострома: Костромск. печатный двор, 2012. С. 316–318.
Шадрин Н.В. Альтернативные устойчивые состояния озерных экосистем и критические солености: есть ли жесткая связь? // Тр. Зоол. ин-та РАН. Прилож. № 3. 2013. С. 214–221.
Шадрин Н.В., Загородняя Ю.А., Батогова Е.А. Биоразнообразие гиперсоленых озер Крыма: проблемы изучения, сохранения и перспективы использования // Биоразнообразие и устойчивое развитие: Матер. Междунар. науч.-практ. конф. Симферополь: КНЦ НАН Украины и МОН Украины, 2010. С. 178–180.
Aladin N.V. Salinity tolerance, morphology and physiology of the osmoregulation organs in Ostracoda with special reference to Ostracoda from the Aral Sea // Ostracoda in the earth and life sciences. Rotterdam: A.A. Balkema, 1993. P. 387–403.
Anufriieva E.V. Do copepods inhabit hypersaline waters worldwide? A short review and discussion // Chin. J. Ocean. Limnol. 2015. V. 33. № 6. P. 1354–1361.
Anufriieva E., Hołyńska M., Shadrin N. Current invasions of Asian Cyclopid species (Copepoda: Cyclopidae) in Crimea, with taxonomical and zoogeographical remarks on the hypersaline and freshwater fauna // Ann. Zool. 2014. V. 64. P. 109–130.
Baltanás A., Montes C., Martino P. Distribution patterns of ostracods in Iberian saline lakes. Influence of ecological factors // Hydrobiologia. 1990. V. 197. P. 207–220.
Belmonte G., Moscatello S., Batogova E.A. et al. Fauna of hypersaline lakes of the Crimea (Ukraine) // Thalassia Salentina. 2012. V. 34. P. 11–24.
Berdan J. Leperditicopid ostracodes from Ordovician rocks of Kentucky and nearby states and characteristic features of the Order Leperditicopida // US Geol. Surv. Prof. Pap. 1984. V. 1066-J. P. J1–J40.
Brandão S.N., Angel M.V., Karanovic I. et al. World Ostracoda Database. 2016. Accessed at http://www.marinespecies.org/ostracoda on 2016-10-02.
Brusca R.C., Brusca G.J. Invertebrates, 2nd Edition. Sunderland, Massachusetts: Sinauer Associates, 2003. 936 p.
De Deckker P. Ostracods of athalassic saline lakes // Hydrobiologia. 1981. V. 81. № 1. P. 131–144.
Keyser D., Aladin N., Plotnikov I. Ostracods and their adjustment to saline environments // Mitt. Hamburg. Zool. Mus. Inst. 2004. V. 101. P. 157–167.
Kolesnikova E.A., Mazlumyan S.A., Shadrin N.V. Seasonal dynamics of meiobenthos fauna from a salt lake of the Crimea (Ukraine) // Environmental Micropaleontology, Microbiology and Meiobenthology EMMM’2008: First Intern. Conf. Chennai, Univ. of Madras, India, 2008. P. 155–158.
Li X., Liu W. Oxygen isotope fractionation in the ostracod Eucypris mareotica: results from a culture experiment and implications for paleoclimate reconstruction // J. Paleolimnol. 2010. V. 43. № 1. P. 111–120.
Li Y.F., Li B.Y., Wang G. et al. Ostracoda and it’s environmental significance at the ancient Tianshui hai lake of the west Kunlun // J. Lake Sci. 1997. V. 9. № 3. P. 223–230.
Martens K., Davies B.R., Baxter A.J., Meadows M.E. A contribution to the taxonomy and ecology of the Ostracoda (Crustacea) from Verlorenvlei (Western Cape, South Africa) // S. Afr. J. Zool. 1996. V. 31. № 1. P. 23–36.
Meriç E., Avsar N., Nazik A. et al. The response of benthic foraminifer, ostracod and mollusc assemblages to environmental conditions: a case study from the Camalti Saltpan (Izmir-Western Turkey) // Medit. Mar. Sci. 2010. V. 11. № 1. P. 5–32.
Mischke S., Zhang C., Börner A. Bias of ostracod stable isotope data caused by drying of sieve residues from water // J. Paleolimnol. 2008. V. 40. № 1. P. 567–575.
Müller P.H., Neuman P., Storm R. Tafeln der mathematischen statistik (Hardcover-Ausgabe). Leipzig: VEB Fachbuchverlag, 1979. 272 p.
Rasouli H., Scharf B., Meisch C., Aygen C. An updated checklist of the Recent non-marine Ostracoda (Crustacea) of Iran, with a redescription of Eucypris mareotica (Fischer, 1855) // Zootaxa. 2016. V. 4154. № 3. P. 273–292.
Razzaq S.A.A. The Ostracoda community in hypersaline channels in Al-Khiran, Arabian Gulf // J. Micropalaeontol. 1991. V. 10. № 1. P. 17–21.
Roca J.R., Wansard G. Temperature influence on development and calcification of Herpetocypris brevicaudata Kaufmann, 1900 (Crustacea: Ostracoda) under experimental conditions // Hydrobiologia. 1997. V. 347. № 1–3. P. 91–95.
Semenova L.M. The species composition and distribution of ostracods (Crustacea, Ostracoda) in rockpools of the Kandalaksha Bay in the White Sea // Inland Water Biol. 2014. V. 7. № 1. P. 10–14. https://doi.org/10.1134/S199508291401012X
Shadrin N.V., Anufriieva E.V. Climate change impact on the marine lakes and their Crustaceans: The case of marine hypersaline Lake Bakalskoye (Ukraine) // Turk. J. Fish. Aquat. Sci. 2013. V. 13. Iss. 4. P. 603–611.
Shadrin N.V., Anufriieva E.V. Dependence of Arctodiaptomus salinus (Calanoida, Copepoda) halotolerance on exoosmolytes: new data and a hypothesis // J. Mediterranean Ecol. 2013. V. 12. P. 21–26.
Shadrin N.V., Anufriieva E.V., Amat F., Eremin O.Yu. Dormant stages of crustaceans as a mechanism of their existence in an extreme unpredictable environment of the Crimean hypersaline lakes // Chin. J. Ocean. Limnol. 2015. V. 33. № 6. P. 1362–1367.
Stout J.D. The terrestrial plankton // Tuatara. 1963. V. 11. № 2. P. 57–65.
Williams M., Siveter D.J. Lithofacies-influenced ostracod associations in the middle Ordovician Bromide Formation, Oklahoma, USA // J. Micropalaeontol. 1996. V. 15. P. 69–81.
Williams W.D. Chinese and Mongolian saline lakes: a limnological overview // Hydrobiologia. 1991. V. 210. P. 39–66.
Zhang L., Sun Z.C., An Z.S. et al. A preliminary distribution characteristic analysis on different water bodies ostracoda from lake Qinghai area, NW China // Acta Micropalaeontologica Sinica. 2006. V. 23. P. 425–436.
Дополнительные материалы отсутствуют.
Инструменты
Биология внутренних вод