Биология внутренних вод, 2019, № 2-1, стр. 79-86
Физиологические показатели леща (Abramis brama L.) на разнотипных участках Рыбинского водохранилища
А. А. Паюта 1, *, Е. Г. Пряничникова 2, Г. Х. Щербина 2, С. Н. Перова 2, Е. А. Флёрова 1, 3
1 Ярославский научно-исследовательский институт животноводства и кормопроизводства Федерального научного центра кормопроизводства и агроэкологии им. В.Р. Вильямса
150517 Ярославская обл., Ярославский р-н, пос. Михайловский, ул. Ленина, д. 1, Россия
2 Институт биологии внутренних вод им. И.Д. Папанина Российская академия наук
152742 Ярославская обл., Некоузский р-н, пос. Борок, Россия
3 Ярославский государственный университет им. П.Г. Демидова
150003 Ярославль, ул. Советская, д. 14, Россия
* E-mail: a.payuta@mail.ru
Поступила в редакцию 09.08.2017
После доработки 10.10.2017
Принята к публикации 07.11.2017
Аннотация
Рассмотрены особенности накопления жира, белка, минеральных и безазотистых экстрактивных веществ в скелетных мышцах леща (Abramis brama L.), отобранного на различающихся по степени антропогенной нагрузки участках Рыбинского водохранилища. Приведены данные по его кормовой базе и питанию в водохранилище. Показано, что на высококормных участках Шекснинского плеса, находящихся в зоне продолжительного локального антропогенного загрязнения, уменьшается интенсивность питания леща. Это приводит к снижению упитанности рыб, количества жира и минеральных веществ в их мышечной ткани по сравнению с особями из условно чистых высококормных станций Моложского и Волжского плесов.
ВВЕДЕНИЕ
Рыбинское водохранилище – один из крупнейших искусственных водоемов России, расположенный в Ярославской, Тверской и Вологодской областях. В северо-восточной части водохранилища находится промышленный Череповецкий комплекс – крупнейший индустриальный центр, в который входят предприятия химической промышленности и черной металлургии. В район Шекснинского плеса поступает наибольшее количество сточных вод с предприятий, поэтому данный участок считается самым загрязненным [11, 28, 35], в том числе его донные отложения, в которых аккумулируются тяжелые металлы, полихлорированные бифенилы и полиароматические углеводороды [6, 15, 28, 35].
Химические загрязнители даже в малых концентрациях могут оказывать влияние на организм гидробионтов. Рядом авторов показано, что ионы тяжелых металлов изменяют пищевое поведение, нарушают обмен веществ, снижают темпы роста и упитанность рыб [29, 34, 37, 38]. Органические загрязняющие вещества приводят к нарушению функций сенсорных систем, в результате чего снижается пищевая мотивация и проявляется анорексия – отказ от потребления пищи [13].
Известно, что тяжелые металлы и стойкие органические загрязнители, будучи устойчивыми соединениями, поступают в организм рыб преимущественно по пищевым цепям, поэтому наиболее подвержены влиянию этих веществ бентофаги [6, 15, 37, 40]. Лещ Abramis brama L. – самый массовый и распространенный вид в Рыбинском водохранилище, питается бентосными организмами, обитающими в поверхностном слое донных отложений.
Цель работы – изучить особенности физиологических показателей леща из разных по степени антропогенного воздействия участков Рыбинского водохранилища.
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
Материалом для исследования были лещи, выловленные в конце нагульного периода (конец сентября–начало октября 2013 г.) с помощью трала НИС “Академик Топчиев”. Рыбу отбирали на станциях Рыбинского водохранилища, различающихся по степени антропогенного воздействия (рис. 1).
Рис. 1.
Карта-схема Рыбинского водохранилища: cт. 1 – Волжский плес, ст. 2, 4, 5 – Главный плес, ст. 3 – Моложский плес, ст. 6–8 – Шекснинский плес.
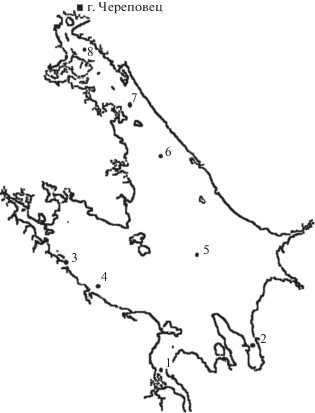
Выбор станций, где собирали материал, обусловлен многолетними исследованиями ряда авторов [4, 5, 7, 15, 18, 28, 35]. Cтанции 1 (58°05.845′ с.ш., 38°18.116′ в.д.), 2 (58°06.221′ с.ш., 38°49.147′ в.д.), 3 (58°24.194′ с.ш., 37°44.070′ в.д.), 4 (58°18.760′ с.ш., 37°53.829′ в.д.) и 5 (58°25.528′ с.ш., 38°29.263′ в.д.) находились в условно чистых районах Волжского, Моложского и Главного плесов, на ст. 5 преобладали продукты трансформации загрязняющих веществ. Станции 6 (58°43.383′ с.ш., 38°16.024′ в.д.), 7 (58°51.622′ с.ш., 38°06.984′ в.д.) и 8 (59°01.017′ с.ш., 37°51.571′ в.д.) были в непосредственной близости от г. Череповец, в зоне продолжительного локального антропогенного загрязнения.
На каждой станции отлавливали по 10 половозрелых и примерно одноразмерных особей леща (табл. 1). Рыбу непосредственно после поимки помещали в контейнеры с речной водой и доставляли в лабораторию судна для биологического анализа. Затем на хладагенте иссекали мышечную ткань и желудочно-кишечный тракт. Коэффициенты упитанности (по Фультону и Кларк) рассчитывали по общепринятой методике [30].
Таблица 1.
Биологические показатели лещей из разных по степени антропогенного воздействия участков Рыбинского водохранилища
| Номер станции |
Длина, см | Масса, г | Коэффициент упитанности | ||
|---|---|---|---|---|---|
| рыбы | порки | по Фультону | по Кларк | ||
| 1 | 35.9 ± 0.7 | 790 ± 48 | 701 ± 40 | 1.69 ± 0.04 | 1.51 ± 0.04 |
| 2 | 36.7 ± 0.5 | 913 ± 32 | 810 ± 29 | 1.85 ± 0.02 | 1.64 ± 0.01 |
| 3 | 35.6 ± 0.7 | 793 ± 55 | 703 ± 48 | 1.73 ± 0.03 | 1.53 ± 0.03 |
| 4 | 36.8 ± 0.7 | 857 ± 47 | 753 ± 40 | 1.71 ± 0.03 | 1.51 ± 0.04 |
| 5 | 36.1 ± 0.6 | 828 ± 48 | 719 ± 40 | 1.74 ± 0.04 | 1.52 ± 0.04 |
| 6 | 35.7 ± 0.6 | 740 ± 61 | 701 ± 42 | 1.62 ± 0.10 | 1.52 ± 0.03 |
| 7 | 32.7 ± 1.2 | 621 ± 63 | 548 ± 60 | 1.74 ± 0.04 | 1.53 ± 0.04 |
| 8 | 29.1 ± 1.2 | 397 ± 63 | 374 ± 57 | 1.57 ± 0.09 | 1.40 ± 0.09 |
В мышечной ткани леща определяли показатели обмена веществ: количество воды, сухого вещества, жира, белка, золы, безазотистых экстрактивных веществ (БЭВ). Количество воды и сухого вещества определяли с помощью двухступенчатого высушивания. Сначала навески высушивали при температуре 60°С до достижения постоянной массы и определяли количество свободной воды. Далее пробу измельчали и высушивали при температуре 105°С до достижения постоянной массы навески. Количество общей воды и сухого вещества определяли расчетным путем. Количество жира определяли в аппарате Сокслета, пробы экстрагировали петролейным эфиром. Для определения белка использовали метод Кьельдаля. Количество минеральных веществ определяли гравиметрическим методом, сжигая навески при температуре 550°С. Количество БЭВ вычисляли по разнице между 100% и суммой процентов общей воды, сырого протеина, сырого жира и золы [30].
Сбор, хранение, полевую и цифровую обработку материала по питанию леща проводили согласно существующей методике [22] с некоторыми дополнениями. Пищевой комок каждой особи высушивали на фильтровальной бумаге, взвешивали на торсионных весах, просматривали под бинокуляром и микроскопом целиком (определяли, измеряли и подсчитывали все организмы). Массу хирономид восстанавливали по ширине головной капсулы у личинок или ширине анального сегмента у куколок, массу остальных донных макробеспозвоночных – по таковой из бентосных проб, собранных одновременно с материалом по питанию рыб [23]. Длину потребленной дрейссены восстанавливали по размеру уголка раковины, который хорошо сохраняется после дробления моллюска глоточными зубами плотвы. Для определения длины раковины составляли таблицу зависимости между длиной раковины и минимальным размером примакушечного уголка раковины, на котором расположен передний аддуктор. Сырую и сухую массы съеденной дрейссены восстанавливали по таблице зависимости массы раковины от ее длины [19]. Частный индекс потребления рассчитывали как отношение восстановленной массы отдельных кормовых объектов к массе рыбы, а общий индекс потребления – суммируя все индексы потребления и деля их на число исследованных рыб. При расчете среднего и частного индекса потребления исключали рыб с пустыми кишечниками [1].
На каждой станции в местах вылова лещей собирали по одной пробе макрозообентоса для изучения кормовой базы. Бентос отбирали дночерпателями ДАК-100 и ДАК-250 по два подъема на каждой станции. Глубина отбора проб варьировала от 10 до 13 м на всех станциях, за исключением ст. 2 (18 м). На большинстве станций донные отложения представлены серым илом, на ст. 2, 3, 8 – заиленным ракушечником. В придонном слое воды температура была 6.4–7.8°С, содержание растворенного кислорода – ~8–9 мг/л. Сбор и камеральную обработку проб макробентоса проводили по стандартной методике [21].
Для измерения связей между показателями использовали корреляционный анализ. Согласно данным ряда авторов об экологическом состоянии Рыбинского водохранилища, для выявления корреляционной связи полученных показателей с уровнем загрязнения станции разделяли на три группы: условно чистые (1–4), среднезагрязненные (5) и загрязненные (6–8) [4, 5, 7, 15, 18, 28, 35].
Данные представлены в виде средних значений и их ошибок (M ± m). Распределение полученных данных соответствовало нормальному закону, поэтому для оценки достоверности различий использовали t-критерий Стьюдента при p ≤ 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Коэффициент упитанности по Фультону у лещей варьировал в пределах 1.57–1.85 (при среднем значении 1.71), по Кларк – в пределах 1.40–1.64 (1.52). Низкие показатели упитанности выявлены на ст. 6 и 8, которые находятся в непосредственной близости от г. Череповец, высокие – на условно чистых ст. 2 и 3, среднезагрязненной ст. 5 и загрязненной ст. 7 (табл. 1). На ст. 1 и 4 упитанность особей имела средние значения.
Скелетные мышцы лещей в среднем по всем станциям содержали 78.8% воды. На долю сухого вещества (совокупность всех конечных продуктов обмена веществ) приходилось 21.2%, из них белков – 17.2%, жира – 1.5%, зольных веществ – 1.6%, БЭВ – 0.9%. При сравнении показателей обмена веществ в мышечной ткани леща, отобранного на станциях с разной антропогенной нагрузкой, выявлены следующие особенности. Наибольшее количество воды обнаружено в мышцах лещей Шекснинского (ст. 8) и Волжского (ст. 1) плесов, наименьшее – Главного (ст. 2) и Моложского (ст. 3) плесов (табл. 2).
Таблица 2.
Химический состав мышечной ткани лещей на исследованных станциях
| Номер станции | Общая вода | Сухое вещество | Жир | Белок | Минеральные вещества |
БЭВ |
|---|---|---|---|---|---|---|
| % мышечной ткани | % сухого вещества | |||||
| 1 | 79.16 ± 0.27b | 20.84 ± 0.27b | 1.57 ± 0.20b | 16.32 ± 0.55a | 0.91 ± 0.03a, d, f, h | 2.04 ± 0.50 |
| 2 | 77.31 ± 0.21b, c, d, e, f, g | 22.69 ± 0.21b, c, d, e, f, g | 2.11 ± 0.24d, e, f | 17.67 ± 0.36a | 1.81 ± 0.29c, d | 1.10 ± 0.34 |
| 3 | 77.89 ± 0.65a | 22.11 ± 0.65a | 1.40 ± 0.15d | 18.03 ± 0.72 | 1.48 ± 0.16g, h | 1.21 ± 0.31 |
| 4 | 78.70 ± 0.21e | 21.30 ± 0.21e | 1.70 ± 0.30a | 17.21 ± 0.17 | 1.33 ± 0.11a, b | 1.07 ± 0.21 |
| 5 | 78.89 ± 0.60c | 21.11 ± 0.60c | 1.85 ± 0.22c | 16.75 ± 0.53 | 0.89 ± 0.07b, c, e, g | 1.61 ± 0.49 |
| 6 | 79.05 ± 0.35d | 20.95 ± 0.35d | 1.36 ± 0.16e | 17.05 ± 0.40 | 1.41 ± 0.12e, f | 1.14 ± 0.19 |
| 7 | 78.87 ± 0.26f | 21.13 ± 0.26f | 1.38 ± 0.11f | 16.99 ± 0.30 | 1.09 ± 0.05e, g, h | 1.67 ± 0.28 |
| 8 | 79.60 ± 0.21a, e, f, g | 20.40 ± 0.21a, e, f, g | 0.92 ± 0.09a, b, c, d, e, f | 17.24 ± 0.19 | 1.05 ± 0.03a, c, d, f | 1.20 ± 0.23 |
Наиболее высокое количество жира в мышечной ткани леща отмечено на ст. 2 и 5, низкое – на ст. 6–8 (табл. 2). Высокое содержание белка – на ст. 2 и 3, низкое – на ст. 1. В скелетных мышцах лещей, выловленных на ст. 2 и 3, количество минеральных веществ достигало максимальных значений по сравнению с лещами других станций, на ст. 1 и 5 оно было наиболее низким. Наибольшее количество БЭВ отмечено в мышечной ткани лещей на ст. 1 и 7, наименьшее – на ст. 2, 4 и 6.
Таким образом, на станциях Шекснинского плеса, донные отложения которого наиболее загрязнены, в мышечной ткани леща обнаружено наименьшее количество сухих веществ, в том числе жира. На условно чистых ст. 2 и 3 в мышцах лещей содержалось минимальное количество общей влаги и наибольшее содержание жира, белка, золы. Кроме того, выявлена отрицательная корреляционная связь количества сухого вещества (–0.62), в том числе жира (–0.63), а также упитанности лещей по Фультону (–0.59) и Кларк (–0.49) с уровнем загрязнения станций.
Осенью 2013 г. макрозообентос профундали Рыбинского водохранилища был представлен олигохетно-хирономидным комплексом, что характерно для водоeма [42]. В среднем олигохеты и хирономиды суммарно формировали 94 ± 2% численности и 75 ± 14% биомассы. На станциях 2 и 5–8 были отмечены наименьшие значения численности макрозообентоса по сравнению с остальными участками (табл. 3). Но при этом наибольшая общая биомасса макрозообентоса обнаружена на ст. 8, где обитает ценозообразующий моллюск Dreissena polymorpha (Pallas), и обилие бентоса в формируемом им сообществе выше, что характерно для биоценозов дрейссенид [25, 33]. Биоценоз дрейссены был обнаружен также на ст. 3. По этой причине вклад моллюсков в общую биомассу на ст. 3 и 8 был значительным – 69 и 91% соответственно. По классификации Пидгайко [24] ст. 1, 3, 4, 7 и 8 можно отнести к весьма высококормным, ст. 5 и 6 – к высококормным, а ст. 2 к среднекормному участку. Выявлена отрицательная корреляция упитанности лещей (–0.62 по Фультону и –0.78 по Кларк), накопления сухого вещества (–0.39) и жира (–0.72) в их мышечной ткани с биомассой макробентоса.
Таблица 3.
Основные характеристики макрозообентоса из разных участков Рыбинского водохранилища
| Показатель | Номера станций | |||||||
|---|---|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | |
| Численность, тыс. экз./м2 | 10.2 | 4.6 | 11.9 | 22.9 | 2.6 | 2.4 | 7.6 | 3.4 |
| Доля в численности, %: | ||||||||
| хирономид | 20 | 24 | 22 | 16 | 0 | 6 | 18 | 31 |
| олигохет | 78 | 62 | 64 | 81 | 98 | 94 | 82 | 58 |
| Биомасса, г/м2 | 48.1 | 4.2 | 119.3 | 100.9 | 10.8 | 7.54 | 29.3 | 275.9 |
| Доля в биомассе, %: | ||||||||
| хирономид олигохет |
73 20 |
26 58 |
20 6 |
84 15 |
0 92 |
23 77 |
80 18 |
8 1 |
| Биомасса без учета моллюсков, г/м2 | 45.1 | 3.9 | 37.4 | 99.6 | 10.0 | 7.5 | 28.7 | 25.0 |
| Доля в биомассе без учета моллюсков, %: | ||||||||
| хирономид | 78 | 29 | 64 | 85 | 0 | 23 | 82 | 89 |
| олигохет | 21 | 64 | 21 | 15 | 100 | 77 | 18 | 10 |
В пищевом комке лещей доли объектов питания соответствовали распределению основных групп макробентоса в донных сообществах исследуемых участков водохранилища (табл. 3 и 4). Исключение – ст. 8, где хирономиды присутствовали в бентосе, но, если судить по общему индексу потребления, лещ ими почти не питался. Сходная ситуация с нарушением пищевого поведения у леща отмечена на высококормных ст. 5 и 6 (табл. 4). Выявлена обратная корреляция (–0.69) общего индекса потребления основных групп макрозообентоса с повышением уровня загрязнения станций.
Таблица 4.
Частный и общий индексы потребления основных групп макробентоса у леща
| Показатель | Номерa станций | |||||||
|---|---|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | |
| Частный индекс потребления | ||||||||
| хирономид | 19.81 | 30.39 | 36.41 | 36.05 | 0.22 | 0.36 | 25.65 | 1.75 |
| моллюсков | 0.01 | 0.49 | 0.00 | 0.26 | 0.01 | 0.24 | 0.00 | 0.17 |
| олигохет | 0.00 | 0.03 | 0.05 | 0.00 | 0.00 | 0.61 | 0.09 | 0.17 |
| Общий индекс потребления | 19.82 | 30.91 | 36.46 | 36.31 | 0.23 | 1.21 | 25.74 | 2.09 |
Следует отметить, что с уменьшением общего индекса потребления снижается упитанность лещей и уменьшается количество белка, жира, минеральных веществ в их скелетных мышцах. Об этом свидетельствует положительная корреляция между общим индексом потребления макрозообентоса и накоплением сухого вещества (0.67), в том числе минеральных веществ (0.51), белка (0.49) и жира (0.35), а также коэффициентом упитанности особей по Фультону (0.60) и Кларк (0.49).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Известно, что загрязняющие вещества на ст. 6–8 поступают непосредственно со стоками Череповецкого комплекса, а на ст. 5 преобладают продукты их трансформации [15, 18]. Существует прямая зависимость между накоплением органических загрязняющих веществ и тяжелых металлов в донных отложениях и кормовых объектах бентосных рыб, при этом происходит изменение структуры донного биоценоза и биомассы бентоса [8, 12, 16]. Этот факт подтверждается исследованиями на Рыбинском водохранилище, в результате которых показано, что максимальное содержание полихлорированных бифенилов в потенциальных объектах питания леща (личинках хирономид, олигохетах, брюхоногих моллюсках и дрейссене) было на ст. 6–8 [18].
Обнаружено, что ст. 2, 5–7 характеризовались наименьшим количеством видов макрозообентоса и его обилием относительно условно чистых ст. 1, 3 и 4. Это согласуется с данными, полученными для различных водоемов, где в условиях интенсивного загрязнения выявлено изменение структуры донного биоценоза и биомассы бентоса [2, 12, 14, 31]. Тем не менее, несмотря на снижение биомассы на отдельных загрязненных станциях, по количеству корма они продолжают относиться к высококормным участкам.
Доказано, что при благоприятных условиях в конце нагульного периода леща хирономиды и олигохеты должны присутствовать в его рационе примерно в равном количестве [10]. Вероятно, именно с изменениями в качественном составе макрозообентоса, вызванными локальным хроническим загрязнением, связано значительное уменьшение потребления рыбой олигохет, тогда как хирономиды составляли основную часть рациона леща. Можно предположить, что вследствие этого, а также малой доли хирономид в общей биомассе на некоторых станциях наблюдается отрицательная корреляция упитанности, количества сухого вещества и жира с общей биомассой макрозообентоса.
Несмотря на весьма высокий уровень кормности на ст. 8 и благоприятные условия откорма рыб на ст. 5 и 6, значения общего индекса потребления корма, характеризующие интенсивность питания леща, были низкие. Более того, выявлена отрицательная корреляционная связь количества потребляемой пищи леща с повышением уровня загрязнения исследованных станций. Это может быть связано с изменением пищевого поведения лещей из-за высокого уровня загрязнения этих участков водоема. Данное предположение подтверждается результатами ряда авторов о негативном влиянии загрязняющих веществ на пищевое поведение рыб, в том числе на уменьшение аппетита гидробионтов, а в некоторых случаях и полного отказа от пищи [17, 27, 43, 45].
В условиях хронического загрязнения у рыб наблюдается снижение усвояемости питательных веществ, что, в свою очередь, приводит к замедлению темпов роста и уменьшению упитанности, характеризирующейся в первую очередь накоплением жира в организме [12, 37]. В среднем у леща коэффициенты упитанности по Фультону могут меняться в пределах 1.49–2.27, по Кларк – в пределах 1.37–2.73 [9, 20, 32]. Коэффициенты упитанности лещей Рыбинского водохранилища вне зависимости от места вылова соответствовали этим значениям. Тем не менее, лещи, пойманные на загрязненных станциях, оказались менее упитанными по сравнению с выловленными на условно чистых станциях, о чем свидетельствует коэффициент корреляции. Кроме того, на самых загрязненных ст. 6–8 выявлены минимальные значения содержания жира в мышцах лещей, на условно чистых ст. 2, 4 и среднезагрязненной ст. 5 – максимальные. Негативное влияние антропогенной нагрузки на накопление жира подтверждается отрицательной зависимостью изменения его количества от уровня загрязнения станции.
Известно [8, 36, 37, 39, 41, 44, 46], что под действием загрязняющих веществ ухудшается эффективность ассимиляции пищи, снижается метаболизм гликогена в печени рыб, происходит нарушение липидного и белкового обменов. Эти данные подтверждаются полученной нами корреляционной зависимостью накопления сухого вещества в скелетных мышцах леща от уровня загрязнения станций Рыбинского водохранилища. На участках, имеющих высокую концентрацию загрязняющих веществ (ст. 6 и 8) в мышечной ткани лещей выявлено наименьшее значение сухого вещества, являющегося результатом усвояемости пищи. Следует отметить, что и на условно чистой ст. 1 этот показатель был низким.
Уровень минерального обмена также зависел от места обитания лещей. Наибольшие значения зольных веществ в мышечной ткани лещей зарегистрированы на условно чистых ст. 2 и 3, наименьшие – на ст. 5, 7, 8.
Накопление белка в мышцах леща в наименьшей степени зависело от места его обитания. Максимальные показатели наблюдались в мышцах особей на условно чистых ст. 2 и 3, минимальные – на относительно благоприятных по экологической обстановке ст. 1 и 5. На наиболее загрязненных участках Рыбинского водохранилища содержание белка в мышечной ткани леща имело средние значения. Связи между углеводистой частью мышечной ткани леща, представленной БЭВ, и местом обитания рыб не обнаружено. В мышцах лещей, отобранных на станциях в зоне антропогенного загрязнения, были средние значения БЭВ.
Интересен факт, что на ст. 5 у лещей с относительно высоким содержанием жира, белка и минеральных веществ в мышечной ткани выявлен низкий общий индекс потребления макрозообентоса. При этом значение частного индекса потребления хирономид достигало лишь 0.22, а доля хирономид в общей биомассе макрозообентоса равнялась нулю. Такие особенности можно объяснить миграцией лещей. Известно, что лещ в водохранилище представляет собой единую популяцию, состоящую из локальных стад (группировок). Они различаются масштабами перемещения в процессе нереста и нагульного периода, и делятся на оседлых особей и мобильных, перемещающихся в поисках пищи на большие расстояния [3]. Кроме того, Б.А. Флёров [26] ранее отмечал, что осенью лещ мог приходить на зимовку из незагрязненных районов Рыбинского водохранилища в Шекснинский плес. Таким образом, из-за миграции лещей в течение года в одной выборке могли находиться как особи, обитающие в загрязненных районах, так и приплывающие туда из более чистых мест.
Выводы. В мышцах леща из районов Рыбинского водохранилища с большей антропогенной нагрузкой выявлены негативные изменения показателей липидного и минерального обмена, в меньшей степени – белкового. Изменения показателей углеводного обмена отсутствуют. С увеличением уровня загрязнения уменьшается упитанность рыб. При сходных кормовых условиях на разных станциях снижение значения общего индекса потребления корма, характеризующего интенсивность питания леща, может быть связано с изменением пищевого поведения, вызванным высоким уровнем антропогенной нагрузки на исследуемых участках водохранилища.
Список литературы
Баканов А.И., Краснопер Е.В., Стрижникова Л.Н. Об использовании индексов при изучении питания рыб-бентофагов // ИБВВ АН СССР. 1980. 29 с. Деп. в ВИНИТИ. № 4984-80 деп.
Белан Т.А. Особенности обилия и видового состава бентоса в условиях загрязнения: Залив Петра Великого, Японское море: Автореф. дис. … канд. биол. наук. Владивосток, 2001. 27 с.
Герасимов Ю.В., Бражник С.Ю., Стрельников А.С. и др. Лещ // Рыбы Рыбинского водохранилища: популяционная динамика и экология. Ярославль: Филигрань, 2015. С. 198–223.
Герман А.В., Законнов В.В. Аккумуляция полихлорированных бифенилов в Шекснинском плесе Рыбинского водохранилища // Вод. ресурсы. 2003. Т. 30. № 5. С. 571–575.
Герман А.В., Законнов В.В., Мамонтов А.А. Хлорорганические соединения в донных отложениях, бентосе и рыбе Волжского плеса Рыбинского водохранилища // Вод. ресурсы. 2010. Т. 37. № 1. С. 84–88.
Герман А.В., Козловская В.И. Гепатосоматический индекс и биохимический состав печени леща Abramis brama L. Шекснинского плеса Рыбинского водохранилища при различных уровнях накопления органических токсикантов // Вопр. ихтиологии. 2001. Т. 41. № 2. С. 249–252.
Герман А.В., Козловская В.И. Содержание полихлорированных бифенилов в леще Abramis brama Рыбинского водохранилища // Вопр. ихтиологии. 1999. Т. 39. № 1. С. 139–142.
Голованова И.Л., Филиппов А.А., Левин Б.А и др. Влияние тяжелых металлов (Cu, Zn, Pb) на активность гликозидаз кишечника синца и белоглазки // Матер. V Всерос. конф. по водной экотоксикологии “Антропогенное влияние на водные организмы и экосистемы”. Ярославль: Филигрань, 2014. С. 33–36.
Горюнова А.И., Данько Е.К. Рыбоводное освоение степных озер Казахстана. Товарное выращивание леща (к вопросу о воссоздании озерно-товарных хозяйств) // Изв. НАН РК. Сер. биол. и мед. 2014. № 6. С. 7–11.
Житенева Т.С. Питание леща на разных биотопах Рыбинского водохранилища // Биология внутренних вод: Информ. бюл. Л., 1980. № 48. С. 37–41.
Заботкина Е.А. Оценка здоровья леща Abramis brama L. из разных по уровню загрязнения плесов Рыбинского водохранилища по цито- и гистологическим показателям селезенки // Матер. V Всерос. конф. по водной экотоксикологии “Антропогенное влияние на водные организмы и экосистемы”. Ярославль: Филигрань, 2014. С. 52–56.
Зиновьев Е.А., Китаев А.Б. Роль химического загрязнения в формировании и особенностях ихтиофауны Камского водохранилища в районе Соликамско-Березниковского промышленного комплекса // Географ. вестн. 2011. № 2. С. 59–65.
Касумян А.О. Воздействие химических загрязнителей на пищевое поведение и чувствительность рыб к пищевым стимулам // Вопр. ихтиологии. 2001. Т. 41. № 1. С. 82–95.
Клочкова Н.Г., Климова А.В., Очеретяна С.О. и др. Воздействие антропогенного загрязнения на состояние макробентоса в бухте Раковая (Авачинская губа, юго-восточная Камчатка) // Вестн. Камчат. гос. техн. ун-та. 2016. № 35. С. 53–64.
Козловская В.И., Герман А.В. Полихлорированные бифенилы и полиароматические углеводороды в экосистеме Рыбинского водохранилища // Вод. ресурсы. 1997. Т. 24. № 5. С. 563–569.
Козловская В.И., Герман А.В., Козловская О.И. Полихлорированные бифенилы // Экологические проблемы Верхней Волги. Ярославль: Изд-во Ярослав. гос. техн. ун-та, 2001. С. 243–248.
Кузьмина В.В., Гладков А.В., Баранов Д.А. Влияние состава пищи на динамику двигательных реакций и рациона карпа // Вестн. АПК Верхневолжья. 2011. № 2. С. 28–33.
Лапирова Т.Б., Чуйко Г.М., Пряничникова Е.Г. Некоторые иммунофизиологические параметры Dreissena polymorpha из разных по степени антропогенного воздействия участков Рыбинского водохранилища // Вестн. Твер. гос. ун-та. Сер. биол. и экол. 2012. № 25. С. 64–75.
Львова А.А. Экология дрейссены (Dreissena polymorpha polymorpha (Pall.)) // Бентос Учинского водохранилища. М.: Наука, 1980. С. 101–119.
Маренков О.Н., Федоненко Е.В., Габибов М.М. и др. Развитие гонад леща (Abramis brama Linnaeus, 1758) в условиях Запорожского водохранилища // Изв. вузов Поволж. региона. Естеств. науки. 2013. № 4(4). С. 25–35.
Методика изучения биогеоценозов внутренних водоемов. М.: Наука, 1975. 240 с.
Методическое пособие по изучению питания и пищевых отношений рыб в естественных условиях. М.: Наука, 1974. 254 с.
Мордухай-Болтовской Ф.Д. Материалы по среднему весу водных беспозвоночных бассейна Дона // Тр. проблемн. и тематич. совещ. М.; Л., 1954. Вып. 2. С. 223–241.
Пидгайко М.П., Александров Б.М., Иоффе Ц.И. и др. Краткая биолого-продукционная характеристика водоемов Северо-Запада // Изв. Гос. НИИ озер. и реч. рыб. хоз-ва. 1968. Т. 68. С. 205–228.
Пряничникова Е.Г. Макрозообентос совместных поселений двух видов дрейссенид (Mollusca, Dreissenidae) в Рыбинском водохранилище // Поволж. экол. журн. 2015. № 1. С. 72–79.
Флёров Б.А. Экологическая обстановка на Рыбинском водохранилище в результате аварии на очистных сооружениях г. Череповца в 1987 г. // Влияние стоков Череповецкого промышленного узла на экологическое состояние Рыбинского водохранилища. Рыбинск: ИБВВ АН СССР, 1990. С. 3–11.
Флёров Б.А. Эколого-физиологические аспекты токсикологии пресноводных животных. Л.: Наука, 1989. 141 с.
Флёров Б.А., Томилина И.И., Кливленд Л. и др. Комплексная оценка состояния донных отложений Рыбинского водохранилища // Биология внутр. вод. 2000. № 2. С. 148–156.
Флёрова Е.А. Биологические последствия накопления кадмия в организме рыб // Вода: химия и экология. 2012. № 6. С. 43–47.
Флёрова Е.А. Физиолого-биохимические методы исследования рыб. Учебно-методическое пособие. Ярославль: Изд-во ФГБОУ ВПО “Ярославская ГСХА”, 2014. 40 с.
Цурпало А.П. Макробентос литорали бухты Крабовой (остров Шикотан, Курильские острова) и его многолетние изменения: Автореф. дис. … канд. биол. наук. Владивосток, 2009. 23 с.
Шайдуллина Ж.М. Сезонная и возрастная динамика морфофизиологических показателей леща реки Урал: Автореф. дис. … канд. биол. наук. Астрахань, 2009. 23 с.
Щербина Г.Х. Роль видов-вселенцев в структуре макрозообентоса верхневолжских водохранилищ. Инвазии чужеродных видов в Голарктике. Рыбинск: Ин-т биологии внутр. вод РАН, 2003. С. 164–171.
Afshan S., Ali S., Ameen U.S. Effect of Different Heavy Metal Pollution on Fish // Res. J. Chem. Environ. Sci. 2014. V. 2. № 1. P. 35–40.
Chuiko G.M., Zakonnov V.V., Morozov A.A. et al. Spatial distribution and qualitative composition of polychlorinated biphenyls and organochlorine pesticides in bottom sediments and bream (Abramis brama L.) from the Rybinsk Reservoir // Inland Water Biol. 2010. V. 3. № 2. pp. 193–202. https://doi.org/10.1134/S199508291002015X
Collier T.K., Anulacion B.F., Arkoosh M.R. et al. Effects on fish of polycyclic aromatic hydrocarbons (PAHs) and naphthenic acid exposures // Fish Physiology: Organic Chemical Toxicology of Fishes. 2013. V. 33. P. 195–255.
Golovanova I.L. Effects of heavy metals on the physiological and biochemical status. // Inland Water Biol. 2008. V. 1. №. 1. P. 93–101. https://doi.org/10.1134/S1995082908010148
Khayatzadeh J., Abbasi E. The Effects of Heavy Metals on Aquatic Animals // The 1st International Applied Geological Congress, Department of Geology. Iran: Islamic Azad University – Mashad Branch, 26–28 April. 2010. P. 688–694.
Meador J.P., Sommers F.C., Ylitalo G.M. et al. Altered growth and related physiological responses in juvenile Chinook salmon (Oncorhynchus tshawytscha) from dietary exposure to polycyclic aromatic hydrocarbons (PAHs) // Can. J. Fish and Aquat. Sci. 2006. № 63. P. 2364–2376.
Olgunoğlu M.P., Artar E., Olgunoğlu İ.A. Comparison of Heavy Metal Levels in Muscle and Gills of Four Benthic Fish Species from the Northeastern Mediterranean Sea // Pol. J. Environ. Stud. 2015. V. 24. № 4. P. 1743–1748.
Pavlov D.F., Chuiko G.M., Pavlov D.D. Growth of mozambique tilapia (Oreochromis mossambicus Peters) chronically exposed to cadmium, naphthalene, and DDVP // Inland Water Biol. 2010. V. 7. № 1. pp. 97–100. https://doi.org/10.1134/S1995082913040135
Perova S.N. Taxonomic composition and abundance of macrozoobenthos in the Rybinsk Reservoir at the beginning of the 21st century // Inland Water Biol. 2012. V. 5. № 2. pp. 199–207. https://doi.org/10.1134/S1995082912020125
Sabullah M.K., Ahmad S.A., Shukor M.Y. et al. Heavy metal biomarker: Fish behavior, cellular alteration, enzymatic reaction and proteomics approaches // Int. Food Res. J. 2015. V. 22. № 2. P. 435–454.
Vijayan M.M., Aluru N., Maule A.G. et al. Fasting augments PCB impact on liver metabolism in anadromous arctic char // Toxicol. Sci. 2006. V. 91. № 2. P. 431–439.
Weis J.S., Candelmo A.C. Pollutants and fish predator/prey behavior: A review of laboratory and field approaches // Current Zool. 2012. V. 58. № 1. P. 9–20.
Wiseman S., Vijayan M.M. Aroclor 1254 disrupts liver glycogen metabolism and enhances acute stressor-mediated glycogenolysis in rainbow trout // Comp. Biochem. and Physiol. Part C. Toxicol. & Pharmacol. 2011. V. 154. № 3. P. 254–260.
Дополнительные материалы отсутствуют.
Инструменты
Биология внутренних вод


