Биология внутренних вод, 2019, № 2-2, стр. 51-60
Раннелетний зоопланктон Азовского моря в период осолонения
Д. Ф. Афанасьев 1, *, З. А. Мирзоян 1, М. Л. Мартынюк 1, Д. В. Хренкин 1, Н. А. Шляхова 1, М. В. Бычкова 1, С. В. Жукова 1
1 Азово-Черноморский филиал Всероссийского научно-исследовательского института рыбного хозяйства
и океанографии
344002 Ростов-на-Дону, ул. Береговая, д. 21в, Россия
* E-mail: dafanas@mail.ru
Поступила в редакцию 16.12.2016
После доработки 19.10.2017
Принята к публикации 05.04.2018
Аннотация
Приведены данные по таксономическому составу и структуре зоопланктона Азовского моря и Таганрогского залива в период с 2005 по 2015 гг. Выделены основные сообщества планктона, проанализированы изменения таксономического разнообразия и структуры сообществ планктона, произошедшие в результате осолонения моря. Показано, что в раннелетнем зоопланктоне таксономическое разнообразие снизилось в 1.4–1.5 раза. Увеличение солености способствовало вытеснению пресноводного комплекса видов и распространению морской копеподы Acartia tonsa.
ВВЕДЕНИЕ
Азовское море – внутренний водоем, расположенный на юге европейской части Российской Федерации. Соединяется с Черным морем через Керченский пролив. Для него характерно наличие заливов, из которых самый крупный – Таганрогский, значительно отличающийся по уровню солености от остальной акватории. Бассейн Азовского моря находится в зоне недостаточного увлажнения, и на его водный баланс в основном оказывает влияние сток крупных рек – Дона и Кубани.
Географическое положение и относительно небольшие размеры Азовского моря обусловливают высокую пространственно-временную изменчивость основных абиотических факторов экосистемы моря, и в первую очередь солености, которую определяют речной сток, двусторонний водообмен с Черным морем через Керченский пролив и флюктуации общей увлажненности бассейна. В период естественного режима речного стока (1912–1951 гг.) среднемноголетняя соленость моря была 10.6‰, что благоприятствовало развитию солоновато-водной и реликтовой фауны. После 1968 г., в результате снижения стока рек Дон и Кубань, вызванного активным гидростроительством, развитием промышленности, сельского хозяйства и ростом безвозвратного потребления пресной воды, среднегодовая соленость возросла в собственно море до 12.8‰, в Таганрогском заливе до 9.4‰ [3]. После нескольких периодов распреснения в многоводные годы (1977–1983, 1986–1998, 2001–2006 гг.), начиная с 2007 г., Азовское море вновь вступило в цикл значительного осолонения, обусловленного снижением материкового стока и увеличением объема поступления компенсационных потоков из Черного моря. В результате среднее годовое значение солености в собственно море повысилось с 9.6‰ в 2006 г. до 13.2‰ в 2015 г., в Таганрогском заливе – с 5.3 до 11.1‰. Произошло существенное перераспределение зон опреснения: акватории с соленостью до 4‰ исчезли, а с соленостью от 7 до 11‰ значительно сократились и теперь отмечаются только в восточной части Таганрогского залива. Градиент солености также уменьшился с 10‰ (от 0.5‰ в восточной части Таганрогского залива до 10.5‰ в районе Керченского пролива в период опреснения) до 6.5‰ (от 7 до 13.5‰ в период осолонения).
Цель работы – проанализировать изменения таксономического разнообразия планктонных животных и структуры сообществ зоопланктона, произошедшие в результате осолонения Азовского моря.
Для анализа изменений выбран раннелетний период. Причина выбора раннелетнего периода заключаются в следующем. До появления в Черном и Азовском морях гребневика Mnemiopsis leidyi (A. Agassiz, 1865) сезонная динамика развития зоопланктона Азовского моря была представлена двумя продолжительными пиками биомассы: в Таганрогском заливе – летом (за счет развития коловраток и копепод) и осенью (за счет копепод), в открытой части моря – весной (за счет развития морских коловраток и личинок балянуса) и летом (за счет развития копепод) [11]. С конца 80-х гг. ХХ в. в Азовском море в весенне-осенний период стал массово развиваться пелагический хищник Mnemiopsis leidyi, завезенный в 80-х гг. в Черное море. Каждый год весной или в начале лета мнемиопсис заходит в Азовское море из Черного и дает вспышку численности, выедая зоопланктон. В результате биомасса зоопланктона со второй половины лета и до осени снижается до очень малых величин (в собственно море – до 5–10 мг/м3, что в среднем на два порядка ниже значений в период до вселения мнемиопсиса), существенно меняется структура сообществ в сторону преобладания меропланктона [7, 25]. Таким образом, конец весны и начало лета теперь единственное время, когда зоопланктон не находится под непосредственным влиянием мнемиопсиса и формирует наиболее высокий уровень биомассы, что позволяет проводить корректное сравнение влияния осолонения на сообщества. Этот период имеет и определяющее значение в формировании рыбопродуктивности водоема.
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
В основу настоящей статьи положены результаты исследований, проведенных в Азовском море на 34 станциях (12 – в Таганрогском заливе и 22 – в собственно море) в середине июня 2005–2006 гг. (период до осолонения), 2009–2010 гг. (промежуточные этапы осолонения) и 2014–2015 гг. (текущий этап осолонения). Всего в указанные периоды отобрано и проанализировано 204 пробы зоопланктона (учтены полный видовой состав, биомасса и численность каждого вида).
Сбор и обработку проб проводили в соответствии с методами работ [1, 6].
В качестве орудия лова использовали среднюю модель планктонной сети Джеди с диаметром входного отверстия 24 см, длиной боковой поверхности конуса 100 см и надставки – 80 см. Конус был изготовлен из сита с ячеей размером 0.076 мм, надставка – из плотной ткани. В двукратной повторности сетью облавливали водную толщу от дна до поверхности, каждый раз сливая содержимое планктонного стакана в посуду объемом 500 мл. Отобранную пробу фиксировали 40%-ным формалином до концентрации в пробе 4%. Камеральную обработку проб проводили в лабораторных условиях. Использовали счетный метод, заключающийся в подсчете в камере Богорова количества организмов каждого вида по возрастным стадиям и размерным группам.
Таксономия приведена по базе данных WoRMS (World Register of Marine Species) [26] и справочной литературе [16], отношение видов к изменению солености – по [10, 11, 16, 17, 28].
Для визуализации паттернов сходства сообществ использовали метод многомерного шкалирования (MDS). Ординация выполнена на основании данных по биомассе видов (данные не трансформированы). При создании матрицы сходства использовали индекс Брея–Кертиса. Привязку выделенных сообществ к их положению в водоеме осуществляли соотнесением номеров станций, входящих в то или иное сообщество, со схемой отбора проб.
Для оценки достоверности выделения групп на MDS-диаграмме применяли однофакторный анализ сходства (ANOSIM). Нетрансформированные данные по биомассе подвергали анализу SIMPER для оценки вклада биомассы каждого вида в каждую из выделенных групп и анализу DIVERSE для оценки индексов выровненности и разнообразия сообществ. При расчете индекса Шеннона использовали натуральный логарифм.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Таксономический состав. В период максимального распреснения Азовского моря (2005–2006 гг.) в составе раннелетнего зоопланктона в Таганрогском заливе насчитывалось 56 видов и внутривидовых таксонов истинных планктеров, относящихся к 26 родам; в собственно море – 37 видов и внутривидовых таксонов из 22 родов. В период осолонения (2014–2015 гг.) количество видов и внутривидовых таксонов эупланктеров сократилось до 37 в Таганрогском заливе и до 26 – в собственно море. Общее количество родов снизилось до 20 как в заливе, так и в собственно море (табл. 1).
Таблица 1.
Видовой состав раннелетнего зоопланктона Азовского моря в период до начала осолонения и во время осолонения
| Таксон | 2005 г. | 2006 г. | 2009 г. | 2010 г. | 2014 г. | 2015 г. | Отношение к солености | ||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 2 | 1 | 2 | 1 | 2 | 1 | 2 | 1 | 2 | 1 | 2 | ||
| Ciliophora | |||||||||||||
| Tintinnopsis sp. | – | + | – | – | + | – | – | – | + | + | + | + | м |
| Rotifera | |||||||||||||
| Asplanchna priodonta Gosse, 1850 | + | + | + | – | + | – | + | – | + | – | + | – | п |
| A. sieboldii (Leydig, 1854) | – | – | – | – | – | – | – | – | – | – | + | – | п |
| Brachionus angularis Gosse, 1851 | + | – | + | – | + | + | + | – | + | – | + | – | п |
| B. calyciflorus spinosus Wierzejski, 1891 | + | – | – | – | + | – | – | – | – | – | – | – | п |
| B. calyciflorus сalyciflorus Pallas, 1776 | + | – | + | + | + | – | + | – | + | – | + | – | п |
| B. diversicornis (Daday, 1883) | + | – | + | + | + | – | + | – | – | – | – | – | п |
| B. diversicornis homoceros (Wierzejski, 1891) | + | – | – | – | – | – | – | – | – | – | – | – | п |
| B. quadridentatus Hermann, 1783 | – | – | + | – | + | + | + | – | + | + | + | + | п, св |
| B. quadridentatus quadridentatus Hermann, 1783 | + | – | + | + | + | – | + | + | – | – | – | – | п, св |
| B. quadridentatus f. brevispinus Ehrenberg, 1832 | + | – | – | – | – | – | – | – | – | – | – | – | п, св |
| B. quadridentatus cluniorbicularis Skorikov, 1894 | + | + | – | – | + | – | + | – | + | – | – | – | п, св |
| B. quadridentatus hyphalmiros Tschugunoff, 1921 | + | + | + | – | + | + | + | + | + | + | + | + | п, св |
| B. nilsoni Ahlstrom, 1940 | + | – | – | – | + | – | – | – | – | + | + | – | п |
| B. plicatilis Müller, 1786 | + | – | – | – | – | – | + | – | + | – | – | – | св |
| B. plicatilis longicornis Fadeev, 1925 | – | + | – | – | – | – | + | + | + | – | + | – | св |
| B. plicatilis rotundiformis Tschugunoff, 1921 | – | – | – | – | – | – | – | – | + | – | + | + | св |
| B. forficula (Wierzejski, 1891) | – | – | + | – | – | – | – | – | – | – | – | – | п |
| B. rubens Ehrenberg, 1838 | + | + | + | – | + | – | + | – | – | – | – | – | п |
| Encentrum sp. | – | + | – | + | + | + | + | + | + | + | + | – | п, св, м |
| Filinia longiseta (Ehrenberg, 1834) | + | – | + | – | + | – | + | – | + | + | + | – | п, св |
| F. terminalis (Plate, 1886) | – | – | + | – | – | – | – | – | – | – | – | – | п, св |
| Keratella cochlearis (Gosse, 1851) | + | – | + | + | + | + | + | + | – | – | + | – | п |
| K. cochlearis robusta (Lauterborn, 1900) | – | – | – | – | – | – | – | – | + | – | – | – | п |
| K. tecta (Gosse, 1851) | – | + | + | – | + | – | – | + | – | – | + | – | п |
| K. quadrata (Müller, 1786) | + | – | + | + | – | – | + | – | – | – | + | – | п |
| K. quadrata quadrata Müller, 1786 | – | – | + | – | – | – | – | – | – | – | – | – | п |
| K. tropica (Apstein, 1907) | + | – | – | – | + | + | + | – | + | + | – | – | п, св |
| K. valga (Ehrenberg, 1834) | – | – | – | – | + | – | – | – | + | – | – | – | п |
| K. valga heterospina (Klausener, 1908) | – | – | + | – | + | + | – | – | – | – | – | – | п |
| K. valga monospina (Klausener, 1907) | – | – | + | – | – | – | – | – | – | – | – | – | п |
| Lecane sp. | – | – | – | + | – | – | – | – | – | – | – | – | п, св |
| Mytilina ventralis brevispina (Ehrenberg, 1830) | – | – | – | – | – | – | + | – | – | – | – | – | п |
| Notholca acuminata (Ehrenberg, 1832) | – | – | – | – | – | – | + | – | – | – | – | – | п, св |
| Ploesoma hudsoni (Imhof, 1891) | + | – | + | – | + | – | + | – | – | – | – | – | п, св |
| Polyarthra vulgaris Carlin, 1943 | + | – | + | – | + | – | + | – | + | – | – | – | п |
| Synchaeta sp. | + | + | + | + | + | + | + | + | + | + | + | + | св, м |
| Trichocerca sp. | + | – | + | – | + | + | + | – | – | – | – | – | п, св |
| Copepoda | |||||||||||||
| Diacyclops bicuspidatus (Claus, 1857) | – | – | – | – | – | – | – | – | + | – | – | – | п |
| Acanthocyclops vernalis vernalis (Fischer, 1853) | + | – | – | – | – | – | – | – | – | – | – | – | п |
| Acartia (Acartiura) clausi Giesbrecht, 1889 | + | + | + | + | + | + | + | + | + | + | + | + | м |
| A. (Acanthacartia) tonsa Dana, 1849 | + | + | + | + | + | + | + | + | + | + | + | + | св, м |
| Calanipeda aquaedulcis Krichagin, 1873 | + | + | + | + | + | + | + | + | + | + | + | + | п, св |
| Canuella perplexa Scott T. & A., 1893 | – | + | – | + | + | – | + | + | – | + | + | – | св, м |
| Centropages ponticus Karavaev, 1895 | + | + | + | + | + | + | + | + | + | + | + | + | м |
| Cyclopina gracilis Claus, 1863 | + | – | – | – | – | – | – | – | – | – | – | – | м |
| Cyclops sp. | + | + | + | + | + | + | + | + | – | – | – | + | п |
| C. strenuus strenuus Fischer, 1851 | + | – | – | – | – | – | – | – | – | – | – | – | п |
| C. vicinus vicinus Uljanin, 1875 | + | – | – | – | – | – | – | – | – | – | – | – | п |
| Ectinosoma abrau (Krichagin, 1877) | – | + | – | – | – | – | – | – | – | – | – | – | св, м |
| E. sp. | – | – | – | – | – | – | – | – | – | + | – | – | св, м |
| Eurytemora affinis (Poppe, 1880) | + | + | + | + | + | + | + | – | + | + | + | – | п, св |
| E. grimmi (G.O. Sars, 1897) | + | + | – | – | – | + | – | – | – | – | – | – | св |
| E. velox (Lilljeborg, 1853) | + | + | + | + | + | + | + | + | + | – | + | – | п, св |
| E. sp. | – | + | – | – | – | – | – | – | – | – | – | – | п, св, м |
| Halicyclops sp. | – | + | – | – | – | – | – | – | – | – | – | – | св |
| Harpacticus gracilis Claus, 1863 | – | – | – | – | – | + | – | – | – | – | – | – | м |
| H. sp. | + | – | + | + | + | + | + | + | + | + | + | + | м |
| Heterocope caspia G.O. Sars, 1897 | + | + | + | + | + | + | + | – | – | – | – | – | п, св |
| Mesocyclops leuckarti leuckarti (Claus, 1857) | – | – | – | – | – | – | – | – | + | – | – | + | п |
| Thermocyclops oithonoides (G.O. Sars, 1863) | + | – | – | – | – | – | – | – | – | – | – | – | п |
| Oithona davisae F.D. Ferrari & Orsi, 1984 | – | – | – | – | – | – | – | – | + | + | + | + | м |
| Pseudocalanus elongatus (Boeck, 1865) | – | – | – | – | – | – | – | – | – | + | – | – | м |
| Cladocera | |||||||||||||
| Coronatella rectangula (G.O. Sars, 1862) | – | – | – | – | – | – | – | – | – | + | – | – | п |
| Bosmina (Bosmina) longirostris (O.F. Müller, 1785) | + | + | + | – | + | – | + | – | – | – | – | – | п, св |
| Cercopagis (Cercopagis) pengoi (Ostroumov, 1891) | + | – | + | – | – | – | – | – | + | – | – | – | п, св |
| Cornigerius bicornis (Zernov, 1901) | – | – | – | – | + | – | + | – | – | – | – | – | п, св |
| C. maeoticus (Pengo, 1879) | + | + | + | + | + | + | + | + | + | – | + | – | п, св |
| Diaphanosoma brachyurum (Liévin, 1848) | + | – | + | – | – | – | – | – | – | – | – | – | п, св |
| Leptodora kindtii (Focke, 1844) | + | – | + | – | – | – | – | – | – | – | – | – | п, св |
| Leydigia leydigi (Schödler, 1863) | + | – | – | – | – | – | – | – | – | – | – | – | п, св |
| Moina rectirostris (Leydig, 1860) | + | – | + | – | – | – | – | – | – | – | – | – | п, св |
| M. macrocopa (Straus, 1820) | – | – | + | – | – | – | – | – | – | – | – | – | п, св |
| Pleopis polyphemoides (Leuckart, 1859) | + | + | + | + | + | + | + | + | + | + | + | + | св, м |
| Podonevadne trigona (G.O. Sars, 1897) | + | + | + | + | + | + | + | + | + | – | + | – | п, св |
| Меропланктон | |||||||||||||
| Foraminifera | + | + | + | + | + | + | + | + | + | – | + | + | – |
| Planaria | + | + | + | + | + | + | + | + | + | + | + | + | – |
| Nematoda larvae | – | – | + | + | + | + | + | + | – | – | – | + | – |
| Polychaeta larvae | + | + | + | + | + | + | + | + | + | + | + | + | – |
| Oligochaeta larvae | – | + | – | + | – | – | + | – | – | – | – | – | – |
| Gastropoda larvae | + | + | + | + | + | + | + | + | + | + | + | + | – |
| Lamellibranchia larvae | + | + | + | + | + | + | + | + | + | + | + | + | – |
| Ostracoda | + | + | + | + | + | + | + | – | + | – | + | + | – |
| Amphibalanus improvisus (Darwin, 1854) larvae | + | + | + | + | + | + | + | + | + | + | + | + | св, м |
| Mizida larvae | + | + | + | + | – | + | – | – | + | + | + | – | – |
| Decapoda larvae | + | + | + | + | – | – | – | + | + | + | + | + | – |
Наибольшей трансформации видового состава подвергся комплекс ветвистоусых ракообразных и коловраток. Так, число таксонов в составе кладоцер в Таганрогском заливе снизилось на 67%, в собственно море – на 33%. Таксономический состав коловраток в годы осолонения сократился в Таганрогском заливе на 26%, в собственно море – на 50%. Тем не менее, в Таганрогском заливе максимальное количество видов и внутривидовых таксонов до сих пор отмечается в группе коловраток. Наибольшим разнообразием характеризуются роды Brachionus (14 видов и внутривидовых таксонов в период распреснения и 9 – в период осолонения) и Keratella (6 и 5 видов и внутривидовых таксонов соответственно). В собственно море в период распреснения по количеству видов и внутривидовых таксонов лидировали коловратки рода Brachionus (7 таксонов), а также веслоногие рачки родов Acartia и Eurytemora (по 4 таксона). В период осолонения по количеству видов и внутривидовых таксонов (по 4 таксона) преобладали роды Brachionus и Acartia.
Таким образом, в период с 2005 по 2015 гг. таксономическое разнообразие зоопланктона в собственно море и в заливе снизилось в 1.4 и 1.5 раза соответственно (в основном, за счет коловраток и ветвистоусых ракообразных).
Распределение видов по отношению к солености. В Таганрогском заливе до осолонения преобладали виды пресноводного комплекса (52% общего числа видов). В период осолонения их общая доля в заливе снизилась до 35%. Число таксонов морского генезиса, напротив, возросло с 12% (в 2005 г.) до 25% (в 2015 г.).
В собственно Азовском море в период минимальной солености по количеству таксонов доминировали представители пресноводного (39% общего таксономического состава зоопланктона) и солоновато-водного (37%) комплексов. В процессе осолонения доля пресноводных видов снизилась до 21%, солоновато-водных – не изменилась, морских – увеличилась с 24 до 41%.
Выделение раннелетних сообществ зоопланктона и их количественная характеристика. Во всем комплексе сообществ Азовского моря методом многомерного шкалирования выделено 3 группы сообществ (рис. 1). Сообщество 1 представляет собой зооценозы с доминированием пресноводной коловратки Asplanchna priodonta, сообщество 2 – ценозы с доминированием меропланктона (в основном молоди усоногого рака Amphibalanus improvisus) и сообщество 3 – морской копеподы-вселенца Acartia tonsa. Согласно результатам анализа сходства, все группы сообществ достоверно отличаются друг от друга (табл. 2).
Рис. 1.
MDS-ординация сообществ зоопланктона Азовского моря: 1 – 2005 г., 2 – 2006 г., 3 – 2014 г., 4 – 2015 г.; 1 – сообщество аспланхны, 2 – сообщество меропланктона (а – бедное по видовому составу и биомассе; б – с более богатым видовым составом), 3 – сообщество акартии.
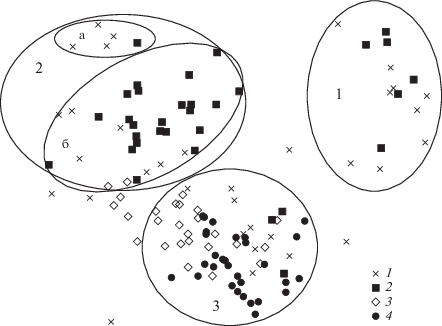
Таблица 2.
Результаты анализа сходства выделенных групп сообществ зоопланктона Азовского моря
| Группы сообществ |
R-статистика | Уровень значимости, % |
|---|---|---|
| 1, 3 | 0.989 | 0.01 |
| 1, 2а | 0.998 | 0.01 |
| 1, 2б | 0.986 | 0.01 |
| 3, 2а | 0.996 | 0.01 |
| 3, 2б | 0.791 | 0.01 |
| 2а, 2б | 0.674 | 0.01 |
Пресноводное сообщество 1 характеризовалось высокими биомассой (>0.8 г/м3) и численностью (>160 тыс. экз./м3), высоким видовым богатством, обусловленным большим числом видов в пробе (табл. 3 и табл. 4). Отмечены низкая выровненность биомассы составляющих его видов и значительное преобладание по биомассе (75%) доминирующего вида. Кроме доминанта, в ядро сообщества с заметной биомассой (20–60 мг/м3) входили коловратка Brachionus calyciflorus, копеподы Calanipeda aquaedulcis, Heterocope caspia, Eurytemora affinis и E. velox, кладоцеры Bosmina longirostris и Podonevadne trigona. Сообщество фиксировали только в 2005 и 2006 гг. на станциях Таганрогского залива со средней соленостью 2.8‰. Средняя биомасса сообщества была в 2005 г. 1682.3 мг/м3, в 2006 – 868.0 мг/м3. С 2014 г., после повышения солености вод залива >7‰, это сообщество не встречается (рис. 2).
Таблица 3.
Показатели видового богатства и уровень количественного развития выделенных сообществ зоопланктона Азовского моря в 2005–2006 и 2014–2015 гг.
| Сообщество | Число видов в пробе | Биомасса, мг/м3 | Численность, тыс. экз./м3 | Индекс видового богатства Маргалефа | Индекс выровненности Пиелу | Индекс Шеннона |
|---|---|---|---|---|---|---|
| 1 | 26 ± 1.1 | 1356.5 ± 192.3 | 162.9 ± 17.4 | 3.5 | 0.4 | 1.3 |
| 2а | 10 ± 1.8 | 13.1 ± 2.1 | 1.9 ± 0.2 | 3.6 | 0.4 | 1.1 |
| 2б | 15 ± 0.5 | 151.2 ± 22.4 | 26.0 ± 4.5 | 3.0 | 0.5 | 1.4 |
| 3 | 15 ± 0.5 | 418.0 ± 29.1 | 116.6 ± 21.3 | 2.3 | 0.4 | 1.2 |
Таблица 4.
Состав и структура выделенных сообществ зоопланктона Азовского моря в 2005–2006 и 2014–2015 гг. (приведены первые пять таксонов по вкладу в общую биомассу)
| Вид | Средняя биомасса, мг/м3 | Вклад в общую биомассу с учетом встречаемости, % | Накопленный вклад видов в общую биомассу, % |
|---|---|---|---|
| Сообщество 1, среднее сходство 40.9% | |||
| Asplanchna priodonta | 948.6 | 75.0 | 75.0 |
| Eurytemora affinis | 41.9 | 4.6 | 79.6 |
| Bosmina longirostris | 58.3 | 4.4 | 83.9 |
| Eurytemora velox | 36.4 | 3.3 | 87.3 |
| Brachionus calyciflorus | 38.9 | 2.9 | 90.2 |
| Сообщество 2а, среднее сходство 39.7% | |||
| Amphibalanus improvisus larvae | 8.9 | 74.0 | 74.0 |
| Lamellibranchia larvae | 1.4 | 12.6 | 86.5 |
| Podon polyphemoides | 0.4 | 5.1 | 91.6 |
| Acartia tonsa | 0.3 | 3.1 | 94.7 |
| A. clausi | 0.9 | 2.8 | 97.4 |
| Сообщество 2б, среднее сходство 39.8% | |||
| Amphibalanus improvisus larvae | 79.2 | 62.3 | 62.3 |
| Podon polyphemoides | 27.6 | 15.9 | 78.2 |
| Synchaeta sp. | 11.4 | 4.9 | 83.1 |
| Acartia tonsa | 4.7 | 4.3 | 87.5 |
| Eurytemora affinis | 4.2 | 3.1 | 90.5 |
| Сообщество 3, среднее сходство 42.8% | |||
| Acartia tonsa | 219.2 | 78.0 | 78.0 |
| Amphibalanus improvisus larvae | 49.3 | 10.9 | 89.0 |
| Calanipeda aquaedulcis | 35.8 | 2.4 | 91.3 |
| Lamellibranchia larvae | 18.6 | 2.0 | 93.3 |
| Synchaeta sp. | 23.8 | 1.9 | 95.1 |
Рис. 2.
Распределение выделенных сообществ зоопланктона в Азовском море в 2005, 2006 и 2014, 2015 гг. 1 – сообщество аспланхны, 2 – зона смешения сообществ аспланхны и меропланктона, 3 – сообщества меропланктона, 4 – сообщество акартии.
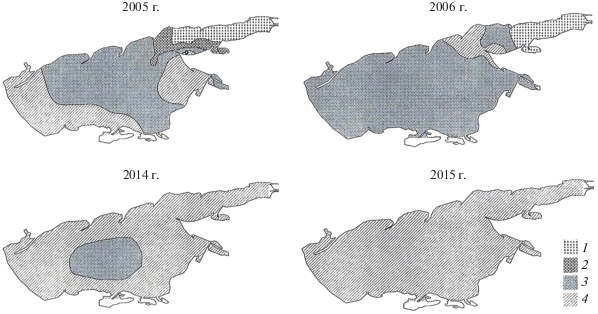
Меропланктонное сообщество 2, с доминированием планктонных стадий развития Amphibalanus improvisus, характеризовалось наименьшим видовым разнообразием и наиболее низкими численностью и биомассой (табл. 3 и табл. 4). Выделено два варианта этого сообщества – 2а и 2б. В сообществе 2а преобладали науплиусы и циприсы Amphibalanus improvisus, а также личинки двустворчатых моллюсков Cerastoderma glaucum (Bruguière, 1789), Abra segmentum (Récluz, 1843) и, в меньшей степени, Mytilaster lineatus (Gmelin, 1791) и Anadara kagoshimensis (Tokunaga, 1906) (в сумме – 87% общей биомассы). Это наиболее бедное по видовому составу и биомассе сообщество, встречавшееся преимущественно в центральной части моря в период опреснения. Средняя биомасса сообщества 2а была лишь 12.7 мг/м3 в 2005 г. и 14.5 мг/м3 в 2006 г. Сообщество 2б, кроме ранних стадий развития Amphibalanus improvisus и моллюсков, включало ряд сопутствующих видов кладоцер, коловраток и копепод: Podon polyphemoides, виды рода Synchaeta, Acartia tonsa и Eurytemora affinis. Сообщество с доминированием меропланктона в 2005 и 2006 гг. преобладало на большей части Азовского моря при средней солености 9‰. В 2014 г. это сообщество выявлено только на 8% станций в центре моря, в 2015 г. оно не обнаружено (табл. 3, табл. 4, рис. 2). Средняя биомасса сообщества 2б менялась от 102.2 мг/м3 в 2005 г. и 141.2 мг/м3 в 2006 г. до 255.0 мг/м3 в 2014 г.
Сообщество 3 с доминированием Acartia tonsa по видовому составу было сходно с сообществом 2б: в качестве субдоминантов с биомассой 10–50 мг/м3 в нем присутствовали ранние стадии развития Amphibalanus improvisus, вышеупомянутых двустворчатых моллюсков, а также виды рода Synchaeta и Podon polyphemoides. Сообщество 3 отличалось от сообщества 2б лишь высокой степенью развития Acartia tonsa, биомасса которой была в среднем 220 мг/м3 и достигала 78% общей биомассы. Как следствие, для сообщества 3 были характерны достаточно высокие количественные показатели развития, но более низкая выровненность (табл. 2). В 2005 и 2006 гг. сообщество зафиксировано на 9 и 25% станций, причем только в прибрежных мелководных районах моря. В 2014 г. доля станций с преобладанием Acartia tonsa достигла 81%, а в 2015 г. все Азовское море, включая Таганрогский залив, занимало только это сообщество (рис. 2). Многолетняя динамика биомассы сообщества не выражена: в 2005 г. средняя биомасса была 454.0 мг/м3, в 2006 г. – 530.6 мг/м3, в 2014 г. – 358.3 мг/м3, в 2015 г. – 440.4 мг/м3.
Таким образом, в многолетнем аспекте количественные показатели развития отдельных сообществ изменялись относительно несущественно, а трансформация зоопланктона Азовского моря связана с изменением ареалов целых сообществ. В период максимального опреснения (2005–2006 гг.) в Азовском море существовали сообщества зоопланктона как пресноводного (в Таганрогском заливе), так и морского генезиса, в текущий период осолонения опресненные районы исчезли, а из всего разнообразия планктонных ценозов остались только морские полигалобные сообщества.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Во второй половине ХХ в. в развитии планктонной фауны Азовского моря выделяют несколько периодов, в основе которых лежит изменение гидрологического режима моря, в частности, солености. Первые работы, посвященные трансформации зоопланктона в условиях меняющегося режима моря, появились в середине 50-х гг. ХХ в. [10, 15]. Показано влияние гидростроительства и сокращения стока р. Дон на размножение, развитие и распределение зоопланктона. На основании этих данных сделана попытка прогноза изменения зоопланктона Азовского моря в условиях зарегулированного стока рек [15], исследована реакция отдельных видов на изменение солености [10], составлены фаунистические списки зоопланктона Азовского моря [14], подведены первые итоги исследований планктонных сообществ [8]. В начале 70-х гг. произошло существенное повышение солености моря, ее максимальное значение (13.8‰) отмечено в октябре 1976 г. В этот период в сообществе зоопланктона произошли существенные структурные и функциональные изменения, в основе которых находилась замена аборигенных видов вселенцами из Черного моря [2, 4, 5, 11]. В результате такой смены состава сообществ снизилось не только разнообразие, но и продуктивность зоопланктона: в Таганрогском заливе она уменьшилась в 1.5, в собственно море – в 1.2 раза [7].
Настоящие данные по трансформации зоопланктона Азовского моря, полученные в 2005–2015 гг., достаточно хорошо соотносятся с более ранними исследованиями. Так, исчезновение сообщества пресноводного зоопланктона с доминированием коловратки Asplanchna priodonta в процессе осолонения согласуется с наблюдениями, по которым A. priodonta, как и другие виды пресноводного комплекса, массово развиваются в восточной части Таганрогского залива в теплых водах с соленостью <4‰ [20].
В то же время, современная трансформация сообществ зоопланктона Азовского моря в связи с повышением солености не сравнима с таковой в 70-х гг. ХХ в., поскольку происходит параллельно с другими крупномасштабными изменениями: потеплением и вселением новых видов гидробионтов, которые становятся доминантными. Так, инвазия хищного гребневика-зоопланктофага Mnemiopsis leidyi в южные моря России в 90-х гг. ХХ в. привела к существенному перераспределению потоков вещества и энергии в трофической сети пелагиали [7]. Среди инвазий других планктонных организмов в последнее время следует отметить появление и широкое распространение в Черном и в Азовском морях копепод Oithona davisae и Acartia tonsa [9, 12, 13, 19–24, 27]. Особого внимания заслуживает последний вид. Известно, что Acartia tonsa – морской по происхождению веслоногий рачок, обитающий в опресненных, прибрежных, эстуарных акваториях и интенсивно развивающийся при температуре воды >16°С [20, 21, 26]. Этот вселенец появился в 70-х гг. в Черном море, а затем в начале ХХI в. – и в Азовском море [20, 21, 26]. Согласно настоящему исследованию, до 2006 г. A. tonsa занимал в начале лета исключительно прибрежные биотопы в составе небогатого в таксономическом отношении сообщества меропланктона. Однако, достаточно быстро он стал доминировать в сообществе и расселяться по всему морю, чему, вероятно, способствовало осолонение.
Выводы. В процессе осолонения с 2007 по 2015 гг. таксономическое разнообразие раннелетнего зоопланктона в Азовском море снизилось в 1.4–1.5 раза (в основном за счет коловраток и ветвистоусых ракообразных). Выделены три основных раннелетних сообщества зоопланктона в Азовском море: пресноводное с доминированием коловратки Asplanchna priodonta, сообщества с преобладанием меропланктона (в основном молоди усоногого рака Amphibalanus improvisus) и сообщество с доминированием морской копеподы-вселенца Acartia tonsa. Увеличение солености способствовало вытеснению пресноводного комплекса видов и распространению морской копеподы Acartia tonsa, ранее встречавшейся только в прибрежных районах.
Список литературы
Абакумов В.А. Руководство по методам гидробиологического анализа поверхностных вод и донных отложений. Л.: Гидрометеоиздат, 1983. 240 с.
Алдакимова А.Я., Некрасова М.Я., Студеникина Е.И. Гидробиологический режим Азовского моря и его изменения в связи с преобразованием речного стока // Вопр. биогеографии Азовского моря и его бассейна. Л.: Географическое общество СССР, 1977. С. 90–103.
Бронфман А.М., Дубинина В.Г., Воловик С.П., Макарова Г.Д. Гидрологические и гидрохимические основы продуктивности Азовского моря // М.: Пищ. пром-сть, 1979. С. 288.
Воловик С.П. Основные черты преобразования экосистемы Азовского моря в связи с развитием рыбного хозяйства в его бассейне // Вопр. ихтиологии. 1986. № 16. С. 37–47.
Воловик С.П. Продуктивность и проблемы управления экосистемой Азовского моря: Автореф. дис. … д.б.н. М., 1985. 50 с.
Воловик С.П., Корпакова И.Г. Методы рыбохозяйственных и природоохранных исследований в Азово-Черноморском бассейне. Краснодар: Просвещение-Юг, 2005. 351 с.
Гребневик Mnemiopsis leidyi (A. Agassiz) в Азовском и Черном морях. Ростов-на-Дону: Батайское кн. изд-во, 2000. 500 с.
Грезе В.Н., Ковалев А.В. Основные этапы столетних исследований зоопланктона в Институте биологии южных морей // Вестн. зоологии. 1971. № 5. С. 12–17.
Загородняя Ю.А. Таксономический состав и количественные характеристики зоопланктона в восточном Сиваше летом 2004 г. // Экосистемные исследования Азовского, Черного и Каспийского морей. Апатиты: Кольск. науч. центр РАН, 2006. Т. 8. С. 103–114.
Карпевич А.Ф. Отношение беспозвоночных Азовского моря к изменению солености // Тр. Всерос. НИИ озер. и реч. рыб. хоз-ва. 1955. Т. 31. № 1. С. 240–275.
Копец В.А. О некоторых изменениях зоопланктона при современном осолонении Азовского моря // Тр. Всерос. НИИ озер. и реч. рыб. хоз-ва. 1978. Т. 31. С. 38–43.
Кренева К.В., Свистунова Л.Д., Саяпин В.В., Поважный В.В. Современное состояние зоопланктонного сообщества Азовского моря // Современное состояние и технологии мониторинга аридных и семиаридных экосистем юга России. Ростов-на-Дону: Юж. науч. центр РАН, 2010. С. 265–287.
Матишов Г.Г., Игнатьев С.М., Загородняя Ю.А. и др. Фаунистическое разнообразие и показатели обилия планктонных сообществ Азовского моря в июне 2014 г. // Вестн. Юж. науч. центра. 2015. Т. 11. № 3. С. 81–91.
Мордухай-Болтовской Ф.Д. Каталог фауны свободноживущих беспозвоночных Азовского моря // Зоол. журн. 1960. Т. 39. Вып. 10. С. 1454–1466.
Новожилова А.Н. Изменения в зоопланктоне Азовского моря в условиях меняющегося режима // Тр. Всерос. НИИ озер. и реч. рыб. хоз-ва. 1955. Т. 31. С. 199–216.
Определитель зоопланктона и зообентоса пресных вод Европейской России. Т. 1: Зоопланктон. М.: Товарищество науч. изданий КМК, 2010. 495 с.
Определитель рыб и беспозвоночных Каспийского моря. Т. 2: Стрекающие, гребневики, многощетинковые черви, веслоногие ракообразные и мизиды. СПб.; М.: Товарищество науч. изданий КМК, 2015. 244 с.
Поважный В.В. Зоопланктон // Вселенцы в биоразнообразии и продуктивности Азовского и Черного морей. Ростов-нa-Дону: Изд-во Юж. науч. центра РАН, 2010. С. 12–16.
Поважный В.В. Особенности динамики зоопланктонного сообщества Таганрогского залива // Вестн. Юж. науч. центра. 2009. Т. 5. № 2. С. 94–101.
Поважный В.В. Особенности функционирования зоопланктонного сообщества Таганрогского залива Азовского моря: Автореф. дис. … канд. биол. наук. Мурманск, 2009. 25 с.
Прусова И.Ю., Губанова А.Д., Шадрин Н.В. и др. Acartia tonsa (Copepoda, Calanoida): новый вид в зоопланктоне Каспийского и Азовского морей // Вестн. зоол. 2002. Т. 36. № 5. С. 65–68.
Свистунова Л.Д. Новый вселенец в зоопланктоне Азовского моря // Вестн. Юж. науч. центра РАН. 2013. Т. 9. № 4. С. 104–107.
Селифонова Ж.П. Вселенец в Черное и Азовское моря Oithona brevicornis Giesbrecht (Copepoda: Cyclopoida) // Рос. журн. биол. инвазий. 2011. № 2. С. 142–150.
Селифонова Ж.П. Таксономический состав и межгодовые изменения численности меропланктона в Азовском море // Биология моря. 2008. Т. 34. № 5. С. 311–317.
Студеникина Е.И., Сафронова Л.М., Мирзоян З.А. и др. Биологические основы формирования рыбопродуктивности Азовского моря в современный период. Ростов-на-Дону: Азов.НИИ рыб. хоз-ва, 2010. 170 с.
Gubanova A.D. Occurrence of Acartia tonsa Dana in the Black Sea. Was it introduced from the Mediterranean? // Mediterr. Mar. Sci. 2000. V. 1. № 1. P. 105–109.
Selifonova Zh.P. The Role of Zooplankton in the Functioning of the Taganrog Gulf Ecosystem in the Sea of Azov // Inland Water Biol. 2010. V. 3. № 4. P. 335–343. https://doi.org/10.1134/S1995082910040061
WoRMS Editorial Board. World Register of Marine Species. 2018. Available from http://www.marinespecies.org at VLIZ. Accessed 2018-12-20. https://doi.org/10.14284/170
Дополнительные материалы отсутствуют.
Инструменты
Биология внутренних вод


