Биология внутренних вод, 2019, № 3, стр. 80-83
Суточная динамика тиреоидных и половых стероидных гормонов в крови молоди радужной форели
Е. В. Ганжа 1, Е. Д. Павлов 1, *
1 Институт проблем экологии и эволюции им. А.Н. Северцова Российской академии наук
119071 Москва, Ленинский проспект, 33, Россия
* E-mail: p-a-v@nxt.ru
Поступила в редакцию 20.12.2018
После доработки 12.01.2019
Принята к публикации 06.02.2019
Аннотация
Исследована суточная динамика содержания тиреоидных и половых стероидных гормонов в крови годовиков радужной форели. Выявлены половые различия суточной динамики исследованных гормонов и показателя отношения тестостерона к эстрадиолу-17β. Показано, что максимумы и минимумы концентраций тиреоидных гормонов в течение суток у самок и самцов находятся в противофазе.
ВВЕДЕНИЕ
Естественный ареал радужной форели Parasalmo mykiss (=Oncorhynchus mykiss (Walbaum, 1792)) приурочен к северным широтам [11, 12, 16]. Благодаря высокой пластичности вида радужная форель распространена за пределами своего ареала [8], в том числе в горных районах тропиков.
Ранее были проведены исследования в рыбоводном хозяйстве Клонг-Кланх Южного Вьетнама (провинция Ламдонг), где выращивали радужную форель [2, 3]. Показано, что из-за климатических условий провинции, в значительной степени отличающихся от оптимальных для радужной форели (высокая температура воды – до 26.7°С, низкий уровень растворенного кислорода ‒ 6‒7 мг/л), наблюдаются выраженные аномалии в ее репродуктивной системе, зачастую приводящие к стерильности. Известно, что тиреоидные гормоны наряду с половыми стероидными участвуют в формировании и развитии гонад [4, 13]. Регуляция синтеза этих гормонов, как и многих других, в организме во многом определяется внешними факторами [6, 14].
Один из методов оценки физиологического состояния рыб – определение суточной динамики уровня гормонов в крови [1, 7, 10]. Концентрация многих гормонов, в частности тиреоидных и половых стероидных, зависит от времени суток и приурочена к определенным физиолого-биохимическим процессам, происходящим в организме [1, 6].
Цель работы – оценить суточную динамику тиреоидных и половых стероидных гормонов в крови годовиков радужной форели при выращивании в условиях горных районов Южного Вьетнама.
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
Материал собирали в апреле 2013 г. в экспериментальном рыбоводном хозяйстве Klong-Klanch, Research Institute of Aquaculture № 3 (провинция Ламдонг, Вьетнам). Хозяйство расположено на плато высотой 1485 м над уровнем моря, 12°10′29.88″ с.ш. и 108°41′52.98″ в.д.
За сутки до отбора проб крови годовиков (14 мес) радужной форели пересаживали в круглый бассейн (диаметр 1.5, глубина 0.7 м) и прекращали кормить. Температура воды была 15.0–16.5°С. Пробы крови отбирали с 3-го по 4-е марта вечером на закате (В) в 18:00 ч (~102 лк), ночью (Н) в 23:30 ч (10–2‒10–4 лк), перед рассветом (Пр) в 05:30 ч (10‒102 лк), утром после рассвета (У) в 06:30 ч (102‒103 лк), днем (Д) в 12:30 ч (104 лк). Процедура отбора проб крови длилась ≤1 ч. Далее измеряли длину тела по Смитту (FL), массу тела и определяли пол. Всего исследовано 16 самок и 17 самцов радужной форели.
Кровь прижизненно отбирали у рыб из хвостовой вены за анальным плавником в шприц объемом 1-2 мл, в зависимости от размера особи. Объем отобранной крови варьировал от 300 до 750 мкл. Плазму крови получали стандартным способом. Методом иммуноферментного анализа с использованием тест-наборов производства DRG (ФРГ) на приборе Mindray MR 96A (КНР) определяли концентрацию тироксина (Т4), трийодтиронина (Т3), тестостерона (Ts) и эстрадиола-17β (E). В каждой пробе содержание этих гормонов исследовали в трех повторностях. Рассчитывали соотношение тиреоидных гормонов (Т4/Т3) и половых стероидных гормонов (Ts/E). Показатель Т4/Т3 использовали для оценки изменений регуляции энергетических процессов в организме и установления зависимой динамики их содержания в крови, поскольку известно, что Т4 в результате дейодирования расщепляется до активной формы ‒ Т3 [5, 9, 15].
При статистической обработке материала использовали критерии Краскела–Уоллиса, Муда и U-критерий Манна–Уитни.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Длина радужной форели в период отбора проб у самок и самцов была 31.6 ± 0.97 (25.0–39.5)11 и 30.4 ± 0.98 (21.6–37.0) см соответственно. Масса самок достигала 424 ± 37.9 (227–780) г, самцов – 383 ± 34.7 (133–645) г. Все исследованные самки и бóльшая часть самцов имели половые железы массой ~1 г. Самцов с относительно развитыми половыми железами (средняя масса гонад ‒ 13.5 г) было 4 экз. Концентрации исследованных гормонов у самцов с гонадами разного размера достоверно не различались (р > 0.05).
Тиреоидные гормоны. Содержание тиреоидных гормонов в крови годовиков радужной форели связано (р < 0.05 для T3 по критерию Муда и р < 0.05 для T4 по критерию Краскела‒Уоллиса) с временем суток.
Среднесуточная концентрация T3 составила 9.5 ± 0.66 нг/мл у самцов и 8.7 ± 0.72 нг/мл у самок (рис. 1а), среднесуточная концентрация T4 – 134.2 ± 11.00 нг/мл у самцов и 153.7 ± 12.85 нг/мл у самок (рис. 1б). Во все временные периоды взятия проб динамика концентраций тиреоидных гормонов в крови самок и самцов находились в противофазе.
Рис. 1.
Суточная динамика T3 (а), T4 (б) и их отношения (T4/T3) (в) в крови самок (1) и самцов (2) радужной форели; Д – день, В – вечер, Н – ночь, Пр – перед рассветом, У – утро. Затененная область характеризует темный период суток (В, Н, Пр); над осью абсцисс обозначены уровни значимости (при р < 0.05) по U-критерию Манна–Уитни в конкретный период суток между самками и самцами по концентрациям гормонов.
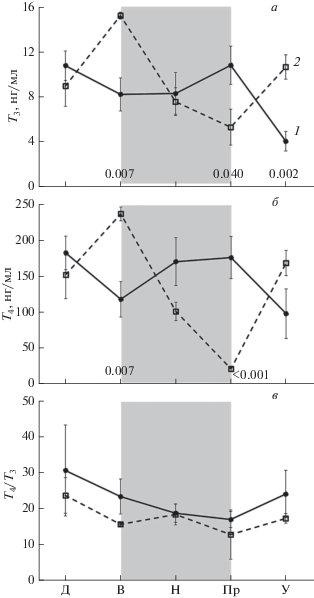
Среднесуточное значение показателя Т4/Т3 равнялось 23.9 ± 3.86 у самок и 17.7 ± 1.65 у самцов (рис. 1в). Минимальные значения этого показателя зафиксированы и у самок, и у самцов перед рассветом, а максимальные – днем.
Половые стероидные гормоны. Уровни половых стероидных гормонов Ts и E связаны с временем суток (р < 0.05 и р < 0.01 соответственно, здесь и далее по критерию Краскела–Уоллиса) и полом рыб (р < 0.001 и р < 0.01 соответственно), показатель Ts/E зависит только от пола радужной форели (р < 0.001).
Среднесуточная концентрация Ts у самок ниже, чем у самцов – 3.2 ± 0.33 и 7.3 ± 0.56 нг/мл соответственно (р < 0.001, здесь и далее по U-критерию Манна–Уитни) (рис. 2а). Среднесуточная концентрация E у самок выше (р < 0.01), чем у самцов – 137.0 ± 12.10 и 82.3 ± 5.95 пг/мл соответственно (рис. 2б).
Рис. 2.
Суточная динамика Ts (а), E (б) и их соотношение (Ts/Е) (в) в крови самок (1) и самцов (2) радужной форели. Остальные обозначения, как на рис. 1.
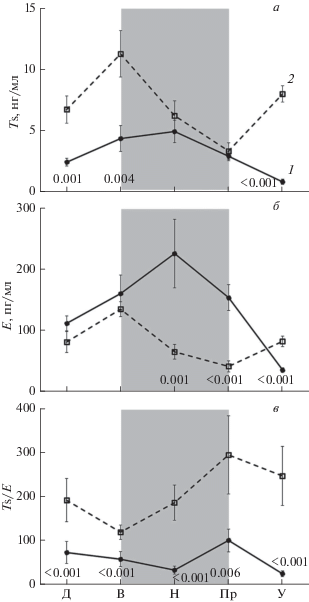
У самок показатель Ts/E заметно ниже (р < 0.001), чем у самцов – 61.8 ± 9.71 и 205.4 ± 25.19 соответственно (рис. 2в). Как у самок, так и у самцов Ts/E достигает максимума перед рассветом.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Была выявлена cуточная динамика концентраций в крови тиреоидных и половых стероидных гормонов у радужной форели в возрасте 14 мес. Она была обусловлена как общими физиологическими процессами, приуроченными к определенному суточному ритму, так и индивидуальными различиями в физиологическом состоянии рыб.
Уровень тиреоидных и половых стероидных гормонов в крови различался у самок и самцов в зависимости от времени суток – по концентрациям T4, T3 и E суточная динамика находилась в противофазе. Динамика показателя Ts/E в течение суток у самок и самцов выражалась на разном количественном уровне, средние значения показателя в любой интервал наблюдений у самок выше, чем у самцов. Следовательно, показатель Ts/E может быть использован для прижизненного определения пола рыб при отсутствии внешних морфологических признаков полового диморфизма. Суточные изменения показателя Т4/Т3, напротив, не были связаны с половым диморфизмом и, вероятно, указывали на сходный процесс дейодирования у самок и самцов радужной форели в течение суток.
Уровень тиреоидных и половых стероидных гормонов у самцов радужной форели повышался в светлое время и снижался ночью. У самок повышение тиреоидных гормонов происходило в ночное время, а снижение – в утреннее. Полученные результаты частично согласуются с литературными данными. Известно, что у пестряток атлантического лосося Salmo salar L. T4 повышается в светлое время, а T3 снижается [7]. На примере канального сомика Ictalurus punctatus (Rafinesque, 1818) показано, что летом (июль) уровни в крови Т3 и Т4 в светлое время суток (с утра до вечера) повышаются более, чем в 2 раза [10]. Авторы указанных работ не обнаружили половых различий по суточной динамике тиреоидных гормонов.
Отметим общие закономерности в суточной динамике исследованных гормонов у радужной форели и близкородственного вида – черноморской кумжи Salmo trutta labrax (Pallas, 1814) [1]. Для самок и самцов как одного, так и другого вида характерно суточное изменение уровня тиреоидных гормонов в противофазе (обратная зависимость). У радужной форели и черноморской кумжи совпадают временные интервалы изменения концентраций Т3 и значений Т4/Т3 (максимумы) у самцов и уровня Ts (минимумы) у самок.
Выводы. Таким образом, в суточной динамике концентраций гормонов, исследованных в крови радужной форели, выражен половой диморфизм. У самцов суточная динамика концентраций тиреоидных и половых стероидных гормонов совпадает – наблюдается прямая корреляция между изменениями уровня гормонов. У самок прослеживается как прямая, так и обратная зависимость (в вечерние часы). Суточная динамика тиреоидных гормонов отражает ряд процессов, происходящих в организме, один из которых – миграционное поведение рыб [7].
БЛАГОДАРНОСТИ
Авторы выражают благодарность сотрудникам Приморского отделения Российско-вьетнамского тропического научно-исследовательского и технологического центра за помощь при сборе материала; Д.С. Павлову и М.И. Шатуновскому (Институт проблем экологии и эволюции РАН) за ценные замечания по тексту рукописи.
Список литературы
Ганжа Е.В., Павлов Е.Д., Костин В.В. Павлов Д.С. Суточная динамика тиреоидных и половых стероидных гормонов в крови годовиков жилой формы черноморской кумжи Salmo trutta labrax // Изв. РАН. Сер. биол. 2015. № 1. С. 90–94.
Павлов Е.Д., Ганжа Е.В., Нгуен Вьет Туи, Нгуен Ти Хуан Ту. Состояние половых желез годовиков триплоидной радужной форели в высокогорных условиях южного Вьетнама при воздействии андрогенного гормона // Вопр. ихтиологии. 2013. Т. 53. № 6. С. 726–740.
Павлов Е.Д., Нгуен Вьет Туи, Нгуен Ти Хуан Ту. Состояние половых желез молоди триплоидной форели Oncorhynchus mykiss в условиях южного Вьетнама после искусственной инверсии пола // Вопр. ихтиологии. 2010. Т. 50. № 5. С. 675–684.
Comeau L.A., Campana S.E. Correlations between thyroidal and reproductive endocrine status in wild Atlantic cod // Can. Techn. Rept. Fish. Aquat. Sci. 2006. № 2682. 14 p.
Cyr D.G., Eales J.G. Interrelationships between thyroidal and reproductive endocrine systems in fish // Fish Biol. and Fisher. 1996. V. 6. P. 165–200.
Dolomatov S.I., Kubyshkin A.V., Kutia S.A., Zukow W. Role of thyroid hormones in fishes // J. Health Sci. 2013. V. 3. № 9. P. 279–296.
Ebbesson L.O.E., Bjornsson B.T., Ekstrom P., Stefansson S.O. Daily endocrine profiles in parr and smolt Atlantic salmon // Comp. Biochem. Physiol. 2008. V. 151. № 4. P. 698–704.
https://www. fishbase.org/Summary/SpeciesSummary.php?ID=239&AT=rainbow+trout.
Hulbert A.J. Thyroid hormones and their effects a new perspective // Biological review. 2000. V. 75. P. 519–631.
Loter T.C., MacKenzie D.S., McLeese J., Eales J.G. Seasonal changes in channel catfish thyroid hormones reflect increased magnitude of daily thyroid hormone cycles // Aquaculture. 2007. V. 262. P. 451–460.
MacCrimmon H.R., Gordon J.D. Salmonid spawning runs and estimated ova production in Normandale Creek of Lake Erie // J. Great Lakes Res. 1981. V. 7. P. 155–161.
MacCrimmon H.R., Gots B.L. Rainbow trout in the Great Lakes // Ontario Ministry of Natural Resources. 1972. 66 p.
Nelson E.R., Allan E.R., Pang F.Y., Habibi H.R. Thyroid hormone and reproduction: regulation of estrogen receptors in goldfish gonads // Mol. Reprod. Dev. 2010. V. 77. № 9. P. 784–794.
Pavlov D.S., Ganzha E.V., Nemova N.N. et al. The Level of Thyroid and Sex Steroid Hormones in the Brown Trout Salmo trutta in Three Rivers of Karelia // Inland Water Biol., 2019. V. 12. № 2. P. 225–230. doi 10.1134/S1995082919020111.
Shields C.A., Eales J.G. Thyroxine 5'-monodeiodinase activity in hepatocytes of rainbow trout, Salmo gairdneri: distribution, effects of starvation, and exogenous inhibitors // Gen. Comp. Endocrinol. 1986. V. 63. P. 334–343.
Stolz J., Schnell J. Trout. Pennsylvania: Stackpole Books, 1991. 370 p.
Дополнительные материалы отсутствуют.
Инструменты
Биология внутренних вод


