Биология внутренних вод, 2019, № 3, стр. 73-79
Влияние NaCl на фотосинтетические показатели и структурные компоненты мембран макрофита Hydrilla verticillata (L.f.) Royle
О. А. Розенцвет 1, *, В. Н. Нестеров 2, Е. С. Богданова 1, 2, О. Н. Макурина 1
1 Институт экологии Волжского бассейна Российской академии наук
445003 Тольятти, ул. Комзина, 10, Россия
2 Самарский национальный исследовательский университет им. акад. С.П. Королева
443086 Самара, ул. Потапова, 64, Россия
* E-mail: olgarozen55@mail.ru
Поступила в редакцию 26.04.2018
После доработки 29.10.2018
Принята к публикации 27.11.2018
Аннотация
Исследовано влияние разных концентраций NaCl на фотосинтетические показатели и структурные компоненты мембран Hydrilla verticillata (L.f.) Royle. Действие NaCl в диапазоне концентраций 5–10 г/л в течение 24 ч приводило к увеличению фотосинтеза, содержания пигментов и перестройке липидных компонентов мембран. Концентрация NaCl 20 г/л оказывала выраженный негативный эффект на мембранную проницаемость и фотосинтез растений. В гликолипидах отмечено снижение относительного содержания моногалактозилдиацилглицерина, увеличение дигалактозилдиацилглицерина и сульфолипида. В фосфолипидах с увеличением концентрации NaCl уменьшалось относительное содержание фосфатидилхолина, фосфатидилэтаноламина, фосфатидилинозита и повышался вклад фосфатидилглицерина. Изменение стеринового компонента связано со снижением концентрации стигмастерина и увеличением β-ситостерина. Адаптивные перестройки в составе пигментов и структуре мембран свидетельствуют о высокой функциональной активности фотосинтетического аппарата H. verticillata, что позволяет данному виду реализовать устойчивость в засоленных экотопах.
ВВЕДЕНИЕ
Высшие водные растения – макрофиты – одни из основных продуцентов органического вещества и утилизаторов солнечной энергии нашей планеты. Это пищевой ресурс и местообитание для нематод, моллюсков, ракообразных, насекомых, некоторых рыб, водных и наземных птиц и животных. Многие виды водных растений способны изменять гидрохимический состав воды, оказывая влияние на численность и состав микроперифитона [6]. Известны факты эффективного использования макрофитов для удаления токсичных металлов из сточных вод, рекреации засоленных водоемов и др. [12, 14]. Однако чрезмерное их развитие ведет к зарастанию водных объектов, постепенному их заболачиванию и обмелению. В естественных экосистемах это приводит к изменению локальных популяций растений и рыб, а в ирригационных системах и каналах – к снижению скорости течения воды [6].
Жизнедеятельность макрофитов и их распространение зависят от многих экологических факторов. Один из них – избыточное засоление водной среды. За последние 50 лет во многих аридных регионах минерализация речных вод выросла в 3–8 раз [5]. Пресноводные макрофиты, такие как Hydrilla verticillata (L.f.) Royle, Potamogeton perfoliatus L. и Vallisneria americana Michx., способны переносить достаточно высокие концентрации NaCl (1/2 части морской воды), однако они не могут эффективно избавляться от накопленного натрия [19]. Изучение влияния повышенной солености на водные растения необходимо для прогнозирования долгосрочных эффектов увеличения солености на биотические сообщества в водно-болотных угодьях, поймах и реках.
H. verticillata (гидрилла мутовчатая) – погруженный водный макрофит семейства водокрасовых (Hydrocharitaceae). Растения этого семейства отличаются высокой скоростью роста и неприхотливостью к условиям среды. В отличие от морских представителей водокрасовых – родов Enhalus, Thalassia и Halophyla – H. verticillata считается пресноводным видом, но в то же время обладает умеренной галотолерантностью, поскольку может занимать верховья эстуариев с соленостью распресненной морской воды 8–11‰ [18].
H. verticillata может произрастать в воде с различным составом химических веществ, широким диапазоном рН, температур, интенсивности света и трофического состояния (от олиготрофных до эвтрофных озер). Растение относится к факультативным C4-растениям и, наряду с C3-типом фотосинтеза, может индуцировать C4-тип, например, при воздействии низких концентраций CO2 [11, 15]. Все эти качества позволяют H. verticillata легко осваивать новые водные объекты.
В результате интродукции и саморасселения этот вид распространился за пределы первичного ареала и в настоящее время встречается на всех континентах [17]. В естественных условиях произрастает преимущественно в стоячих и медленно текущих водах теплых областей Азии, Африки, Австралии и Европы, а также в северной части Европы, постепенно распространяясь все севернее. Поскольку H. verticillata – трудно контролируемый активно расселяющийся водный макрофит, требуется системное изучение морфологических, физиологических и биохимических показателей, определяющих способность адаптации данного вида к различным экологическим условиям.
Цель работы – выявить влияние различных концентраций NaCl на параметры фотосинтетического аппарата и структурные компоненты мембран макрофита H. verticillata. В задачу исследования входило изучение интенсивности фотосинтеза, пигментного фонда, проницаемости и состава липидов мембран в суточной динамике.
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
Объектом исследования были побеги H. verticillata. Растения выращивали в лабораторных условиях на 5%-ной среде Хогланда–Арнона. Перед началом эксперимента побеги массой 5.0 г разрезали на фрагменты и помещали в вегетационные сосуды с дистиллированной водой объемом 1 л. В опытные варианты добавляли NaCl в концентрациях 5, 10, 20 г/л и инкубировали в течение 24 ч при 10-часовом световом дне и температуре 20°С. Контролем послужили растения, в водной среде которых отсутствовала соль. В эксперименте использовали лампы дневного света типа T5 для аквариума. Спектральный состав лампы аналогичен дневному свету. Условия освещения (1400 мкМ/(м2 · с) соответствовали освещенности в безоблачный солнечный день. Для изучения процесса фотосинтеза растения отбирали через 1, 3, 5, 7, 12 и 24 ч экспозиции. Одновременно проводили три серии экспериментов по одному для каждой концентрации NaCl. Через 24 ч из каждого варианта отбирали три биологические пробы по 0.5–1.5 г сырой массы для каждого вида биохимического анализа.
Интенсивность фотосинтеза оценивали по содержанию кислорода в воде с помощью электрода Кларка [2] и рассчитывали на 1 г сырой массы.
Проницаемость клеточных мембран определяли по выходу электролитов из листьев в дистиллированной воде с использованием кондуктометра (PWT HI98308 pure water test) согласно методу [3].
Содержание пигментов определяли в 90%-ном ацетоновом экстракте на спектрофотометре СФ-46 (“ЛОМО”, Россия) при λ = 662, 645 и 470 нм. Расчет концентрации хлорофиллов (Хл) а, b и каротиноидов (Кар) рассчитывали согласно методу [17].
Экстракцию, разделение, идентификацию и анализ состава липидов проводили по работе [8]. Общее количество липидов определяли по сумме проанализированных отдельно фосфолипидов (ФЛ), гликолипидов (ГЛ) и нейтральных липидов (НЛ).
Растительные стерины (СТ) выделяли из экстракта общих липидов с помощью тонкослойной хроматографии (ТСХ) и анализировали на газовом хроматографе (“Хроматэк. Кристалл 5000.1”, Россия) с использованием стеклянной колонки длиной 2 м и диаметром 3 мм (5% SE-30). Температура колонки − 230°С, испарителя и детектора – 290°С. Скорость тока газа-носителя (гелия) − 60 мл/мин.
Жирные кислоты (ЖК) анализировали в виде метиловых эфиров, получаемых кипячением в 5%-ном растворе HCl в метаноле в течение 1 ч. Полученные эфиры очищали препаративной ТСХ [7] и анализировали на газовом хроматографе (“Хроматэк. Кристалл 5000.1”, Россия) с использованием капиллярной колонки длиной 105 м и диаметром 0.25 мм (“RESTEK”, США) в изотермическом режиме. Температура колонки 180°С, испарителя и детектора – 260°С. Скорость тока газа-носителя (гелия) 2 мл/мин.
На рисунках и в таблицах приведены М ± m, где М – среднее арифметическое, m – стандартное отклонение от среднего арифметического. Достоверность различий измеряемых величин между контрольными и опытными вариантами оценивали по t-критерию Стьюдента при p < 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
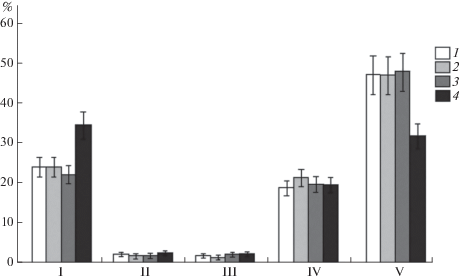
Физиологический ответ H. verticillata на действие NaCl оценивали по интенсивности выделения кислорода растениями, изменению количества фотосинтетических пигментов в листьях и выходу электролитов из клеток. Данные рис. 1 демонстрируют развитие интенсивности процесса фотосинтеза в течение 24 ч в зависимости от концентрации NaCl в среде.
Рис. 1.
Динамика содержания кислорода в воде (мг/л на 1 г сырой массы) при экспозиции H. verticillata с NaCl. К – контроль; по оси абсцисс – концентрация NaCl, г/л; время экспозиции – 1, 3, 5, 7, 12, 24 ч (а–е соответственно).
Содержание кислорода в воде контрольных вариантов варьировало в интервале 4.0–5.2 мг/л из расчета на г сырой массы растений. В первые 7 ч экспозиции растений с NaCl (при всех исследованных концентрациях) содержание кислорода увеличилось в 1.5–2 раза по сравнению с контролем. Через 12 ч двукратное увеличение кислорода сохранялось при концентрации NaCl 5 мг/л и снижалось при более высоких концентрациях, но оставалось выше контроля. Только при концентрации NaCl 20 г/л содержание кислорода было ниже контрольных значений в 2 раза.
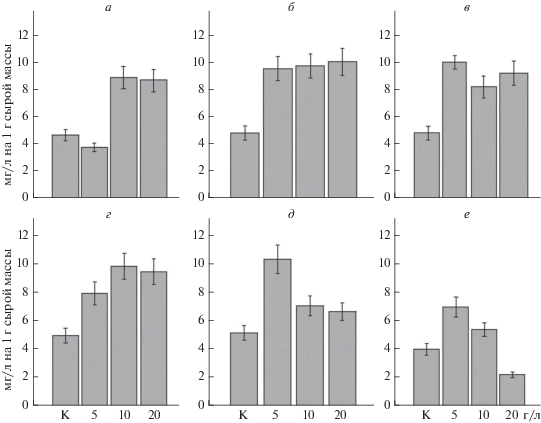
Анализ пигментного состава показал увеличение содержания Хл а и b в 1.5–2.0 раза по сравнению с контролем через 24 ч экспозиции при всех концентрациях NaCI (рис. 2а). При концентрациях 5 и 10 г/л NaCl количество Кар также превышало контрольное значение. Однако при действии концентрации NaCl 20 г/л содержание Кар было сравнимо с таковым в контроле.
Рис. 2.
Содержание фотосинтетических пигментов в листьях, мг/г сырой массы (а) и выход электролитов из клеток, % (б) H. verticillata при разных концентрациях NaCl (г/л). 1 – Хл а, 2 – Хл b, 3 – Кар.
Стабильность клеточных мембран используется для оценки устойчивости разных видов растений к солевому стрессу. Выход электролитов как характеристика проницаемости мембран из клеток листьев контрольных растений не превышал 6%. По мере увеличения концентрации NaCI проницаемость мембран в клетках H. verticillata возрастала. Так, при концентрации NaCI 5–10 мг/л выход электролитов увеличивался в 1.2–1.3 раза, при 20 г/л – в 7.6 раз по сравнению с контролем (рис. 2б).
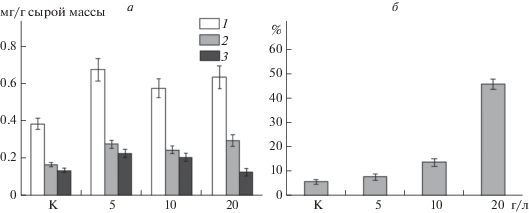
ГЛ, ФЛ и СТ – структурные компоненты мембран. Суммарное содержание липидов в контрольных растениях достигало 4.8 мг/г сырой массы. Содержание ГЛ в них было 2.5 мг/г, НЛ – 1.5 и ФЛ – 1.2 мг/г (рис. 3а). На долю мембранных липидов в контрольных опытах приходилось ~70%. С увеличением концентрации NaCl в воде количество выделенных липидов снижалось и достигало 3.3 мг/г. Соотношение липидов также менялось в сторону снижения мембранных ГЛ и ФЛ (на 18.0–54.0% от контроля) и увеличения доли запасных НЛ. Происходили изменения и в содержании индивидуальных классов липидов (рис. 3б). Во фракции ГЛ снижалось относительное содержание моногалактозилдиацилглицерина (МГДГ) на фоне увеличения дигалактозилдиацилглицерина (ДГДГ) и особенно сульфохиновозилдиацил-глицерина (СХДГ). Так, при концентрации NaCl 20 г/л содержание МГДГ снизилось в 1.3 раза, а содержание СХДГ увеличилось в 2.6 раза.
Рис. 3.
Состав и содержание липидов в листьях H. verticillata при разных концентрациях NaCl (г/л): а – содержание липидов (1 – гликолипиды, 2 – фосфолипиды, 3 – нейтральные липиды, мг/г сырой массы); б – содержание гликолипидов (1 – моногалактозилдиацилглицерол, 2 – дигалактозилдиацилглицерол, 3 – сульфохиновозилдиацилглицерол, % суммы гликолипидов); в – фосфолипиды (1 – фосфатидилхолин, 2 – фосфатидилэтаноламин, 3 – фосфатидилглицерол, 4 – фосфатидилинозит, 5 – фосфатидная кислота, % суммы фосфолипидов); г – состав стеринов (1 – холестерин, 2 – кампастерин, 3 – стигмастерин, 4 – β-ситостерин, %).
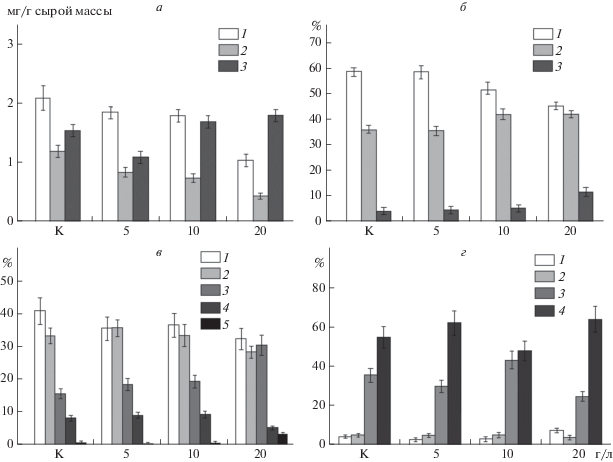
В ФЛ главными липидами были фосфатидилхолин (ФХ), фосфатидилэтаноламин (ФЭ), фосфатидилинозит (ФИ) и фосфатидилглицерин (ФГ). Обнаружены также минорные компоненты – дифосфатидилиглицерин (ДФГ) и фосфатидная кислота (ФК) (рис. 3в). Внесение NaCl в водную среду приводило к снижению относительного содержания ФХ, ФЭ и ФИ на 11–20% и существенному увеличению ФГ, особенно при концентрации NaCl 20 г/л (~ в 2 раза). Эти данные свидетельствуют о структурных изменениях в клеточных мембранах H. verticillata при воздействии NaCl.
В составе СТ присутствуют холестерин, кампестерин, стигмастерин и β-ситостерин (рис. 3г). Последние два типа СТ, как правило, доминируют в листьях высших растений. По результатам проведенных экспериментов отчетливо прослеживается тенденция к снижению концентрации стигмастерина и увеличению β-ситостерина в зависимости от концентрации NaCl.
Анализ ЖК общей липидной фракции, выделенной из H. verticillata, показал, что основную группу ЖК составляют кислоты с длиной цепи 16–18 атомов углерода (рис. 4). Ненасыщенные кислоты (ННЖК) представлены олеиновой (С18:1n9c), линолевой (С18:2n6c) и линоленовой (С18:3n3c) кислотами. Среди насыщенных ЖК (НЖК) доминирует пальмитиновая кислота (С16:0), содержание которой возрастало по мере увеличения концентрации NaCl в среде (22.0–34.0% суммы ЖК) с одновременным уменьшением концентрации линоленовой кислоты (48.0–32.0%).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Влияние NaCl на параметры фотосинтетического аппарата и структурные компоненты мембран растений H. verticillata изучали в интервале концентраций 0–20 г/л. Известно, что в зависимости от количества растворенных солей различают пресную воду (<0.5‰), солоноватую (0.5–16‰), морскую (16–47‰) и пересоленную (>47‰) [4]. Таким образом, в наших экспериментах концентрация соли варьировала от значений в пресных водах (контроль) до значений в морских водах (20 г/л).
Полученные в модельных экспериментах результаты показали, что растения довольно быстро реагируют на присутствие соли в среде. При концентрации NaCl 10–20 г/л ответная реакция наступает уже через 1 ч, при малой концентрации – позднее, но сохраняется в течение более длительного времени. Повышенный уровень фотосинтеза наблюдали на протяжении 24 ч при инкубации растений в присутствии 5 г/л NaCl. И только при концентрации 20 г/л зарегистрировано двукратное снижение выделенного кислорода. Вероятно, увеличение интенсивности фотосинтеза – проявление активной адаптации растений H. verticillata к действию NaCl. Интенсификация данного процесса проходила, в том числе, за счет увеличения концентрации пигментов Хл и Кар. Для некоторых видов водных растений, например, Ceratophyllum demеrsum L., обнаружено снижение содержания Хл в интервале концентраций NaCl 20–80 мМ [13]. Аналогичная зависимость отмечена у Salvinia molesta и Pistia stratiotes [21]. Однако у одноклеточной водоросли Navicula sp. увеличение количества Хл и Кар было при концентрации NaCl 1.7 М [10]. Поскольку растения H. verticillata способны индуцировать C4 тип фотосинтеза, не исключено, что интенсификация фотосинтеза при действии NaCl также связана с переходом с одного типа фотосинтеза на другой [11, 16].
Результаты наших экспериментов показали также, что добавление NaCl в водную среду приводило к увеличению выхода электролитов – показателя проницаемости мембран, т.е. к изменению в соотношении гидрофобных/гидрофильных зон в мембране, что приводит к увеличению как выхода, так и поступления ионов воды и других молекул в клетку. Однако выход электролитов при концентрациях 5–10 г/л NaCl не превышал 15–20% в сравнении с контролем, что говорит об устойчивости мембранных систем к данному диапазону концентраций соли.
Изменение проницаемости клеточных мембран связывают, в первую очередь, со структурными изменениями липидов. Так, из рис. 3б видно, что в липидах листьев контрольных вариантов отношение МГДГ/ДГДГ (главных компонентов тилакоидных мембран) было 1.6. Присутствие NaCl в водной среде приводило к уменьшению данного параметра до 1.1. Происходящие взаимозаменяемые и взаимозависимые изменения в соотношении данных липидов в мембранах H. verticillata, по-видимому, способствуют перестройке структуры и фотохимической активности хлоропластов. Полученные результаты подтверждают данные о том, что соотношение индивидуальных ГЛ пластично и может меняться в зависимости от вида растений и количества солей в среде [9]. Например, в ответ на действие NaCl по мере возрастания галофильности в разных группах растений снижалось отношение МГДГ/ДГДГ, а у галофитов Aster tripolium L. и Sesuvium portulacastrum (L.) увеличивалось содержание СХДГ с ростом концентрации NaCl в среде.
Для ФЛ, кроме снижения количественного содержания, наиболее заметные изменения отмечены для ФГ, который подобно СХДГ участвует в процессе формирования гран тилакоидов и обеспечивает оптимальную конфигурацию мембран для активного электронного транспорта [14]. Увеличение доли этих липидов в составе ГЛ и ФЛ также направлены на поддержание структуры фотосинтезирующего аппарата.
Наличие СТ в составе липидов оказывает стабилизирующее воздействие на мембраны и способствует упорядочению структурных компонентов. По показателю отношения ФЛ/СТ судят о чувствительности растений к солевому воздействию [9]. В контрольных вариантах наших экспериментов отношение ФЛ/СТ достигало 3.4. Под влиянием высокой концентраций соли значение данного показателя уменьшалось до 1.1 из-за снижения содержания ФЛ и повышения СТ. В результате солевого стресса в мембранах наземных растений увеличивается содержание CТ как следствие адаптационного процесса [1]. Различные модуляции СТ приводят к изменениям в составе других мембранных липидов и в результате влияют на проницаемость и функционирование мембран. Экспериментально доказано, что встраивание стигмастеринов в мембраны между ненасыщенными цепями ЖК имеет меньшую степень упорядоченности по сравнению с β-ситостерином [1]. Следовательно, увеличение доли β-ситостерина направлено на регуляцию состояния мембран. Можно заключить, что СТ, подобно ГЛ и ФЛ – активные участники механизма реорганизации мембранного аппарата H. verticillata в ответ на действие засоления.
Высокие концентрации NaCl по-разному влияют на содержание ЖК растений. Показано [7], что у многоклеточной макроводоросли Ulva intestinalis (L.) высокая степень солености воды способствует увеличению относительного содержания ННЖК, главным образом С18:3n3c и С18:4. С другой стороны, в липидах микроводоросли Dunaliella с увеличением солености среды количество ННЖК уменьшалось, особенно С18:3n3c [21]. Снижение степени ННЖК направлено на большую структурированность мембраны и способствует более эффективному контролю ее проницаемости для ионов Na+ и Cl–.
Выводы. Полученные данные позволяют заключить, что одна из первых реакций водного растения H. verticillata на действие NaCl – увеличение интенсивности фотосинтеза, регистрируемого по количеству выделенного кислорода. Направленность физиолого-биохимических ответных реакций у H. verticillata зависит от концентрации NaCl. Действие малых концентраций в диапазоне 5–10 г/л в течение 24 ч приводит к увеличению содержания пигментов, перестройке липидных компонентов мембран и интенсификации фотосинтетической функции. Более высокая концентрация NaCl (20 г/л) оказывает выраженный негативный эффект на мембранную проницаемость и фотосинтез растений при повышенном уровне Хл. Адаптивные перестройки в составе пигментов и структуре мембран свидетельствуют о высокой функциональной активности фотосинтетического аппарата H. verticillata, что повышает устойчивость данного вида в засоленных экотопах.
Список литературы
Валитова Ю.Н. Связывание стеринов влияет на функционирование мембран и состав сфинголипидов в корнях пшеницы // Биохимия. 2010. Т. 75. № 5. С. 644–653.
Гавриленко В.Ф., Жигалова Т.В. Большой практикум по фотосинтезу. М.: Академия, 2003. 256 с.
Гришенкова А.С., Лукаткин Н.Н. Определение устойчивости растительных тканей к абиотическим стрессам с использованием кондуктометрического метода // Поволж. экол. журн. 2005. № 1. С. 3–11.
Грищенко Л.И., Акбаев М.Ш., Васильков Г.В. Болезни рыб и основы рыболовства. М.: Колос, 1999. 456 с.
Ковда В.А. Проблемы опустынивания почв аридных регионов мира. М.: Наука, 2008. 415 с.
Матвеев В.И., Соловьева В.В., Саксонов С.В. Экология водных растений. Самара: Изд-во Самар. науч. центра РАН, 2005. 282 с.
Нестеров В.Н., Розенцвет О.А., Богданова Е.С. Влияние абиотических факторов на состав жирных кислот Ulva intestinalis // Сиб. экол. журн. 2013. № 4. С. 587–594.
Нестеров В.Н., Розенцвет О.А., Мурзаева С.В. Изменение состава липидов у пресноводного растения Hydrilla verticillata (L.f.) Royle в условиях аккумуляции и элиминации ионов тяжелых металлов // Физиол. растений. 2009. Т. 56. № 1. С. 85–93.
Розенцвет О.А., Нестеров В.Н., Богданова Е.С. Структурные и физиолого-биохимические аспекты солеустойчивости галофитов // Физиол. растений. 2017. Т. 64. № 4. С. 251–265.
Al-Hasan R.H., Ali A.M., Ka’wash H.H., Radwan S.S. Effect of salinity on the lipid and fatty acid composition of the halophyte Navicula sp.: potential in mariculture // J. Appl. Phycol. 1990. V. 2. P. 215–222.
Bowes G. Single-cell C4 photosynthesis in aquatic plants // C4 photosynthesis and related CO2 concentrating mechanisms. Dordrecht; Netherlands: Springer, 2011. P. 63–80.
Chen V., Zhang L.-L., Tuo Y.-C. et al. Treatability thresholds for cadmium-contaminated water in the wetland macrophyte Hydrilla verticillata (L.f.) Royle // Ecol. Eng. 2016. V. 96. P. 178–186.
Dogan M., Demirors Saygideger S. Physiological effects of NaCl on Ceratophyllum demersum L., a submerged rootless aquatic macrophyte // Iran. J. Fish. Sci. 2018.V. 17. P. 346–356.
Kobayashi I.K., Endo K., Wada H. Roles of lipids in photosynthesis // Lipids in plant and algae development. Switzerland: Springer Int. Publ., 2016. P. 21–49.
Kumar J.I.N., Soni H., Kumar R.N., Bhatt I. Macrophytes in phytoremediation of heavy metal contaminated water and sediments in Pariyej community reserve, Gujarat, India // Turk. J. Fish. Aquat. Sci. 2008. V. 8. P. 193–200.
Leegood R.C. C4 photosynthesis: principles of CO2 concentration and prospects for its introduction into C3 plants // J. Exp. Bot. 2002. V. 53. P. 581–590.
Lichtenthaler K., Welburn A.R. Determination of total carotenoids and chlorophylls a and b of leaf extracts in different solvents // Biochem. Soc. Transact. 1983. V. 11. P. 591–592.
Madeira P.T., Jacono C.C., Van T.K. Monitoring Hydrilla using two RAPD procedures and the nonindigenous aquatic species database // J. Aquat. Plant Manag. 2000. V. 38. P. 33–40.
True-Meadows S., Haug E.J., Richardson R.J. Monoecious Hydrilla – A review of the literature // J. Aquat. Plant Manag. 2016. V. 54. P. 1–11.
Twilley R.R., Barko J.W. The growth of submersed macrophytes under experimental salinity and light conditions // Estuaries. 1990. V. 13. P. 311–321.
Upadhyay R.K., Panda S.K. Salt tolerance of two aquatic macrophytes, Pistia stratiotes and Salvinia molesta // Biol. Plantar. 2005. V. 49. P. 157–159.
Xu X.-Q., Beardall J. Effect of salinity on fatty acid composition of a green microalga from an antarctic hypersaline lake // Phytochemistry. 1997. V. 45. P. 655–658.
Дополнительные материалы отсутствуют.
Инструменты
Биология внутренних вод