Биология внутренних вод, 2019, № 3, стр. 100-103
Экспериментальное изучение влияния времени нахождения на суше экскрементов околоводных птиц на численность Copepoda и плодовитость Cladocera
Н. С. Шевченко 1, И. В. Чалова 1, О. Л. Цельмович 1, Н. Н. Жгарева 1, А. В. Крылов 1, *, М. Е. Елизаров 1
1 Институт биологии внутренних вод им. И.Д. Папанина Российской академии наук
152742 пос. Борок, Некоузский р-н, Ярославская обл., Россия
* E-mail: krylov@ibiw.yaroslavl.ru
Поступила в редакцию 01.11.2017
После доработки 15.09.2018
Принята к публикации 27.11.2018
Аннотация
В ходе проведения лабораторного эксперимента в микрокосмах показано, что поступление экскрементов околоводных птиц в воду способствовало повышению численности Copepoda. При увеличении сроков высушивания экскрементов на воздухе ее численность сокращалась, но оставалась выше контрольных величин. Плодовитость Cladocera (по результатам биотестирования на Ceriodaphnia dubia Richard) возрастала при увеличении сроков пребывания экскрементов на воздухе. Предположено, что преобладание той или иной группы Crustacea определяется временем нахождения экскрементов на суше и поступления их в воду. Его увеличение приводит к снижению соотношения азота и фосфора в экскрементах, соответственно в воде и, как следствие, в кормовых объектах ракообразных.
Известно, что обилие той или иной группы планктонных ракообразных зависит не только от контроля снизу и сверху, но и от стехиометрического соотношения азота и фосфора в их кормовых объектах [7, 8, 14]. С высоким содержанием азота в экскрементах [10–12 и др.], поступающих в воду в местах колониальных поселений птиц, мы связываем преобладание в планктоне Copepoda [2]. Однако в ряде случаев в зонах влияния птиц высокого обилия достигают Cladocera. Показано, что определенную роль в этом играет степень зарастания водоема макрофитами, а также время нахождения на суше и поступления продуктов жизнедеятельности птиц (ПЖП) в воду. Об этом косвенно свидетельствуют и установленные связи между количеством атмосферных осадков, способствующих быстрому смыву ПЖП, и обилием Copepoda [2].
Представляло интерес экспериментально оценить влияние времени нахождения ПЖП на суше и их поступления в воду на концентрацию в ней азота и фосфора, обилие Copepoda и плодовитость Cladocera.
Опыт проводили в течение 49 сут в микрокосмах объемом 5 л, в которые помещали ранее отловленных и адаптированных в течение 1 мес взрослых особей Acanthocyclops americanus (Marsh), A. vernalis (Fischer), Eucyclops serrulatus (Fischer), Macrocyclops albidus (Jurine) и Mesocyclops leuckarti (Claus) (всего 15 экз.). В микрокосмах они обитали совместно с Ceriodaphnia dubia Richard и Daphnia magna Strаus. В качестве корма для Cladocera в воду ежедневно добавляли культуру Chlorella vulgaris Beijer, для Copepoda – Paramecium caudatum Ehrenberg.
Эксперимент включал контроль (три повторности) и три варианта опыта (каждый по три повторности). В микрокосмы варианта 1 каждые 7 сут добавляли свежие ПЖП в концентрации 1.5 г/л, варианта 2 – аналогичную навеску ПЖП, лежавших в тени на воздухе 7 сут, варианта 3 – находившихся на суше 14 сут. В качестве ПЖП использовали экскременты уток Anas platyrhynchos Linnaeus, выращиваемых на кормах, включающих рыбу, а также периодически питающихся в естественном водоеме рясками, водными беспозвоночными и земноводными.
Один раз в 7 сут из всех микрокосмов каждого варианта опыта отбирали интегральную пробу воды для определения концентрации азота и фосфора [1, 4], в начале и в конце эксперимента также для биотестирования на Ceriodaphnia dubia [6]. Исследуемую воду процеживали через газ с размером ячеи 64 мкм, животных, попавших в сачок, выпускали обратно. Веслоногих ракообразных собирали в конце эксперимента, процеживая весь объем воды через газ с размером ячеи 64 мкм, и фиксировали 4%-ным формалином. Камеральную обработку проб проводили стандартным методом [5].
Для оценки достоверности различий в численности Copepoda применяли метод Краскела–Уоллиса, результатов биотестирования – LSD-тест, также подсчитывали коэффициент корреляции Спирмена (р < 0.05).
В воде опытных микрокосмов, испытывающих влияние ПЖП, содержание азота и фосфора было выше, чем в контроле (табл. 1). Обнаружена тенденция снижения количества азота и фосфора по мере увеличения сроков пребывания экскрементов на воздухе, при этом достоверно (r = –0.65) сокращалась величина N/P. Известно, что чем дольше экскременты птиц находятся на суше, тем больше они теряют азота [9, 11, 13]. Очевидно, в связи с этим в среднем потери фосфора, поступающего в воду с экскрементами после 7 сут высушивания, составили 0.18 мг/л, после 14 сут – 1.02, в то время как азота – 1.38 и 3.14 мг/л соответственно (табл. 1).
Таблица 1.
Среднее за период проведения опыта содержание в воде азота (N), фосфора (P) и их соотношение в разных вариантах опыта
| Вариант | Nобщ, мг/дм3 | Pобщ, мг/дм3 | N/P |
|---|---|---|---|
| Контроль | 2.93 | 2.05 | 1.43 |
| 1 сут | 7.73 | 5.19 | 1.49 |
| 7 сут | 6.35 | 5.01 | 1.27 |
| 14 сут | 4.59 | 4.17 | 1.10 |
Результаты биотестирования показали, что разовое внесение экскрементов в микрокосмы не оказало стимулирующего или угнетающего влияния на тест-объект Ceriodaphnia dubia (табл. 2). Однако в конце эксперимента во всех опытных вариантах отмечено достоверное увеличение среднего числа отрожденных особей как относительно контрольной величины, так и относительно данных, полученных в его начале. При этом достоверно большая плодовитость рачков зарегистрирована в случае поступления экскрементов, находившихся на воздухе в течение 14 сут.
Таблица 2.
Среднее (M ± SD) количество потомства Ceriodaphnia dubia, отрожденного самкой в течение 7 сут биотестирования воды в начале (нач) и конце (кон) эксперимента в контроле (К) и при поступлении экскрементов в трех вариантах их высушивания (1, 7 и 14-е сутки) и достоверность различий средних (LSD-тест)
| Вариант | Kнач | 1нач | 7нач | 14нач | Kкон | 1кон | 7кон | 14кон |
|---|---|---|---|---|---|---|---|---|
| M ± SD | 10.2 ± 2.6 | 11.8 ± 4.2 | 11.3 ± 3.0 | 12.4 ± 3.7 | 12.1 ± 1.1 | 19.8 ± 1.7 | 22.0 ± 4.3 | 26.9 ± 4.4 |
| Kнач | – | 0.199748 | 0.362455 | 0.075716 | 0.01373 | 0.000000 | 0.000000 | 0.000000 |
| 1нач | – | – | 0.069194 | 0.619178 | 0.263895 | 0.000429 | 0.000000 | 0.000000 |
| 7нач | – | – | – | 0.185669 | 0.080981 | 0.000000 | 0.000000 | 0.000000 |
| 14нач | – | – | – | – | 0.147866 | 0.000000 | 0.000000 | 0.000000 |
| Kкон | – | – | – | – | – | 0.000004 | 0.000000 | 0.000000 |
| 1кон | – | – | – | – | – | – | 0.063142 | 0.000000 |
| 7кон | – | – | – | – | – | – | – | 0.000064 |
| 14кон | – | – | – | – | – | – | – | – |
В микрокосмах с присутствием ПЖП численность Copepoda была значимо выше относительно контрольных. Наибольшей плотностью веслоногих отличались микрокосмы, в которые поступали экскременты первых суток (рис. 1). Однако достоверных различий численности Copepoda в микрокосмах, принимающих ПЖП на 7-е и 14-e сут высушивания, не обнаружено.
Рис. 1.
Средняя к концу эксперимента численность веслоногих ракообразных в контроле (I) и в микрокосмах, в которые поступали экскременты в первые сутки (II), через 7 сут (III) и через 14 сут (IV). 1 – М, 2 – M ± SE, 3 – M ± SD.
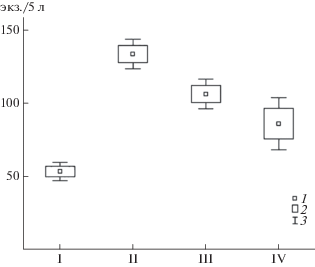
Таким образом, преобладание той или иной группы ракообразных в условиях влияния колоний птиц определяется временем нахождения на суше и поступления их экскрементов в воду. Следствием этого могло быть изменение стехиометрического соотношения азота и фосфора в воде и объектах питания животных, что отмечено в полевых исследованиях [3]. В результате, при быстром поступлении экскрементов, богатых азотом, преимущество получают Copepoda, при долгом нахождении на суше и потере азота – Cladocera.
Итак, при увеличении времени нахождения экскрементов птиц на воздухе в воде, в которую они попадают, снижается количество азота и в меньшей степени фосфора, увеличивается плодовитость ветвистоусых ракообразных. Поступление экскрементов птиц способствует повышению плотности веслоногих ракообразных, однако при увеличении сроков пребывания помета на воздухе их численность сокращается, хотя остается выше, чем в контроле.
БЛАГОДАРНОСТИ
Авторы выражают благодарность Н.В. Елизаровой (ИБВВ РАН) за помощь в проведении эксперимента.
Список литературы
Гапеева М.В., Разгулин С.М., Скопинцев Б.А. Ампульный персульфатный метод определения общего азота в природных водах // Гидрохим. материалы. 1984. Т. 87. С. 67–70.
Крылов А.В., Кулаков Д.В., Чалова И.В., Папченков В.Г. Зоопланктон пресных водоемов в условиях влияния гидрофильных птиц. Ижевск: Издатель Пермяков С.А., 2012. 204 с.
Крылов А.В., Махутова О.Н., Сахарова Е.Г. и др. Неоднозначное влияние поселений околоводных птиц на биохимический состав сестона, планктонных организмов и молоди рыб равнинного водохранилища // Журн. общ. биологии. 2018. Т. 79. № 6. С. 449–460.
Методика выполнения измерений массовой концентрации фосфора общего в пробах природных и очищенных сточных вод фотометрическим методом после окисления персульфатом. ПНД Ф 14.1:2.106-97. Ростов-на-Дону: АКВАРОС, 2004. 12 с.
Методика изучения биогеоценозов внутренних водоемов. М.: Наука, 1975. 240 с.
Методика определения токсичности воды и водных вытяжек из почв, осадков сточных вод, отходов по смертности и изменению плодовитости цериодафний. ФР.1 39.2007.03221. М.: АКВАРОС, 2007. 56 с.
Толомеев А.П. Концепция “экологической стехиометрии” в водных экосистемах: литературный обзор // Сиб. экол. журн. 2006. № 1. С. 13–19.
Andersen T., Hessen D.O. Carbon, nitrogen, and phosphorus content of freshwater zooplankton // Limnol., Oceanogr. 1991. V. 36. P. 807–814.
Bazely D.R., Jefferies R.L. Goose Faeces: A source of nitrogen for plant growth in a grazed salt marsh // J. Appl. Ecol. 1985. V. 22. P. 693–703.
Gould D.J., Fletcher M.R. Gull droppings and their effects on water quality // Water Res. 1978. V. 12. P. 665–672.
Hahn S., Bauer S., Klaassen M. Estimating the contribution of carnivorous waterbirds to nutrient loading in freshwater habitats // Freshwater Biol. 2007. V. 52. P. 2421–2433.
Hahn S., Bauer S., Klaassen M. Quantification of allochthonous nutrient input into freshwater bodies by herbivorous water birds // Freshwater Biol. 2008. V. 53. P. 181–193.
Skrzypek G., Wojtuń B., Richter D. et al. Diversification of nitrogen sources in various tundra vegetation types in the high arctic // PLoS ONE. 2015. V. 10. № 9. P. 3–21.
Sterner R.W., Schulz K.L. Zooplankton nutrition: recent progress and a reality check // Aquat. Ecol. 1998. V. 32. P. 261–279.
Дополнительные материалы отсутствуют.
Инструменты
Биология внутренних вод


