Биология внутренних вод, 2019, № 3, стр. 63-72
Пресноводные моллюски верхнего участка Вятско-Камского междуречья
Т. Г. Шихова 1, *, И. Ю. Митрофанова 2
1 ВНИИ охотничьего хозяйства и звероводства им. проф. Б.М. Житкова
610000 Киров, ул. Преображенская, 79, Россия
2 Пермское отделение “ГосНИОРХ”
614002 Пермь, ул. Чернышевского, 3, Россия
* E-mail: biota.vniioz@mail.ru
Поступила в редакцию 23.12.2016
После доработки 22.11.2018
Принята к публикации 24.12.2018
Аннотация
Обобщены сведения по структуре малакоценозов рек верхнего участка Вятско-Камского бассейна в условиях незарегулированного стока. Малакофауна сформирована преимущественно видами с европейским и европейско-западносибирским типами ареалов (58 видов из девяти семейств). Моллюски характерны для всех бентических комплексов р. Вятка. Максимальное видовое разнообразие зарегистрировано в верховьях реки и представлено в основном Gastropoda (53%). Ниже по течению преобладают Bivalvia (58–71%). Состав Unionidae меняется по продольному профилю реки: в зарастающих верховьях обычны Unio crassus и Pseudanodonta kletti, в русле свободного течения – U. tumidus и U. pictorum. Состав Sphaeriidae относительно стабилен – преобладают Sphaerium radiatum, Pisidium amnicum и S. rivicola. В большинстве бентоценозов рек Вятка и Кама по численности и биомассе доминируют Bivalvia.
ВВЕДЕНИЕ
В условиях зарегулированного стока большинства крупных рек Волжской системы особенно важны сведения о фауне водотоков с естественным гидрологическим режимом.
Большинство исследований малакофауны среднего и нижнего течения Вятки обобщены в работах [4, 6, 10, 22–24]. О верховьях реки сведения отрывочны [22, 23], достаточно емко проанализирована роль моллюсков в бентоценозах р. Вятки лишь на небольшом отрезке между устьями рек Белая Холуница и Чепца [10]. Моллюсков верхнего участка р. Камы ранее исследовали только в пределах Пермского края [11–15, 19, 20].
Цель работы – обобщить сведения по структуре малакоценозов верхнего участка Вятско-Камского междуречья и выявить особенности малакофауны крупных притоков р. Волги в условиях их естественного стока.
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
Характеристика исследованных водотоков. Р. Вятка – главный правобережный приток р. Камы, типично равнинная река длиной 1314 км с преимущественно заболоченной поймой и большим количеством старичных озер. Протяженность верховья реки (до впадения р. Чепца) 576 км, ширина ≤50 м, глубина ≤3–5 м и течение ~0.7 м/с. Грунт галечно-песчаный, местами заиленный, на перекатах – галечно-гравийный. Вода верхнего течения мягкая. Р. Кобра (правый приток р. Вятки) с медленным течением, длина 324 км, ширина ≤85 м, глубина 1.5–3 м; русло песчано-галечное, у берегов илистое с зарослями макрофитов. Р. Белая Холуница (левый приток р. Вятки) длиной 168 км, шириной ≤50 м [16]. Крупный пруд площадью 150 га наполняется реками Белая Холуница и Шелепиха. Р. Кама в верхнем течении – типично равнинная река со спокойным течением (≤0.5 м/с) и развитой системой придаточных водоемов. Ширина русла в верховьях ≤70 м, грунт песчаный с разной степенью заиления, на перекатах – песчано-галечный; вода мягкая [12].
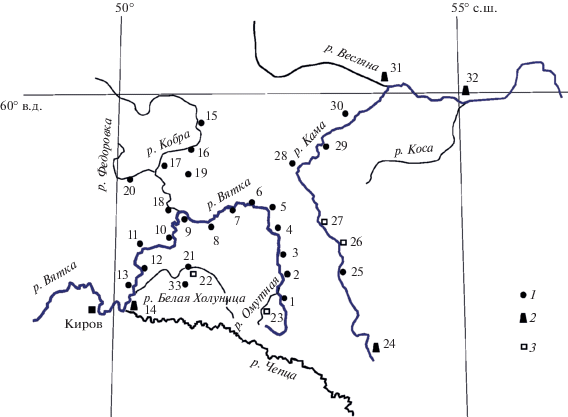
Основные материалы собраны с 1994 г. по 2010 г. в разнотипных водных объектах Вятско-Камского междуречья (русла рек, ручьи, пойменные водоемы, озера, болота). Гидробиологическая съемка в русле р. Вятки проведена в 1995 г. от дер. Загарье до устья р. Белая Холуница на участке протяженностью ~500 км (станции (ст.) 1–13) и в 1998 г. – между устьями рек Белая Холуница и Чепца (ст. 14) (рис. 1). Река Кобра (от дер. Красная Речка до г. Нагорск) и ее притоки (реки Федоровка, Грехневка и Малая Светлица) исследованы в 1994, 1995 и 2002 гг. (ст. 15–20), р. Белая Холуница с притоками (реки Сома и Вохма и др.) и прудом – в 2005, 2010 гг. (ст. 21, 33). Идентифицированы материалы коллекции Кировского краеведческого музея, собранные в 1947 г. в р. Омутная (ст. 23, сбор Г. Мамонова) и в 1949 г. в р. Белая Холуница (ст. 22, сбор А.Д. Фокина), а также в 1926 и 1927 гг. в русле р. Камы у пос. Светлаково (ст. 26, сбор Б.С. Лукаша) и у с. Бисерово (ст. 27, сбор Н.И. Пашкина). Водоемы и водотоки верхней Камы исследованы в 2000 и 2010 гг. (ст. 25, 28–30). Проанализированы литературные источники по фауне моллюсков верхнего течения р. Камы и некоторых ее притоков (ст. 24, 31, 32) [11–15, 19, 20].
Рис. 1.
Места отбора проб: 1–33 – номера станций; 1 – данные авторов, 2 – литературные данные, 3 – коллекция Кировского краеведческого музея.
Пробы отбирали традиционными методами [8, 9]. Обработано 110 малакологических и 58 комплексных проб зообентоса. Идентифицировано >2 тыс. экз. моллюсков с использованием определителей [1–3, 18]. Номенклатура видов, за некоторыми исключениями, дана по работам [26, 27, 30], зоогеографическая характеристика по [5, 17, 25, 28, 30]. Сравнительный анализ проведен с использованием индекса Серенсена (KS) [29].
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
На водосборе верховий рек Вятки и Камы по результатам оригинальных исследований и обработки литературных данных [10–15, 19, 20, 22–24] зарегистрировано 58 видов моллюсков из девяти семейств (Unionidae, Sphaeriidae, Viviparidae, Bithyniidae, Valvatidae, Acroloxidae, Lymnaeidae, Physidae, Planorbidae) (табл. 1).
Таблица 1.
Видовой состав моллюсков бассейнов верхнего течения рек Вятки и Камы
| Виды | Бассейн р. Вятки | Бассейн р. Камы | Ареал | ||||||
|---|---|---|---|---|---|---|---|---|---|
| р. Вятка | р. Кобра | р. Холуница | |||||||
| Р | ПП | Р | ПП | Р | ПП | Р | ПП | ||
| Сем. Unionidae | |||||||||
| Unio (Unio) pictorum (Linnaeus, 1758) | 2, 10 | + | + | – | – | – | 1, 8, 9,+ | – | Е |
| U. (U.) tumidus (Philipsson, 1788) | 2, 10 | – | + | – | – | – | 1, 8, 9 | – | Е |
| U. (Crassiana) crassus Philipsson, 1788 | 10,+ | – | + | – | + | – | 1, 8, 9,+ | – | Е |
| Anodonta cygnea (Linnaeus, 1758) | 10 | – | + | – | + | + | – | – | Е |
| A. zellensis (Gmelin, 1791) | 10 | – | + | – | – | – | – | – | Е |
| A. anatina Linnaeus, 1758 | 10,+ | 10 | + | – | + | – | 1, 8, 9 | – | Е–ЗС |
| Pseudanodonta kletti (Rossmaessler, 1835) | + | – | – | – | – | – | – | – | Е |
| Сем. Sphaeriidae | |||||||||
| Sphaerium (Sphaerium) corneum (Linnaeus, 1758) | 10, + | 10 | + | + | – | + | 3, 8, 9 | + | П |
| Sph. (Cyrenastrum) solidum (Normand, 1844) | + | – | – | – | – | – | 3, 8, 9 | – | Е |
| Sph. (Nucleocyclas) nucleus (Studer, 1820) | 10 | – | – | – | – | – | – | – | Е–ЗС |
| Sph. (N.) radiatum (Clessin in Westerlund, 1877) | 2, 10 | + | – | – | – | – | – | – | Е–ЗС |
| Sph. (Rivicoliana) rivicola (Lamarck, 1818) | 2, 10 | – | + | – | – | – | 1, 4, 9 | – | Е–ЗС |
| Pisidium (Pisidium) amnicum (Müller, 1774) | 2, 10 | – | – | – | + | + | 3, 8, 9 | – | Е–С |
| P. (Neopisidium) sp. | + | – | – | – | – | – | – | – | Е |
| Euglesa (Euglesa) personata (Malm, 1855) | – | + | – | – | – | – | – | – | Е |
| E. (E.) ponderosa (Stelfox, 1918) | – | – | – | – | + | – | + | – | Е–ЗС |
| E. (Henslowiana) supina (A. Schmidt, 1850) | + | – | – | – | – | – | – | – | E |
| E. sp. | 2 | – | – | – | – | – | 1, 6, 9 | – | – |
| Сем. Viviparidae | |||||||||
| Viviparus (Viviparus) viviparus (Linnaeus, 1758) | 2, 10 | 10 | – | – | – | – | 1, 4, 6 | – | Е |
| V. (Contectiana) contectus (Millet, 1813) | – | 10 | + | + | + | + | – | + | Е–ЗС |
| Сем. Bithyniidae | |||||||||
| Bithynia (Bithynia) tentaculata (Linnaeus, 1758) | 10 | 10 | – | – | – | + | 1, 8, 9 | + | Е |
| B. (Opistorchophorus) troschelii (Paasch, 1842) | – | + | + | + | – | – | 1, 8, 9,+ | + | Е–ЗС |
| Сем. Valvatidae | |||||||||
| Valvata (Cincinna) piscinalis O.F. Müller, 1774 | + | + | – | – | – | – | 1, 6 | + | Е–ЗС |
| V. (C.) ambigua Westerlund, 1873 | + | – | – | – | – | – | + | – | Е–ЗС |
| V. (Atropidina) pulchella Studer, 1820 | + | + | – | – | – | – | – | – | Е–ЗС |
| V. (Sibirovalvata) sibirica Middendorff, 1851 | – | – | – | – | – | – | – | + | С–СЕ |
| Сем. Acroloxidae | |||||||||
| Acroloxus (Acroloxus) lacustris (Linnaeus, 1758) | + | + | – | – | – | – | – | + | П |
| A. (A.) oblongus (Lightfoot, 1786) | – | + | – | – | – | – | – | – | Е–ЗС |
| Сем. Lymnaeidae | |||||||||
| Lymnaea (Lymnaea) stagnalis (Linnaeus, 1758) | + | 10, + | – | + | – | + | 1, 5, 7–9 | + | П |
| Stagnicola (Stagnicola) palustris (O.F. Müller, 1774) | – | + | – | – | – | – | – | 5, + | Е–ЗС |
| S. (S.) atra (Schrank, 1803) | – | + | – | – | – | – | 1, 7–9 | – | Е–С |
| S. (S.) turricula (Held, 1836) | – | – | + | + | – | – | – | – | Е |
| Galba (Galba) truncatula (O.F. Müller, 1774) | – | + | – | + | – | + | – | + | Е–ЗС |
| Myxas glutinosa (O.F. Müller, 1774) | – | + | – | – | – | – | – | 5, + | Е–ЗС |
| Radix (R.) auricularia (Linnaeus, 1758) | + | + | – | – | – | – | 1, 8, 9 | – | П |
| R. (R.) parapsilia Vinarski et Gloer, 2009 | – | + | + | + | – | – | 1, 8, 9 | + | Е–С |
| R. (Peregriana) peregra (O.F. Müller, 1774) | – | + | – | + | – | – | – | – | Е |
| R. (P.) monnardi (Hartmann, 1841) | – | – | + | + | – | – | – | – | Е |
| R. (P.) balthica (Linnaeus, 1758) | + | + | + | + | + | + | 1, 5, 8, 9 | + | Е–С |
| R. (P.) intermedia (Lamarck, 1822) | – | – | – | + | – | – | 1, 8, 9 | – | Е–С |
| R. (P.) lagotis (Schrank, 1803) | + | + | – | – | + | – | 1, 9 | + | Е–С |
| R. (P.) tumida (Held, 1836) | + | + | + | – | – | – | 1, 9 | – | Е–ЗС |
| Сем. Physidae | |||||||||
| Physa fontinalis (Linnaeus, 1758) | + | + | – | – | – | – | – | 9, + | П |
| Aplexa hypnorum (Linnaeus, 1758) | – | + | – | – | – | – | – | 9, + | Е–ЗС |
| Сем. Planorbidae | |||||||||
| Planorbis (Planorbis) planorbis (Linnaeus, 1758) | – | 10 | – | + | + | + | 8 | 1, + | Е–ЗС |
| P. (P.) umbilicatus (Müller, 1774) | – | – | – | – | – | – | 1, 8, 9 | – | Е–ЗС |
| Anisus (Anisus) dazuri (Morch, 1868) | – | + | – | – | – | – | – | + | Е |
| A. (Disculifer) vortex (Linnaeus, 1758) | – | 10 | – | – | – | – | 1, 8, 9 | + | Е–ЗС |
| Armiger crista (Linnaeus, 1758) | – | + | – | – | + | – | – | – | Е |
| Bathyomphalus contortus (Linnaeus, 1758) | – | + | – | – | – | – | 1 | + | Е–С |
| Gyraulus (Gyraulus) acronicus (Ferussac, 1807) | – | + | – | – | – | – | 1, 8, 9 | + | П |
| G. (G.) stelmachoetius (Bourguignat, 1860) | + | + | – | – | – | – | – | – | Е–С |
| G. (G.) stroemi (Westerlund, 1881) | – | – | – | – | + | – | – | – | С–СЕ |
| G. (Torquis) laevis (Alder, 1838) | – | + | – | – | – | – | 1, 8, 9 | – | Е |
| Lamorbis (Pseudogyraulus) rossmaessleri (Auerswald in A. Schmidt, 1852) | + | + | – | – | – | – | – | – | Е |
| Ancylus fluviatilis (Müller, 1774) | + | – | – | – | + | – | + | – | Е |
| Planorbarius corneus (Linnaeus, 1758) | – | 10, + | + | + | + | + | 1, 9 | 9, + | Е–С |
| Segmentina distinguenda (Gredler, 1859) | – | + | – | – | – | – | – | + | Е |
| Количество видов в русле и пойме | 31 | 37 | 16 | 13 | 13 | 10 | 31 | 23 | |
| Количество видов в бассейне реки | 55 | 41 | |||||||
| Общее количество видов | 58 | ||||||||
Примечание. Р – русло водотоков, ПП – пойменные и придаточные водоемы. Типы ареалов: Е – европейский, Е–ЗС – европейско-западносибирский, Е–С – европейско-сибирский, С–СЕ – сибирско-североевропейский, П – палеарктический. “+” – наличие вида по оригинальным данным, 1–10 – наличие вида по литературным источникам (1 – [7], 2 – [10], 3 – [11], 4 – [12], 5 – [13], 6 – [14], 7 – [15], 8 – [19], 9 – [20], 10 – [23]), “–” – отсутствие данных.
Малакофауна бассейна верхней Вятки включает 18 видов Bivalvia и 38 видов Gastropoda. В истоке реки (ст. 1–3) до 60% акватории зарастает высшей водной растительностью, представленной моносообществами Potamogeton, Nymphaea lutea (L.), Elodea canadensis Michx., Equisetum fluviatile L. и ассоциациями Sagittaria sagittifolia L. с Nymphaea lutea (L.). Здесь выявлено 19 видов моллюсков: Unio crassus, Pseudanodonta kletti, Sphaerium solidum, Sph. radiatum, Sph. nucleus, Sph. corneum, Pisidium amnicum, P. (Neopisidium) sp., Euglesa sp., Valvata piscinalis, V. pulchella, V. ambigua, Bithynia tentaculata, B. troschelii, Radix auricularia, R. balthica, Ancylus fluviatilis, Gyraulus stelmachoetius, Acroloxus lacustris. Gastropoda составляют ~53% видового разнообразия (рис. 2). На галечных перекатах обычен Ancylus fluviatilis (до 5.08 г/м2), а на участках, непосредственно прилегающих к перекатам, – Sphaerium radiatum (до 10.05 г/м2). На песчано-гравийных грунтах доминируют Sphaerium radiatum и Pisidium amnicum (76.6% биомассы бентофауны). Для песчано-галечных грунтов характерны малакоценозы с доминированием по численности Euglesa (до 100%), а по биомассе – Sphaerium rivicola и Sph. solidum (до 83.3%). На заиленных песках прибрежной зоны по численности преобладают Euglesa (до 71.8%), по биомассе – униониды Pseudanodonta kletti и Unio crassus. Здесь обычен Pisidium amnicum, встречаются Bithynia tentaculata, Valvata pulchella. На долю моллюсков приходится до 98.6% биомассы зообентоса (табл. 2).
Рис. 2.
Динамика видового разнообразия (а), численности (б) и биомассы (в) по продольному профилю р. Вятки. 1 – Gastropoda, 2 – Bivalvia, 3 – доля моллюсков в зообентосе (%).
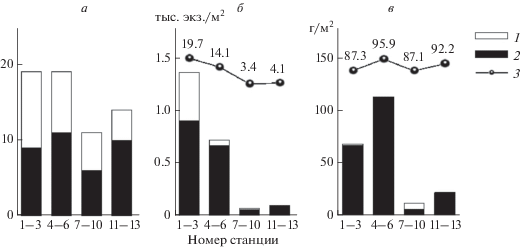
Таблица 2.
Количественные показатели малакоценозов р. Вятки на ст. 1–3
| Классы | Русловая зона | Прибрежная зона | Сообщества макрофитов | ||
|---|---|---|---|---|---|
| плесы | галечные перекаты | песчано-галечный грунт | заиленный песок | ||
| Bivalvia | $\frac{{0.11}}{{5.99}}$ | $\frac{{0.18}}{{5.03}}$ | $\frac{{0.46}}{{0.37}}$ | $\frac{{4.40}}{{521.11}}$ | $\frac{{0.84}}{{60.67}}$ |
| Gastropoda | $\frac{{0.53}}{{0.49}}$ | $\frac{{0.25}}{{2.72}}$ | – | $\frac{{0.76}}{{5.72}}$ | $\frac{{0.23}}{{1.03}}$ |
| Весь зообентос | $\frac{{7.26}}{{14.31}}$ | $\frac{{8.65}}{{46.76}}$ | $\frac{{1.88}}{{2.82}}$ | $\frac{{6.74}}{{534.31}}$ | $\frac{{4.50}}{{74.05}}$ |
| Доля Mollusca в зообентосе, % | $\frac{{8.8}}{{45.3}}$ | $\frac{{5.0}}{{16.6}}$ | $\frac{{24.5}}{{13.1}}$ | $\frac{{76.6}}{{98.6}}$ | $\frac{{23.8}}{{83.3}}$ |
Ниже по течению (ст. 4–6) зарастаемость снижается, меняется и состав малакоценозов – лидирующая роль в видовом разнообразии переходит к двустворчатым моллюскам. На долю Bivalvia приходится 58% из выявленных 19 видов: Unio crassus, U. tumidus, U. pictorum, Pseudanodonta kletti, Anodonta anatina, Sphaerium rivicola, Sph. solidum, Sph. radiatum, Pisidium amnicum, P. (Neopisidium) sp., Euglesa sp., Valvata piscinalis, V. pulchella, Bithynia tentaculata, Radix lagotis, R. balthica, Physa fontinalis, Ancylus fluviatilis, Gyraulus stelmachoetius. На песчано-галечных грунтах русловой зоны доминируют Sphaerium solidum и Sph. rivicola (82.3% биомассы бентоса), на слабозаиленных песчаных и песчано-галечных грунтах открытого прибрежья – Sphaerium radiatum (79.8% биомассы бентоса). В зоне зарослей макрофитов отмечены представители родов Radix, Valvata, Bithynia, Sphaerium, Pisidium; по численности и биомассе преобладают двустворки. Скопления унионид Unio crassus, U. pictorum, U. tumidus местами повышают биомассу бентоса до 4959.36 г/м2. Для данного участка характерно доминирование моллюсков в биомассе зообентоса до 99.3%, в том числе Bivalvia – до 98.7% (табл. 3).
Таблица 3.
Количественные показатели малакоценозов р. Вятки на ст. 4–6
| Классы | Русловая зона | Открытое прибрежье | Сообщества макрофитов |
|---|---|---|---|
| Bivalvia | $\frac{{0.42}}{{36.49}}$ | $\frac{{0.78}}{{14.84}}$ | $\frac{{1.64}}{{1794.38}}$ |
| Gastropoda | $\frac{{0.03}}{{0.19}}$ | – | $\frac{{0.65}}{{10.50}}$ |
| Весь зообентос | $\frac{{8.27}}{{44.32}}$ | $\frac{{2.78}}{{16.90}}$ | $\frac{{4.24}}{{1817.71}}$ |
| Доля Mollusca в бентоценозе, % | $\frac{{5.4}}{{82.7}}$ | $\frac{{28.1}}{{87.8}}$ | $\frac{{54.0}}{{99.3}}$ |
На ст. 7–10, где основные грунты песчаные, песчано-галечные, местами заиленные, а сообщества макрофитов занимают незначительную акваторию, наблюдается обеднение таксономического разнообразия моллюсков, включающее 11 видов: Unio crassus, Sphaerium radiatum, Sph. corneum, Pisidium amnicum, P. (Neopisidium) sp., Euglesa sp., Valvata piscinalis, V. pulchella, Viviparus viviparus, Lymnaea stagnalis, Radix balthica. Качественные и количественные характеристики биоценозов песчано-галечных грунтов варьируют в зависимости от соотношения песка и гальки, размеров галечной фракции, присутствия наилка и скорости течения (табл. 4). На галечно-песчаных грунтах основу бентоценозов составляет Sphaerium radiatum, на чистых песках отмечена Pisidium amnicum. Ядро бентоценозов заиленных песков по биомассе формируют P. amnicum, Sphaerium radiatum, Sph. rivicola, в отдельных пробах – Viviparus viviparus.
Таблица 4.
Количественные показатели малакоценозов р. Вятки на ст. 7–13
| Классы | Песчано-галечные грунты | Песчаные грунты | Заиленный песок | Сообщества макрофитов |
|---|---|---|---|---|
| Ст. 7–10 | ||||
| Bivalvia | $\frac{{0.11}}{{9.13}}$ | $\frac{{0.01}}{{0.02}}$ | $\frac{{0.02}}{{11.26}}$ | $\frac{{0.43}}{{16.33}}$ |
| Gastropoda | $\frac{{0.01}}{{0.07}}$ | – | $\frac{{0.02}}{{29.37}}$ | $\frac{{0.04}}{{22.64}}$ |
| Весь зообентос | $\frac{{1.75}}{{10.99}}$ | $\frac{{0.43}}{{0.39}}$ | $\frac{{6.48}}{{44.92}}$ | $\frac{{1.60}}{{44.00}}$ |
| Доля Mollusca в численности и биомассе бентоценоза, % | $\frac{{6.9}}{{83.7}}$ | $\frac{{2.3}}{{5.1}}$ | $\frac{{0.6}}{{90.5}}$ | $\frac{{29.4}}{{88.6}}$ |
| Ст. 11–13 | ||||
| Bivalvia | $\frac{{0.13}}{{23.92}}$ | $\frac{{0.01}}{{18.40}}$ | $\frac{{0.19}}{{5.89}}$ | $\frac{{0.16}}{{127.46}}$ |
| Gastropoda | $\frac{{0.01}}{{0.07}}$ | – | $\frac{{0.01}}{{0.41}}$ | $\frac{{0.03}}{{8.66}}$ |
| Весь зообентос | $\frac{{2.51}}{{29.15}}$ | $\frac{{1.28}}{{19.03}}$ | $\frac{{4.75}}{{9.43}}$ | $\frac{{4.81}}{{141.72}}$ |
| Доля Mollusca в бентоценозе, % | $\frac{{5.6}}{{82.3}}$ | $\frac{{0.8}}{{96.7}}$ | $\frac{{4.2}}{{66.8}}$ | $\frac{{4.0}}{{96.0}}$ |
В русле р. Вятки на ст. 11–13 зарегистрировано 14 видов: Unio tumidus, U. pictorum, U. crassus, Рseudanodonta kletti, Sphaerium rivicola, Sph. radiatum, Sph. solidum, Sph. nucleus, Pisidium amnicum, Euglesa sp., Viviparus viviparus, Valvata pulchella, Radix balthica, Ancylus fluviatilis [10, 23]. Грунты песчаные, галечно-песчаные, заиленные пески. Основа литопсаммофильного бентоценоза представлена Sphaerium radiatum, псаммофильного – Pisidium amnicum, пелопсаммофильного – Pisidium amnicum, Sphaerium radiatum и Sph. rivicola. На чистых песках встречаются Unio pictorum и U. tumidus.
Динамика малакоценозов по продольному профилю верхнего течения р. Вятки. Моллюски характерны для всех основных бентических комплексов р. Вятки, на заиленных песках и в зарослях макрофитов наблюдается их весовое доминирование (66.8–99.3%). До 96% биомассы зообентоса создают Bivalvia, только на ст. 7–10 Bivalvia и Gastropoda представлены почти в равных долях – 44.5 и 42.7% биомассы соответственно (рис. 2). Среднее обилие двустворчатых – 0.43 тыс. экз./м2 (0.01–4.40 тыс. экз./м2) со средней биомассой 51.86 г/м2 (0.02–1794.38 г/м2). Роль гастропод заметно ниже, обилие и биомасса –0.13 тыс. экз./м2 (0.01–0.76 тыс. экз./м2) и 1.94 г/м2 (0.07–29.37 г/м2) соответственно.
В бассейне р. Кобра зарегистрирован 21 вид из шести семейств (8 – Bivalvia, 13 – Gastropoda) (табл. 1). На песчано-илистом грунте обычны Unio crassus, Anodonta cygnea, A. anatina, Sphaerium rivicola и Radix balthica; на илистом – Anodonta zellensis и Sphaerium corneum; в зарослях макрофитов – Radix balthica, R. monnardi и R. parapsilia; в пойменных и придаточных водоемах на песчано-илистом грунте – Unio pictorum, на илах и растительности – Sphaerium corneum, Viviparus contectus, Bithynia troschelii, Lymnaea stagnalis, Galba truncatula, Stagnicola palustris, Radix peregra, R. balthica, Planorbis planorbis; только на растительности – Stagnicola turricula. Немногочисленны Radix monnardi, R. parapsilia, R. intermedia. Для нижнего течения реки характерны Unio pictorum и U. tumidus.
В притоках р. Кобра (реки Федоровка и Грехневка) на заиленных песках обычна Lymnaea stagnalis, в зарослях макрофитов – Sphaerium corneum, Viviparus contectus, Bithynia troschelii, Planorbarius corneus, во временных водоемах – Planorbis planorbis. В русле р. Малая Светлица на илистом грунте многочисленны Stagnicola turricula (0.06 тыс. экз./м2) и Radix balthica (0.05 тыс. экз./м2), встречаются Sphaerium corneum и Radix parapsilia. В старице р. Большая Светлица на заиленном песке найдена только Galba truncatula.
В бассейне р. Белая Холуница обнаружено 17 видов шести семейств (6 – Bivalvia, 11 – Gastropoda) (табл. 1). В русле реки на заиленных песках отмечен Unio crassus, по коллекционным материалам зарегистрирована Anodonta anatina. В притоках (реки Сома и Вохма) на галечно-каменистых перекатах обычен Ancylus fluviatilis (0.07 тыс. экз./м2), в ассоциациях рдестов на каменистом грунте – Radix lagotis, на заиленных песках – Unio crassus, Planorbis planorbis (0.03 тыс. экз./м2), Radix balthica (0.03 тыс. экз./м2), Galba truncatula и Euglesa ponderosa. Изредка в руслах рек встречается Armiger crista, на заиленных песках р. Вохма – Gyraulus stroemi. В Белохолуницком пруду на заиленном песке и в зарослях макрофитов обычны Viviparus contectus, Bithynia tentaculata, Lymnaea stagnalis, Galba truncatula и Planorbis planorbis.
Малакофауна бассейна верхней Камы включает 10 видов Bivalvia и 31 вид Gastropoda. В список (табл. 1) не вошли Radix fulva и Galba subangulata, упомянутые в работе [19], но не приведенные в сводном перечне малакофауны Пермского края более поздних изданий [7, 20].
В донных сообществах истока р. Камы (ст. 24) моллюски составляют 73.9% биомассы зообентоса. Встречаемость их убывает в ряду: Euglesa (29.6%), Sphaerium rivicola (22.7%), Viviparus viviparus (11.4%), Valvata piscinalis (6.8%), Unio pictorum (2.3%) [14]. В русле реки (ст. 25, 28–30) из унионид обычны Unio pictorum и U. crassus. На ст. 31 и 32 зарегистрированы Unio crassus, U. tumidus, Anodonta anatina [19], Radix tumida, R. auricularia.
В пойменных пелофильных и фитофильных бентоценозах обычны Sphaerium corneum, Viviparus contectus, Bithynia tentaculata, Planorbarius corneus, Lymnaea stagnalis, Myxas glutinosa, Acroloxus lacustris. Единично встречаются Radix balthica, R. parapsilia, R. lagotis. Во временных водоемах на ст. 31 и 32 отмечена Aplexa hypnorum [19].
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Значительная протяженность речных систем затрудняет получение исчерпывающей информации о составе и пространственном распределении бентофауны, но позволяет выявить биотопическую приуроченность ее компонентов, включая моллюсков, к основным бентическим комплексам. Литореофильный комплекс выражен на галечных перекатах в верховьях рек Вятки и Камы, наиболее типичный компонент малакофауны – Ancylus fluviatilis. Литопсаммофильный комплекс на песчано-гравийных и песчано-галечных грунтах русловой зоны характеризуется присутствием Sphaerium rivicola, Sph. solidum, Sph. radiatum, Pisidium amnicum, Euglesa sp. В псаммофильном комплексе прибрежной зоны отмечен Pisidium amnicum, в русле встречаются Unio tumidus и U. pictorum. Пелофильный комплекс прибрежной зоны включает Unio crassus, U. pictorum. U. tumidus, Pseudanodonta kletti, Sphaerium radiatum, Sph. rivicola, Sph. corneum, Pisidium amnicum, Viviparus viviparus, Valvata piscinalis, V. pulchella, Bithynia tentaculata. Фитофильный комплекс характеризуется присутствием Acroloxus lacustris, Lymnaea stagnalis, Valvata pulchella, Bithynia tentaculata, Pisidium amnicum, Sphaerium radiatum, Sph. corneum, местами отмечены скопления Unio crassus, U. pictorum и U. tumidus.
В распределении моллюсков по продольному профилю Вятки прослеживается ряд закономерностей, обусловленных сменой гидродинамического режима реки, типом грунтов и уровнем развития высшей водной растительности (рис. 2). Максимальное видовое разнообразие, плотность и биомасса малакоценозов отмечены в верховье исследованного участка, что объясняется наличием галечных перекатов, высоким уровнем зарастаемости прибрежья и скоплениями унионид в зарослях макрофитов. Ниже по течению на преобладающих песчаных биотопах малакофауна характеризуется качественной и количественной обедненностью. Ближе к истоку реки на участках с повышенной зарастаемостью и заилением прибрежной зоны 53% видового состава моллюсков приходится на Gastropoda; ниже по течению с преобладанием песчаных и песчано-галечных грунтов роль брюхоногих снижается до 29%, а доля Bivalvia возрастает до 71%. Таксономический состав Unionidae меняется по продольному профилю р. Вятки следующим образом: для зарастающих верховий характерны Unio crassus и Рseudanodonta kletti, в русле свободного течения появляются Unio tumidus и U. pictorum. Состав Sphaeriidae, населяющих в основном русловую зону, относительно стабилен – на всем протяжении верхнего течения доминируют Sphaerium radiatum, Pisidium amnicum и Sphaerium rivicola.
Изменение малакофауны Вятки по продольному профилю реки не согласуется с эффектом “вложенности” сообществ (nestedness) [21], предполагающим последовательный рост таксономического разнообразия от истока к устью. Проявление этого эффекта в данном случае возможно только в пограничных зонах соприкосновения бентических комплексов, развивающихся на грунтах разного типа.
По совокупности гидрологических условий, структуре и составу донных сообществ в верхнем течении р. Камы выделяются те же типы бентоценозов, что и в верхней Вятке – литопсаммофильный, псаммофильный, пелопсаммофильный, пелофильный и фитофильный [12]. В русловой зоне р. Камы ≤70% площади речного дна занимают незаиленные песчаные грунты, населенные представителями Euglesa (встречаемость 80–100%). На отдельных участках заиленных песчаных грунтов прибрежной зоны отмечаются скопления Sphaerium rivicola. В зарослях макрофитов обычны Lymnaea stagnalis и Radix auricularia. В пелофильных бентоценозах пойменных водоемов нередок Viviparus viviparus [12, 15].
Внутрибассейновый водораздел между верховьями Камы и ее главным правым притоком – Вяткой – проходит по Верхнекамской возвышенности и крупному верховому болоту Дымное. Русла этих рек сближены до 35 км, притоки питаются водами одного болота и таксономический состав малакофаун очень сходен (KS = 0.8). Однако два вида (Valvata sibirica, Planorbis umbilicatus) пока отмечены только в бассейне Камы, причем Valvata sibirica имеет сибирско-североевропейский ареал. В то же время здесь не выявлены свойственные Вятке европейские виды Anodonta cygnea, Stagnicola turricula, Radix peregra и др. Видовое разнообразие в большей степени создается гастроподами (68% в р. Вятке и 76% в р. Каме).
Исследуемый регион принадлежит Средне-Волжской провинции Европейско-Центрально-Азиатской подобласти Палеарктической области [28]. Палеарктический компонент малакофаун полностью идентичен для верховьев рек Вятки и Камы и представлен Sphaerium corneum, Lymnaea stagnalis, Radix auricularia, Physa fontinalis, Gyraulus acronicus, Acroloxus lacustris. Европейские и европейско-западносибирские виды в совокупности составляют 72% малакофауны р. Вятки и 63% – р. Камы, причем количество европейских видов в бассейне Вятки (39%) превышает таковое в бассейне Камы (25%). Значительна доля видов с европейско-сибирским типом ареала – 15–20%. Характерная особенность исследуемых речных бассейнов – присутствие сибирско-североевропейских видов Valvata sibirica и Gyraulus stroemi (2% малакофауны) в верховьях рек Вятки и Камы, обусловленное общим направлением расселения видов в начале голоцена [5, 17], когда сохранялись широтные межбассейновые связи и в водоемы европейского севера могли проникнуть сибирские виды.
Обнаруженное соотношение зоогеографических компонентов вполне согласуется с данными по Камскому бассейну в целом (без учета р. Вятки) и подтверждает выявленную ранее закономерность уменьшения доли европейских видов моллюсков в восточном и северном направлениях [7, 11, 12].
Выводы. На водосборной территории верхнего участка Вятско-Камского междуречья зарегистрировано 58 видов пресноводных моллюсков из девяти семейств. Видовое разнообразие в большей степени представлено гастроподами (68% в р. Вятке и 76% в р. Каме). Моллюски характерны для всех основных бентических комплексов Вятки. Наибольшая плотность малакоценозов наблюдается в верховье реки и снижается вниз по течению, а величина биомассы подвержена существенным колебаниям из-за локальных скоплений унионид. Максимальное видовое разнообразие отмечено в фитофильных малакоценозах верховьев р. Вятки и на 53% представлено гастроподами. Ниже по течению на песчаных и песчано-галечных грунтах в малакофауне преобладают двустворчатые (58–71%). В верховьях р. Камы наблюдается аналогичная закономерность. Таксономический состав Unionidae меняется по продольному профилю реки Вятки. Для зарастающих верховий характерны Unio crassus и Рseudanodonta kletti, в русле свободного течения появляются Unio tumidus и U. pictorum. Видовой состав Sphaeriidae относительно стабилен – доминируют Sphaerium radiatum, Sph. rivicola и Pisidium amnicum. Фауна пресноводных моллюсков рассмотренных речных бассейнов сформирована широко распространенными видами с европейским и европейско-западносибирским типами ареалов (72% малакофауны Вятки и 63% – Камы). Характерная особенность исследованных речных бассейнов – присутствие сибирско-североевропейских видов Valvata sibirica и Gyraulus stroemi.
Список литературы
Богатов В.В., Кияшко П.В. Класс двустворчатые моллюски // Определитель зоопланктона и зообентоса пресных вод Европейской России. Т. 2: Зообентос. М.; СПб.: Товарищество науч. изданий КМК, 2016. С. 285–334.
Кияшко П.В., Солдатенко Е.В., Винарский М.В. Класс брюхоногие моллюски // Определитель зоопланктона и зообентоса пресных вод Европейской России. Т. 2: Зообентос. М.; СПб.: Товарищество науч. изданий КМК, 2016. С. 335–438.
Корнюшин А.В. Двустворчатые моллюски надсемейства Pisidioidae Палеарктики (фауна, систематика, филогения). Киев: Ин-т зоологии НАН Украины, 1996. 175 с.
Леви Э.К. Тип моллюски // Животный мир Кировской области. Киров: Киров. гос. пед. ин-т, 1971. Т. 1. С. 177–189.
Лешко Ю.В. Моллюски // Фауна европейского Северо-Востока России. СПб.: Наука, 1998. Т. 5. Ч. 1. 168 с.
Лешко Ю.В. Бентос реки Вятки // Тр. Коми НЦ УрО РАН. Сыктывкар, 2005. № 177. С. 248–257.
Лешко Ю.В., Шадрин Н.Ю., Паньков Н.Н. Фауна и зоогеографическая характеристика Западного Урала и Тимана // Тр. Коми НЦ УрО РАН. Сыктывкар, 2001. № 166. С. 152–164.
Методика изучения биогеоценозов внутренних водоемов. М.: Наука, 1975. 240 с.
Методические рекомендации по сбору и обработке материалов при гидробиологических исследованиях на пресноводных водоемах. Зообентос и его продукция. Л.: Гос.НИИ озер. и реч. рыб. хоз-ва, 1984. 51 с.
Митрофанова И.Ю., Антонова Е.Л. Бентофауна реки Вятки // Тр. Пермск. отд. Гос.НИИ озер. и реч. рыб. хоз-ва. Пермь, 2007. Т. 6. С. 80–100.
Овчанкова Н.Б., Паньков Н.Н., Шадрин Н.Ю. Фауна и зоогеографическая характеристика моллюсков надсемейства Pisidioidae севера и востока Европейской России // Вестн. Удмурт. ун-та. Биология. Науки о земле, 2015. Т. 25. Вып. 2. С. 126–134.
Паньков Н.Н. Зообентос текучих вод Прикамья. Пермь: Гармония, 2000. 192 с.
Паньков Н.Н., Овчанкова Н.Б., Шадрин Н.Ю. Фауна прудовиков (Gastropoda: Lymnaeidae) востока Европейской России и Урала // Вестн. Пермск. ун-та. 2015. Вып. 4. Биология. С. 317–326.
Поздеев И.В. Донная фауна некоторых водоемов и водотоков Удмуртии // Вестн. Удмурт. ун-та. 2011. Вып. 3. С. 75–83.
Поздеев И.В. Роль личинок хирономид в структуре донных сообществ рек бассейна верхней и средней Камы: Автореф. дис. … канд. биол. наук. СПб., 2006. 22 с.
Ресурсы поверхностных вод СССР. Средний Урал и Приуралье. Л.: Гидрометеоиздат, 1973. Т. 11. 847 с.
Старобогатов Я.И. Фауна моллюсков и зоогеографическое районирование континентальных водоемов земного шара. Л.: Наука, 1970. 372 с.
Старобогатов Я.И., Прозорова Л.А., Богатов В.В., Саенко Е.М. Моллюски // Определитель пресноводных беспозвоночных России и сопредельных территорий. Т. 6: Моллюски, Полихеты, Немертины. СПб.: Наука, 2004. С. 9–498.
Шадрин Н.Ю. К фауне моллюсков верхней Камы // Актуальные проблемы биологии и экологии: Тез. докл. науч. конф. Сыктывкар: Ин-т биологии Коми науч. центра УрО РАН, 2000. С. 259–260.
Шадрин Н.Ю., Паньков Н.Н. Фауна пресноводных моллюсков Пермской области // Вестн. Пермск. ун-та. 2000. Вып. 2. С. 255–264.
Шитиков В.К., Зинченко Т.Д. Изменение индексов таксономического разнообразия сообществ макрозообентоса по продольному градиенту рек // Принципы экологии. 2013. № 2. С. 46–56. https://doi.org/10.15393/j1.art.2013.2561
Шихова Т.Г. Тип Моллюски // Животный мир Кировской области (беспозвоночные). Киров: Вятск. гос. пед. ун-т, 2001. Т. 5. С. 67–83.
Шихова Т.Г. Фауна моллюсков бассейна реки Вятки и Вятско-Двинской водораздельной области: Автореф. дис. … канд. биол. наук. СПб., 2004. 26 с.
Шихова Т.Г. Пресноводная малакофауна бассейна р. Чепца // Актуальные вопросы современной малакологии: Сб. науч. тр. Всерос. науч. конф., посвящ. 100-летнему юбилею И.М. Лихарева и П.В. Матёкина. Белгород: ИД “Белгород”, 2017. С. 107–113.
Banarescu P. Zoogeography of fresh waters. 2. Distribution and dispersal of freshwater animals in North America and Eurasia. Wiesbaden: Aula-Verlag, 1992. P. 519–1091.
Klishko O., Lopes-Lima M., Froufe E. et al. Taxonomic reassessment of the freshwater mussel genus Unio (Bivalvia: Unionidae) in Russia and Ukraine based on morphological and molecular data // Zootaxa. 2017. V. 4286. № 1. P. 93–112. https://doi.org/10.11646/zootaxa.4286.1.4
Klishko O.K., Lopes-Lima M., Bogan A.E. et al. Morphological and molecular analyses of Anodontinae species (Bivalvia, Unionidae) of Lake Baikal and Transbaikalia // PLoS ONE. 2018. V. 13. № 4. https://doi.org/10.1371/journal.pone.0194944
Kruglov N.D., Starobogatov Ya.I. Guidae to Recent molluscs of northern Eurasia. 3. Annotated and illustrated catalogue of species of the family Lymnaeidae (Gastropoda, Pulmonata, Lymnaeiformes) of Palaearctic and adjacent river drainage areas. Part 1 // Ruthenica. 1993. V. 3. № 1. P. 65–92.
Sorensen T. A method of establishing groups of equal amplitude in plant sociology based on similarity of species content // Kongelige Danske Videnskabernes Selskab. Biol. krifter. 1948. Bd 4. P. 1–34.
Vinarski M.V., Kantor Yu.I. Analytical catalogue of fresh and brackish water molluscs of Russia and adjacent countries. M.: A.N. Severtsov Institute of Ecology and Evolution of RAS, 2016. 544 p.
Дополнительные материалы отсутствуют.
Инструменты
Биология внутренних вод


