Биология внутренних вод, 2019, № 3, стр. 84-93
Индукция деформаций жестких ротовых структур личинок Chironomus riparius Meigen при разном содержании стойких органических веществ в донных отложениях
И. И. Томилина 1, *, Л. П. Гребенюк 1
1 Институт биологии внутренних вод им. И.Д. Папанина Российской академии наук
152742 Некоузский р-н, Ярославская обл., пос. Борок, Россия
* E-mail: i_tomilina@mail.ru
Поступила в редакцию 13.12.2017
После доработки 19.10.2018
Принята к публикации 27.11.2018
Аннотация
Показано, что количество деформаций структур ротового аппарата личинок Chironomus riparius Meigen отражает потенциальную опасность загрязненных донных отложений и может служить хорошим биомаркером при проведении мониторинга экологического состояния пресноводных экосистем. Апробирован метод количественного расчета степени деформаций сильнохитинизированных структур (ментума и мандибул). Установлено, что суммарное количество полихлорированных бифенилов в донных отложениях влияет на долю личинок с множественными деформациями и относительную численность личинок с деформациями ментума и мандибул. Приведены примеры расчета индекса морфологического ответа сильнохитинизированных структур ротового аппарата личинок хирономид при экспонировании на донных отложениях с различным содержанием стойких органических веществ.
ВВЕДЕНИЕ
Морфологические деформации донных беспозвоночных, живущих в загрязненных средах, могут использоваться как показатели антропогенной нагрузки на водные экосистемы. Комары-звонцы (Diptera, Chironomidae) – важнейшие массовые и повсеместно распространенные в природе двукрылые насекомые, которые служат не только кормовыми объектами рыб, но и играют важную роль в самоочищении водоемов [3]. Хирономид используют и в качестве биоиндикаторных организмов. Высокое видовое разнообразие по сравнению с другими донными беспозвоночными свидетельствует об их широком спектре ответных реакций на внешние воздействия, тем самым привлекая внимание исследователей, работающих в разных направлениях биологической науки [2].
Морфологические отклонения в строении структур ротового аппарата личинок хирономид упоминаются в литературе как факт, указывающий на загрязнение [6, 7, 11, 15, 18, 24]. На появление деформаций могут влиять абиотические и биотические факторы. К первым относятся температура и химический состав водной среды, скорость течения, подстилающие дно грунты, а также загрязняющие вещества – тяжелые металлы и некоторые органические соединения (нефтепродукты, пестициды, стойкие органические вещества (СОЗ), синтетические поверхностно-активные вещества (СПАВ) и др.) [7, 23]. Биотические факторы – возраст личинок, стадии жизненного цикла, инвазии, инфекции и др., которые ослабляют или усиливают действие абиотических факторов. Тенденция появления дефектов в ответ на загрязнение сильно варьирует среди различных таксонов хирономид [12, 26]. Согласно сводным данным разные загрязняющие агенты индуцируют морфологические деформации в широком диапазоне – от 1.9 до 100% [6, 29]. Кроме того, отмечена сезонная изменчивость возникновения подобных дефектов: наибольшая частота особей с дефектами зарегистрирована в холодные периоды года, а наименьшая – летом [26].
По данным ряда авторов [6, 30], в современных популяциях хирономид по сравнению с ископаемыми наблюдается двадцатикратное увеличение частоты деформаций. В качестве причин их возникновения рассматриваются в основном воздействия тяжелых металлов и CПАВ [12, 21]. Показано [8, 20], что воздействие меди вызывает появление морфологических нарушений ментума, мандибул, эпифарингеальной пластинки и антенн.
Экспериментально доказано, что загрязняющие вещества органической природы – хлорорганические пестициды [22], сырая нефть [14], ксилол [19], мевинфос [1] оказывают тератогенное действие на личинки хирономид. Обнаружена связь между дефектами антенн и концентрацией дихлордифенилдихлорэтена (DDE) [17].
Однако морфологические деформации остаются всего лишь качественной оценкой наличия загрязняющих веществ в водной экосистеме [2]. Количество деформаций отдельных личинок просто подсчитать, но при этом сложно оценить общий отклик сообщества на загрязнение, поскольку тяжесть и множественность деформаций отдельных личинок важнее частоты этих случаев [7]. Соответственно, необходимы методы, позволяющие количественно определить степень деформации сильнохитинизированных структур (ментума и мандибул) личинок рода Chironomus в условиях загрязненных пресноводных экосистем с различными степенью и типом антропогенной нагрузки. Выявленные морфологические отклики личинок хирономид могут быть важны для идентификации химических веществ или классов соединений в загрязненной среде.
Цель работы – оценить возникновение деформаций структур ротового аппарата личинок Chironomus riparius Meigen и апробировать метод количественного расчета степени деформаций сильнохитинизированных структур (ментума и мандибул) в зависимости от концентрации стойких органических веществ в донных отложениях.
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
Пробы донных отложений (ДО) отбирали в июле 2008 г. на Рыбинском водохранилище дночерпателем Экмана–Берджи (площадь захвата 0.025 м2) с горизонта 0–30 см на затопленных руслах (глубина 10–12 м) р. Шексна напротив устья р. Кошта (ст. 1) и р. Молога в районе пос. Брейтово (ст. 2) в трех повторностях на каждой станции (рис. 1). Cтанции выбирали с учетом выявленных ранее различий в уровнях содержания СОЗ в ДО на этих участках водохранилища (табл. 1) [4, 9, 13, 28]. После перемешивания грунта, взятого на каждой станции, отбирали интегральную пробу, которую перетирали, заливали отстоянной артезианской водой и использовали для эксперимента.
Рис. 1.
Карта-схема станций отбора проб на Рыбинском водохранилище. 1 – напротив устья р. Кошта, 2 – около пос. Брейтово. Стрелками указаны направления течений.
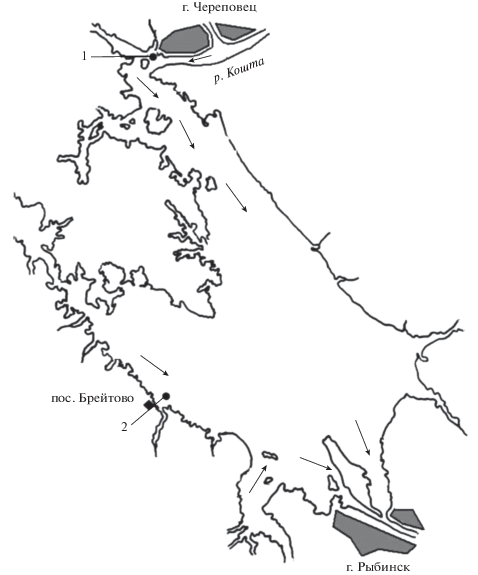
Таблица 1.
Содержание ПХБ и ХОП (мкг/кг сухой массы) в ДО на разных участках Рыбинского водохранилища [13]
| Соединение | Станция | |
|---|---|---|
| 1 | 2 | |
| 3-ХБ | 26.3 | 1.8 |
| 4-ХБ | 71.2 | 11.6 |
| 5-ХБ | 214.9 | 7.7 |
| 6-ХБ | 92.8 | 2.5 |
| 7-ХБ | 20.4 | 1.2 |
| Общая сумма ПХБ | 425.6 | 24.8 |
| o,p' -DDE | 1.2 | 0.55 |
| p,p' -DDE | 4.3 | 0.8 |
| DDT + DDD | 21.6 | 0.94 |
| ГХБ | 0.83 | 0.34 |
Исследования проводили на лабораторной культуре личинок Ch. riparius, выращиваемой на чистом грунте и отстоянной артезианской воде с pH 7.0–7.5, общей жесткостью 4.0–4.5 мМэкв/л Ca++ и Mg++ и содержанием растворенного кислорода на уровне насыщения [5]. Молодь личинок хирономид в первые сутки после вылупления помещали в чашки Петри (по 30 экз. в каждой), содержащие 50 г пробы грунта с каждой станции и 20 мл отстоянной артезианской воды. Опыты проводили в двух повторностях. Температура воды была 20 ± 2°С. Животных кормили суспензией кормовых дрожжей. Контролем служили незагрязненные ДО и интактные животные. Продолжительность эксперимента ~20 сут (до достижения 80% личинок стадии IV возраста).
Для изучения структур ротового аппарата личинок изготавливали постоянные препараты из головных капсул с использованием жидкости Фора–Берлезе по общепринятой методике [10]. Препараты просматривали под микроскопом МБИ-3 (×200, ×280, ×400). Изучали три группы структур ротового аппарата: сильнохитинизированные (ментум и мандибулы), комплекс верхней губы (премандибулы, эпифарингс, верхнегубной гребень) и антенны. Аномалии в строении структур ротового аппарата даны на рисунках, выполненных с помощью рисовального аппарата РА-4. Рассчитывали относительную численность личинок с деформациями, долю личинок с деформациями отдельных структур ротового аппарата, соотношение числа этих структур, индекс тяжести деформации антенн ISAD (Index of Severity of Antennal Deformation) и сильнохитинизированных структур ISMMD (Index of Severity of Mental and Mandibular Deformation), отражающих степень токсической нагрузки на эти структуры в популяции [16, 29].
Вычисляли средние значения и их ошибки (x ± SE). Достоверность различий оценивали методом дисперсионного анализа (ANOVA, LSD-тест) при уровне значимости р ≤ 0.05 [27].
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Высокая относительная численность личинок с деформациями, достоверно отличающаяся от контрольных значений, зарегистрирована при экспонировании на ДО Рыбинского водохранилища с различным содержанием СОЗ (табл. 2). Доля личинок с множественными деформациями при выращивании на ДО, отобранных на ст. 1 (устье р. Кошта), была в 18.5 раза больше, чем на ст. 2 (у пос. Брейтово). В контроле личинки с множественными деформациями не отмечены. У 59% личинок, экспонированных на грунтах ст. 1, выявлены патоморфологические отклонения в строении ментума и мандибул. Количество деформаций ментума существенно превышало таковое мандибул, достигая ~70% общего числа деформированных жестких структур. Разнообразие деформаций и степень их тяжести (качественные показатели) в большей степени представлены в строении ментума.
Таблица 2.
Изменение морфологических параметров личинок Chironomus riparius Meigen при экспонировании на грунтах с различным уровнем содержания СОЗ
| Номер станции |
Доля личинок
с деформациями
в общем числе исследованных личинок, % |
Доля личинок (%) с множественными деформациями в общем числе | Доля личинок (%) с деформациями отдельных структур в общем числе личинок с деформациями | Соотношение деформированных структур, % | ISAD | ISMMD | |||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| личинок с дефор-мациями | исследо-ванных личинок | mt, md | labrum | antennae | mt, md | labrum | antennae | ||||
| 1 | 64.9 ± 1.9c | 85.0 ± 2.5b | 55.1 ± 3.2b | 58.8 ± 0.5b | 76.9 ± 6.5c | 72.3 ± 5.6b | 27.1 ± 1.0b | 35.8 ± 2.5b | 37.2 ± 3.4a | 3.2 ± 0.7b | 7.4 ± 2.4c |
| 2 | 42.0 ± 4.1b, c | 4.6 ± 4.6a | 1.7 ± 1.7a | 6.5 ± 0.4a | 43.4 ± 1.4b,c | 60.3 ± 1.7b | 5.2 ± 1.2a | 32.4 ± 0.5a, b | 62.5 ± 0.8b | 3.5 ± 0.5b | 0.3 ± 0.1a, b |
| Контроль | 7.4 ± 3.7a | 0a | 0a | 3.0 ± 0.7a | 11.1 ± 0a | 28.2 ± 1.5a | 5.6 ± 1.1a | 25.9 ± 4.9a | 68.5 ± 4.9b | 0.9 ± 0.3a | 0.05 ± 0.02a |
Примечание. Даны средние величины и их ошибки. Значения с разными буквенными надстрочными индексами достоверно различаются в каждом столбце при уровне значимости р < 0.05. ISAD – индекс тяжести деформации антенн, ISMMD – деформации сильнохитинизированных структур; mt, md – ментум и мандибула, соответственно, labrum – комплекс верхней губы, antennae – антенны.
Характер деформаций ротового аппарата зависел и от уровня содержания СОЗ в ДО. При выращивании личинок на грунтах с высокими концентрациями СОЗ (ст. 1), их число с деформациями отдельных структур (ментума и мандибул, комплекса верхней губы и антенн) варьировало от 58.8 до 76.9% (табл. 2). При экспонировании на грунтах с более низкими уровнями содержания СОЗ (ст. 2) значительная часть деформаций приходилась на антенны (>60%), а на ментум и мандибулы (~7%) (табл. 2).
Значения ISAD на обеих станциях достоверно превышали таковые в контроле, не различаясь между собой. Величина ISMMD, биологического показателя загрязнения ДО органическими веществами, при экспонировании личинок на грунтах ст. 1 была в 24.5 раза выше, чем на ст. 2, и в 148 раз – чем в контроле (табл. 2).
Расчет индекса ISMMD проводился по схеме, предложенной авторами ранее [16]. Для количественной оценки различных видов морфологических аномалий каждому определенному отклонению в строении ментума и мандибулы придавали соответствующее цифровое значение, так называемое первичное расчетное число P. По мере увеличения тяжести деформаций возрастала и величина Р. Для отображения этого процесса использовали цифровой ряд, выстроенный по принципу геометрической прогрессии. Значения P, соответствующие различным видам деформаций ментума и мандибулы, приведены в работе [16]. Сумма этих чисел, рассчитанная для данной личинки, будет представлять ее индекс морфологического ответа – IMR (Index of Morphological Response). Суммарное значение всех IMR, поделенное на число личинок в данной популяции, нами назван индексом тяжести деформаций сильнохитинизированных структур.
Деформированные ментум и мандибулы личинок Ch. riparius, выращенных на грунтах ст. 1, показаны на рис. 2–4. Примеры расчета индекса морфологического ответа некоторых структур рассмотрены ниже.
Рис. 2.
Ментум личинок Ch. riparius: а – нормальное строение, б–е – смешанные деформации ментума. а – срединный трехзубчатый зубец (а1 – основной, б1, б2 – добавочные), в – субментальные структуры, l1–l6 – латеральные, или боковые зубцы, г – дополнительный зубец на латеральном, д – дополнительный зубец между основным и добавочными. Стрелкой показаны дополнительные зубцы (е) на основном.
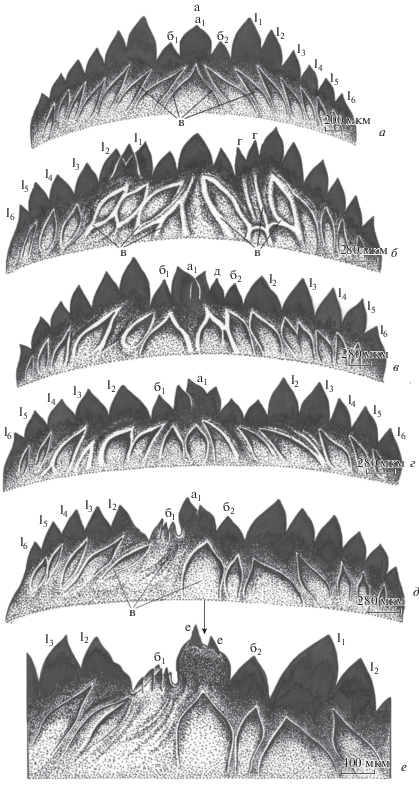
Рис. 3.
Смешанные (а–г) и срединные (д–е) деформации ментума личинок Ch. riparius. ж – дополнительные латеральные зубцы нормального строения, з – выемка между основным и латеральным зубцами. Остальные обозначения, как на рис. 2.
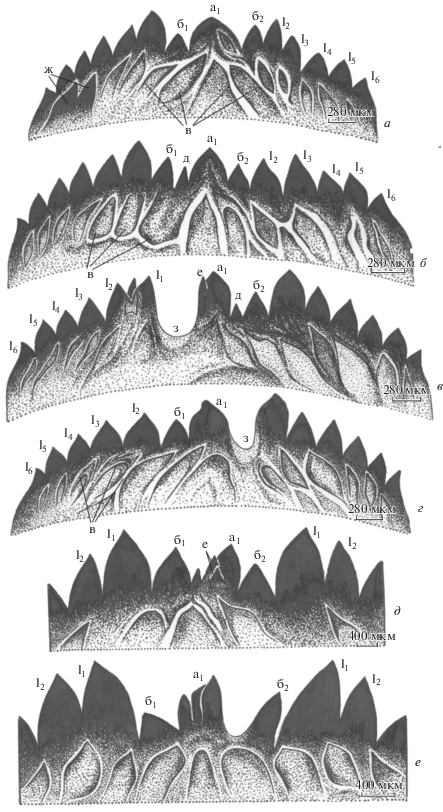
Рис. 4.
Мандибулы личинок Ch. riparius: а, б – нормальное строение, б–е – деформации мандибул. а1–а4 – нижние, или наружные пигментированные зубцы, б1–б7 – верхние, или внутренние непигментированные зубцы, в – мандибулярный гребешок, г – субдентальная щетинка, д – дорзальные щетинки, е – базальные шипики, ж – выемка под пигментированными зубцами, з – прогиб дорзальной части мандибулы.
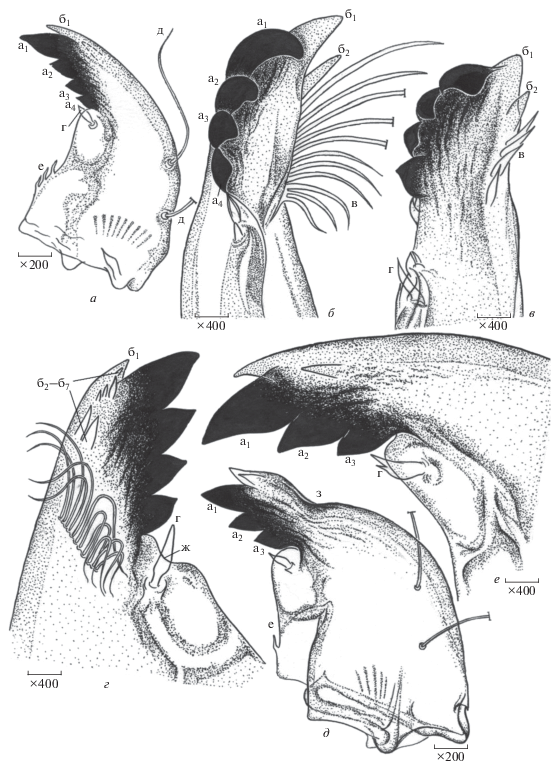
Рис. 2в. IMR = Σ P = 11: латеральная деформация справа (P = 4), дополнительный зубчик между срединным и латеральным (P = 2), основной зубец двойной (P = 4), добавочный зубец справа слегка деформирован (P = 1).
Рис. 2д. IMR = Σ P = 20: сильное искажение формы срединного зубца (P = 8), латеральная деформация слева (P = 8), латеральная деформация справа (P = 4).
Рис. 3в. IMR = Σ P = 20: выемка между основным и латеральным зубцами (P = 8), исчезновение добавочного зубца слева (P = 4), дополнительный зубчик между основным и добавочным (P = 2), дополнительный зубчик на основном зубце (P = 2), дополнительный зубец на латеральном (P = 4).
Рис. 3г. IMR = Σ P = 17: выемка между основным и латеральным зубцами (Р = 8), срединный зубец двузубчатый11 (Р = 4), небольшое искажение формы основного зубца (Р = 1), латеральная деформация слева (Р = 4).
Рис. 4д. IMR = Σ P = 14: прогиб дорзальной части мандибулы (P = 8), сокращение числа пигментированных зубцов без изменения формы (P = 4), сокращение числа вентральных шипиков (P = 2).
Рис. 4е. IMR = Σ P = 6: сокращение числа пигментированных зубцов (P = 4), уродливая субдентальная щетинка (P = 2).
Подобным образом рассчитывали IMR ментума и мандибул всех личинок в эксперименте. В качестве примера приведен подсчет ISMMD для одной из повторностей. Суммарное значение IMR – 236. Общее число личинок в данной популяции 24, соответственно ISMMD = 9.83 (236/24) при норме 0.03 ≤ ISMMD ≤ 0.2.
Cуммарное количество ПХБ в ДО на ст. 1 было 425.6 мкг/л, на ст. 2 – 24.8 (табл. 1). Половина этого количества представлена 5-ХБ, наименьший вклад в суммарную концентрацию вносят 3‑ХБ и 7-ХБ. Особое внимание следует уделить моноортозамещенным ПХБ, поскольку они могут обладать токсичностью диоксинового типа. Их содержание в ДО ст. 1 было 46.7, ст. 2 – 0.92 мкг/г сухой массы. Содержание ГХБ между станциями варьирует незначительно, содержание ДДТ и его метаболитов – в более широком диапазоне, сумма ПХБ – в еще более широких пределах.
Методами математического анализа, в частности корреляционного, можно соотнести возникновение деформаций структур ротового аппарата личинок хирономид c силой воздействия какого-либо конкретного фактора. Результаты анализа корреляционных связей дают основание утверждать, что суммарное количество ПХБ в ДО влияет на долю личинок с множественными деформациями (r = 0.67, p = 0.01) и относительную численность личинок с деформациями ментума и мандибул (r = 0.59, p = 0.04).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В пресноводных экосистемах ДО служат первичным накопителем персистентных загрязняющих веществ и наиболее консервативным элементом по сравнению с водой и гидробионтами. Исходя из этого и учитывая чрезвычайно низкую растворимость СОЗ в воде, ДО наиболее объективно отражают уровень их накопления и пространственного распределения в водном объекте. В связи с высокой устойчивостью СОЗ к физическим, химическим и биологическим факторам среды они могут сохраняться достаточно долгое время в ДО и, передаваясь по трофическим сетям, накапливаться на их высших уровнях и вызывать различные токсические эффекты [9, 13, 28].
СОЗ присутствуют в экосистеме Рыбинского водохранилища и их локальный источник – Череповецкий промышленный комплекс [4, 9]. В 1996 г. в тех же точках содержание Cd, Zn, Cu и Pb в ДО на ст. 1 было 3.1, 220, 12.5, 22.5 соответственно и на ст. 2. – 1.3, 630, 7.0 и 17.5 мкг/г сухой массы. Cуммарное содержание полициклических ароматических углеводородов (ПАУ) было 1409.0 (cт. 1) и 122.0 (ст. 2) мкг/кг сухой массы, ПХБ – 133.76 и 26.0 мкг/кг сухой массы соответственно [9]. Также установлено, что токсичность цельного грунта для тест-объектов на 78% обусловлена присутствием ПХБ и ПАУ [9].
Значительное увеличение деформаций сильнохитинизированных структур у личинок рода Chironomus, обитающих на грунтах с высоким содержанием СОЗ и в экспериментальных условиях, и в природных водоемах отмечалось неоднократно [25, 28]. Негативное влияние этих веществ на жесткие структуры личинок оценивалось косвенным путем – по доле деформированных сильнохитинизированных структур в общем числе аномальных структур ротового аппарата, процентному соотношению деформированных ротовых структур и т.д.
В настоящей работе апробирован метод количественной оценки тех качественных морфологических изменений, которым подвергаются жесткие структуры ротового аппарата личинок хирономид в условиях хронического загрязнения водоемов СОЗ. Метод представляет собой расчет индекса ISMMD, по величине которого можно с высокой степенью объективности судить о силе воздействия органических загрязняющих веществ на личинок хирономид в данном биоценозе. Расчет этого индекса для личинок, экспонированных на грунтах двух станций, заметно отличающихся по содержанию СОЗ в грунте, наглядно демонстрирует значительную разницу в степени влияния загрязнения на жесткие структуры личинок Ch. riparius.
Выявленные уровни содержания CОЗ в ДО не оказывали летального действия на личинок Ch. riparius, но приводили к различным по силе выраженности хроническим эффектам. Относительная численность хирономид с морфологическими деформациями структур ротового аппарата, экспонированных на грунте с высоким суммарным содержанием СОЗ (ст. 1), была достоверно выше, чем у личинок, культивированных на грунте с их низким содержанием (ст. 2). Доля личинок с множественными деформациями на ст. 1 превышала в 18.5 разa таковую на ст. 2. В контроле личинки с множественными деформациями отсутствовали. Отмеченные отклонения в строении ротового аппарата личинок свидетельствуют о нарушении нормального течения морфогенеза, что может стать причиной снижения жизнеспособности как отдельных организмов, так и популяции хирономид на исследованных станциях. Тем более, что наблюдаемые деформации в экспериментальных условиях могут быть в целом слабее и их относительное количество ниже, чем в естественных популяциях, долгое время существующих в условиях хронического загрязнения среды [21].
Результаты проведенного исследования сопоставимы c данными, полученными ранее в эксперименте с фосфорорганическим соединением мевинфос [1]. При увеличении его содержания в грунте происходило достоверное увеличение численности деформированных сильнохитинизированных структур. Органические загрязняющие вещества (хлор- и фосфорсодержащие) сильнее неорганических действуют на морфогенез животных, приводя к аномальным изменениям “устойчивых” сильнохитинизированных структур и вызывая необычные формы патоморфологических отклонений. Примером этого может служить отмеченный ранее случай “двойной” головы личинки Ch. riparius при биотестировании грунтов Рыбинского водохранилища [28] или чрезвычайно уродливой мандибулы в эксперименте с мевинфосом [1].
Частота встречаемости деформаций антенн, как правило, выше, чем ментума и мандибул. Возможно, что такие сенсорные структуры, как антенны, перестают реагировать на загрязнение, начиная с определенных концентраций токсических веществ, и деформации начинают проявляться на более жестких морфологических структурах. При высоких уровнях загрязнения число деформированных антенн не увеличивается, а ментума и мандибул – возрастает [25]. Результаты наших экспериментов служат дополнительным подтверждением данного предположения.
Поскольку аналитическими методами невозможно измерить все токсиканты, аккумулированные в ДО, количество деформаций ротового аппарата личинок хирономид в большей степени может отражать потенциальную опасность загрязненных отложений, чем химический анализ, и служить хорошим биомаркером при проведении мониторинга экологического состояния пресноводных экосистем.
Выводы. Зарегистрирована высокая относительная численность личинок с деформациями, достоверно отличающаяся от контрольных значений, при экспонировании на донных отложениях Рыбинского водохранилища с различным содержанием стойких органических веществ. Показано, что суммарное количество ПХБ в ДО влияет на долю личинок с множественными деформациями (r = 0.67) и относительную численность личинок с деформациями ротовых структур ментума и мандибул (r = 0.59). При выращивании личинок на грунтах с высокими концентрациями СОЗ число личинок с деформациями фактически равномерно распределялось между исследованными группами структур ротового аппарата (58.8, 76.9, 72.3% соответственно для ментума и мандибул, комплекса верхней губы и антенн). При экспонировании на грунтах с более низкими уровнями содержания СОЗ большая часть деформаций приходилась на антенны (60.3%) и в меньшей степени на ментум и мандибулы (6.5%). Апробирован метод количественного расчета степени деформаций сильнохитинизированных структур (ментума и мандибул) ротового аппарата личинок хирономид. Число деформаций ротовых структур личинок отражает потенциальную опасность загрязненных донных отложений и может служить хорошим биомаркером при проведении мониторинга экологического состояния пресноводных экосистем.
ФИНАНСИРОВАНИЕ РАБОТЫ
Работа выполнена в рамках государственного задания “Физиолого-биохимические и иммунологические реакции гидробионтов под действием биотических и абиотических факторов окружающей среды” № АААА-А18-118012690123-4 и “Фауна, систематика и биология основных групп водных беспозвоночных” № АААА-А18-118012690105-0 и при частичной поддержке Программы РАН “Биоразнообразие природных систем. Биологические ресурсы России: оценка состояния и фундаментальные основы мониторинга”.
Список литературы
Гребенюк Л.П., Томилина И.И. Изменение физиологических и морфологических показателей личинок Chironomus riparius Meigen (Diptera: Chironomidae) при действии токсических веществ различной природы // Биол. внутр. вод. 2006. № 3. С. 81–90.
Зинченко Т.Д. Биоиндикация как поиск информативных компонентов водных экосистем (на примере хирономид – Diptera, Chironomidae) // Чтения памяти Владимира Яковлевича Леванидова. 2005. Вып. 3. С. 338–355.
Извекова Э.И. К вопросу о роли хирономид-фильтраторов в процессах самоочищения водоемов // Комплексные исследования водохранилищ. Т. 1. М.: Изд-во МГУ, 1971. С. 204−207.
Козловская В.И., Герман А.В. Полихлорированные бифенилы и полиароматические углеводороды в экосистеме Рыбинского водохранилища // Вод. ресурсы. 1997. Т. 24. № 5. С. 563–569.
Константинов А.С. Биология хирономид и их разведение // Тр. Саратов. отд. Всесоюз. НИИ озер. и реч. рыб. хоз-ва. Саратов, 1958. Т. 5. 362 с.
Назарова Л.Б. Морфологические деформации личинок комаров-звонцов (Diptera, Chironomidae) в гидробиологических исследованиях // Успехи соврем. биологии. 2002. Т. 122. № 5. С. 505–512.
Назарова Л.Б. Морфологические деформации комаров-звонцов Diptera, Chironomidae в связи с загрязнением водоeмов // Успехи соврем. биологии. 2002. Т. 122. № 5. С. 516–523.
Назарова Л.Б., Латыпова В.З., Тухвагулина Л.Г. Тератогенное действие меди на личинки хирономид // Токсикол. вестн. 1999. № 3. С. 50–56.
Флеров Б.А., Томилина И.И., Кливленд Л. и др. Комплексная оценка состояния донных отложений Рыбинского водохранилища // Биол. внутр. вод. 2000. № 2. С. 148–155.
Шилова А.И. Хирономиды Рыбинского водохранилища. Л.: Наука, 1976. 251 с.
Bhattacharyay G., Sadhu A., Mazumdar A., Chaudhuri P. Antennal deformities of Chironomid larvae and their use in biomonitoring of trace metal pollutions in the river Damodar of West Bengal, India // Environ. Monit. and Assess. 2005. V. 108. P. 67–84.
Bird G.A. Use of chironomid deformities to assess environmental degradation in the Yamaska River, Quebec // Environ. Monit. Assess. 1994. V. 30. P. 163–175.
Chuiko G.M., Zakonnov V.V., Morozov A.A. et al. Spatial distribution and qualitative composition of polychlorinated biphenyls and organochlorine pesticides in bottom sediments and bream (Abramis brama L.) from the Rybinsk reservoir // Inland Water Biol. 2010. V. 3. № 2. P. 193–202. https://doi.org/10.1134/S199508291002015X
Cushman R.M. Chironomid deformities as indicators of pollution from a synthetic, coal-derived oil // Freshwater Biol. 1984. V. 14. P. 179–182.
Dickman M., Rygiel G. Chironomid larval deformity frequencies, mortality, and diversity in heavy-metal contaminated sediments of a Canadian riverine wetland // Environ. Int. 1996. V. 22. P. 693–704.
Grebenjuk L.P., Tomilina I.I. Morphological Deformations of Hard Chitinized Mouthpart Structures in Larvae of the Genus Chironomus (Diptera, Chironomidae) as the Index of Organic Pollution in Freshwater Ecosystems // Inland Water Biol. 2014. V. 7. № 3. P. 273–285. https://doi.org/10.1134/S1995082914030092
Hamillton A.C., Saether O.A. The occurrence of characteristic deformities in chironomid larvae of several Canadian lakes // Can. Entomol. 1971. V. 103. P. 363–368.
Hudson L.A., Ciborowski J.J.H. Teratogenic and genotoxic responses of larval Chironomus salinarius group (Diptera: Chironomidae) to contaminated sediments // Environ. Toxicol. Chem. 1996. V. 15. № 8. P. 1375–1381.
Janssens de Bisthoven L., Huysmans C., Goemans G. et al. Field and experimental morphological response of Chironomus larvae to xylene and toluene // Neth. J. Zool. 1997. V. 47. P. 227–239.
Kosalwat P., Knight A.W. Chronic toxicity of copper to a partial life cycle of the midge, Chironomus decorus // Arch. Environ. Contam. Toxicol. 1987. V. 16. P. 283–290.
Langer-Jaesrich M., Kohler H.-R., Gerhardt A. Can mouth part deformities of Chironomus riparius serve as indicators for water and sediment pollution? A laboratory approach // J. Soils Sediments. 2010. V. 10. P. 414–422.
Madden C.P., Suter P.J., Nicolson B.C., Austin A.D. Deformities in chironomid larvae as indicators of pollution (pesticide) stress // Neth. J. Aquat. Ecol. 1992. V. 26. № 2–4. P. 551–557.
Martinez E.A., Barry C., Moore J.S., Nairanjana D. Teratogenic Versus Mutagenic Abnormalities in Chironomid Larvae Exposed to Zinc and Lead // Arch. Environ. Contam. Toxicol. 2004. V. 47. P. 193–198.
Nasarova L., Riss W., Kahlheber A., Werding B. Some observations of buccal deformities in chironomid larvae (Diptera: Chironomidae) from the Cienaga Grande de Santa Marta, Colombia. Algunas observaciones sobre deformidades bucales en larvas de quironomidos (Diptera: Chironomidae) de la Cienaga Grande de Santa Marta, Colombia // Caldasia. 2004. V. 26. № 1. P. 275–290.
Odume O.N., Muller W.J., Palmer C.G., Arimoro F.O. Mentum deformities in Chironomidae communities as indicators of anthropogenic impacts in Swartkops River // Phys. and Chem. Earth. 2012. V. 50–52. P. 140–148.
Servia M., Corbo F., Gonzalez M. Seasonal and interannual variations in the frequency and severity of deformities in larvae of Chironomus riparius (Meigen, 1804) and Prodiamesa olivacea (Meigen, 1818) (Diptera, Chironomidae) collected in a polluted site // Environ. Monit. and Assess. 2000. V. 64. P. 617–626.
Sokal R.R., Rohlf F.J. Biometry: the principles and practice of statistics in biological research. N.Y.: W.H. Freeman and Comp., 1995. 887 p.
Tomilina I.I., Grebenyuk L.P., Chuiko G.M. Toxicological and Teratogenic Assessment of Bottom Sediments from the Rybinsk Reservoir // Inland Water Biol. 2011. V. 4. № 3. P. 373–382. https://doi.org/10.1134/S1995082911030187
Warwick W.F. Morphological deformities in Chironomidae (Diptera) larvae as biological indicators of toxic stress // Toxic Contaminants and Ecosystem Health. A Great Lakes Focus. N.Y.: John Wiley and Sons, 1988. P. 281–320.
Warwick W.F., Tisdale N.A. Morphological deformities in Chironomus, Cryptochironomus, and Procladius larvae (Diptera: Chironomidae) from two differentially stressed sites in Tobin Lake, Saskatchewan // Can. J. Fish. and Aquat. Sci. 1988. V. 45. № 7. P. 1123–1144.
Дополнительные материалы отсутствуют.
Инструменты
Биология внутренних вод


