Биология внутренних вод, 2019, № 3, стр. 52-62
Таксономический состав и структура макрозообентоса в таежных озерах нефтедобывающих районов Западной Сибири
Д. В. Усламин 1, *, О. А. Алешина 1, С. Н. Гашев 1, А. В. Градова 1
1 Тюменский государственный университет
625003 Тюмень, ул. Семакова, 10, Россия
* E-mail: uslamin.d.w@gmail.com
Поступила в редакцию 20.12.2016
После доработки 11.10.2018
Принята к публикации 27.11.2018
Аннотация
Исследован макрозообентос в 14 таежных озерах с разным содержанием тяжелых металлов и нефтепродуктов в донных отложениях (от слабо до экстремально загрязненных). Обнаружено 65 видов и таксонов рангом ниже рода беспозвоночных. По видовому богатству и частоте встречаемости в большинстве озер лидируют хирономиды. Фаунистическое сходство обследованных озер, по коэффициенту Съеренсена–Чекановского, варьировало от 10 до 63%. В группе озер с экстремальным содержанием нефтепродуктов не отмечено угнетения донных сообществ, структурообразующий комплекс представлен олигохетами, моллюсками и хирономидами. Индекс Матковского не выявил существенного отклонения этой группы озер от фоновых. Не обнаружены достоверные корреляции структурных показателей макрозообентоса (общего числа видов, числа видов в таксономических группах) с содержанием нефтепродуктов, но установлены для тяжелых металлов.
ВВЕДЕНИЕ
Ханты-Мансийский автономный округ (ХМАО) – основной нефтегазоносный район России, где добывают ≤58% нефти и газа [22, 28]. Особую угрозу для Обь-Иртышской водосборной области представляют нефтепродукты (НП), на долю которых приходится ~80% общего загрязнения [3, 10, 21]. Известно, что нефть имеет сложный состав. Помимо углеводородов, в неe входят тяжелые металлы, сернистые и азотистые органические соединения, минеральные соли (в том числе и хлориды) [35]. Попадая в воду, нефть подвергается биохимической трансформации, которая состоит из последовательных процессов: испарения, эмульгирования, растворения, окисления, образования агрегатов, седиментации и биодеградации (включая микробное разрушение) [2, 30]. Легколетучие компоненты нефти испаряются за несколько суток, тяжелые фракции оседают на дно водоема и аккумулируются в донных отложениях (ДО) [35]. Дальнейшая их трансформация в грунте озер слабо изучена, особенно на протяжении нескольких десятилетий активного освоения территории, как и эффект воздействия НП на донную биоту, в частности, на макрозообентос. Несмотря на то, что исследований в районе ХМАО проводилось достаточно и имеется значительное количество публикаций, все они, в основном, относятся к речным системам [16, 31, 33, 34, 37]. Работы по изучению состояния донных сообществ беспозвоночных в таежных озерных экосистемах малочисленны.
Цель работы – выявить таксономический состав и структуру макрозообентоса в озерах ХМАО, загрязнявшихся в течение длительного времени НП и тяжелыми металлами (ТМ); оценить влияние этих токсикантов на донную фауну с помощью корреляционного анализа.
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
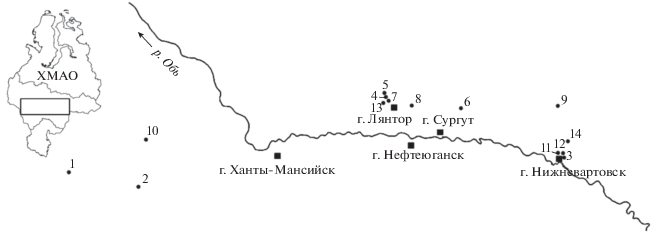
Исследования проводили на территории Среднего Приобья Кондинско-Ваховской ландшафтной области среднетаeжных озeрно-болотных низин на фоновых участках и в районах разработки и многолетней эксплуатации крупнейших месторождений углеводородного сырья Тюменской обл. (Потанайском, Федоровском, Лянторском, Саматлорском) [13] в рамках комплексных экспедиций “Лаборатории качества вод, устойчивости водных экосистем и экотоксикологии” Тюменского государственного университета в период межени с 2011 по 2014 гг. на 14 озерах (рис. 1).
Рис. 1.
Карта-схема расположения исследованных озер. 1 – Рангетур, 2 – Томталяхтур, 3 – Кытылэмтор-1, 4 – Секъяунсоромлор, 5 – Леналонколор, 6 – Качнылор, 7 – Энтльлор, 8 – Токтурилор, 9 – Окунево, 10 – Полынтур, 11 – Калач, 12 – Кытылэмтор-2, 13 – Монкетлор, 14 – Белое. ◼ – населенный пункт.
В своем большинстве исследованные водоемы схожи по морфометрическим параметрам, имеют правильную округлую форму и принадлежат к классу малых озер с площадью зеркала 350–840 га. Исключение составляют озера Энтльлор, Белое и Качнылор, которые имеют сложную форму и относятся к среднему классу с максимальной площадью 1–2.1 тыс. га. Средние глубины озер варьируют в пределах 1.5–1.8 м с максимальными глубинами до 4 м, что характеризует их как мелкие водоемы [7]. ДO всех исследованных озер в основном представлены илами, в прибрежной части встречаются чистые и заиленные пески.
Материал собирали по общепринятым в гидробиологии методам [15]. В качестве орудия сбора макрозообентоса использовали дночерпатель Петерсона с площадью захвата 0.025 м2. На каждой станции брали по две выемки. Всего собрано и обработано 133 бентосные пробы. Одновременно отбирали пробы поверхностной воды и донных отложений на химический анализ. В пробах воды определяли рН, цветность, минерализацию и основные ионы воды; в ДО – рН, содержание НП, Fe, Cu, Cr, Mn, Zn, Sr, Pb, Ni, Cd, Co (табл. 1).
Таблица 1.
Токсикологические показатели донных отложений исследованных водоемов (мг/кг)
| Группа озер | Oзеро | pH | НП | Cu | Cr | Mn | Pb | Ni | Cd | Fe | Zn | Sr | Co |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Фоновые значения | – | 20.0 | 13.5 | 49.2 | 423.0 | 22.9 | 16.7 | 11.6 | – | – | – | – | |
| 1 | 1. Рангетур | 6.51 | 10.0 | 2.81 | 3.32 | 12.08 | 25.61 | 7.61 | 0.24 | 282.3 | 1.42 | 1.49 | 1.82 |
| 2. Томталяхтур | 6.79 | 11.0 | 5.25 | 0 | 6.25 | 0.23 | 3.13 | 0 | 60.2 | 0 | 1.75 | 0.36 | |
| 3. Кытылэмтор-1 | 6.33 | 15.0 | 16.3 | 0 | 194 | 0 | 0 | 1.62 | 2132.0 | 11.6 | 36.8 | 17.1 | |
| 2 | 4. Секъяунсоромлор | 5.93 | 20.0 | 5.5 | 0 | 47 | 0 | 0 | 1.85 | 743.0 | 7.8 | 20.8 | 15.3 |
| 5. Леналонколор | 5.09 | 23.0 | 4.8 | 0 | 80 | 0 | 2.9 | 1.54 | 3262.0 | 7.1 | 17.3 | 0 | |
| 6. Качнылор | 7.18 | 28.5 | 12.28 | 14.43 | 0.54 | 0 | 0.02 | 15.41 | 6832.0 | 6.81 | 6.35 | 4.0 | |
| 7. Энтльлор | 7.2 | 40.5 | 15.39 | 80.95 | 75.18 | 0 | 14.62 | 9.83 | 1303.0 | 12.85 | 70.51 | 3.31 | |
| 3 | 8. Токтурилор | 6.93 | 224.0 | 15.0 | 12.8 | 100.0 | 0 | 18.3 | 1.61 | 4482.0 | 45.5 | 30.5 | 5.4 |
| 9. Окунево | 5.98 | 287.0 | 39.3 | 82.9 | 266.0 | 0 | 54.5 | 1.52 | 17 790.0 | 94.9 | 40.2 | 20.4 | |
| 10. Полынтур | 6.32 | 488.0 | 14.01 | 15.1 | 771.0 | 0 | 27.8 | 0 | 5623.0 | 49.11 | 14.34 | 12.7 | |
| 4 | 11. Калач | 6.76 | 515.0 | 25.3 | 3.0 | 129.0 | 0 | 13.2 | 1.85 | 5236.0 | 37.3 | 223.0 | 17.8 |
| 12. Кытылэмтор-2 | 6.58 | 1064.0 | 40.9 | 62.0 | 424.0 | 0 | 63.7 | 2.08 | 2132.0 | 99.0 | 15.8 | 28.3 | |
| 13. Монкетлор | 6.17 | 2215.0 | 11.4 | 11.1 | 142.0 | 0 | 4.7 | 1.41 | 6120.0 | 34.6 | 16.0 | 0.4 | |
| 14. Белое | 6.18 | 2780.0 | 27.14 | 72.06 | 367.27 | 63.29 | 60.9 | 4.74 | 6717.0 | 121.8 | 7.31 | 6.37 | |
Примечание. Полужирным шрифтом выделены значения, превышающие нормативные и фоновые значения на территории ХМАО-Югра [22]; “–” – нормативы и фоновые значения не разработаны.
Для характеристики донных сообществ учитывали: состав и структуру макрозообентоса, частоту встречаемости видов (Р, %) и индекс фаунистического сходства Съеренсена–Чекановского (KSC ) [26]. При оценке доминантности использована функция рангового распределения относительной численности видов (ni/N). Доминирующими считались виды, относительная численность которых была >0.15 [12]. Для выявления степени отклонения исследованных озер от фоновых рассчитывали индекс Матковского (%) [18]. На основании полученных гидробиологических и химических данных вычисляли коэффициенты ранговой корреляции Спирмена (rs). Статистическую обработку полученных данных проводили по общепринятым методикам [4] с использованием программного пакета STATISTICA 10.0 (Statsoft, USA), MS Excel 2010.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Результаты гидрохимического анализа воды выявили разброс показателей цветности от 8 до 216 град Pt-Co шкалы. Полученные значения, главным образом, обусловлены присутствием гумусовых веществ и общего железа [5]. Для большинства водоемов характерна слабокислая реакция воды, чему способствуют гуминовые кислоты, которые попадают в воду с поверхностным стоком из рядом расположенных болот. В 11 из обследованных озер обнаружено превышение ПДК для рыбохозяйственных водоемов по железу в 2–12 раз. Согласно работам [23, 32], высокое содержание общего железа характерно для всех водных объектов Обь-Иртышского бассейна. Данный элемент является типоморфным для таежных геосистем Западной Сибири [23, 32]. Все озера маломинерализованные, пресные, с очень мягкой водой (<1.5 ммоль/л). По классификации О.А. Алекина [1], озера относятся к гидрокарбонатно-натриевым и хлоридно-натриевым. Хлоридно-натриевый тип воды, выявленный в ряде озер, нетипичен для данной территории. По-видимому, причина поступления хлоридов – комплекс техногенных процессов, связанных с разливами НП и минерализованной воды в процессе бурения [23].
При анализе эколого-геохимической обстановки одним из наиболее информативных объектов исследований служат ДО. Результаты химического анализа ДО приведены в табл. 1. В проанализированных образцах ДО большинства водоемов содержание НП изменяется превышает фоновое в 1.5–139 раз, исключение – озера Рангетур, Томталяхтур и Кытылэмтор-1, у которых концентрация НП ниже в 2 раза. Высокие показатели содержания НП можно объяснить непосредственной близостью водоемов от основных источников загрязнения – участков нефтедобычи. Из ТМ фоновые значения превышают медь, хром, марганец, свинец, никель и кадмий. Значение кислотности ДО изменяется от нейтральной до слабокислой реакции.
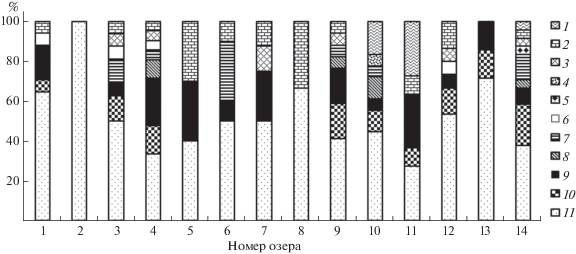
В сообществах донных беспозвоночных обнаружено 65 видов и таксонов рангом ниже рода, относящихся к 11 систематическим группам: водяные клещи, хирономиды, цератопогониды, ручейники, хаоборусы, стрекозы, амфиподы, олигохеты, пиявки, нематоды и моллюски (табл. 2). Наибольшим разнообразием отличалась группа хирономид (33 вида). В остальных таксономических группах количество зарегистрированных видов варьировало от 1 до 8. На рис. 2 показано соотношение основных систематических групп по числу видов в каждом водоеме.
Таблица 2.
Таксономический состав макрозообентоса исследованных групп озер
| Таксон | 1-я группа | 2-я группа | 3-я группа | 4-я группа | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | |
| Класс Gastropoda Сем. Valvatidae |
||||||||||||||
| Tropidina sibirica (Middendorff) | – | – | – | – | – | – | – | – | – | – | – | – | – | + |
| Cincinna depressa (C. Pfeiffer) | – | – | – | – | – | – | – | – | – | + | – | – | – | – |
| Valvata sp. | – | – | – | – | – | – | – | – | – | – | – | – | – | + |
| Сем. Planorbidae | ||||||||||||||
| Choanomphalus rossmaessleri (A. Schmidt) | – | – | – | – | – | – | – | – | – | – | – | – | – | + |
| Класс Bivalvia Сем. Pisidiidae |
||||||||||||||
| Pisidium amnicum (O.F. Müller) | – | – | + | + | – | – | – | – | + | – | – | + | + | + |
| Сем. Euglesidae | ||||||||||||||
| Euglesa juv. | + | – | + | + | – | – | – | – | + | + | + | + | – | – |
| Сем. Sphaeriidae | ||||||||||||||
| Parasphaerium nitidum (Clessin in Westerlund) | – | – | – | + | – | – | – | – | + | – | – | – | – | + |
| Класс Dorylaimea Сем. Dorylaimidae |
||||||||||||||
| Idiodorylaimus robustus Gagarin | – | – | + | + | – | – | + | – | + | – | + | + | – | + |
| Класс Oligochaeta Сем. Tubificidae |
||||||||||||||
| Tubifex tubifex (O.F. Müller) | + | – | – | + | + | + | + | – | + | + | + | + | + | + |
| Limnodrilus hoffmeisteri Claparède | – | – | + | + | – | – | – | – | + | – | – | – | – | – |
| L. udekemianus Claparède | + | – | – | – | – | – | – | – | – | – | – | – | – | – |
| Spirosperma ferox Eisen | + | – | – | + | – | – | – | – | – | – | + | – | – | – |
| Potamothrix bedoti (Piguet) | – | – | – | + | + | – | – | – | + | – | + | – | – | – |
| Сем. Lumbriculidae | ||||||||||||||
| Lumbriculus variegatus (O.F. Müller) | – | – | – | + | + | – | + | – | – | – | – | – | – | + |
| Класс Hirudinea Сем. Glossiphoniidae |
||||||||||||||
| Helobdella stagnalis (Linnaeus) | – | – | – | – | – | – | – | – | – | + | – | – | – | + |
| Сем. Hirudinidae | ||||||||||||||
| Hirudo medicinalis (Linnaeus) | – | – | – | – | – | – | – | – | – | + | – | – | – | – |
| Сем. Erpobdellidae | ||||||||||||||
| Erpobdella nigricollis (Brandes) | – | – | – | – | – | – | – | – | – | + | – | – | – | – |
| Класс Malacostraca Отряд Amphipoda Сем. Gammaridae |
||||||||||||||
| Gammarus lacustris G.O. Sars | – | – | – | – | – | – | – | – | – | + | – | – | – | – |
| Класс Arachnida Сем. Limnesiidae |
||||||||||||||
| Limnesia koenikei (Piersig) | + | – | – | – | – | – | + | – | + | – | + | + | – | – |
| Limnesia undulata (O.F. Müller) | – | – | – | – | + | – | – | + | – | – | + | – | – | – |
| Сем. Pionidae | ||||||||||||||
| Piona pusilla (Neumann) | – | – | + | – | + | + | – | – | – | – | – | + | – | – |
| P. stjordalensis (Thor) | – | – | – | + | + | – | – | – | – | – | + | – | – | + |
| Класс Insecta Отряд Diptera Сем. Chironomidae |
||||||||||||||
| Procladius gr. choreus Meigen | + | + | + | + | + | + | – | + | – | + | – | + | – | + |
| P. ferrugineus Kieffer | – | – | – | – | – | + | – | + | + | – | – | – | – | – |
| Ablabesmyia phatta (Eggert) | – | + | + | – | – | – | – | – | – | – | – | – | + | – |
| Pseсtrocladius limbatellus (Holmgred) | – | + | – | – | – | – | – | – | – | – | – | – | – | |
| P. sordidellus (Zetterstedt) | – | – | – | + | – | – | – | – | – | – | – | + | – | – |
| Cricotopus cylindraceus Kieffer | – | – | – | + | – | – | – | – | – | – | – | – | + | – |
| Orthocladius consobrinus (Holmgren) | – | – | – | – | – | – | – | – | – | – | – | – | – | + |
| Zalutschia zalutschicola Lipina | – | + | – | – | + | – | – | – | – | – | + | – | + | – |
| Cryptochironomus obreptans (Walker) | + | – | + | + | – | + | – | – | + | + | + | + | + | + |
| С. agilis Linevitsh | – | + | – | – | – | – | – | – | – | – | – | – | – | – |
| C. redekei (Kruseman) | + | – | – | – | – | – | – | – | – | – | – | – | – | – |
| Corynocera ambigua Zetterstedt | – | – | – | – | – | – | – | – | – | – | – | – | – | – |
| Endochironomus donatoris Shilova | – | + | – | – | – | – | – | – | – | – | – | – | – | + |
| E. stackelbergi Goetghebuer | – | – | + | – | – | – | – | – | – | – | – | – | – | – |
| Einfeldia dissidens Walker | + | – | – | – | – | – | – | – | – | + | – | – | – | – |
| Glyptotendipes paripes (Edwards) | – | – | + | – | – | – | – | – | + | – | – | – | – | – |
| Microtendipes pedellus (De Geer) | – | + | + | – | – | – | – | – | + | + | – | – | – | + |
| Metriocnemus hygropetricus Kieffer | – | – | – | – | – | + | – | – | – | – | – | – | – | – |
| Microchironomus tener (Kieffer) | – | – | – | – | – | – | – | – | + | – | – | – | – | – |
| Pseudochironomus prasinatus (Staeger) | + | – | – | – | – | – | – | – | – | – | – | – | – | – |
| Chironomus plumosus (Linnaeus) | + | – | – | – | – | – | – | – | – | – | – | – | – | – |
| C. acutiventris Wulker et al. | – | – | – | – | – | – | – | – | + | + | – | – | – | + |
| Limnochironomus lobiger Kieffer | + | + | – | – | – | – | – | – | – | – | – | – | – | – |
| Stictochironomus gr. histrio Fabricius | + | – | – | + | – | – | + | – | – | – | – | – | – | – |
| S. crassiforceps (Kieffer) | – | – | – | – | – | – | – | – | – | – | – | – | – | + |
| Polypedilum nubeculosum (Meigen) | – | – | – | – | – | – | – | – | – | + | – | – | – | + |
| P. scalaenum (Schrank) | + | + | + | – | – | – | + | – | + | + | – | + | – | + |
| Cladotanytarsus gr. mancus (Walker) | + | + | – | + | + | – | + | – | – | + | + | + | + | – |
| Paratanytarsus austriacus (Kieffer) | – | – | + | – | – | – | – | – | – | – | – | – | – | – |
| P. siderophila (Zvereva) | – | – | – | – | – | – | – | – | – | – | – | + | – | – |
| Tanytarsus gregarius (Kieffer) | + | – | – | + | – | + | – | – | – | – | – | + | – | – |
| T. excawatus Edwardas, 1929 | – | – | – | – | + | – | – | – | – | – | – | + | – | – |
| T. pallidicornis (Walker) | – | – | – | – | – | – | + | – | – | – | – | – | – | – |
| Сем. Ceratopogonidae | ||||||||||||||
| Sphaeromias pictus (Meigen) | – | – | – | + | – | – | – | – | + | + | – | – | – | + |
| Polpomyia lineata (Meigen) | – | – | – | + | – | – | – | – | – | – | – | – | – | – |
| Culicoides nubeculosus (Meigen) | – | – | – | – | – | – | – | – | – | + | – | – | – | – |
| Сем. Chaoboridae | – | – | – | – | – | – | – | – | – | – | – | – | – | – |
| Chaoborus flavicans (Meigen) | + | – | + | + | – | – | – | – | – | – | – | + | – | – |
| Отряд Odonata Сем. Coenagrionidae |
– | – | – | – | – | – | – | – | – | – | – | – | – | – |
| Coenagrion pulchellum (Vander Linden) | – | – | – | – | – | – | – | – | – | – | – | – | – | + |
| Отряд Trichoptera Сем. Rhyacophilidae |
||||||||||||||
| Rhyacophila sp. | – | – | + | – | – | + | – | – | + | – | – | – | – | – |
| Сем. Limnephilidae | ||||||||||||||
| Limnephilus sp. | – | – | – | + | – | + | – | – | – | – | – | – | – | + |
| Сем. Molannidae | ||||||||||||||
| Molanna sp. | – | – | – | – | – | + | – | – | – | – | – | – | – | + |
| Сем. Phryganeidae | ||||||||||||||
| Oligotricha sp. | – | – | + | – | – | – | – | – | – | + | – | – | – | + |
| Число обнаруженных видов | 17 | 10 | 16 | 21 | 10 | 10 | 8 | 3 | 17 | 18 | 11 | 15 | 7 | 24 |
Рис. 2.
Соотношение основных таксономических групп по числу видов (%): 1 – пиявки, 2 – клещи, 3 – нематоды, 4 – амфиподы, 5 – стрекозы, 6 – хаоборусы, 7 – ручейники, 8 – цератопогониды, 9 – олигохеты, 10 – моллюски, 11 – хирономиды. Номера озер см. на рис. 1.
Среди макрозообентоса наиболее часто (40–45%) встречались Tubifex tubifex, Procladius gr. choreus и Cryptochironomus obreptans. Это эврибионтные виды с широким распространением и большой экологической пластичностью. Реже (20–30%) отмечались Pisidium amnicum, Euglesa juv., Potamothrix bedoti, Polypedilum scalaenum, Cladotanytarsus gr. mancus и Idiodorylaimus robustus Gagarin. Встречаемость остальных видов была <14%, что позволяет отнести их к редким.
Чтобы выявить доминантов, для каждого озера проведено ранговое распределение видов по их относительной численности (табл. 3). Анализ полученных данных показывал, что макрозообентос обследованных озер отличается по доминирующим видам и по их числу в сообществе (1–4). Невысокое число доминантов указывает на наличие лимитирующих факторов среды.
Таблица 3.
Доминирующие виды макрозообентоса по относительной численности (ni/N)
| Группа озер | Доминанты |
|---|---|
| 1-я группа | |
| Рангетур | Pseudochironomus prasinatus (0.25) |
| Томталяхтур | Procladius gr. choreus (0.19), Cladotanytarsus gr. mancus (0.16), Zalutschia zalutschicola (0.16) |
| Кытылэмтор-1 | Microtendipes pedellus (0.55) |
| 2-я группа | |
| Секъяунсоромлор | Cladotanytarsus gr. mancus (0.27) |
| Леналонколор | Procladius gr. choreus (0.42) |
| Качнылор | Tanytarsus gregarious (0.36), Metriocnemus hygropetricus (0.21) |
| Энтльлор | Tubifex tubifex (0.42), Lumbriculus variegatus (0.28) |
| 3-я группа | |
| Токтурилор | Procladius ferrugineus (0.6), Procladius gr. choreus (0.32) |
| Окунево | Pisidium amnicum (0.29), Parasphaerium nitidum (0.16) |
| Полынтур | Polypedilum nubeculosum (0.46) |
| 4-я группа | |
| Калач | Tubifex tubifex (0.33), Euglesa juv. (0.17), Spirosperma ferox (0.15) |
| Кытылэмтор-2 | Paratanytarsus siderophila (0.23), Idiodorylaimus robustus (0.17) |
| Монкетлор | Tubifex tubifex (0.27), Cladotanytarsus gr. mancus (0.23), Cryptochironomus obreptans (0.18), Pisidium amnicum (0.18) |
| Белое | Pisidium amnicum (0.28), Tubifex tubifex (0.18) |
Для оценки влияния НП на донные сообщества все исследованные озера разделяли на группы в соответствии с разработанным нормативом ПДУ содержания нефти и НП в ДО поверхностных вод для территории ХМАО [27]. Согласно действующему нормативу, первая группа озер соответствует фоновым с содержанием НП ≤20 мг/кг, вторая группа – слабо загрязненным озерам с содержанием НП 20–50 мг/кг, в их донных сообществах наблюдаются нарастающие изменения, связанные с обеднением состава. Третья группа образована сильно загрязненным озерам с содержанием НП 100–500 мг/кг, это область нарастающего угнетения донных сообществ. Четвертая группа соответствует экстремально загрязненным озерам с содержанием НП ≥500 мг/кг, наблюдается резкое угнетение донных сообществ. При планировании исследований предполагалось, что трансформация состава и структуры макрозообентоса в озерах связана с содержанием нефтепродуктов в донных отложениях и наихудшие условия для сообщества будут складываться в экстремально загрязненных озерах. Ниже приведены результаты исследований по каждой группе озер.
В 1-й группе зарегистрировано 32 вида и таксона рангом ниже рода, относящихся к семи систематическим группам: олигохеты, нематоды и моллюски, водяные клещи, хирономиды, ручейники, хаоборусы. Количество видов в озерах варьировало от 10 до 17.
В качественном отношении наиболее богаты хирономиды (20 видов), доля которых по водоемам составляла 50–100%, в среднем – 63% состава макрозообентоса. Самую высокую встречаемость (50%) имели Procladius gr. choreus и Cryptochironomus obreptans. Реже (25–35%) отмечались Cryptochironomus agilis, Limnochironomus lobiger, Cladotanytarsus gr. mancus, Paratanytarsus austriacus, Microtendipes pedellus и Polypedilum scalenum. Во всех озерах в группу доминирующих видов входили исключительно хирономиды (табл. 3). В каждом озере лидировали свои представители данного семейства. Коэффициент фаунистического сходства был 0.30–0.31.
Во второй группе также обнаружено 32 вида и таксона рангом ниже рода, относящихся к восьми систематическим группам: олигохеты, нематоды и моллюски, водяные клещи, хирономиды, цератопогониды, ручейники, хаоборусы. Количество видов в озерах варьировало от 8 до 21. В качественном отношении по-прежнему преобладали хирономиды (13 видов), доля которых по озерам составляла 33–50%, в среднем ≤41% всего состава. Наиболее частыми были представители Chironomidae (Procladius gr. choreus, 48% и Oligochaeta (Tubifex tubifex, 44%). В пределах 25–35% встречались Cladotanytarsus gr. mancus, Lumbriculus variegatus, Tanytarsus gregarius, Spirosperma ferox, Potamothrix bedoti. На остальные таксономические единицы приходилось <13%. Во всех озерах доминировали хирономиды, за исключением оз. Энтельлор, в котором преобладали олигохеты Tubifex tubifex и Lumbriculus variegatus. Коэффициент фаунистического сходства изменялся от 0.1 до 0.50, в основном 0.32–0.41.
В третьей группе озер отмечено 29 видов и таксонов рангом ниже рода, относящихся к девяти систематическим группам: олигохеты, пиявки, нематоды, моллюски, водяные клещи, хирономиды, цератопогониды, ручейники, амфиподы. Количество видов по озерам варьировало от 3 до 18. Наибольшим видовым богатством отличались хирономиды (11 видов), их доля по озерам составляла 41–67%, в среднем – ≤38% всего видового состава. Самая высокая встречаемость была у представителей Oligochaeta Tubifex tubifex (60%) и Mollusca (Euglesa juv., 50%). Несколько реже (35–45%) отмечались Potamothrix bedoti, Helobdella stagnalis, Cincinna depressa, Cryptochironomus obreptans, Polypedilum scalenum, Sphaeromias pictus, Procladius ferrugineus Kieffer, Procladius gr. choreus и Chironomus acutiventris. Встречаемость остальных таксонов была <20%. В группу доминирующих видов входили хирономиды и моллюски. В каждом озере лидировали свои виды. Коэффициент фаунистического сходства между озерами варьировал в пределах 0.10–0.40.
В четвертой группе озер зарегистрировано 39 видов и таксонов рангом ниже рода, относящихся к десяти систематическим группам: олигохеты, пиявки, нематоды, моллюски, водяные клещи, хирономиды, цератопогониды, ручейники, хаоборусы, стрекозы. Видовой состав в озерах варьировал от 7 до 24. В качественном отношении лидировали хирономиды (17 видов), доля которых по озерам была 27–71%, в среднем – 44%. Максимальная встречаемость отмечена у олигохет (Tubifex tubifex, 63% и Limnodrilus hoffmeisteri Claparede, 50%) и моллюсков (Pisidium amnicum, 50%). Реже (32–44%) встречались Procladius gr. choreus, Polypedilum scalenum и Cryptochironomus obreptans. Остальные таксоны отмечались с частотой <6%. В озерах доминировали представители олигохет, нематод, моллюсков и хирономид. Коэффициент фаунистического сходства изменялся от 0.19 до 0.46, в основном 0.23–0.42.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Полученные результаты по видовому составу донных сообществ согласуются с другими исследованиями, проводимыми на данной территории [33, 34, 36]. Состав макрозообентоса представлен видами с широкими, в основном, палеарктическими ареалами [9]. В целом, видовое богатство макрозообентоса озер невелико, что характерно для экосистем, сильно зависящих от лимитирующих физико-химических факторов [6, 25]. Число видов в каждом озере значительно варьирует (от 3 до 24), что указывает на специфичность условий обитания донных беспозвоночных в каждом водоеме. Это подтверждает и коэффициент фаунистического сходства между озерами 0.10–0.63, в большинстве случаев он изменяется в пределах 0.1–0.4. По-видимому, такие особенности вызваны еще и тем, что все водоемы изолированы и не связаны с сетью рек и проточных озер, способствующих распределению фауны.
В качественном отношении самая богатая таксономическая группа – хирономиды, на ее долю приходится 50% всего состава макрозообентоса (33 вида). Для представителей этой группы характерна и самая высокая встречаемость (40–45%), что свидетельствует о ее ведущей роли в донных сообществах водных экосистем Западной Сибири. Аналогичные результаты получены в работах [16, 31]. Помимо хирономид, в большинстве водоемов высокую встречаемость отмечена у олигохет, что позволяет отнести эту группу также к наиболее значимой для донных сообществ таежных озер.
Для выявления токсичного воздействия НП на макрозообентос был проведен сравнительный анализ видового состава и таксономической структуры по группам озер. В первой и второй группах озер было обнаружено одинаковое количество видов – 32, в третьей группе оно незначительно снижалось до 29, а в четвертой – увеличивалось до 39. Таким образом, в группе с экстремальным содержанием НП (500–2780 мг/кг) не было отмечено снижение видового богатства. Количество видов здесь находилось в основном на уровне с озерами, в которых содержание НП не превышает фоновых значений. Следует отметить, что наибольшее число таксонов было обнаружено в оз. Белое с максимальным содержанием НП.
От первой к четвертой группе озер увеличивалось число таксономических групп с 7 до 10. Во всех озерах в качественном отношении лидировали хирономиды, но доля их в общем числе видов макрозообентоса изменялась: максимальные показатели (63%) были зарегистрированы в первой группе озер с минимальным загрязнением НП, затем их доля в озерах второй и третьей групп резко снижалась до 41 и 38% соответственно с последующим возрастанием до 44% в четвертой группе. Хорошо была заметна тенденция увеличения доли моллюсков в макрозообентосе с 6 до 15%. Увеличение их доли в четвертой группе озер происходит за счет представителей сем. Valvatidae и Planorbidae.
В фоновых озерах максимальная частота встречаемости была у Chironomidae. В озерах второй и третьей групп наиболее высокая частота встречаемости была отмечена для видов трех таксономических групп: Chironomidae, Oligochaeta и Ceratopogonidae. В четвертой группе наиболее частыми были представители Oligochaeta и Mollusca. Хорошо прослеживалось изменение частоты встречаемости вида Tubifex tubifex от первой группы озер (15%) к четвертой (63%). Данный вид считается наиболее устойчивым к различным загрязнениям и служит индикатором полисапробных условий.
На имеющиеся различия в условиях обитания макрозообентоса по группам озер указывают и доминирующие комплексы, которые различаются по видовому составу и по числу входящих в них видов. По-видимому, происходящие изменения в доминирующих комплексах – это некий механизм компенсации или ответной реакции донных сообществ на изменения условий среды обитания. Если в фоновых озерах доминирующие комплексы представлены хирономидами, то в последующих группах озер в доминанты начинают выходить олигохеты и моллюски. Особенно это хорошо наблюдается для четвертой группы озер.
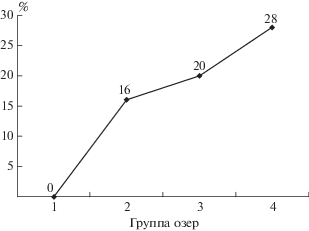
Чтобы получить количественную оценку, насколько озера различаются друг от друга, рассчитан индекс Матковского или индекс отклонения от фонового состояния. Он учитывает количество видов и их численность. За фон принята первая группа озер с минимальным уровнем загрязнения. Наибольший индекс отклонения (28%) от фоновых озер имеет четвертая группа (рис. 3). Полученное значение близко к границе слабое – среднее отклонение. Однако, согласно градации индекса, отклонения, составляющие <30%, считаются несущественными [18]. Они могут быть обусловлены не антропогенными, а более естественными причинами в экосистеме.
Для оценки влияния НП и ТМ на развитие донных сообществ был проведен корреляционный анализ биологических показателей (число видов макрозообентоса и число видов в отдельных таксономических группах) и токсикологических (содержания НП, Fe, Cu, Cr, Mn, Zn, Sr, Pb, Ni, Cd, Co). Достоверных связей между показателями макрозообентоса и НП в ДО не было обнаружено, несмотря на их высокое содержание в грунтах (табл. 4). Полученные нами результаты подтверждаются данными ряда авторов [8, 17, 29]. Согласно работам [24, 29], при попадании нефти в водоем легкие фракции нефти (парафины) испаряются, а тяжeлые опускаются на дно и трансформируются. С течением времени остаточные НП становятся менее токсичные или превращаются в нетоксичную органику нефти, которая может вызывать увеличение количественных показателей бентоса.
Таблица 4.
Коэффициенты корреляции между показателями зообентоса и содержанием (мг/кг) НП и ТМ в донных отложениях
| Показатель | НП | Mn | Zn | Sr | Pb | Co |
|---|---|---|---|---|---|---|
| Общее число видов | –0.17 (0.55) | 0.32 (0.25) | 0.19 (0.51) | –0.05 (0.8)6 | 0.16 (0.58) | 0.48 (0.08) |
| Число видов: | ||||||
| хирономиды | –0.40 (0.16 | 0.03 (0.91) | –0.21 (0.47) | –0.51 (0.06) | 0.15 (0.60) | –0.07 (0.81) |
| моллюски | 0.44 (0.11) | 0.54 (0.04) | 0.60 (0.02) | 0.05 (0.87) | 0.41 (0.15) | 0.37 (0.19) |
| олигохеты | –0.02 (0.93) | –0.04 (0.88) | 0.23 (0.42) | 0.59 (0.02) | –0.27 (0.34) | 0.53 (0.053) |
| цератопогониды | –0.02 (0.94) | 0.79 (0.001) | 0.08 (0.78) | –0.11 (0.71) | –0.10 (0.73) | 0.10 (0.73) |
| ручейники | 0.01 (0.96) | –0.07 (0.7) | –0.09 (0.76) | –0.15 (0.60) | 0.22 (0.46) | 0.17 (0.57) |
| хаоборусы | –0.26 (0.37) | –0.31 (0.27) | –0.35 (0.22) | –0.18 (0.53) | 0.15 (0.60) | –0.05 (0.88) |
| нематоды | –0.15 (0.60) | 0.14 (0.62) | 0.25 (0.39) | –0.09 (0.77) | –0.24 (0.41) | 0.78 (0.001) |
| клещи | –0.13 (0.66) | –0.08 (0.77) | 0.16 (0.58) | 0.89 (0.0001) | –0.26 (0.37) | 0.50 (0.06) |
| пиявки | 0.52 (0.06) | 0.76 (0.002) | 0.50 (0.07) | –0.19 (0.52) | 0.60 (0.02) | 0.0008 (0.99) |
Выявлены статистически значимые положительные корреляции между количеством видов отдельных таксономических групп (моллюсков, олигохет, цератопогонид, нематод, клещей, пиявок) и содержанием ТМ (Mn, Zn, Sr, Co и Pb) при р <0.05 (табл. 4).
С одной стороны, такая положительная связь объясняется тем, что илистые грунты интенсивно аккумулируют загрязняющие вещества и наиболее привлекательны для бентоса [17]. По существу, это не причинная связь, а опосредованная косвенная. С другой стороны, полученные положительные корреляции могут свидетельствовать о высокой значимости этих элементов в жизни гидробионтов [19, 20, 38, 40]. Известно, что Zn, Mn, Sr и Co относятся к эссенциальным элементам, обладают высокой биофильностью, которые включены в метаболизм, участвуют в окислительно-восстановительных реакциях и входят в состав коферментов организмов. Дефицит или избыток этих биофильных металлов приводят к неблагоприятным проявлениям в организме. Следует учесть и то, что биоаккумуляция этих элементов увеличивается в низкоминерализованных и закисленных водах [20].
Установлена положительная связь количества видов моллюсков с концентрацией Mn и Zn (табл. 4). Аналогичные результаты ранее получены И.В. Чернышовой [40]. Максимальное количество этих элементов обнаружено в тканях и раковине моллюсков. Причем, двустворчатые моллюски активнее концентрируют Mn, а брюхоногие – Zn. Отмечено, что моллюски извлекают в больших количествах металлы, содержание которых максимально в окружающей среде. В наших исследованиях наибольшее содержание этих элементов приходится на озера третьей и четвертой групп, что, по-видимому, и способствовало увеличению доли моллюсков в макрозообентосе и появлению их в составе доминирующих комплексов. Положительную корреляцию количества видов клещей с Sr можно объяснить тем, что клещи обитают на поверхности грунта и им необходим жесткий экзоскелет, при построении которого используются ряд элементов, в том числе и Sr [11]. Sr относится к строительным материалам организмов, после Ca и Mg он – один из важнейших элементов для роста твердых покровов [38, 41]. Корреляционный анализ показал связь числа видов пиявок с Mn и Pb, что согласуется с работами [14, 39]. Pb относится к эссенциальным элементам, но вследствие высокого сходства с Ca включается в метаболические процессы. Наиболее активно его биоаккумуляция происходит в низкоминерализованных водах при низких pН [20]. В работах [14, 38] отмечается высокая способность хищных и кровососущих пиявок (особенно в период интенсивного роста) к накоплению Pb, что позволяет отнести их к макроконцентраторам Pb. В большинстве обследованных нами озер Pb в ДО не обнаружен, что указывает на преимущественно трофический путь поступления этого элемента в организм пиявок и о наличии механизмов его регуляции [39].
Выводы. В составе макрозообентоса исследованных озер было обнаружено 65 видов и таксонов рангом ниже рода, относящихся к 11 систематическим группам. Наибольшее количество видов было отмечено у хирономид. Видовое богатство макрозообентоса в каждом озере невысокое. Индекс фаунистического сходства между озерами значительно варьировал (0.10–0.63). В донных сообществах озер наиболее часто встречались хирономиды и олигохеты. В озерах с сильным и экстремальным загрязнением НП частота встречаемости олигохет увеличивается. В фоновых озерах по относительной численности однозначно доминируют хирономиды. При повышении содержания НП в ДО доминирующие комплексы становятся более разнообразными за счет олигохет, моллюсков и нематод. В озерах с экстремальным содержанием НП не было отмечено резкого угнетения донных сообществ, что подтверждается индексом Матковского. Были получены достоверные положительные зависимости числа видов ряда таксонов с содержанием ТМ (Mn, Zn, Sr, Pb и Co), однако достоверные связи этого показателя с НП в ДО не были выявлены.
Список литературы
Алекин О.А. Основы гидрохимии. Л.: Гидрометеоиздат, 1970. 443 с.
Биохимическая трансформация нефтяных углеводородов в водах Западной Сибири // Вестн. Тюмен. гос. ун-та. 2012. № 12. С. 38–48.
Воробьев Д.С. Влияние нефти и нефтепродуктов на макрозообентос // Изв. Томск. политех. ун-та. 2006. Т. 309. № 3. С. 42–45.
Гашев С.Н., Бетляева Ф.Х., Лупинос М.Ю. Математические методы в биологии: анализ биологических данных в системе STATISTICA. Тюмень: Изд-во Тюмен. гос. ун-та, 2014. 207 с.
Гидрохимические показатели состояния окружающей среды. Справочные материалы. М.: Эколайн, 2000. 87 с.
Голубков С.М. Водные экосистемы в условиях экстремальных факторов внешней среды: влияние высокой солености воды и других видов экологического стресса // IX Съезд Гидробиол. об-ва РАН: Тез. докл. Тольятти, 2006. Т. 1. С. 109.
ГОСТ 17.1-1.02-77 Охрана природы. Гидросфера. Классификация водных объектов, действует на всей территори РФ с изменениями от 01.07.2013 г. 1977. 13 с.
Ершов Ю.В., Баканов А.И., Бисеров В.И., Бикбулатова Е.М. Органическое вещество, битумоиды и углеводороды в донных отложениях водохранилищ Волги и их влияние на макрозообентос // Органическое вещество донных отложений волжских водохранилищ. СПб.: Гидрометеоиздат, 1994. С. 74–92.
Жукова О.Н., Безматерных Д.М. Состав и структура макрозообентоса Карасукской озерно-речной системы (Западная Сибирь) // Мир науки, культуры, образования. 2010. № 2. С. 285–289.
Исаченко-Боме Е.А. Оценка современного состояния водных экосистем бассейна реки Туры по структуре макрозообентоса в условиях хронического антропогенного воздействия: Дис. … канд. биол. наук. Борок, 2004. 268 с.
Кожахметова А.Н. Биондикационное исследование аккумуляции нефтепроизводных, тяжелых металлов в организме гидробионтов казахстанской зоны Каспия Фундаментальные исследования. 2015. № 2. Ч. 1. С. 58–62.
Киреева И.Ю. Особенности мониторинга биоразнообразия водных экосистем // Научный альманах. 2015. № 5(7). С. 158–165.
Козин В.В. Кондо-Ваховская ландшафтная область // Большая Тюменская энциклопедия. 2004. Т. 2. С. 120–121.
Ковальчук Л.А., Чёрная Л.В., Тарханова А.Э., Нохрина Е.С. Основной обмен и содержание микроэлементов в тканях медицинских пиявок из природных популяций и выращенных в искусственных условиях биофабрики // Вестн. Урал. мед. акад. науки. 2007. № 4. С. 49–53.
Комплексное гидрохимическое и биологическое исследование качества вод и состояния водных и околоводных экосистем. Методическое руководство. Ч. 1: Полевые исследования ТюмГУ. Тюмень: Изд-во Тюмен. гос. ун-та, 2011. 128 с.
Кузикова В.Б. Зообентос водоемов Обского бассейна и его использование для оценки качества водной среды // Гидробионты Обского бассейна в условиях антропогенного воздействия. СПб.: Гос.НИИ озер. и реч. рыб. хоз-ва, 1995. Вып. 327. С. 49–55.
Литвинов А.С., Баканов А.И., Законнов В.В., Кочеткова М.Ю. О связи показателей донных сообществ с некоторыми характеристиками среды обитания // Вод. ресурсы. 2004. Т. 31. № 5. С. 611–618.
Матковский А.К. Один из подходов оценки предельно допустимого вредного воздействия (ПДВВ) на водоем // Контроль и реабилитация окружающей среды: Матер. IV Междунар. симп. Томск, 2004. С. 145–146.
Махлун А.В. Микроэлементный состав донных сообществ авандельты Волги и западной части Северного Каспия: Автореф. дис. … канд. биол. наук. Севастополь, 2017. 23 с.
Моисеенко Т.И. Водная экотоксикология: теоретические и прикладные аспекты. М.: Наука, 2009. 400 с.
Моисеенко Т.И., Гашев С.Н., Шалабодов А.Д. Качество вод и устойчивость экосистем: теоретические и прикладные аспекты исследований // Вестн. Тюмен. гос. ун-та. 2012. № 12. С. 6–16.
Московченко Д.В., Валеева Э.И. Исследование состава донных отложений рек бассейна нижней Оби (в пределах Ханты-Мансийского автономного округа) // Вестн. экологии, лесоведения и ландшафтоведения. 2001. № 2. С. 138–142.
Московченко Д.В., Бабушкин А.Г. Экогеохимия гидросферы на участках нефтедобычи Западной Сибири. Saarbrüсken: LAP Lambert Acad. Publ., 2012. 116 с.
Немировская И.А. Нефтяные углеводороды в океане // Природа. 2008. № 3. С. 17–27.
Одум Ю. Экология. М.: Мир, 1986. Т. 2. 376 с. (Odum E.P. Basic ecology. Philadelphia: CBS College Publ., 1983. V. 2. 376 p).
Песенко Ю.А. Принципы и методы количественного анализа в фаунистических исследованиях. М.: Наука, 1982. 287 с.
Постановление № 441п Правительства ХМАО-Югры от 10.10.2004 г. “Об утверждении регионального норматива “Предельно допустимый уровень содержания нефти и нефтепродуктов в донных отложениях поверхностных водных объектов на территории Ханты-Мансийского автономного округа – Югры” (с изменениями на: 22.07.2016). Ханты-Мансийск: Правительство ХМАО, 2016. 3 с.
Родь Ю.С. Влияние нефтегазового сектора на экономику Ханты-Мансийского автономного округа – ЮГРЫ // Экономика и социум. 2014. № 3(12). С. 116–120.
Рузанова А.И., Воробьев Д.С. Трансформация донных сообществ в условиях нефтяного загрязнения // Экология пойм сибирских рек и Арктики. Новосибирск: Изд-во СО РАН, 1999. С. 71–78.
Сапрыкина А.Ю. Технология снижения содержания нефтепродуктов в воде малых и средних рек: Автореф. дис. … канд. техн. наук. Екатеринбург, 2004. 32 с.
Степанова В.Б., Шарапова Т.А. Фауна хирономид Западной Сибири // Вестн. экологии, лесоведения и ландшафтоведения. Тюмень: Изд-во Ин-та проблем освоения Севера РАН, 2001. С. 117–124.
Уварова В.И. Гидрохимическая характеристика водотоков Нижней Оби // Вестн. экологии лесоведения и ландшафтоведения. 2011. № 11. С. 132–142.
Шарапова Т.А. Зообентос и зооперифитон р. Иртыш // Гидробиол. журн. 1998. № 4. С. 32–44.
Шарапова Т.А. К изучению зообентоса бассейна р. Демьянки // Вестн. экологии лесоведения и ландшафтоведения. 2012. № 12. С. 111–118.
Элементный состав нефти и рассеянного органического вещества и методы их изучения; учебно-методическое пособие. Казань: Казан. ун-т, 2012. 25 с.
Юхнева B.C. Бентос нижней Оби и использование его рыбами: Тез. докл. 11 съезда ВГБО. Кишинев, 1970. С. 423–424.
Яныгина Л.В. Структура зообентоса и оценка экологического состояния р. Ишим // Мир науки, культуры, образования. 2009. № 6. С. 21–22.
Чемагин А.А. Биотическая аккумуляция тяжелых металлов макрозообентосом нижнего Иртыша // Современные проблемы науки и образования. 2015. № 5. http://www.science-education.ru/ru/article/view?id=21455
Черная Л.В. Эколого-физиологические особенности кровососущих и хищных пиявок (Hirudinea, Hirudinidae): Автореф. дис. … на соиск. уч. степени д.б.н. Тюмень, 2015. 36 с.
Чернышова И.В. Функциональное значение моллюсков в миграции тяжелых металлов: Автореф. дис. … на соиск. уч. степени к.б.н. М., 1992. 28 с.
Bury N.R. Nutritive metal uptake in teleost fish // J. Exp. Biol. 2003. V. 206. № 1. P. 11–23.
Дополнительные материалы отсутствуют.
Инструменты
Биология внутренних вод