Биология внутренних вод, 2019, № 4-1, стр. 33-40
Экология и сезонное развитие Ranunculus nipponicus Nakai (Batrachium, Ranunculaceae) в незамерзающих водотоках северного побережья Охотского моря
Е. А. Андриянова 1, О. А. Мочалова 1, *, Е. А. Мовергоз 2
1 Институт биологических проблем Севера Дальневосточного отделения Российской академии наук
685000 Магадан, ул. Портовая, 18, Россия
2 Институт биологии внутренних вод им. И.Д. Папанина Российской академии наук
152742 Некоузский р-н, Ярославская обл., пос. Борок, Россия
* E-mail: mochalova@inbox.ru
Поступила в редакцию 12.04.2018
После доработки 29.05.2018
Принята к публикации 01.08.2018
Аннотация
Изучены экология и сезонное развитие Ranunculus nipponicus Nakai (Batrachium, Ranunculaceae) в незамерзающих водотоках северного побережья Охотского моря (59° с.ш.), где впервые на территории России отмечены круглогодичные вегетация и цветение водяного лютика без прохождения стадии зимнего покоя. Во все месяцы года наблюдается рост побегов, формирование молодых корней, бутонов и клейстогамных цветков при среднемесячной температуре воды от +0.1 до +5.8°С. Наиболее интенсивное образование молодых корней в феврале–марте и подводных цветов в конце марта–начале апреля не связано с повышением температуры воды. Клейстогамное цветение редко приводит к созреванию семян, возможно, из-за слишком низкой температуры воды.
ВВЕДЕНИЕ
Ranunculus nipponicus Nakai (Batrachium, Ranunculaceae) – бореальный восточно-азиатский вид, распространенный в северо-западной Пацифике: в Японии и на российском Дальнем Востоке [23]. Сведения о его биологии отрывочны и приводятся лишь для японской части ареала [16]. Есть данные, что вид пригоден к использованию в пищу [20], отличается высоким уровнем внутрипопуляционного генетического разнообразия [17] и может активно поглощать нитраты из прохладной воды [22]. В Японии проводятся исследования факторов, способных сократить численность R. nipponicus в природных популяциях [21].
Особенности биологии и ритмов развития отдельных видов рода Ranunculus секции Batrachium рассмотрены во многих публикациях [5, 6, 9, 11–15, 19, 25 и др.], но в основном для ограниченного числа широко распространенных видов. Исследование биологии водяных лютиков в районах распространения многолетней мерзлоты ранее не проводили, за исключением нашей работы [1], где даны первые сведения о круглогодичной вегетации R. nipponicus на этой территории.
Цель работы – изучить сезонное развитие R. nipponicus в незамерзающих водотоках северного побережья Охотского моря.
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
Биологию и ритмы развития R. nipponicus изучали на юге Магаданской обл. с 2013 по 2018 гг. Наблюдения (1–4 раза с ноября по май) проводили на незамерзающих в течение зимы участках в бассейнах рек Ола и Яма, впадающих в Охотское море восточнее г. Магадан: 1) в притоках р. Ола – р. Угликан (59.6149° с.ш., 151.3120° в.д.), р. Танон (59.6107° с.ш., 151.2640° в.д.) и нижнем течении р. Ланковая (59.6849° с.ш., 151.3991° в.д.); 2) в притоках р. Яма – р. Неутер (59.9147° с.ш., 153.2676° в.д.), руч. Гнутый (59.8486° с.ш., 153.2800° в.д.) и руч. Аллельный (59.8077° с.ш., 153.3801° в.д.). Отдельные наблюдения проводились в реках Кава, Невта (бассейн р. Тауй), в верхнем и среднем течениях р. Ланковая и в ее притоке р. Белая. Растения исследовали на нескольких участках каждого из водотоков протяженностью 50–100 м. Фиксировали размеры растений, наличие молодых растущих корней, молодых (неразвернувшихся) и отмирающих листьев, бутонов, цветков и плодов.
В р. Угликан регулярные фенологические наблюдения проводили 1 раз в месяц с ноября 2015 г. по февраль 2018 г., биоморфологический анализ растений – в 2017 г. по четырем съемкам (15.02, 12.05, 29.07, 13.10). У 10–15 растений измеряли длину побега, число и длину междоузлий, отмечали число и порядок ветвления придаточных корней, наличие/отсутствие молодых и зачаточных (до 2–3 мм) корней, длину и количество листьев, длину цветоножки, размеры и количество бутонов и цветков.
На всех этапах работы проводили фотосъемку растений и собирали гербарий. При температуре воздуха <–5°С растения помещали в термос с последующей гербаризацией в помещении. Основные сборы хранятся в гербарии Института биологических проблем Севера ДВО РАН (MAG), дублеты – в Институте биологии внутренних вод РАН (IBIW).
В р. Угликан одновременно с фенологическими наблюдениями с февраля 2016 г. по ноябрь 2017 г. ежедневно измеряли температуру воды с использованием автоматических регистраторов температуры iBDL (iButton Data Loggers) (термограф DS1922L-F5, диапазон измерений –40…+85°С, точность 0.5°С) и не реже раза в месяц отмечали состояние ледового покрова. Наблюдения за температурой воды в р. Неутер проводили с декабря 2013 г. по март 2014 г. Основные физико-химические свойства воды (pH, минерализацию) изучаемых водных объектов определяли с помощью портативного анализатора Hanna Combo HI 98129.
Природные условия района исследований. По климатическому районированию северное побережье Охотского моря находится в зоне приморского климата тундры и лесотундры [4]. Весеннее повышение температуры воды в реках (переход через 0.2°С) происходит 15–25 мая. Среднемесячная температура воды в реках за период с июня по сентябрь находится в пределах 6–10°С. Переход через 0.2°С в сторону понижения происходит 10–25 октября, лед устанавливается в конце октября–начале ноября. Весеннее таяние льда начинается в первой половине мая, полное очищение водотоков – в конце мая [3].
При характеристике мерзлотных и гидрогеологических особенностей Магаданской обл. отмечается обилие наледей и таликов. Пойменные талики – уникальное явление, распространенное преимущественно на северо-востоке Азии. В долинах большинства рек этого региона значительная часть стока идет в толще аллювиальных отложений. Летом за счет конвективного теплообмена между грунтовыми и поверхностными водами прогреваются аллювиальные отложения в зоне талика, занимающего обычно всю пойму реки, а вода в русле прогревается слабо. Зимой талик остывает настолько медленно, что запасов тепла часто хватает на поддержание системы открытых всю зиму полыней [7, 8].
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Номенклатура и морфологическое описание. Современные таксономия, морфологическое описание и распространение вида опубликованы G. Wiegleb с соавт. [23].
Ranunculus nipponicus Nakai, Bot. Mag. (Tokyo) 42:19 (1928). – B. nipponicum (Nakai) Kitam. 1962, Acta Phytotax. Geobot. 20:204. – Водяной лютик, шелковник японский. Бореальный восточноазиатский вид, распространенный на Дальнем Востоке России в реках бассейна Охотского моря в Магаданской и Сахалинской областях, в Хабаровском крае, а также в Японии и, возможно, в северо-восточном Китае [23].
Лютик японский – многолетний травянистый симподиально нарастающий поликарпик с удлиненным погруженным в воду побегом длиной 30–70 см. Стебли голые, сильно ветвящиеся. По всей длине побега междоузлия удлиненные, сближенные только в апикальной части. От узлов в нижней части основного побега отходят боковые побеги n + 1-го порядка (бóльшего порядка ветвления нет), состоящие из 1–4 метамеров с листьями в каждом узле и придаточными корнями. Растение гетерофильное. Плавающие и переходные листья немногочисленны, в условиях потока образуются редко. Плавающие листья округло-почковидные (0.7–1.5) × (1.5–2.5) см, трех-, пятираздельные; сегменты продолговатые, шириной 0.2–0.5 см, цельнокрайние. Изредка отмечены переходные листья, разделенные на 7–11 ланцетных долей. Погруженные листья зеленые, темно-зеленые, на черешках 0.5–3.0 см, округлые, трех-, пятирассеченные на многочисленные нитевидные сегменты; вне воды листья слипаются. Цветоножки голые, ко времени плодоношения удлиняются до 3.0–8.0 см. Цветки ~1.5 см в диаметре. Чашелистики зеленые, эллиптические, (4–5) × (3–4) мм. Лепестки продолговато-округлые, обратнояйцевидные, (4–7) × (3–5.5) мм, белые с желтым пятном в основании, нектарник полулунной формы. Тычинок 10–15. Цветоложе слабо опушенное. Плоды 4 мм в диаметре с 9–12 зрелыми орешками до 1.5 мм длины.
Считается гибридогенным видом, произошедшим от R. mongolicus (Kryl.) Serg. и R. trichophyllus Chaix [17]. Несмотря на свою гибридогенную природу, вид высоко фертилен, так как оба родителя тетраплоиды (2n = 32). Число хромосом 2n = 32 определено для R. nipponicus в трех точках на территории Магаданской обл. [10].
Наряду с водной формой встречается и наземная форма, которая образуется при резком падении уровня воды и в результате укоренения фрагментов побегов на влажных участках берега. Она представляет собой укороченный побег с несколькими междоузлиями и небольшими (в 2 раза меньше обычных) листьями с жесткими нитевидными долями. Встречается единично с середины июля до середины сентября.
Экология. Круглогодичная вегетация растений отмечена на незамерзающих участках небольших рек и ручьев, паводки на которых не такие мощные, как на большинстве горных рек Охотоморского бассейна. R. nipponicus обычно произрастает в медленно текущих реках до 7 (10) м ширины и на приустьевых участках их мелких притоков с торфянистым или торфяно-галечным дном. Вода в этих водотоках холодная, нейтральная, слабоминерализованная, например, в р. Угликан pH 6.9–7.1, минерализация 36.1–44.8 мг/л, в р. Неутер – 6.8 и 33.1 мг/л соответственно. Средняя скорость течения 0.6–0.8 м/с (по данным топографических карт). Изредка R. nipponicus встречается по старицам и затонам на крупных реках с быстрым течением, например Ланковая и Халанчига. На руслах рек с сильным течением и на крупногалечном дне шелковник не может закрепиться и выжить, особенно в паводки.
В незамерзающих зимой водотоках совместно с шелковником чаще всего встречаются R. gmelinii DC., Alopecurus aequalis Sobol., мхи (Hygrohypnella ochracea (Turner ex Wilson) Ignatov et Ignatova) и водоросли (Hydrurus foetidus (Villars) Trevisan).
Основные местообитания шелковника в водотоках, где отмечена зимняя вегетация, можно объединить в три группы: I. Участки глубиной 0.2–0.5 м, дно торфянисто-галечное или песчано-галечное, течение быстрое; расположены ниже перекатов около мест слияния рукавов или в местах впадения небольших ручейков. Нередко ≤10–30% дна покрыто мхами, доминирует Hygrohypnella ochracea, изредка растет Fontinalis antipyretica Hedw. Это наиболее распространенные местообитания шелковника. Здесь он представлен в основном плагиотропными побегами длиной ≤20–30 см с многочисленными спиралевидно скрученными придаточными корнями. В местах с подвижным песчаным грунтом побеги частично погружены в грунт. II. Участки глубиной 0.5–1 м, дно торфянистое или торфянисто-галечное и течение медленное (ямы). В таких местонахождениях преобладают крупные растения с плагиотропными и ортотропными побегами размером >30–50 см с длинными (~5 см) междоузлиями. III. Места выходов таликовых вод, глубина 0.2–0.7 м, дно вязкое торфянистое, находятся обычно в истоках ручьев. Для них характерны мощные маты нитчатых зигнемовых водорослей. R. nipponicus представлен плагиотропными и ортотропными побегами 20–40 см длиной, с более короткими, чем у растений в моховой дернине, корнями.
На незамерзающих участках рек перекаты не покрываются льдом всю зиму, лишь вдоль берега иногда образуется тонкая корка льда. На ямах в сильные морозы появляется лед толщиной 1–2 см. Во время оттепелей он полностью или частично тает, даже если температура воздуха ≤0°С. В р. Угликан в 2014–2018 гг. ледяной покров наблюдали лишь в феврале 2016 г., подо льдом находилось ~50% мест произрастания R. nipponicus.
Изменения средней полумесячной температуры воды в двух местообитаниях шелковника в течение года представлены на рис. 1. В р. Угликан в 2016–2017 гг. логгер находился в 1 м от переката на глубине 0.3–0.5 м в 0.1 м от дна, в р. Неутер – зимой 2013–2014 гг. в яме глубиной ~1 м в 0.1 м от дна.
Рис. 1.
Динамика температуры воды в исследованных местообитаниях шелковника: 1 – р. Угликан в 2015–2016 гг., 2 – р. Угликан в 2017 г., 3 – р. Неутер в 2013–2014 гг. Значки на графиках – средние полумесячные значения, разрывы – отсутствие данных из-за всплытия логгера и вмерзания в лед под берегом или снятия логгера на время паводка.
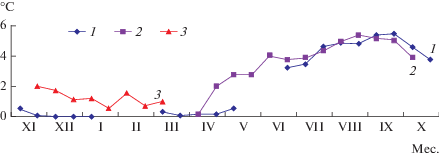
Температура воды с ноября по апрель относительно постоянна – от +0.1 до +2.0°С в зависимости от глубины и расстояния до выхода таликовых вод. Повышение температуры воды начинается в конце апреля–начале мая, достигая максимума в августе–сентябре. С июня по октябрь среднемесячная температура изменяется от +3.2 до +5.8°С, максимальная +9°С. Наиболее значительные колебания температуры в течение суток наблюдаются в мае–июне: от 3–4 до 7–8°С. Низкая температура воды летом и медленное остывание осенью – характерная особенность рек с таликами [7, 8].
Сезонное развитие. В Магаданской обл. в незамерзающих водотоках R. nipponicus существует в виде постоянно растущих побегов до 20–30 (60) см длины. Внешние различия растений в разные сезоны года незначительны. Зимой листья более жесткие, темно-зеленого, зеленовато-бурого цвета, стебли и корни часто приобретают бурый оттенок. Размеры листьев без черешков зимой наиболее вариабельные по сравнению с другими сезонами года, так как имеются крупные старые и небольшие молодые листья. Рост растений продолжается в течение всего года, но в октябре–январе замедляется. Активизация роста перезимовавших побегов начинается с конца февраля–начала марта и не связана с повышением температуры воды (рис. 1). В конце февраля–марте на побегах в среднем из 5–6 метамеров отмечается образование многочисленных узловых придаточных корней 1-го порядка. В это время растения легко обламываются, что говорит о начале периода дезинтеграции. Отделившиеся фрагменты имеют 2–4 метамера с листьями и корнями в каждом узле.
В марте–апреле происходит частичное отмирание листьев и корней, появляются многочисленные молодые корни, увеличивается число метамеров. К середине мая плагиотропные моноподиально нарастающие побеги шелковника имеют в среднем восемь метамеров, их средняя длина не меняется, на побеге развито в среднем четыре боковых побега n + + 1-го порядка (табл. 1). Длина придаточных корней увеличивается до 6 см, порядок ветвления корней не повышается.
Таблица 1.
Морфометрические показатели Ranunculus nipponicus на р. Угликан в 2017 г.
| Морфометрические показатели | Дата сбора растений | |||
|---|---|---|---|---|
| 15.02 | 12.05 | 29.07 | 13.10 | |
| Длина растения, см | 16.9 ± 5.8 | 23.1 ± 6.5 | 25.7 ± 13.7 | 20.9 ± 8.8 |
| Среднее число метамеров | 5.9 | 8.4 | 8.6 | 7.6 |
| Средняя длина междоузлий, см | 2.4 ± 1.3 | 2.3 ± 1.0 | 2.6 ± 1.2 | 2.3 ± 1.4 |
| Среднее количество боковых побегов | 3.5 | 4.1 | 5.3 | 1.3 |
| Среднее число листьев | 5.0 | 5.3 | 5.3 | 5.1 |
| Средняя длина листьев с черешком, см | 2.5 ± 0.8 | 2.9 ± 0.7 | 2.7 ± 0.4 | 3.2 ± 0.7 |
| Средняя длина листьев без черешка, см | 2.0 ±1.8 | 1.6 ± 0.4 | 1.2 ± 0.2 | 2.0 ± 0.5 |
| Среднее число бутонов | 0.8 | 0.4 | 0.4 | 0.4 |
| Среднее число клейстогамных цветков | 0 | 0.1 | 0.2 | 0 |
| Средняя длина придаточных корней, см | 4.6 ± 3.0 | 6.2 ± 3.4 | 7.4±3.7 | 4.2 ± 2.4 |
| Макс. длина придаточных корней, см | 15.0 | 15.0 | 15.5 | 11.5 |
| Порядок ветвления придаточных корней | I | I | II | II |
Летом растения из незамерзающих водотоков нарастают медленно. Вегетативно-генеративные побеги сильно варьируют по длине (20–50 см) и количеству метамеров (6–15). Количество боковых побегов самое высокое за год (>5). Незначительно возрастает количество растений с бутонами и цветками. Цветоножки сильно различаются по длине (от 1 до 5 см). На боковых побегах бутоны и цветки образуются крайне редко. Цветение растений на р. Угликан отмечалось только подводное, клейстогамное.
В сентябре–октябре происходит фрагментирование побегов. В октябре–ноябре отмечены многочисленные укоренившиеся фрагменты побегов из трех–четырех метамеров с листьями в каждом узле, отдельными мелкими цветочными почками на коротких цветоножках и с многочисленными корнями.
Молодые придаточные корни образуются на побегах постоянно. Минимальное их число было в декабре (≤1–2 на побег), максимальное – в марте (по 4–5, изредка до 15 на побег). Ежемесячные определения ростовой активности с помощью митотического индекса в зоне роста кончика корня показали, что скорость роста корней наименьшая в октябре–декабре, наибольшая – в феврале–марте. Листья остаются зелеными всю зиму. На самых мелких участках они приобретают бурый оттенок в начале зимы, но частично отмирают только в марте–апреле.
Образование цветочных почек R. nipponicus происходит всю зиму. Единичные крупные бутоны встречаются и на мелководье, и на глубине круглый год. Если света достаточно, цветоножки удлиняются до 3 (8) см и под водой развиваются клейстогамные цветки с полураскрытыми зеленовато-белыми или желтовато-белыми лепестками (рис. 2). При целенаправленных поисках одиночные цветки отмечали во все месяцы года, хотя были периоды, когда их не удалось обнаружить. Многочисленные отцветшие цветки, не завязавшие плодов, зарегистрированы в разных реках в марте–апреле (13.03.2016 г., 01.04.2017 г., 06.04.2017 г.).
Рис. 2.
Ranunculus nipponicus в начале апреля: а – фрагмент побега с отцветшим клейстогамным цветком, б – плоды с молодыми семенами, в – клейстогамный цветок с начинающими осыпаться лепестками.

Плоды, образовавшиеся из клейстогамных цветков под водой (рис. 2), выявлены нами трижды – в р. Неутер 06.04.2017 г. (~50% отцветших растений), в устье р. Танон 01.04.2017 г. и в верховьях р. Ланковая 30.06.2016 г. (единичные растения). При плодоношении цветоножки удлиняются до 10–12 (7) см и отмирают (при сборе плодоносящих растений почти все цветоножки ломались), т.е. плоды обычно отрываются от растения и уносятся течением еще до полного созревания семян. Таким образом, цветение отдельных растений может происходить в любое время года, но в зимние месяцы цветочная почка не развивается в полноценный цветок и не продуцирует жизнеспособные семена.
За период исследования ни разу не удалось собрать всхожие семена R. nipponicus. Летом семена были собраны лишь однажды – в начале августа 2012 г. в период низкого уровня воды в р. Ланковая. Они не проросли, возможно, из-за незрелости. Семена, образовавшиеся из клейстогамных цветков и собранные в апреле 2017 г. на р. Неутер, были пустые.
Наблюдения за сезонным развитием R. nipponicus в покрытых зимой льдом и лучше прогревающихся летом водотоках, преобладающих на территории Магаданской обл., отрывочны. В протоке р. Олы в середине мая сразу после ледохода было собрано ~10 коротких побегов растения длиной 10–15 см с мелкими жесткими листьями темно-зеленого цвета и без цветочных почек. В устье притока р. Кава в конце сентября (уже образовывались забереги, но до формирования сплошного ледового покрова было около месяца) наблюдались длинные плагиотропные побеги R. nipponicus с мелкими зелеными листьями и малочисленными мелкими цветочными почками на коротких цветоножках.
После схода льда активный рост побегов начинается в июне. Массовое цветение и плодоношение происходит при низком уровне воды и теплой погоде. Такие условия складываются не каждый год, поэтому круглогодичная вегетация без перехода к массовому цветению обычна для R. nipponicus. Массовое цветение возможно с середины июля до середины августа. В редких случаях (после резких перепадов уровня воды) вторичное цветение наблюдается в середине сентября. Плодоношение происходит не каждый год, плоды отмечаются на мелководье после первой декады августа. В разные годы сроки наступления фенофаз могут различаться.
Феноритмотип R. nipponicus определен как длительно вегетирующий вечнозеленый без зимнего покоя. В незамерзающих водотоках североохотского побережья ритм сезонного развития вида характеризуется отсутствием фазы зимнего покоя и предгенеративного пика биомассы, постоянной вегетацией при редко наблюдающемся массовом цветении и плодоношении.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Сезонное развитие и морфология Ranunculus секции Batrachium изучены в европейской части России в водоемах и водотоках Ярославской обл., в зимний период покрытых льдом [5, 6, 9, 19]. Естественный ритм развития для всех исследованных видов водяных лютиков одинаков. Растения зимуют в виде небольшого побега с укороченными междоузлиями, несколькими листьями и зачатками боковых побегов. Вегетация начинается после схода льда в апреле–мае, как правило, с повышением температуры воды до +5°С и заканчивается в сентябре. После зимнего покоя идет накопление вегетативной массы. Максимум морфологических показателей совпадает с низким уровнем воды и ее температурным максимумом. Летом растения могут перейти к массовому цветению и плодоношению при стабильном небольшом уровне воды. В полноводные годы сроки наступления фенофаз смещаются, отдельные фазы могут выпадать. В разные годы отмечается от одного до трех волн цветения. После плодоношения преобладают процессы отмирания, и побеги перезимовывают. Водяные лютики могут развиваться как многолетние растения в относительно постоянных условиях обитания или как однолетники в условиях сильных колебаний уровня воды [9].
Одной из важнейших особенностей развития R. kauffmannii Clerc и R. trichophyllus из европейской части России – пик биомассы перед цветением. Активное нарастание вегетативной массы, состоящей из множества тонких основных и боковых побегов, предшествует началу генеративного периода. У R. nipponicus на североохотском побережье накопление биомассы в предгенеративный период почти не выражено.
Преобладание вегетативного размножения над семенным характерно для большинства видов водяных лютиков, произрастающих в европейской части России [9]. По нашим наблюдениям, у R. nipponicus и R. trichophyllus, произрастающих в океаническом климате североохотского побережья, преобладает вегетативное размножение. Надводное цветение нерегулярное и сильно зависит от климатических и гидрологических условий. В р. Угликан зарегистрировано только подводное клейстогамное цветение. Массовое надводное цветение, как и образование плодов, не отмечено здесь, вероятно, из-за постоянно низкой температуры воды, недостаточной для запуска механизма массового цветения. После клейстогамного цветения плоды обычно не вызревают. В Магаданской обл. солнечная погода и невысокий уровень воды в реках бывают редко, либо не сохраняются достаточно долго для формирования семян. Возможно, отсутствие регулярного семенного возобновления способствовало сохранению подводного цветения у этого вида на северо-востоке Азии. В работе по водяным лютикам Японии [24] упоминается, что появление клейстогамных цветков, раскрывающихся под водой, характерно для многих видов этой группы.
Сведения о сезонном развитии различных видов водяных лютиков за пределами России немногочисленны. Выраженная фаза зимнего покоя в регионах с более мягким климатом, чем в Ярославской и Магаданской областях, не описана, хотя отмечается замедление или остановка роста растений в холодное время года. В Корее [18] и Великобритании [12, 13] начало активного роста у различных водяных лютиков наблюдается в марте–мае, также упоминается об образовании единичных цветков в течение всего периода вегетации, в том числе зимой.
Круглогодичное цветение и циклы развития двух разновидностей R. nipponicus описаны в Японии (35°38′ с.ш., 133°27′–133°38′ в.д.) [16]. Круглогодичное цветение с пиком в июне–июле отмечено у R. nipponicus var. submersus, произрастающего в р. Хонги со стабильной (~13–15°С) температурой воды в течение всего года (среднемесячная температура изменяется от 9°С в феврале до 16°С в сентябре). В то же время у R. nipponicus var. okayamaensis, произрастающего в р. Утсумиа со значительными колебаниями температуры воды в течение года (от 2.5 до 19.5°С), цветки распускались лишь с мая по ноябрь. Скорость роста побегов у этих разновидностей различалась. У R. nipponicus var. submersus, произрастающего при стабильной температуре воды, максимальная скорость роста отмечалась в сентябре, постепенно увеличиваясь с июня, а небольшие пики усиления роста наблюдались в феврале, апреле и декабре. Пик цветения приходился на июнь–июль. У R. nipponicus var. okayamaensis скорость роста постепенно нарастала к маю, потом немного снижалась и достигала максимума в июле, после чего начинала падать. Массовое цветение было в мае–июле. В лабораторных условиях скорости роста обоих разновидностей почти не различалась [16]. Вероятно, круглогодичное цветение и многопиковая кривая скорости роста связана со стабильными температурными условиями в водотоках.
R. nipponicus – светолюбивое, очень холодостойкое растение. В относительно стабильных температурных условиях незамерзающих водотоков североохотского побережья на 59° с.ш., где температура воды относительно постоянна (от +0.1 до +5.8°С) (рис. 1), сезонный цикл развития R. nipponicus во многом сходен с ритмом развития этого вида, растущего при стабильной, но более высокой температуре в Японии почти на 25° южнее. Рост растений в обоих местонахождениях не прекращается в течение всего года. Наиболее активное образование молодых корней у “магаданских” растений происходит в феврале–марте. Единичные клейстогамные цветки отмечались нами во все месяцы холодного периода года (с октября по май). Летний пик цветения приходится на июль, как и у растений из Японии, однако он возможен лишь в отдельные годы при благоприятных погодных и гидрологических условиях.
Время цветения – генетически наследуемый признак у большинства покрытосеменных [2, 26]. Цветение у разных видов водяных лютиков происходит с марта–апреля до августа, наиболее ранние сроки цветения выявлены в марте–апреле у R. omiophyllus Ten. в Великобритании и R. kadzusensis Makino в Корее [13, 18]. Такие же сроки появления наибольшего числа клейстогамных подводных цветков отмечены у R. nipponicus в Магаданской обл. в зоне климата тундры и лесотундры. Наблюдается совпадение сроков цветения у разных видов Ranunculus секции Batrachium в разных климатических зонах. Вероятно, весенний пик цветения может быть связан с длиной светового дня, который в марте, около дня весеннего равноденствия, примерно одинаков на различных широтах. В большинстве северных регионов водоемы и водотоки в марте еще подо льдом или только освобождаются ото льда, поэтому весенний пик роста и цветения в марте невозможен. На северном побережье Охотского моря возможность круглогодичной вегетации и цветения обеспечивается существованием специфических местообитаний – незамерзающих водотоков.
Известно, что наиболее распространенный тип цветения в растительном мире – это ежегодное цветение, когда растения цветут 1 раз в год. Непрерывное цветение – редкое явление, широко распространенное только в некоторых типах тропических лесов. Отдельные виды, непрерывно цветущие в течение всего вегетационного периода, встречаются во всех климатических зонах от тропиков до тундр [2]. Изученный нами R. nipponicus относится к видам, для которых возможно непрерывное цветение при наличии благоприятных (постоянных) условий среды.
Выводы. Впервые на территории России зарегистрированы круглогодичные вегетация и цветение водяного лютика без прохождения стадии зимнего покоя. Ранее круглогодичное цветение R. nipponicus отмечено в Японии в водотоках со среднемесячной температурой воды в холодное время года ~+10°С. На северном побережье Охотского моря (59° с.ш.) благодаря наличию незамерзающих водотоков, связанных с пойменными таликами, возможны круглогодичный рост и цветение R. nipponicus. Во все месяцы года наблюдается рост побегов, формирование молодых корней, бутонов и клейстогамных цветков, при среднемесячной температуре воды от +0.1 до +5.8°С. Клейстогамное цветение редко приводит к формированию и вызреванию плодов, возможно, из-за слишком низкой температуры воды. Массовое появление подводных цветков шелковника в начале весны не связано с повышением температуры воды.
Список литературы
Андриянова Е.А., Мочалова О.А. Лютики, цветущие в морозы // Природа. 2018. № 4. С. 24–33.
Жмылев П.Ю., Карпухина Е.А., Жмылева А.П. Вторичное цветение: индукция и нарушение развития // Журн. общ. биол. 2009. Т. 70. № 3. С. 262–272.
Иогансен В.Е., Кузнецов А.С., Деев Г.Н. Реки // Север Дальнего Востока. М.: Наука, 1970. С. 186–188.
Клюкин Н.К. Климат // Север Дальнего Востока. М.: Наука, 1970. С. 101–132.
Лебедева О.А. Особенности фенологического развития Batrachium kauffmannii (Ranunculaceae) в малых реках Ярославской области // Ярослав. пед. вестн. 2012. № 1. Т. III (Естественные науки). С. 98–102.
Лебедева О.А., Лапиров А.Г. Особенности онтогенеза Batrachium trichophyllum (Ranunculaceae) // Бот. журн. 2005. Т. 90. № 11. С. 1744–1752.
Михайлов В.М. Пойменные талики северо-востока России. Новосибирск: Изд-во “Гео”, 2013. 244 с.
Михайлов В.М. Пойменные талики в долинах меандрирующих водотоков северо-востока России // Криосфера Земли. 2016. Т. 20. № 2. С. 41–48.
Мовергоз Е.А., Бобров А.А. Сравнительная морфология и биология водяных лютиков Ranunculus circinatus, R. trichophyllus и R. kauffmannii (Batrachium, Ranunculaceae) в Средней России // Тр. ИБВВ РАН. 2016. Вып. 76(79). С. 93–118.
Andriyanova E.A., Mochalova O.A. IAPT/IOPB chromosome data 21 // Taxon. 2016. V. 65. № 3. P. 673.
Bobrov A.A., Zalewska-Gałosz J., Jopek M., Movergoz E.A. Ranunculus schmalhausenii (section Batrachium, Ranunculaceae), a neglected water crowfoot endemic to Fennoscandia – a case of rapid hybrid speciation in postglacial environment of North Europe // Phytotaxa. 2015. V. 233. № 2. P. 101–138.
Cook C.D.K. Studies in Ranunculus subgenus Batrachium (DC.) A. Gray. II. General morphological considerations in the taxonomy of the subgenus // Watsonia. 1963. V. 5. № 5. P. 294–303.
Cook C.D.K. A monographic study of Ranunculus subgenus Batrachium (DC.) A. Gray // Mitt. Bot. Staatssammlung München. 1966. № 6. P. 47–237.
Garbey C., Thiebaut G., Muller S. Morphological plasticity of a spreading aquatic macrophyte, Ranunculus peltatus, in response to environmental variables // Plant Ecol. 2004. V. 173. № 1. P. 125–137.
Jo I.S., Han D.U., Cho Y.J., Lee E.Ju. Effects of light, temperature, and water depth on growth of a rare aquatic plant, Ranunculus kadzusensis // J. Plant Biol. 2010. V. 53. № 1. P. 88–93.
Kimura Y., Kunii H. Comparison of morphological traits and growth characteristics in Ranunculus nipponicus var. submersus and R. nipponicus var. okayamaensis // Jap. J. Ecol. 1998. V. 48. P. 257–264.
Koga K., Kadono Y., Setoguchi H. The genetic structure of populations of the vulnerable aquatic macrophyte Ranunculus nipponicus (Ranunculaceae) // J. Plant Res. 2007. V. 120. № 3. P. 471–480.
Ku Y.B., Oh H.K., Lee J.H. et al. Distribution and genetic uniformity of an endangered aquatic plant, Ranunculus kadzusensis, in a South Korean rice paddy // Weed Biol. Manag. 2007. V. 7. P. 120–123.
Lebedeva O.A., Lapirov A.G. The rhythm of the seasonal development and morphological polyvariation of Batrachium circinatum (Sibth.) Spach at the Rybinsk reservoir // Inland Water Biol. 2009. V. 2. № 3. P. 223–227. https://doi.org/10.1134/S1995082909030055
Nakaya S., Usami A., Yorimoto T., Miyazawa M. Characteristic chemical components and aroma-active compounds of the essential oils from Ranunculus nipponicus var. submersus used in Japanese traditional food // J. Oleo Sci. 2015. V. 64. № 6. P. 595–601.
Takafumi H., Matsumoto A., Aotani K., Yoshida T. The cross-ecosystem impact of deer on an endangered submerged macrophyte, Ranunculus nipponicus var. submersus // Glob. Ecol. Conserv. 2015. V. 4. P. 581–588.
Takayanagi S.T., Hiroshi Y.H. The shoot of Ranunculus nipponicus var. submersus, a submerged vascular plant, can actively take up nitrate from cool water // Plant Biotechnol. J. 2015. V. 32. P. 97–102.
Wiegleb G., Bobrov A.A., Zalewska-Galosz J. A taxonomic account of Ranunculus section Batrachium (Ranunculaceae) // Phytotaxa. 2017. V. 319. № 1. P. 1–55.
Wiegleb G. Notes on Japanese Ranunculus subgenus Batrachium // Acta Phytotax. Geobot. 1988. V. 39. № 4–6. P. 117–132.
Zander B., Wiegleb G. Biosystematische Untersuchungen an Populationen von Ranunculus subgen. Batrachium in Nordwest-Deutschland // Bot. Jahrb. Syst. 1987. Bd 109. Hf. 1. S. 81–130.
Zimmerman M., Pyke G.H. Pollination ecology of christmas bells (Blandfordia nobilis): Effects of pollen quantity and source on seed set // Aust. J. Ecol. 1988. V. 13. P. 301–309.
Дополнительные материалы отсутствуют.
Инструменты
Биология внутренних вод


