Биология внутренних вод, 2019, № 4-2, стр. 66-72
Фауна свободноживущих нематод (Nematoda) песчаных пляжей заплесковой зоны оз. Байкал в районах с интенсивной и умеренной антропогенной нагрузкой
Т. В. Наумова a, *, О. В. Медвежонкова a, В. Г. Гагарин b
a Лимнологический институт, Сибирское отделение Российской академии наук
Иркутск, Россия
b Институт биологии внутренних вод им. И.Д. Папанина Российской академии наук
Некоузский р-н, Ярославская обл., пос. Борок, Россия
* E-mail: tvnaum@lin.irk.ru
Поступила в редакцию 21.03.2017
После доработки 20.06.2017
Принята к публикации 20.10.2017
Аннотация
Исследованы качественные и количественные характеристики фауны свободноживущих нематод заплесковой зоны песчаных пляжей в двух районах оз. Байкал – в заливе Лиственичный напротив нерпинария и в бухте Большие Коты в районе пади Варначка. Выявлено, что в интерстициали залива Лиственичный, береговая зона и акватория которого подвергаются интенсивному антропогенному воздействию из-за непрерывного потока туристов, видовой состав нематод беднее, чем на значительно реже посещаемом пляже в бухте Большие Коты в 3 км от поселка. Численность нематод за период открытой воды в интерстициали пади Варначка постепенно возрастала от июня к октябрю 2015 г. (в 11.7 раза). В районе нерпинария регулярного прироста численности не отмечено, более того, в августе произошло ее заметное падение с восстановлением к октябрю до первоначального июньского уровня. Анализ абиотических факторов не выявил значимых достоверных изменений, объясняющих такое резкое падение численности червей. В то же время на август приходится наибольшая антропогенная нагрузка в связи с высоким и почти непрерывным потоком туристов в пос. Листвянка.
ВВЕДЕНИЕ
Зона заплеска представляет собой грунт выше уреза воды водоемов, увлажненный за счет волн и капиллярной подпитки. Она населена богатыми по количественным характеристикам и разнообразию сообществами, которые развиваются в очень динамичных условиях окружающей среды (резкая смена температур, увлажненности и т.д.). Исследование фауны песчаных пляжей оз. Байкал впервые проведено в 1982–1983 гг., но его результаты не полностью опубликованы (за исключением работ по фауне коловраток (Аров, 1985, 1987; Кутикова, Аров, 1985)). Каменистые грунты пляжей Южного Байкала, в том числе в рaйоне пос. Большие Коты, исследованы И.В. Вейнберг с соавт. (Вейнберг, Камалтынов, 1998; Вейнберг и др., 1995), но только на уровне макробентосных сообществ, поэтому сведений о нематодофауне в них не содержится. С 2009 г. проводятся регулярные междисциплинарные исследования заплесковой зоны оз. Байкал (Тиошкин и др., 2011, 2012; Попова и др., 2012; Потапская и др., 2012; Тамберг и др., 2012), в рамках которых получены первые сведения о видовом составе и некоторых количественных характеристиках фауны свободноживущих нематод зоны заплеска (Gagarin, Naumova, 2012), описано 7 новых для науки видов нематод (Gagarin, Naumova, 2012a, 2012б, 2016, 2018), отмечено много новых для оз. Байкал находок нематод.
Заплесковая зона озер – наиболее индикаторная и быстро реагирующая на антропогенные изменения экосистема (Тимошкин и др., 2011). В последние 20 лет наблюдается существенное увеличение потока туристов по всему побережью оз. Байкал. Постоянно растет количество турбаз, гостиниц, процветает “дикий” туризм. Такая повышенная антропогенная нагрузка уже негативно сказалась на состоянии побережья озера. В 2010–2016 гг. отмечены резкие изменения функционирования экосистемы прибрежной зоны озера, выражающиеся в массовой гибели эндемичных губок и моллюсков, преобразовании водных растительных сообществ и т.д. (Timoshkin et al., 2016). Для выяснения реакции сообществ заплесковой зоны на интенсивную и умеренную антропогенную нагрузки были выбраны два пляжа юго-западного побережья озера: первый пляж (51°50′ с.ш., 104°52′ в.д.) – в заливе Лиственичный в центре пос. Листвянка напротив нерпинария, подвержен постоянной антропогенной деятельности; второй (51°53′ с.ш., 105°7′ в.д.) – в бухте Большие Коты в районе пади Варначка в 3 км от пос. Большие Коты, туристы посещают его относительно редко. Расположение пляжей на одной береговой линии на расстоянии ~20 км друг от друга позволяет говорить о сходном термическом и гидрологическом режимах. Гранулометрическая структура песчано-гравийных пляжей также сравнима.
Крупный пос. Листвянка находится в 60 км от г. Иркутска. Между этими населенными пунктами проложена скоростная автомобильная дорога с ежедневным потоком туристов. Однако в поселке отсутствуют очистные сооружения, и все бытовые стоки попадают непосредственно в оз. Байкал. Кроме того, вблизи пляжа в пос. Листвянка находится устье реки, протекающей вдоль одной из центральных улиц поселка и несущей смыв жидких бытовых отходов непосредственно в озеро. Поселок Большие Коты – относительно труднодоступное для туристов место, поскольку попасть туда можно только водным транспортом (регулярное сообщение с мая по сентябрь) или пешком по туристической тропе протяженностью 20 км. Постоянной автомобильной дороги нет, существует только зимняя ледовая переправа. Таким образом, поток туристов в пос. Большие Коты существенно меньший, чем в пос. Листвянка.
Гидрохимические анализы (Томберг и др., 2012) показали, что интерстициальная вода пляжа в заливе Лиственичный содержит большое количество биогенных элементов (N, P) как результат разложения органического вещества, постоянно привносимого в зону пляжа жителями пос. Листвянка и отдыхающими на пляже. Отмечено пониженное содержание кислорода (Томберг и др., 2012). Наличие органического загрязнения антропогенного характера подтверждается и стабильным присутствием в воде пляжа пос. Листвянка высоких концентраций кишечной микрофлоры (кишечной палочки и энтерококков) (Тимошкин и др., 2012). Все эти факторы позволили нам рассматривать залив Лиственичный как район с повышенной антропогенной нагрузкой, а бухту Большие Коты как зону умеренного влияния человека.
Цель работы – подробный анализ фауны свободноживущих нематод (одной из модельных групп для мониторинга экосистем) в районах с сильной и умеренной антропогенной нагрузкой.
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
В качестве материала использовали пробы мейобентоса, собранные в 2009–2012 гг. и 2015 г. в заплесковой зоне (0.5 и 1 м выше уреза воды) залива Лиственичный (ст. 1) и бухты Большие Коты (ст. 2). Пробы для изучения сезонной динамики количественных показателей отбирали на расстоянии 0.5 м выше уреза воды один раз в месяц с июня по октябрь 2015 г. Материал собирали с помощью пробоотборной трубки (длина 50 см, диаметр выходного отверстия 59.5 мм), которую погружали в толщу грунта до максимальной глубины. Пробы (послойно или целиком) промывали методом взмучивания, профильтровывали через гидробиологический сачок и фиксировали 4%-ным формалином, далее разбирали по таксономическим группам, используя бинокуляр МБС-10. Одновременно с отбором проб измеряли температурy, рН и электропроводность интерстициальной воды. Гранулометрический состав грунта определяли методом сухого рассеивания. Образцы разделяли на фракции: галька – размер >10 мм; гравий – 10–5, 5–3, 4–3, 2–1 мм; песок – 1–0.5, 0.5–0.25, 0.25–0.1, 0.1–0.05 мм. По этим данным (о размере частиц и их процентном содержании по массе) образцы делили на классы. На основе интегральных кривых (график, отражающий суммарное содержание фракций мельче определенного диаметра) вычисляли медианный размер частиц (Md).
Нематод подкрашивали трипановым синим и помещали в глицериновую среду с окантовкой бесцветным лаком. Определение и промеры червей проводили с помощью светового микроскопа Olympus CX-21. В работе использовано 80 мейобентосных проб, подготовлено и проанализировано 507 препаратов, включающих 4654 экз. червей. Материалы хранятся в коллекции лаборатории биологии и систематики водных беспозвоночных Лимнологического института СО РАН (г. Иркутск).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Абиотические факторы. Данные по температуре воды в момент взятия проб представлены в табл. 1. Гранулометрический состав грунта на изученных пляжах был сходным. В 2015 г. грунт относился к гравийному типу и лишь в 30% проб ст. 2 – к гравелистому песку с песчаным заполнителем. Медианный размер частиц был также близок – 5 мм на ст. 1 и 4 мм на ст. 2. Выявлена положительная корреляционная связь (r = 0.6) количества круглых червей с долей частиц грунта размером 0.25–1 мм и отрицательная – с долей крупных (>5 мм) и очень мелких (<0.1 мм) частиц.
Таблица 1.
Температура (°C) интерстициальной воды в лунках во время взятия проб в 2015 г.
| Номер станции | Июнь | Июль | Август | Сентябрь | Октябрь |
|---|---|---|---|---|---|
| 1 | 11.9 | 18.7 | 17.6 | 12.8 | 1.5 |
| 2 | 9.6 | 18.3 | 16.9 | 9.2 | 2.4 |
Примечание. Здесь и в табл. 2 ст. 1 – заплесковая зона залива Лиственичный; ст. 2 – бухта Большие Коты.
Видовой состав фауны. В 2015 г. в заплеске ст. 1 обнаружено 13 видов свободноживущих нематод, в заплеске ст. 2 – 17, общие для двух станций – 11 видов (табл. 2). Большинство из них – эндемики для оз. Байкал, 5 видов относятся к широкораспространенным.
Таблица 2.
Видовой состав нематод в зоне заплеска (0.5 м выше уреза воды) на ст. 1 и ст. 2
| Вид | Ст. 1 | Ст. 2 | Зоогеографическая характеристика и тип питания видов |
|---|---|---|---|
| Eumonhystera filiformis (Bastian, 1865) Andrássy, 1981 | + | + | Космополит, встречается на всех континентах в воде и на суше. Бактерио- и детритофаг |
| E.melnikae (Gagarin et Naumova, 2010) Gagarin & Gusakov, 2013 | – | + | Эндемик оз. Байкал (бухта Большие Коты, заплеск; мыс Березовый, глубина 3.3 м). Бактерио- и детритофаг |
| Theristus psammophilus Gagarin et Naumova, 2012 | + | + | Эндемик оз. Байкал (заплеск). Альгофаг |
| Th. tsalolikhini Gagarin et Naumova, 2012 | + | + | Эндемик оз. Байкал (заплеск). Альгофаг |
| Ethmolaimus pratensis de Man, 1880 | – | + | Космополит, широко распространен в континен-тальных водоемах, особенно в прибрежной части. Питается диатомовыми водорослями, бактериями и простейшими |
| E. riparius Gagarin et Naumova, 2016 | + | + | Эндемик оз. Байкал (заплеск). Питается диатомовыми водорослями, бактериями и простейшими |
| E. pilosus Shoshin, 1998 | + | – | Эндемик оз. Байкал (песок литорали бухты Песчаная). Питается диатомовыми водорослями, бактериями и простейшими |
| Tobrilus undophilus Shoshin, 1988 | + | + | Эндемик оз. Байкал (бухты Песчаная и Большие Коты, залив Лиственичный); заплеск, прибойная зона под камнями и в обрастаниях камней. Смешанное питание (мелкие животные, бактерии, водоросли) |
| T. beckmanae Tsalolikhin, 1975 | + | + | Эндемик оз. Байкал, эврибатный вид. Смешанное питание (мелкие животные, бактерии, водоросли) |
| T. incognitus (Tsalolikhin, 1972) | + | + | Эндемик оз. Байкал, обитает на песках литорали и сублиторали. Смешанное питание (мелкие животные, бактерии, водоросли) |
| Epitobrilus interstitialis Gagarin et Naumova, 2017 | + | + | Эндемик оз. Байкал (заливы Лиственичный и Большие Коты, заплеск). Хищник |
| Paramononchusmajor Gagarin et Naumova, 2016 | + | + | Эндемик оз. Байкал. Хищник |
| Mylonchylus sp. | – | + | Судя по более ранним находкам, предположительно, Mylonchulus brachyuris (Bütschli, 1873) Altherr, 1953. Космополит, обитает в почве и пресной воде. Хищник |
| Eudorylaimus sedatus Gagarin et Naumova, 2011 | – | + | Эндемик оз. Байкал (бухта Большие Коты, заплеск; мыс Березовый, глубина 3.3 м). Вероятно, смешанное питание – прокалывает копьем покровы животных и водорослей, высасывая содержимое |
| Eudorylaimus sp. | + | + | Смешанное питание |
| Plectus sp. | – | + | Предположительно, P. rhizophilus de Man, 1880 или P. cirratus Bastian, 1865. Космополит. Избирательный детритофаг |
| Pelodera sp. | – | + | Широко распространенный род. Неизбирательные детритофаги, населяющие полисапробные водоемы, богатые разлагающимся органическим веществом и флорой бактерий. Часто паразиты животных |
| Allodiplogaster angarensis (Gagarin, 1983) | + | + | Оз. Байкал, реки Ангара, Лена. Сапрофаг (детритофаг) |
| A. mordax (Shoshin, 1989) | + | – | Эндемик оз. Байкал. Сапрофаг (детритофаг) |
| Всего видов | 13 | 17 |
Также нами проанализированы пробы, собранные в 2009 и 2010 гг. в бухте Большие Коты (ст. 2, стационар Лимнологического института СО РАН, падь Черная и 300 м севернее пади Черная) и в 2011, 2012 гг. в пос. Листвянка (около нерпинария в 0.5 и 1 м выше уреза воды и около почты в 0.5 м выше уреза), поэтому к имеющемуся списку добавляется еще несколько видов нематод для каждого из районов. Для залива Лиственичный – это Eumonhystera arenosa Gagarin, Naumova, 2018, Tripyla alekseevi Gagarin et Naumova, 2018, Plectus cirratus Bastian, 1865, Ethmolaimus pratensis de Man, 1880, Paratrilobus sp., Eudorylaimus cf. acuticauda (de Man, 1880), Aporcelaimus sp.; для залива Большие Коты – Hofmaenneria optata Alekseev, 1983, Plectus rhizophilus de Man, 1880, Mylonchulus brachyuris (Bütschli, 1873) Altherr, 1953, Ethmolaimus revaliensis (Schneider, 1906), Tobrilus amabilis Tsalolikhin, 1974, Eudorylaimus vestibulifer (Micoletzky, 1922) Andrássy, 1959, E. olgae Gagagin et Naumova, 2012, Aporcelaimellus alius Andrássy, 2002, A. obtusicaudatus (Bastian, 1865) Altherr, 1968, Allodiplogaster lupata (Shoshin, 1989), Achromadora terricola (de Man, 1880) Micoletzky, 1925, Labronema sp., Goffartia variabilis (Micoletzky, 1922) Hirshmann, 1952. Таким образом, общий видовой состав найденных нами свободноживущих нематод заплеска в бухте Большие Коты представлен 29 видами из 17 родов, в заливе Лиственичный – 18 видами из 10 родов.
Численность и количественные соотношения родов в сообществах нематод. Поскольку видовую принадлежность нематод в личиночной стадии точно установить невозможно, а количество ювенильных особей было не только сопоставимо с половозрелыми, но в некоторые месяцы существенно превышало количество самцов и самок, то оценку вклада отдельных групп нематод в их общую численность проводили на родовом уровне.
Наибольший вклад в численность нематод на ст. 1 вносили виды рода Theristus (преимущественно, T. psammophilus) – от 55% в июле до 68 и 83% в сентябре и октябре 2015 г. соответственно (табл. 3). По типу питания виды рода относятся к альгофагам, заглатывающим водоросли целиком. В июне и августе по численности доминировал род Tobrilus (~58 и 40% соответственно). Представители этого рода имеют смешанный тип питания – потребляют мелких животных, водоросли и бактерий. Следует отметить, что август характеризовался сменой не только доминантных родов, но и субдоминантных – на долю рода Theristus приходилось только 15%, рода Paramononchus – 25% общей численности нематод.
Таблица 3.
Доли родов (%) в общей численности нематод на ст. 1 в 2015 г.
| Род | Июнь | Июль | Август | Сентябрь | Октябрь |
|---|---|---|---|---|---|
| Tobrilus | 57.7 | 11.7 | 39.5 | 14.6 | 5.7 |
| Theristus | 34.6 | 55.0 | 15.8 | 68.0 | 83.0 |
| Paramononchus | – | 16.2 | 24.7 | 8.0 | 2.5 |
| Allodiplogaster | 4.8 | 1.8 | – | 0.7 | – |
| Ethmolaimus | 1.9 | 13.5 | 4.0 | 0.7 | 5.0 |
| Epitobrilus | 1.0 | 1.8 | 5.0 | 8.0 | 1.3 |
| Eumonhystera | – | – | 4.0 | – | – |
| Eudorylaimus | – | – | 3.0 | – | 2.5 |
| Prodorylaimus | – | – | 2.0 | – | – |
| Tripyla | – | – | 2.0 | – | – |
Представитель этого рода P. major – типичный хищник с очень крупными для нематод размерами тела (до 8 мм) (Gagarin, Naumova, 2016). В заплеске ст. 2 виды рода Theristus по численности доминировали в июне и в октябре (табл. 4). В июле, августе и сентябре абсолютным доминантом становится род Tobrilus (>70% общей численности), представленный преимущественно T. undophilus – типичным обитателем не только заплеска, но и прибойной зоны под камнями и в обрастаниях камней.
Таблица 4.
Доля родов (%) в общей численности нематод на ст. 2 в 2015 г.
| Род | Июнь | Июль | Август | Сентябрь | Октябрь |
|---|---|---|---|---|---|
| Tobrilus | 27.2 | 77.3 | 70.1 | 91.6 | – |
| Theristus | 59.2 | 11.8 | 19.4 | 1.9 | 91.9 |
| Paramononchus | 4.9 | 4.6 | 8.9 | 0.9 | 1.7 |
| Allodiplogaster | 2.5 | 0.9 | – | – | – |
| Ethmolaimus | 3.7 | 0.9 | – | – | – |
| Epitobrilus | – | 0.9 | 0.8 | 1.9 | 6.4 |
| Eumonhystera | 2.5 | 1.8 | – | – | – |
| Eudorylaimus | – | 0.9 | 0.8 | 0.9 | – |
| Mylonchulus | – | 0.9 | – | – | – |
| Pelodera | – | – | – | 1.9 | – |
| Plectus | – | – | – | 0.9 | – |
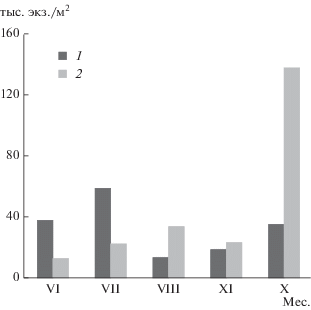
На двух исследованных станциях в течение безледного периода 2015 г. наблюдалась следующая картина (рис. 1): в июне численность нематод на ст. 1 более, чем в 3 раза превышала таковую на ст. 2 (37.7 и 11.8 тыс. экз./м2 соответственно), близкое соотношение сохранялось и в июле (в 2.6 раза). В августе численность нематод на ст. 1 снижалась в 4.5 раза по сравнению с предыдущим месяцем, однако, на ст. 2 она росла, незначительно падая в сентябре, и достигая максимума в октябре (>135 тыс. экз./м2).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Интерстициаль заплесковой зоны оз. Байкал населяет сообщество нематод, состоящее как из эндемиков, так и из широко распространенных, в том числе космополитных, видов. Согласно результатам наших исследований, видовое разнообразие свободноживущих нематод в зоне заплеска бухты Большие Коты выше, чем в заливе Лиственичный (17 и 13 видов в 2015 г., 29 и 18 видов соответственно за период 2010–2015 гг.).
Судить о зонах с органическим загрязнением можно по наличию в пробах сапробиотических нематод, обитающих в разлагающемся органическом материале (навозе, гумусе, гниющих овощах и фруктах) и предпочитающих насыщенные разлагающейся органикой полисапробные водоемы. В оз. Байкал это представители отр. Diplogasterida – род Allodiplogaster (A. angarensis, A. mordax и A. lupata) и Goffartia variabilis. До находок в заплеске они были обнаружены в сорах, заливах и на мелководье оз. Байкал (Шошин, Цалолихин, 2001). Бактерио- и детритофаги (избирательные или неизбирательные) тоже часто населяют полисапробные водоемы, в которых на гниющем органическом веществе в массе развивается бактериальная флора – из наших находок это представители родов Eumonhystera, Monhystera, Plectus и Ethmolaimus.
Сапробиотические формы из отр. Rhabditida (род Pelodera) – типичные обитатели вод, загрязненных бытовыми и промышленными стоками. Они населяют полисапробные водоемы, богатые разлагающимся органическим веществом и бактериальной флорой, к содержанию кислорода в воде эти черви не требовательны. В пробах до 2009 г. (включительно) в оз. Байкал представителей отр. Rhabditida не отмечали. Виды нематод, предпочитающие места с органическим и бактериальным загрязнением, были встречены нами на ст. 1 и 2, но в небольшом количестве (по сравнению с видами-доминантами).
На обеих обследованных станциях доминируют представители родов Theristus и Tobrilus, чередуясь в разные месяцы. Численность нематод на ст. 2 в течение безледного периода постепенно возрастает и достигает максимума в октябре. В заплеске ст. 1 рост численности наблюдается с июня по июль, в августе происходит ее заметное падение (в 4.5 раза по сравнению с предыдущим месяцем) с восстановлением первоначального уровня только к октябрю. Анализ абиотических факторов (температуры воздуха и воды, химического состава воды и гранулометрического состава грунта) не выявил значимых изменений, объясняющих такое резкое падение численности червей. В то же время на август приходится наибольшая антропогенная нагрузка в связи с высоким потоком туристов в пос. Листвянка. Подобные падения численности нематод в разгар туристического сезона фиксировались нами и ранее (в 2010 и 2012 гг.), но поскольку наблюдения были более фрагментарны, то воспринимались как случайные колебания. В настоящее время можно с бóльшей уверенностью предполагать, что падение численности нематод связано с воздействием людей на структуру пляжа в этот период.
Выводы. При сравнении фауны свободноживущих нематод на двух участках заплесковой зоны Южного Байкала выявлено, что видовое разнообразие червей в районе пос. Листвянка ниже, чем в районе бухты Большие Коты. В составе байкальской фауны за последние годы отмечена тенденция к увеличению сапробиотических нематод, но в небольших количествах. На обеих станциях доминируют по численности представители родов Theristus и Tobrilus. Количественный анализ показал, что в период открытой воды с июня по октябрь в заплеске бухты Большие Коты наблюдается постепенный рост численности нематод, в заливе Лиственичный рост происходит только с июня по июль, в августе численность червей заметно падает и только в октябре восстанавливается до первоначального июньского уровня. Такая картина выявлена не впервые, но до 2015 г. регулярных сборов на обеих станциях не проводили, и события характеризовались как случайные. В местах массового отдыха людей, особенно в разгар туристического сезона, оказывается отрицательное воздействие на численность и структуру популяции нематод. Количество круглых червей существенно снижается, что может негативно сказываться и на других участниках пищевой цепи.
Список литературы
Аров И.В. 1985. Псаммонные коловратки озера Байкал // Коловратки: Матер. 2-го Всесоюз. симп. Л.: Наука, С. 189–197.
Аров И.В. 1987. Коловратки (Rotatoria) псаммона озера Байкал: Автореф. дис. … к.б.н. Л.: Изд-во Зоол. ин-та РАН, 24 с.
Вейнберг И.В., Камалтынов Р.М. 1998. Сообщества макрозообентоса каменистого пляжа оз. Байкал. 1. Фауна // Зоол. журн. Т. 77. Вып. 2. С. 158–165.
Вейнберг И.В., Камалтынов Р.М. 1998. Сообщества макрозообентоса каменистого пляжа оз. Байкал. 2. Сообщества // Зоол. журн. Т. 77. Вып. 3. С. 259–265.
Вейнберг И.В., Камалтынов Р.М., Карабанов Е.Б. 1995. Динамика сообщества каменистого пляжа оз. Байкал // Вод. ресурсы. Т. 22. Вып. 4. С. 446–453.
Кутикова Л.А., Аров И.В. 1985. Новые виды псаммофильных коловраток (Rotatoria) в озере Байкал // Коловратки: Матер. 2-го Всесоюз. симп. Л.: Наука, С. 50–54.
Попова О.В., Тимошкин О.А., Зайцева Е.П. и др. 2012. Состав и сезонная динамика мейозообентоса заплесковой зоны Южного Байкала (на примере бухты Большие Коты) // Изв. Иpкут. гос. ун-та. Серия Биология. Экология. Т. 5. № 3. С. 11–122.
Потапская Н.В., Лухнев А.Г., Оболкина Л.А. 2012. Первые сведения по количественной динамике инфузорий разных биотопов заплесковой зоны в бухте Большие Коты (Южный Байкал) // Изв. Иркут. гос. ун-та. Серия Биология. Экология. Т. 5. № 3. С. 103–110.
Тимошкин О.А., Сутурин А.Н., Бондаренко Н.А. и др. 2011. Биология прибрежной зоны озера Байкал. Сообщение 1. Заплесковая зона: первые результаты междисциплинарных исследований, важность для мониторинга экосистемы // Изв. Иркут. гос. ун-та. Серия Биология. Экология. Т. 4. № 4. С. 75–110.
Тимошкин О.А., Томберг И.В., Куликова Н.Н. и др. 2012. Биология прибрежной зоны озера Байкал. Сообщение 3. Сезонная динамика инфауны береговых скоплений; гидрохимическая, микробиологическая характеристика интерстициальных вод зоны заплеска // Изв. Иркут. гос. ун-та. Серия Биология. Экология. Т. 5. № 1. С. 92–110.
Томберг И.В., Сакирко М.В., Домышева В.М. и др. 2012. Первые сведения о химическом составе интерстициальных вод заплесковой зоны озера Байкал // Изв. Иркут. гос. ун-та. Серия Биология. Экология. Т. 5. № 3. С. 64–74.
Шошин А.В., Цалолихин С.Я. 2001. Свободноживущие нематоды (Nemathelminthes: Nematoda) // Аннотированный список фауны озера Байкал и его водосборного бассейна. Новосибирск: Наука, Т. 1. Кн. 1. С. 305–320.
Gagarin V.G., Naumova T.V. 2012a. Free-living nematodes (Nematoda) fauna from the interstitial of the lake Baikal splash zone // Inland Water Biol. V. 5. № 3. P. 229–235. https://doi.org/10.1134/S1995082912030030
Gagarin V.G., Naumova T.V. 2012б. Two new species of Theristus Bastian, 1865 (Nematoda: Xyalidae) from interstitial zone of Lake Baikal, Siberia, Russia // Nematology. V. 14. № 4. P. 499–508.
Gagarin V.G., Naumova T.V. 2016. Ethmolaimus riparius sp.n. and Paramononchus major sp. n. from Lake Baikal, Russia // Zootaxa. V. 4098. № 3. P. 582–592.
Gagarin V.G., Naumova T.V. 2018. Species of free-living nematodes (Nematoda) new to science from Lake Baikal and freshwater bodies of the Russian Far East // Inland Water Biol. V. 11. № 4. P. 396–406. https://doi.org/10.1134/S1995082918040065
Timoshkin O.A., Samsonov D.P., Yamamuro M. et al. 2016. Rapid ecological change in the coastal zone of Lake Baikal (East Siberia): Is the site of the world’s greatest freshwater biodiversity in danger? // J. Great Lakes Res. V. 42. P. 487–497.
Дополнительные материалы отсутствуют.
Инструменты
Биология внутренних вод