Биология внутренних вод, 2019, № 4-2, стр. 82-89
Анализ связей между сообществами гидробионтов в соленых реках с использованием многомерной блочной ординации
Т. Д. Зинченко a, *, В. К. Шитиков a, Л. В. Головатюк a, В. А. Гусаков b, В. И. Лазарева b
a Институт экологии Волжского бассейна Российской академии наук
Самарская обл., Тольятти, Pocсия
b Институт биологии внутренних вод им. И.Д. Папанина Российской академии наук
Некоузский р-н, Ярославская обл., пос. Борок, Россия
* E-mail: zinchenko.tdz@yandex.ru
Поступила в редакцию 29.01.2019
После доработки 06.02.2019
Принята к публикации 14.03.2019
Аннотация
Представлены результаты комплексных исследований пяти соленых рек аридного региона Приэльтонья, включающие гидробиологическую съемку планктонных и донных сообществ. Для статистического анализа ассоциативных связей между видовыми структурами cообществ макрозообентоса, мейобентоса и зоопланктона применяли метод DIABLO, который выполняет объединение многомерных ординаций на основе n блоков наблюдений и использует специальные алгоритмы канонической корреляции. Показано, что значительная доля совокупной вариации данных может быть объяснена консенсусной конфигурацией, основанной на информации, общей для всех трех групп наблюдений. С использованием кластерного и обобщенного прокрустова анализа построены и проанализированы диаграммы, позволяющие выделить устойчивые ассоциации таксонов, характерные для отдельных биотопов с однородными условиями среды. Построены графы корреляционных плеяд и рассчитаны оценки индикаторной значимости для отдельных видов макрозообентоса, мейобентоса и зоопланктона. Показано, что для высокоминерализованных систем аридных регионов четкое разделение жизненных форм планктонных и донных сообществ неочевидно. В частности, отмечен переход бентосных животных к планктонному образу жизни и наоборот, что приводит к высокой доле смешанных экологических группировок. Планктонные и донные сообщества достаточно хорошо коррелируют между собой, что свидетельствует о тесной связи между ними, обусловленной как биотическими взаимодействиями, так и взаимно согласованной реакцией на изменение факторов водной среды. Полученные результаты позволяют рассматривать планктонные и донные сообщества высокоминерализованных рек как неравновесные динамически изменяющиеся консорциумы видов.
ВВЕДЕНИЕ
Характерная особенность лотических систем аридных регионов – их нестационарность, обусловленная глобальными и региональными климатическими колебаниями, включая антропогенное воздействие (Zinchenko et al., 2017). На разных участках водотоков при низкой скорости течения, малой глубине и высоком трофическом статусе вод создаются специфические условия для жизни гидробионтов. Один из главных факторов – уровень минерализации, во многом обуслoвливающий таксономический состав и характер трофических отношений. В мелководных соленых реках и озерах обычно нет четкого разграничения планктонных и донных сообществ: их массовые виды встречаются как на дне, так и в толще воды (Крылов, 2005; Балушкина и др., 2009; Гусаков, Гагарин, 2012; Лазарева, 2017; Зинченко и др., 2018; Шадрина, Ануфриева, 2018). Поэтому изучение совместного пространственного распределения этих сообществ на сходных биотопах в условиях меняющихся абиотических факторов представляет несомненный интерес для анализа структурной организации водных экосистем (Алимов и др., 2013).
Основа количественных экосистемных исследований была заложена Р. Уиттекером при использовании прямого градиентного анализа (Whittaker, 1973), моделирующего распределение отдельных ценопопуляций относительно осей двух-трех комплексных средообразующих градиентов. Современный подход к изучению экосистем основан на многомерном статистическом анализе десятков и сотен разнообразных переменных (популяционных, фенотипических, генетических, экологических, химических, ландшафтно-географических и т.д.), которые характеризуются значительной временной и пространственной изменчивостью. Основная задача такого анализа – выявление значимости и механизмов воздействия всей совокупности факторов на структурно-функциональные особенности изучаемых сообществ, а также последующий прогноз характера их развития при различных сценариях природоохранной деятельности.
К началу XXI в. важное место в экологии заняли методы многомерной ординации, которые осуществляют синтез оптимальной информационной структуры сообществ, состоящей из осей новых латентных переменных, наилучшим образом описывающих совокупную вариацию наблюдаемых данных. Главные оси ординации концентрируют основную долю дисперсии и являются ортогональными, что дает возможность визуализации многомерного облака точек, проецируя их, например, на плоскость с минимальными искажениями. Широкое распространение получили различные методы непрямой ординации: анализ главных компонент, анализ соответствий, неметрическое многомерное шкалирование (Джонгман и др., 1999; Kenkel, 2006). Подход на основе редукции данных стал основой для реализации таких алгоритмов прямой ординации, как анализ избыточности и канонический анализ соответствий, связывающих внутреннюю изменчивость видовой структуры изучаемого сообщества с матрицей комплекса факторов внешних воздействий (Ter Braak, 1994; Legendre P., Legendre L., 2012).
В настоящее время сфера применения алгоритмов многомерного анализа постоянно расширяется, и на их основе решаются все более сложные проблемы количественной оценки взаимосвязей в больших массивах данных. Бурное развитие исследований, связанных с геномикой и смежными областями, потребовало разработки мощных алгоритмов выделения биомаркеров с использованием латентных структур (Meng et al., 2016). Это обусловило появление группы новых методов, основанных на блочном симметричном анализе ковариаций, прокрустовом анализе, канонических корреляциях и т.д. (Hervé et al., 2018).
Цель работы – анализ внутрисистемных взаимосвязей таксономической структуры донных и планктонных сообществ малых рек с различным уровнем минерализации в бассейне оз. Эльтон на основе метода многомерной ординации с последующей интеграцией отдельных блоков данных (DIABLO).
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
Исходный материал получен по результатам гидробиологических съемок макрозообентоса, мейобентоса и зоопланктона в соленых реках (табл. 1) бассейна гипергалинного оз. Эльтон (49°07′30″ с.ш., 46°30′40″ в.д.), имеющих значительный градиент минерализации (от 6 до ≥41.1 г/л). Подробное описание и схема района исследований, методы отбора проб гидробионтов и камеральной обработки собранного материала представлены ранее в работах (Гусаков, Гагарин, 2012; Лазарева, 2017; Zinchenko et al., 2017; Зинченко и др., 2018). Для проведения многомерного статистического анализа использовали результаты одновременной гидробиологической съемки на 15 станциях пяти соленых рек в августе 2013 г. и были сформированы три матрицы численностей T (экз./м2) 88 отдельных таксономических групп, в том числе 28 видов и родов зоопланктона, 24 – макрозообентоса и 36 – мейобентоса. Для корректной совместной обработки данных значения матриц трансформировали в единую шкалу баллов от 0 до 6 с применением алгоритма нахождения оптимальных границ (Зинченко и др., 2018). На тех же станциях параллельно проводили гидрохимический мониторинг, на основе которого выполнена группировка станций по уровню минерализации воды: >25, 10–25 и <10 г/л.
Таблица 1.
Реки бассейна оз. Эльтон, расположение станций и основные гидрохимические показатели
| Река | Станция | Участок реки | Расстояние до впадения в озеро, км | Общая минерализация, г/дм3 | Кислород насыщения, % | Фосфор минеральный, мг/дм3 | Аммоний (${\text{NH}}_{4}^{ + }$), мг/дм3 |
|---|---|---|---|---|---|---|---|
| Солянка | Сол_1 | Верхний | 5.0 | 25.7 | 96 | 0.011 | 64.86 |
| Сол_2 | Средний | 3.0 | 26.7 | 226 | 0.182 | 31.48 | |
| Сол_3 | Устье | 0.5 | 25.2 | 325 | 0.031 | 29.05 | |
| Ланцуг | Лан_1 | Средний | 3.0 | 5.95 | 22 | 0.836 | 0.416 |
| Лан_3 | Устье | 0.8 | 13.6 | 558 | 0.005 | 9.207 | |
| Хара | Хар_4 | Средний | 20.0 | 6.55 | 75 | 0.832 | 0.356 |
| Хар_5 | Средний | 12.0 | 8.74 | 64 | 0.971 | 0.178 | |
| Хар_5а | Средний | 11.0 | 7.54 | 52 | 1.011 | 0.594 | |
| Хар_6 | Нижний | 5.0 | 11.77 | 64 | 0.005 | 13.306 | |
| Хар_7 | Устье | 0.8 | 13.27 | 417 | 0.005 | 9.563 | |
| Чернавка | Чер_0 | Верхний | 5.0 | 28.1 | 67 | 0.032 | 45.38 |
| Чер_1 | Средний | 3.0 | 27.5 | 178 | 0.032 | 45.92 | |
| Чер_2 | Устье | 0.3 | 31.7 | 282 | 0.015 | 41.99 | |
| Большая Саморода | Б.С_2 | Средний | 5.0 | 16.3 | 96 | 0.513 | 1.782 |
| Б.С_3 | Устье | 0.8 | 10.33 | 129 | 0.597 | 0.178 |
Статистический анализ данных проводили с использованием интегрированного метода многомерной ординации и совместной классификации n групп наблюдений DIABLO (Data Integration Analysis for Biomarker discovery using a Latent component for Omics studies) (Singh et al., 2016), который заключался в выполнении нескольких основных алгоритмов. Разложение исходных переменных по осям главных компонент осуществляли с применением метода частных наименьших квадратов PLS (Partial Least Squares, (Wold, 1985)), далее проводили “разреженный” дискриминантный анализ (sparse PLS-DA, (Lé Cao et al., 2011)), не требующий предположений о характере распределения данных. Использование PLS-DA позволило вычленить долю вариации таксономических структур зоопланктона, макрозообентоса и мейобентоса, обусловленную главным фактором, минерализацией воды, и оценить независимо внутренние корреляционные связи внутри и между блоками сообществ.
Интеграцию всех трех таблиц гидробиологической съемки проводили с помощью обобщенного канонического корреляционного анализа с регуляризацией (Tenenhaus A., Tenenhaus M., 2011), на основе которого находили максимум общей объясненной межблочной дисперсии проекций латентных переменных. С использованием обобщенного прокрустово анализа (Gower, 1975) выполняли построение консенсусной конфигурации, т.е. “средней” из частных ординаций, соответствующих каждому из блоков исходных данных.
При выявлении видов гидробионтов, которые можно считать статистически значимыми указателями группы водных объектов по их минерализации, использовали индексы индикаторной значимости (Legendre P., Legendre L., 2012). Индикаторный индекс djk для проб из k-й группы биотопов, k = {1, 2, 3}, вычисляли как произведение относительной частоты на относительную среднюю численность j-го вида. Вид считался индикатором той группы, для которой djk принял максимальное значение IndValj = max[djk]; причем IndValj = 1, если экземпляры вида j встречаются во всех пробах только одной k-й группы.
Визуализацию ассоциативных связей между комплексами наблюдений осуществляли на основе рекомендаций (González et al., 2012). Расчеты выполняли с использованием пакета mixOmics статистической среды R версия 3.02 ( Rohart et al., 2017).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Основные результаты блочной многомерной ординации планктонных и донных сообществ, связанные с разложением совокупной изменчивости данных на внутри- и межгрупповую вариации, представлены в табл. 2. Найдена высокая корреляция между главными компонентами каждого комплекса видов, т.е. оси максимальной вариации частных ординаций имеют приблизительно одинаковое направление в общем многомерном пространстве. Высокая статистическая значимость (р <0.001) доли объясненной межблочной дисперсии подтверждена с использованием рандомизационного теста.
Таблица 2.
Корреляция между блоками данных и разложение объясненной внутриблоковой вариации (%) по главным компонентам (ГК)
| Блок (сообщество гидробионтов) | Корреляция между блоками | Доля объясненной внутриблоковой вариации | ||||
|---|---|---|---|---|---|---|
| по 1-й ГК | по 2-й ГК | |||||
| макро-зообентос | зоопланктон | макро-зообентос | зоопланктон | 1-я ГК | сумма ГК | |
| Макрозообентос | – | – | – | – | 21.94 | 33.45 |
| Зоопланктон | 0.901 | – | 0.89 | – | 19.45 | 32.18 |
| Мейобентос | 0.925 | 0.937 | 0.929 | 0.944 | 15.99 | 33.90 |
Консенсусная конфигурация, построенная на линейных комбинациях двух главных компонент, объясняет 53.7% дисперсии содержащихся во всех массивах данных. На рис. 1 представлена обобщенная ординация всего анализируемого сообщества гидробионтов, а также прокрустовы расстояния от центроидов “консенсусной” конфигурации до отдельных блоков, соответствующих макрозообентосу, мейобентосу и зоопланктону.
Рис. 1.
Ординация участков рек бассейна оз. Эльтон на основе обобщения трех блоков данных гидробиологической съемки (1 – макрозообентос, 2 – зоопланктон, 3 – мейобентос). Прямоугольниками отмечены координаты консенсусной конфигурации; обозначения участков даны в табл. 1.
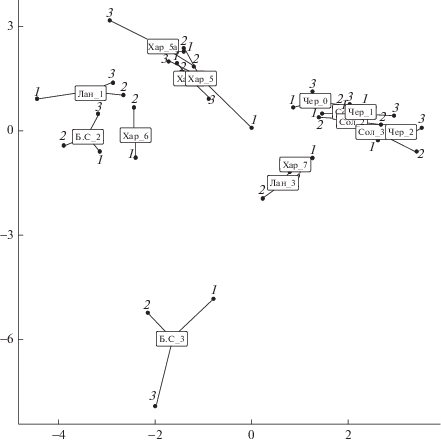
Первые две главные компоненты частных ординаций (табл. 2) объясняют только ~33% внутриблоковой дисперсии, полученной за вычетом общей межблочной вариации, что связано с высокой специфичностью каждого вида и отсутствием сильных корреляций между ними. Относительно равномерное распределение остаточной вариации по группам показывает, что выполненное обобщение достаточно эффективно для всех частных ординаций.
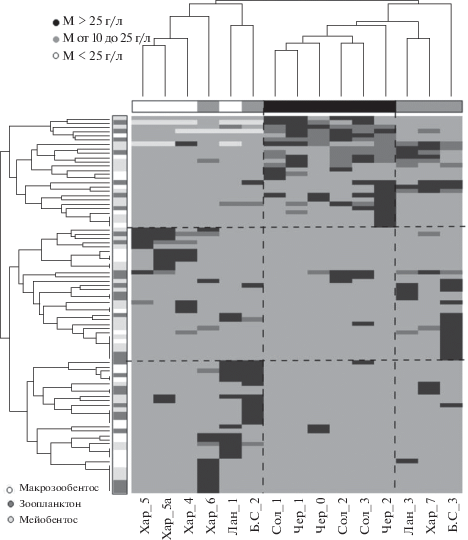
Поскольку между группами гидробионтов установлена статистически значимая синхронность изменения видового состава, использовался ряд методов выделения устойчивых ассоциаций таксонов, характерных для отдельных типов биотопов с однородными условиями среды. “Тепловая карта” (heatmap) или карта кластерных отношений (рис. 2) представлена матрицей, строки и столбцы которой упорядочены в соответствии с одновременной иерархической классификацией станций наблюдения и сопряженной с ними видовой структуры. Дендрограммы, добавленные слева и сверху, иллюстрируют состав объектов сформированных кластеров, а интенсивность цвета соответствует баллам обилия вида. На диаграмме выделены области со специфическим видовым составом гидробионтов, непосредственно зависящим от уровня минерализации.
Рис. 2.
Карта кластерных отношений между участками рек бассейна оз. Эльтон (обозначения см. табл. 1.) с различной минерализацией М (в столбцах) и таксономической структурой макрозообентоса, зоопланктона и мейобентоса (в строках). Интенсивность окраски элементов матрицы соответствует относительной численности соответствующего вида.
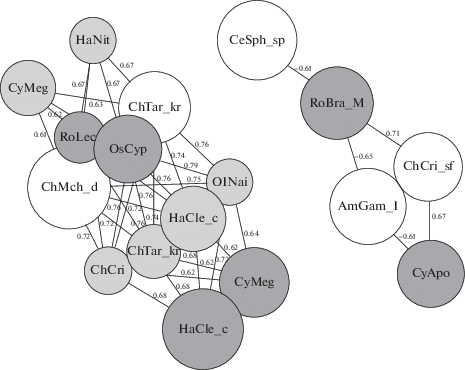
Корреляционная матрица между таксонами отдельных блоков, соответствующих макрозоо-бентосу, мейобентосу и зоопланктону, и построенный на ее основе граф корреляционной связи (рис. 3) позволяют уточнить состав групп видов, которые можно считать связанными межвидовыми взаимодействиями.
Рис. 3.
Граф корреляционной связи между численностями таксонов разных групп. Показаны только связи с модулем коэффициента корреляции >0.6; в темно-серых кружках даны коды видов зоопланктона, в светло-серых – мейобентоса, в белых – макрозообентоса (см. табл. 3).
Для всех 88 видов анализируемого сообщества гидробионтов рассчитаны индикаторные индексы IndValj с учетом разделения всех изученных биотопов на три группы по величине общей минерализации воды. С помощью рандомизационной процедуры оценивался достигнутый уровень статистической значимости р каждого вида при использовании такового в качестве индикатора степени солености воды. Наиболее характерные виды–индикаторы каждого класса – приведены в табл. 3.
Таблица 3.
Виды зоопланктона (ZP), мейобентоса (MB) и макрозообентоса (ZB), характерные для различных групп станций соленых рек бассейна оз. Эльтон, выделенных по степени минерализации
| Сообщества | Вид | Код вида | Встречаемость, % | IndValj | р |
|---|---|---|---|---|---|
| Минерализация >25 г/л (n = 33) | |||||
| MB | Cricotopus salinophilus | ChCri_sf | 100 | 0.666 | 0.008 |
| ZP | Brachionus plicatilis | RoBra_M | 100 | 0.663 | 0.003 |
| ZP | Apocyclops dengizicus | CyApo | 100 | 1.0 | 0.001 |
| ZP, ZB | Palpomyia sp. | CePal_sp | 83 | 0.794 | 0.007 |
| ZB | Chironomus salinarius | ChChi | 100 | 0.730 | 0.002 |
| ZB | Palpomyia schmidti | CeCer | 100 | 0.842 | 0.001 |
| Минерализация 10–25 г/л (n = 59) | |||||
| MB | Nais elinguis | OlNai | 60 | 0.6 | 0.031 |
| ZP | Megacyclops viridis (juv.) | CyMeg | 60 | 0.6 | 0.033 |
| MB, ZB | Cletocamptus confluens? | HaCle_c | 40 | 0.4 | 0.167 |
| MB | Megacyclops viridis | CyMeg | 40 | 0.4 | 0.145 |
| ZB | Microchironomus deribae | ChMch_d | 40 | 0.339 | 0.289 |
| ZP | Cyprinotus salinus | OsCyp | 20 | 0.2 | 0.596 |
| ZP | Lecane luna | RoLec | 20 | 0.2 | 0.633 |
| MB | Chironomus aprilinus | ChChi_g | 20 | 0.2 | 0.603 |
| Минерализация <10 г/л (n = 35) | |||||
| ZP, MB | Brachionus calyciflorus | RoBra_P | 75 | 0.75 | 0.007 |
| ZB | Glyptotendipes salinus | ChGly | 50 | 0.5 | 0.049 |
| ZP | Acanthocyclops americanus | CyAca | 75 | 0.568 | 0.027 |
| ZB | Cricotopus gr. sylvestris | ChCri | 50 | 0.5 | 0.052 |
| MB, ZB | Glyptotendipes salinus | ChGly_sl | 50 | 0.05 | 0.056 |
| ZB, MB | Chironomus plumosus | ChChi_p | 50 | 0.5 | 0.064 |
| MB | Candona spp. | OsCan | 25 | 0.178 | 0.715 |
| ZB | Limnodrilus udekemianus | OlLim_u | 25 | 0.253 | 0.251 |
| MB | Chironomus salinarius | ChChi | 50 | 0.5 | 0.058 |
| MB | Microchironomus deribae | ChMic | 50 | 0.326 | 0.277 |
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
На основе анализа биотопической приуроченности гидробионтов выявлено, что большинство видов планктона фактически относятся к бентопланктону и связаны трофическими отношениями с субстратом (Крылов, 2005; Балушкина и др., 2009; Лазарева, 2017; Шадрин, Ануфриева, 2018). В исследованных реках эупланктонные виды составляли лишь 20% фауны зоопланктона и были представлены копеподами и коловратками (Лазарева, 2017). Бентопланктон включал 45% таксонов (в основном циклопоидных копепод и гарпактицид), а на эвритопные формы (кладоцер и коловратку Brachionus plicatilis) и меропланктон (личинок хирономид и клопов кориксид) приходилось по 15%. Отметим, что во всех реках таксоны Harpacticoida и Ostracoda преобладали в сборах мейобентоса, что характеризует это сообщество как эумейобентос или бентопланктон.
По обилию в зоопланктоне полигалинных рек Солянка и Чернавка доминировали эвритопные виды (>50% общей численности), тогда как в мезогалинных реках Хара, Ланцуг и Большая Саморода – бентопланктон или эупланктон (Лазарева, 2017). Общая закономерность для всех рек – это снижение таксономического разнообразия зоопланктона, мейобентоса и макрозообентоса в условиях высокой трофности и продуктивности в придонном слое воды при сохранении высокой численности (Зинченко и др., 2018). Такие галофильные виды макрозообентоса, как личинки двукрылых Cricotopus salinophilus, Chironomus aprilinus, Ch. salinarius, Microchironomus deribae, Palpomyia schmidti и др. характерны одновременно для сообществ зоопланктона и мейобентоса. При этом наибольшую устойчивость к критическим факторам среды в соленых реках проявляют цератопогониды и хирономиды.
Высокая межсезонная изменчивость параметров среды, присущая соленым рекам аридных экосистем, определила специфический характер процессов формирования и трансформации сообществ, главные из которых – адаптационные возможности отдельных видов. Проведенные нами ранее исследования соленых рек не выявили наиболее значимые факторы или комплексы факторов, определяющих структуру планктонных и донных сообществ (Zinchenko et al., 2017; Зинченко и др., 2018) в изменяющемся пространственно-временном отрезке времени. Очевидно, изменение структуры биотических сообществ разных таксономических групп различно и зависит не только от уровня изменения минерализации, но и от биотопических особенностей и специфики адаптации отдельных видов.
Пространственная структура сообществ зоопланктона, макро- и мейобентоса, представленная на рис. 2, имеет высокую мозаичность: в пределах одного биотопа границы и площадь, занятая “взаимопроникающими” таксоценами разных экологических групп, перекрываются и находятся в состоянии флуктуирующего равновесия.
Понятия устойчивости и равновесия часто связывают с метафорой “экологического баланса”, основанной на идее о стремлении природных компонентов скомпенсировать влияние различных внешних возмущений, что выражается в регулярных флуктуациях отдельных популяций и видового состава в целом (Cuddington, 2001). Эта метафора играет фундаментальную роль для понимания “динамического равновесия” сообществ высокоминерализованных вод аридных регионов. Возможно, что способность большинства таксоценов образовывать “временные ассоциации” с консорциативными связями – доминирующий фактор формирования структуры сообществ в высокоминерализованных реках.
Выводы. Немногочисленные работы, освещающие разные аспекты организации сообществ соленых рек, как правило, географически и функционально не аналогичны району Приэльтонья. Таксономический спектр организмов, обитающих в соленых реках аридных регионов мира, существенно различается, что не позволяет провести прямое сопоставление организации планктонных и донных сообществ. С использованием кластерного и обобщенного прокрустова анализа нами построены и проанализированы устойчивые ассоциации таксонов с оценкой индикаторной значимости для отдельных видов сообществ соленых рек, характерные для биотопов с однородными условиями среды. Выявлены три группы видов, приуроченные к различному уровню минерализации воды. Выделены статистически значимые индикаторы гипергалинных условий (>25 г/л), в число которых вошли хирономиды Cricotopus salinophilus, Chironomus salinarius, цератопогониды Palpomyia schmidti, копеподы Apocyclops dengizicus, коловратки Brachionus plicatilis и др. Взаимодействие планктонных и донных сообществ в соленых реках аридного региона Приэльтонья приводит к преобладанию смешанных экологических группировок. Анализ структуры сообществ на основе использования разных методов многомерного анализа указывает на то, что планктон, мейобентос и макрозообентос в условиях флуктуирующей среды высокоминерализованных рек можно рассматривать как своеобразные и динамичные ассоциации консорциативного типа.
Список литературы
Алимов А.Ф., Богатов В.В., Голубков С.М. 2013. Продукционная гидробиология. СПб.: Наука, 342 с.
Балушкина Е.В., Голубков С.М., Голубков М.С. и др. 2009. Влияние абиотических и биотических факторов на структурно-функциональную организацию экосистем соленых озер Крыма // Журн. общ. биологии. Т. 70. № 6. С. 504–514.
Гусаков В.А., Гагарин В.Г. 2012. Состав и структура мейобентоса высокоминерализованных притоков озера Эльтон // Аридные экосистемы. Т. 18. № 4(53). С. 45–54.
Джонгман Р.Г.Г., тер Браак С.Дж.Ф., ван Тонгерен О.Ф.Р. 1999. Анализ данных в экологии сообществ и ландшафтов. М.: Рос. акад. с.-х. наук, 306 с.
Зинченко Т.Д., Шитиков В.К., Головатюк Л.В. и др. 2018. Планктонные и донные сообщества в соленых реках бассейна оз. Эльтон: статистический анализ зависимостей // Аридные экосистемы. Т. 24. № 3(76). С. 89−96.
Крылов А.В. 2005. Зоопланктон равнинных малых рек. М.: Наука, 263 с.
Лазарева В.И. 2017. Топическая и трофическая структура летнего зоопланктона соленых рек бассейна оз. Эльтон // Аридные экосистемы. Т. 23. № 1(70). С. 72–82.
Шадрин Н.В., Ануфриева Е.В. 2018. Экосистемы гиперсоленых водоемов: структура и трофические связи // Журн. общ. биологии. Т. 79. № 6. С. 418–428.
Cuddington K. 2001. The “balance of nature” metaphor and equilibrium in population ecology // Biology and Philosophy. V. 16(4). P. 463–479.
González I., Lê Cao K.-A., Davis M.J., Déjean S. 2012. Visualising associations between paired “omics” data sets // BioData Minning. V. 5(19). [Электронный ресурс] (Дата обращения: 12.04.2019).https://doi.org/10.1186/1756-0381-5-19
Gower J.C. 1975. Generalized procrustes analysis // Psychometrika. V. 40. P. 33–51.
Hervé M.R., Nicolè F., Lê Cao K.A. 2018. Multivariate Analysis of Multiple Datasets: a Practical Guide for Chemical Ecology // J. Chem. Ecol. V. 44. P. 215–234.
Kenkel N.C. 2006. On selecting an appropriate multivariate analysis // Can. J. Plant Sci. V. 86. P. 663–676.
Lê Cao K.-A., Boitard S., Besse P. 2011. Sparse PLS Discriminant Analysis: biologically relevant feature selection and graphical displays for multiclass problems // BMC Bioinformatics. V. 12. P. 253–269. https://doi.org/10.1186/1471-2105-12-253
Legendre P., Legendre L. 2012. Numerical Ecology. Amsterdam: Elsevier Sci. BV., 1006 p.
Meng C., Zeleznik O.A., Thallinger G.G. et al. 2016. Dimension reduction techniques for the integrative analysis of multi-omics data // Briefings in Bioinformatics. V. 17. P. 628–641.
Rohart F., Gautier B., Singh A., Lê Cao K.-A. 2017. MixOmics: An R package for ‘omics feature selection and multiple data integration // PLoS Comput. Biol. V. 13. № 11. [Электронный ресурс] (Дата обращения: 12.04.2019).https://doi.org/10.1371/journal.pcbi.1005752
Singh A., Gautier B., Shannon C.P. et al. 2016. DIABLO – an integrative, multi-omics, multivariate method for multi-group classification // BioRxiv. № 067611. 50 р. [Электронный ресурс] (Дата обращения: 12.04.2019).https://doi.org/10.1101/067611
Tenenhaus A., Tenenhaus M. 2011. Regularized generalized canonical correlation analysis // Psychometrika. V. 76. P. 257–284.
Ter Braak C.J.F. 1994. Canonical community ordination. Part I: Basic theory and linear methods // Ecoscience. V. 1. P. 127–140.
Whittaker R.H. 1973. Direct gradient analysis: techniques // Handbook of Vegetation Science. Part V: Ordination and Classification of Vegetation. The Hague: Dr. W. Junk B.V. Publ., P. 7–31.
Wold H. 1985. Partial least squares // Encyclopedia of statistical sciences. N.Y.: Wiley P. 581–591.
Zinchenko T.D., Golovatyuk L.V., Abrosimova E.V., Popchenko T.V. 2017. Macrozoobenthos in Saline Rivers in the Lake Elton Basin: Spatial and Temporal Dynamics // Inland Water Biol. V. 10. № 4. P. 384–398. https://doi.org/10.1134/S1995082917040125
Дополнительные материалы отсутствуют.
Инструменты
Биология внутренних вод


