Биология внутренних вод, 2019, № 4-2, стр. 74-81
Анализ клеточного цикла и морфофункциональных параметров гемоцитов Mytilus galloprovincialis Lam., 1819 (Bivalvia) в прибрежных экосистемах с различной антропогенной нагрузкой
А. Ю. Андреева a, *, Е. С. Кладченко a, Т. А. Кухарева a, Е. Г. Сахонь a
a Институт морских биологических исследований им. А.О. Ковалевского РАН
Севастополь, Россия
* E-mail: andreevaal@gmail.com
Поступила в редакцию 20.04.2018
После доработки 18.02.2019
Принята к публикации 09.04.2019
Аннотация
Прибрежная акватория Черного моря в районе г. Севастополь активно используется в хозяйственно-бытовых и промышленных целях и характеризуется повышенным содержанием органических и неорганических загрязнителей. Для определения степени влияния токсикантов на функциональное состояние организмов, населяющих эту акваторию, были проанализированы изменения морфологии, содержания ДНК и параметров клеточного цикла гемоцитов двустворчатого моллюска Mytilus galloprovincialis Lam. на шести станциях, характеризующихся различной степенью антропогенного загрязнения. В качестве контрольной группы использованы особи с мидийно-устричной фермы (оз. Донузлав, Крым). Между гемоцитами особей из референтного района и исследуемой акватории установлены достоверные различия по основным морфофункциональным параметрам (размер, гранулярность, величина ядерно-плазматическое отношение). У мидий из прибрежных вод г. Севастополь выявлены аномалии клеточного цикла гемоцитов, проявлявшиеся в виде анеуплоидии, увеличения внутрииндивидуальной вариабельности размера генома, увеличения доли клеток с содержанием ДНК 4с до 34.80–65.50%. Последнее, вероятно, соответствует переходу клеток в полиплоидное состояние.
ВВЕДЕНИЕ
Начиная с середины ХХ в. по настоящее время, акватория г. Севастополь и Севастопольская бухта, в частности, подвергались интенсивной антропогенной нагрузке со стороны военно-промышленного комплекса, рекреационных объектов, предприятий бытового и коммунального обслуживания города (Овсяный и др., 2009). В бассейн акватории поступают ливневые, промышленные и хозяйственно-бытовые сточные воды (Моисеенко и др., 2016). Результат такого воздействия – загрязнение акватории тяжелыми металлами, биогенными элементами, синтетическими поверхностно-активными веществами и нефтепродуктами (Овсяный и др., 2009). Значительно усугубляет ситуацию затрудненный водообмен между бухтой и открытым морем (Копытов и др., 2010). Показано (Кадошников и др., 2011; Копытов и др., 2010; Орехова и др., 2011), что в донных осадках Севастопольской бухты превышены концентрации нефтепродуктов, мышьяка, фосфора, титана, а также тяжелых металлов, среди которых марганец, олово, цинк, медь, свинец, кадмий, хром, никель. Концентрация загрязняющих веществ в донных осадках максимальна в центральной части бухты, в районе бухты Северная, и снижается по направлению к притоку р. Черная и южному молу (Копытов и др., 2010; Осадчая и др., 2004). В результате сброса ливневых стоков в районе Южной бухты (входит в гидрологическую сеть Севастопольской бухты) и г. Инкерман в поверхностном слое вод повышено содержание биогенных элементов антропогенного происхождения (Орехова и др., 2011). В донных осадках в районе пляжа Хрустальный концентрации тяжелых металлов и нефтепродуктов значительно ниже, чем в районе бухты Северная, но при этом донные осадки содержат большое количество свободной органики, что свидетельствует о полисaпробности этой части бухты (Миронов и др., 2012).
Двустворчатые моллюски – классический модельный объект для мониторинговых исследований морских акваторий (Oehlmann, Schulte-Oehlmann, 2003). При этом оценка функционального состояния моллюсков возможна по морфологическим и физиологическим показателям клеток, циркулирующих в гемолимфе, – гемоцитов. Гемоциты считаются основными клетками, осуществляющими фагоцитоз, продукцию растворимых белковых факторов гуморального иммунитета (лизины, опсонины, агглютинины, антимикробные пептиды), генерацию активных форм кислорода и другие реакции неспецифического иммунитета (Carballal et al., 1997; Ottaviani et al., 1998). Показано (Ottaviani et al., 1998), что наличие в воде загрязняющих веществ различной природы индуцирует изменения в числе и соотношении типов гемоцитов, их жизнеспособности и показателях неспецифического иммунитета. Также отмечено (Bihari et al., 2003), что многие токсиканты оказывают выраженный генотоксический эффект, вызывая целый комплекс хромосомных нарушений у моллюсков. В настоящее время для исследования функционального состояния гемоцитов наиболее часто применяется метод проточной цитометрии. Эта технология зарекомендовала себя как наиболее релевантный способ их классификации, оценки показателей неспецифического иммунитета и жизнеспособности. Широкое применение метод проточной цитометрии получил в работах по оценке содержания ДНК и анализу клеточного цикла. Интенсивность пролиферации гемоцитов устанавливается на основании количественного подсчета числа клеток, находящихся в G0, G1, S, G2 и M. Также метод позволяет идентифицировать клетки с аномальным содержанием ДНК (полиплоидные или анеуплоидные) (da Silva et al., 2005; Elston et al., 1990; Moore et al., 1991; Reno et al., 1994).
Цель работы – провести сравнительный анализ морфофункциональных показателей и содержания ДНК гемоцитов средиземноморской мидии Mytilus galloprovincialis Lam. на различных участках акватории Черного моря в районе г. Севастополь.
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
Особей M. galloprovincialis массой 12.9 ± 2.3 г и размером 57.8 ± 1.8 мм отбирали на шести станциях прибрежных участков Черного моря вблизи г. Севастополь (табл. 1) в течение лета 2017 г. В качестве контрольной группы использовали особей с мидийно-устричной фермы (оз. Донузлав, Крым). Объем выборки для каждой точки был ≥20 особей. Стадию зрелости гонад определяли стандартным методом по шкале Любе–Валли (Valli, 1971). Все исследуемые особи находились на стадии возобновления половой активности (II и III стадии).
Таблица 1.
Географические координаты станций отбора проб
| Станция | Местонахождение | Координаты | |
|---|---|---|---|
| с.ш. | в.д. | ||
| Контрольная | оз. Донузлав | 45.346322 | 33.026841 |
| 1 | Выход из Севастопольской бухты | 44.619188 | 33.505882 |
| 2 | Артиллерийская бухта | 44.617032 | 33.516267 |
| 3 | Северная бухта | 44.626547 | 33.534877 |
| 4 | Севастопольская бухта | 44.612091 | 33.58094 |
| 5 | Открытое море вблизи м. Фиолент | 44.507909 | 33.478384 |
| 6 | То же | 44.626547 | 33.534877 |
Образцы гемолимфы отбирали стерильным шприцом из мускула-замыкателя, фильтровали (фильтр с диаметром ячеи 20 мкм) и трижды отмывали в стерильной морской воде путем центрифугирования (500 g, 10 мин). Для анализа использовали пробы гемолимфы, объединенные из 3–5 особей. Все работы по отмывке, подготовке клеток для анализа проводились при температуре +4°С для предотвращения слипания клеток. Готовые суспензии гемоцитов разводили стерильной морской водой (1–2 × 106 гемоцитов на 1 мл), окрашивали ДНК-специфичным количественным красителем SYBR Green I (финальная концентрация в пробе 10 мкМ, инкубация 30 мин в темноте) и анализировали методом проточной цитометрии на цитометре Beckman Coulter FC500. Размеры и гранулярность гемоцитов определяли на двухпараметрических гистограммах распределения клеток по параметрам светорассеяния –FS и SS, соответственно. Содержание ДНК в гемоцитах измеряли на однопараметрических гистограммах распределения интенсивности флуоресценции SYBR Green I в программе Flowing Software 5.2. Для анализа клеточного цикла использовали следующие параметры: количество пиков флуоресценции SYBR Green I (появление дополнительных пиков наряду сo стандартными пиками G0/G1 и G2/M говорит о наличии поли- или анеуплоидии); коэффициент вариации диплоидного G0/G1 пика (CV) (ширина пика на гистограмме), число полиплоидных клеток в пробе по стандартному методу путем определения количества клеток в фазах S, G2 и M (Nunez, 2001). Дискриминацию клеточных агрегатов проводили на основании анализа распределения интенсивности флуоресценции красителя в канале FL2 по амплитуде и широте сигнала (Nunez, 2001).
Для микроскопического анализа из части гемолимфы готовили мазки, которые затем окрашивали по комбинированному методу Паппенгейма (Золотницкая, 1987). После окрашивания мазки фотографировали на микроскопе БИОМЕД ПР-2 ЛЮМ, оборудованном камерой Levenhuk C NG Series, и проводили морфометрический анализ в программе ImageJ 1.51. У каждого гемоцита измеряли наибольший диаметр клетки (без учета псевдоподий), а также диаметр ядра. По результатам измерений определяли ядерно-плазматическое отношение клетки (ЯПО) (Carballal et al., 1997):
где Дя – наибольший диаметр ядра клетки, Дк – наибольший диаметр клетки без учета псевдоподий.Нормальность распределения проверяли по критерию Шапиро–Уилко. Достоверность различий между группами оценивали при помощи t-критерия Стьюдента при уровне значимости p ≤ 0.05. Результаты представлены в виде M ± m.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Анализ распределения гемоцитов по параметрам FS и SS на проточном цитометре выявил две субпопуляции клеток, характеризующихся разными размерами и уровнем гранулярности (рис. 1). Различия между субпопуляциями по обоим показателям были достоверны. Относительно мелкие клетки с низким уровнем гранулярности, классифицированные как агранулоциты, преобладали в пробах контрольного района – 78.38 ± 8.97% всех клеток в суспензии. Крупные клетки, размер и гранулярность которых в >4.5 раза превышали таковые у агранулоцитов, идентифицированы как гранулоциты и были 21.58 ± 8.98%. Высокие значения SS, характерные для клеток данной субпопуляции, свидетельствовали о неоднородности структуры цитоплазмы и наличия в ней большого числа включений (гранул). У мидий, отобранных в различных точках Севастопольской бухты, значения FS и SS внутри каждой субпопуляции гемоцитов были близкими к контрольной группе. Соотношение числа гемоцитов, принадлежащих разным популяциям, напротив, варьировало в широких пределах. Наименьшее число агранулоцитов обнаружено на ст. 5 (район м. Фиолент) – 17.04 ± 2.21%. На ст. 6 (район м. Фиолент) и ст. 4 (район г. Инкерман) доля агранулярных клеток была также существенно ниже контроля и составляла 49.49 ± 7.18 и 49.44 ± 10.33% соответственно. В свою очередь, особи, отобранные на ст. 1 (выход из Севастопольской бухты), характеризовались самым низким числом гранулоцитов – 6.61 ± 0.60%. На остальных участках соотношение морфотипов клеток в гемолимфе мидий соответствовало показателям контрольной группы (агранулоциты – 78.38 ± ± 8.97%, гранулоциты – 21.58 ± 8.98%).
Рис. 1.
Морфотипы гемоцитов и их соотношение в гемолимфе мидий акватории г. Севастополь: (а) пример распределения клеток методом проточной цитометрии на основании прямого и бокового рассеяния; (б) соотношение морфотипов клеток в гемолимфе на контрольной станции (К) и ст. 1–6. 1 – агранулоциты, 2 – гранулоциты.
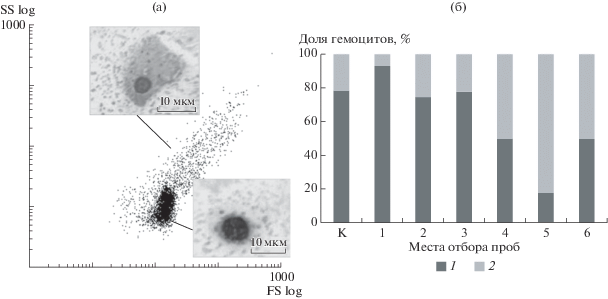
На окрашенных мазках гемолимфы мидий также выделено два морфотипа гемоцитов: агранулоциты и гранулоциты. Агранулоциты представляли собой клетки диаметром 7.95 ± 0.12 мкм со сравнительно крупным ядром и узкой полосой цитоплазмы вокруг него. Гранулоциты имели больший размер (11.88 ± 0.44 мкм в диаметре), ядра располагались преимущественно ацентрично. Характерная особенность гранулоцитов – наличие в цитоплазме базофильно окрашенных гранул, число которых варьировало в пределах 3–25 шт. У всех мидий, использованных в работе, размер и морфология гемоцитов были сходными.
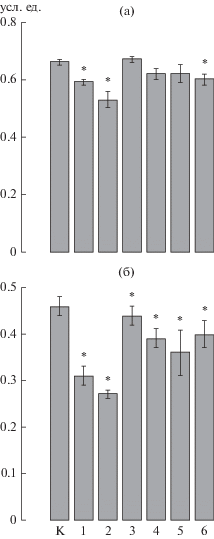
В результате морфометрического анализа отмечено, что величина ЯПО у агранулоцитов и гранулоцитов контрольной группы мидий достигала 0.68 ± 0.01 и 0.46 ± 0.02 соответственно (рис. 2). Сравнение данных со ст. 1–6 с контрольными показателями выявило, что агранулоциты имели меньший разброс в значениях ЯПО, чем гранулоциты. Минимальная величина ЯПО (0.53 ± 0.03 для агранулоцитов и 0.27 ± 0.01 для гранулоцитов) отмечена у мидий, обитающих в Артиллерийской бухте (ст. 2), максимальная (0.67 ± 0.01 для агранулоцитов и 0.44 ± 0.02 для гранулоцитов) – в Северной бухте (ст. 3).
Рис. 2.
ЯПО агранулоцитов (а) и гранулоцитов (б) у гемоцитов мидий, обитающих в местах с различной антропогенной нагрузкой. Остальные обозначения, как на рис. 1.
Контрольная группа мидий характеризовалась нормальным распределением гемоцитов по содержанию ДНК. Случаи деления гемоцитов выявлены в двух пробах из шести, доля делящихся клеток не превышала 8.50%. Гистограммы распределения флуоресценции красителя SYBR Green I имели стандартный вид, диплоидные пики были однородны, значение CV составляло 9.96 ± 0.77. Случаев анеуплоидии не выявлено (табл. 2).
Таблица 2.
Отклонения в содержании ДНК мидий прибрежной акватории г. Севастополь
| Станция | Число отобранных проб |
CV диплоидного пика | Множественные пики содержания ДНК | Деление гемоцитов | Доля делящихся гемоцитов, % |
|---|---|---|---|---|---|
| Число проб гемолимфы | |||||
| Контроль | 6 | 9.96 ± 0.77 | – | 2 | 8.50 ± 0.05 |
| 1 | 11 | 19.48 ± 1.48 | 7 | – | – |
| 2 | 9 | 12.30 ± 1.25 | 2 | 7 | 48.36 ± 6.97 |
| 3 | 8 | 18.03 ± 1.7 | 3 | 4 | 34.80 ± 7.93 |
| 4 | 8 | 12.69 ± 1.59 | 2 | 5 | 65.50 ± 5.47 |
| 5 | 6 | 15.05 ± 2.88 | 6 | – | – |
| 6 | 10 | 15.65 ± 1.83 | – | 3 | 35.80 ± 5.42 |
У особей, отобранных на ст. 1–6, отмечались разнообразные нарушения в распределении гемоцитов по содержанию ДНК (табл. 2). Среди них наиболее частыми были следующие: увеличение числа пиков флуоресценции красителя, раздвоение и неоднородность диплоидного пика, увеличение числа клеток в фазах S, G2 и М. Также у гемоцитов мидий из разных станций преобладали различные отклонения в структуре ДНК-профиля (рис. 3). У всех мидий на ст. 1–6 диплоидный пик флуоресценции красителя имел более высокие значения CV по сравнению с контрольной группой (табл. 2). Минимальное увеличение показателя (в 1.2 раза) отмечено на ст. 2 и 4, максимальное (в 1.9 раза) – на ст. 1. На ст. 2–4, 6 у особей наблюдалось интенсивное деление гемоцитов. Наибольшее количество проб с делящимися клетками гемолимфы зарегистрировано на ст. 2, где клетки в семи из девяти проб имели ДНК-профиль, соответствующий большому числу полиплоидных клеток (48.36 ± 6.97%). В точках, расположенных в открытом море, случаев деления гемоцитов либо не обнаруживали (ст. 1, 5), либо они составляли (35.80 ± 5.42%) и встречались не более чем в трех пробах из 10 (ст. 6). Число делящихся гемоцитов в пробах, как правило, было велико и превышало контрольные значения в 4–7.7 раза. На ст. 4 отмечено появление в пробах полиплоидных гемоцитов.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Изменение концентрации гемоцитов, а также соотношения морфотипов клеток в гемолимфе двустворчатых моллюсков часто используется в качестве индикатора при оценке качества водной среды. У особей, обитающих в контрольном районе (оз. Донузлав), преобладающим морфотипом гемоцитов были агранулоциты, их доля превышала 75% всех клеток в клеточной популяции. В точках отбора мидий из Севастопольской акватории увеличение числа гранулоцитов отмечено на ст. 4–6 (Севастопольская бухта, район м. Фиолент). При этом участки, расположенные в открытом море вблизи м. Фиолент (ст. 5, 6), характеризуются относительно невысоким уровнем загрязнения, в то время как Севастопольская бухта (ст. 4), напротив, испытывает на себе значительную антропогенную нагрузку. Таким образом, сопоставление доли гранулоцитов в гемолимфе мидий с уровнем загрязнения среды на станциях не позволяет сделать вывод об однозначном влиянии интегрального загрязнения на клеточный состав гемолимфы. Вероятно, изменение клеточного состава гемолимфы происходит при действии конкретных токсикантов, что требует дополнительного исследования в лабораторных условиях. Известно, что по сравнению с агранулоцитами, циркулирующие гранулоциты моллюсков в бóльшей степени отвечают за реализацию клеточного иммунного ответа, осуществляя фагоцитоз, продукцию факторов гуморального иммунитета и генерацию окислительного взрыва (Aladaileh, 2007). Повышение доли гранулоцитов в гемолимфе свидетельствует об интоксикации организма (Giron-Pérez, 2010). Увеличение количества гранулоцитов часто наблюдается у моллюсков, обитающих в загрязненных акваториях (Seiler, Morse, 1988). Аналогичные результаты получены при экспериментальном воздействии поверхностно-активных соединений, тяжелых металлов и других поллютантов на Ostrea edulis Linnaeus, 1758 и Mytilus galloprovincialis (Giron-Pérez, 2010). Показано также, что увеличение доли гранулоцитов носит дозозависимый характер и наблюдается при воздействии умеренных концентраций токсических веществ, в то время как многократное превышение предельно допустимых концентраций приводит к снижению доли гранулоцитов и общего числа клеток в гемолимфе (Giron-Pérez, 2010). Среди возможных объяснений наблюдаемого повышения количества гранулоцитов можно предположить активизацию иммунного ответа моллюсков. Кроме того, учитывая, что гранулоциты обладают высокой фагоцитарной активностью, их увеличение может быть обусловлено повышением содержания взвешенных в воде частиц и связанной с этим необходимостью их элиминации из организма моллюска-фильтратора. Таким образом, изменение клеточного состава гемолимфы в сторону увеличения доли гранулоцитов у мидий, отобранных на открытом участке Севастопольской акватории (ст. 5, 6), позволяет нам предположить наличие неких факторов, усиливающих фагоцитарную активность гемоцитов.
Отдельного внимания заслуживают различия в величине ЯПО гемоцитов мидий, отобранных на разных участках Севастопольской акватории. Наибольшие различия между станциями по этому показателю были характерны для гранулоцитов. В основе снижения данной величины, как показано в ряде работ (Hoher et al, 2012; Seiler, Morse, 1988; Sung et al, 2003), может лежать несколько механизмов: гипервакуолизация цитоплазмы, округление клеток, увеличение объема цитоплазмы, появление псевдоподий, увеличение количества и размера гранул у гранулоцитов. Достоверные различия в ЯПО гранулоцитов контрольного района и Севастопольской акватории позволяют использовать его в качестве одного из критериев биоиндикации.
Анализ содержания ДНК гемоцитов мидий, отобранных на станциях вблизи г. Севастополь, продемонстрировал нарушения плоидности клеток. Клеточная популяция гемоцитов контрольной группы характеризовалась нормальным распределением клеток по содержанию ДНК, о чем свидетельствовали следующие показатели: небольшое число делящихся гемоцитов (<9%), а также отсутствие дополнительных анеуплоидных пиков. У особей, отобранных в исследуемых участках акватории, отмечалась высокая внутрииндивидуальная вариабельность размера генома, проявлявшаяся в увеличении CV диплоидного пика или его раздвоении. Для гемоцитов моллюсков небольшие количественные различия в размере генома (CV < 9%) допустимы и укладываются в границы нормы (Bihari et al., 1999; Rodriguez, et al., 1996). Вариабельность диплоидного пика у контрольных особей превышала установленные пределы. Причины подобного явления в настоящей работе не были определены и требуют дальнейших уточнений, но, по-видимому, влияние антропогенного фактора на этот показатель исключено. Следует учитывать также, что на всех исследованных участках, кроме Артиллерийской бухты (ст. 2) и станции в Севастопольской бухте (ст. 4), зарегистрировано увеличение CV по сравнению с контролем. Это, в свою очередь, может свидетельствовать о присутствии в гемолимфе субпопуляций анеуплоидных клеток и клеток с хромосомными аберрациями (Bihari et al, 2003). Показано, что высокий CV диплоидного пика (>9%) может быть следствием фрагментации хромосом в результате токсического воздействия или указывать на другие хромосомные аберрации, вызываемые, в частности, кластогенными агентами (Lowcock et al.,1997). Также обнаружено, что увеличение CV наблюдается при химическом и радиационном воздействии. Кроме того, изменения плоидности циркулирующих гемоцитов могут возникать вследствие развития у мидий гемопоэтической неоплазии (Elston et al., 1990). Данное заболевание выявлено у 15 видов двустворчатых моллюсков и характеризуется широкой географией распространения. Среди возможных причин возникновения гемопоэтической неоплазии следует рассматривать и загрязнение окружающей среды (Aladaileh et al., 2007), хотя в последнее время все больше подтверждений находит гипотеза о горизонтальном переносе гемопоэтической неоплазии – путем вирусной инфекции (Renault, Novoa, 2014) или даже прямой клональной трансмиссии раковых клеток от больных моллюсков к здоровым (Metzger et al., 2015, 2016). Вместе с тем, однозначно говорить о наличии неоплазии у мидий, использованных нами в анализе, некорректно, поскольку диагностика заболевания требует применения дополнительных методов исследования.
У мидий, обитающих в исследуемой части акватории, отмечалось увеличение количества полиплоидных гемоцитов. Известно, что циркулирующие гемоциты способны к делению, однако, допустимой нормой считается 5–8% пролиферирующих клеток (Aladaileh et al., 2007; Delaporte et al., 2008). У мидий, отобранных на всех станциях, кроме тех, что расположены на выходе из Севастопольской бухты (ст. 1) и открытого участка вблизи м. Фиолент (ст. 5), отмечено >30% полиплоидных гемоцитов с содержанием ДНК 4с, что позволяет предполагать переход гемоцитов на полиплоидизирующий митоз. Наибольшее число делящихся и/или полиплоидных клеток (34.80–65.50%) обнаружено у особей из Севастопольской бухты (ст. 2–4), которая по данным работ (Кадошников и др., 2011; Копытов и др., 2010; Моисеенко и др., 2016; Овсяный и др., 2009) отличается повышенным содержанием органических и неорганических загрязнений. Вероятно, увеличение числа полиплоидных гемоцитов обусловлено наличием в спектре загрязняющих веществ агентов, обладающих генотоксическим эффектом. Известно, что многие водные поллютанты вызывают разрывы цепей ДНК, нарушения работы системы репарации и появление микроядер (Bihari et al., 1999). Инкубация мидий в воде, содержащей пестициды, индуцировала дозозависимые нарушения клеточного цикла, проявляющиеся в усилении их деления и/или блокировке премитотической и митотической фаз деления (Mičić et al., 2004).
Гемоциты мидий, отобранных на исследуемых станциях, обладали специфическим профилем отклонений в пропорции морфотипов, структурных характеристиках, а также содержании ДНК. По-видимому, преобладание определенных аномалий обусловлено спектром загрязняющих веществ и их концентрации в месте отбора проб. Согласно имеющимся работам (Кадошников и др., 2011; Копытов и др., 2010; Моисеенко и др. 2016; Овсяный и др., 2009) станции отбора мидий ранжированы по уровню загрязнения в следующем порядке 3 > 2 ≥ 4 > 1 > 5 ~ 6. Данные экологического мониторинга коррелировали с исследованными показателями. Наиболее существенные нарушения в содержании ДНК (массовое деление гемоцитов, высокий CV диплоидного пика) характерны для самых загрязненных участков Севастопольской бухты (ст. 2, 3). Нарушения в процессе деления гемоцитов мидий, отобранных в Артиллерийской бухте (ст. 2), сопровождались изменениями величины ЯПО. У особей, отобранных в Севастопольской бухте (ст. 4), отмечены значительные отклонения в количестве гранулоцитов, интенсивности деления клеток гемолимфы, а также значениях ЯПО. В свою очередь, распределение клеток по интенсивности флуоресценции ДНК-красителя у особей, собранных за пределами г. Севастополь (ст. 5, 6), оказалось наиболее близким к контрольной группе, но доля гранулоцитов была значительно выше. Следует учитывать, что морфофункциональные особенности гемоцитов определяются не только присутствием экотоксикантов в морской воде, но и комплексом абиотических и биотических факторов, среди которых наиболее существенны следующие: температура воды, содержание растворенного в ней кислорода, а также стадия жизненного цикла моллюска (нерест) (Анисимова, 2013; Delaporte et al., 2008). В настоящей работе использовали моллюсков, собранных на всех станциях в течение короткого промежутка времени, характеризующегося постоянством температуры. Нерестовые процессы также были исключены.
Выводы. У мидий из различных участков акватории г. Севастополь выявлены аномалии в содержании ДНК и морфологических характеристиках гемоцитов. Наиболее существенные отклонения клеточного цикла – анеуплоидия, полиплоидия, внутрииндивидуальная вариабельность размера генома. Аномалии в содержании ДНК, изменение величины ядерно-плазматического отношения гемоцитов и клеточного состава гемолимфы мидий соотносились со степенью антропогенной нагрузки на среду в районе отбора проб. Максимальное количество делящихся/полиплоидных клеток, отклонения ЯПО и число гранулоцитов в гемолимфе обнаружено у мидий, обитающих в Севастопольской бухте, характеризующейся высокими концентрациями загрязняющих веществ.
Список литературы
Анисимова А.А. 2013. Морфофункциональные параметры гемоцитов в оценке физиологического состояния двустворчатых моллюсков // Биология моря. Т. 39. № 6. С. 389.
Золотницкая Р.П. 1987. Методы гематологических исследований // Лабораторные методы исследования в клинике (справочник). Москва: Медицина. С. 106.
Кадошников В.М., Шкапенко В. В., Горлицкий Б.А. и др. 2011. Тяжелые металлы в донных отложениях Севастопольской бухты // Мінералогічний журнал. С. 73.
Копытов Ю.П., Минкина Н.И., Самышев Э.З. 2010. Уровень загрязненности воды и донных отложений Севастопольской бухты (Черное море) // Системы контроля окружающей среды. № 14. С. 199.
Миронов О.Г., Алёмов С.В., Осадчая Т.С. и др. 2012. Мониторинг экологического состояния бухты Артиллерийская (Севастополь, Черное море) // Морской экологический журнал. Т. 10. № 1. С. 41.
Моисеенко О.Г., Орехова Н.А., Полякова А.В. и др. 2016. Индексы и показатели экологического статуса Севастопольской бухты // Вестник Московского университета. Сер. 5. География. № 4. С. 42.
Овсяный Е.И., Котельянец Е.А., Орехова Н.А. 2009. Мышьяк и тяжелые металлы в донных отложениях Балаклавской бухты (Черное море) // Морской гидрофизический журнал. № 4. С. 67.
Орехова Н.А., Романов А.С., Хоружий Д.С. 2011. Межгодовые изменения концентрации биогенных элементов в Севастопольской бухте за период 2006–2010 гг. // Кологічна безпека прибережної та шельфової зон та комплексне використання ресурсів шельфу. Вип. 25. Т. 1. С. 192
Осадчая Т.С., Алемов С.В., Шадрина Т.В. 2004. Экологическое качество донных осадков Севастопольской бухты: ретроспектива и современное состояние // Экология моря. Т. 66. С. 82.
Aladaileh S., Nair S.V., Birch D., Raftos D.A. 2007. Sydney rock oyster (Saccostrea glomerata) hemocytes: morphology and function // J. Invertebr. Pathol. V. 96(1). P. 48.
Barcia R., Cao A., Arbeteta J., Ramos-Martinez J.I. 1999. The IL-2 Receptor in Hemocytes of the Sea Mussel Mytilus galloprovincialis Lam. // IUBMB life. V. 48. I. 4. P. 419.
Bayne C.J., Moore M.N., Carefoo T.H., Thompson R.J. 1979. Hemolymph functions in Mytilus californianus: the cytochemistry of hemocytes and their responses to foreign implants and hemolymph factors in phagocytosis // J. Invertebr. Pathol. V. 34(1). P. 1.
Bihari N., Batel R., Zahn R.K. 1999. Flow cytometry in marine environmental research // Periodicum biologorum. V. 101(2). P. 151.
Bihari N., Mičić M., Batel R., Zahn R.K. 2003. Flow cytometric detection of DNA cell cycle alterations in hemocytes of mussels (Mytilus galloprovincialis) off the Adriatic coast, Croatia // Aquat. Toxicol. V. 64(2). P. 121. https://doi.org/10.1016/S0166-445X(03)00040-7
Carballal M.J., Lopez C., Azevedo C., Villalba A. 1997. Hemolymph cell types of the mussel Mytilus galloprovincialis // Dis. Aquat. Org. V. 29. № 2. P. 127.
da Silva P.M., Soudant P., Carballal M.J. et al. 2005. Flow cytometric DNA content analysis of neoplastic cells in haemolymph of the cockle Cerastoderma edule // Dis. Aquat. Organ. V. 67. P. 133. https://doi.org/10.3354/dao067133
Delaporte M., Synard S., Pariseau J. et al. 2008. Assessment of haemic neoplasia in different soft shell clam Mya arenaria populations from eastern Canada by flow cytometry // J. Invertebr. Pathol. V. 98. P. 190. https://doi.org/10.1016/j.jip.2007.12.005
Donaghy L., Lambert C., Choi K.-S., Soudant P. 2009. Hemocytes of the carpet shell clam (Ruditapes decussatus) and the Manila clam (Ruditapes philippinarum): current knowledge and future prospects // Aquaculture. V. 297. P. 10.
Elston R.A., Drum A.S., Allen S.K. 1990. Progressive development of circulating polyploidy cells in Mytilus with hemic neoplasia // Dis. Aquat. Org. V. 8. P. 51.
Feng S.Y., Feng J.S., Yamasu T. 1977. Roles of Mytilus coruscus and Crassostrea gigas blood cells in defense and nutrition // Comp. Pathobiol. Springer: Boston. P. 31.
Galloway S.M. 1994. Chromosome aberrations induced in vitro: mechanisms, delayed expression, and intriguing questions // Environ. Mol. Mutagen. V. 23 (Suppl.). P. 24. https://doi.org/10.1002/em.2850230612
Giron-Pérez M.I. 2010. Relationships between innate immunity in bivalve molluscs and environmental pollution // Invertebrate Survival Journal. V. 7. P. 149.
Hine P.M. 1999. The inter-relationships of bivalve haemocytes // Fish Shellfish Immunol. V. 9. № 5. P. 367. https://doi.org/10.1006/fsim.1998.0205
Höher N., Köhler A., Strand J., Broeg K. 2012. Effects of various pollutant mixtures on immune responses of the blue mussel (Mytilus edulis) collected at a salinity gradient in Danish coastal waters // Mar. Environ. Res. V. 75. P. 35. https://doi.org/10.1016/j.marenvres.2011.11.003
Lowcock L.A., Sharbel T.F., Bonin J. et al. 1997. Flow cytometric assay for in vivo genotoxic effects of pesticides in green frogs (Rana clamitans) // Aquat. Toxicol. V. 38. P. 241. https://doi.org/10.1016/S0166-445X(96)00846-6
Metzger M.J., Reinisch C., Sherry J., Goff S.P. 2015. Horizontal transmission of clonal cancer cells causes leukemia in soft-shell clams // Cell. V. 161. P. 255–263.
Metzger M.J., Villalba A., Carballal M.J. et al. 2016. Widespread transmission of independent cancer lineages within multiple bivalve species // Nature. № 534(7609). P. 705.
Mičić M., Bihari N., Mlinarič-Raščan I. 2004. Influence of herbicide, 2,4-dichlorophenoxy acetic acid, on haemocyte DNA of in vivo treated mussel // J. Exp. Mar. Biol. Ecol. V. 311. P. 157. https://doi.org/10.1016/j.jembe.2004.05.007
Moore J.D., Elsterr R.A., Drum S., Wilkinson M.T. 1991. Alternate pathogenesis of systemic neoplasia in the bivalve mollusk Mytilus // J. Invertebr. Pathol. V. 58. P. 231. https://doi.org/10.1016/0022-2011(91)90067-Z
Nunez R. 2001. DNA measurement and cell cycle analysis by flow cytometry // Curr. Issues Mol. Biol. V. 3. P. 67–70.
Oehlmann J., Schulte-Oehlmann U. 2003. Molluscs as bioindicators // Trace Metals and other Contaminants in the Environment. V. 6. P. 577.
Ottaviani E., Franchini A., Barbieri D., Kletsas D. 1998. Comparative and morphofunctional studies on Mytilus galloprovincialis hemocytes: Presence of two aging-related hemocyte stages // Ital. J. Zool. V. 65. № 4. P. 349.
Pipe R.K. 1990. Differential binding of lectins to haemocytes of the mussel Mytilus edulis // Cell Tissue Res. V. 261(2). P. 261.
Pipe R.K., Farley S.R., Coles J.A. 1997. The separation and characterization of haemocytes from the mussel Mytilus edulis // Cell Tissue Res. V. 289(3). P. 537.
Reno P.W., House M., Illingworth A. 1994. Flow cytometric and chromosome analysis of softshell clams, Mya arenaria, with disseminated neoplasia // J. Invertebr. Pathol. V. 64. P. 163.
Renault T., Novoa B. 2014. Viruses infecting bivalve mollusks // Aquat. Living Res. V. 17. P. 397.
Rodríguez A.M., Torrado M., Mendéz J. 1996. Genome-size variation in bivalve molluscs determined by flow cytometry // Mar. Biol. V. 126. P. 489.
Russo J., Lagadic L. 2004. Effects of environmental concentrations of atrazine on hemocyte density and phagocytic activity in the pond snail Lymnaea stagnalis (Gastropoda, Pulmonata) // Environ. Pollut. V. 127. P. 303. https://doi.org/10.1016/S0269-7491(03)00269-0
Seiler G.R., Morse M.P. 1988. Kidney and hemocytes of Mya arenaria (Bivalvia): normal and pollution-related ultrastructural morphologies // J. Invertebr. Pathol. V. 52(2). P. 201. https://doi.org/10.1016/0022-2011(88)90127-9
Sung H.H., Kao W.Y., Su Y.J. 2003. Effects and toxicity of phthalate esters to hemocytes of giant freshwater prawn, Macrobrachium rosenbergii // Aquat. Toxicol. V. 64(1). P. 25. https://doi.org/10.1016/S0166-445X(03)00011-0
Valli G. 1971. Ciclo di maturita sessuale in Mytilus galloprovincialis Lam. di Duino (Trieste) // Boll. Pesca, Piscicolt. Ehidrobiol. V. 26. № 1–2. P. 259.
Vassilenko E., Baldwin S.A. 2014. Using flow cytometry to detect haemic neoplasia in mussels (Mytilus trossulus) from the Pacific Coast of Southern British Columbia, Canada // J. Invertebr. Pathol. V. 117. P. 68. https://doi.org/10.1016/j.jip.2014.02.002
Дополнительные материалы отсутствуют.
Инструменты
Биология внутренних вод



