Биология внутренних вод, 2020, № 1, стр. 50-56
Трофическая структура сообществ донных макробеспозвоночных озер различного уровня минерализации
Д. М. Безматерных a, *, О. Н. Вдовина a
a Институт водных и экологических проблем СО РАН
Алтайский край, Барнаул, Россия
* E-mail: bezmater@iwep.ru
Поступила в редакцию 19.10.2016
После доработки 28.03.2019
Принята к публикации 09.04.2019
Аннотация
Рассмотрена трофическая структура сообществ донных макробеспозвоночных озер различного уровня минерализации юга Обь-Иртышского междуречья – от олигогалинных до гипергалинных. В 48 изученных озерах выявлено 4 трофические группы макробеспозвоночных: 1) хищники; 2) размельчители; 3) соскребатели; 4) собиратели-детритофаги и факультативные фильтраторы. Показано, что при увеличении солености озерных вод меняется доля различных трофических групп в таксономическом составе и биомассе сообществ макробеспозвоночных.
ВВЕДЕНИЕ
Пищевые цепи – один из ведущих показателей функционирования экосистем в условиях действия различных факторов. Трофическая структура сообществ донных макробеспозвоночных может служить чувствительным индикатором состояния водных экосистем. Основная часть макробеспозвоночных в озерах относится к экологической группировке макрозообентоса. В трофической классификации организмов зообентоса учитывают способ питания и преобладающий состав потребляемой пищи (Яковлев, 2005). Наиболее известной на сегодня считается разработанная для рек классификация Камминза (Cummins, 1973) актуальная и в настоящее время (Merritt et al., 2008, 2017). Более подробную классификацию для бентосных и нектобентосных организмов водных объектов cеверной Фенноскандии предложил Яковлев (2000), который выделил шесть трофических групп: 1) грунтозаглатыватели; 2) собиратели детритофаги и факультативные фильтраторы; 3) облигатные собиратели-фильтраторы; 4) соскребатели; 5) размельчители; 6) активные хищники. В России эта система используется и на других озерных системах (Батурина и др., 2014).
К числу наиболее важных факторов, определяющих трофическую структуру сообществ водных беспозвоночных, относится минерализация воды (Cooper, Wissel, 2012). Величина минерализации оказывает существенное влияние на состав, структуру и обилие озерных биоценозов (Hammer, 1986; Williams, 1998), в том числе и на юге Обь-Иртышского междуречья (Благовидова, 1973; Жукова, Безматерных, 2013; Опыт комплексного…, 1982; Bezmaternykh, Zhukova, 2013; Kipriyanova et al., 2007). Однако работ по выявлению трофической структуры сообществ макробеспозвоночных в озерах разной степени минерализации этого региона ранее не проводили.
Цель работы – анализ трофической структуры сообществ донных макробеспозвоночных в озерах различного уровня минерализации юга Обь-Иртышского междуречья.
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
В 2003–2011 гг. в рамках комплексных лимнологических экспедиций исследованы сообщества макробеспозвоночных в озерах юга Обь-Иртышского междуречья. Изученные озера находятся на юге Западной Сибири, в пределах Алтайского края и Новосибирской обл. Общая минерализация вод изученных озер 0.33–140 г/дм3 (табл. 1). По составу и структуре сообществ макробеспозвоночных изученные озера делятся на 4 группы: олигогалинные (минерализация воды <1.2 г/дм3), субгалинные (1.2–5.0), гипогалинные (5.0–20.0), мезо- и гипергалинные (20–140) (Вдовина, Безматерных, 2015). За основу предложенной классификации взята система Хаммера (Hammer, 1986). Всего исследовано 48 озер. Параллельно получены гидрохимические данные (Долматова, Котовщиков, 2013; Кириллов и др., 2008, 2009, 2010).
Таблица 1.
Число отобранных проб в четырех группах озер разного уровня минерализации, выделенных по составу и структуре из 48 сообществ макробеспозвоночных на юге Обь-Иртышского междуречья (2003–2011 гг.)
| Группа озер разного уровня минерализации | Проба | Всего | ||
|---|---|---|---|---|
| количественная | качественная | |||
| I. Олигогалинные | ||||
| Астродым, Батовое, Большое, Бол. Островное, Бол. Пустынное, Верхнее, Гусиное, Кривое (бассейн р. Карасук), Кусган, Ледорезное, Мал. Топольное, Мелкое, Мельничное, Нижнее, Прыганское, Титово, Хомутинное | 146 | 28 | 174 | |
| II. Субгалинные | ||||
| Бол. Горькое, Дуненок, Кабанье, Каменное, Котлёнок, Кривое (бассейн р. Кулунда), Кротово, Лена, Мал. Горькое (бассейн р. Карасук), Мостовое, Песчаное, Студеное, Угловое, Фадиха, Хорошее, Чаган, Чернаково, Шкалово, Широкая Курья | 165 | 33 | 198 | |
| III. Гипогалинные | ||||
| Абушкан, Бол. Топольное, Горькое (бассейн р. Касмала), Горькое (Причановская группа), Илюбайсор, Кривое (бассейн р. Бурла), Фатеево | 28 | 10 | 38 | |
| IV. Мезо- и гипергалинные | ||||
| Кулундинское, Левое Польяново, Людкино, Пресное, Чебаклы | 32 | 5 | 37 | |
| Всего | 371 | 76 | 447 | |
Район исследований расположен в условиях континентального климата на территории Западно-Сибирской низменности в пределах двух физико-географических зон: степной и лесостепной (Поползин, 1967; Савченко, 1997). Озера этого региона различаются размерами, типом питания, минерализацией вод. Общее свойство изученных озер – их мелководность, наличие мягких грунтов, многолетняя изменчивость водного режима. На многих озерах ведется промысел водных биоресурсов (Водоемы…, 1999). Более подробно методы и условия отбора проб, а также таксономический состав и структура сообществ макробеспозвоночных охарактеризованы в предыдущих работах (Вдовина, Безматерных, 2015; Vdovina, Bezmaternykh, 2016).
Материал для исследований отбирали и обрабатывали по стандартным гидробиологическим методикам (Руководство…, 1992): качественные сборы проводили сачком или скребком, количественные – дночерпателем Петерсена с площадью захвата 0.025 м2 или штанговым дночерпателем ГР 91 с площадью захвата 0.007 м2. Было отобрано и проанализировано 371 и 76 коли-чественных и качественных проб соответственно. Отношение видов макробеспозвоночных в каждой трофической группе определяли по классификации Яковлева (2005), с уточнением Емельяновой (1994), Монакову (1998), Прокину (2008), Silina, Prokin (2008), Цихон-Луканиной (1987), Hadicke et al., (2017). Для оценки связи показателей сообществ донных беспозвоночных с экологическими факторами использовали коэффициент ранговой корреляции Спирмена. Сходство видового состава сообществ различных озер оценивали с помощь кластерного анализа по методу Варда (Электронный учебник…, 2012).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
С учетом преобладающего типа питания в исследованных озерах выделено четыре основных трофических группы гидробионтов: собиратели-детритофаги и факультативные фильтраторы (далее – собиратели-детритофаги), соскребатели, размельчители, хищники.
Таксономический состав. Наибольшим таксономическим разнообразием в сообществах макробеспозвоночных исследованных озер отличались собиратели-детритофаги, поедающие детрит на поверхности грунта. Эта группа включала 66 видов беспозвоночных; представлена брюхоногими моллюсками, личинками двукрылых семейств Chironomidae и Stratiomyidae, поденками из сем. Caenidae, а также фитодетритофагами из сем. Naididae.
В следующей по разнообразию (45 видов) группе хищников преобладали пиявки, личинки стрекоз, клопы семейств Corixidae, Gerridae, Nepidae и Notonectidae, жуки сем. Dytiscidae, личинки двукрылых семейств Chaoboridae и Ceratopogonidae. Отмечены хищные личинки ручейников сем. Polycentropodidae, хирономид подсем. Tanypodinae и рода Cryptochironomus, жуки сем. Hydrophilidae. Хищников разделяли на активно охотящихся за жертвой (пиявки, водные жуки, хирономиды, хаобориды), сидящих в засаде (стрекозы, клопы), а также использующих сети и ловушки наряду с активным захватом жертвы (личинки ручейников сем. Polycentropodidae).
В группу размельчителей (18 видов) вошли брюхоногие моллюски рода Lymnaea, ручейники из семейств Limnephilidae и Phryganeidae, хирономиды рода Cricotopus, двукрылые сем. Tipulidae, фитофильные жуки семейств Chrysomelidae и Haliplidae.
Видовой состав соскребателей включал два вида семейств Molannidae и Dryopidae.
Часть выявленных видов можно отнести как к соскребателям, так и к размельчителям – это личинки ручейников сем. Leptoceridae и Gammarus lacustris Sars. Подобная ситуация характерна для представителей отр. Lepidoptera, которые принадлежат к собирателям – облигатным фильтраторам и соскребателям. Не вошли в анализ личинки семейств Dolichopodidae и Scathophagidae, которые не удалось идентифицировать до вида и всеядные личинки сем. Tabanidae.
Более детальное рассмотрение полученных данных позволило выявить характер изменчивости трофической структуры видового состава в зависимости от уровня минерализации вод. В олиго- и субгалинных озерах отмечены все выделенные трофические группы. Наиболее многочисленны собиратели-детритофаги (46 и 44% соответственно), далее по числу видов следовали хищники (40 и 39%), размельчители (13 и 12%) и соскребатели (1 и 5%). С увеличением минерализации воды (в гипогалинных озерах) снижалась доля собирателей-детритофагов (35%), увеличивалась доля хищников (49%) и размельчителей (16%), исчезла группа соскребателей. В мезо- и гипергалинных снизилась доля хищников (30%) и увеличилась доля размельчителей (30%). Доля собирателей-детритофагов достигала 40%.
Трофический спектр видового состава макробеспозвоночных в пределах групп различного уровня минерализации изменялся в зависимости от типа грунта (рис. 1). На илистых грунтах в олигогалинных озерах доминировали собиратели-детритофаги (45%), субдоминировали хищники (40%), далее по количеству видов следовали размельчители (15%). На песчаных грунтах донных беспозвоночных в основном представляли собиратели-детритофаги (64%), далее шли хищники (22%), размельчители (7%) и соскребатели (7%). В субгалинных озерах собиратели-детритофаги доминировали на обоих типах грунта. При переходе от илистых к песчаным грунтам доля размельчителей увеличивалась, хищников – уменьшалась. В более минерализованных гипогалинных озерах, как и в предыдущей группе озер, наблюдалось снижение доли хищников и повышение – размельчителей.
Рис. 1.
Доли трофических групп в видовом составе (а, в) и общей биомассе (б, г) сообществ макробеспозвоночных исследованных озер с разным уровнем минерализации на илистых (a, б) и песчаных грунтах (в, г). I–IV см. табл. 1; 1 – хищники, 2 – размельчители, 3 – соскребатели, 4 – собиратели-детритофаги.
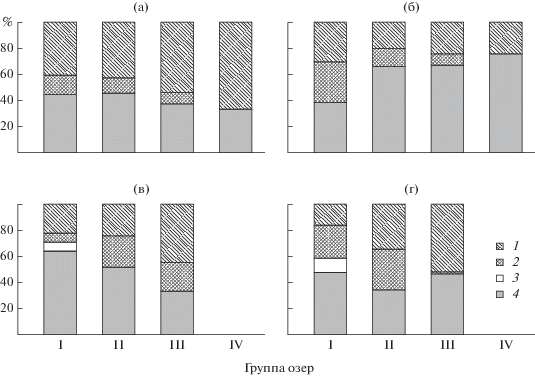
Илистые грунты представлены в озерах всех уровней минерализации. Очень близки по соотношению основных трофических групп зообентоса были олиго- и субгалинные озера (рис. 1а). В этих группах озер преобладали собиратели-детритофаги (45 и 46% соответственно), далее по числу видов следовали хищники (40 и 42% соответственно), незначительно различались доли размельчителей (15 и 12%). В гипогалинных озерах отмечена меньшая доля видов собирателей-детритофагов (37.5%) и большая – хищников (54%). В озерах с более высокой минерализацией вод (мезо- и гипергалинные озера) отсутствовали размельчители, доминировали хищники (66%), субдоминировали собиратели-детритофаги (34%). Следовательно, на илистых грунтах при повышении минерализации вод постепенно снижалась доля собирателей-детритофагов и увеличивалась доля хищников.
Несколько иначе представлен трофический спектр видового состава донных беспозвоночных на песчаных грунтах (рис. 1в). Здесь также при увеличении минерализации снижалась доля собирателей-детритофагов (с 64 до 33%), возрастало количество хищников (с 22 до 45%). С увеличением минерализации увеличивалась роль размельчителей. В мезо- и гипергалинных озерах данный тип грунта отсутствовал.
Общая биомасса. На илистых грунтах по биомассе доминировали собиратели-детритофаги, их доля в различных по минерализации озерах изменялась от 39 до 77% общей биомассы макробеспозвоночных (рис. 1б). В олигогалинных озерах богатая по видовому составу группа собирателей-детритофагов в количественном отношении находилась почти на одном уровне с размельчителями и хищниками. С увеличением минерализации (суб- и гипогалинныe озера) по биомассе преобладали собиратели-детритофаги (по 67%), количество хищников и размельчителей снижалось. В озерах с более высокой минерализацией вод (мезо- и гипергалинные озера) доминировали собиратели-детритофаги (77%), на долю хищников приходилось 23%, размельчители отсутствовали.
На песках также отмечена тенденция увеличения доли хищников при повышении солености вод, биомасса собирателей-детритофагов в различных по минерализации озерах изменялась незначительно (35–48% общей биомассы). В олигогалинных озерах преобладали собиратели-детритофаги (48%), субдоминировали размельчители (25%) (рис. 1г). В суб- и гипогалинных озерах соотношение собирателей-детритофагов и хищников было фактически одинаковым. Биомасса размельчителей незначительно колебалась в олиго- и субгалинных озерах (25–30%), с увеличением минерализации их доля снижалась до 2% общей биомассы зообентоса. Соскребатели присутствовали только в олигогалинных озерах.
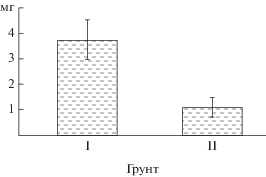
Индивидуальная масса организмов. С трофической структурой сообществ тесно связаны средние размерные характеристики, входящих в них организмов. Известно, что минерализация вод оказывает существенное влияние не только на разнообразие, но и на рост и развитие гидробионтов (Хлебович, 1974). Анализ влияния фактора минерализации вод на размерные характеристики макрозообентоса озер (общей выборки по всем озерам, а также группированной по типам грунтов) не позволил установить статистически значимых зависимостей (низкая достоверность аппроксимации полученных функций R2 <0.3 и коэффициент корреляции Спирмена r <0.5 при уровне достоверности p >0.5). При этом средняя индивидуальная масса бентосных организмов на различных типах грунта достоверно различалась: на илах она была значительно больше, чем на песках (рис. 2). Таким образом, размерные характеристики макробеспозвоночных бентоса в основном определяются типом грунта, а не минерализацией вод.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В исследованных озерах, в соответствии с классификацией Яковлева (2005), представлены все трофические группы, за исключением группы грунтозаглатывателей, в которую в основном входят представители различных семейств класса Oligochaeta. Характерная черта озер юга Обь-Иртышского междуречья – низкое разнообразие олигохет (Bezmaternykh, Zhukova, 2013). По-видимому, это связано с негативным воздействием на олигохет повышенной минерализации вод, отмеченным для других озер и озерных систем (Экология…, 1986; Wolfram et al., 1999). Для трофической структуры донных макробеспозвоночных изученных озер характерно доминирование по видовому составу группы собирателей-детритофагов и субдоминирование хищников. Преобладание группы собирателей-детритофагов в зообентосе выявлено рядом исследователей для озер (Батурина и др., 2014; Курашов, 1994; Яковлев, 2000, 2005) и рек (Зинченко и др., 2010). Максимальный вклад в общую биомассу на илистых грунтах вносят собиратели-детритофаги, на песчаных – собиратели-детритофаги и хищники, что характерно для небольших озер ≤0.5 км2 (Яковлев, 2005).
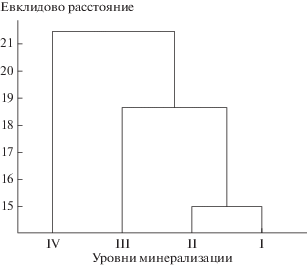
Проведенный кластерный анализ показал, что наибольшее сходство трофической структуры сообществ макробеспозвоночных отмечено между пресноводными олиго- и субгалинными озерами, ниже – с гипогалинными озерами, а наименьшее – с наиболее солеными мезо- и гипергалинными озерами (рис. 3). Ранее отмечено значительное сходство фаун озер различного уровня минерализации, связанное с тем, что большинство обитающих в них видов относится к экологически пластичным эврибионтам (Specziar, Biro, 1998).
Рис. 3.
Результаты кластерного анализа трофического спектра видового состава макробеспозвоночных озер разного уровня минерализации (по всем типам грунтов). Обозначения, см. в табл. 1.
В изученных пресных и солоноватых озерах большая часть видов приходилась на долю собирателей-детритофагов, в основном представленных комарами-звонцами. Основную массу хищников составили пиявки, стрекозы и клопы, большая часть размельчителей относилась к моллюскам и ручейникам, группу соскребателей, в основном, образовывали ручейники и жуки. С увеличением минерализации вод снижалось количество таксонов и менялся состав трофических групп. Среди соскребателей-детритофагов преобладали хирономиды, хищников представляли стрекозы и клопы, большая часть размельчителей приходилась на брюхоногих моллюсков, группа соскребателей отсутствовала. При минерализации >25 г/л все трофические группы представляли только беспозвоночныe из отряда двукрылых. Ранее отмечено отсутствие в макрозообентосе мезо- и гипергалинных озер Обь-Иртышского междуречья каких-либо таксонов, кроме двукрылых (Жукова, Безматерных, 2013). Хотя имеются сведения (Rawson, Moore, 1944) об отдельных представителях семейств жесткокрылых и клопов, имеющих широкий диапазон обитания при солености ≤118 г/л. Большинство видов семейств жесткокрылых Hydraenidae, Dytiscidae и Hydrophilidae обитают в диапазоне солености до ≤100 г/л; Corixidae: типичные представители солоноватых и соленых вод, отмечены при солености 3.5–134 г/л (Barahona et al., 2005).
Показано (Беляков, Скворцов, 1994; Вдовина, Безматерных, 2015), что количественное развитие и состав донных беспозвоночных в конкретных биотопах озер зависят в первую очередь от локальных условий, главным образом от грунта. В исследованных озерах независимо от минерализации вод и на илистых, и на песчаных грунтах максимальный вклад в биомассу вносили собиратели-детритофаги. Никитенко (2014) также отмечено доминирование этой группы на биотопах ила и песка. Остальные трофические группы при увеличении минерализации вод на различных грунтах представлены по-разному. На илах доля видов размельчителей и биомасса снижались, на песках количество видов возрастало. Группа соскребателей присутствовала только в олигогалинных озерах. Видовое разнообразие хищников увеличивалось при повышении солености воды на илистых и на песчаных грунтах по сравнению с другими группами, их доля в биомассе сообществ была меньше на песчаных грунтах, чем на илистых. Сходная тенденция отмечена Яковлевым (2005) в пресноводных озерах северной Фенноскандии. Увеличение роли хищников при возрастании минерализации вод связано с гидрологическими и гидрохимическими характеристиками исследованных озер. Большинство исследованных озер с высоким уровнем минерализации бессточные. Возрастание доли хищников в таких озерах связано со скудностью высшей водной растительности в результате высыхания литорали, а также с уменьшением нагрузки со стороны бентосоядных рыб (Яковлев, 2005).
В озерах Обь-Иртышского междуречья, в отличие от эстуариев (Удалов и др., 2004), с понижением солености воды не наблюдается уменьшения среднего размера (средней индивидуальной массы) макробеспозвоночных. Это, по-видимому, обусловлено присутствием эвригалинных видов и отсутствием в изученных озерах истинных галофилов – видов, которые могут реагировать на опреснение уменьшением индивидуальной массы особей, поскольку для них это неблагоприятные условия, негативно влияющие на водно-солевой обмен (Хлебович, 1974).
Выводы. В исследованных озерах различного уровня минерализации выявлены четыре основные трофические группы донных макробеспозвоночных, по видовому составу доминировала группа собирателей-детритофагов, субдоминировала группа хищников. Олиго- и субгалинные озера наиболее близки по трофическому спектру макробеспозвоночных относительно других озер, а мезо- и гипергалинные озера – наиболее отличаются от прочих. На илистых грунтах при повышении минерализации вод постепенно снижалась доля собирателей-детритофагов и увеличивалась доля хищников. На песчаных грунтах доля хищников в видовом составе была ниже, чем на илистых. По биомассе на илистых грунтах озер всех уровней минерализации доминировали собиратели-детритофаги, доля хищников в биомассе сообществ донных макробеспозвоночных последовательно уменьшалась от олигогалинных до мезо-гипергалинных озер. На песчаных грунтах максимальная доля хищников в биомассе отмечена в субгалинных и гипогалинных озерах, где они доминировали наравне с собирателями-детритофагами. Средняя индивидуальная биомасса макробеспозвоночных в изученных озерах в основном определялась не минерализацией вод, а типом грунта.
Список литературы
Батурина М.А., Лоскутова О.А., Щанов В.М. 2014. Структура и распределение зообентоса озер Харбейской системы // J. Sib. Fed. Univ., Biol. V. 7. P. 332.
Беляков В.П., Скворцов В.В. 1994. Макро- и мейобентос, их продукция // Особенности структуры экосистем озер Крайнего Севера (на примере озер Большеземельской тундры). Санкт-Петербург: Наука.
Благовидова Л.А. 1973. Влияние факторов среды на зообентос озер юга Западной Сибири // Гидробиол. ж. Т. 9. № 1. С. 55.
Вдовина О.Н., Безматерных Д.М. 2015. Фауна водных макробеспозвоночных озер юга Обь-Иртышского междуречья // Известия Алтайского отделения Русского географического общества. № 3. С. 46.
Водоемы Алтайского края. 1999. Новосибирск: Наука.
Гусаков В.А. 2007. Мейобентос Рыбинского водохранилища. Москва: Товарищество научных изданий КМК.
Долматова Л.А., Котовщиков А.В. 2013. Оценка экологического состояния озер Новосибирской области по химическому составу воды и пигментным характеристикам фитопланктона // Вода: химия и экология. № 7. С. 28.
Емельянова Л.В. 1994. Гаммариды литорали днепровских водохранилищ. Киев: Наукова думка.
Жукова О.Н., Безматерных Д.М. 2013. Минерализация как фактор формирования зообентоса озер юга Обь-Иртышского междуречья // Тр. Зоол. ин-та РАН. Прил. № 3. С. 120.
Зинченко Т.Д., Головатюк Л.В., Выхристюк Л.А., Шитиков В.К. 2010. Разнообразие и структура сообществ макрозообентоса высокоминерализованной р. Хара (Приэльтонье) // Поволжский экологический журнал. № 1. С. 14.
Кириллов В.В., Безматерных Д.М., Зарубина Е.Ю. и др. 2008. Состав и структура экосистем степных озер Алтайского края в 2008 г. // Наука – Алтайскому краю. Барнаул: Изд-во Азбука. Вып. 2. С. 237.
Кириллов В.В., Зарубина Е.Ю., Безматерных Д.М. и др. 2009. Сравнительный анализ экосистем разнотипных озер Касмалинской и Кулундинской долин древнего стока // Наука – Алтайскому краю. Барнаул: Изд-во Азбука. Вып. 3. С. 311.
Кириллов В.В., Зарубина Е.Ю., Котовщиков А.В. и др. 2010. Состав и структура водных экосистем бассейна реки Бурлы в 2010 году // Наука – Алтайскому краю. Барнаул: Изд-во Алтайский дом печати. Вып. 4. С. 239.
Курашов Е.А. 1994. Мейобентос как компонент озерной системы. Санкт-Петербург: Алга-фонд.
Монаков А.В. 1998. Питание пресноводных беспозвоночных. Москва: Институт проблем экологии и эволюции РАН.
Никитенко Е.В. 2014. Макрозообентос водоемов долины Восточного Маныча: Автореф. дис. … канд. биол. наук. Борок.
Опыт комплексного изучения и использования Карасукских озер. 1982. Новосибирск: Наука.
Поползин А.Г. 1967. Озера Обь-Иртышского бассейна (Зональная комплексная характеристика). Новосибирск: Зап.-Сиб. кн. изд-во.
Прокин А.А. 2008. Водные жесткокрылые (Coleoptera) малых рек Европейской части России: разнообразие, биоценотическая и индикационная роль // Экосистемы малых рек: биоразнообразие, экология, охрана: Лекции и матер. докл. Всерос. шк.-конф. Борок, 18–21 ноября. Ярославль. С. 38.
Руководство по гидробиологическому мониторингу пресноводных экосистем. 1992. Санкт-Петербург: Гидрометеоиздат.
Савченко Н.В. 1997. Озера южных равнин Западной Сибири. Новосибирск: Изд-во СО РАН.
Удалов А.А., Бурковский И.В., Мокиевский В.О. и др. 2004. Изменение основных характеристик микро-, мейо- и макробентоса по градиенту солености в эстуарии Белого моря // Океанология. Т. 44. № 4. С. 549.
Хлебович В.В. 1974. Критическая соленость биологических процессов. Ленинград: Наука.
Цихон-Луканина Е.А. 1987. Трофология водных моллюсков. Москва: Наука.
Экология озера Чаны. 1986. Новосибирск: Наука.
Электронный учебник по статистике. 2012. http://www.statsoft.ru/home/textbook/default.htm
Яковлев В.А. 2000. Трофическая структура зообентоса – показатель состояния водных экосистем и качества воды // Водные ресурсы. Т. 27. № 2. С. 237.
Яковлев В.А. 2005. Пресноводный зообентос северной Фенноскандии (разнообразие, структура и антропогенная динамика). Апатиты: Изд-во Кольск. науч. центра РАН. Ч. 2.
Barahona J., Millon A., Velasco J. 2005. Population dynamics, growth and production of Sigara selecta (Fieber, 1848) (Hemiptera, Corixidae) in a Mediterranean hypersaline stream // Freshwater Biol. V. 50. P. 2101.
Bezmaternykh D.M., Zhukova O.N. 2013. Composition, structure and factors of formation of communities of benthic invertebrates in lakes of the South of the Ob-Irtysh interfluve // Russ. J. Ecol. V. 44. № 2. P. 170. https://doi.org/10.1134/S1067413613020057
Cooper R.N., Wissel B. 2012. Interactive effects of chemical and biological controls on food-web composition in saline prairie lakes // Aquat. Biosyst. V. 8. № 29. P. 1. https://doi.org/10.1186/2046-9063-8-29
Cummins K.W. 1973. Trophic relation in aquatic insects // Ann. Rev. Entomol. V. 8. P. 183.
Hädicke C., Rebet D., Kment P. 2017. The diversity of feeding habits recorded for water boatmen (Heteroptera: Corixoidea) world-wide with implications for evaluating information on the diet of aquatic insects // Eur. J. Entomol. V. 114. P. 147. https://doi.org/10.14411/eje.2017.020
Hammer U.T. 1986. Saline Lake Ecosystems of the World. Dordrecht: Dr. W. Junk Publishers.
Kipriyanova L.M., Yermolaeva N.I., Bezmaternykh D.M. et al. 2007. Changes in the biota of Chany Lake along a salinity gradient // Hydrobiologia. V. 576. № 1. P. 83. https://doi.org/10.1007/s10750-006-0295-9
Merritt R.W., Cummins K.W., Berg M.B. 2008. An introduction to the aquatic insects of North America. Dubuque: Kendall Hunt Publishing.
Merritt R.W., Cummins K.W., Berg M.B. 2017. Trophic Relationships of Macroinvertebrates // Methods in Stream Ecology. V. 1. Ecosystem Structure. Cambridge: Academic Press. P. 413.
Rawson D.S., Moore J.E. 1944. The saline lakes of Saskatchewan // Can. J. Res. D. V. 22. P. 141.
Silina A.E., Prokin A.A. 2008. The trophic structure of macrozoobentos in march waterbodies of the forest-steppe zone in the Middle Russian Hills // Inland Water Biology. V. 1. № 3. P. 231. https://doi.org/10.1134/S199508290803006
Specziar A., Biro P. 1998. Spatial distribution and short-term changes of benthic macrofauna in Lake Balaton (Hungary) // Hydrobiologia. V. 389. P. 203.
Timm H., Mols T. 2005. Macrozoobenthos of Lake Verevi // Hydrobiologia. V. 547. P. 185. https://doi.org/10.1007/s10750-005-4159-5
Vdovina O.N., Bezmaternykh D.M. 2016. Peculiarities of Macrozoobenthos in Lakes of Different Mineralization of the Southern Section of the Ob-Irtysh Interfluve // Hydrobiological J. V. 52. №. 3. P. 65.https://doi.org/10.1615/HydrobJ.v52.i3.60
Williams W.D. 1998. Salinity as a determinant of the structure of biological communities in salt lakes // Hydrobiologia. V. 381. P. 191.
Wolfram G., Donabaum K., Schagerl M., Kowarc V. 1999. The zoobenthic community of shallow salt pans in Austria – preliminary results on phenology and the impact of salinity on benthic invertebrates // Hydrobiologia. V. 408/409. P. 193.
Дополнительные материалы отсутствуют.
Инструменты
Биология внутренних вод