Биология внутренних вод, 2020, № 1, стр. 3-16
Мшанки (Bryozoa) Каспийского моря
В. И. Гонтарь *
Зоологический институт РАН
Санкт-Петербург, Россия
* E-mail: gontarvi@gmail.com
Поступила в редакцию 24.04.2017
После доработки 18.09.2018
Принята к публикации 27.11.2018
Аннотация
В Каспийском море распространены пять видов мшанок класса Gymnolaemata и единственный вид Plumatella emarginata класса Phylactolaemata. Гимнолематные мшанки представлены отрядами Ctenostomatida (Amathia caspia, Paludicella articulata, Victorella pavida) и Cheilostomatida (Conopeum grimmi и Lapidosella ostroumovi). Два вида (Conopeum grimmi и Amatia caspia) – каспийские эндемики. Lapidosella ostroumovi впервые отмечена в Каспийском море. Даны систематическое положение, иллюстрированное морфологическое описание и экология выявленных видов.
ВВЕДЕНИЕ
Каспийские солоновато-водные мшанки уникальны. В их фауне полностью отсутствуют виды из наиболее многочисленного и распространенного в Мировом океане инфраотр. Ascophora отр. Cheilostomatida.
Первые достоверные сведения о каспийских мшанках даны в работе Ковалевского (1870), Гримм (1874) исследовал Бакинский залив и южную часть Каспийского моря. Согласно последней сводке (Абрикосов, 1969), в которой использованы иллюстрации (Prenant, Bobin, 1966), из четырех видов мшанок, обитающих в солоноватых водах Каспия, к вселенцам голоценового времени провизорно отнесены Bowerbankia imbricata auct. и B. gracilis auct. (вероятно, принадлежат к современной Amathia caspia), а V. pavida auct. объявлена автохтоном. Род Victorella солоновато-водный, по мнению Абрикосова (1959б), ведущий свою историю из водоемов третичного времени. Эти сведения скорее иллюстрируют недостаточную изученность каспийских мшанок, чем интенсивность инвазии. В настоящее время отсутствуют полные описания видов мшанок Каспийского моря с иллюстрациями, которые отражали бы современные данные о его фауне.
Цель работы – инвентаризация фауны мшанок Каспийского моря с использованием современных методов исследований и современной номенклатуры.
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
Работа выполнена на основе анализа литературных данных и материалов, собранных преимущественно в Северном Каспии (>2.5 тыс. проб) в 1981–1988 гг. (Тарасов, 1998, 1999) и 533 проб Г.М. Пятаковой за 1960–1974 гг. из Среднего и Южного Каспия. Изучены коллекции по каспийским мшанкам Зоологического института РАН (г. Санкт-Петербург), Т.Г. Тарасова (Центр экологии ТЭК, г. Москва) и Н.Ш. Шамионовой (Институт зоологии НАНА, г. Баку).
Препараты мшанок исследовали в световом и сканирующем электронном микроскопе Зоологического института РАН. Даны оригинальные иллюстрации всех встреченных видов. Для исследования морфологии колонии и аутозооидов образец обрабатывали жавелевой водой – раствором солей калия хлорноватистой и соляной кислот (KOCl + KCl). Затем материал отмывали водой и сушили на воздухе. После предварительного напыления платиной (слой толщиной 30 нм) фрагмент колонии изучали с помощью электронного микроскопа FEI Quanta 250 (Балашов, Леонович, 1984). Типовой материал хранится в Зоологическом институте РАН (г. Санкт-Петербург).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Согласно нашим исследованиям и литературным данным (Абрикосов, Зевина, 1968; Гонтарь и др., 2009; Kasaei et al., 2017), Каспийское море населяют солоновато-водные виды отр. Cheilos-tomatida (Conopeum grimmi Gontar et Tarasov и впервые обнаруженная в 2016 г. Lapidosella ostroumovi Gontar) и отр. Ctenostomatida (Amatia caspia (Abrikosov), широко распространенная Victorella pavida S. Kent и пресноводная Paludicella articulata (Ehrenberg)). В Северном Каспии встречается пресноводная мшанка Plumatella emarginata Allman. Далее дано систематическое положение, морфологическое описание, распространение и экология обнаруженных видов.
Класс Gymnolaemata Allman, 1856
Отряд Ctenostomatida Busk, 1952
Семейство Paludicellidae Allman, 1885.
Род Paludicella Gervais, 1836.
Paludicella articulata (Ehrenberg, 1810) (рис. 1)
Рис. 1.
Paludicella articulata: a, в – различная форма колоний, б – форма аутозооидов, г – щупальца и перегородка, отделяющая дочерний аутозооид от материнского.

Абрикосов, 1959б: 698.
Диагноз. Колонии коричневатые или желтовато-коричневатые, сильно ветвятся, размером до 10 см. Частично прикреплены к субстрату, частично образуют вертикальные или повисающие ветви. Аутозооиды очень тонкие, прозрачные, размером 250–450 мкм. Цистид у аутозооида веретеновидной формы, орифиций – четырехугольной формы. Трубчатые аутозооиды могут быть ползущими или прямостоячими, отделены друг от друга внутренними перегородками. Зооиды могут ответвляться друг от друга под косым или почти прямым углом (рис. 1б). Столоны отсутствуют. Кутикула аутозооидов хитинизированная. Цистид иногда несет известковые частички. Эпистом отсутствует. Щупальца расположены в виде кольца, их количество варьирует от 10 до 23. Новый аутозооид развивается от материнского аутозооида почкованием и отделяется от него неполной поперечной перегородкой (рис. 1г). Каждый аутозооид может давать боковые почки на противоположных сторонах, располагающиеся почти под прямым углом к основной оси. Вид образует хитиновые hibernacula коричневатого цвета и неправильной формы, когда колония погибает, они остаются.
Распространение. В исследуемом бассейне найдена в р. Волге и Северном Каспии в обрастаниях судов (Абрикосов, 1959б).
Экология. По данным Абрикосова (1959б), в Северном Каспии P. articulata отмечена в чистой воде на глубинах <20 м (чаще в проточной и турбулентной), на камнях и древесных остатках. Колония растет в местах, где отсутствует ил. Пресноводные виды способны выдерживать соленость ≤5‰.
Семейство Victorellidae Hincks, 1880
Род Victorella S. Kent, 1870
Victorella pavida S. Kent, 1870 (рис. 2)
Farella repens Ковалевский, 1870; Prenant et Bobin, 1966; Laguncula repens Гримм, 1875, 1876: 118, table IV, fig. 5–5b; Державин, 1951; Абрикосов, 1959б: 695–698 (рис. 1).
Диагноз. Колонии желтоватые или белые, образуют цепочки мелких изящных аутозооидов, связанных ползущими трубочками, похожими на “столоны”. Присутствие этих “столонов”, ползущих по субстрату, – характерная черта V. pavida. У молодых мшанок морфология колонии очень простая, однако, по мере развития колонии аутозооиды удлиняются и почкуют новые “столоны” и аутозооиды, образуя мощную сеть. Первоначально аутозооиды удлиненной цилиндрической формы, слегка сжатые, достигают ~0.15 × 0.60 мм; у старых колоний они 2–3 мм. Лофофор кольцевой, диаметром 0.37 мм, несет 8 щупалец (рис. 2в). Зооиды размером 2–3 мм, имеют различную функцию внутри колонии. Чем взрослее колония, тем более мощной становится сеть образующих ее аутозооидов. У V. pavida эмбрионы развиваются перед выведением в целоме.
Сравнение и общие замечания. Вид широко представлен в Каспии. Колонии V. pavida напоминают мшанок из рода Amathia.
Распространение. Происхождение и время сбора материала из Каспия в литературе точно не указаны. Вероятно, обнаружена на западе Северного или Среднего Каспия от авандельты Волги до границы Дагестана и Азербайджана (Абрикосов, 1959б) после 1932 г. В 2016 г. найдена у берегов Ирана (Kasaеi et al., 2017). Вид занесен в Красную Книгу Великобритании (www.marlin.ac.uk/species/detail/1302).
Экология. Колонии Victorella pavida живут на разнообразных субстратах. Встречаются на камнях, в гаванях на сваях и на других твердых поверхностях (включая раковины), а также на морских водорослях, морских травах или тростниках. Отмечена на мелководье глубиной ≤2 м, часто в эстуариях, шлюзах и других водных объектах с небольшими глубинами. Хотя считают (Hayward, 1985), что это солоновато-водный вид, V. pavida выживает в очень широком диапазоне солености (1–27‰). Предложено (Hayward, 1985) ее использование в качестве индикатора границы между пресноводными условиями и нижней границей солоноватых вод в прибрежных зонах, где встречаются различные водные массы. Вид толерантен к загрязненным и мутным водам.
Семейство Vesiculariidae Hincks, 1880
Род Amathia Lamouroux, 1812
Amathia caspia (Abrikosov, 1959б) (рис. 3, 4).
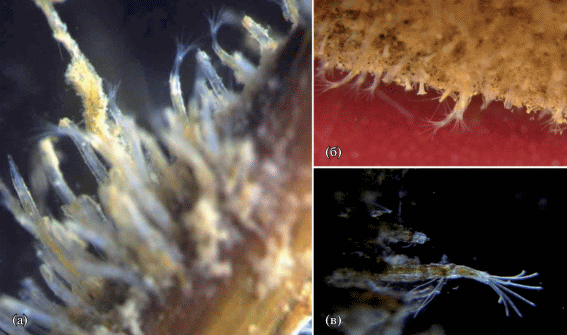
Рис. 3.
Amathia caspia: а – колония на балянусах; б – A. caspia при бóльшем увеличении (×14), фото Н.Ш. Шамионовой; в – колонии A. caspia и Conopeum grimmi, г – A. caspia под бинокуляром (×20).
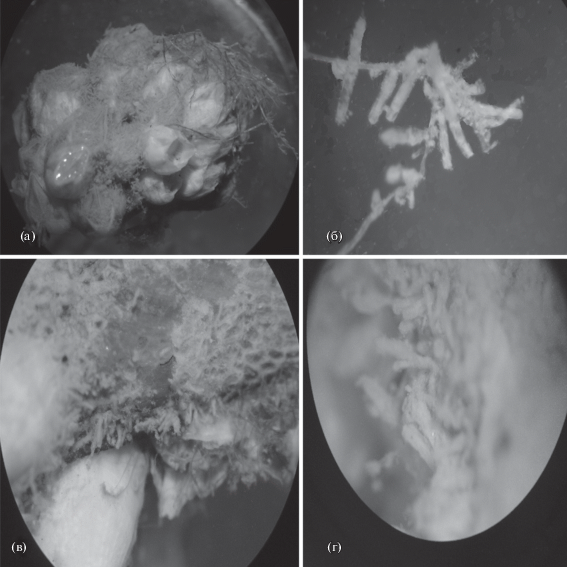
Рис. 4.
Amathia caspia при бóльшем увеличении (×70). (фото Н.Ш. Шамионовой): а – аутозооид со втянутыми щупальцами, б – верхняя часть цистида, видны мышцы-ретракторы (показано стрелкой), в – четырехугольное отверстие цистида, г – новообразование на столоне (показано стрелкой).
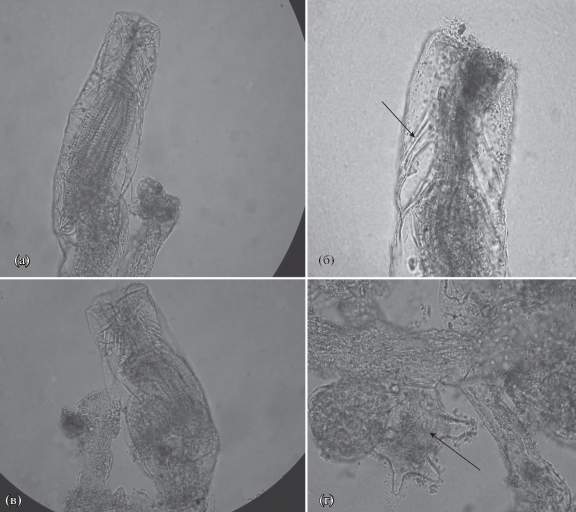
Рис. 5.
Соnореum grimmi: a – колония Conopeum reticulum; б – часть колонии Conopeum seurati, в – Stichoporina sp.

Bowerbankia densa Гримм, 1876: 117b, table IV, рис. 4; table VI, fig. 17; Bowerbankia imbricata caspia Абрикосов, 1959б: 698; B. imbricata Prenant et Bobin, 1966; Абрикосов, Зевина, 1969: 392 non fig. 375; B. caudata Остроумов, 1905; Зевина, 1957; Зевина, 1959; B. gracilis Абрикосов, Зевина, 1968: 393, non fig. 376.
Диагноз. Зоарий в виде стелющихся и свободно растущих столонов, покрытых обычно на некотором расстоянии друг от друга группами аутозооидов (рис. 3a). Столон ветвистый, разделенный поперечными стенками на интернодии различной длины (рис. 3б). Зооиды отходят непосредственно от довольно толстого столона и не связаны друг с другом (рис. 3б). Зооиды прозрачные, цилиндрические, <1.00 мм, сидят обычно попарно группами перед диафрагмой, иногда одиночно (рис. 3б). Отверстие на дистальном конце аутозооида (цистида) четырехугольное (рис. 4). Жевательный желудок сплошь выстлан высокими ороговевшими на дистальном конце клетками. Размер конусовидных “зубов” по Гримму в длину ~0.018 мм, их основание имеет неправильное четырехугольное очертание и в диаметре 0.006–0.008 мм. “Зубы” полые, их основание вдавлено внутрь куполом (Абрикосов, 1959а).
Сравнение и общие замечания. A. caspia отличается от A. imbricata меньшими размерами зооидов – ≤1.0 и 1.2–1.5 мм соответственно. Форма отдельных зооидов A. caspia более яйцевидная, чем у A. imbricata. Число щупалец 10 характерное и постоянное для вида (Абрикосов, 1959б).
Распространение и экология. Найдена в мезо- и олигогалинных водах соленостью от ~13 до ~3‰ (на глубинах до 15 м (Зевина, 1957)). В Северном Каспии зарегистрирован при солености <8‰ и на глубинах >10 м. Встречен в г. Энзели (Иран) в полупресноводном бассейне глубиной ≤3 м, наполненном пресноводными формами (Гримм, 1876), в заливе Кызыл-Агач (Юго-Западный Каспий), в Бакинском заливе (Cредний Каспий) на глубинах до 1.3 м; массовые поселения отмечены в прибрежье о. Кулалы (Северный Каспий) на стеблях тростника; у о-ва Огурчинский (Южный Каспий). В Южном и Среднем Каспии встречалась в обрастаниях камыша, тростника, плавсредств и гидротехнических сооружений (Гримм, 1876; Зевина, 1957). В 2014 г. найдена у побережья Апшеронского п-ва возле пос. Мардакяны (рис. 4в), в 2015 г. – у пос. Бильгя и пос. Шувелян в единичных экземплярах (Шамионова, личное сообщение), в 2016 г. – в прибрежных водах Ирана (Kasaei et al., 2017).
Отряд Cheilostomatida Busk, 1852
Семейство Electridae d’Orbigny, 1851
Род Conopeum Gray, 1848.
В Каспийском море встречается единственный вид этого рода. Изучение колоний с использованием электронной микроскопии и сравнение с другими видами рода Conopeum дало основание для описания нового вида Conopeum grimmi.
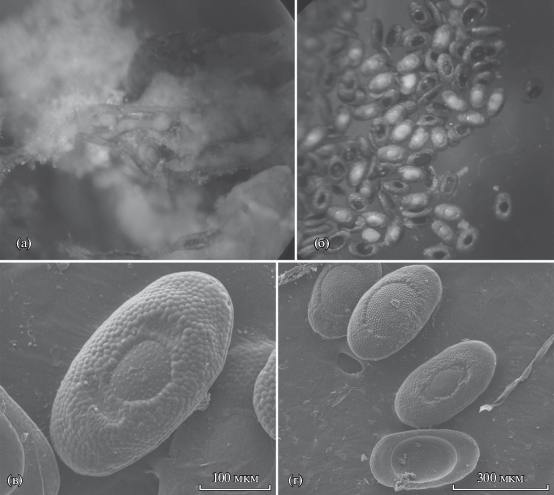
Сопореит grimmi Gontar et Tarasov, 2009 (рис. 5–7).
Рис. 6.
Conopeum grimmi: а – часть колонии (×40); б – расположение аутозооидов в колонии – общие латеральные стенки отсутствуют, латеральные стенки соседних аутозооидов не соприкасаются (×283); в – соединение дистального и проксимального аутозооидов (×400); г – криптоциста (в апертуре) (×2000).
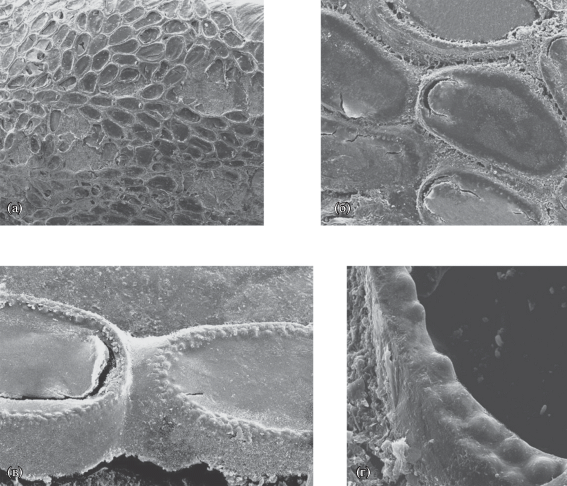
Рис. 7.
Conopeum grimmi и начальная стадия формирования колоний у других видов рода Conopeum: а – абортивный зооид с криптоцистой, аутозооиды в соседних рядах расположены в противоположных направлениях (×260), б – абортивные зооиды (по Jebram, Voigt, 1977), в – C. grimmi (×40), г – C. tenuissimum (стрелками обозначены особь анцеструлы и две отпочковавшиеся особи), д – C. seurati.
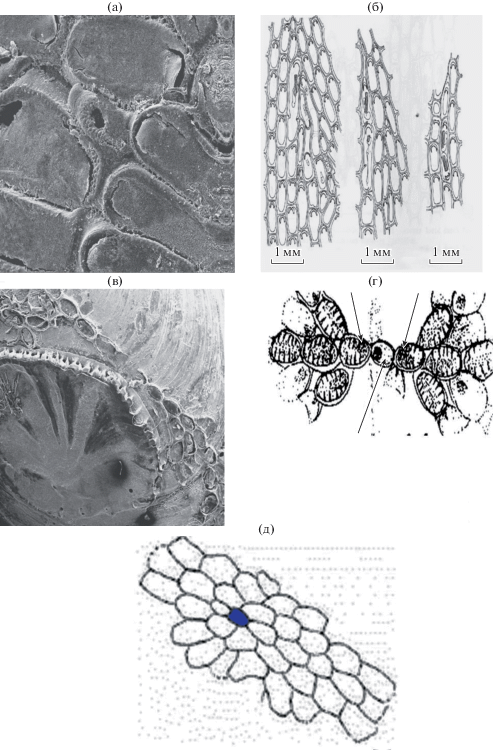
Membranipora crustulenta Абрикосов, 1959а: 1754–1755; 1959б: 694–701; Electra crustulenta Зевина, 1959: 80; Сопореит seurati Зевина и Кузнецова, 1965 (part.) non fig. 1; Абрикосов, Зевина, 1968: 390 (part.) non fig. 374; Stichoporina? Гримм, 1876: 120.
Диагноз. Зоарий белого цвета. Колония состоит из многих аутозооидов, расположенных довольно часто косыми рядами, расходящимися от первой начальной цепочки аутозооидов (рис. 5a, 6а). Такое расположение аутозооидов определяется дистолатеральным почкованием аутозооидов. Колония может использовать “бегущую стратегию” (running strategy), вследствие чего часто наблюдаeтся неупорядоченное расположение зооидов. Аутозооиды в начальной цепочке зооидов, от которой расходятся косые или радиальные ряды аутозооидов, и впоследствии в онтогенезе часто имеют сильно хитинизированную фронтальную мембрану. Аутозооиды прилежат друг другу неплотно (рис. 6б) и имеют лишь общую дистально-проксимальную стенку (рис. 6в). Между аутозооидами иногда наблюдаются абортивные зооиды (рис. 7а, 7б). Аутозооиды средней величины (длина 0.45–0.65 мм, ширина 0.2–0.25 мм), удлиненно овальной или неправильной удлиненной формы с закругленными дистальными углами. Латеральные стенки сильно обызвествлены. Базальная стенка видна через прозрачную фронтальную мембрану и представлена базальной мембраной. Обызвествленная гимноциста слабо выражена и слегка утолщена, окружает апертуру ровной каймой и расширяется у проксимального края аутозооида. Апертура занимает почти всю фронтальную поверхность, покрыта фронтальной слегка выпуклой прозрачной мембраной, сквозь которую хорошо виден втянутый полипид. Криптоциста имеет вид очень узкой каймы, так что опезия по размерам лишь немного отличается от апертуры. Криптоциста образует невысокий валик, покрытый бугорками почти полусферической формы (рис. 6г).
Оперкулюм необызвествленный, прозрачный, с закругленным дистальным краем, натянутым на склерит и прямым проксимальным краем, шириной 80–110 мкм (рис. 6а), впоследствии у некоторых аутозооидов имеет по своему дистальному краю волокнистую хитинизированную мембрану. Отдельные аутозооиды в колониях, расположенных в складках домиков балянусов, вооружены слегка изогнутыми длинными тонкими боковыми шипами (до трех пар). В проксимальной части шипы не отмечены, в дистальной – парные, расположены почти перпендикулярно фронтальной поверхности аутозооида (рис. 5a). В отличие от других видов рода Conopeum, у C. grimmi почкование происходит от дистального и проксимального концов анцеструлы (рис. 7в). Хотя анцеструла разрушена, однако, видно, что почкование идет в двух противоположных направлениях.
Морфологические замечания. В Северном Каспии колонии нередко многослойные. На раковинах митилястра Mytilaster lineatus они дендровидной формы, а на листьях Zostera sp. – линейной. От близкого вида C. seurati (Canu) отличается размерами аутозооидов и анцеструлы. Анцеструла у C. seurati 340 мкм в длину и 300 мкм в ширину, имеет пару шипов, у C. grimmi 140 мкм в длину, шипы отсутствуют. Размеры аутозооидов у C. seurati в длину 360–650 мкм и в ширину 215–370 мкм, у C. grimmi длина 450–650 мкм, ширина 200–250 мкм. Также отличается формой и строением оперкулюма. Строение криптоцисты C. grimmi в виде округлых выростов, у C. seurati – в виде зазубрин, которые заходят в опезию и могут меняться от простых фестонов до очень острых шипиков, расположенных иногда в несколько рядов в некоторых плоскостях.
Гимноциста C. seurati может иметь разное число крупных выростов, не отмеченных у C. grimmi. Присутствуют различия и в характере роста зоария, который у C. grimmi может начинаться с почкования в проксимальной и дистальной части анцеструлы, которое затем происходит по радиусам и далее достаточно нерегулярно. У С. grimmi отсутствуют треугольные площадки между зооидами и дистальные выросты у зооидов, характерные для C. reticulum. У С. grimmi, если шипы имеются, то лишь немного отклоняются от вертикального положения к поверхности апертуры аутозооида; у большинства аутозооидов шипы отсутствуют, у С. reticulum маленькие заостренные шипы в различном количестве иногда присутствуют. Они расположены регулярно вокруг апертуры и иногда наклонены в виде арки над фронтальной мембраной.
Чтобы подтвердить самостоятельность описанного нами из Каспийского моря вида Conopeum grimmi, проведено исследование митохондриальной 18S ДНК, как наиболее консервативной и мало изменяющейся. Последовательность нуклеотидов в митохондриальной 18S ДНК у C. grimmi также значительно отличается от C. reticulum и C. seurati, с которым его неверно идентифицировали (Гонтарь и др., 2009).
Распространение и биотопическая приуроченность. В 1874 г. С. grimmi встречался по всей акватории Среднего и Южного Каспия преимущественно на моллюсках Theodoxus gr. pallasi и Dreissena caspia Eichwald, 1855 (глубины ≤80 м), реже на створках Cerastoderma (Гримм, 1876). Находки на гидротехнических сооружениях, навигационных буях и корпусах плавсредств в 1958–1961 гг. также были ограничены средней и южной каспийской сублиторалью (Зевина, Кузнецова, 1965). В Северном Каспии вид чаще отмечен на створках моллюска Mytilaster lineatus (Gmelin) Mytilaster lineatus (Gmelin) и листьях живой Zostera sp. В Южном Каспии зарегистрирован в районе Сальянского рейда на глубине 17 м, грунт – ил с ракушей. В 2014 г. найден у побережья Апшеронского п-ва возле пос. Мардакяны (Шамионова, личное сообщение).
В Северном Каспии при солености <5.5‰ не отмечен. В водах с соленостью 5.5–8.5‰ частота встречаемости была ~3%, и только при солености 8.5–13.1‰ она увеличивалась до 18–24%. На глубинах >20 м число колоний резко уменьшается. В Красноводском заливе с соленостью >13‰ встречен в обрастаниях судов (Абрикосов, 1959а). Исходя их вышеизложенного, верхний предел соленостной резистентности С. grimmi, вероятно, ≤15‰.
Насролахи (Kasaei et al., 2017) указывает, что вид собран в 2016 г. вдоль всего Иранского прибрежья Каспийского моря, соленость на всех станциях была ~10‰.
Стратиграфическое распространение. В некроценозах Туркменского залива части колоний С. grimmi отмечены на истлевших листьях Zostera sp. Части базальных и латеральных стенок отдельных зооидов найдены в складках верхних частей раковин Didacna sp. из хвалынского разреза в районе пос. Светлый Яр (Волгоградская обл.). Поскольку распространение Didacna trigonoides (Pallas, 1771) ограничено соленостью 5‰, можно констатировать, что до 1988 г. в Каспии обитал лишь автохтонный вид рода Сопореит.
Lapidosella ostroumovi Gontar, 2010 (рис. 8).
Рис. 8.
Lapidosella ostroumovi: a – (×70), б – общий вид колоний, в – слой колонии нарастает на другой слой (×5.5), г – край колонии с формирующимися латеральными и поперечными стенками, д – часть колонии (×220), е – широкие аутозооиды на краю колонии, ж – открытые оперкулюмы (крышечки), з – шипик на внутреннем опезиальном проксимальном крае криптоцисты.

Membranipora reticulum Остроумов, 1892: 8–11, 18; Зевина, 1967: 32–34; Lapidosella ostroumovi Гонтарь, 2010: 274–282.
Диагноз. Зоарий белого цвета, достигающий в длину и ширину нескольких сантиметров, вначале обрастающий, затем двухслойный и свободно растущий, обызвествленный и твердый (рис. 8а, 8б). Колония может образовывать многочисленные фестоны в разных плоскостях и направлениях. Состоит из многих аутозооидов, расположенных рядами и часто в шахматном порядке (рис. 8в).
Расположение аутозооидов определяется их дистальным почкованием. Каждый аутозооид может отпочковывать дистально один или два дочерних аутозооида. Если образуются два дочерних аутозооида, то появляются дополнительные ряды аутозооидов в колонии. Одна и та же колония способна формировать второй слой аутозооидов, разрастаясь по базальной поверхности уже сформированной колонии (рис. 8в). Таким образом, формируется двухслойная веерообразная колония, часто напоминающая не полностью раскрытый веер. Затем лопасти могут сближаться друг с другом под разными углами, напоминая кружевные воланы. Край двуслойной колонии с одной стороны формируется крупными неправильной формы аутозооидами (рис. 8е), способными соединять оба слоя колонии. Поскольку базальные стенки аутозооидов почти прозрачные, сквозь них просвечивает противоположный слой аутозооидов в колонии, которые могут быть ориентированы различным образом.
На дистальном крае колонии располагается несколько рядов формирующихся новых аутозооидов (рис. 8д). Вначале появляются латеральные стенки, между которыми можно наблюдать разные стадии формирования дистально-проксимальной стенки. Образование дистально-латеральной стенки начинается в виде небольших выростов с двух сторон от латеральных стенок, которые затем соединяются. Появление дополнительной латеральной стенки между двумя латеральными стенками при формировании двух дочерних аутозооидов начинается от края колонии, а не от дистально-проксимальной стенки еще не полностью сформированного материнского аутозооида. Таким образом, образуются новые два зооида. После формирования вертикальных стенок аутозооида появляются криптоцисты от проксимального края аутозооида под его фронтальной мембраной. Криптоциста зрелого аутозооида окружает опезию очень узкой полоской и заметно расширена в проксимальной части.
Аутозооиды в онтогенезе имеют прозрачную фронтальную мембрану. Аутозооиды плотно прилегают друг к другу и имеют латеральные и общую дистально-проксимальную стенки (рис. 8г).
Аутозооиды средней величины (длина 0.35–0.57 мм (средняя 0.43 мм)), ширина 0.22–0.39 мм (средняя 0.33 мм)), отношение длины к ширине 1.35–1.6, редко 2.5), удлиненно-овальной или неправильной удлиненной формы, иногда слегка расширенные в средней части, с закругленными дистальными углами и несколько вогнутым проксимальным краем (рис. 8ж). У колоний из Иранского прибрежья размеры аутозооидов 0.43–0.66 мм в длину, 0.17–0.37 мм в ширину. Латеральные стенки более обызвествленные, у молодых аутозооидов они полупрозрачные (рис. 8г). Базальная стенка слабо обызвествленная, выпуклая, видна через прозрачную фронтальную мембрану. Апертура овальная и занимает почти всю фронтальную поверхность, покрыта слегка выпуклой фронтальной прозрачной мембраной, сквозь которую хорошо виден втянутый полипид. Криптоциста в виде очень узкой каймы, так что опезия по размерам лишь немного отличается от апертуры. Криптоциста образует плоскость (полку), покрытую бугорками почти полусферической формы, и слегка расширяется у проксимального края, формируя овальную опезию. На проксимальном крае криптоциста образует на своей плоскости несколько (2–3) рядов округлых бугорков (рис. 8з). В центре на внутреннем опезиальном проксимальном крае криптоцисты находится небольшой прозрачный шипик, вдающийся в опезию (рис. 8з). Этот шипик хорошо виден у сформированных аутозооидов, но по краю колонии у вновь образующихся аутозооидов может отсутствовать. У очень широких аутозооидов на боковом крае колонии (или отпочковывающихся от них двух дочерних аутозооидов) таких шипиков может быть два или три, причем один или два расположены на внутренних опезиальных латеральных краях криптоцисты. Некоторые очень широкие аутозооиды с двумя оперкулюмами. В каждой боковой стенке аутозооида находятся две округлые поровые пластинки, в дистальной стенке – одна или две (у зооида, отпочковывающего два дистальных дочерних зооида) округлые многопоровые пластинки. В проксимальной части у некоторых аутозооидов наблюдаются бурые тела.
Оперкулюм необызвествленный, прозрачный, с закругленным дистальным краем и прямым проксимальным краем, натянутый по дистальному краю на прозрачный или тонкий коричневый склерит, шириной в среднем 150 мкм. Овицеллы и авикулярии отсутствуют.
Сравнение и замечания. Колонии разного размера и формы. От Conopeum seurati (Canu) отличается размерами аутозооидов, флюстроподобной формой колонии, отсутствием гимноцисты. Анцеструла у Lapidosella ostroumovi меньше обычных аутозооидов и может быть с двумя шипами. У L. ostroumovi оперкулюм не хитинизирован, прозрачный, иногда с узким коричневатым краем, отличается формой и строением от оперкулюма Conopeum seurati, который имеет плоскость оперкулюма, окаймленную не простым краевым склеритом, а сложным, широким и гибким перепончатым образованием, которое занимает всю свою свободную окружность (Bobin, 1962). Натянутая на две тонкие арки и отмеченная многочисленными волокнами эта мембрана бесцветна в молодости у C. seurati, и затем коричневая, хитинизированная. Криптоциста Lapidosella ostroumovi в виде узкой плоскости с округлыми бугорками, у Conopeum seurati – в виде зазубрин. Криптоциста у Lapidosella ostroumovi несет один или несколько выдающихся в пространство опезии шипиков, расположенных на внутреннем опезиальном крае криптоцисты. Как правило, у большинства аутозооидов L. ostroumovi шипы отсутствуют. У C. grimmi отдельные аутозооиды в колониях, расположенные в складках домиков балянусов, вооружены слегка изогнутыми длинными тонкими боковыми шипами (до трех пар). В проксимальной части шипы не отмечены, в дистальной – парные, расположены почти перпендикулярно фронтальной поверхности аутозооида. У С. reticulum маленькие заостренные шипы в различном количестве иногда присутствуют, у C. seurati имеется пара дистальных шипов. L. ostroumovi отличается от всех упомянутых других видов способом почкования аутозооидов.
Распространение. Азовское море (Гонтарь, 2010). В Каспийском море впервые обнаружен в 2016 г. в прибрежных водах Ирана (Kasaei et al., 2017).
Класс Phylactolaemata Allman, 1856
Отряд Plumatellida Pennak, 1953
Семейство Plumatellidae Allman, 1856
Род Plumatella Lamarck, 1816
Plumatella emarginata (Allman, 1844) (рис. 9, 10)
Рис. 9.
Plumatella emarginata: а – колония, б – аутозооиды, cтрелкой указан дорзальный киль (margin) (фото M. Waaij), в – сессобласт (фото Th. Wood, B. Okamura), г – флотобласт (фото Л.В. Яныгиной).

Абрикосов, 1959б: 698.
Диагноз. Колонии очень разнообразные по форме: часто ветвящиеся (рис. 9a), иногда полностью покрывающие субстрат, компактные или шаровидные. Колонии могут быть почти целиком обрастающими, т.е. ползущими по субстрату. Размер одного аутозооида достигает 2 мм. Серый пигмент часто появляется даже на стенке тела молодых зооидов. Полипид с подковообразным лофофором, несущим два ряда щупалец. Ротовое отверстие прикрыто эпистомом. Цистид часто имеет киль и инкрустирован мелкими песчинками. Цистиды частично прикреплены, их контрастная прозрачная область окружает верхушку зооида и сужается на фронтальной поверхности на конце цистида, формируя V-образный “вырез”. Данный признак особенно выражен у этого вида, хотя может присутствовать не так явно и у других видов. V-образный вырез может отсутствовать или быть трудно различимым. Зооиды часто имеют дорзальный (фронтальный) киль (рис. 9б) – это линия сращения (на противоположной от субстрата стороне), которая начинается от кончика V-образного выреза. Киль обычно отсутствует у свободно растущих ветвей. Аутозооиды отделены внутри септами, которые перпендикулярны линии роста ветви. Щупальцевая корона в форме подковы и состоит из 30–60 щупалец.
Все эти признаки могут так или иначе отсутствовать, и тогда определение возможно только при изучении статобластов. Отношение длины флотобластов к их ширине (L/B) равно 1.65 (рис. 9г, рис. 10). Боковые края их более или менее параллельные. Плавательное кольцо серебристое, с мелкой пузыревидной структурой, сильно заходит на капсулу и значительно простирается за пределы капсулы. Статобласты часто уплощены на концах (полюсах) так, что очертания их почти квадратные. На дорзальной стороне флотобласта в центре есть небольшое круглое окно (fenestra). Вентральная fenestra гладкая, а дорзальная – бугорчатая. Капсула покрывает annulus (кольцо) больше с дорзальной стороны, чем с вентральной. Дорзальная створка почти плоская, вентральная – очень выпуклая. Вентральная створка немного больше дорзальной, ее края заходят за края дорзальной створки так, что шов виден с дорзальной стороны. Annulus имеет одинаковую ширину. Сессобласты (рис. 9в) прикрепляются к субстрату, они широкоовальные по форме, жесткие, с рудиментарным плавательным кольцом, латеральные стенки и фронтальная створка бугорчатые, но не сетчатые. У аутозооида бывает большое число статобластов.
Распространение. По данным Абрикосова (1959а), в Каспии, особенно в его северной части, встречаются, главным образом, два пресноводных вида – Paludicella articulata и Plumatella emarginata. Наиболее широко распространенная в северной части моря P. emarginata проникает довольно далеко в море и часто поселяется на моллюсках (Vivipara и Dreissena). Обитает в чистых (особенно проточных) водах, избегает областей с оседающим илом.
Выводы. По мнению Абрикосова (1959а), “фауна мшанок как Каспия, так и Арала изучена еще крайне недостаточно”. Это послужило основанием для описания им нескольких новых видов и подвидов мшанок из отр. Ctenostomatida (Абрикосов, 1959б). В Каспийском море живут солоновато-водные виды: эндемики Conopeum grimmi (отр. Cheilostomatida) и Amathia caspia (отр. Ctenostomatida) и более широко распространенный вид Victorella pavida (отр. Ctenostomatida). Cолоновато-водный род Victorella ведет свою историю из водоемов третичного времени. По мнению Абрикосова (1959а), он должен рассматриваться в Каспийском и Аральском морях, как типично автохтонный, исторически связанный с третичными водоемами. Вид Victorella pavida имеет понто-каспийский ареал. В Северном Каспии встречаются также пресноводные мшанки Paludicella articulata (Ehrenb.) и Plumatella emarginata Allm. В Южном Каспии впервые обнаружен азовский солоновато-водный вид Lapidosella ostroumovi Gontar. В Северном Каспии имеются пресноводная, переходная пресноводно-солоновато-водная и солоновато-водная зоны. Распространение пресноводных и солоновато-водных видов мшанок соответствуют этим зонам. Представитель рода Amathia, согласно утверждению Абрикосова (1959а), должен рассматриваться как морской вселенец с запада, претерпевший существенные изменения вследствие экологических условий, и этот факт увеличивает число морских вселенцев в Каспийское море.
Список литературы
Абрикосов Г.Г. 1959а. Новый вселенец в Каспийское море // Зоол. журн. Т. 38. № 11. С. 1754.
Абрикосов Г.Г. 1959б. Мшанки Каспийского и Аральского морей // Зоол. журн. Т. 38. № 5. С. 694–701.
Абрикосов Г.Г., Зевина Г.Б. 1968. Тип Мшанки Bryozoa // Атлас беспозвоночных Каспийского моря. М.: Пищ. пром-сть. С. 386–395.
Балашов Ю.С., Леонович С.А. 1984. Методы применения растровой электронной микроскопии в зоологии. Л.: Наука. 70 с.
Гримм О.А. 1874. Предварительное сообщение о результатах исследования фауны Каспийского моря, произведенного по поручению Петербургского общества естествоиспытателе // Труды Санкт-Петербургского общества естествоиспытателей. СПб., Т. 5. Вып. 2. С. 113.
Гримм О.А. 1876. Каспийское море и его фауна // Труды Арало-Каспийской экспедиции. СПб. Т. 1. Вып. 2. Тетрадь 1. 186 с.
Гонтарь В.И. 2010. Азовский представитель рода Lapidosella gen. nov. (Cheilostomatida, Anasca) новый вид Lapidosella ostroumovi Gontar и его экология // Мир науки, культуры и образования. № 5(24). С. 274.
Гонтарь В.И., Тарасов А.Г., Шамионова Н.Ш. 2009. Морфологическая изменчивость, географическое распространение и экология Conopeum grimmi (Cheilostomatida, Anasca) Gontar et Tarasov // Мир науки, культуры и образования. № 7. С. 57.
Зевина Г.Б. 1957. К вопросу обрастания судов Каспийского моря // Тр. Всес. гидробиол. общ-ва. Т. 3. С. 305.
Зевина Г.Б. 1959. Новые организмы в Каспийском море // Природа. № 7. С. 79.
Зевина Г.Б., Кузнецова Н.А. 1965. Роль судоходства в изменении фауны Каспийского моря // Океанология. Т. 5. № 5. С. 518.
Ковалевский А.О. 1870. Заметка о поездке на Каспийское море // Зап. Киев. общ-ва естествоиспыт. Т. 1.
Audouin J.V. 1826. Explication sommaire des planches de polypes de l’Egypte et de la Syrie, publiees par Jules-Cesar Savigny. Description de l’Egypte, ou recueil des observations et des recherches qui ont été faites en Egypte pendant l’expédition de l’armée francaise … Histoire naturelle, T. 1, 4, partie: 339. (Imprimerie Impériale, Paris).
Blainville H.M.D. 1834. Manuel d’Actinologie ou de Zoophytologie. Paris: Levrauly.
Bobin G. 1962. Les Espéces Francais du Genre CONOPEUM Gray (Briozoirés, Chilostomes) // Cahiers de Biologia Marine. T. 3. № 4. P. 275.
Busk G. 1854. Catalogue of marine Polyzoa in the collection of the British Museum, II. Cheilostomatida (part). L.: Trustees of the British Museum (Natural History). P. 55.
Cook P. 1962. The early larval development of Membranipora seurati (Canu) and Electra crustulenta (Pallas), Polyzoa // Cahiers de Biol. Marine. T. 3. № 1. P. 57.
Gray J.E. 1848. List of the specimens of British animals in the collections of the British Museum. Part 1. Centrionae or radiated animals L.: Trustees of the British Museum. V. 173. P. 91.
Jebram D. Voigt, 1977. Monsterzooide and Doppelpolypide bei fossilen and rezenten Cheilostomatida Anasca (Bryozoa) // Abh. Verh. Naturwiss. Ver. Hamburg. № 20. P. 151.
Kasaei S.M., Nasrolahi A., Behrooz A., Taylor P.D. 2017. Bryozoa of the southern Caspian Sea, Iranian coast // Check List. № 13(4). P. 305.
Pallas P.S. 1771. Reise durch verschiedene Provinzen des Rußischen Reichs. Erster Theil. St. Petersburg (Kayserliche Academie der Wissenschaften).
Prenant M., Bobin G. 1966. Bryozoaires, deuxieme partie. Chilostomes Anasca // Faune de France. V. 68. P. 398.
Дополнительные материалы отсутствуют.
Инструменты
Биология внутренних вод