Биология внутренних вод, 2020, № 1, стр. 67-75
Сельдь-черноспинка Alosa kessleri kessleri (Grimm, 1887) из р. Ахтубы Нижневолжского бассейна: биологические и морфологические особенности
К. В. Кузищин a, b, *, М. А. Груздева a, В. А. Филенко a, Д. С. Павлов a, b
a Московский государственный университет им. М.В. Ломоносова
Москва, Россия
b Институт проблем экологии и эволюции РАН им. А.Н. Северцова
Москва, Россия
* E-mail: KK_office@mail.ru
Поступила в редакцию 19.07.2019
После доработки 18.08.2019
Принята к публикации 28.08.2019
Аннотация
Приведены данные по динамике анадромной миграции, возрастному составу, длине, массе тела и морфометрической характеристике сельди-черноспинки из р. Ахтубы. Установлено, что в настоящее время сельдь-черноспинка из бассейна р. Ахтубы мономорфна, какие-либо темпоральные группировки не выявлены. Она представлена некрупными младшевозрастными раносозревающими (в 2–3 г.) рыбами не старше 5 лет. По важнейшим диагностическим признакам, прежде всего по числу жаберных тычинок, и некоторым пластическим признакам сельдь-черноспинка из р. Ахтубы, в целом, соответствует типичным для формы рядам изменчивости.
ВВЕДЕНИЕ
Проходные волго-каспийские сельди рода Alosa в прошлом имели высокую численность, широко использовали Волжский бассейн для размножения, поднимаясь на нерест вверх до рек Камы и Оки, играя весьма важную роль в промысле (Берг, 1948; Казанчеев, 1981; Световидов, 1952). Однако, начиная с 1958 г., когда была введена в строй Волгоградская ГЭС, произошли масштабные изменения экосистемы всего Волжского бассейна. Проходные сельди потеряли бóльшую часть районов своего воспроизводства, претерпели катастрофическое падение численности, сократилось разнообразие их внутривидовых форм. В конце ХХ–начале XXI в. отмечен некоторый рост численности только одной из форм проходных сельдей – сельди-черноспинка Alosa kessleri kessleri (Grimm, 1887), и она даже стала объектом небольшого промысла в дельтовых участках р. Волги (Водовская, 1998, 2001; Ким, 2012; Пятикопова, 2019). В то же время степень изученности черноспинки на современном этапе недостаточна, данные по особенностям биологии и морфологии требуют уточнения.
Имеющаяся литература по сельди-черноспинке Нижневолжского бассейна посвящена преимущественно группировке вида из дельты и русла р. Волги, где в настоящее время осуществляется ее промысел и мониторинг (Васильева и др., 2012; Водовская, 1998, 2001; Войнова, 2012, 2016; Пятикопова, 2019; Фомичев, Тарадина, 2006). Однако в работах ХХ–ХХI вв. отсутствуют данные по сельди-черноспинке из р. Ахтуба, хотя она относится к важным составным элементам сложной по строению Волго-Ахтубинской системы и имеет рыбохозяйственное значение (Зволинский и др., 2015; Николаев, 1962).
Цель работы – изучить особенности анадромной миграции производителей, размерный, возрастной и половой состав и морфологические признаки сельди-черноспинки р. Ахтубы на современном этапе.
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
Материал собирали в мае–июле 2014–2018 гг. в реках Ахтуба и Волга на территории Харабалинского р-на Астраханской обл. Место сбора удалено вверх по течению от верхней границы дельты Волги на 150 км, от плотины Волгоградской ГЭС – на 300 км. На исследованном участке реки Волга и Ахтуба протекают параллельными руслами, ширина поймы между ними 2–4 км. Ширина Ахтубы (в межень) варьирует от 190 до 420 (в среднем 313) м, глубина на плесах 10–11 м, в русловых ямах ≤22 м. Стрежень русла сильно меандрирует, на плесах с одного берега образуется высокий обрывистый “яр” с резким свалом глубины до 8–11 м, противоположный берег пологий с плавным нарастанием глубины до русловой бровки на глубине 6–8 м. Исследованные участки р. Ахтубы по своему строению не отличаются от таковых выше и ниже по течению (Николаев, 1962). В 2014–2018 гг. проводили ежегодные наблюдения за ходом производителей и поведением рыб после нереста; данные по размерному, половому, возрастному составу и морфологии получены на основе сборов 2018 г.
Для определения уровня воды использовали неподвижную шкалу-ординар, закрепленную на береговых укреплениях-габионах, температуру воды определяли 1 раз в час с помощью автоматических электронных записывающих датчиков Vemco Minilog T8K 8bit DataLogger.
Производителей черноспинки отлавливали во время их анадромной миграции (с конца апреля по конец июня), использовали удебные снасти-“самодуры” с шестью крючками и резиновым амортизатором, облавливали все горизонты от придонного (6–8 м) до приповерхностного. Интенсивность хода производителей оценивали по уловам шести операторов (шесть снастей, по одной снасти на человека, в соответствии с Правилами спортивного и любительского рыболовства по Астраханской обл.), проводивших отлов стационарно в течение всего периода работы. Снасть-“самодур” обладает низкой селективностью (с одинаковым успехом ловятся рыбы длиной тела от 12–15 до 50 см), тем самым соотношение рыб с разной длиной тела в улове адекватно отражает их соотношение среди мигрирующих стай. Значения интенсивности хода оценивали по показателю “величина улова на единицу усилия”, выраженную как кг/ч при усилии шести снастей по шесть крючков (всего 36 крючков).
Использовали несмещенные выборки, когда анализировали весь улов при наполнении контрольной емкости объемом 15 л. Всего для исследования взяты две выборки: одна собрана 18–21 мая 2018 г. (пик хода производителей), другая – 2–6 июня 2018 г. (конец хода). Выборки изучали отдельно и в дальнейшем проводили их сравнительный анализ для выявления фенетического разнообразия в течение периода хода на нерест. Объем использованного материала по разным видам анализа представлен в соответствующих таблицах и на рисунках.
У всех пойманных рыб измеряли длину и массу тела, для определения возраста брали пробу чешуи под спинным плавником, при вскрытии визуально определяли пол рыбы и стадию зрелости гонад (Правдин, 1966). Для изучения морфологических особенностей проводили классический инструментный (ручной) морфометрический анализ по 25 пластическим и 6 меристическим признакам (Берг, 1948; Правдин, 1966; Световидов, 1952). Во избежание системной ошибки (Решетников, Попова, 2015; Решетников, Терещенко, 2017) все промеры рыб выполнены в стандартных условиях одним оператором.
Возраст сельди определяли по чешуе в соответствии с методикой Чугуновой (1959) с учетом рекомендаций Yilmaz и Polat (2002) по электронным изображениям оттисков (image-cаpture system, микроскоп Leica DMLS с набором объективов кратностью от ×2.5 до ×10, цифровая камера Canon X500-D) на акрилацетатных пластинках.
Материал обрабатывали стандартными методами унивариантного статистического анализа.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Анадромная миграция производителей. Ход черноспинки по р. Ахтубе в точке сбора материала начинался 9–12 мая при прогреве воды >12°С. Пик хода приходился на третью декаду мая, в последних числах мая интенсивность хода сельди резко падала до завершения 10–12 июня (рис. 1). Несмотря на порой существенные колебания среднесуточной температуры воды, вызванные сильными дождями и короткими похолоданиями, интенсивность хода сельди заметно не менялась (рис. 1).
Рис. 1.
Зависимость интенсивности миграции сельди по р. Ахтубе в районе работ от температуры и уровня воды в 2018 г.: 1 – среднесуточная температура воды, °C, 2 – уровень воды, 3 – интенсивность хода производителей черноспинки.
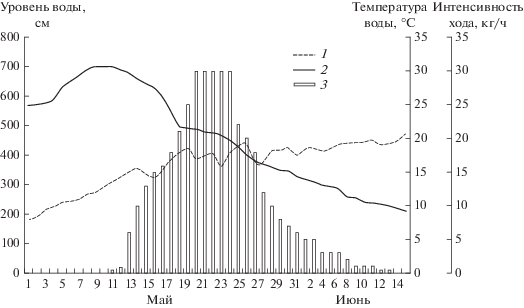
Миграция сельди проходит на глубине 1–3 м вдоль крутых берегов реки на удалении 3–8 м от уреза воды, широкие и мелководные участки с корытообразным профилем ложа русла стаи сельди пересекают по середине реки. Даже во время массового хода стая сельди никогда не выдает себя всплесками, что отличается от данных Световидова (1952). Движение сельди в темное время суток не зарегистрировано, ночью крупные стаи ходовой сельди распадаются на мелкие скопления, приуроченные к небольшим суводям с водоворотными течениями, которые образуются на выдающихся в реку мысах у высоких подмытых берегов-яров. Формирование крупных стай сельди и их движение вверх по течению начинается с рассветом, что соответствует данным работ прежних лет (Павлов, 1979).
В начале и конце хода сельдь идет отдельными, порой малочисленными стаями, интервал между ними может достигать несколько сотен метров. Во время пика хода сельдь мигрирует сплошной массой и интервала между стаями почти нет. В подавляющем большинстве случаев, в стаях сельди отсутствуют другие виды рыб, но иногда, особенно в маловодные годы, вместе с сельдью вверх по течению мигрирует чехонь Pelecus cultratus (L., 1758). В 2014 и 2015 гг. отмечены случаи, когда численность двигающейся вверх чехони была сопоставима с численностью сельди, но чехонь двигалась в приповерхностных слоях воды, а сельдь – на глубине ~3 м.
В обследованном районе, как в русле р. Ахтубы на участке от дер. Бугор до пос. Харабали (~40 км), так и в русле р. Волги от дер. Копановка до о. Капитанский (~50 км) нерест сельди не выявлен – ни разу не обнаружено массовых плотных скоплений у поверхности в русловых участках рек Волги и Ахтубы, в речных затонах и протоках, не зарегистрировано в вечерние часы выпрыгивающих из воды и плещущихся у поверхности производителей, что характерно для нерестящейся волжской проходной сельди (Берг, 1948; Световидов, 1952).
Скат отнерестившихся производителей. Отнерестившаяся сельдь появляется в реках Ахтуба и Волга в районе сбора материала 21–25 июня, наибольшей интенсивности скат живых и сплывание умирающих и погибших рыб наблюдается в первую неделю июля. К 12–15 июля скат заканчивается. Мертвую и умирающую сельдь заносит течением в затоны или небольшие бухты, где она может скапливаться в больших количествах. Так, например, в небольшом затоне р. Волги у о. Чуб на площади 200 × 100 м у поверхности в 2018 г. скопилось >3 тыс. погибших сельдей. Во время ската отнерестившихся рыб ими активно питаются хищники, в первую очередь, судак Sander lucioperca (L., 1758) и сом Silurus glanis (L., 1758). В последнюю неделю июня – первую неделю июля погибающая сельдь служит основой питания судака, ее частота встречаемости в желудках судака длиной тела >35 см – 100% (2014–2018 гг., n = 830). Особи судака длиной тела 50–55 см могут заглотить пять-шесть сельдей длиной тела ~30 см (n = 112). Для мелких сомов массой тела ≤20 кг в конце июня частота встречаемости сельди в желудках достигает ~100% (n = 78), для крупных особей массой тела >50 кг частота ее встречаемости не превышает 40% (n = 44). В то же время сельдь почти отсутствует в питании щуки Esox lucius (L., 1758) (n = 64), случаи питания ею жереха Aspius aspius (L., 1758) (n = 96) не зарегистрированы.
Описание. Тело удлиненное, без резкого сужения в хвостовой части тела, умеренно высокое (наибольшая высота 18–23% длины тела по Смитту (Lsm)). Тело слегка сжато с боков в передней части и вальковатое в хвостовом отделе. Голова большая, 20–26 (в среднем 22.8)% Lsm, межглазничное расстояние 19–27 (20.8)% длины головы (С); умеренно высокая – 13–19 (15.2)% Lsm или 65–75 (70.5)% С, горизонтальный диаметр глаза 17–22 (19.7)% С. Челюсти или равной длины (у 43% рыб), или нижняя челюсть выдается вперед (у 57% рыб); оба варианта встречаются как у мелких (<250 мм), так и у крупных особей. Грудные плавники короткие, 11–16 (12.9)% Lsm. Основания брюшных плавников у всех рыб расположены позади вертикали, проходящей через начало спинного плавника.
Число и форма жаберных тычинок подвержены значительной изменчивости. В объединенной выборке (n = 356) не обнаружено ни одной особи с обломанными, искривленными или зазубренными жаберными тычинками, на что указывалось разными авторами как характерная особенность черноспинки (Берг, 1948; Казанчеев, 1981; Световидов, 1952). Однако по длине жаберных тычинок и форме их наружного края можно выделить четыре морфы. У морфы I (5.8% рыб) жаберные тычинки длинные, по длине превышают жаберные лепестки, их наружный край образует выпуклую дугу; у морфы II (19.3% рыб) жаберные тычинки равны по длине жаберным лепесткам, а их наружный край слегка выпуклый и волнистый; у морфы III (44.3% рыб) жаберные тычинки равны по длине жаберным лепесткам, наружный край прямой; у морфы IV (30.6% рыб) жаберные тычинки по длине меньше, чем жаберные лепестки, их наружный край прямой. Разная форма жаберных тычинок встречается как у мелких, так и крупных особей, во время пика миграции и в ее конце. Несмотря на некоторые различия пределов варьирования числа жаберных тычинок и их длины, достоверных различий между группами по числу жаберных тычинок и длине тела нет (табл. 1).
Таблица 1.
Длина тела, количество жаберных тычинок у сельди-черноспинки разных групп и статистическая оценка различий между группами
| Признак | Группы рыб с разной длиной и формой жаберных тычинок | Оценка различий, Tst/M-U | |||||
|---|---|---|---|---|---|---|---|
| I n = 19 |
II n = 68 |
III n = 160 |
IV n = 109 |
I : II | I : III | I : IV | |
| Lsm, мм | $\frac{{258 \pm 13.3}}{{198--336}}$ | $\frac{{266 \pm 10.2}}{{202--367}}$ | $\frac{{282 \pm 8.2}}{{201--370}}$ | $\frac{{277 \pm 11.6}}{{199--365}}$ | $\frac{{0.47}}{--}$ | $\frac{{1.53}}{--}$ | $\frac{{1.07}}{--}$ |
| Sp. br | $\frac{{70.5 \pm 0.24}}{{64--86}}$ | $\frac{{70.3 \pm 0.21}}{{61--84}}$ | $\frac{{70.1 \pm 0.19}}{{59--82}}$ | $\frac{{70.0 \pm 0.20}}{{57--81}}$ | $\frac{{0.63}}{{0.8234}}$ | $\frac{{1.31}}{{0.6352}}$ | $\frac{{1.60}}{{0.4416}}$ |
Возрастной и половой состав. Во время пика хода возрастной состав самцов и самок, в целом, сходный – в объединенной выборке (n = 186) доминируют рыбы в возрасте 3 года (85.2%), второе место занимают рыбы в возрасте 4 года (8.4%), в небольшом количестве встречаются особи в возрасте 2 (5.2%) и 5 (3.2%) лет. В конце хода возрастной состав сельди-черноспинки менее вариабелен – в выборке (n = 170) обнаружены рыбы в возрасте 3 (97.5%) и 4 (2.5%) года. В пик хода незначительно преобладают самцы – их доля 52%, но в конце хода самок становится существенно больше – доля самцов падает до 24%. Во время пика хода почти все самки имели половые железы на четвертой стадии зрелости, выявлены особи, в каудальном отделе яичников которых были текучие ооциты. Сходная картина наблюдалась и у самцов – большая часть особей имела семенники на четвертой стадии зрелости, у 15.2% самцов в каудальном отделе семенников отмечены признаки пятой стадии зрелости. Несколько более сложная картина была в конце хода. В этот период 9.5% самок имели яичники на третьей-четвертой стадии зрелости, остальные самки – на четвертой-пятой, среди самцов преобладали рыбы с семенниками на четвертой-пятой стадии зрелости.
Длина и масса тела. Длина тела черноспинки в объединенной выборке (n = 356) варьирует от 198 до 370 (в среднем 264.9) мм, масса тела – от 92 до 489 (в среднем 146.6) г. Средние длина и масса тела самок в одновозрастных классах существенно превышали таковые самцов (табл. 2). На протяжении всего периода анадромной миграции сельди-черноспинки самцы были мельче самок, однако достоверные различия не установлены (самцы, возраст 3 года, пик хода: конец хода, Tst = 1.05, p < 0.95; самки, возраст 3 года, пик хода: конец хода, Tst = 1.38, p < 0.95; самцы, возраст 4 года, пик хода: конец хода, Tst = 1.29, p < 0.95).
Таблица 2.
Длина и масса тела сельди-черноспинки
| Возраст, лет | Пик хода | Конец хода | ||
|---|---|---|---|---|
| Самцы n = 100 |
Самки n = 89 |
Самцы n = 41 |
Самки n = 133 |
|
| 2 | $\frac{{206\left( {198--215} \right)\left[ 8 \right]}}{{96\left( {92--102} \right)}}$ | $\frac{{218\left( {195--230} \right)\left[ 5 \right]}}{{112\left( {93--141} \right)}}$ | – | – |
| 3 | $\frac{{249\left( {209--286} \right)\left[ {78} \right]}}{{127\left( {97--204} \right)}}$ | $\frac{{277\left( {205--343} \right)\left[ {69} \right]}}{{177\left( {96--310} \right)}}$ | $\frac{{239\left( {220--251} \right)\left[ {31} \right]}}{{105\left( {97--203} \right)}}$ | $\frac{{258\left( {234--285} \right)\left[ {99} \right]}}{{112\left( {92--206} \right)}}$ |
| 4 | $\frac{{284\left( {231--327} \right)\left[ {10} \right]}}{{205\left( {108--311} \right)}}$ | $\frac{{319\left( {269--365} \right)\left[ {11} \right]}}{{303\left( {185--472} \right)}}$ | $\frac{{279\left( {230--302} \right)\left[ {10} \right]}}{{181\left( {100--295} \right)}}$ | $\frac{{302\left( {276--325} \right)\left[ {34} \right]}}{{167\left( {145--189} \right)}}$ |
| 5 | $\frac{{316\left( {293--337} \right)\left[ 4 \right]}}{{309\left( {206--388} \right)}}$ | $\frac{{325\left( {312--370} \right)\left[ 4 \right]}}{{332\left( {293--489} \right)}}$ | – | – |
Морфометрическая характеристика. Анализ полового диморфизма по пластическим и меристическим признакам не выявил достоверных различий между самцами и самками ни по одному из 32 пластических и из 6 меристических признаков. Кроме того, достоверные различия не выявлены между выборками пика хода (n = 161) и конца хода (n = 112). Анализ распределений полученных значений в объединенной выборке показал, что для всех пластических и меристических признаков характерно нормальное распределение – показатели асимметрии (As) и эксцесса (Ex) ни в одном случае не достигают пороговых уровней (табл. 3). В связи с этим, приведены данные по объединенной (самцы и самки, пик и конец хода) выборке (табл. 3).
Таблица 3.
Морфометрическая характеристика сельди-черноспинки р. Ахтубы, объединенная выборка (n = 273)
| Признак | Показатель | ||||
|---|---|---|---|---|---|
| M ± m | SD | Lim | As | Ex | |
| Lsm | 262.7 ± 1.1 | 18.2 | 198–338 | 0.34 | 0.10 |
| Пластические признаки, % Lsm | |||||
| C | 23.83 ± 0.09 | 0.63 | 22.3–25.3 | 0.02 | 0.26 |
| ao | 6.36 ± 0.05 | 0.36 | 5.6–7.3 | 0.11 | 0.25 |
| o | 4.69 ± 0.05 | 0.37 | 3.9–5.5 | 0.27 | –0.58 |
| op | 12.98 ± 0.07 | 0.51 | 11.0–14.1 | –0.24 | 0.32 |
| io | 4.96 ± 0.04 | 0.33 | 4.4–6.4 | 0.25 | 0.71 |
| hcz | 16.77 ± 0.07 | 0.55 | 15.6–17.7 | –0.27 | –0.75 |
| hco | 12.65 ± 0.09 | 0.66 | 11.5–14.1 | 0.30 | –0.47 |
| lm | 11.93 ± 0.07 | 0.56 | 10.8–13.9 | 0.20 | 0.76 |
| hmx | 3.21 ± 0.04 | 0.27 | 2.5–3.7 | –0.16 | –0.36 |
| lmd | 14.65 ± 0.10 | 0.69 | 13.0–16.0 | 0.15 | –0.25 |
| H | 22.13 ± 0.15 | 1.09 | 20.3–24.8 | 0.13 | –0.13 |
| h | 6.75 ± 0.06 | 0.39 | 6.2–8.0 | 0.15 | 0.41 |
| pl | 14.25 ± 0.11 | 0.81 | 12.4–16.2 | 0.02 | 0.22 |
| lD | 12.58 ± 0.10 | 0.67 | 11.3–14.1 | 0.24 | –0.15 |
| hD | 10.92 ± 0.14 | 1.01 | 9.6–14.0 | 0.24 | 0.79 |
| lA | 15.24 ± 0.10 | 0.68 | 13.7–16.7 | 0.17 | –0.40 |
| hA | 6.86 ± 0.09 | 0.62 | 5.4–8.1 | 0.13 | –0.21 |
| lP | 14.27 ± 0.09 | 0.64 | 12.2–15.8 | –0.29 | 0.24 |
| lV | 8.85 ± 0.06 | 0.44 | 8.1–10.0 | 0.26 | 0.42 |
| aD | 44.75 ± 0.17 | 1.17 | 42.3–47.9 | 0.23 | 0.48 |
| pD | 41.34 ± 0.14 | 0.98 | 39.1–43.7 | 0.31 | –0.22 |
| aV | 47.13 ± 0.14 | 0.97 | 44.6–49.0 | –0.31 | –0.17 |
| aA | 67.66 ± 0.15 | 1.04 | 65.6–70.1 | 0.15 | 0.04 |
| P–V | 24.03 ± 0.12 | 0.89 | 22.0–25.8 | –0.27 | –0.49 |
| V–A | 21.39 ± 0.16 | 1.12 | 19.3–23.8 | 0.09 | –0.65 |
| Пластические признаки, % С | |||||
| ao/C | 26.62 ± 0.21 | 1.52 | 23.8–29.7 | 0.19 | –0.66 |
| o/C | 19.69 ± 0.20 | 1.40 | 16.7–22.2 | –0.09 | –0.72 |
| op/C | 54.47 ± 0.24 | 1.67 | 49.3–58.1 | –0.12 | 0.66 |
| io/C | 20.86 ± 0.22 | 1.51 | 18.8–24.3 | 0.19 | –0.71 |
| hcz/C | 70.41 ± 0.34 | 2.35 | 64.7–74.6 | –0.10 | –0.45 |
| lm/C | 50.06 ± 0.25 | 1.74 | 45.9–54.7 | –0.12 | 0.16 |
| lmd/C | 61.45 ± 0.29 | 1.75 | 55.8–65.6 | –0.16 | 0.24 |
| Меристические признаки | |||||
| D | 14.47 ± 0.06 | 0.78 | 12–16 | –0.07 | 0.48 |
| A | 18.54 ± 0.09 | 1.18 | 16–22 | 0.21 | –0.08 |
| P | 14.80 ± 0.07 | 0.95 | 11–17 | –0.14 | 0.72 |
| V | 7.76 ± 0.04 | 0.49 | 6–9 | –0.20 | 0.53 |
| sp. br | 70.20 ± 0.44 | 5.62 | 57–86 | 0.24 | –0.48 |
| vert. | 52.13 ± 0.10 | 1.01 | 50–54 | –0.11 | –0.22 |
Примечание. Lsm – длина тела по Смитту; С – длина головы, ao – длина рыла, o – горизонтальный диаметр глаза, op – заглазничное расстояние, io – межглазничное расстояние, hcz – высота головы на уровне затылка, hco – высота головы на уровне глазниц, lm – длина верхней челюсти, hmx – высота верхнечелюстной кости, lmd – длина нижней челюсти, H – наибольшая высота тела, h – высота хвостового стебля, pl – длина хвостового стебля, lD – длина основания спинного плавника, hD – высота спинного плавника, lA – длина основания анального плавника, hA – высота анального плавника, lP и lV – длина грудного и брюшного плавников, aD, pD, aV, aA, P–V и V–A – антедорсальное, постдорсальное, антевентральное, антеанальное, пектовентральное и вентроанальное расстояния; D, A, P и V число ветвистых лучей в спинном, анальном, грудном и брюшном плавниках, vert. – число позвонков. As и Ex – показатель асимметрии и эксцесса соответственно; Lim – пределы варьирования; SD – среднее квадратичное отклонение; M ± m – значение среднего и его ошибка. Остальные обозначения, как в табл. 1.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Полученные нами результаты относятся к отдельному участку Нижневолжского бассейна – р. Ахтуба, – который ранее не был исследован по проходным сельдям. Значение р. Ахтубы для воспроизводства сельди-черноспинки крайне редко упоминается в опубликованных работах, имеются отрывочные сведения, что в 60–80-е гг. ХХ в. в реке воспроизводилось ~12% локального стада (Водовская, 2001). Данные по морфологическим и биологическим особенностям ахтубинской сельди-черноспинки отсутствуют.
Результаты нашего исследования позволяют прийти к заключению, что в настоящее время сельдь-черноспинка из р. Ахтубы мономорфна, какие-либо темпоральные группировки не выявлены. По важнейшим диагностическим признакам – прежде всего, по числу жаберных тычинок и некоторым пластическим признакам – сельдь-черноспинка из р. Ахтуба в целом, соответствует типичным для формы рядам изменчивости.
В то же время, представляется важным проведение сравнительного анализа полученных нами результатов по черноспинке из р. Ахтубы с историческими данными. Такое сравнение мы проводим с осторожностью, так как они почти все относятся к районам дельты р. Волги (Берг, 1948; Водовская, 1974; Водовская, 2001; Казанчеев, 1965, 1981; Пятикопова, 2019; Световидов, 1952). Выявлены временные изменения по многим параметрам сельди-черноспинки (табл. 4). Так, существенно уменьшились длина и масса тела, увеличилась доля младшевозрастных рыб в нерестовом стаде. Особенно это заметно в период с 60-х до 70-х гг. ХХ в., когда из уловов пропали крупные старшевозрастные (7–8 лет) особи длиной тела >50 см и массой ≤2 кг. По-видимому, это было обусловлено резким сокращением путей анадромной миграции в р. Волге. Еще Световидов (1952) указывал, что до появления плотин наиболее крупные особи черноспинки шли дальше всех вверх по реке, поднимаясь до устья р. Ока.
Таблица 4.
Сравнительный анализ биологических и морфологических показателей сельди-черноспинки в разные годы
| Показатель | Исторический период, локализация мест и источники данных | ||
|---|---|---|---|
| До 1959 г., дельта и низовья р. Волги (Берг, 1948; Световидов, 1952) | 60–70-е гг. ХХ в., дельта и низовья р. Волги (Водовская, 1974, 1977, 2001; Казанчеев, 1965, 1981) | 2016–2018 гг., р. Ахтуба, в ~300 км от моря (данные авторов) | |
| Сроки анадромной миграции | Конец апреля–начало июля. В течение хода наблюдалось несколько пиков, обычно в середине мая и середине июня | 10–20 апреля–начало-середина июня (по некоторым источникам – до начала июля). Один пик –во второй половине мая | Первая декада мая–первая декада июня, пик хода ~9 сут (20–28 мая) |
| Длина тела, см Масса тела, г |
30–52 (40–42) 300–2000 (500–600) |
24–46 (33 см) 200–1000 (460) |
19–37 (26) 90–490 (146) |
| Возраст, лет | 3–7, в основном 4, 5 | 2–8, в основном 3, 4, 5 лет | 2–5, в основном 3 |
| Число жаберных тычинок | 59–92 (72.4) | 51–96 (74.6) | 52–86 (72.0) |
| Форма жаберных тычинок | У крупных рыб толстые и грубые, часть их обломана, некоторые искривленные, с боковыми шипиками. Жаберные тычинки короче лепестков, образуют прямую линию | У крупных рыб крепкие, толстые, редко посаженные, часто обломанные, у мелких рыб они тоньше и короче | Прямые, не искривлены и не обломаны, гладкие, чаще равны по длине жаберным лепесткам. Образуют прямую линию, реже выпуклую дугу. Размерной изменчивости не выявлено |
| Число позвонков | 47–50 (48.9) | 49–54 (51.8) | 50–54 (52.1) |
| С/Lsm | 22–25.0 (23.1) | 22–26 (23.2) | 20–26 (22.8) |
| lP/Lsm | 13.7–15.9 (14.9) | 13–16 (14.6) | 11–16 (12.9) |
| Н/Lsm | 20–28 (23.9) | 20–28 (23.8) | 18–23 (22.1) |
| io/С | 18–23 (20.3) | – | 19–27 (20.8) |
| hcz/Lsm | 15–18 (16.5) | 15–19 (17) | 13–19 (15.2) |
Примечание. Обозначения показателей в табл. 3. Даны пределы варьирования, в скобках – среднее значение.
Тенденция к уменьшению размеров и массы тела черноспинки продолжается и по настоящее время (Пятикопова, 2019). Наши данные подтверждают наблюдаемые другими исследователями тренды – в 2018 г. были обнаружены половозрелые самцы и самки в возрасте двух лет, не отмечавшиеся ранее, и не было поймано ни одной рыбы в возрасте старше пяти лет (табл. 4).
Изменения затронули форму и число жаберных тычинок (табл. 4). До 1959 г. и в 60–70-х гг. ХХ в. в выборках черноспинки часто присутствовали особи с короткими, обломанными и искривленными жаберными тычинками (Водовская, 1974). В нашей выборке 2018 г. из р. Ахтуба такие особи не обнаружены. После зарегулирования стока р. Волга в 70-х годах ХХ в. максимальное значение числа жаберных тычинок было >90 (Водовская, 1974; Казанчеев, 1981), а нашей выборке – 86 (2018 г.). Не исключено, что изменения в количестве и строении жаберных тычинок отражают изменения в характере ее питания. По мнению Водовской (1984, 2011), Казанчеева (1981), Световидова (1952), черноспинка – хищник и в море питается мелкой рыбой и ракообразными. Возможно, что питание рыбой могло приводить к деформации и облому жаберных тычинок. По данным Казанчеева (1981) и Световидова (1952), обломанные тычинки гораздо чаще встречались у крупных рыб, которые потребляли, в основном, рыбу. Возможно, отсутствие рыб с обломанными тычинками в настоящее время – следствие изменений в питании черноспинки в море, однако этот аспект фактически не освещен в современной литературе.
Другой признак, затронутый значительными изменениями, – количество позвонков. За более чем 60-летний период закономерно увеличилось количество позвонков, причем не только расширились пределы варьирования, но и произошел существенный сдвиг вариационных кривых. В настоящее время пределы варьирования признака – 50–54, тогда как в первой половине ХХ в. они были 47–50 (Берг, 1948; Световидов, 1952). Вероятно, такой существенный сдвиг признака вызван сменой условий воспроизводства – комплекс гидрогеоморфологических параметров Средней Волги, где сельдь-черноспинка размножалась до ввода в строй плотин Волгоградской и Саратовской ГЭС, значительно отличается от такового в Нижневолжском бассейне. Кроме того, выявлены изменения и по некоторым пластическим признакам, в частности, в настоящее время высота головы и высота тела черноспинки стали более низкими, чем ранее.
Очевидно, произошедшие сдвиги в биологии и морфологии сельди-черноспинки, а также катастрофическое падение ее численности, – следствие изменений условий существования проходных волжских сельдей из-за зарегулирования стока р. Волги. В результате зарегулирования стока произошла коренная перестройка в условиях размножения сельди-черноспинки и протекания ранней пресноводной фазы ее жизненного цикла. До зарегулирования реки плотинами в Северный Каспий из р. Волги скатывались сформированные мальки (Водовская, 1990, 1994, 1996; Павлов, 1979; Пятикопова, 2019), в настоящее время преобладают личинки. Эффективность естественного воспроизводства черноспинки в новых условиях ухудшилась в 10–11 раз (Водовская, 2001) поэтому, несмотря на некоторый рост численности черноспинки, условия ее естественного воспроизводства рассматриваются как неблагоприятные (Водовская, 2001; Войнова, 2012, 2013, 2016; Пятикопова, 2019). Фактически, популяция сельди-черноспинки в настоящее время находится в стрессовом состоянии и весьма уязвима для любых неблагоприятных внешних факторов, например, для низкого объема стока р. Волги (Водовская, 1996, 2001; Пятикопова, 2019). Высокая уязвимость сельди-черноспинки подтверждается фактом быстрого падения ее численности в начале 2000-х гг. в результате даже небольшого промысла, который срочно пришлось прекратить (Войнова, 2013; Лепилина и др., 2016).
Выводы. Параметры среды для существования сельди-черноспинки далеки от оптимальных, и процесс выработки локальных адаптаций для ее устойчивого выживания в современных измененных условиях еще продолжается. В связи с этим, есть основания рассматривать выявленные изменения по биологическим и морфологическим признакам как отражение активных микроэволюционных процессов, направленных на эффективную адаптацию формы/вида к новым изменившимся условиям экосистемы Нижневолжского бассейна. В то же время, полученные результаты предполагают дальнейшие исследования структуры и разнообразия группировки сельди-черноспинки из Нижневолжского бассейна. В частности, представляется важным расширенный дифференцированный анализ параметров структуры популяции черноспинки из рек Волги и Ахтубы, в том числе с привлечением методов молекулярно-генетического анализа.
Список литературы
Берг Л.С. 1948. Рыбы пресных вод СССР и сопредельных стран. Москва: Изд-во АН СССР. Т. 1.
Васильева Т.В., Власенко А.Д., Дегтярева Н.Г. 2012. История и современное состояние рыбохозяйственных исследований на Каспии // Вопросы рыболовства. Т. 13. № 4(52). С. 679.
Водовская В.В. 1974. Новые данные о внутривидовых формах каспийской проходной сельди (Alosa kessleri) // Труды Всероссийского научно-исследовательского института рыбного хозяйства и океанографии. Т. 1. С. 74.
Водовская В.В. 1977. О связи между численностью проходной сельди и ее распределением в Северном Каспии // Вопр. ихтиол. Т. 17. Вып. 1(102). С. 179.
Водовская В.В. 1984. Экология каспийской проходной сельди (Alosa kessleri) на Нижней Волге в современных условиях гидрологического режима: Автореф. дис. … канд. биол. наук. Москва: Всероссийский научно-исследовательский институт рыбного хозяйства и океанографии. С. 24.
Водовская В.В. 1990. Проходная сельдь – важный объект охраны ихтиофауны Каспия // Матер. Всесоюзной конференции Экологические проблемы охраны живой природы. Москва: Всероссийский научно-исследовательский институт рыбного хозяйства и океанографии. Ч. 3. С. 12.
Водовская В.В. 1994. Воспроизводство сельди на Волге // Рыбное хозяйство. № 6. С. 28.
Водовская В.В. 1996. Влияние гидрологического режима на воспроизводство и численность проходных сельдей // Гидрометеорология и гидрохимия морей. Т. 6. Вып. 2. С. 300.
Водовская В.В. 1998. Научные основы устойчивого рыболовства и регионального распределения промысловых объектов Каспийского моря. Москва: Изд-во ВНИРО.
Водовская В.В. 2001. Экологические аспекты биологии проходной сельди Каспия. Астрахань: КаспНИРХ, 74 с.
Войнова Т.В. 2012. Современное состояние нерестовой части популяции проходной сельди-черноспинки Alosa kessleri kessleri // Экологический мониторинг и биоразнообразие. № 2. С. 75.
Войнова Т.В. 2013. Динамика уловов и биологические показатели сельди-черноспинки в Волго-Каспийском рыбохозяйственном подрайоне в современных условиях (река Волга и ее водотоки) // Вестник Астраханского государственного технического университета. Серия: Рыбное хозяйство. № 3. С. 25.
Войнова Т.В. 2016. Мониторинг современного состояния популяции сельди-черноспинки (Alosa kesselri kessleri Grimm) в р. Волге // Экологический мониторинг и биоразнообразие. № 1. С. 21.
Зволинский В.П., Овчинников А.С., Яковлев С.В., Рыбашлыкова Л.П. 2015. Комплексный мониторинг водных биологических ресурсов водоемов Волго-Ахтубинской поймы. Волгоград: Волгоградский ГАУ.
Казанчеев Е.Н. 1965. О распределении осетровых рыб в промысловой зоне Северного Каспия в связи с запрещением их морского лова // Труды Каспийского НИИ рыбного хозяйства. Т. 20. С. 53.
Казанчеев Е.Н. 1981. Рыбы Каспийского моря. Москва: Легк. и пищ. пром-сть.
Ким А.И. 2012. О восстановлении Урало-Каспийской популяции сельди Alosa kessleri kessleri // Вестник Казанского национального университета. Серия экологическая. № 1(33). С. 79.
Лепилина И.Н., Войнова Т.В., Николаенков А.А., Степанова Т.Г. 2016. Состояние запасов сельди-черноспинки, биологические, физиолого-биохимические показатели и трофологический анализ производителей, мигрирующих в реку Волгу // Вестник Астраханского государственного технического университета. Серия: Рыбное хозяйство. Вып. 2. С. 43.
Николаев В.А. 1962. Геологическая история, рельеф и аллювиальные отложения р. Ахтуба // Природа и сельское хозяйство Волго-Ахтубинской долины и дельты. Москва: Изд-во МГУ. С. 11.
Павлов Д.С. 1979. Биологические основы управления поведением рыб в потоке воды. Москва: Наука.
Правдин И.Ф. 1966. Руководство по изучению рыб. Москва: Пищ. пром-сть.
Пятикопова О.В. 2019. Современные особенности нерестовой миграции производителей и покатной миграции личинок сельди-черноспинки (Alosa kessleri kessleri) в Волжско-Каспийском бассейне: Автореф. дис. … канд. биол. наук. Астрахань: АГТУ.
Решетников Ю.С., Попова О.А. 2015. О методиках полевых ихтиологических исследований и точности полученных результатов // Труды Всероссийского научно-исследовательского института рыбного хозяйства и океанографии. Т. 156. С. 114.
Решетников Ю.С., Терещенко В.Г. 2017. Количественный уровень исследования в экологии рыб и ошибки, связанные с ним // Экология. № 3. С. 178.
Световидов А.Н. 1952. Фауна СССР. Рыбы. Т. 2. Вып. 1. Сельдевые (Clupeidae) Москва: Изд-во академии наук СССР.
Фомичев О.А., Тарадина Д.Г. 2006. Оценка численности покатной молоди полупроходных и речных рыб в водоемах дельты Волги // Материалы Международной конференции Астрахань “Современное состояние и пути совершенствования научных исследований в Каспийском бассейне”. Астрахань: КаспНИРХ. С. 233.
Чугунова Н.И. 1959. Руководство по изучению возраста и роста рыб. Москва: Изд-во академии наук СССР.
Yilmaz S., Polat N. 2002. Age determination of shad (Alosa pontica Eichwald, 1838) inhabiting the Black Sea // Turkish Journal of Zoology. V. 26. № 4. P. 393.
Дополнительные материалы отсутствуют.
Инструменты
Биология внутренних вод


